需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
微图设计及植物和土壤样品制备,进行15次氮气分析
摘要
介绍了用于15N 示踪剂研究的微图设计,以适应多个季节内植物和土壤采样事件。提出了用于15N分析的土壤和植物样品收集和处理程序,包括研磨和称重方案。
摘要
许多氮肥研究评估处理对季末测量(如谷物产量或累计 N 损失)的总体影响。需要采用稳定的同位素方法,跟踪和量化通过土壤作物系统获得N(FDN)的肥料的命运。本文的目的是描述一种小图研究设计,利用非封闭15个N富集微图,在两个生长季节进行多个土壤和植物采样事件,并提供样品收集、处理和处理方案,用于总共15个N分析。这些方法通过一项从明尼苏达州中南部种植到玉米的复制研究进行演示(Zea Mays L.)。每次处理包括六排玉米(76厘米的行间距)15.2米长,一端嵌入一个微图(2.4米 x 3.8米)。肥料级尿素在种植时以135公斤N+ha-1施用,而微图在种植过程中多次采集了富集量至5原子%15N的尿素,并注意使用单独的工具,并在所有过程中使用物理分离未富集和浓缩的样品,尽量减少交叉污染。土壤和植物样品干燥,地面通过2毫米的屏幕,然后地面到面粉一样一致性使用辊罐磨。跟踪器研究需要额外的规划、样品处理时间和人工,并且比传统的 N 研究产生更高的 15N 浓缩材料和样品分析成本。然而,使用质量平衡方法,具有多个季节采样事件的跟踪研究使研究人员能够通过土壤作物系统估计 FDN 分布,并估计系统中对 FDN 的下落不明。
引言
化肥氮(N)的使用对于满足全球不断增长的人口的粮食、纤维、饲料和燃料需求至关重要,但农业领域的氮气损失可能会对环境质量产生负面影响。由于N在土壤作物系统中经历了许多转变,因此,要改进提高N使用效率并最大限度地减少环境损失的管理方法,必须更好地了解N循环、作物利用率和肥料N的总体命运。传统的 N 肥料研究主要侧重于处理对季末测量的影响,如作物产量、作物 N 吸收相对于 N 速率(明显的肥料使用效率)和残留土壤 N。虽然这些研究量化了整个系统N投入、产出和效率,但它们无法识别或量化土壤作物系统中来自肥料来源或土壤的N。必须使用使用稳定同位素的不同方法来跟踪和量化土壤作物系统中衍生的N(FDN)肥料的命运。
氮有两种稳定的同位素,14N和15N,在自然界中相对恒定比为272:1,为14N/15N151(浓度为0.366原子% 15N或3600 ppm 15N2,3)。增加15N富肥增加了土壤系统15N含量。由于15N富肥与未富土N混合,14N/15N比率的测量变化15使研究人员能够跟踪FDN在土壤轮廓和作物,3,4。质量平衡可以通过测量系统中15N 示踪器的总量及其每个部件2来计算。由于15种N富肥比传统肥料贵得多,15个N富肥通常嵌入到处理地块中。本文的目的是描述利用微图对玉米(Zea mays L.)的多个季节土壤和植物取样事件进行小图研究设计,并提出为总共15个N分析准备植物和土壤样本的协议。然后,这些结果可用于估算 N 肥料的使用效率,并在散装土壤和作物中为 FDN 创建部分 N 预算核算。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 现场现场描述
注:在进行15N示踪场试验时,选定地点应尽量减少因土壤、地形和物理特征而变化5。由于坡度、风或水迁移或耕种,横向土壤移动后可能发生交叉污染,而土壤N的垂直分布可能受到地下水流和瓦片排水的影响。
- 描述实验场址,包括过去的管理(如以前的作物和耕种)、经纬度、土壤物理和化学性质(例如土壤纹理分析、初始肥力条件、pH值和土壤体积密度)。
- 记录研究地点和字段角的 GPS 坐标。
- 描述生长季节管理,包括病虫害管理(除草剂、杀虫剂或杀菌剂)、土壤肥力管理(包括速率、来源、放置和应用时间)、耕种、灌溉事件和数量以及残留物管理。
- 由于作物生长和微生物介质 N 转化受土壤湿度、土壤温度和气温的影响,因此记录气候信息,包括每日高温和低温、每日降水以及反映土壤采样深度的多个深度的土壤水分和温度。
2. 绘图设计
- 在76厘米间距上种植六排玉米(约86,000株公顷-1),最终地块尺寸为15.2米×4.6米。
- 建立边界区1.5米,从长度尺寸的每一端(0-1.5米,13.7-15.2米)和附加边界区1.5米长(9.8-11.3米)毗邻采样和收获区(图1)。
- 将第2排和第3排指定为玉米谷物产量的季内植物和土壤取样区(1.5-9.8米),第4行和第5行为玉米谷物产量的收获区(1.5-9.8米)。
- 建立一个微图区域(11.3-13.7 m),尺寸为2.4米,以宽度尺寸为中心,为3.8米。从该区域收集所有 15个 N 富集植物和土壤样本,在长度和宽度尺寸上留下 0.38 m 的未采样边框,以最大限度地减少边缘效应(图 2)。
- 用不同颜色的标志描绘处理图和微图角。
3. 土壤和植物样品预防措施
- 使用专用设备和加工区进行未浓缩和丰富的材料。浓缩材料对未富料(肥料、土壤或植物)的污染,反之亦然,会严重影响结果。
- 收集并处理15N 富集土壤和植物样品,按最低至最高 15N 预期浓缩顺序进行收集,以最大限度地减少交叉污染。确保每个样品之间彻底清洁工作表面、手套、餐具和机械,以最大限度地减少样品结转造成的交叉污染。
- 尽量减少微图的步行交通,防止未富污染的取样区。访问微图时,请佩戴防护鞋罩,在退出微图区域时将其拆下。
4. 15N富肥制备与施用
- 按照参考2提出的肥料15N使用效率(F15NUE)研究的指南,将10原子%15N浓缩尿素稀释至5原子%15N富集尿素,溶解在2L的脱化水中,确保尿素肥料均匀浓缩。
注:15N浓缩肥料的所需浓度取决于农艺研究的目标。如果库存15N浓缩肥料的浓度超过研究人员的要求,则用以下公式3稀释库存肥料浓度。
X2 = = /C1/C2) - 1 = X1
X2是常规未富肥的质量,X1是示踪肥料的质量,C1是同位素浓度[表示为原子百分比多(测量原子百分比富集减去自然背景浓度假设为0.3663原子%)]原示踪肥料,而C2是同位素浓度的最终混合物。例如,如果100克10原子富集尿素,92.7克常规未富肥对于最终同位素浓度为5原子;
X2 = [(10-0.3663)/5] - 1= = 100。 - 分析15N 浓度溶液以验证富集。作者利用了加州大学戴维斯分校稳定同位素设施提供的分析服务。
注:土壤-植物-微生物系统对肥料添加的反应可能受到肥料物理形式的影响。根据研究的目标,尿素溶液可以作为液体或脱水剂用于改造晶体。晶体可以压缩成蛋糕使用卡弗压机在10,000 psi,然后粉碎蛋糕和筛选颗粒到所需的大小3。 - 使用校准的背包 CO2喷雾器将15N 浓缩尿素溶液均匀地应用于微图(图 3A)。如果使用多个 N 速率或富集水平,请考虑在每个浓缩级别使用指定的 CO2喷雾器,或使用单个喷雾器,并应用从最低到最高浓缩的解决方案,以最大限度地减少处理交叉污染。
- 在施用后 24 小时内,将含尿素肥料与轻质耕作、洗手铲或至少 0.6 厘米的灌溉结合,以最大限度地降低挥发性损失潜力。
- 在第二个生长季节,没有额外的15N浓缩尿素肥料应用于微图。将传统的未富尿素应用于整个处理,以避免因氮气而导致玉米生长出现差异反应。
5. 田间样品加工:地上玉米生物质
- 在每个取样阶段,从取样区(15N未富集)采集6个地上玉米植物复合样品,从15个无基微图中采集6个地上玉米植物复合样品。至少两个植物应分离每个样本植物,以避免显著改变植物的生长动态。作者在V8和R1玉米生理发育阶段11和生理成熟度时采集植物样本(图2)。
- 按照步骤3.1和3.2所述的原则,砍下V8和R1地上生物量(±5厘米×+5厘米);院子里的废碎机是一个令人满意的选择。将切碎的生物量放在标记的织物或纸袋中,并在 60°C 的强制空气烤箱中干燥,直到恒定质量。记录生物质干重(图3B)。
- 将生理上成熟的玉米植物分割成茎(包括叶子、表膜和茎在内的所有植物组织)、谷物和棒状部分。在60°C的强制空气烤箱中切碎并干燥,直到恒定的质量。记录生物质干重。
- 在微图中,在土壤表面切割所有玉米茎,绑在一捆,根据地块贴上标签,然后从田地中去除(图3C)。调整微图角旗,使土壤表面几乎齐平,以最大限度地降低在收获或收获后耕种过程中由组合清除的风险。
- 从收获区收获粮食,报告产量在15.5%的水分含量12。收获剩余研究领域与地块相结合。
- 从微图区域中释放未富量的生物量。将地上的微图生物量切碎并重新应用到正确的地块(图3D)。
- 将残留物纳入土壤表面,并注意耕种,以尽量减少土壤和玉米残留物流入或运出微图区域。更换因耕作而移除的任何微图角标志。
- 种植第二年玉米在同一行第一年玉米。
- 仅在生理成熟度和过程(如步骤 5.3 中所述的第一年玉米样本)时收集第二年地上玉米生物量。从微图区域中心(1.52 m by 0.76 m)收集微图样本,以避免耕种后出现任何潜在的信号稀释(图2)。从收获区收获谷物,报告产量为15.5%的水分含量。
- 按照步骤 3.1 和 3.2 的原则,彻底混合和研磨 100 至 200 g 的干燥植物材料,通过 2 mm 筛。彻底混合地面材料,将子包装在贴有标签的硬币信封中,以进行进一步处理。
注:Thomas Wiley 磨机是植物组织研磨的满意选择,而 Perten 实验室磨机 3610 是研磨颗粒的满意选择。
注意:磨削植物样品应佩戴国家职业安全与健康研究所批准的 N95 颗粒过滤面体呼吸器,防止吸入灰尘。
6. 现场样品加工:土壤
- 在15次氮肥施用后8天采集第一年土壤样品,V8、R1和收获后耕种前。在植物前和收获后收集第二年的土壤样本。由于后勤取样的限制,作者在0至15、15至30、0至15、15、30、的季节土壤样本中采集了土壤样本。 和30至60厘米的深度,收获后土壤样本在0至15,15至30,30至60和60至90厘米深,第二年植物前土壤样本在0至30-,30至60-,60至120厘米深度。
注:如果土壤探针无法将土壤核心收集到最深的所需深度作为单个核心,则从同一井眼中收集更深的深度核心,因为上部钻孔丢弃顶部 1 厘米的土壤,以避免土壤从上部深度下降污染。- 使用手动探头从 V8 和 R1 的未富土采样区收集四芯(直径 1.8 厘米)复合土壤样本。在玉米行中收集一个核心,在玉米行之间收集三个核心。
- 使用液压探头从预工厂和收获后未覆盖的取样区收集双芯(5 厘米直径)复合土壤样本。
- 使用手探针在 15 N 富肥、V8 和 R1 施用后 8 天从微图区域采集15核(直径 1.8 厘米)复合土壤样本。在玉米行中收集三到四个核心,在玉米行之间收集 11 到 12 个核心。
注:土壤是极其异质的。从富集的微图内收集的更多核心提供了对土壤N13的真实15N富集的更好估计。 - 使用液压探头从预工厂和收获后微图区域收集三芯(直径 5 厘米)复合土壤样本。
- 将每个复合土壤样品均质化到桶中,并放在预先标记的纸袋中。
- 在35°C的强制空气烤箱中干燥土壤样品,直到恒定的质量。研磨每个样品,通过2毫米筛。如果每个样品之间可以彻底清洁机械土壤研磨机,它就是令人满意的。
注:土壤样品可以通过将样品在薄层托盘上铺开来风干。托盘应位于不受外部 N 源污染的区域。未加丰富样品应物理分离,以防止交叉污染。
注意:磨土样品的人应佩戴国家职业安全与健康研究所批准的 N95 颗粒过滤面呼吸器,防止吸入灰尘。
7. 实验室样品加工:研磨土壤和植物样品
- 干燥地面植物样品(2毫米)在60°C的烤箱中过夜。
- 按照步骤3中所述的原则,将干燥的植物样品或土壤材料研磨为精细的面粉般。辊罐磨机是一个令人满意的选择。
注:作者的罐磨机是一个定制的传送带系统,可以一次处理54个滚轮罐。- 用 10 至 20 g 的地面植物或土壤样品以及 7 根不锈钢棒(8.5 厘米长,直径 0.7 厘米)填充每个滚轮罐(250 mL 硅酸盐玻璃罐,带螺丝顶盖)。
- 滚辊罐在0.4 x g 6-24小时或直到样品有一个精细的,面粉一样一致性。
- 将细磨材料转移到一个清洁的、标有 20 mL 的闪烁小瓶中。
- 在每个样品之间,用肥皂和水清洗滚筒罐、不锈钢棒和盖子,以清除任何残留物。
- 将滚筒罐和盖子浸入 5% 的 HCl 酸浴(从 36-38% 浓缩库存中准备)过夜 14。
注意:盐酸具有腐蚀性。它可能导致严重的皮肤灼伤,眼睛损伤,如果吸入有害。始终穿着防护服、手套以及眼睛和面部防护。用水彻底冲洗接触组织。运输酸时,始终使用辅助容器。始终向水中添加酸,因为这种反应是放热的。立即用小苏打中和酸溢出。
注:在 208 L 塑料容器中,可将大型酸浴准备为 100 L 的 5% HCl。在烟罩中准备几个较小的卷,然后将溶液转移到塑料容器中。每三个月更换一次解决方案。 - 三重冲洗辊罐和盖子与去维化水和空气干燥。
- 将不锈钢棒浸入0.05 M NaOH浴池(在1L的去化水中溶解2g NaOH)过夜14。每天准备一个新的0.05 M NaOH浴。
注意:氢氧化钠可引起严重的皮肤灼伤和眼睛损伤。始终穿着防护服和眼睛保护。立即去除受污染的衣物,用水冲洗皮肤或眼睛几分钟。 - 在运行的热自来水下冲洗棒 5 分钟。用去维化水冲洗棒,然后三次冲洗。让杆在纸巾衬布上风干。
- 将滚筒罐和盖子浸入 5% 的 HCl 酸浴(从 36-38% 浓缩库存中准备)过夜 14。
8. 称重地面植物和土壤样本,用于总 N 和15N 分析
- 分析几个具有代表性的植物和土壤样本的总 N 含量(例如,燃烧分析15)。根据分析仪规格计算为15N 分析提供足够的 N 含量的样品质量。
注:作者利用了加州大学戴维斯分校稳定同位素设施提供的分析服务。富集样品重量针对 20 μg N 进行了优化,最大为 100 μg N。 - 组织从最低到最高预期15N 浓缩的样样本。每次运行中复制每八到十二个样本以检查样本精度。每个运行 16 中至少包括一个检查样本。
- 标记一个干净的 96 井板,并安装盖与单独的井蒸发环。切割干净的索引卡,以适合在盖子内,以防止样品在运输过程中在井间移动。
- 戴上亚硝酸盐手套,用实验室湿巾和乙醇清洁微垢、工作表面、铲子和钳子。将清洁的餐具放在实验室长椅上的 Kimwipe 上。
注:未加丰富样品应使用单独的秤和器皿进行处理,以防止交叉污染。 - 使用钳子将预成型的 5 mm x 9 mm 锡胶囊放在干净的工作表面上,例如 5 mm x 8 mm 井的不锈钢块。轻轻地将胶囊插入井中,以改变圆柱形,并根据需要将胶囊底部压平。
注:由于样品质量非常小,因此样品污染的风险很高。切勿用手套触摸胶囊。如果胶囊接触钳子、清洁工作表面、秤称量锅或 96 井板以外的任何表面,请丢弃胶囊。 - 使用钳子轻轻爆发出胶囊顶部的 1 mm,以方便操作。为避免在拖累胶囊重量时造成天垢损伤,请将胶囊悬停并释放在微尺度称重锅上方 1 至 2 mm 的胶囊。把胶囊扎到皮上。使用钳子将胶囊返回到干净的工作表面。
- 使用铲子小心地将所需的细磨样品材料质量添加到胶囊中。避免将样品材料溅到胶囊外表面或工作表面。
- 使用钳子,慢慢压接胶囊的三分之一,折叠起来密封。使用钳子,继续折叠和压缩胶囊成球形,注意不要刺穿或撕裂锡。
注:低N含量的样品可能需要超过5x9 mm胶囊容量的样品量。在这些情况下可以使用较大的胶囊(例如 9 mm x 10 mm)。 - 使用钳子将包裹的胶囊从 1 厘米高数次掉落到干净、黑暗的表面或镜子上,以检查是否泄漏。如果没有灰尘出现,则使用步骤 8.6 中描述的相同技术称重样品。记录样品重量。将胶囊放在 96 井板中,并记录井的位置。
- 如果灰尘出现在深色表面上,请记录样品重量。将样品包裹在第二个锡胶囊中,重新检查有无泄漏,并放在干净的 96 井板中。
注:如果包装胶囊太大,不能放入 96 井板中,请使用 24 或 48 井板。
- 如果灰尘出现在深色表面上,请记录样品重量。将样品包裹在第二个锡胶囊中,重新检查有无泄漏,并放在干净的 96 井板中。
- 在样品之间,用乙醇和实验室湿巾清洁每个餐具和表面,特别注意铲和钳子边缘。
- 使用胶带将盖子固定到 96 井板上,然后存放在干燥器中。
9. 计算
- 使用以下方程计算植物或土壤样本中所含的N(kg+ha-1)的质量。
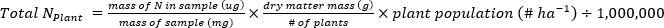
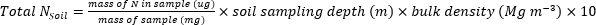
- 计算肥料N分数(Nf),肥料衍生N(FDN),土壤衍生N(SDN)植物和土壤样本17。
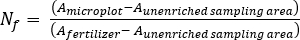
其中A是原子 % 15N 浓缩。 -
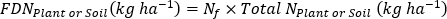
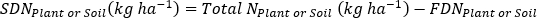
- 计算肥料15N 使用效率17。

Access restricted. Please log in or start a trial to view this content.
结果
本文提供的结果来自2015年位于明尼苏达州瓦塞卡附近的明尼苏达大学南方外展研究中心的一个现场。该基地在 2015 年以前被管理为玉米大豆 +甘氨酸最大值 (L.) Merr] 旋转,但在 2015 和 2016 生长季节作为玉米玉米轮作进行管理。土壤是一个Nicollet粘土土(细洛米,混合,超活性,梅西阿基克哈普卢多斯)-韦伯斯特粘土土(细洛米,混合,超活性,中西泰皮克恩多阿...
Access restricted. Please log in or start a trial to view this content.
讨论
稳定的同位素研究是通过土壤作物系统跟踪和量化FDN的有用工具。然而,有三个主要假设与N示踪器研究有关,如果违反,可能会使使用这种方法得出的结论无效。它们是 1) 示踪剂在整个系统中均匀分布,2) 研究下的进程以相同的速率发生,3) N 离开15N 富集池不返回3。由于本研究对整个土壤作物系统中FDN总量分布感兴趣,假设2和假设3是关注最少的21。<...
Access restricted. Please log in or start a trial to view this content.
披露声明
作者没有什么可透露的。
致谢
作者感谢明尼苏达州玉米研究与促进委员会、休格-哈里森研究金和明尼苏达州发现、研究和无病毒经济 (MnDRIVE) 研究金的支持。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| 20 mL scintillation vial | ANY; Fisher Scientific is one example | 0334172C | |
| 250 mL borosilicate glass bottle | QORPAK | 264047 | |
| 48-well plate | EA Consumables | E2063 | |
| 96-well plate | EA Consumables | E2079 | |
| Cloth parts bag (30x50 cm) | ANY | NA | For corn ears |
| CO2 Backpack Sprayer | ANY; Bellspray Inc is one example | Model T | |
| Coin envelop (6.4x10.8 cm) | ANY; ULINE is one example | S-6285 | For 2-mm ground plant samples |
| Corn chipper | ANY; DR Chipper Shredder is one example | SKU:CS23030BMN0 | For chipping corn biomass |
| Corn seed | ANY | NA | Hybrid appropriate to the region |
| Disposable shoe cover | ANY; Boardwalk is one example | BWK00031L | |
| Ethanol 200 Proof | ANY; Decon Laboratories Inc. is one example | 2701TP | |
| Fabric bags with drawstring (90x60 cm) | ANY | NA | For plant sample collection |
| Fertilizer Urea (46-0-0) | ANY | NA | ~0.366 atom % 15N |
| Hand rake | ANY; Fastenal Company is one example | 5098-63-107 | |
| Hand sickle | ANY; Home Depot is one example | NJP150 | For plant sample collection |
| Hand-held soil probe | ANY; AMS is one example | 401.01 | |
| Hydraulic soil probe | ANY; Giddings is one example | GSPS | |
| Hydrochloric acid, 12N | Ricca Chemical | R37800001A | |
| Jar mill | ANY; Cole-Parmer is one example | SI-04172-50 | |
| Laboratory Mill | Perten | 3610 | For grinding grain |
| Microbalance accurate to four decimal places | ANY; Mettler Toledo is one example | XPR2 | |
| N95 Particulate Filtering Facepiece Respirator | ANY, ULINE is one example | S-9632 | |
| Neoprene or butyl rubber gloves | ANY | NA | For working in HCl acid bath |
| Paper hardware bags (13.3x8.7x27.8 cm) | ANY; ULINE is one example | S-8530 | For soil samples and corn grain |
| Plant grinder | ANY; Thomas Wiley Model 4 Mill is one example | 1188Y47-TS | For grinding chipped corn biomass to 2-mm particles |
| Plastic tags | ULINE | S-5544Y-PW | For labeling fabric bags and microplot stalk bundles |
| Sodium hydroxide pellets, ACS | Spectrum Chemical | SPCM-S1295-07 | |
| Soil grinder | ANY; AGVISE stainless steel grinder with motor is one example | NA | For grinding soil to pass through a 2-mm sieve |
| Tin capsule 5x9 mm | Costech Analytical Technologies Inc. | 041061 | |
| Tin capsule 9x10 mm | Costech Analytical Technologies Inc. | 041073 | |
| Urea (46-0-0) | MilliporeSigma | 490970 | 10 atom % 15N |
参考文献
- Sharp, Z. Principles of Stable Isotope Geochemistry. , 2nd Edition, (2017).
- Van Cleemput, O., Zapata, F., Vanlauwe, B. Guidelines on Nitrogen Management in Agricultural Systems. Guidelines on Nitrogen Management in Agricultural Systems. 29 (29), 19(2008).
- Hauck, R. D., Meisinger, J. J., Mulvaney, R. L. Practical considerations in the use of nitrogen tracers in agricultural and environmental research. Methods of Soil Analysis: Part 2-Microbiological and Biochemical Properties. , 907-950 (1994).
- Bedard-Haughn, A., Van Groenigen, J. W., Van Kessel, C. Tracing 15N through landscapes: Potential uses and precautions. Journal of Hydrology. 272 (1-4), 175-190 (2003).
- Peterson, R. G. Agricultural Field Experiments: Design and Analysis. , Marcel Dekker, Inc. New York. (1994).
- Follett, R. F. Innovative 15N microplot research techniques to study nitrogen use efficiency under different ecosystems. Communications in Soil Science and Plant Analysis. 32 (7/8), 951-979 (2001).
- Russelle, M. P., Deibert, E. J., Hauck, R. D., Stevanovic, M., Olson, R. A. Effects of water and nitrogen management on yield and 15N-depleted fertilizer use efficiency of irrigated corn. Soil Science Society of America Journal. 45 (3), 553-558 (1981).
- Schindler, F. V., Knighton, R. E. Fate of Fertilizer Nitrogen Applied to Corn as Estimated by the Isotopic and Difference Methods. Soil Science Society of America Journal. 63, 1734(1999).
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study. Agronomy Journal. 97 (4), 1037(2005).
- Recous, S., Fresneau, C., Faurie, G., Mary, B. The fate of labelled 15N urea and ammonium nitrate applied to a winter wheat crop. Plant and Soil. 112 (2), 205-214 (1988).
- Abendroth, L. J., Elmore, R. W., Boyer, M. J., Marlay, S. K. Corn Growth and Development. , (2011).
- Lauer, J. G. Methods for calculating corn yield. , http://corn.agronomy.wisc.edu/AA/pdfs/A033.pdf (2002).
- Gomez, K. A., Gomez, A. A. Statistical Procedures for Agricultural Research. , 2nd Edition, John Wiley and Sons. (1984).
- Khan, S. A., Mulvaney, R. L., Brooks, P. D. Diffusion Methods for Automated Nitrogen-15 Analysis using Acidified Disks. Soil Science Society of America Journal. 62 (2), 406(1998).
- Horneck, D. A., Miller, R. O. Determination of Total Nitrogen in Plant Tissue. Handbook of Reference Methods for Plant Analysis. , 75-84 (1998).
- UC Davis Stable Isotope Facility. Carbon (13C) and Nitrogen (15N) Analysis of Solids by EA-IRMS. , https://stableisotopefacility.ucdavis.edu/13cand15n.html (2019).
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study: II. Nitrogen Uptake Efficiency. Agronomy Journal. 97 (4), 1046(2005).
- Kaiser, D. E., Fernandez, F. G., Coulter, J. A. Fertilizing Corn in Minnesota. , University of Minnesota Extension. https://extension.umn.edu/crop-specific-needs/fertilizing-corn-minnesota (2018).
- Blake, G. R., Hartge, K. H. Bulk Density. Methods of Soil Analysis: Part 1 Physical and Mineralogical Methods. , 363-375 (1986).
- Jokela, W. E., Randall, G. W. Fate of Fertilizer Nitrogen as Affected by Time and Rate of Application on Corn. Soil Science Society of America Journal. 61 (6), 1695(2010).
- Hart, S. C., Stark, J. M., Davidson, E. A., Firestone, M. K. Nitrogen Mineralization, Immobilization, and Nitrification. Methods of Soil Analysis, Part 2. Microbiological and Biochemical Properties. (5), 985-1018 (1994).
- Jokela, W., Randall, G. A nitrogen-15 microplot design for measuring plant and soil recovery of fertilizer nitrogen applied to corn. Agronomy journal (USA). 79 (APRIL), http://agris.fao.org/agris-search/search/display.do?f=1988/US/US88241.xml;US875113688 322-325 (1987).
- Olson, R. V. Fate of tagged nitrogen fertilizer applied to irrigated corn. Soil Science Society of America Journal. 44 (3), 514-517 (1980).
- Follett, R. F., Porter, L. K., Halvorson, A. D. Border Effects on Nitrogen-15 Fertilized Winter Wheat Microplots Grown in the Great Plains. Agronomy Journal. 83 (3), 608-612 (1991).
- Balabane, M., Balesdent, J. Input of fertilizer-derived labelled n to soil organic matter during a growing season of maize in the field. Soil Biology and Biochemistry. 24 (2), 89-96 (1992).
- Recous, S., Machet, J. M., Mary, B. The partitioning of fertilizer-N between soil and crop: Comparison of ammonium and nitrate applications. Plant and Soil. 144 (1), 101-111 (1992).
- Bigeriego, M., Hauck, R. D., Olson, R. A. Uptake, Translocation and Utilization of 15N-Depleted Fertilizer in Irrigated Corn. Soil Science Society of America Journal. 43 (3), 528(1979).
- Glendining, M. J., Poulton, P. R., Powlson, D. S., Jenkinson, D. S. Fate of15N-labelled fertilizer applied to spring barley grown on soils of contrasting nutrient status. Plant and Soil. 195 (1), 83-98 (1997).
- Khanif, Y. M., Cleemput, O., Baert, L. Field study of the fate of labelled fertilizer nitrate applied to barley and maize in sandy soils. Fertilizer Research. 5 (3), 289-294 (1984).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。