Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Conception de microplots et préparation d’échantillons de plantes et de sols pour 15analyses d’azote
Dans cet article
Résumé
Une conception de microplots pour la recherche sur les traceurs de 15N est décrite pour tenir compte de multiples événements d’échantillonnage des plantes et des sols en saison. Des procédures de collecte et de traitement des échantillons de sol et d’usine, y compris les protocoles de broyage et de pesage, pour l’analyse de 15N sont mises de l’avant.
Résumé
De nombreuses études sur les engrais azotés évaluent l’effet global d’un traitement sur les mesures de fin de saison, comme le rendement des grains ou les pertes cumulatives de N. Une approche isotopique stable est nécessaire pour suivre et quantifier le sort de l’engrais dérivé du N (FDN) par le système de culture du sol. Le but de ce document est de décrire une conception de recherche sur de petites parcelles utilisant des microplots non confinés enrichis de 15N pour de multiples événements d’échantillonnage des sols et des plantes sur deux saisons de croissance et de fournir des protocoles de collecte, de manipulation et de traitement d’échantillons pour l’analyse totale de 15N. Les méthodes ont été démontrées à l’aide d’une étude reproduite du centre-sud du Minnesota plantée au maïs (Zea mays L.). Chaque traitement consistait en six rangées de maïs (espacement des rangées de 76 cm) de 15,2 m de long avec un microlot (2,4 m sur 3,8 m) intégré à une extrémité. L’urée de qualité engrais a été appliquée à 135 kg N-ha-1 lors de la plantation, tandis que le microplot a reçu de l’urée enrichie à 5 atomes % 15N. Des échantillons de sol et de plantes ont été prélevés plusieurs fois tout au long de la saison de croissance, en prenant soin de minimiser la contamination croisée en utilisant des outils distincts et en séparant physiquement des échantillons non enrichis et enrichis pendant toutes les procédures. Les échantillons de sol et de plantes ont été séchés, moulus pour passer à travers un écran de 2 mm, puis moulus à une consistance semblable à de la farine à l’aide d’un moulin à rouleaux. Les études de traceur exigent la planification supplémentaire, le temps de traitement d’échantillon et le travail manuel, et engagent des coûts plus élevés pour 15matériaux enrichis de N et l’analyse d’échantillon que les études traditionnelles de N. Toutefois, à l’aide de l’approche de l’équilibre de masse, les études de traceur avec de multiples événements d’échantillonnage en saison permettent au chercheur d’estimer la distribution du FDN par l’intermédiaire du système de culture du sol et d’estimer le FDN non comptabilisé du système.
Introduction
L’utilisation d’azote d’engrais (N) est essentielle dans l’agriculture pour répondre aux demandes alimentaires, de fibres, d’aliments pour animaux et de carburant d’une population mondiale croissante, mais les pertes de N provenant des champs agricoles peuvent avoir un impact négatif sur la qualité de l’environnement. Étant donné que n subit de nombreuses transformations dans le système de culture du sol, une meilleure compréhension du cycle N, l’utilisation des cultures et le sort global de l’engrais N sont nécessaires pour améliorer les pratiques de gestion qui favorisent l’efficacité de l’utilisation de N et minimisent les pertes environnementales. Les études traditionnelles sur les engrais n se concentrent principalement sur l’effet d’un traitement sur les mesures de fin de saison telles que le rendement des cultures, l’absorption de N par rapport au taux de N appliqué (efficacité apparente de l’utilisation des engrais) et l’efficacité résiduelle du sol N. Bien que ces études quantifient l’ensemble des intrants, des extrants et des gains d’efficacité du système N, elles ne peuvent ni identifier ni quantifier le N dans le système de culture du sol dérivé des sources d’engrais ou du sol. Une approche différente à l’aide d’isotopes stables doit être utilisée pour suivre et quantifier le sort du N dérivé de l’engrais (FDN) dans le système de culture du sol.
L’azote a deux isotopes stables, 14N et 15N, qui se produisent dans la nature à un rapport relativement constant de 272:1 pour 14N/15N1 (concentration de 0,366 atome % 15N ou 3600 ppm 15N2,3). L’ajout de 15engrais enrichis de N augmente la teneur totale de 15N du système de sol. Comme 15N engrais enrichi se mélange avec le sol non enrichi N, le changement mesuré de 14N /15N rapport permet aux chercheurs de tracer FDN dans le profil du sol et dans la culture3,4. Un solde de masse peut être calculé en mesurant la quantité totale de traceur de 15N dans le système et chacune de ses parties2. Étant donné que 15engrais enrichis de 15 N sont beaucoup plus chers que les engrais conventionnels, 15microplots enrichis de N sont souvent intégrés dans les parcelles de traitement. Le but de ce document de méthodes est de décrire une conception de recherche de petites parcelles utilisant des microplots pour de multiples épreuves d’échantillonnage en saison et d’échantillonnage des plantes pour le maïs(Zea mays L.) et de présenter des protocoles pour la préparation d’échantillons de plantes et de sols pour une analyse totale de 15N. Ces résultats peuvent ensuite être utilisés pour estimer l’efficacité de l’utilisation des engrais N et créer un budget N partiel tenant compte du FDN dans le sol en vrac et la culture.
Protocole
1. Description du site sur le terrain
REMARQUE : Lors de l’exécution d’essais sur le terrain de traçage de 15N, les sites sélectionnés doivent réduire au minimum les variations dues au sol, à la topographie et aux caractéristiques physiques5. La contamination croisée peut se produire à la suite d’un mouvement latéral du sol dû à la translocation de la pente, du vent ou de l’eau, ou du travail du sol, tandis que la distribution verticale du sol N peut être affectée par le débit d’eau souterrain et le drainage des tuiles6.
- Décrire le site expérimental du champ, y compris la gestion antérieure (p. ex., les cultures et le travail du sol antérieurs), la latitude et la longitude, les propriétés physiques et chimiques du sol (p. ex., analyse texturale du sol, conditions initiales de fertilité, pH et densité en vrac du sol).
- Enregistrez les coordonnées GPS du site de recherche et des coins de terrain.
- Décrire la gestion de la saison de croissance, y compris la lutte contre les ravageurs et les maladies (utilisation d’herbicides, d’insecticides ou de fongicides), la gestion de la fertilité du sol (y compris le taux, la source, le placement et le moment de l’application), le travail du sol, les événements et les quantités d’irrigation et la gestion des résidus.
- À mesure que la croissance des cultures et les transformations de N médiées par les microbes sont affectées par l’humidité du sol, la température du sol et la température de l’air, enregistrez l’information sur le climat, y compris les températures quotidiennes élevées et basses, les précipitations quotidiennes et l’humidité et les températures du sol à plusieurs profondeurs qui reflètent les profondeurs d’échantillonnage du sol.
2. Conception de parcelle
- Plantez six rangées de maïs (~86 000 plants ha-1) sur un espacement de 76 cm avec une dimension de parcelle finale de 15,2 m sur 4,6 m.
- Établir des zones frontalières à 1,5 m de chaque extrémité de la dimension dans le sens de la longueur (0-1,5 m, 13,7-15,2 m) et une zone frontalière supplémentaire de 1,5 m de long (9,8 à 11,3 m) attenante aux aires d’échantillonnage et de récolte (figure 1).
- Désigner les rangées 2 et 3 comme zone d’échantillonnage des plantes et du sol en saison (1,5 à 9,8 m) et les rangées 4 et 5 comme zone de récolte (1,5 à 9,8 m) pour le rendement des grains de maïs.
- Établir une zone de microplot (11,3-13,7 m) avec des dimensions de 2,4 m par 3,8 m centrées sur la dimension de largeur. Prélever les 15échantillons de plantes et de sol enrichis de N de cette zone, en laissant 0,38 m de bordure non masquée sur les dimensions de longueur et de largeur pour minimiser les effets des bords (figure 2).
- Délimiter la parcelle de traitement et les coins microplots avec différents drapeaux colorés.
3. Précautions relatives aux échantillons de sol et de plantes
- Utiliser des équipements dédiés et des zones de traitement pour les matériaux non enrichis et enrichis. La contamination des matériaux non enrichis (engrais, sol ou plante) par des matériaux enrichis et vice versa peut avoir une incidence considérable sur les résultats.
- Recueillir et traiter 15échantillons de sol et de plantes enrichis de N de l’ordre de 15N d’enrichissement prévu le plus bas à le plus élevé afin de minimiser la contamination croisée. Assurez-vous que les surfaces de travail, les gants, les ustensiles et les machines sont bien nettoyés entre chaque échantillon afin de minimiser la contamination croisée du report de l’échantillon.
- Réduire au minimum la circulation à pied dans les microplots afin d’éviter la contamination des zones d’échantillonnage non enrichies. Portez des revêtements de chaussures de protection lors de l’accès aux microplots et retirez-les à la sortie de la zone du microplot.
4. 15N préparation et application d’engrais enrichis
- Conformément aux directives avancées par le Réf. 2 pour les études sur l’efficacité de l’utilisation des engrais 15N (F15NUE), diluer 10 atomes % 15N d’urée enrichie à 5 atomes % 15N d’urée enrichie et dissoudre dans 2 L d’eau déionisée pour assurer un enrichissement uniforme de l’engrais d’urée.
REMARQUE : La concentration requise de 15engrais enrichis de N dépend des objectifs de l’étude agronomique. Si la concentration d’engrais enrichi en stock 15N dépasse les besoins du chercheur, la concentration d’engrais de stock peut être diluée avec des engrais conventionnels similaires en utilisant la formule3suivante .
X2 = [(C1/C2) - 1] × X1
X2 est la masse de l’engrais conventionnel non enrichi, X1 est la masse de l’engrais traceur, C1 est la concentration isotopique [exprimée en atome % excès (atome mesuré % enrichissement moins la concentration naturelle de fond supposé être 0,3663 atome %)] de l’engrais traceur original, et C2 est la concentration isotopique du mélange final. À titre d’exemple, étant donné 100 g d’urée enrichie de 10 atomes, 92,7 g d’engrais conventionnel non enrichi seraient nécessaires pour une concentration isotopique finale de 5 atomes %;
X2 = {[(10-0.3663)/5] - 1} × 100. - Analyser la solution pour une concentration de 15N afin de vérifier l’enrichissement. Les auteurs ont utilisé les services d’analyse fournis par UC Davis Stable Isotope Facility.
REMARQUE : Les réactions du régime de microbe-plante-sol aux ajouts d’engrais peuvent être affectées par la forme physique d’engrais. Selon les objectifs de l’étude, la solution d’urée peut être appliquée comme liquide ou déshydratée pour réformer les cristaux. Les cristaux peuvent être compactés dans un gâteau à l’aide d’une presse Carver à 10.000 psi, suivie par l’écrasement du gâteau et le dépistage des particules à la taille désirée3. - Appliquez uniformément les 15 solutions d’urée enrichies de 15N aux microplots à l’aide d’un pulvérisateur de CO2 calibré à dos (Figure 3A). Si plusieurs taux de N ou niveaux d’enrichissement sont utilisés, envisagez d’utiliser des pulvérisateurs de CO2 désignés pour chaque niveau d’enrichissement ou d’utiliser un seul pulvérisateur et appliquez des solutions allant du plus bas à l’enrichissement le plus élevé pour minimiser la contamination croisée du traitement.
- Incorporer des engrais contenant de l’urée avec du travail du sol léger, des râteaux à main ou au moins 0,6 cm d’irrigation dans les 24 h suivant l’application afin de minimiser le potentiel de perte de volatilisation.
- Aucun engrais supplémentaire enrichi de 15N n’est appliqué au microplot au cours de la deuxième saison de croissance. Appliquer l’urée conventionnelle non enrichie à l’ensemble du traitement afin d’éviter une réaction différentielle dans la croissance du maïs due à l’azote.
5. Traitement des échantillons de champ : biomasse de maïs hors sol
- À chaque étape d’échantillonnage, prélever un échantillon composite de six plantes de maïs hors-sol à l’intérieur de la zone d’échantillonnage(15N non enrichi) et un échantillon composite de six plantes de maïs hors-sol du microplot enrichi de 15N. Au moins deux plantes devraient séparer chaque plante échantillonnée pour éviter de modifier de façon significative la dynamique de croissance des plantes. Les auteurs ont recueilli des échantillons de plantes aux stades de développement physiologique du maïs V8 et R111 et à maturité physiologique (figure 2).
- Suivant les principes décrits aux étapes 3.1 et 3.2, hacher la biomasse hors sol V8 et R1 (≤5 cm par ≤5 cm); un broyeur de déchets de jardin est une option satisfaisante. Placer la biomasse hachée dans des sacs en tissu ou en papier étiquetés et sécher dans un four à air forcé à 60 °C jusqu’à ce qu’il soit en masse constante. Enregistrer le poids sec de la biomasse (figure 3B).
- Partitionnez physiologiquement les plants de maïs matures en stover (tous les tissus végétatifs, y compris les feuilles, les cosses et les tiges), les fractions de grains et d’épis. Hacher et sécher dans un four à air forcé à 60 °C jusqu’à ce qu’il soit à masse constante. Enregistrez le poids sec de la biomasse.
- Dans le microplot, couper toutes les tiges de maïs à la surface du sol, les attacher dans un faisceau, l’étiquette selon la parcelle et retirer du champ (Figure 3C). Ajuster les indicateurs d’angle de microplot pour qu’ils soient presque rincés avec la surface du sol afin de minimiser le risque d’enlèvement par la moissonneuse-batteuse pendant la récolte ou la récolte du sol.
- Récolter le grain de la zone de récolte et déclarer le rendement à 15,5 % de teneur en humidité12. Récolter les zones de recherche restantes avec une parcelle de combiner.
- Râteau de la biomasse non enrichie à partir de la zone microplot. Hacher et réappliquer la biomasse hors sol de microlots à la parcelle correcte (Figure 3D).
- Incorporer les résidus dans la surface du sol avec le travail du sol en prenant soin de minimiser le transport des résidus de sol et de maïs dans ou hors de la zone de microplot. Remplacez les drapeaux d’angle microplot retirés en raison du travail du sol.
- Plantez du maïs de deuxième année sur les mêmes rangées que le maïs de première année.
- Prélever de la biomasse de maïs hors sol de deuxième année seulement à maturité physiologique et à processus, comme les échantillons de maïs de première année, tel que décrit à l’étape 5.3. Prélever des échantillons de microplots au centre de la zone du microplot (1,52 m sur 0,76 m) afin d’éviter toute dilution potentielle du signal après le travail du sol (figure 2). Récolter les grains de la zone de récolte et déclarer le rendement à une teneur en humidité de 15,5 %.
- Suivant les principes des étapes 3.1 et 3.2, mélanger et broyer soigneusement 100 à 200 g de matières végétales séchées pour passer à travers un tamis de 2 mm. Mélangez soigneusement le matériau moulu et rangez un sous-échantillon dans une enveloppe de pièces étiquetée pour un traitement ultérieur.
REMARQUE : Une usine Thomas Wiley est une option satisfaisante pour le broyage des tissus végétaux, tandis qu’un usine de laboratoire 3610 de Perten est une option satisfaisante pour le broyage du grain.
AVERTISSEMENT : Les personnes qui broient des échantillons d’usines doivent porter une protection contre l’oreille et être protégées contre l’inhalation de poussière en portant un respirateur de protection contre les particules N95 approuvé par l’Institut national de sécurité et de santé au travail.
6. Traitement des échantillons sur le terrain : sol
- Prélever des échantillons de sol de première année 8 jours après l’épandage d’engrais enrichi de 15N, le V8, le R1 et le début de la récolte avant la récolte du sol. Prélever des échantillons de sol de deuxième année à la préinstation et après la récolte. En raison de contraintes d’échantillonnage logistique, les auteurs ont recueilli des échantillons de sol en saison à 0 à 15, 15 à 30 ans, et des échantillons de sol de 30 à 60 cm, des échantillons de sol post-récolte à 0- à 15- 15- à 30-, 30- à 60-, et 60- à 90 cm de profondeur, et des échantillons de sol pré-plante de deuxième année à 0- à 30-, 30- à 60-, 60- à 120 cm de profondeur.
REMARQUE : Si une sonde de sol est incapable de recueillir un noyau de sol à la profondeur désirée la plus profonde sous forme de noyau unique, recueillir des carottes de profondeur plus profondes à partir des mêmes forages que les profondeurs supérieures rejetant les 1 cm supérieurs du sol pour éviter que la contamination du sol ne tombe des profondeurs supérieures.- Prélever un échantillon de sol composite de quatre cœurs (1,8 cm de diamètre) dans la zone d’échantillonnage non enrichie à l’aide de V8 et R1 à l’aide d’une sonde à main. Recueillir un noyau dans la rangée de maïs et trois carottes entre les rangées de maïs.
- Prélever un échantillon de sol composite à deux cœurs (5 cm de diamètre) de la zone d’échantillonnage non enrichie à l’aide d’une sonde hydraulique à l’aide d’une sonde hydraulique.
- Prélever un échantillon de sol composite de 15 carottes (1,8 cm de diamètre) dans la zone du microplot 8 jours après l’application d’engrais enrichi de 15N, V8 et R1 à l’aide d’une sonde à main. Recueillir trois à quatre carottes dans la rangée de maïs et 11 à 12 carottes entre les rangées de maïs.
REMARQUE : Les sols sont extrêmement hétérogènes. Le plus grand nombre de carottes recueillies à l’intérieur du microplot enrichi fournit une meilleure estimation de l’enrichissement réel de 15N du sol N13. - Prélever un échantillon de sol composite de trois cœurs (5 cm de diamètre) de la zone de microplot à l’aide d’une sonde hydraulique à l’aide d’une sonde hydraulique.
- Homogénéiser chaque échantillon de sol composite dans un seau et le placer dans un sac en papier pré-étiqueté.
- Échantillons de sol sec à 35 °C dans un four à air forcé jusqu’à ce qu’une masse constante. Broyer chaque échantillon pour passer à travers un tamis de 2 mm. Un broyeur de sol mécanique est satisfaisant s’il peut être soigneusement nettoyé entre chaque échantillon.
REMARQUE : Les échantillons de sol peuvent être séchés à l’air en répandant des échantillons sur des plateaux en couche mince. Les plateaux doivent être dans une zone exempte de contamination par des sources extérieures de N. Les échantillons non enrichis et enrichis doivent être séparés physiquement afin de prévenir la contamination croisée.
ATTENTION : Les personnes qui broient des échantillons de sol doivent porter une protection contre l’oreille et être protégées contre l’inhalation de poussière en portant un respirateur de protection contre les particules N95 approuvé par l’Institut national de sécurité et de santé au travail.
7. Traitement des échantillons de laboratoire : broyage des échantillons de sol et de plantes
- Échantillons d’usines au sol sec (2 mm) pendant la nuit dans un four à 60 °C.
- Suivant les principes décrits à l’étape 3, moudre les échantillons de plantes séchées ou les matériaux du sol jusqu’à une consistance fine semblable à celle de la farine. Un moulin à rouleaux est une option satisfaisante.
REMARQUE : Le moulin à bocaux des auteurs est un système de bande transporteuse sur mesure qui peut traiter 54 pots à rouleaux à la fois.- Remplissez chaque bocal à rouleaux (pot en verre borosilicate de 250 ml avec un couvercle à vis) avec 10 à 20 g d’échantillon de plantes ou de sol moulus et sept tiges en acier inoxydable (8,5 cm de long, 0,7 cm de diamètre).
- Rouler les pots à rouleaux à 0,4 x g pendant 6-24 h ou jusqu’à ce que les échantillons aient une consistance fine ressemblant à de la farine.
- Transférer le matériau finement moulu dans un flacon de scintillation propre et étiqueté de 20 mL.
- Entre chaque échantillon, lavez les pots à rouleaux, les tiges en acier inoxydable et les couvercles avec du savon et de l’eau pour enlever les résidus.
- Immerger les pots à rouleaux et les couvercles dans un bain d’acide HCl de 5 % (préparé à partir de 36-38 % de bouillon concentré) pendant la nuit14.
ATTENTION : L’acide chlorhydrique est corrosif. Il peut causer de graves brûlures de la peau, des lésions oculaires, et est nocif en cas d’inhalation. Portez toujours des vêtements de protection, des gants et une protection pour les yeux et le visage. Rincer les tissus contactés à fond avec de l’eau. Utilisez toujours un contenant secondaire lors du transport des acides. Ajoutez toujours de l’acide à l’eau car cette réaction est exothermique. Neutraliser immédiatement les déversements d’acide avec du bicarbonate de soude.
REMARQUE : Un grand bain acide peut être préparé sous forme de 100 L de 5 % HCl dans un contenant en plastique de 208 L. Préparer plusieurs petits volumes dans un capot de fumée, puis transférer les solutions dans le contenant en plastique. Remplacez la solution tous les trois mois. - Triple rinçage des pots à rouleaux et des couvercles à l’eau déionisée et à sec à l’air.
- Immerger les tiges en acier inoxydable dans un bain NaOH de 0,05 M (préparé en dissolvant 2 g de NaOH dans 1 L d’eau déionisée) pendant la nuit14. Préparez un nouveau bain NaOH de 0,05 M chaque jour.
ATTENTION : L’hydroxyde de sodium peut causer de graves brûlures cutanées et des lésions oculaires. Portez toujours des vêtements de protection et une protection oculaire. Retirez immédiatement les vêtements contaminés et rincez la peau ou les yeux avec de l’eau pendant plusieurs minutes. - Rincer les tiges sous l’eau chaude courante du robinet pendant 5 minutes. Décanter et tripler rincer les tiges à l’eau déionisée. Laisser sécher les tiges sur un plateau tapissé de papier essuie-tout.
- Immerger les pots à rouleaux et les couvercles dans un bain d’acide HCl de 5 % (préparé à partir de 36-38 % de bouillon concentré) pendant la nuit14.
8. Peser les échantillons d’usines et de sols pour l’analyse totale de N et de 15N
- Analyser quelques échantillons représentatifs de plantes et de sols pour la teneur totale en N (p. ex., analyse de la combustion15). Calculer la masse d’échantillon qui fournit un contenu N adéquat pour l’analyse de 15N selon les spécifications de l’analyseur.
REMARQUE : Les auteurs ont utilisé les services d’analyse fournis par UC Davis Stable Isotope Facility. Les poids d’échantillon enrichis ont été optimisés pour 20 μg de N avec un maximum de 100 μg de N. - Organisez des échantillons semblables de l’enrichissement le plus bas au plus élevé prévu de 15N. Dupliquer chaque huitième à douzième échantillon dans chaque course pour vérifier la précision de l’échantillon. Inclure au moins un échantillon de contrôle par exécution16.
- Étiqueter une plaque propre de 96 puits et un couvercle ajusté avec des anneaux d’évaporation individuels. Coupez une carte d’index propre pour tenir juste à l’intérieur du couvercle pour empêcher le mouvement de l’échantillon entre les puits pendant le transport.
- Porter des gants de nitrille, nettoyer la micro-échelle, les surfaces de travail, les spatules et les forceps avec des lingettes de laboratoire et de l’éthanol. Placez les ustensiles nettoyés sur un Kimwipe sur le banc du laboratoire.
REMARQUE : Les échantillons non enrichis et enrichis doivent être traités à l’aide d’écailles et d’ustensiles distincts pour prévenir la contamination croisée. - Utilisez des forceps pour placer une capsule d’étain préformé de 5 mm x 9 mm sur une surface de travail propre, comme un bloc en acier inoxydable avec 5 mm x 8 mm de puits. Appuyez doucement sur la capsule dans le puits pour réformer la forme cylindrique et aplatir le fond de la capsule si nécessaire.
REMARQUE : Comme les masses d’échantillons seront très faibles, le risque de contamination par l’échantillon est élevé. Ne touchez jamais les capsules avec des gants. Jetez la capsule si elle touche une surface autre que les forceps, la surface de travail propre, la plaque de pesée à l’échelle, ou la plaque de 96 puits. - Utilisez des forceps pour évaser doucement le haut de 1 mm de la capsule pour faciliter la manipulation. Pour éviter les dommages à l’échelle lors de l’engrégation du poids de la capsule, planez et relâchez la capsule de 1 à 2 mm au-dessus de la plaque de pesée microcal. Tare la capsule. Utilisez des forceps pour retourner la capsule à la surface de travail propre.
- Utilisez une spatule pour ajouter soigneusement la masse requise de matériel d’échantillon finement moulu à la capsule. Évitez de renverser du matériel d’échantillonnage sur la surface extérieure de la capsule ou sur les surfaces de travail.
- À l’aide de forceps, sertir lentement le tiers supérieur de la capsule et plier pour sceller. À l’aide de forceps, continuez à plier et comprimer la capsule en forme sphérique en prenant soin de ne pas perforer ou déchirer l’étain.
REMARQUE : Les échantillons à faible teneur en N peuvent nécessiter des volumes d’échantillons qui dépassent la capacité de la capsule de 5x9 mm. Des capsules plus grandes (p. ex., 9 mm x 10 mm) peuvent être utilisées dans ces cas. - Utilisez des forceps pour déposer la capsule enveloppée plusieurs fois d’une hauteur de 1 cm sur une surface propre et sombre ou un miroir pour vérifier s’il y a des fuites. Si aucune poussière n’apparaît, pesez l’échantillon en utilisant la même technique que celle décrite à l’étape 8.6. Enregistrez le poids de l’échantillon. Placez la capsule dans une plaque de 96 puits et enregistrez le placement du puits.
- Si de la poussière apparaît sur la surface sombre, enregistrez le poids de l’échantillon. Enveloppez l’échantillon dans une deuxième capsule d’étain, vérifiez à nouveau les fuites et placez-le dans une assiette propre de 96 puits.
REMARQUE : Si la capsule enveloppée est trop grande pour tenir dans une assiette de 96 puits, utilisez une plaque de 24 ou 48 puits.
- Si de la poussière apparaît sur la surface sombre, enregistrez le poids de l’échantillon. Enveloppez l’échantillon dans une deuxième capsule d’étain, vérifiez à nouveau les fuites et placez-le dans une assiette propre de 96 puits.
- Entre les échantillons, nettoyez chacun des ustensiles et des surfaces à l’éthanol et des lingettes de laboratoire en accordant une attention particulière aux bords de la spatule et des forceps.
- Fixez le couvercle de la plaque de 96 puits à l’aide de ruban adhésif et conservez-le dans un dessiccateur.
9. Calculs
- Calculer la masse de N (kg•ha-1) contenue dans les échantillons de plantes ou de sol à l’aide des équations suivantes.
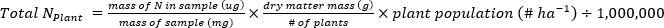
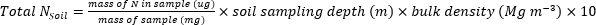
- Calculer l’engrais N fraction (Nf), l’engrais dérivé N (FDN), et le sol dérivé N (SDN) pour les échantillons de plantes et de sol17.
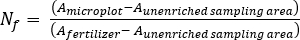
où A est l’atome % 15N d’enrichissement. -
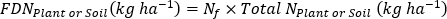
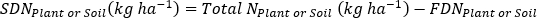
- Calculer l’engrais 15N efficacité d’utilisation17.

Résultats
Les résultats présentés dans cet article proviennent d’un site de terrain établi en 2015 à l’Université du Minnesota Southern Outreach and Research Center situé près de Waseca, MN. Le site a été géré comme une rotation maïs-soja[Glycine max (L.) Merr] avant 2015, mais a été géré comme une rotation maïs-maïs au cours des saisons de croissance 2015 et 2016. Le sol était un loam d’argile Nicollet (fine-loamy, mixte, superactif, mésique Aquic Haplulls)-Webs...
Discussion
La recherche sur les isotopes stables est un outil utile pour le suivi et la quantification du FDN par l’entremise du système de culture du sol. Cependant, il y a trois hypothèses principales associées aux études de traceur de N qui, si elle est violée, peuvent invalider les conclusions tirées de l’utilisation de cette méthodologie. Ils sont 1) le traceur est uniformément réparti dans tout le système, 2) les processus dans le cadre de l’étude se produisent aux mêmes taux, et 3) N laissant la piscine enr...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs reconnaissent le soutien du Minnesota Corn Research & Promotion Council, de la Hueg-Harrison Fellowship et de la Bourse Discovery, Research and InnoVation Economy (MnDRIVE) du Minnesota.
matériels
| Name | Company | Catalog Number | Comments |
| 20 mL scintillation vial | ANY; Fisher Scientific is one example | 0334172C | |
| 250 mL borosilicate glass bottle | QORPAK | 264047 | |
| 48-well plate | EA Consumables | E2063 | |
| 96-well plate | EA Consumables | E2079 | |
| Cloth parts bag (30x50 cm) | ANY | NA | For corn ears |
| CO2 Backpack Sprayer | ANY; Bellspray Inc is one example | Model T | |
| Coin envelop (6.4x10.8 cm) | ANY; ULINE is one example | S-6285 | For 2-mm ground plant samples |
| Corn chipper | ANY; DR Chipper Shredder is one example | SKU:CS23030BMN0 | For chipping corn biomass |
| Corn seed | ANY | NA | Hybrid appropriate to the region |
| Disposable shoe cover | ANY; Boardwalk is one example | BWK00031L | |
| Ethanol 200 Proof | ANY; Decon Laboratories Inc. is one example | 2701TP | |
| Fabric bags with drawstring (90x60 cm) | ANY | NA | For plant sample collection |
| Fertilizer Urea (46-0-0) | ANY | NA | ~0.366 atom % 15N |
| Hand rake | ANY; Fastenal Company is one example | 5098-63-107 | |
| Hand sickle | ANY; Home Depot is one example | NJP150 | For plant sample collection |
| Hand-held soil probe | ANY; AMS is one example | 401.01 | |
| Hydraulic soil probe | ANY; Giddings is one example | GSPS | |
| Hydrochloric acid, 12N | Ricca Chemical | R37800001A | |
| Jar mill | ANY; Cole-Parmer is one example | SI-04172-50 | |
| Laboratory Mill | Perten | 3610 | For grinding grain |
| Microbalance accurate to four decimal places | ANY; Mettler Toledo is one example | XPR2 | |
| N95 Particulate Filtering Facepiece Respirator | ANY, ULINE is one example | S-9632 | |
| Neoprene or butyl rubber gloves | ANY | NA | For working in HCl acid bath |
| Paper hardware bags (13.3x8.7x27.8 cm) | ANY; ULINE is one example | S-8530 | For soil samples and corn grain |
| Plant grinder | ANY; Thomas Wiley Model 4 Mill is one example | 1188Y47-TS | For grinding chipped corn biomass to 2-mm particles |
| Plastic tags | ULINE | S-5544Y-PW | For labeling fabric bags and microplot stalk bundles |
| Sodium hydroxide pellets, ACS | Spectrum Chemical | SPCM-S1295-07 | |
| Soil grinder | ANY; AGVISE stainless steel grinder with motor is one example | NA | For grinding soil to pass through a 2-mm sieve |
| Tin capsule 5x9 mm | Costech Analytical Technologies Inc. | 041061 | |
| Tin capsule 9x10 mm | Costech Analytical Technologies Inc. | 041073 | |
| Urea (46-0-0) | MilliporeSigma | 490970 | 10 atom % 15N |
Références
- Sharp, Z. . Principles of Stable Isotope Geochemistry. , (2017).
- Van Cleemput, O., Zapata, F., Vanlauwe, B. Guidelines on Nitrogen Management in Agricultural Systems. Guidelines on Nitrogen Management in Agricultural Systems. 29 (29), 19 (2008).
- Hauck, R. D., Meisinger, J. J., Mulvaney, R. L. Practical considerations in the use of nitrogen tracers in agricultural and environmental research. Methods of Soil Analysis: Part 2-Microbiological and Biochemical Properties. , 907-950 (1994).
- Bedard-Haughn, A., Van Groenigen, J. W., Van Kessel, C. Tracing 15N through landscapes: Potential uses and precautions. Journal of Hydrology. 272 (1-4), 175-190 (2003).
- Peterson, R. G. . Agricultural Field Experiments: Design and Analysis. , (1994).
- Follett, R. F. Innovative 15N microplot research techniques to study nitrogen use efficiency under different ecosystems. Communications in Soil Science and Plant Analysis. 32 (7/8), 951-979 (2001).
- Russelle, M. P., Deibert, E. J., Hauck, R. D., Stevanovic, M., Olson, R. A. Effects of water and nitrogen management on yield and 15N-depleted fertilizer use efficiency of irrigated corn. Soil Science Society of America Journal. 45 (3), 553-558 (1981).
- Schindler, F. V., Knighton, R. E. Fate of Fertilizer Nitrogen Applied to Corn as Estimated by the Isotopic and Difference Methods. Soil Science Society of America Journal. 63, 1734 (1999).
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study. Agronomy Journal. 97 (4), 1037 (2005).
- Recous, S., Fresneau, C., Faurie, G., Mary, B. The fate of labelled 15N urea and ammonium nitrate applied to a winter wheat crop. Plant and Soil. 112 (2), 205-214 (1988).
- Abendroth, L. J., Elmore, R. W., Boyer, M. J., Marlay, S. K. . Corn Growth and Development. , (2011).
- Gomez, K. A., Gomez, A. A. . Statistical Procedures for Agricultural Research. , (1984).
- Khan, S. A., Mulvaney, R. L., Brooks, P. D. Diffusion Methods for Automated Nitrogen-15 Analysis using Acidified Disks. Soil Science Society of America Journal. 62 (2), 406 (1998).
- Horneck, D. A., Miller, R. O. Determination of Total Nitrogen in Plant Tissue. Handbook of Reference Methods for Plant Analysis. , 75-84 (1998).
- . Carbon (13C) and Nitrogen (15N) Analysis of Solids by EA-IRMS Available from: https://stableisotopefacility.ucdavis.edu/13cand15n.html (2019)
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study: II. Nitrogen Uptake Efficiency. Agronomy Journal. 97 (4), 1046 (2005).
- . Fertilizing Corn in Minnesota Available from: https://extension.umn.edu/crop-specific-needs/fertilizing-corn-minnesota (2018)
- Blake, G. R., Hartge, K. H. Bulk Density. Methods of Soil Analysis: Part 1 Physical and Mineralogical Methods. , 363-375 (1986).
- Jokela, W. E., Randall, G. W. Fate of Fertilizer Nitrogen as Affected by Time and Rate of Application on Corn. Soil Science Society of America Journal. 61 (6), 1695 (2010).
- Hart, S. C., Stark, J. M., Davidson, E. A., Firestone, M. K. Nitrogen Mineralization, Immobilization, and Nitrification. Methods of Soil Analysis, Part 2. Microbiological and Biochemical Properties. (5), 985-1018 (1994).
- Olson, R. V. Fate of tagged nitrogen fertilizer applied to irrigated corn. Soil Science Society of America Journal. 44 (3), 514-517 (1980).
- Follett, R. F., Porter, L. K., Halvorson, A. D. Border Effects on Nitrogen-15 Fertilized Winter Wheat Microplots Grown in the Great Plains. Agronomy Journal. 83 (3), 608-612 (1991).
- Balabane, M., Balesdent, J. Input of fertilizer-derived labelled n to soil organic matter during a growing season of maize in the field. Soil Biology and Biochemistry. 24 (2), 89-96 (1992).
- Recous, S., Machet, J. M., Mary, B. The partitioning of fertilizer-N between soil and crop: Comparison of ammonium and nitrate applications. Plant and Soil. 144 (1), 101-111 (1992).
- Bigeriego, M., Hauck, R. D., Olson, R. A. Uptake, Translocation and Utilization of 15N-Depleted Fertilizer in Irrigated Corn. Soil Science Society of America Journal. 43 (3), 528 (1979).
- Glendining, M. J., Poulton, P. R., Powlson, D. S., Jenkinson, D. S. Fate of15N-labelled fertilizer applied to spring barley grown on soils of contrasting nutrient status. Plant and Soil. 195 (1), 83-98 (1997).
- Khanif, Y. M., Cleemput, O., Baert, L. Field study of the fate of labelled fertilizer nitrate applied to barley and maize in sandy soils. Fertilizer Research. 5 (3), 289-294 (1984).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon