このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
15窒素分析のためのマイクロプロット設計と植物および土壌サンプル調製
要約
15Nトレーサー研究のためのマイクロプロット設計は、複数の季節内の植物および土壌サンプリングイベントに対応するために記述されています。15N分析のための粉砕および計量の議定書を含む土および植物のサンプルの収集および処理のプロシージャは出される。
要約
多くの窒素肥料研究は、穀物収量や累積N損失などの季節末の測定に対する治療の全体的な効果を評価します。土壌作物システムを通じて肥料由来N(FDN)の運命に従い、定量化するためには、安定した同位体のアプローチが必要です。本稿の目的は、2つの成長期にわたる複数の土壌および植物サンプリングイベントに対して、非閉じ込めの15N濃縮マイクロプロットを利用した小さなプロット研究設計を説明し、合計15N分析のためのサンプル収集、取り扱い、および処理プロトコルを提供することである。この方法は、ミネソタ州南中部からトウモロコシに植えられた複製研究(Zea mays L.)を用いて実証された。各処理は、15.2 mの6つのトウモロコシ列(76 cmの行間隔)で構成され、一方の端にマイクロプロット(2.4 m x 3.8 m)が埋め込まれています。肥料グレードの尿素は植え付け時に135kgのN∙ha-1で塗布され、尿素を受けたマイクロプロットは5原子%15N.に富んだ尿素を受け取り、土壌および植物サンプルを栽培期を通じて数回採取し、別々の工具を使用して交差汚染を最小限に抑え、すべての手順で濃縮された不富分化したサンプルを物理的に分離することに注意を払いました。土壌および植物サンプルを乾燥させ、粉砕して2mmスクリーンを通過し、ローラージャーミルを使用して小麦粉のような一貫性に粉砕した。トレーサの研究では、追加の計画、サンプル処理時間、手作業が必要であり、従来のN研究よりも15N濃縮材料とサンプル分析に高いコストがかかります。しかし、質量バランスアプローチを使用して、複数の季節サンプリングイベントを使用したトレーサー研究により、研究者は土壌作物システムを通じてFDN分布を推定し、システムから未確認のFDNを推定することができます。
概要
肥料窒素(N)の使用は、世界人口の増加に対する食料、繊維、飼料、燃料需要を満たすために農業に不可欠ですが、農業分野からのN損失は環境品質に悪影響を及ぼす可能性があります。Nは土壌作物システムにおいて多くの変化を遂げるため、Nの使用効率を促進し、環境損失を最小限に抑える管理慣行を改善するために、Nサイクリング、作物利用、肥料Nの全体的な運命をよりよく理解することが必要です。従来のN肥料研究は、主に収穫収量、N率に対する作物Nの取り込み(明らかな肥料の使用効率)、および残留土壌Nなどの季節の終わりの測定に対する治療の効果に焦点を当てています。これらの研究は、全体のシステムNの入力、出力、および効率を定量化するが、肥料源または土壌に由来する土壌作物系でNを同定したり定量化したりすることはできません。安定同位体を用いた別のアプローチは、土壌作物系における肥料由来N(FDN)の運命を追跡し、定量化するために使用されなければならない。
窒素は、14 N/15N1(0.366原子%15 N1または3600ppm15 15N2、3)の比較的一定の比で自然界に発生する2つの安定同位体315、14Nおよび15Nを有する。 1415Nの富化肥料の添加は土システムの合計15Nの含量を増加させる。15Nの富化肥料が富化土壌Nと混合するので、14N/15N比の測定された変化は、研究者が土壌プロファイル内および作物33、44にFDNを追跡することを可能にする。質量バランスは、システムとその各部品2の15Nトレーサの合計量を測定することによって計算することができます。15Nの濃縮肥料は従来の肥料よりもかなり高価であるため、15N濃縮されたマイクロプロットはしばしば治療プロットに埋め込まれています。この方法論文の目的は、トウモロコシ(Zea mays L.)の複数の季節内土壌および植物サンプリングイベントのマイクロプロットを利用した小さなプロットの研究設計を記述し、合計15N分析のために植物および土壌サンプルを調製するためのプロトコルを提示することである。これらの結果は、N肥料の使用効率を推定し、バルク土壌と作物のFDNの部分的なN予算会計を作成するために使用することができます。
プロトコル
1. フィールドサイトの説明
注: 15N トレーサー フィールド試験を実行する場合、選択したサイトは土壌、地形、および物理的な特徴に起因する変動を最小限に抑える必要があります5.クロスコンタミネーションは、斜面、風または水の転座による横方向の土壌移動に続いて起こり得る、または耕作中に土Nの垂直分布は、地下水流およびタイル排水6によって影響を受ける可能性がある。
- 過去の管理(例えば、以前の作物や耕作法)、緯度経度、土壌の物理的および化学的特性(例えば、土壌のテクスチャ分析、初期の不妊状態、pH、土壌かさ密度)を含む実験場部位を記述する。
- 研究現場とフィールドコーナーのGPS座標を記録します。
- 害虫や病気の管理(除草剤、殺虫剤、殺菌剤の使用)、土壌不妊治療管理(レート、ソース、配置、アプリケーションタイミングを含む)、耕作、灌漑イベントと量、残留管理を含む成長期管理について説明します。
- 作物の成長と微生物媒介性N変換は土壌水分、土壌温度、および気温によって影響を受けるため、土壌サンプリング深度を反映するいくつかの深さで、毎日の高温と低温、日日の降水量、土壌水分および温度などの気候情報を記録します。
2. プロット設計
- 76 cmの間隔に6つのトウモロコシ列(約86,000の植物は-1)を植え、最終的なプロットの次元は15.2 m x 4.6 mです。
- 長さ寸法の両端から 1.5 m (0-1.5 m, 13.7-15.2 m) と、サンプリング領域と収穫面積に隣接する長さ 1.5 m (9.8 ~11.3 m) を追加する境界領域を確立します (図 1)。
- 2列目と3列目を季節の植物および土壌サンプリングエリア(1.5~9.8 m)、4列目と5列目を収穫面積(1.5~9.8m)に指定します。
- 幅寸法を中心に2.4 m×3.8 mのマイクロプロット面積(11.3~13.7 m)を設定します。この領域から15Nの濃縮植物および土壌サンプルをすべて収集し、エッジ効果を最小限に抑えるために長さと幅の寸法に0.38 mの未サンプリングの境界線を残します(図2)。
- 異なる色のフラグを持つ処理プロットとマイクロプロットコーナーを描画します。
3. 土壌および植物のサンプルの注意
- 豊かさのない、豊かな材料のための専用の装置および処理区域を使用する。富化材料による富のない材料(肥料、土壌、または植物)の汚染、およびその逆も結果に大きな影響を与える可能性があります。
- 15N濃縮土壌および植物サンプルを最低から最高の15Nの期待される濃縮の順序で収集し、処理して、クロスコンタミネーションを最小限に抑えます。各サンプル間の作業面、手袋、調理器具、機械を十分に洗浄し、サンプルの持ち越しによるクロスコンタミネーションを最小限に抑えます。
- 富のないサンプリングエリアの汚染を防ぐために、マイクロプロットでの足のトラフィックを最小限に抑えます。マイクロプロットにアクセスする際は保護靴カバーを着用し、マイクロプロット領域を出るときには取り外してください。
4. 15N濃縮肥料の調製と適用
- 肥料15N使用効率(F15NUE)研究のためのRef.2によって定められたガイドラインに従って、10原子%15N濃縮尿素を5原子%15N濃縮尿素に希釈し、2Lの脱イオン水に溶解して尿素肥料の均一な濃縮を確実にする。
注:15N濃縮肥料の必要な濃度は、農業研究の目標に依存しています。ストック15N濃縮肥料の濃度が研究者の要求を超える場合、ストック肥料濃度は、以下の式3を用いて同様の従来の肥料で希釈することができる。
X2 =[(C1/C2)- 1] × X1
X2は従来の富化肥料の質量であり、X1はトレーサー肥料の質量であり、C1は同位体濃度である[原子%過剰(測定原子%濃縮率を差し引いた天然背景濃度を差し引いた)を原型トレーサー肥料の元の微量肥料の同位体濃度、C2は最終混合物の同位体濃度である。例として、10原子%濃縮尿素の100gを与えられ、従来の非富化肥料の92.7 gは5原子%の最終同位体濃度に必要とされるであろう。
X2 = {[(10-0.3663)/5] - 1} × 100. - 15N濃度の溶液を分析し、濃縮を検証します。著者らは、UCデイビス安定同位体施設が提供する分析サービスを利用した。
注:肥料の添加に対する土壌植物微生物のレジーブの反応は、肥料の物理的形態によって影響を受ける可能性があります。研究の目的に応じて、尿素溶液は、結晶を改質するために液体として適用されるか、脱水状態で適用され得る。結晶は、10,000 psiでカーバープレスを使用してケーキに圧縮され、続いてケーキを粉砕し、所望のサイズ3に粒子をスクリーニングすることができる。 - キャリブレーション済みのバックパックCO2噴霧器を使用して、15N濃縮尿素溶液をマイクロプロットに均等に塗布します(図3A)。複数のNレートまたは濃縮レベルを使用する場合は、各濃縮レベルに指定されたCO2噴霧器を使用するか、単一の噴霧器を使用し、治療クロスコンタミネーションを最小限に抑えるために、最低から最も高い濃縮液までのソリューションを適用することを検討してください。
- 尿素含有肥料を、軽い耕作、手の熊手、または少なくとも0.6 cmの灌漑を適用の24時間以内に組み込むことで、揮発損失の可能性を最小限に抑えます。
- 第2の成長期の間に付加的な15Nの富化された尿素肥料はマイクロプロットに適用されません。窒素によるトウモロコシの成長の差動を避けるために、従来の非濃縮尿素を処理全体に適用します。
5. フィールドサンプル処理:地上トウモロコシバイオマス
- 各サンプリング段階で、サンプリング領域内から6地上トウモロコシ植物複合サンプル(15N非濃縮)と15N濃縮マイクロプロットから6地上トウモロコシ植物複合サンプルを収集します。少なくとも2つの植物は、植物の成長ダイナミクスを大幅に変化させないために、各サンプリングされた植物を分離する必要があります。著者らは、V8およびR1トウモロコシ生理学的発達段階11および生理的成熟時に植物サンプルを採取した(図2)。
- ステップ3.1および3.2に記載された原則に従って、V8およびR1の地上バイオマスを刻む(≤5 cmで≤5 cm)。ヤード廃棄物チッパーは満足のいく選択肢です。刻んだバイオマスをラベル付き生地または紙袋に入れ、一定の質量になるまで60°Cの強制空気オーブンで乾燥させます。バイオマス乾燥重量を記録する(図3B)。
- 生理学的に成熟したトウモロコシの植物をスタバ(葉、殻、茎を含むすべての栄養組織)、穀物、およびコブ画分に分割します。60°Cの強制空気オーブンで一定の質量になるまでみじん切りにして乾燥させます。バイオマス乾燥重量を記録します。
- マイクロプロット内で、土壌表面ですべてのトウモロコシの茎を切断し、束に結び、プロットに従ってラベルを付け、フィールドから取り除きます(図3C)。収穫または耕作後の収穫の間に結合によって除去の危険を最小にするために土表面とほぼ同じフラッシュされるようにマイクロプロットコーナーの旗を調整してください。
- 収穫地域からの収穫穀物と報告収率 15.5% 含水量12.プロットを組み合わせて残りの研究領域を収穫します。
- マイクロプロット領域の外から濃縮されていないバイオマスをレーキ。地上バイオマスを刻んで再適用して正しいプロットにする(図3D)。
- ミクロプロット領域へのまたはマイクロプロット領域からの土壌およびトウモロコシの残留物の輸送を最小限に抑えるために注意して、土壌表面に残留物を組み込みます。ミクロプロットコーナーフラグを、耕作により削除した値に置き換えます。
- 1年生のトウモロコシと同じ列に2年目のトウモロコシを植えます。
- ステップ5.3で説明したように、生理学的成熟度と1年目のトウモロコシサンプルのようなプロセスでのみ2年目の地上トウモロコシバイオマスを収集します。ミクロプロット領域の中心(1.52 m x 0.76 m)からマイクロプロットサンプルを収集し、耕作後の潜在的な信号希釈を避ける(図2)。収穫地域から穀物を収穫し、15.5%の水分含量で収量を報告します。
- ステップ3.1および3.2の原則に従って、2mmふるいを通過するために乾燥した植物材料の100〜200gを十分に混合し、粉砕する。地盤材料を十分に混合し、さらに処理するためにラベル付きコインエンベロープにサブサンプルを保存します。
注:トーマスワイリーミルは植物組織研削のための満足のいく選択であるがパーテン実験室のミル3610は穀物を粉砕するための満足のいく選択である。
注意:植物サンプルを粉砕する人々は、耳の保護を着用し、国立労働安全衛生研究所が承認したN95微粒子フィルタリングフェイスピース呼吸器を着用してほこりを吸い込むことから保護されるべきです。
6. フィールドサンプル処理:土壌
- 15N濃縮肥料塗布、V8、R1、および耕作前の収穫後8日後に、初年度の土壌サンプルを収集します。植物前および収穫後の2年目の土壌サンプルを収集します。ロジスティックサンプリングの制約により、著者らは季節内の土壌サンプルを0〜15-に収集し、 15~30~30cm、深さ30~60cm、収穫後の土壌サンプルを0~15~15~30~30~60cm、60~90cmの深さで、2年目の植物前土壌サンプルは0~30~30~60~60~120cmの深さである。
注:土壌プローブが単一のコアとして最も深い所望の深さまで土壌コアを収集することができない場合は、上層深度と同じ穴から深い深さのコアを収集し、上の深さから落ちる土壌からの汚染を避けるために、土壌の上の1cmを捨てます。- V8とR1のアンリッチングサンプリング領域から、ハンドプローブを使用して4コア(直径1.8cm)の複合土壌サンプルを収集します。トウモロコシの列に1つのコアとトウモロコシの行の間に3つのコアを収集します。
- 油圧プローブを使用して、植物前および収穫後の不富分サンプリング領域から2コア(直径5cm)の複合土壌サンプルを収集します。
- ハンドプローブを使用して、15 N濃縮肥料塗布、V8、およびR1の8日後にマイクロプロット領域から15コア(直径1.8cm)の複合土壌サンプルを収集します。トウモロコシの列に3〜4コア、トウモロコシの列の間に11〜12コアを収集します。
注:土壌は非常に異質です。濃縮されたマイクロプロット内から収集されたコアの数が多いほど、土壌N13の真の15N濃縮のより良い推定値を提供する。 - プラント前および税引き後のマイクロプロット領域から、油圧プローブを使用して、3コア(直径5cm)の複合土壌サンプルを収集します。
- 各複合土壌サンプルをバケットに均質化し、あらかじめラベル付けされた紙袋に入れます。
- 一定の質量まで強制空気オーブンで35°Cで乾燥土壌サンプル。各サンプルを粉砕して2mmのふるいを通過します。機械式土削り機は、各サンプル間で十分に洗浄できれば満足です。
注:土壌サンプルは、薄い層のトレイにサンプルを広めることによって空気乾燥することができます。トレイは、外部Nソースによる汚染のない領域にあるべきです。富みのない濃縮サンプルは、クロスコンタミネーションを防ぐために物理的に分離する必要があります。
注意:土壌サンプルを粉砕する人々は、耳の保護を着用し、国立労働安全衛生研究所が承認したN95微粒子フィルタリングフェイスピース呼吸器を着用してほこりを吸い込むことから保護されるべきです。
7. ラボサンプル加工:粉砕土および植物サンプル
- 乾燥した植物のサンプル(2mm)をオーブンで一晩60°Cで行う。
- ステップ3に記載の原則に従って、乾燥した植物サンプルまたは土壌材料を細かい小麦粉のような一貫性に粉砕する。ローラージャーミルは満足のいく選択肢です。
注:著者のジャーミルは、一度に54個のローラージャーを処理できるカスタムメイドのコンベアベルトシステムです。- 各ローラージャー(250 mLホウケイ酸ガラス瓶にスクリュートップリッド)を10~20gの地盤または土壌サンプルと7本のステンレス鋼棒(長さ8.5cm、直径0.7cm)で充填します。
- ロールロールジャーは、6〜24時間またはサンプルが細かい小麦粉のような一貫性を持つまで、0.4 x gでロールします。
- 細かく接地材料を清潔な20 mLシンチレーションバイアルに移します。
- 各サンプルの間にローラージャー、ステンレス鋼の棒、石鹸と水のふたを洗って残留物を取り除きます。
- ローラージャーと蓋を5%HCl酸浴(36~38%濃縮ストックから調製)に浸す14.
注意:塩酸は腐食性です。重度の皮膚や目の損傷を引き起こし、吸入すると有害です。常に防護服、手袋、目と顔の保護を着用してください。水で十分に接触した組織を洗い流す。酸を輸送する際は必ず二次容器を使用してください。この反応は発熱であるため、常に水に酸を加えます。すぐに重曹で酸こぼれを中和します。
注:大きな酸浴は、208 Lプラスチック容器に5%HClの100 Lとして調製することができる。ヒュームフードに複数の小さなボリュームを準備し、その後、プラスチック容器にソリューションを転送します。3か月ごとにソリューションを交換してください。 - 脱イオン水と空気乾燥したトリプルリンスローラージャーと蓋。
- ステンレス棒を0.05MNaOH浴M中に浸漬(1Lの脱イオン水にNaOHの2gを溶解して調製する)一晩14。毎日新しい0.05 M NaOHバスを準備してください。
注意:水酸化ナトリウムは重度の皮膚の火傷や眼の損傷を引き起こす可能性があります。常に防護服と目の保護を着用してください。すぐに汚染された衣類を取り除き、皮膚や目を数分間水ですすいだ。 - 流れる水道水の下でロッドを5分間すすります。デカンと三重脱イオン水でロッドをすすいでください。タオルが並ぶトレイでロッドを空気乾燥させます。
- ローラージャーと蓋を5%HCl酸浴(36~38%濃縮ストックから調製)に浸す14.
8. 合計Nおよび15N分析のための地面の植物および土のサンプルを量る
- N含有量の少ない代表的な植物および土壌サンプルを分析する(例えば、燃焼分析15)。分析装置の仕様に従って、15N 分析に適した N コンテンツを提供するサンプル質量を計算します。
注:著者らは、UCデイビス安定同位体施設が提供する分析サービスを利用しました。濃縮されたサンプル重量は、Nの20 μgに最適化され、最大で100 μgのNが得られました。 - 最低から予想される最高の15Nの濃縮まで同様のサンプルを整理します。各実行で 8 番目から 12 番目のサンプルを複製して、サンプルの精度を確認します。16の実行ごとに少なくとも 1 つのチェック サンプルを含めます。
- 清潔な96ウェルプレートと取り付けられた蓋に、個々の井戸蒸発リングをラベル付けします。輸送中の井戸間のサンプルの動きを防ぐために、蓋の内側に収まるようにきれいなインデックスカードをカットします。
- ニトリル手袋を着用し、マイクロスケール、作業面、へら、および実験室のワイプとエタノールで鉗子をきれいにします。ラボベンチのキムワイプに清掃された道具を置きます。
注: 富みのない濃縮されたサンプルは、クロスコンタミネーションを防ぐために、別々のスケールと調理器具を使用して処理する必要があります。 - 鉗子を使用して、5 mm x 8 mm ウェルのステンレス鋼ブロックのようなクリーンな作業面にあらかじめ形成された 5 mm x 9 mm スズ カプセルを置きます。カプセルをウェルにそっとタップして円筒形を変え、必要に応じてカプセルの底部を平らにします。
注: サンプルの質量は非常に小さいため、サンプル汚染のリスクは高くなります。手袋でカプセルに触れないでください。鉗子、きれいな作業面、スケール計量パン、または96ウェルプレート以外の表面に触れた場合は、カプセルを廃棄します。 - 鉗子を使用して、カプセルの上部1mmを静かに燃え上がって操作を容易にします。カプセルの重量をタールするときのスケールの損傷を避けるために、マイクロスケールの計量パンの上にカプセル1〜2mmをホバーして放出する。カプセルをちらりと食い上がる。鉗子を使用してカプセルをクリーンワーク面に戻します。
- スパチュラを使用して、必要な細かく粉砕されたサンプル材料の質量をカプセルに慎重に加えます。カプセルまたは作業面の外面にサンプル材料をこぼさないようにしてください。
- 鉗子を使用して、ゆっくりとカプセルの上の3分の1を圧着し、シールするために折り畳みます。鉗子を使用して、スズを穿刺したり引き裂いたりしないように注意して、カプセルを折りたたんで球状に圧縮し続けます。
注:N含有量の少ないサンプルは、5x9 mmカプセルの容量を超えるサンプルボリュームを必要とする場合があります。より大きいカプセル(例えば、9 mm x 10 mm)はこれらの例で使用されてもよい。 - 鉗子を使用して、ラップされたカプセルを1cmの高さから清潔で暗い表面または鏡に数回落とし、漏れをチェックします。ほこりが出ない場合は、ステップ8.6で説明したのと同じ手法を用いてサンプルの重量を量る。サンプルの重量を記録します。カプセルを96ウェルプレートに入れ、井戸の配置を記録します。
- 暗い表面にほこりが現れる場合は、サンプルの重量を記録します。サンプルを2番目のスズカプセルに包み、漏れを再確認し、きれいな96ウェルプレートに入れます。
注:包まれたカプセルが96ウェルプレートに収まらない場合は、24ウェルまたは48ウェルプレートを使用してください。
- 暗い表面にほこりが現れる場合は、サンプルの重量を記録します。サンプルを2番目のスズカプセルに包み、漏れを再確認し、きれいな96ウェルプレートに入れます。
- サンプルの間に、スパチュラと鉗子の端に特別な注意を払ってエタノールと実験室のワイプで各調理器具および表面をきれいにしなさい。
- テープを使用して蓋を96ウェルプレートに固定し、デシケータに保管します。
9. 計算
- 次の式を使用して、植物または-1土壌サンプルに含まれるN(kg∙ha-1)の質量を計算します。
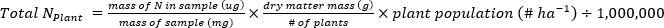
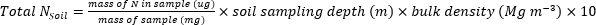
- 肥料N画分(Nf)、肥料由来N(FDN)、土壌由来N(SDN)を計算して、植物および土壌サンプル17に対して。FDNSDN
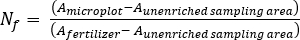
ここでAは原子%15Nの濃縮である。 -
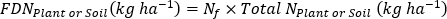
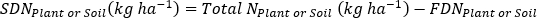
- 肥料15Nの使用効率17を計算する。

結果
本論文の結果は、ミネソタ大学サザンアウトリーチ・リサーチセンター(MN)の近くに2015年に設立されたフィールドサイトから得られたものです。このサイトは、2015年以前はトウモロコシ大豆[グリシンマックス(L.)Merr]ローテーションとして管理されていましたが、2015年と2016年の成長期にトウモロコシの回転として管理されていました。土壌はニコレット粘土ロ?...
ディスカッション
安定同位体研究は、土壌作物システムを介してFDNを追跡し、定量化するための有用なツールです。しかし、Nトレーサー研究に関連する3つの主な仮定があり、違反した場合、この方法論を使用して得られた結論を無効にする可能性があります。それらは1)トレーサーがシステム全体に均一に分布し、2)研究の下でのプロセスは同じ速度で起こり、3)Nは15N濃縮されたプールを残して
開示事項
著者らは開示するものは何もない。
謝辞
著者らは、ミネソタ・コーン・リサーチ・アンド・プロモーション・カウンシル、ヒューグ・ハリソン・フェローシップ、ミネソタ州のディスカバリー・リサーチ・アンド・イノヴィズ・エコノミー(MnDRIVE)フェローシップの支援を認めている。
資料
| Name | Company | Catalog Number | Comments |
| 20 mL scintillation vial | ANY; Fisher Scientific is one example | 0334172C | |
| 250 mL borosilicate glass bottle | QORPAK | 264047 | |
| 48-well plate | EA Consumables | E2063 | |
| 96-well plate | EA Consumables | E2079 | |
| Cloth parts bag (30x50 cm) | ANY | NA | For corn ears |
| CO2 Backpack Sprayer | ANY; Bellspray Inc is one example | Model T | |
| Coin envelop (6.4x10.8 cm) | ANY; ULINE is one example | S-6285 | For 2-mm ground plant samples |
| Corn chipper | ANY; DR Chipper Shredder is one example | SKU:CS23030BMN0 | For chipping corn biomass |
| Corn seed | ANY | NA | Hybrid appropriate to the region |
| Disposable shoe cover | ANY; Boardwalk is one example | BWK00031L | |
| Ethanol 200 Proof | ANY; Decon Laboratories Inc. is one example | 2701TP | |
| Fabric bags with drawstring (90x60 cm) | ANY | NA | For plant sample collection |
| Fertilizer Urea (46-0-0) | ANY | NA | ~0.366 atom % 15N |
| Hand rake | ANY; Fastenal Company is one example | 5098-63-107 | |
| Hand sickle | ANY; Home Depot is one example | NJP150 | For plant sample collection |
| Hand-held soil probe | ANY; AMS is one example | 401.01 | |
| Hydraulic soil probe | ANY; Giddings is one example | GSPS | |
| Hydrochloric acid, 12N | Ricca Chemical | R37800001A | |
| Jar mill | ANY; Cole-Parmer is one example | SI-04172-50 | |
| Laboratory Mill | Perten | 3610 | For grinding grain |
| Microbalance accurate to four decimal places | ANY; Mettler Toledo is one example | XPR2 | |
| N95 Particulate Filtering Facepiece Respirator | ANY, ULINE is one example | S-9632 | |
| Neoprene or butyl rubber gloves | ANY | NA | For working in HCl acid bath |
| Paper hardware bags (13.3x8.7x27.8 cm) | ANY; ULINE is one example | S-8530 | For soil samples and corn grain |
| Plant grinder | ANY; Thomas Wiley Model 4 Mill is one example | 1188Y47-TS | For grinding chipped corn biomass to 2-mm particles |
| Plastic tags | ULINE | S-5544Y-PW | For labeling fabric bags and microplot stalk bundles |
| Sodium hydroxide pellets, ACS | Spectrum Chemical | SPCM-S1295-07 | |
| Soil grinder | ANY; AGVISE stainless steel grinder with motor is one example | NA | For grinding soil to pass through a 2-mm sieve |
| Tin capsule 5x9 mm | Costech Analytical Technologies Inc. | 041061 | |
| Tin capsule 9x10 mm | Costech Analytical Technologies Inc. | 041073 | |
| Urea (46-0-0) | MilliporeSigma | 490970 | 10 atom % 15N |
参考文献
- Sharp, Z. . Principles of Stable Isotope Geochemistry. , (2017).
- Van Cleemput, O., Zapata, F., Vanlauwe, B. Guidelines on Nitrogen Management in Agricultural Systems. Guidelines on Nitrogen Management in Agricultural Systems. 29 (29), 19 (2008).
- Hauck, R. D., Meisinger, J. J., Mulvaney, R. L. Practical considerations in the use of nitrogen tracers in agricultural and environmental research. Methods of Soil Analysis: Part 2-Microbiological and Biochemical Properties. , 907-950 (1994).
- Bedard-Haughn, A., Van Groenigen, J. W., Van Kessel, C. Tracing 15N through landscapes: Potential uses and precautions. Journal of Hydrology. 272 (1-4), 175-190 (2003).
- Peterson, R. G. . Agricultural Field Experiments: Design and Analysis. , (1994).
- Follett, R. F. Innovative 15N microplot research techniques to study nitrogen use efficiency under different ecosystems. Communications in Soil Science and Plant Analysis. 32 (7/8), 951-979 (2001).
- Russelle, M. P., Deibert, E. J., Hauck, R. D., Stevanovic, M., Olson, R. A. Effects of water and nitrogen management on yield and 15N-depleted fertilizer use efficiency of irrigated corn. Soil Science Society of America Journal. 45 (3), 553-558 (1981).
- Schindler, F. V., Knighton, R. E. Fate of Fertilizer Nitrogen Applied to Corn as Estimated by the Isotopic and Difference Methods. Soil Science Society of America Journal. 63, 1734 (1999).
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study. Agronomy Journal. 97 (4), 1037 (2005).
- Recous, S., Fresneau, C., Faurie, G., Mary, B. The fate of labelled 15N urea and ammonium nitrate applied to a winter wheat crop. Plant and Soil. 112 (2), 205-214 (1988).
- Abendroth, L. J., Elmore, R. W., Boyer, M. J., Marlay, S. K. . Corn Growth and Development. , (2011).
- Gomez, K. A., Gomez, A. A. . Statistical Procedures for Agricultural Research. , (1984).
- Khan, S. A., Mulvaney, R. L., Brooks, P. D. Diffusion Methods for Automated Nitrogen-15 Analysis using Acidified Disks. Soil Science Society of America Journal. 62 (2), 406 (1998).
- Horneck, D. A., Miller, R. O. Determination of Total Nitrogen in Plant Tissue. Handbook of Reference Methods for Plant Analysis. , 75-84 (1998).
- . Carbon (13C) and Nitrogen (15N) Analysis of Solids by EA-IRMS Available from: https://stableisotopefacility.ucdavis.edu/13cand15n.html (2019)
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study: II. Nitrogen Uptake Efficiency. Agronomy Journal. 97 (4), 1046 (2005).
- . Fertilizing Corn in Minnesota Available from: https://extension.umn.edu/crop-specific-needs/fertilizing-corn-minnesota (2018)
- Blake, G. R., Hartge, K. H. Bulk Density. Methods of Soil Analysis: Part 1 Physical and Mineralogical Methods. , 363-375 (1986).
- Jokela, W. E., Randall, G. W. Fate of Fertilizer Nitrogen as Affected by Time and Rate of Application on Corn. Soil Science Society of America Journal. 61 (6), 1695 (2010).
- Hart, S. C., Stark, J. M., Davidson, E. A., Firestone, M. K. Nitrogen Mineralization, Immobilization, and Nitrification. Methods of Soil Analysis, Part 2. Microbiological and Biochemical Properties. (5), 985-1018 (1994).
- Olson, R. V. Fate of tagged nitrogen fertilizer applied to irrigated corn. Soil Science Society of America Journal. 44 (3), 514-517 (1980).
- Follett, R. F., Porter, L. K., Halvorson, A. D. Border Effects on Nitrogen-15 Fertilized Winter Wheat Microplots Grown in the Great Plains. Agronomy Journal. 83 (3), 608-612 (1991).
- Balabane, M., Balesdent, J. Input of fertilizer-derived labelled n to soil organic matter during a growing season of maize in the field. Soil Biology and Biochemistry. 24 (2), 89-96 (1992).
- Recous, S., Machet, J. M., Mary, B. The partitioning of fertilizer-N between soil and crop: Comparison of ammonium and nitrate applications. Plant and Soil. 144 (1), 101-111 (1992).
- Bigeriego, M., Hauck, R. D., Olson, R. A. Uptake, Translocation and Utilization of 15N-Depleted Fertilizer in Irrigated Corn. Soil Science Society of America Journal. 43 (3), 528 (1979).
- Glendining, M. J., Poulton, P. R., Powlson, D. S., Jenkinson, D. S. Fate of15N-labelled fertilizer applied to spring barley grown on soils of contrasting nutrient status. Plant and Soil. 195 (1), 83-98 (1997).
- Khanif, Y. M., Cleemput, O., Baert, L. Field study of the fate of labelled fertilizer nitrate applied to barley and maize in sandy soils. Fertilizer Research. 5 (3), 289-294 (1984).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved