JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
15개의질소 분석을 위한 마이크로플롯 설계 및 식물 및 토양 샘플 준비
요약
15N 추적기 연구를 위한 마이크로플롯 설계는 여러 계절식물 및 토양 샘플링 이벤트를 수용하기 위해 설명된다. 15N분석을 위해 연삭 및 계량 프로토콜을 포함한 토양 및 식물 샘플 수집 및 처리 절차가 제시됩니다.
초록
많은 질소 비료 연구는 곡물 수율 또는 누적 N 손실과 같은 시즌 종료 측정에 대한 치료의 전반적인 효과를 평가합니다. 토양 작물 시스템을 통해 비료 유래 N(FDN)의 운명을 따르고 정량화하기 위해서는 안정적인 동위원소 접근법이 필요하다. 이 논문의 목적은 두 번의 재배 시즌 동안 여러 토양 및 식물 샘플링 이벤트에 대한 비밀한 15N 농축 마이크로플롯을 활용한 소규모 플롯 연구 설계를 설명하고 총 15N분석을 위한 샘플 수집, 처리 및 처리 프로토콜을 제공하는 것입니다. 이 방법은 미네소타 중남부에서 옥수수에 심은 복제된 연구를 사용하여입증되었습니다(Zea mays L.). 각 처리는 1끝에 내장된 마이크로플롯(2.4m x 3.8m)으로 6개의 옥수수 행(76cm 행 간격) 15.2m로 구성되었다. 비료 급 우레아는 심기 시 135kgN∙ha-1로 적용되었으며, 마이크로플롯은 재배 기간 동안 5원자% 15N토양 및 식물 샘플로 농축된 우레아를 여러 번 수차례 취했으며, 별도의 도구를 사용하여 교차 오염을 최소화하고 모든 시술 중에 풍부하지 않고 농축된 시료를 물리적으로 분리하여 교차 오염을 최소화했습니다. 토양 및 식물 샘플은 건조되어 2mm 화면을 통과한 다음 롤러 항아리 밀을 사용하여 밀가루와 같은 일관성으로 접지했습니다. Tracer 연구는 추가 계획, 샘플 처리 시간 및 수동 노동이 필요하며 기존 N 연구보다 15N 농축 재료 및 샘플 분석에 대해 더 높은 비용이 발생합니다. 그러나, 질량 균형 접근 방식을 사용하여, 여러 시즌 샘플링 이벤트를 가진 추적자 연구는 연구원이 토양 작물 시스템을 통해 FDN 분포를 추정하고 시스템에서 FDN에 대한 회계되지 않은 추정을 할 수 있습니다.
서문
비료 질소 (N) 사용은 증가하는 글로벌 인구의 식품, 섬유, 사료 및 연료 요구를 충족하기 위해 농업에 필수적이지만 농업 분야의 N 손실은 환경 품질에 부정적인 영향을 미칠 수 있습니다. N은 토양 작물 시스템에서 많은 변화를 겪고 있기 때문에 N 사이클링, 작물 활용 및 비료 N의 전반적인 운명에 대한 더 나은 이해가 N 사용 효율성을 촉진하고 환경 손실을 최소화하는 관리 관행을 개선하는 데 필요합니다. 전통적인 N 비료 연구는 주로 작물 수확량, N 속도에 비해 작물 N 섭취량(명백한 비료 사용 효율) 및 잔류 토양 N과 같은 시즌 종료 측정에 대한 치료의 효과에 중점을 둡니다. 이러한 연구는 전체 시스템 N 입력, 출력 및 효율성을 정량화하지만 비료 소스 또는 토양에서 파생된 토양 작물 시스템에서 N을 식별하거나 정량화할 수 없습니다. 안정적인 동위원소를 사용하는 다른 접근법은 토양 작물 시스템에서 비료 유래 N(FDN)의 운명을 추적하고 정량화하는 데 사용되어야 한다.
질소는 2개의 안정동위원소, 14N 및 15N을 가지고 있으며, 이는 자연에서 비교적 일정한 비율로 발생하며 14N/15 N151(0.366 원자% 15N 또는 3600 ppm 15N1 2,,3)에대해 비교적 일정한 비율로 발생합니다. 15N농축 비료를 첨가하여 토양 시스템의 총 15N함량을 증가시킨다. 15N 농축 비료가 농축되지 않은 토양 N과 혼합됨에 따라, 14N/15N 비의 측정된 변화는 연구원이 토양 프로파일과 작물3,,4로FDN을 추적할 수 있게 한다. 질량 저울은 시스템의 총 15N트레이서 양과 각 부품2를측정하여 계산할 수 있다. 15N농축 비료는 기존 비료보다 훨씬 비싸기 때문에 15N농축 마이크로플롯이 치료 플롯 내에 내장되어 있는 경우가 많습니다. 이 방법의 목적은 옥수수(Zea mays L.)에 대한 여러 계절 토양 및 식물 샘플링 이벤트에 대한 마이크로 플롯을 활용하는 작은 플롯 연구 설계를 설명하고 총 15N 분석을위한 식물 및 토양 샘플을 준비하기위한 프로토콜을 제시하는 것입니다. 이러한 결과는 N 비료 사용 효율을 추정하고 벌크 토양 및 작물에서 FDN에 대한 부분 N 예산을 생성하는 데 사용할 수 있습니다.
Access restricted. Please log in or start a trial to view this content.
프로토콜
1. 필드 사이트 설명
참고: 15N추적자 필드 시험을 수행할 때 선택한 사이트는 토양, 지형 및 물리적 특징5로인한 변동을 최소화해야 합니다. 교차 오염은 경사, 바람 또는 물 전좌, 또는 틸지로 인한 측면 토양 이동에 따라 발생할 수 있으며, N 토양의 수직 분포는 지하 수분 흐름 및 타일 배수6에의해 영향을 받을 수 있다.
- 과거 관리(예: 이전 작물 및 경도), 위도 및 경도, 토양 물리적 및 화학적 특성(예: 토양 텍스처 분석, 초기 불임 조건, pH 및 토양 벌크 밀도)을 포함한 실험 현장 부위를 설명합니다.
- 연구 사이트와 필드 코너에 대한 GPS 좌표를 기록합니다.
- 해충 및 질병 관리(제초제, 살충제 또는 살균제 사용), 토양 불임 관리(비율, 출처, 배치 및 적용 타이밍 포함), 경유, 관개 이벤트 및 양 및 잔류물 관리를 포함한 성장하는 계절 관리를 설명합니다.
- 작물 성장과 미생물 매개 N 변환은 토양 수분, 토양 온도 및 공기 온도의 영향을 받아 토양 샘플링 깊이를 반영하는 여러 깊이에서 매일 높고 낮은 온도, 일일 강수량 및 토양 수분 및 온도를 포함한 기후 정보를 기록합니다.
2. 플롯 디자인
- 76cm 간격에 6개의 옥수수 행(~86,000식물 ha-1)을심고 최종 플롯 치수는 15.2mx 4.6m입니다.
- 표본오차는 1.5m(0-1.5m, 13.7~15.2m) 및 추가 국경면적 1.5m(9.8~11.3m)를 표본오차 와 수확지역(그림1)의각 끝에서 설정한다.
- 2행과 3행을 제철 식물 및 토양 샘플링 영역(1.5-9.8m)으로 지정하고 4열과 5열을 옥수수 곡물 수율에 대한 수확지역(1.5~9.8m)으로 지정한다.
- 폭 치수를 중심으로 2.4m x 3.8m의 치수로 마이크로플롯 영역(11.3~13.7m)을 설정합니다. 이 지역에서 15N농축 식물 및 토양 샘플을 모두 수집하여 길이 및 너비 치수에 0.38m의 비샘플링 테두리를 남기고 에지 효과를 최소화합니다(그림2).
- 다른 색깔의 깃발처리 플롯 및 마이크로플롯 모서리를 묘사합니다.
3. 토양 및 식물 샘플 예방 조치
- 농축되지 않고 농축된 재료에 전용 장비 및 가공 영역을 사용하십시오. 농축 된 재료에 의한 농축되지 않은 재료 (비료, 토양 또는 식물)의 오염은 결과에 크게 영향을 미칠 수 있습니다.
- 15N농축 토양 및 식물 시료를 가장 낮은 15N의농축 순서로 수집하고 처리하여 교차 오염을 최소화합니다. 작업 표면, 장갑, 기구 및 기계류가 각 샘플 간에 철저히 세척되어 샘플 이월로 인한 교차 오염을 최소화하십시오.
- 마이크로플롯의 발 트래픽을 최소화하여 농축되지 않은 샘플링 영역의 오염을 방지합니다. 마이크로플롯에 접근할 때 보호 신발 덮개를 착용하고 마이크로플롯 영역을 빠져나갈 때 제거합니다.
4. 15N 농축 비료 준비 및 응용 프로그램
- 비료 15N 사용 효율 (F15NUE) 연구에 대한 Ref. 2에 의해 제시 된 지침에 따라, 10 원자 % 15N 농축 우레아를 희석 5 원자 % 15N 농축 우레아와 용해 2 L의 열화 된 풍부함을 보장하기 위해 우레아 비료의 균일 한 농축을 보장합니다.
참고: 15N 농축 비료의 필요한 농도는 농업 연구의 목표에 따라 달라집니다. 주식 15N 농축 비료의 농도가 연구원의 요구 사항을 초과하는 경우, 주식 비료 농도는 다음과 같은 공식3을사용하여 유사한 종래의 비료로 희석 될 수 있습니다.
X2 = [(C1/C2) - 1] × X1 C1C2
X2는 종래의 비료의 질량이고, X1은 트레이서 비료의 질량이며, X1은 동위원소 농도[원자%+과잉으로 표현됨(원자%++0.3663 atom%]로 추정되는 천연 배경 농도로, C2는 최종 혼합물의 이소성 농도이다. 예를 들어, 10 원자 %농축 우레아의 100g을 감안할 때, 종래의 비농축 비료 92.7 g는 5 원자 %의 최종 동위원소 농도에 필요합니다.
X2 = {[(10-0.3663)/5] - 1} × 100. - 15N 농도용 용액을 분석하여 농축을 확인합니다. 저자는 UC 데이비스 안정 동위원소 시설에서 제공하는 분석 서비스를 활용.
참고: 비료 첨가에 대한 토양 식물-미생물 정권의 반응은 비료의 물리적 형태에 의해 영향을 받을 수 있다. 연구의 목표에 따라, 우레아 용액은 액정으로 적용되거나 결정개혁을 위해 탈수될 수 있다. 결정은 10,000 psi에서 카버 프레스를 사용하여 케이크로 압축 될 수 있으며, 케이크를 분쇄하고 입자를 원하는 크기 3로 선별할 수있습니다. - 보정된 배낭CO2 분무기(도3A)를이용하여Figure 3 15N농축 우레아 용액을 마이크로플롯에 균일하게 적용한다. 여러 N 속도 또는 농축 수준을 사용하는 경우 각 농축 수준에 지정된CO2 분무기를 사용하거나 단일 분무기를 사용하고 가장 낮은 농축에서 가장 높은 농축에 대한 솔루션을 적용하여 처리 교차 오염을 최소화하십시오.
- 발광 손실 가능성을 최소화하기 위해 24시간 이내에 광 경유, 손 갈퀴 또는 최소 0.6cm의 관개를 함유한 우레아 함유 비료를 통합한다.
- 두 번째 성장 기 동안 마이크로 플롯에 추가 15N 농축 우레아 비료가 적용되지 않습니다. 질소로 인한 옥수수 성장에 차동 반응을 피하기 위해 기존의 농축되지 않은 우레아를 전체 치료에 적용하십시오.
5. 필드 샘플 처리 : 지상 옥수수 바이오 매스
- 각 샘플링 단계에서, 샘플링 영역 내에서 6-지상 옥수수 식물 복합 샘플을 수집(15N 농축) 및 15N 농축 마이크로 플롯에서 6 지상 옥수수 식물 복합 샘플. 식물 성장 역학을 크게 변경하지 않도록 적어도 두 개의 식물은 각 샘플링 된 식물을 분리해야합니다. 저자는 V8 및 R1 옥수수 생리학적 발달단계(11)와 생리성성숙도(그림 2)에서식물 샘플을 수집하였다.
- 단계 3.1 및 3.2에 기술 된 원리에 따라, V8 및 R1 지상 바이오 매스 (≤5cm x ≤5 cm); 야드 폐기물 치퍼는 만족스러운 옵션입니다. 다진 바이오매스를 라벨이 붙은 직물이나 종이 봉투에 넣고 일정한 질량이 될 때까지 60°C의 강제 공기 오븐에서 건조시십시오. 바이오매스 건성중량(그림3B)을기록합니다.
- 생리학적으로 성숙한 옥수수 식물을 스테버 (잎, 껍질 및 줄기를 포함한 모든 식물 조직), 곡물 및 코브 분획으로 분할하십시오. 일정한 질량까지 60 °C에서 강제 공기 오븐에서 잘라 건조. 바이오매스 건식 중량을 기록합니다.
- 마이크로 플롯 내에서, 토양 표면에 있는 모든 옥수수 줄기를 잘라 묶고, 플롯에 따라 라벨을 붙이고, 필드에서 제거합니다(그림3C). 마이크로플롯 코너 플래그를 조정하여 토양 표면과 거의 플러시되어 수확 또는 수확 후 수확 후 결합하여 제거 위험을 최소화합니다.
- 수확 지역에서 곡물을 수확하고 15.5 %의 수분 함량12에서수율을 보고합니다. 플롯결합으로 남은 연구 영역을 수확하십시오.
- 마이크로플롯 지역에서 농축되지 않은 바이오매스를 긁어내라. 올바른플롯(그림3D)에지상 바이오매스 위에 마이크로플롯을 잘라서 다시 적용한다.
- 토양 및 옥수수 잔류물 수송을 최소화하기 위해 주의를 기울여 토양 표면에 잔류물을 통합하여 마이크로플롯 영역 안팎으로 이동합니다. 경유로 인해 제거된 마이크로플롯 모서리 플래그를 교체합니다.
- 1년차 옥수수와 같은 줄에 2년째 옥수수를 심는다.
- 단계 5.3에 설명된 바와 같이 1학년 옥수수 샘플과 같은 생리적 성숙및 공정에서만 2년째 옥수수 바이오매스를 수집합니다. 마이크로플롯 영역(1.52m~0.76m)의 중심에서 마이크로플롯 샘플을 수집하여 경유(그림2)에따른 잠재적신호 희석을 피한다. 수확 지역에서 곡물을 수확하고 15.5 %의 수분 함량으로 수율을보고합니다.
- 3.1 및 3.2 단계의 원칙에 따라 2mm 체를 통과하기 위해 말린 식물 재료 100 ~ 200 g을 철저히 혼합하고 갈아냅니다. 접지 재료를 철저히 혼합하고 추가 처리를 위해 라벨이 붙은 동전 봉투에 하위 샘플을 저장합니다.
참고: 토마스 와일리 공장은 식물 조직 연삭에 만족하는 옵션이며 퍼튼 실험실 밀 3610은 곡물을 연마하는 데 만족스러운 옵션입니다.
주의: 식물 샘플을 연마하는 사람들은 귀 보호를 착용하고 N95 미립자 필터링 페이스피스 호흡보호기를 승인한 국립 산업 안전 보건 연구소를 착용하여 먼지를 흡입하지 않도록 보호해야 합니다.
6. 필드 샘플 처리 : 토양
- 15N농축 비료 응용 프로그램, V8, R1 및 수확 후 8일 후에 1학년 토양 샘플을 수집합니다. 2년차 토양 샘플을 사전 식물 및 수확 후에서 수집합니다. 물류 샘플링 제약으로 인해 저자는 0-15-의 계절 토양 샘플을 수집했습니다. 15-30-60cm 깊이, 수확 후 토양 샘플0-15-15- 30-30- 60-60-, 60-90cm 깊이, 2년제 전식물 토양 샘플0~30-30~60-60-10-10cm
참고: 토양 프로브가 단일 코어로서 가장 깊은 깊이까지 토양 코어를 수집할 수 없는 경우, 상심1cm의 토양을 폐기하는 상부 깊이와 동일한 시추공에서 심층 코어를 수집하여 토양의 상부 깊이에서 떨어지는 토양으로부터 오염을 방지합니다.- 손 프로브를 사용하여 V8 및 R1의 농축되지 않은 샘플링 영역에서 4코어(직경 1.8cm) 복합 토양 샘플을 수집합니다. 옥수수 행에 코어 1개, 옥수수 행 사이에 3개의 코어를 수집합니다.
- 유압 프로브를 사용하여 사전 식물 및 후 수확에서 농축되지 않은 샘플링 영역에서 2 코어 (직경 5cm 직경) 복합 토양 샘플을 수집합니다.
- 15N 농축 비료 적용, V8 및 R1 후 8일 후 마이크로플롯 영역에서 15코어(직경1.8cm) 복합 토양 샘플을 수거하여 손 프로브를 이용하여 수집한다. 옥수수 행에 3 ~4 개의 코어와 옥수수 행 사이에 11 ~ 12 코어를 수집합니다.
참고 : 토양은 매우 이질적입니다. 농축 된 마이크로 플롯 내에서 수집 된 코어의 큰 수는 토양 N13의진정한 15N 농축의 더 나은 추정을 제공한다. - 유압 프로브를 사용하여 사전 식물 및 수확 후 마이크로플롯 영역에서 3 코어 (직경 5cm 직경) 복합 토양 샘플을 수집합니다.
- 각 복합 토양 샘플을 양동이에 균질화하고 미리 표지된 종이 봉투에 넣습니다.
- 일정한 질량까지 강제 공기 오븐에서 35 °C에서 건조 토양 샘플. 각 샘플을 갈아서 2mm 체를 통과합니다. 기계토양 분쇄기는 각 시료 간에 철저히 세척할 수 있다면 만족합니다.
참고: 토양 샘플은 얇은 층의 트레이에 샘플을 퍼뜨리면 공기 건조될 수 있습니다. 트레이는 N 외부 소스에 의해 오염이없는 지역에 있어야합니다. 농축되지 않고 농축된 시료는 교차 오염을 방지하기 위해 물리적으로 분리되어야 합니다.
주의: 토양 샘플을 분쇄하는 사람들은 귀 보호를 착용하고 N95 미립자 필터링 페이스피스 호흡보호기를 승인한 국립 산업 안전 보건 연구소를 착용하여 먼지를 흡입하지 않도록 보호해야 합니다.
7. 실험실 샘플 처리 : 분쇄 토양 및 식물 샘플
- 60 °C에서 오븐에서 하룻밤 동안 건조 분쇄 식물 샘플 (2mm).
- 3단계에서 설명된 원리에 따라, 말린 식물 샘플이나 토양 물질을 밀가루와 같은 미세한 일관성으로 갈아줍니다. 롤러 항아리 공장은 만족스러운 옵션입니다.
참고 : 저자의 항아리 공장은 한 번에 54 롤러 항아리를 처리 할 수있는 맞춤형 컨베이어 벨트 시스템입니다.- 각 롤러 항아리(스크류 상단 뚜껑이 있는 250mL 보로실리케이트 유리 항아리)를 10~20g의 지상 식물 또는 토양 샘플과 7개의 스테인레스 스틸 봉(길이 8.5cm, 직경 0.7cm)으로 채웁니다.
- 롤러 항아리를 6-24 h의 경우 0.4 x g로 굴리거나 샘플이 밀가루와 같은 미세한 일관성을 가질 때까지 굴려줍니다.
- 미세하게 접지 된 재료를 20 mL 의 깨끗한 점성 유리병으로 옮습니다.
- 각 샘플 사이에, 세척 롤러 항아리, 스테인레스 스틸 막대, 비누와 물로 뚜껑을 씻어 어떤 잔류물을 제거합니다.
- 5% HCl 산성 목욕에 롤러 항아리와 뚜껑을 담그고 (36-38% 농축 재고에서 제조)하룻밤 14.
주의: 염산은 부식성입니다. 심한 피부 화상, 눈 손상을 일으킬 수 있으며 흡입하면 유해합니다. 항상 보호 복, 장갑, 눈과 얼굴 보호 기능을 착용하십시오. 물로 철저하게 조직에 연락 플러시. 산을 운반할 때항상 보조 용기를 사용하십시오. 이 반응은 외래이기 때문에 항상 물에 산을 추가하십시오. 베이킹 소다로 산성 유출을 즉시 중화시합니다.
참고: 208L 플라스틱 용기에 5% HCl의 100L로 대산목욕을 제조할 수 있다. 연기 후드에 몇 가지 작은 볼륨을 준비 한 다음 플라스틱 용기에 솔루션을 전송합니다. 3개월마다 솔루션을 교체합니다. - 산화 된 물과 공기 건조와 트리플 린스 롤러 항아리와 뚜껑.
- 0.05 M NaOH 욕조에 스테인레스 스틸 봉을 담그고(나오 2g을 탈수 1L에 용해하여 제조)14. 매일 새로운 0.05 M NaOH 목욕을 준비합니다.
주의: 수산화 나트륨은 심한 피부 화상과 눈 손상을 일으킬 수 있습니다. 항상 보호복과 눈 보호 기능을 착용하십시오. 오염된 옷을 즉시 제거하고 몇 분 동안 물로 피부나 눈을 헹구습니다. - 뜨거운 수돗물 아래에서 5분간 막대를 헹구는 다. 데산과 삼중은 막대를 탈온된 물로 헹구는 다. 종이 타월 이늘어진 트레이에 막대가 건조하도록 합니다.
- 5% HCl 산성 목욕에 롤러 항아리와 뚜껑을 담그고 (36-38% 농축 재고에서 제조)하룻밤 14.
8. 총 N 및 15N 분석을 위한 지상 식물 및 토양 시료의 계량
- 총 N 함량(예: 연소 분석15)에대한 몇 가지 대표적인 식물 및 토양 샘플을 분석합니다. 분석기 사양에 따라 15N 분석에 적합한 N 함량을 제공하는 샘플 질량을 계산합니다.
참고: 저자는 UC 데이비스 안정 동위원소 시설에서 제공하는 분석 서비스를 활용했습니다. 농축 된 샘플 가중치는 N의 20 μg에 최적화되었으며 최대 100 μg의 N. - 가장 낮은 에서 가장 높은 예상 15N 농축에 같은 샘플을 구성합니다. 각 실행에서 8~12번째 샘플을 복제하여 샘플 정밀도를 확인합니다. 실행16당하나 이상의 검사 샘플을 포함합니다.
- 깨끗한 96웰 플레이트에 라벨을 부착하고 뚜껑에 개별 웰 증발 링이 장착되어 있습니다. 깨끗한 인덱스 카드를 뚜껑 바로 안쪽에 맞게 잘라 운송 중 우물 간의 샘플 이동을 방지합니다.
- 니트릴 장갑을 착용하고 마이크로 스케일, 작업 표면, 주걱 및 집게를 실험실 와이프와 에탄올로 청소하십시오. 청소된 기구를 실험실 벤치에 김스와이프에 놓습니다.
참고: 농축되지 않고 농축된 시료는 교차 오염을 방지하기 위해 별도의 저울과 기구를 사용하여 처리해야 합니다. - 집게를 사용하여 5mm x 8mm의 스테인리스 스틸 블록과 같은 깨끗한 작업 표면에 미리 형성된 5mm x 9mm 주석 캡슐을 배치합니다. 캡슐을 웰에 부드럽게 탭하여 원통형 모양을 개혁하고 필요한 경우 캡슐 바닥을 평평하게 만듭니다.
참고: 샘플 질량은 매우 작기 때문에 샘플 오염의 위험이 높습니다. 장갑으로 캡슐을 만지지 마십시오. 그것은 집게, 깨끗한 작업 표면, 스케일 계량 팬, 또는 96 웰 플레이트 이외의 표면에 터치하는 경우 캡슐을 폐기합니다. - 집게를 사용하여 캡슐의 상단 1mm를 부드럽게 플레어하여 조작을 용이하게 합니다. 캡슐의 무게를 타르팅 할 때 스케일 손상을 방지하기 위해 마이크로 스케일 계량 팬 위에 캡슐을 1 ~ 2mm 로 가져 갑니다. 캡슐을 타레. 집게를 사용하여 캡슐을 깨끗한 작업 표면으로 되돌려 보입니다.
- 주걱을 사용하여 캡슐에 미세하게 접지 된 샘플 재료의 필요한 질량을 조심스럽게 추가하십시오. 캡슐또는 작업 표면의 외부 표면에 샘플 물질을 흘리지 마십시오.
- 집게를 사용하여 캡슐의 상단 3분의 1을 천천히 압착하고 접어 서 밀봉합니다. 집게를 사용하여 캡슐을 계속 접고 압축하여 주석을 구멍을 뚫거나 찢지 않도록 주의하십시오.
참고: N 함량이 낮은 샘플에는 5x9 mm 캡슐의 용량을 초과하는 샘플 볼륨이 필요할 수 있습니다. 더 큰 캡슐(예: 9mm x 10mm)은 이러한 경우에 사용될 수 있다. - 집게를 사용하여 포장 된 캡슐을 1cm 높이에서 깨끗하고 어두운 표면 또는 거울에 여러 번 떨어 뜨려 누출을 확인하십시오. 먼지가 나타나지 않으면 8.6 단계에서 설명된 것과 동일한 기술을 사용하여 시료의 무게를 측정합니다. 샘플 가중치를 기록합니다. 캡슐을 96웰 플레이트에 넣고 우물 배치를 기록합니다.
- 어두운 표면에 먼지가 나타나면 샘플 무게를 기록합니다. 샘플을 두 번째 주석 캡슐에 싸서 누출을 다시 확인하고 깨끗한 96웰 플레이트에 놓습니다.
참고: 래핑된 캡슐이 너무 커서 96웰 플레이트에 들어갈 수 없다면 24웰 또는 48웰 플레이트를 사용하십시오.
- 어두운 표면에 먼지가 나타나면 샘플 무게를 기록합니다. 샘플을 두 번째 주석 캡슐에 싸서 누출을 다시 확인하고 깨끗한 96웰 플레이트에 놓습니다.
- 샘플 사이에 각 기구와 표면에 에탄올과 실험실 물티슈로 청소하여 주걱과 집게 가장자리에 특별한 주의를 기울입니다.
- 테이프를 사용하여 96웰 플레이트에 뚜껑을 고정하고 건조기에 보관하십시오.
9. 계산
- 다음 방정식을 사용하여 식물-1또는 토양 샘플에 포함된 N(kg∙ha-1)의 질량을 계산합니다.
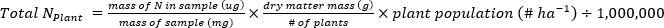
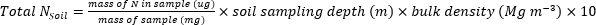
- 식물 및 토양샘플(17)에대해 비료 N 분획(Nf), 비료 유래N(FDN)및 토양 유래N(SDN)을계산한다.f
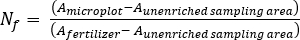
여기서 A는 원자 % 15N 농축입니다. -
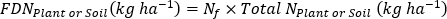
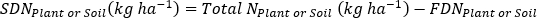
- 비료 를 계산 15N 사용 효율(17)

Access restricted. Please log in or start a trial to view this content.
결과
이 논문에 제시된 결과는 2015년 미네소타 대학교 서던 아웃리치 및 연구 센터와 MN 근처에 위치한 현장 현장에서 나온 것입니다. 이 사이트는 2015년 이전에 옥수수대두[글리신 맥스(L.) Merr] 회전으로 관리되었지만 2015년과 2016년 재배 시즌 동안 옥수수 회전으로 관리되었습니다. 토양은 니콜렛 점토 로암 (미세 혐오, 혼합, 초활성, mesic Aquic Hapludolls)-웹스터 클레이 로?...
Access restricted. Please log in or start a trial to view this content.
토론
안정적인 동위원소 연구는 토양 작물 시스템을 통해 FDN을 추적하고 정량화하는 데 유용한 도구입니다. 그러나 N 추적기 연구와 관련된 세 가지 주요 가정이 위반되면이 방법론을 사용하여 얻은 결론을 무효화 할 수 있습니다. 그(것)들은 1) 트레이서가 시스템 전체에 균일하게 분포되고, 2) 연구 하에 프로세스는 동일한 비율로 발생하고, 3) N은 15N 농축 풀을 떠나는 것은3을
Access restricted. Please log in or start a trial to view this content.
공개
저자는 공개 할 것이 없습니다.
감사의 말
저자는 미네소타 옥수수 연구 및 진흥 위원회, 휴그 해리슨 펠로우십, 미네소타의 발견, 연구 및 불복 경제 (MnDRIVE) 펠로우십의 지원을 인정합니다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 20 mL scintillation vial | ANY; Fisher Scientific is one example | 0334172C | |
| 250 mL borosilicate glass bottle | QORPAK | 264047 | |
| 48-well plate | EA Consumables | E2063 | |
| 96-well plate | EA Consumables | E2079 | |
| Cloth parts bag (30x50 cm) | ANY | NA | For corn ears |
| CO2 Backpack Sprayer | ANY; Bellspray Inc is one example | Model T | |
| Coin envelop (6.4x10.8 cm) | ANY; ULINE is one example | S-6285 | For 2-mm ground plant samples |
| Corn chipper | ANY; DR Chipper Shredder is one example | SKU:CS23030BMN0 | For chipping corn biomass |
| Corn seed | ANY | NA | Hybrid appropriate to the region |
| Disposable shoe cover | ANY; Boardwalk is one example | BWK00031L | |
| Ethanol 200 Proof | ANY; Decon Laboratories Inc. is one example | 2701TP | |
| Fabric bags with drawstring (90x60 cm) | ANY | NA | For plant sample collection |
| Fertilizer Urea (46-0-0) | ANY | NA | ~0.366 atom % 15N |
| Hand rake | ANY; Fastenal Company is one example | 5098-63-107 | |
| Hand sickle | ANY; Home Depot is one example | NJP150 | For plant sample collection |
| Hand-held soil probe | ANY; AMS is one example | 401.01 | |
| Hydraulic soil probe | ANY; Giddings is one example | GSPS | |
| Hydrochloric acid, 12N | Ricca Chemical | R37800001A | |
| Jar mill | ANY; Cole-Parmer is one example | SI-04172-50 | |
| Laboratory Mill | Perten | 3610 | For grinding grain |
| Microbalance accurate to four decimal places | ANY; Mettler Toledo is one example | XPR2 | |
| N95 Particulate Filtering Facepiece Respirator | ANY, ULINE is one example | S-9632 | |
| Neoprene or butyl rubber gloves | ANY | NA | For working in HCl acid bath |
| Paper hardware bags (13.3x8.7x27.8 cm) | ANY; ULINE is one example | S-8530 | For soil samples and corn grain |
| Plant grinder | ANY; Thomas Wiley Model 4 Mill is one example | 1188Y47-TS | For grinding chipped corn biomass to 2-mm particles |
| Plastic tags | ULINE | S-5544Y-PW | For labeling fabric bags and microplot stalk bundles |
| Sodium hydroxide pellets, ACS | Spectrum Chemical | SPCM-S1295-07 | |
| Soil grinder | ANY; AGVISE stainless steel grinder with motor is one example | NA | For grinding soil to pass through a 2-mm sieve |
| Tin capsule 5x9 mm | Costech Analytical Technologies Inc. | 041061 | |
| Tin capsule 9x10 mm | Costech Analytical Technologies Inc. | 041073 | |
| Urea (46-0-0) | MilliporeSigma | 490970 | 10 atom % 15N |
참고문헌
- Sharp, Z. Principles of Stable Isotope Geochemistry. , 2nd Edition, (2017).
- Van Cleemput, O., Zapata, F., Vanlauwe, B. Guidelines on Nitrogen Management in Agricultural Systems. Guidelines on Nitrogen Management in Agricultural Systems. 29 (29), 19(2008).
- Hauck, R. D., Meisinger, J. J., Mulvaney, R. L. Practical considerations in the use of nitrogen tracers in agricultural and environmental research. Methods of Soil Analysis: Part 2-Microbiological and Biochemical Properties. , 907-950 (1994).
- Bedard-Haughn, A., Van Groenigen, J. W., Van Kessel, C. Tracing 15N through landscapes: Potential uses and precautions. Journal of Hydrology. 272 (1-4), 175-190 (2003).
- Peterson, R. G. Agricultural Field Experiments: Design and Analysis. , Marcel Dekker, Inc. New York. (1994).
- Follett, R. F. Innovative 15N microplot research techniques to study nitrogen use efficiency under different ecosystems. Communications in Soil Science and Plant Analysis. 32 (7/8), 951-979 (2001).
- Russelle, M. P., Deibert, E. J., Hauck, R. D., Stevanovic, M., Olson, R. A. Effects of water and nitrogen management on yield and 15N-depleted fertilizer use efficiency of irrigated corn. Soil Science Society of America Journal. 45 (3), 553-558 (1981).
- Schindler, F. V., Knighton, R. E. Fate of Fertilizer Nitrogen Applied to Corn as Estimated by the Isotopic and Difference Methods. Soil Science Society of America Journal. 63, 1734(1999).
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study. Agronomy Journal. 97 (4), 1037(2005).
- Recous, S., Fresneau, C., Faurie, G., Mary, B. The fate of labelled 15N urea and ammonium nitrate applied to a winter wheat crop. Plant and Soil. 112 (2), 205-214 (1988).
- Abendroth, L. J., Elmore, R. W., Boyer, M. J., Marlay, S. K. Corn Growth and Development. , (2011).
- Lauer, J. G. Methods for calculating corn yield. , http://corn.agronomy.wisc.edu/AA/pdfs/A033.pdf (2002).
- Gomez, K. A., Gomez, A. A. Statistical Procedures for Agricultural Research. , 2nd Edition, John Wiley and Sons. (1984).
- Khan, S. A., Mulvaney, R. L., Brooks, P. D. Diffusion Methods for Automated Nitrogen-15 Analysis using Acidified Disks. Soil Science Society of America Journal. 62 (2), 406(1998).
- Horneck, D. A., Miller, R. O. Determination of Total Nitrogen in Plant Tissue. Handbook of Reference Methods for Plant Analysis. , 75-84 (1998).
- UC Davis Stable Isotope Facility. Carbon (13C) and Nitrogen (15N) Analysis of Solids by EA-IRMS. , https://stableisotopefacility.ucdavis.edu/13cand15n.html (2019).
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study: II. Nitrogen Uptake Efficiency. Agronomy Journal. 97 (4), 1046(2005).
- Kaiser, D. E., Fernandez, F. G., Coulter, J. A. Fertilizing Corn in Minnesota. , University of Minnesota Extension. https://extension.umn.edu/crop-specific-needs/fertilizing-corn-minnesota (2018).
- Blake, G. R., Hartge, K. H. Bulk Density. Methods of Soil Analysis: Part 1 Physical and Mineralogical Methods. , 363-375 (1986).
- Jokela, W. E., Randall, G. W. Fate of Fertilizer Nitrogen as Affected by Time and Rate of Application on Corn. Soil Science Society of America Journal. 61 (6), 1695(2010).
- Hart, S. C., Stark, J. M., Davidson, E. A., Firestone, M. K. Nitrogen Mineralization, Immobilization, and Nitrification. Methods of Soil Analysis, Part 2. Microbiological and Biochemical Properties. (5), 985-1018 (1994).
- Jokela, W., Randall, G. A nitrogen-15 microplot design for measuring plant and soil recovery of fertilizer nitrogen applied to corn. Agronomy journal (USA). 79 (APRIL), http://agris.fao.org/agris-search/search/display.do?f=1988/US/US88241.xml;US875113688 322-325 (1987).
- Olson, R. V. Fate of tagged nitrogen fertilizer applied to irrigated corn. Soil Science Society of America Journal. 44 (3), 514-517 (1980).
- Follett, R. F., Porter, L. K., Halvorson, A. D. Border Effects on Nitrogen-15 Fertilized Winter Wheat Microplots Grown in the Great Plains. Agronomy Journal. 83 (3), 608-612 (1991).
- Balabane, M., Balesdent, J. Input of fertilizer-derived labelled n to soil organic matter during a growing season of maize in the field. Soil Biology and Biochemistry. 24 (2), 89-96 (1992).
- Recous, S., Machet, J. M., Mary, B. The partitioning of fertilizer-N between soil and crop: Comparison of ammonium and nitrate applications. Plant and Soil. 144 (1), 101-111 (1992).
- Bigeriego, M., Hauck, R. D., Olson, R. A. Uptake, Translocation and Utilization of 15N-Depleted Fertilizer in Irrigated Corn. Soil Science Society of America Journal. 43 (3), 528(1979).
- Glendining, M. J., Poulton, P. R., Powlson, D. S., Jenkinson, D. S. Fate of15N-labelled fertilizer applied to spring barley grown on soils of contrasting nutrient status. Plant and Soil. 195 (1), 83-98 (1997).
- Khanif, Y. M., Cleemput, O., Baert, L. Field study of the fate of labelled fertilizer nitrate applied to barley and maize in sandy soils. Fertilizer Research. 5 (3), 289-294 (1984).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유