É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Projeto de microtrat e preparação de amostras de plantas e solo para 15análises de nitrogênio
Neste Artigo
Resumo
Um projeto de microtrama para pesquisa de rastreador de 15N é descrito para acomodar múltiplos eventos de amostragem de plantas e solos na estação. São apresentados procedimentos de coleta e processamento de amostras de solo e plantas, incluindo protocolos de moagem e pesagem, para análise de 15N.
Resumo
Muitos estudos de fertilizantes nitrogenados avaliam o efeito global de um tratamento em medições de fim de temporada, como rendimento de grãos ou perdas cumulativas n. Uma abordagem estável de isótopos é necessária para acompanhar e quantificar o destino do fertilizante derivado N (FDN) através do sistema de cultura do solo. O objetivo deste artigo é descrever um projeto de pesquisa de pequeno porte utilizando microtramas enriquecidas de 15N não confinadas para múltiplos eventos de amostragem de solo e plantas ao longo de duas estações de cultivo e fornecer protocolos de coleta, manuseio e processamento de amostras para análise total de 15N. Os métodos foram demonstrados usando um estudo replicado do centro-sul de Minnesota plantado em milho(Zea mays L.). Cada tratamento consistia em seis linhas de milho (76 cm de espaçamento de linha) de 15,2 m de comprimento com uma microtrama (2,4 m por 3,8 m) embutida em uma extremidade. A ureia de grau de fertilizante foi aplicada a 135 kg N∙ha-1 no plantio, enquanto o microempresário recebeu ureia enriquecida a 5 átomos % 15N. Amostras de solo e plantas foram colhidas várias vezes durante toda a estação de cultivo, tomando o cuidado de minimizar a contaminação cruzada usando ferramentas separadas e separando fisicamente amostras não enriquecidas e enriquecidas durante todos os procedimentos. Amostras de solo e plantas foram secas, moída para passar por uma tela de 2 mm e, em seguida, moída a uma consistência semelhante a farinha usando um moinho de pote de rolo. Estudos rastreadores requerem planejamento adicional, tempo de processamento amostral e trabalho manual, e incorrem em custos mais elevados para materiais enriquecidos em 15N e análise de amostras do que os estudos tradicionais n. No entanto, utilizando a abordagem de equilíbrio de massa, estudos rastreadores com múltiplos eventos amostrais na estação permitem ao pesquisador estimar a distribuição de FDN através do sistema de culturas de solo e estimar fdn não contabilizado do sistema.
Introdução
O uso de nitrogênio de fertilizantes (N) é essencial na agricultura para atender às demandas alimentares, fibras, rações e combustíveis de uma população global crescente, mas as perdas de N dos campos agrícolas podem impactar negativamente a qualidade ambiental. Como n passa por muitas transformações no sistema de culturas do solo, uma melhor compreensão do ciclismo N, utilização de culturas e o destino geral do fertilizante N são necessários para melhorar as práticas de manejo que promovam a eficiência do uso de N e minimizem as perdas ambientais. Os estudos tradicionais de fertilizantes N concentram-se principalmente no efeito de um tratamento em medições de fim de temporada, como rendimento da cultura, absorção de N em relação à taxa N aplicada (eficiência aparente do uso de fertilizantes) e solo residual N. Embora esses estudos quantifiquem os insumos, saídas e eficiências globais do sistema N, eles não podem identificar nem quantificar N no sistema de cultura do solo derivado de fontes de fertilizantes ou do solo. Uma abordagem diferente usando isótopos estáveis deve ser usada para rastrear e quantificar o destino do fertilizante derivado N (FDN) no sistema de cultura do solo.
O nitrogênio tem dois isótopos estáveis, 14N e 15N, que ocorrem na natureza em uma razão relativamente constante de 272:1 para 14N/15N1 (concentração de 0,366 átomo % 15N ou 3600 ppm 15N2,,3). A adição de 15N de fertilizante enriquecido aumenta o teor total de 15N do sistema de solo. Como 15N mistura de fertilizante enriquecido com solo não enriquecido N, a variação medida da razão de 14N/15N permite aos pesquisadores rastrear a FDN no perfil do solo e na cultura3,,4. Um saldo de massa pode ser calculado medindo a quantidade total de rastreador de 15N no sistema e cada uma de suas partes2. Como os fertilizantes enriquecidos de 15N são significativamente mais caros que os fertilizantes convencionais, microtraídos enriquecidos de 15N são frequentemente incorporados dentro das parcelas de tratamento. O objetivo deste artigo de métodos é descrever um projeto de pesquisa de pequeno porte utilizando microtramas para múltiplos eventos de amostragem de solo e plantas na estação para milho (Zea mays L.) e apresentar protocolos para preparação de amostras de plantas e solos para análise total de 15N. Esses resultados podem então ser usados para estimar a eficiência do uso de fertilizantes N e criar uma contabilidade parcial do orçamento N para a FDN no solo a granel e na cultura.
Protocolo
1. Descrição do site de campo
NOTA: Ao realizar testes de campo de rastreamento de 15N, os locais selecionados devem minimizar a variação devido ao solo, topografia e características físicas5. A contaminação cruzada pode ocorrer após o movimento lateral do solo devido à inclinação, translocação eólica ou de água, enquanto a distribuição vertical do solo N pode ser impactada pelo fluxo de água subsuperficial e drenagem de telhas6.
- Descreva o campo experimental, incluindo manejo passado (por exemplo, culturas e lavouras anteriores), latitude e longitude, propriedades físicas e químicas do solo (por exemplo, análise textural do solo, condições iniciais de fertilidade, pH e densidade a granel do solo).
- Registo as coordenadas gps para o local de pesquisa e os cantos de campo.
- Descrever o manejo da estação de crescimento, incluindo o manejo de pragas e doenças (uso de herbicidas, inseticidas ou fungicidas), o gerenciamento da fertilidade do solo (incluindo taxa, origem, colocação e tempo de aplicação), lavoura, eventos de irrigação e quantidades e gerenciamento de resíduos.
- À medida que o crescimento das culturas e o micróbio mediado N transformações são afetadas pela umidade do solo, temperatura do solo e temperatura do ar, informações climáticas recordes, incluindo altas e baixas temperaturas diárias, precipitação diária e umidade do solo e temperaturas em várias profundidades que refletem as profundidades de amostragem do solo.
2. Projeto de enredo
- Plante seis linhas de milho (~86.000 plantas ha-1) em espaçamento de 76 cm com uma dimensão final de parcela de 15,2 m por 4,6 m.
- Estabeleça áreas fronteiriças a 1,5 m de cada extremidade da dimensão longitudinal (0-1,5 m, 13,7-15,2 m) e uma área de fronteira adicional de 1,5 m de comprimento (9,8-11,3 m) ao lado das áreas de amostragem e colheita(Figura 1).
- Designe as linhas 2 e 3 como a área de amostragem de plantas e solos na estação (1,5-9,8 m) e as linhas 4 e 5 como área de colheita (1,5-9,8 m) para a produção de grãos de milho.
- Estabeleça uma área de microtrama (11,3-13,7 m) com dimensões de 2,4 m por 3,8 m centradas na dimensão da largura. Colete todas as amostras de plantas e solo enriquecidas de 15N desta área, deixando 0,38 m de borda não amostrada nas dimensões de comprimento e largura para minimizar os efeitos da borda(Figura 2).
- Delineie o enredo de tratamento e cantos de microtrama com diferentes bandeiras coloridas.
3. Precauções de solo e amostra vegetal
- Utilize equipamentos e áreas de processamento dedicados para materiais não enriquecidos e enriquecidos. A contaminação de materiais não enriquecidos (fertilizantes, solo ou planta) por materiais enriquecidos e vice-versa pode afetar drasticamente os resultados.
- Coletar e processar 15N enriqueceu amostras de solo e plantas em ordem de menor a mais alto enriquecimento esperado de 15N para minimizar a contaminação cruzada. Certifique-se de que superfícies de trabalho, luvas, utensílios e máquinas sejam completamente limpos entre cada amostra para minimizar a contaminação cruzada da transferência da amostra.
- Minimizar o tráfego de pés em microtramas para evitar a contaminação de áreas de amostragem não polidas. Use revestimentos de sapato protetores ao acessar microtramas e remova-as ao sair da área do microplot.
4. 15N enriquecido preparação e aplicação de fertilizantes
- Seguindo as diretrizes apresentadas pelo Ref. 2 para fertilizantes 15N estudos de eficiência de uso (F15NUE), diluir 10 átomos % 15N enriqueceu a ureia para 5 átomos % 15N enriquecido ureia e dissolver em 2 L de água desionizada para garantir o enriquecimento uniforme do fertilizante ureia.
NOTA: A concentração necessária de 15N de fertilizante enriquecido depende dos objetivos do estudo agronômico. Se a concentração de fertilizante enriquecido de 15N exceder as exigências do pesquisador, a concentração de fertilizantes de estoque poderá ser diluída com fertilizante convencional similar utilizando a seguinte fórmula3.
X2 =[C1/C2) - 1] × X1
X2 é a massa do fertilizante convencional nãorico, X1 é a massa do fertilizante rastreador, C1 é a concentração isotópica [expressa como excesso de átomo % (átomo medido % enriquecimento menos a concentração de fundo natural assumida como 0,3663 átomo %)] do fertilizante rastreador original, e C2 é a concentração isotópica da mistura final. Como exemplo, dado 100 g de 10 átomos % ureia enriquecida, 92,7 g de fertilizante convencional não enriquecido seria necessário para uma concentração isotópica final de 5 átomos %;
X2 = {[10-0,3663)/5] - 1} × 100. - Analise a solução para concentração de 15N para verificar o enriquecimento. Os autores utilizaram os serviços analíticos prestados pela UC Davis Stable Isótopos Facility.
NOTA: As reações do regime solo-vegetal-micróbio às adições de fertilizantes podem ser afetadas pela forma física de fertilizante. Dependendo das metas do estudo, a solução de ureia pode ser aplicada como líquido ou desidratado para reformar cristais. Os cristais podem ser compactados em um bolo usando uma prensa Carver a 10.000 psi, seguido por esmagar o bolo e triagem das partículas para o tamanhodesejado 3. - Aplique uniformemente as soluções de ureia enriquecida de 15N aos microtramas usando um pulverizador de CO2 de mochila calibrada(Figura 3A). Se forem utilizadas várias taxas N ou níveis de enriquecimento, considere usar pulverizadores de CO2 designados para cada nível de enriquecimento ou use um único pulverizador e aplique soluções do menor ao maior enriquecimento para minimizar a contaminação cruzada do tratamento.
- Incorpore fertilizantes contendo ureia com lavoura leve, ancinhos manuais ou pelo menos 0,6 cm de irrigação dentro de 24 horas de aplicação para minimizar o potencial de perda de volatilização.
- Nenhum fertilizante de ureia enriquecido de 15N adicional é aplicado no microtrama durante a segunda temporada de crescimento. Aplique ureia convencional não enriquecida a todo o tratamento para evitar uma resposta diferencial no crescimento do milho devido ao nitrogênio.
5. Processamento de amostras de campo: biomassa de milho acima do solo
- Em cada estágio de amostragem, colete uma amostra composta de planta de milho de seis acima de solo de dentro da área de amostragem (15N não polida) e uma amostra composta de planta de milho de seis acima do solo do microplot enriquecido de 15N. Pelo menos duas plantas devem separar cada planta amostrada para evitar alterar significativamente a dinâmica de crescimento das plantas. Os autores coletaram amostras de plantas nos estágios de desenvolvimento fisiológico de milho V8 e R111 e na maturidade fisiológica(Figura 2).
- Seguindo os princípios descritos nas etapas 3.1 e 3.2, corte v8 e R1 acima da biomassa do solo (≤5 cm por ≤5 cm); um triturador de lixo de quintal é uma opção satisfatória. Coloque biomassa picada em tecido rotulado ou sacos de papel e seque em um forno de ar forçado a 60 °C até massa constante. Registo o peso seco de biomassa(Figura 3B).
- Partição fisiologicamente maduro plantas de milho em stover (todos os tecidos vegetativos, incluindo folhas, cascas e talos), frações de grãos e espigas. Pique e seque em um forno de ar forçado a 60 °C até massa constante. Regisso o peso seco de biomassa.
- Dentro do microplodo, corte todos os talos de milho na superfície do solo, amarre em um feixe, rotule de acordo com a trama e retire do campo(Figura 3C). Ajuste as bandeiras de canto de microtrama para estar quase alinhada com a superfície do solo para minimizar o risco de remoção pela combinação durante a colheita ou plantio pós-colheita.
- Colher grãos da área de colheita e reportar rendimento em 15,5% de teor de umidade12. Colher áreas de pesquisa remanescentes com um enredo combinar.
- Recolei biomassa não polida da área de microtrama. Pique e reaplique a biomassa de microtrama acima do solo para o enredo correto(Figura 3D).
- Incorpore resíduos na superfície do solo com lavoura tomando cuidado para minimizar o transporte de resíduos de solo e milho dentro ou fora da área de microtrama. Substitua as bandeiras de canto de microtrama removidas devido à lavoura.
- Plante milho do segundo ano nas mesmas linhas que o milho do primeiro ano.
- Coletar biomassa de milho acima do segundo ano apenas na maturidade fisiológica e processar como amostras de milho do primeiro ano, conforme descrito na etapa 5.3. Coletar amostras de microtramas do centro da área de microtrama (1,52 m por 0,76 m) para evitar qualquer diluição potencial de sinal após a lavoura(Figura 2). Colher grãos da área de colheita e reportar rendimento em 15,5% de teor de umidade.
- Seguindo os princípios das etapas 3.1 e 3.2, misture e triture completamente de 100 a 200 g de material vegetal seco para passar por uma peneira de 2 mm. Misture completamente o material moído e armazene uma subsample em um envelope de moeda rotulado para processamento posterior.
NOTA: Uma fábrica de Thomas Wiley é uma opção satisfatória para moagem de tecidos vegetais, enquanto uma Fábrica de Laboratório Perten 3610 é uma opção satisfatória para moer grãos.
ATENÇÃO: As pessoas que moem amostras de plantas devem usar proteção de ouvido e estar protegidas contra inalação de poeira usando um Respirador facial de filtragem de partículas N95 aprovado pelo Instituto Nacional de Segurança e Saúde Ocupacional do Instituto Nacional de Segurança e Saúde Ocupacional.
6. Processamento de amostras de campo: solo
- Colete amostras de solo do primeiro ano 8 dias após a aplicação de fertilizantes enriquecidos de 15N, V8, R1 e pós-colheita antes da lavoura. Coletar amostras de solo do segundo ano na pré-planta e pós-colheita. Devido a restrições logísticas de amostragem, os autores coletaram amostras de solo na estação de 0 a 15, 15 a 30-, e profundidades de 30 a 60 cm, amostras de solo pós-colheita de 0 a 15, 15 a 30, 30 a 60, e 60 a 90 cm de profundidade, e amostras de solo pré-vegetal do segundo ano a 0-30, 30 a 60, 60 a 120 cm de profundidade.
NOTA: Se uma sonda de solo é incapaz de coletar um núcleo de solo à profundidade mais profunda desejada como um único núcleo, colete núcleos de profundidade mais profundos dos mesmos furos que as profundezas superiores descartando o topo de 1 cm de solo para evitar a contaminação do solo que cai das profundezas superiores.- Colete uma amostra de solo composto de quatro núcleos (1,8 cm de diâmetro) da área de amostragem não enriquecida em V8 e R1 usando uma sonda manual. Colete um núcleo na linha de milho e três núcleos entre as linhas de milho.
- Colete uma amostra de solo composto de dois núcleos (5 cm de diâmetro) da área de amostragem não enriquecida na pré-planta e pós-colheita usando uma sonda hidráulica.
- Colete uma amostra de solo composto de 15 núcleos (1,8 cm de diâmetro) da área de microtrama 8 dias após a aplicação de fertilizante enriquecido de 15N, V8 e R1 usando uma sonda manual. Colecione de três a quatro núcleos na linha de milho e de 11 a 12 núcleos entre as linhas de milho.
NOTA: Os solos são extremamente heterogêneos. O maior número de núcleos coletados dentro do microplot enriquecido fornece uma melhor estimativa do verdadeiro enriquecimento de 15N do solo N13. - Colete uma amostra de solo composto de três núcleos (5 cm de diâmetro) da área de microtrama na pré-planta e pós-colheita usando uma sonda hidráulica.
- Homogeneize cada amostra de solo composto em um balde e coloque-a em um saco de papel pré-rotulado.
- Amostras de solo seco a 35 °C em um forno de ar forçado até massa constante. Triture cada amostra para passar por uma peneira de 2 mm. Um moedor de solo mecânico é satisfatório se puder ser completamente limpo entre cada amostra.
NOTA: As amostras de solo podem ser secas ao ar espalhando amostras em bandejas em uma camada fina. As bandejas devem estar em uma área livre de contaminação por fontes externas n. Amostras não enriquecidas e enriquecidas devem ser fisicamente separadas para evitar a contaminação cruzada.
ATENÇÃO: As pessoas que moem amostras de solo devem usar proteção auditiva e estar protegidas da inalação de poeira usando um Respirador facial de filtragem de partículas N95 aprovado pelo Instituto Nacional de Segurança e Saúde Ocupacional do Instituto Nacional de Segurança e Saúde Ocupacional.
7. Processamento de amostras de laboratório: moer amostras de solo e plantas
- Amostras de plantas moída secas (2 mm) durante a noite em um forno a 60 °C.
- Seguindo os princípios descritos na etapa 3, triture amostras de plantas secas ou material do solo para uma consistência fina, semelhante à farinha. Um moinho de pote de rolo é uma opção satisfatória.
NOTA: O moinho de frascos dos autores é um sistema de correia transportadora personalizado que pode processar 54 potes de rolo por vez.- Encha cada pote de rolo (frasco de vidro borossilicato de 250 mL com tampa de rosca) com 10 a 20 g de amostra de planta moída ou solo e sete hastes de aço inoxidável (8,5 cm de comprimento, 0,7 cm de diâmetro).
- Enrole os potes de rolo a 0,4 x g por 6-24 h ou até que as amostras tenham uma consistência fina, semelhante à farinha.
- Transfira o material finamente moído para um frasco de cintilação de 20 mL limpo e rotulado.
- Entre cada amostra, lave potes de rolo, barras de aço inoxidável e tampas com água e sabão para remover qualquer resíduo.
- Mergulhe potes de rolo e tampas em um banho de ácido HCl de 5% (preparado de 36-38% de estoque concentrado) durante a noite14.
ATENÇÃO: O ácido clorídrico é corrosivo. Pode causar queimaduras graves na pele, danos oculares, e é prejudicial se inalado. Use sempre roupas de proteção, luvas e proteção dos olhos e rostos. Flush contatou o tecido completamente com água. Use sempre um recipiente secundário no transporte de ácidos. Adicione sempre ácido à água, pois essa reação é exotérmica. Neutralizar imediatamente os derramamentos de ácido com bicarbonato de sódio.
NOTA: Um grande banho de ácido pode ser preparado como 100 L de 5% HCl em um recipiente plástico de 208 L. Prepare vários volumes menores em um capô de fumaça e, em seguida, transfira as soluções para o recipiente de plástico. Substitua a solução a cada três meses. - Enxágüe três potes e tampas com água deionizada e ar seco.
- Mergulhe as hastes de aço inoxidável em um banho naOH de 0,05 M (preparado dissolvendo 2 g de NaOH em 1 L de água desionizada) durante a noite14. Prepare um novo banho naOH de 0,05 M todos os dias.
ATENÇÃO: Hidróxido de sódio pode causar queimaduras graves na pele e danos oculares. Use sempre roupas protetoras e proteção ocular. Remova imediatamente as roupas contaminadas e enxágue a pele ou os olhos com água por vários minutos. - Enxágüe as hastes em água quente da torneira por 5 minutos. Decantar e enxaguar triplamente as hastes com água deionizada. Deixe as hastes secarem em uma bandeja forrada com papel toalha.
- Mergulhe potes de rolo e tampas em um banho de ácido HCl de 5% (preparado de 36-38% de estoque concentrado) durante a noite14.
8. Pesar amostras de plantas e solos para análise total n e 15N
- Analise algumas amostras representativas de plantas e solos para o teor total de N (por exemplo, análise de combustão15). Calcule a massa amostral que fornece conteúdo N adequado para análise de 15N de acordo com as especificações do analisador.
NOTA: Os autores utilizaram os serviços analíticos prestados pela UC Davis Stable Isótopos Facility. Os pesos amostrais enriquecidos foram otimizados para 20 μg de N com um máximo de 100 μg de N. - Organize amostras semelhantes do enriquecimento de 15N mais baixo e mais esperado. Duplique cada oitava a décima segunda amostra em cada corrida para verificar a precisão da amostra. Inclua pelo menos uma amostra de verificação por corrida16.
- Rotule uma placa limpa de 96 poços e tampa equipada com anéis individuais de evaporação de poços. Corte um cartão de índice limpo para caber apenas dentro da tampa para evitar o movimento da amostra entre os poços durante o transporte.
- Usando luvas de nitrito, limpe a microescala, superfícies de trabalho, espátula e fórceps com lenços de laboratório e etanol. Coloque utensílios limpos em um Kimwipe no banco do laboratório.
NOTA: Amostras não enriquecidas e enriquecidas devem ser processadas usando balanças e utensílios separados para evitar contaminação cruzada. - Use fórceps para colocar uma cápsula de estanho pré-formada de 5 mm x 9 mm em uma superfície de trabalho limpa, como um bloco de aço inoxidável com poço de 5 mm x 8 mm. Bata suavemente a cápsula no poço para reformar a forma cilíndrica e achatar o fundo da cápsula, se necessário.
NOTA: Como as massas amostrais serão muito pequenas, o risco de contaminação da amostra é alto. Nunca toque nas cápsulas com luvas. Descarte a cápsula se tocar em qualquer superfície que não seja as fórceps, superfície de trabalho limpa, panela de pesar de escala ou placa de 96 poços. - Use fórceps para disparar suavemente o topo 1 mm da cápsula para facilitar a manipulação. Para evitar danos na escala ao reencamas o peso da cápsula, passe o mouse e solte a cápsula de 1 a 2 mm acima da panela de pesagem de microescala. Tare a cápsula. Use fórceps para devolver a cápsula à superfície de trabalho limpa.
- Use uma espátula para adicionar cuidadosamente a massa necessária de material de amostra finamente moída à cápsula. Evite derramar material amostral na superfície externa da cápsula ou nas superfícies de trabalho.
- Usando fórceps, amasse lentamente o terço superior da cápsula e dobre para selar. Usando fórceps, continue dobrando e comprimindo a cápsula em uma forma esférica, tomando cuidado para não perfurar ou rasgar a lata.
NOTA: Amostras com baixo teor N podem exigir volumes amostrais que excedam a capacidade da cápsula de 5x9 mm. Cápsulas maiores (por exemplo, 9 mm x 10 mm) podem ser usadas nestes casos. - Use fórceps para soltar a cápsula embrulhada várias vezes a partir de uma altura de 1 cm em uma superfície limpa e escura ou espelho para verificar se há vazamentos. Se não aparecer poeira, pese a amostra usando a mesma técnica descrita na etapa 8.6. Regisso peso amostral. Coloque a cápsula em uma placa de 96 poços e regise a colocação do poço.
- Se a poeira aparecer na superfície escura, regisite o peso da amostra. Enrole a amostra em uma segunda cápsula de lata, verifique novamente os vazamentos e coloque-a em uma placa limpa de 96 poços.
NOTA: Se a cápsula embrulhada for muito grande para caber em uma placa de 96 poços, use uma placa de 24 ou 48 poços.
- Se a poeira aparecer na superfície escura, regisite o peso da amostra. Enrole a amostra em uma segunda cápsula de lata, verifique novamente os vazamentos e coloque-a em uma placa limpa de 96 poços.
- Entre as amostras, limpe cada um dos utensílios e superfícies com etanol e lenços umedecidos de laboratório prestando especial atenção às bordas de espátula e fórceps.
- Fixar a tampa na placa de 96 poços usando fita adesiva e armazenar em um desiccador.
9. Cálculos
- Calcule a massa de N (kg∙ha-1) contida nas amostras de plantas ou solos utilizando as seguintes equações.
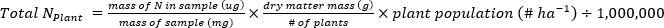
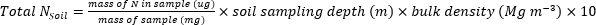
- Calcule a fração de fertilizante N(Nf),fertilizante derivado N(FDN),e o solo derivado N (SDN) para amostras de plantas e solo17.
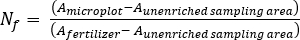
onde A é o átomo % 15N enriquecimento. -
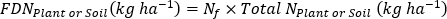
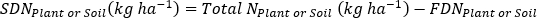
- Calcular fertilizante 15N eficiência de uso17.

Resultados
Os resultados apresentados neste artigo vêm de um site de campo criado em 2015 no Centro de Pesquisa e Extensão do Sul da Universidade de Minnesota, localizado perto de Waseca, MN. O local foi gerenciado como uma rotação de milho-soja [Glycine max (L.) Merr] antes de 2015, mas foi gerenciado como uma rotação de milho-milho durante as temporadas de crescimento de 2015 e 2016. O solo era um loam de argila Nicollet (fina-loamy, misto, superativo, mesic Aquic Hapludolls)-Webste...
Discussão
A pesquisa de isótopos estáveis é uma ferramenta útil para rastrear e quantificar a FDN através do sistema de cultura do solo. No entanto, existem três premissas principais associadas a estudos de rastreadores N que, se violadas, podem invalidar conclusões extraídas do uso dessa metodologia. São 1) o rastreador é uniformemente distribuído em todo o sistema, 2) processos sob o estudo ocorrem nas mesmas taxas, e 3) N deixando a piscina enriquecida de 15N não retorna3. Como est...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores reconhecem o apoio do Minnesota Corn Research & Promotion Council, da Hueg-Harrison Fellowship e da Bolsa de Economia de Descoberta, Pesquisa e InnoVation de Minnesota (MnDRIVE).
Materiais
| Name | Company | Catalog Number | Comments |
| 20 mL scintillation vial | ANY; Fisher Scientific is one example | 0334172C | |
| 250 mL borosilicate glass bottle | QORPAK | 264047 | |
| 48-well plate | EA Consumables | E2063 | |
| 96-well plate | EA Consumables | E2079 | |
| Cloth parts bag (30x50 cm) | ANY | NA | For corn ears |
| CO2 Backpack Sprayer | ANY; Bellspray Inc is one example | Model T | |
| Coin envelop (6.4x10.8 cm) | ANY; ULINE is one example | S-6285 | For 2-mm ground plant samples |
| Corn chipper | ANY; DR Chipper Shredder is one example | SKU:CS23030BMN0 | For chipping corn biomass |
| Corn seed | ANY | NA | Hybrid appropriate to the region |
| Disposable shoe cover | ANY; Boardwalk is one example | BWK00031L | |
| Ethanol 200 Proof | ANY; Decon Laboratories Inc. is one example | 2701TP | |
| Fabric bags with drawstring (90x60 cm) | ANY | NA | For plant sample collection |
| Fertilizer Urea (46-0-0) | ANY | NA | ~0.366 atom % 15N |
| Hand rake | ANY; Fastenal Company is one example | 5098-63-107 | |
| Hand sickle | ANY; Home Depot is one example | NJP150 | For plant sample collection |
| Hand-held soil probe | ANY; AMS is one example | 401.01 | |
| Hydraulic soil probe | ANY; Giddings is one example | GSPS | |
| Hydrochloric acid, 12N | Ricca Chemical | R37800001A | |
| Jar mill | ANY; Cole-Parmer is one example | SI-04172-50 | |
| Laboratory Mill | Perten | 3610 | For grinding grain |
| Microbalance accurate to four decimal places | ANY; Mettler Toledo is one example | XPR2 | |
| N95 Particulate Filtering Facepiece Respirator | ANY, ULINE is one example | S-9632 | |
| Neoprene or butyl rubber gloves | ANY | NA | For working in HCl acid bath |
| Paper hardware bags (13.3x8.7x27.8 cm) | ANY; ULINE is one example | S-8530 | For soil samples and corn grain |
| Plant grinder | ANY; Thomas Wiley Model 4 Mill is one example | 1188Y47-TS | For grinding chipped corn biomass to 2-mm particles |
| Plastic tags | ULINE | S-5544Y-PW | For labeling fabric bags and microplot stalk bundles |
| Sodium hydroxide pellets, ACS | Spectrum Chemical | SPCM-S1295-07 | |
| Soil grinder | ANY; AGVISE stainless steel grinder with motor is one example | NA | For grinding soil to pass through a 2-mm sieve |
| Tin capsule 5x9 mm | Costech Analytical Technologies Inc. | 041061 | |
| Tin capsule 9x10 mm | Costech Analytical Technologies Inc. | 041073 | |
| Urea (46-0-0) | MilliporeSigma | 490970 | 10 atom % 15N |
Referências
- Sharp, Z. . Principles of Stable Isotope Geochemistry. , (2017).
- Van Cleemput, O., Zapata, F., Vanlauwe, B. Guidelines on Nitrogen Management in Agricultural Systems. Guidelines on Nitrogen Management in Agricultural Systems. 29 (29), 19 (2008).
- Hauck, R. D., Meisinger, J. J., Mulvaney, R. L. Practical considerations in the use of nitrogen tracers in agricultural and environmental research. Methods of Soil Analysis: Part 2-Microbiological and Biochemical Properties. , 907-950 (1994).
- Bedard-Haughn, A., Van Groenigen, J. W., Van Kessel, C. Tracing 15N through landscapes: Potential uses and precautions. Journal of Hydrology. 272 (1-4), 175-190 (2003).
- Peterson, R. G. . Agricultural Field Experiments: Design and Analysis. , (1994).
- Follett, R. F. Innovative 15N microplot research techniques to study nitrogen use efficiency under different ecosystems. Communications in Soil Science and Plant Analysis. 32 (7/8), 951-979 (2001).
- Russelle, M. P., Deibert, E. J., Hauck, R. D., Stevanovic, M., Olson, R. A. Effects of water and nitrogen management on yield and 15N-depleted fertilizer use efficiency of irrigated corn. Soil Science Society of America Journal. 45 (3), 553-558 (1981).
- Schindler, F. V., Knighton, R. E. Fate of Fertilizer Nitrogen Applied to Corn as Estimated by the Isotopic and Difference Methods. Soil Science Society of America Journal. 63, 1734 (1999).
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study. Agronomy Journal. 97 (4), 1037 (2005).
- Recous, S., Fresneau, C., Faurie, G., Mary, B. The fate of labelled 15N urea and ammonium nitrate applied to a winter wheat crop. Plant and Soil. 112 (2), 205-214 (1988).
- Abendroth, L. J., Elmore, R. W., Boyer, M. J., Marlay, S. K. . Corn Growth and Development. , (2011).
- Gomez, K. A., Gomez, A. A. . Statistical Procedures for Agricultural Research. , (1984).
- Khan, S. A., Mulvaney, R. L., Brooks, P. D. Diffusion Methods for Automated Nitrogen-15 Analysis using Acidified Disks. Soil Science Society of America Journal. 62 (2), 406 (1998).
- Horneck, D. A., Miller, R. O. Determination of Total Nitrogen in Plant Tissue. Handbook of Reference Methods for Plant Analysis. , 75-84 (1998).
- . Carbon (13C) and Nitrogen (15N) Analysis of Solids by EA-IRMS Available from: https://stableisotopefacility.ucdavis.edu/13cand15n.html (2019)
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study: II. Nitrogen Uptake Efficiency. Agronomy Journal. 97 (4), 1046 (2005).
- . Fertilizing Corn in Minnesota Available from: https://extension.umn.edu/crop-specific-needs/fertilizing-corn-minnesota (2018)
- Blake, G. R., Hartge, K. H. Bulk Density. Methods of Soil Analysis: Part 1 Physical and Mineralogical Methods. , 363-375 (1986).
- Jokela, W. E., Randall, G. W. Fate of Fertilizer Nitrogen as Affected by Time and Rate of Application on Corn. Soil Science Society of America Journal. 61 (6), 1695 (2010).
- Hart, S. C., Stark, J. M., Davidson, E. A., Firestone, M. K. Nitrogen Mineralization, Immobilization, and Nitrification. Methods of Soil Analysis, Part 2. Microbiological and Biochemical Properties. (5), 985-1018 (1994).
- Olson, R. V. Fate of tagged nitrogen fertilizer applied to irrigated corn. Soil Science Society of America Journal. 44 (3), 514-517 (1980).
- Follett, R. F., Porter, L. K., Halvorson, A. D. Border Effects on Nitrogen-15 Fertilized Winter Wheat Microplots Grown in the Great Plains. Agronomy Journal. 83 (3), 608-612 (1991).
- Balabane, M., Balesdent, J. Input of fertilizer-derived labelled n to soil organic matter during a growing season of maize in the field. Soil Biology and Biochemistry. 24 (2), 89-96 (1992).
- Recous, S., Machet, J. M., Mary, B. The partitioning of fertilizer-N between soil and crop: Comparison of ammonium and nitrate applications. Plant and Soil. 144 (1), 101-111 (1992).
- Bigeriego, M., Hauck, R. D., Olson, R. A. Uptake, Translocation and Utilization of 15N-Depleted Fertilizer in Irrigated Corn. Soil Science Society of America Journal. 43 (3), 528 (1979).
- Glendining, M. J., Poulton, P. R., Powlson, D. S., Jenkinson, D. S. Fate of15N-labelled fertilizer applied to spring barley grown on soils of contrasting nutrient status. Plant and Soil. 195 (1), 83-98 (1997).
- Khanif, Y. M., Cleemput, O., Baert, L. Field study of the fate of labelled fertilizer nitrate applied to barley and maize in sandy soils. Fertilizer Research. 5 (3), 289-294 (1984).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados