Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Microplot Дизайн и завод и почва Пример подготовки к 15анализа азота
В этой статье
Резюме
Микрофло дизайн для 15N трассировщик исследований описывается для размещения нескольких в сезон растений и почве выборки событий. Процедуры сбора и обработки образцов почвы и растений, включая протоколы шлифования и взвешивания, для анализа 15N выдвигаются.
Аннотация
Многие исследования азотных удобрений оценивают общий эффект лечения от измерений конца сезона, таких как урожайность зерна или кумулятивные потери N. Стабильный изотопный подход необходим для того, чтобы следить и дать количественную оценку судьбы удобрений, полученных N (FDN) через систему почвоу/сельскохозяйственных культур. Цель настоящего документа состоит в том, чтобы описать небольшой участок исследования дизайн с использованием не ограниченных 15N обогащенных микрослой для нескольких почвенных и растительных случаев отбора проб в течение двух вегетационных сезонов и обеспечить сбор образцов, обработка и обработка протоколов для общего 15N анализа. Методы были продемонстрированы с помощью реплицированного исследования из южной части центральной Миннесоты посадили на кукурузу (Зеа майс Л.). Каждая обработка состояла из шести кукурузных рядов (76 см рядового интервала) длиной 15,2 м с микропроплатой (2,4 м на 3,8 м), встроенным на одном конце. Удобрение класса мочевины был применен на 135 кгН'ха-1 при посадке, в то время как микропло получил мочевину обогащенный до 5 атома % 15N. Почва и образцы растений были взяты несколько раз в течение вегетационного периода, заботясь, чтобы свести к минимуму перекрестное загрязнение с помощью отдельных инструментов и физически отделяя необогащенные и обогащенные образцы во время всех процедур. Образцы почвы и растений были высушены, измельчались, чтобы пройти через 2 мм экран, а затем измельчить до мукомольной консистенции с помощью мельницы роликовых банок. Исследования Tracer требуют дополнительного планирования, времени обработки проб и ручного труда, а также влечет за собой более высокие затраты на 15N обогащенных материалов и анализ образцов, чем традиционные исследования N. Однако, используя подход к массовому балансу, исследования трассировщика с несколькими событиями выборки в межсезонье позволяют исследователю оценить распределение FDN через систему почвообнамер и оценить неучтенные FDN из системы.
Введение
Использование азота удобрений (N) имеет важное значение в сельском хозяйстве для удовлетворения потребностей в продовольствии, клетчатке, кормах и топливе растущего населения мира, однако потери N от сельскохозяйственных полей могут негативно сказаться на качестве окружающей среды. Поскольку N претерпевает много преобразований в системе почвоурожа, лучшее понимание N велосипедов, использования сельскохозяйственных культур, и общая судьба удобрений N необходимы для улучшения методов управления, которые способствуют эффективности использования N и свести к минимуму экологические потери. Традиционные исследования N удобрений в первую очередь сосредоточены на воздействии лечения на конце сезона измерений, таких как урожайность, урожай N поглощения по отношению к N ставка применяется (явное использование удобрений эффективности), и остаточная почва N. Хотя в этих исследованиях можно количественно оценить общие входные данные, результаты и эффективность системы N, они не могут определить и количественно оценить N в системе почвоурожайных культур, полученных из источников удобрений или почвы. Для отслеживания и количественной оценки судьбы удобрений, полученных N (FDN) в системе почвооодержащих культур, необходимо использовать иной подход с использованием стабильных изотопов.
Азот имеет два стабильных изотопа, 14N и 15N, которые происходят в природе при относительно постоянном соотношении 272:1 для 14N/15N1 (концентрация 0,366 атома % 15N или 3600 промилле 15N2,3). Добавление 15N обогащенных удобрений увеличивает общее содержание 15N почвенной системы. Как 15N обогащенных удобрений смеси с необогащенной почвы N, измеренное изменение 14N /15N соотношение позволяет исследователям проследить FDN в профиле почвы и в урожай3,4. Баланс массы может быть рассчитан путем измерения общей суммы 15N трассировщик в системе и каждой из его частей2. Поскольку 15N обогащенных удобрений значительно дороже, чем обычные удобрения, 15N обогащенных микрослой часто встроенных в очистных сооружений. Цель этого метода бумаги заключается в описании мелкого участка исследования дизайн с использованием микрослой для нескольких в сезоне почвы и растений выборки событий для кукурузы (Зеа майс Л.) и представить протоколы для подготовки образцов растений и почвы для общего 15N анализа. Эти результаты могут быть использованы для оценки эффективности использования N удобрений и создания частичного бюджета N учета FDN в объеме почвы и урожая.
протокол
1. Описание полевого сайта
ПРИМЕЧАНИЕ: При выполнении 15N трассинер полевых испытаний, выбранные участки должны свести к минимуму изменения из-за почвы, топографии и физических особенностей5. Перекрестное загрязнение может произойти после бокового движения почвы из-за наклона, ветра или воды транслокации, или обработки в то время как вертикальное распределение почвы N может быть затронуто подземным потоком воды и плиткадренажа 6.
- Опишите экспериментальный участок поля, включая прошлые сельскохозяйственные (например, предыдущие культуры и обработку), широту и долготу, физические и химические свойства почвы (например, текстурный анализ почвы, начальные условия фертильности, рН и плотность навалом почвы).
- Запись GPS координаты для исследовательского сайта и полевых углов.
- Опишите управление вегетационным периодом, включая борьбу с вредителями и болезнями (гербицид, использование инсектицидов или фунгицидов), управление фертильностью почвы (включая скорость, источник, размещение и сроки применения), обработку, ирригационные мероприятия и количества, а также управление остатками.
- По мере роста сельскохозяйственных культур и опосредованных N преобразований влияет влажность почвы, температура почвы и температура воздуха, информация о климате, включая суточные высокие и низкие температуры, ежедневные осадки, а также влажность почвы и температуры на нескольких глубинах, которые отражают глубины отбора проб почвы.
2. Дизайн участка
- Завод шесть кукурузных рядов (86000 растений га-1) на 76 см интервал с окончательным размером участка 15,2 м на 4,6 м.
- Установить пограничные участки 1,5 м от каждого конца протяженного измерения (0-1,5 м, 13,7-15,2 м) и дополнительную пограничную зону длиной 1,5 м (9,8-11,3 м), примыкающую к участкам отбора проб и сбора урожая(рисунок 1).
- Обозначение ряды 2 и 3 как в сезонной области отбора проб растений и почв (1,5-9,8 м) и ряды 4 и 5 в качестве сбора урожая (1,5-9,8 м) для урожайности зерна кукурузы.
- Установите площадь микропрока (11,3-13,7 м) с размерами 2,4 м на 3,8 м по размеру ширины. Соберите все 15N обогащенных растений и почвы образцов из этой области, оставляя 0,38 м нешмпованных границы на длину и ширину размеры, чтобы свести к минимуму эффект края (Рисунок 2).
- Очертьте участок обработки и микропрофы с разноцветными флагами.
3. Меры предосторожности образца почвы и растений
- Используйте специальное оборудование и области обработки для необогащенных и обогащенных материалов. Загрязнение необогащенных материалов (удобрений, почвы или растений) обогащенными материалами и наоборот может существенно повлиять на результаты.
- Сбор и обработка 15N обогащенной почвы и образцов растений в порядке от самого низкого до самого высокого 15N ожидаемого обогащения, чтобы свести к минимуму перекрестное загрязнение. Убедитесь, что рабочие поверхности, перчатки, посуда и оборудование тщательно очищаются между каждым образцом, чтобы свести к минимуму перекрестное загрязнение от переноса образца.
- Свести к минимуму пешеходное движение в микрослойках для предотвращения загрязнения необсужнутых участков отбора проб. Носите защитные обувные покрытия при доступе к микрослой и удалите их при выходе из области микропла.
4. 15N обогащенных удобрений подготовки и применения
- В соответствии с руководящими принципами, выдвинутыми Ref. 2 для удобрений 15N использования эффективности (F15NUE) исследований, разбавить 10 атома % 15N обогащенной мочевины до 5 атома % 15N обогащенной мочевины и растворяются в 2 Л деионизированной воды для обеспечения равномерного обогащения мочевины удобрений.
ПРИМЕЧАНИЕ: Необходимая концентрация 15N обогащенных удобрений зависит от целей агрономического исследования. Если концентрация запасов 15N обогащенных удобрений превышает требования исследователя, концентрация складских удобрений может быть разбавлена аналогичными обычными удобрениями с использованием следующей формулы3.
X2 -C1/C2) - 1 "X1"
X2 масса обычных unenriched удобрения, X1 будет массой удобрения трассировщика, C1 будет изотопной концентрацией «выраженная как атом % избыток (измеренное обогащение атома % минус естественная концентрация предпосылки предположенная для того чтобы быть 0.3663 атомом %) первоначально удобрения трассировщика, и C2 будет изотопной концентрацией окончательной смеси. Например, с учетом 100 г 10 атомов% обогащенной мочевины, 92,7 г обычных необмораченных удобрений потребуется для конечной изотопной концентрации 5 атомов %;
X2 ( (10-0.3663)/5" - 1 и 100. - Проанализируйте раствор на 15N концентрации для проверки обогащения. Авторы использовали аналитические услуги, предоставляемые UC Davis Стабильный изотоп фонда.
ПРИМЕЧАНИЕ: Реакция почво-растительно-микробного режима на добавление удобрений может быть затронута физической формой удобрений. В зависимости от целей исследования, раствор мочевины может быть применен в качестве жидкости или обезвоженной для реформирования кристаллов. Кристаллы могут быть уплотнены в торт с помощью пресса Карвер на 10000 пси, а затем дробления торт и скрининга частиц до нужного размера3. - Равномерно применять 15N обогащенных мочевины решения для микрослой с помощью калиброванного рюкзака CO2 опрыскиватель(Рисунок 3A). Если используются несколько уровней N или уровней обогащения, рассмотрите возможность использования назначенных опрыскивателей CO2 для каждого уровня обогащения или используйте один опрыскиватель и примените растворы от самого низкого до самого высокого обогащения, чтобы свести к минимуму перекрестное загрязнение.
- Включите карбамидсодержащие удобрения с легкими обработками, ручными граблями или не менее 0,6 см орошения в пределах 24 ч применения, чтобы свести к минимуму потенциал потери волатилизации.
- Во время второго вегета в микрофлоте на микрофлот не применяется дополнительное 15-еудобрение мочевины. Примените обычные необученные мочевины на всю обработку, чтобы избежать дифференциальной реакции на рост кукурузы из-за азота.
5. Обработка полевых образцов: надземная биомасса кукурузы
- На каждом этапе отбора проб соберите композитный образец из шести наземных кукурузных растений из области отбора проб(15N необогащеный) и композитный образец из 15N обогащенного микропропа. По крайней мере, два завода должны отделить каждое отобранного растения, чтобы избежать существенного изменения динамики роста растений. Авторы собрали образцы растений на стадиях физиологического развития кукурузы V8 и R111 и при физиологической зрелости(рисунок 2).
- Следуя принципам, описанным в шагах 3.1 и 3.2, нарежьте надземную биомассу V8 и R1 (5 см на 5 см); двор отходов дробилка является удовлетворительным вариантом. Поместите нарезанную биомассу в маркированную ткань или бумажные пакеты и высушите в духовке с принудительным воздухом при температуре 60 градусов по Цельсию до постоянной массы. Запись биомассы сухой вес(Рисунок 3B).
- Раздел физиологически зрелых растений кукурузы в stover (все растительные ткани, включая листья, шелуху и стебли), зерно, и початок фракций. Нарезать и высушить в духовке с принудительным воздухом при температуре 60 градусов до постоянной массы. Запишите биомассу сухого веса.
- В микропло, вырезать все стебли кукурузы на поверхности почвы, галстук в пучок, этикетку в соответствии с участком, и удалить с поля (Рисунок 3C). Отрегулируйте микрофлот угловые флаги, чтобы быть почти заподлицо с поверхностью почвы, чтобы свести к минимуму риск удаления комбайна во время сбора урожая или обработки послеуборочного урожая.
- Урожай зерна из области сбора урожая и отчет о урожайности на уровне 15,5% содержаниевлаги 12. Урожай оставшихся исследовательских областей с участка комбайна.
- Рейк необсученной биомассы от области микрофлота. Чоп и повторно microplot надземной биомассы на правильный участок (Рисунок 3D).
- Включите остатки в поверхность почвы с обработкой, заботясь, чтобы свести к минимуму транспортировку остатков почвы и кукурузы в или из области микроплота. Замените любые микропло угловые флаги, удаленные из-за обработки.
- Завод второй год кукурузы на тех же рядах, как первый год кукурузы.
- Соберите второй год надземной биомассы кукурузы только в физиологической зрелости и процесс, как первый год образцы кукурузы, как описано в шаге 5.3. Соберите образцы микропла из центра области микрофлота (1,52 м на 0,76 м), чтобы избежать любого потенциального разбавления сигнала после обработки(рисунок 2). Урожай зерна из области сбора урожая и отчет урожая на 15,5% содержание влаги.
- Следуя принципам шагов 3.1 и 3.2, тщательно перемешайте и измельчите от 100 до 200 г высушенного растительного материала, чтобы пройти через 2 мм сито. Тщательно смешайте молотый материал и храните подсемку в помеченном конверте монеты для дальнейшей обработки.
ПРИМЕЧАНИЕ: Мельница Thomas Wiley является удовлетворительным вариантом для измельчения тканей растений, в то время как Perten Laboratory Mill 3610 является удовлетворительным вариантом для измельчения зерна.
ВНИМАНИЕ: Люди шлифовальные образцы растений должны носить защиту уха и быть защищены от вдыхания пыли, нося Национальный институт охраны труда и здоровья утвержденных N95 частиц фильтрации Facepiece респиратор.
6. Обработка образцов на местах: почва
- Сбор образцов почвы первого года через 8 дней после 15N обогащенных удобрений применения, V8, R1, и после сбора урожая до обработки. Сбор проб почвы второго года на предварительном заводе и послеуборочных работ. Из-за ограничений по материально-техническому отбору проб авторы собрали в сезоне пробы почвы по 0- -15- , от 15 до 30-, и глубины от 30 до 60 см, послеуборочные пробы почвы на 0- 15-, 15- - 30-, 30-60-, и 60- - 90-сантиметровые, а также пробы почвы второго года на глубине 0--30- - 30- - 60-, 60--- см.
ПРИМЕЧАНИЕ: Если почвенный зонд не в состоянии собрать ядро почвы на глубочайшую нужную глубину в виде одного ядра, собирайте более глубокие глубинные ядра из тех же скважин, что и верхние глубины, отбрасывая верхние 1 см почвы, чтобы избежать загрязнения почвы, падающей с верхних глубин.- Соберите четырехядерный (диаметр 1,8 см) композитный образец почвы из необсученной области отбора проб на V8 и R1 с помощью ручного зонда. Соберите одно ядро в кукурузном ряду и три ядра между кукурузными рядами.
- Соберите двухядерный (диаметр 5 см) композитный образец почвы из необсужденной области отбора проб на предварительном заводе и послеуборок с помощью гидравлического зонда.
- Соберите 15-ядерный (1,8-сантиметровый диаметр) композитный образец почвы из области микрофлота через 8 дней после 15N обогащенных удобрений, V8 и R1 с помощью ручного зонда. Соберите от трех до четырех ядер в кукурузном ряду и от 11 до 12 ядер между кукурузными рядами.
ПРИМЕЧАНИЕ: Почвы чрезвычайно неоднородны. Большее количество ядер, собранных из обогащенного микропротеза, обеспечивает лучшую оценку истинного обогащения почвыN13 15N. - Соберите трехядерный (диаметром 5 см) композитный образец почвы из области микрофлота на предварительном заводе и послеуборок с помощью гидравлического зонда.
- Гомогенизировать каждый образец композитной почвы в ведро и поместить его в предварительно маркированный бумажный мешок.
- Сухие образцы почвы при температуре 35 градусов по Цельсию в духовке с принудительным воздухом до постоянной массы. Измельчить каждый образец, чтобы пройти через 2 мм сито. Механическая шлифовка почвы является удовлетворительным, если она может быть тщательно очищена между каждым образцом.
ПРИМЕЧАНИЕ: Образцы почвы могут быть высушены в воздухе путем распространения образцов на лотки тонким слоем. Трейс должен находиться в зоне, свободной от загрязнения внешними источниками N. Необогащенные и обогащенные образцы должны быть физически разделены для предотвращения перекрестного загрязнения.
ВНИМАНИЕ: Люди шлифовальные образцы почвы должны носить защиту уха и быть защищены от вдыхания пыли, нося Национальный институт по охране труда и здоровья утвержденных N95 частиц фильтрации Facepiece респиратор.
7. Обработка проб лаборатории: молоть почву и образцы завода
- Сухие образцы растений (2 мм) на ночь в духовке при температуре 60 градусов Цельсия.
- Следуя принципам, описанным в шаге 3, измельчить образцы высушенных растений или почвенного материала в тонкой, муковисновой консистенции. Роликовая кувшинная мельница является удовлетворительным вариантом.
ПРИМЕЧАНИЕ: Фабрика банок авторов является специально построенной системой конвейерной ленты, которая может обрабатывать 54 банки ролика за один раз.- Заполните каждую банку ролика (250 мл борозиликат стеклянную банку с крышкой винта) с 10 до 20 г образца грунта или почвы и семь стержней из нержавеющей стали (8,5 см в длину, 0,7 см в диаметре).
- Ролл роликовые банки на 0,4 х г на 6-24 ч или до тех пор, пока образцы имеют штраф, мука, как консистенция.
- Перенесите мелкомолотый материал в чистый, помеченный 20-мл сцинтилляционный флакон.
- Между каждым образцом, мыть ролик банки, из нержавеющей стали стержней, и крышки с мылом и водой, чтобы удалить любые остатки.
- Погрузите роликовые банки и крышки в 5% кислотной ванне HCl (приготовленная из 36-38% концентрированного бульона) на ночь14.
ВНИМАНИЕ: Гидрохлорная кислота коррозионная. Это может привести к серьезным ожогам кожи, повреждение глаз, и вредно, если вдыхать. Всегда носите защитную одежду, перчатки, а также защиту глаз и лица. Флеш полностью соприкасается с водой. Всегда используйте вторичный контейнер при транспортировке кислот. Всегда добавляйте кислоту в воду, так как эта реакция экзотермическая. Немедленно нейтрализовать разливы кислоты с выпечки соды.
ПРИМЕЧАНИЕ: Большая кислотная ванна может быть подготовлена как 100 L 5% HCl в 208 L пластиковый контейнер. Подготовьте несколько меньших томов в дымовом капоте, а затем перенесите растворы в пластиковый контейнер. Заменить решение каждые три месяца. - Тройной полоскания роликовых банок и крышки с деионированной водой и сухим воздухом.
- Погрузите стержней из нержавеющей стали в ванну 0,05 M NaOH (подготовленную растворении 2 г NaOH в 1 л деионизированной воды) на ночь14. Каждый день подготовьте новую ванну 0.05 M NaOH.
ВНИМАНИЕ: Гидроксид натрия может вызвать сильные ожоги кожи и повреждения глаз. Всегда носите защитную одежду и защиту глаз. Немедленно снимите загрязненную одежду и промойте кожу или глаза водой в течение нескольких минут. - Промыть стержни под проточной горячей водопроводной водой в течение 5 минут. Декант и тройной промыть стержни с деионизированной водой. Разрешить стержни, чтобы высохнуть на бумажном полотенце подкладкой лоток.
- Погрузите роликовые банки и крышки в 5% кислотной ванне HCl (приготовленная из 36-38% концентрированного бульона) на ночь14.
8. Взвешивание образцов грунтовых растений и почвы для общего анализа N и 15N
- Проанализируйте несколько репрезентативных образцов растений и почвы для общего содержания N (например, анализ сгорания15). Рассчитайте массу образца, которая обеспечивает адекватное содержание N для анализа 15N в соответствии со спецификациями анализатора.
ПРИМЕЧАНИЕ: Авторы использовали аналитические услуги, предоставляемые UC Davis Стабильный изотоп фонда. Обогащенные весы образцов были оптимизированы для 20 мкг N с максимум 100 мкг N. - Организуйте подобные образцы от самого низкого до самого высокого ожидаемого обогащения 15N. Дублируйте каждый восьмой-двенадцатый образец в каждом запуске, чтобы проверить точность выборки. Включите по крайней мере один контрольный образец за пробег16.
- Этикетка чистой 96-хорошо пластины и оборудованы крышкой с отдельными кольцами испарения хорошо. Вырезать чистую карточку индекса, чтобы поместиться только внутри крышки, чтобы предотвратить движение образца между скважинами во время транспортировки.
- Ношение нитрил перчатки, очистить микромасштавр, рабочие поверхности, шпатель, и щипцы с лабораторными салфетками и этанолом. Поместите очищенную посуду на Кимвипе на лабораторной скамейке.
ПРИМЕЧАНИЕ: Необогащенные и обогащенные образцы должны обрабатываться с использованием отдельных чешуек и посуды для предотвращения перекрестного загрязнения. - Используйте щипцы для размещения предварительно сформированной 5 мм х 9 мм олова капсулы на чистую рабочую поверхность, такие как блок из нержавеющей стали с 5 мм х 8 мм хорошо. Аккуратно нажмите капсулу в колодец, чтобы реформировать цилиндрическую форму и при необходимости сгладить дно капсулы.
ПРИМЕЧАНИЕ: Поскольку массы образцов будут очень малы, риск заражения образцами высок. Никогда не прикасайтесь к капсулам в перчатках. Отбросьте капсулу, если она касается любой поверхности, кроме щипцов, чистая рабочая поверхность, весят весят на сковороде или 96-хорошо пластины. - Используйте щипцы, чтобы аккуратно высвекать верхний 1 мм капсулы, чтобы облегчить манипуляции. Чтобы избежать повреждения масштаба при смоле веса капсулы, парить и отпустите капсулу от 1 до 2 мм выше микромасштабного взвешивания кастрюлю. Тар капсула. Используйте щипцы, чтобы вернуть капсулу на чистую рабочую поверхность.
- Используйте шпатель, чтобы тщательно добавить необходимую массу мелко молотого материала образца в капсулу. Избегайте разлива пробного материала на внешнюю поверхность капсулы или рабочие поверхности.
- Используя щипцы, медленно обжимайте верхнюю треть капсулы и сложите, чтобы запечатать. Используя щипцы, продолжать складывать и сжимать капсулу в сферической форме, заботясь, чтобы не проколоть или разорвать олово.
ПРИМЕЧАНИЕ: Образцы с низким содержанием N могут потребовать объемов выборки, превышающих емкость капсулы 5x9 мм. В этих случаях могут использоваться более крупные капсулы (например, 9 мм x 10 мм). - Используйте щипцы, чтобы бросить завернутые капсулы несколько раз с высоты 1 см на чистую, темную поверхность или зеркало, чтобы проверить наличие утечек. Если пыль не появляется, взвесить образец, используя тот же метод, как описано в шаге 8.6. Запишите вес образца. Поместите капсулу в 96-хорошо пластины и записать хорошо размещения.
- Если пыль появляется на темной поверхности, запишите вес образца. Оберните образец во вторую капсулу олова, перепроверьте на утечки, и поместите его в чистую 96-хорошо пластины.
ПРИМЕЧАНИЕ: Если завернутая капсула слишком велика, чтобы поместиться в 96-хорошо пластины, используйте 24- или 48-хорошо пластины.
- Если пыль появляется на темной поверхности, запишите вес образца. Оберните образец во вторую капсулу олова, перепроверьте на утечки, и поместите его в чистую 96-хорошо пластины.
- Между образцами, очистить каждую из посуды и поверхностей с этанолом и лабораторных салфеток уделяя особое внимание шпателя и щипцы края.
- Закрепите крышку к 96-ну пластины с помощью ленты и хранить в desiccator.
9. Расчеты
- Рассчитайте массу N (кгжа-1),содержащуюся в образцах растений или почвы, используя следующие уравнения.
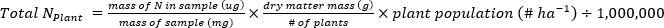
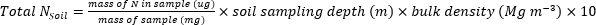
- Рассчитайте удобрение N фракция (Nf), удобрения, полученные N (FDN), и почва, полученная N (SDN) для образцов растений и почв17.
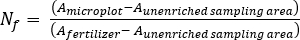
где A является атомом % 15N обогащения. -
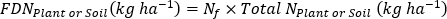
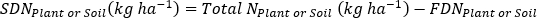
- Рассчитайте удобрения 15N использование эффективности17.

Результаты
Результаты, представленные в настоящем документе, получены на месте, созданном в 2015 году в Научно-исследовательском центре по пропаганде и исследованиям Университета Миннесоты, расположенному недалеко от Васека, штат Миннесота. Сайт управлялся как кукуруза-соя(Гли...
Обсуждение
Стабильные исследования изотопов являются полезным инструментом для отслеживания и количественной оценки FDN через систему почвоутводящих культур. Однако существуют три основных предположения, связанные с исследованиями N трассировщика, которые в случае нарушения могут привести к ан...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы признают поддержку Миннесота кукурузы исследований и поощрения Совета, Хьюг-Харрисон стипендий, а также Миннесота Discovery, исследований и Инновации экономики (MnDRIVE) стипендий.
Материалы
| Name | Company | Catalog Number | Comments |
| 20 mL scintillation vial | ANY; Fisher Scientific is one example | 0334172C | |
| 250 mL borosilicate glass bottle | QORPAK | 264047 | |
| 48-well plate | EA Consumables | E2063 | |
| 96-well plate | EA Consumables | E2079 | |
| Cloth parts bag (30x50 cm) | ANY | NA | For corn ears |
| CO2 Backpack Sprayer | ANY; Bellspray Inc is one example | Model T | |
| Coin envelop (6.4x10.8 cm) | ANY; ULINE is one example | S-6285 | For 2-mm ground plant samples |
| Corn chipper | ANY; DR Chipper Shredder is one example | SKU:CS23030BMN0 | For chipping corn biomass |
| Corn seed | ANY | NA | Hybrid appropriate to the region |
| Disposable shoe cover | ANY; Boardwalk is one example | BWK00031L | |
| Ethanol 200 Proof | ANY; Decon Laboratories Inc. is one example | 2701TP | |
| Fabric bags with drawstring (90x60 cm) | ANY | NA | For plant sample collection |
| Fertilizer Urea (46-0-0) | ANY | NA | ~0.366 atom % 15N |
| Hand rake | ANY; Fastenal Company is one example | 5098-63-107 | |
| Hand sickle | ANY; Home Depot is one example | NJP150 | For plant sample collection |
| Hand-held soil probe | ANY; AMS is one example | 401.01 | |
| Hydraulic soil probe | ANY; Giddings is one example | GSPS | |
| Hydrochloric acid, 12N | Ricca Chemical | R37800001A | |
| Jar mill | ANY; Cole-Parmer is one example | SI-04172-50 | |
| Laboratory Mill | Perten | 3610 | For grinding grain |
| Microbalance accurate to four decimal places | ANY; Mettler Toledo is one example | XPR2 | |
| N95 Particulate Filtering Facepiece Respirator | ANY, ULINE is one example | S-9632 | |
| Neoprene or butyl rubber gloves | ANY | NA | For working in HCl acid bath |
| Paper hardware bags (13.3x8.7x27.8 cm) | ANY; ULINE is one example | S-8530 | For soil samples and corn grain |
| Plant grinder | ANY; Thomas Wiley Model 4 Mill is one example | 1188Y47-TS | For grinding chipped corn biomass to 2-mm particles |
| Plastic tags | ULINE | S-5544Y-PW | For labeling fabric bags and microplot stalk bundles |
| Sodium hydroxide pellets, ACS | Spectrum Chemical | SPCM-S1295-07 | |
| Soil grinder | ANY; AGVISE stainless steel grinder with motor is one example | NA | For grinding soil to pass through a 2-mm sieve |
| Tin capsule 5x9 mm | Costech Analytical Technologies Inc. | 041061 | |
| Tin capsule 9x10 mm | Costech Analytical Technologies Inc. | 041073 | |
| Urea (46-0-0) | MilliporeSigma | 490970 | 10 atom % 15N |
Ссылки
- Sharp, Z. . Principles of Stable Isotope Geochemistry. , (2017).
- Van Cleemput, O., Zapata, F., Vanlauwe, B. Guidelines on Nitrogen Management in Agricultural Systems. Guidelines on Nitrogen Management in Agricultural Systems. 29 (29), 19 (2008).
- Hauck, R. D., Meisinger, J. J., Mulvaney, R. L. Practical considerations in the use of nitrogen tracers in agricultural and environmental research. Methods of Soil Analysis: Part 2-Microbiological and Biochemical Properties. , 907-950 (1994).
- Bedard-Haughn, A., Van Groenigen, J. W., Van Kessel, C. Tracing 15N through landscapes: Potential uses and precautions. Journal of Hydrology. 272 (1-4), 175-190 (2003).
- Peterson, R. G. . Agricultural Field Experiments: Design and Analysis. , (1994).
- Follett, R. F. Innovative 15N microplot research techniques to study nitrogen use efficiency under different ecosystems. Communications in Soil Science and Plant Analysis. 32 (7/8), 951-979 (2001).
- Russelle, M. P., Deibert, E. J., Hauck, R. D., Stevanovic, M., Olson, R. A. Effects of water and nitrogen management on yield and 15N-depleted fertilizer use efficiency of irrigated corn. Soil Science Society of America Journal. 45 (3), 553-558 (1981).
- Schindler, F. V., Knighton, R. E. Fate of Fertilizer Nitrogen Applied to Corn as Estimated by the Isotopic and Difference Methods. Soil Science Society of America Journal. 63, 1734 (1999).
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study. Agronomy Journal. 97 (4), 1037 (2005).
- Recous, S., Fresneau, C., Faurie, G., Mary, B. The fate of labelled 15N urea and ammonium nitrate applied to a winter wheat crop. Plant and Soil. 112 (2), 205-214 (1988).
- Abendroth, L. J., Elmore, R. W., Boyer, M. J., Marlay, S. K. . Corn Growth and Development. , (2011).
- Gomez, K. A., Gomez, A. A. . Statistical Procedures for Agricultural Research. , (1984).
- Khan, S. A., Mulvaney, R. L., Brooks, P. D. Diffusion Methods for Automated Nitrogen-15 Analysis using Acidified Disks. Soil Science Society of America Journal. 62 (2), 406 (1998).
- Horneck, D. A., Miller, R. O. Determination of Total Nitrogen in Plant Tissue. Handbook of Reference Methods for Plant Analysis. , 75-84 (1998).
- . Carbon (13C) and Nitrogen (15N) Analysis of Solids by EA-IRMS Available from: https://stableisotopefacility.ucdavis.edu/13cand15n.html (2019)
- Stevens, W. B., Hoeft, R. G., Mulvaney, R. L. Fate of Nitrogen-15 in a Long-Term Nitrogen Rate Study: II. Nitrogen Uptake Efficiency. Agronomy Journal. 97 (4), 1046 (2005).
- . Fertilizing Corn in Minnesota Available from: https://extension.umn.edu/crop-specific-needs/fertilizing-corn-minnesota (2018)
- Blake, G. R., Hartge, K. H. Bulk Density. Methods of Soil Analysis: Part 1 Physical and Mineralogical Methods. , 363-375 (1986).
- Jokela, W. E., Randall, G. W. Fate of Fertilizer Nitrogen as Affected by Time and Rate of Application on Corn. Soil Science Society of America Journal. 61 (6), 1695 (2010).
- Hart, S. C., Stark, J. M., Davidson, E. A., Firestone, M. K. Nitrogen Mineralization, Immobilization, and Nitrification. Methods of Soil Analysis, Part 2. Microbiological and Biochemical Properties. (5), 985-1018 (1994).
- Olson, R. V. Fate of tagged nitrogen fertilizer applied to irrigated corn. Soil Science Society of America Journal. 44 (3), 514-517 (1980).
- Follett, R. F., Porter, L. K., Halvorson, A. D. Border Effects on Nitrogen-15 Fertilized Winter Wheat Microplots Grown in the Great Plains. Agronomy Journal. 83 (3), 608-612 (1991).
- Balabane, M., Balesdent, J. Input of fertilizer-derived labelled n to soil organic matter during a growing season of maize in the field. Soil Biology and Biochemistry. 24 (2), 89-96 (1992).
- Recous, S., Machet, J. M., Mary, B. The partitioning of fertilizer-N between soil and crop: Comparison of ammonium and nitrate applications. Plant and Soil. 144 (1), 101-111 (1992).
- Bigeriego, M., Hauck, R. D., Olson, R. A. Uptake, Translocation and Utilization of 15N-Depleted Fertilizer in Irrigated Corn. Soil Science Society of America Journal. 43 (3), 528 (1979).
- Glendining, M. J., Poulton, P. R., Powlson, D. S., Jenkinson, D. S. Fate of15N-labelled fertilizer applied to spring barley grown on soils of contrasting nutrient status. Plant and Soil. 195 (1), 83-98 (1997).
- Khanif, Y. M., Cleemput, O., Baert, L. Field study of the fate of labelled fertilizer nitrate applied to barley and maize in sandy soils. Fertilizer Research. 5 (3), 289-294 (1984).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены