需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
脑毛细管中培养细胞细胞钙测量和钙成像研究
摘要
脑毛细管性信号是调节血脑屏障特性和血流的基本参与者。该协议描述了如何分离、培养脑毛细管腹膜,在细胞类型方面进行特征分析,并应用于用荧光探针研究细胞内钙信号。
摘要
在称为神经血管单元(NVU)的结构中,佩里西特与内皮细胞和星形末脚相关。脑毛细管性周丽素功能不完全知道。已建议参与毛细管发育、内皮屏障紧绷和转膜活动调节、毛细管音的调节,并在某些大脑病理中发挥关键作用。
由于在脑筋障碍中难以可视化过程,以及接近 NVU 的其他细胞,因此在完整大脑中对研究是具有挑战性的。本协议描述了一种主要牛脑毛细管性胸毛的分离和培养方法及其在钙成像研究中的以下用法,其中可以研究参与大脑信号和病理学的激动剂的影响。皮质毛细管碎片可以附着在培养瓶的底部,6天后,内皮细胞和心状物从毛细管碎片中生长出来。内皮细胞通过温和的三分血化去除,在通过前再培养5天。
分离的腹膜在96孔培养板中播种,并装有钙指示器染料(Fura-2醋氧甲基(AM),用于测量板读卡器设置中的细胞内钙水平。或者,在盖玻片上播种,并安装在细胞室中。在用钙指示器(Cal-520 AM)加载后,可以使用共物显微镜在488纳米和发射波长为510-520 nm时进行钙活成像。
此处描述的方法已用于从原发性脑毛细管腹膜获得第一个细胞内钙测量,表明环状细胞通过 ATP 受到刺激,并且能够在体外收缩。
引言
脑毛细管内皮,连同内皮细胞和星形细胞,构成NVU1,2,3。内皮细胞构成毛细血管的结构基础,形成直径为5-8μm的长圆柱管。内皮细胞零星被围皮覆盖,周围是星形细胞的突起;星细胞末脚。
血脑屏障(BBB)位于脑毛细血管,是大脑和血液之间交换营养物质、气体和废物的主要地点。BBB还保护大脑免受内源和外源性神经毒素的污染,并充当大量药物化合物的传递屏障。屏障功能是制药公司开发中枢神经系统(CNS)药物的重点领域,也是障碍。这激起了对调查NVU在培养中细胞的很大兴趣。脑星形细胞和内皮细胞在一些研究中被培养和描述,而对周来细胞培养的研究和协议是稀疏的。
此前公布的协议在一定程度上描述了脑毛细管的生成,使用一系列不同的方法,如免疫平移5、高和低血糖介质6、荧光激活细胞分选7、密度梯度离心8等。虽然这些方法似乎足以获得过长的区域性,但有些是耗时的,成本昂贵,获得可能不理想,因为文化通道的数量,可以去区分的周分。此外,培养的周利未得到体外信号研究的潜力,直到现在还相当未被探索。
本工作的重点是从孤立的牛脑毛细血管中生成腹膜培养物,以及随后对细胞内钙(一个重要的细胞内第二信使)变化的测量和成像研究进行的后续设置。我们简要地描述了毛细血管与皮质灰质的分离(详情见Helms等人10),以及纯单培养中胸腺的分离和培养,而不受到内皮或胶质细胞的污染。然后,我们提供一个协议,用于在96孔板中播种性,并为钙探针Fura-2 AM提供加载协议。最后,我们介绍了在显微镜培养室中如何将过色物用于实时共合成像,并描述了其方案。
研究方案
1. 为细胞培养准备缓冲液和溶液
- 在4°C下,在50 mL的PBS中溶解5毫克胶原蛋白IV,准备胶原蛋白库存溶液。 将库存溶液分成5 mL部分,储存在-20°C。
- 在5mL的无菌水中溶解5毫克纤维素,准备纤维素库存溶液。将纤维素储存在 -20 °C 下以 500 μL 的等分。 解冻时,将 PBS 添加到 50 mL 的最终体积中,以准备工作解决方案并将其储存在 4°C。
- 准备Dulbecco的改性鹰介质(DMEM)完整的介质,加入50 mL的胎儿牛血清(FBS),5 mL的MEM非必需氨基酸和5 mL的青霉素/链霉素(0.1克/L链霉素硫酸盐和100,000U/L青霉素G钠)到500 mL的DMEM。
- 通过溶解PBS中的肝素钠盐,制备5mg/mL肝素库存溶液,并通过0.2μm过滤器进行灭菌。将库存溶液储存在 4 °C。
- 使用前立即准备生长介质 (GM);将 10 mL 的 DMEM-comp 和 250 μL 的肝素库存溶液混合到 T75-烧瓶中。
2. 从新鲜牛脑分离毛细血管
注:如前面所述,牛脑毛细血管被分离和培养(Helms等人,第10页)。
- 从12个月大的小牛那里收集大脑,然后直接用冰面带到实验室。
- 用手术刀去除脑筋,从大脑中收集所有灰物质。用灰色识别毛脑是覆盖大脑和灰物质的薄膜。
- 使用 40 mL Dounce 组织研磨机在杜尔贝科的修改鹰介质 (DMEM) 中均匀化灰质。用灰物质悬浮液填充组织研磨机的纤细部分 1/5,并添加 DMEM,直到填充纤细部分。
- 通过 160 μm 尼龙网过滤器过滤均质质,将毛细管从自由细胞和较小的组织片段中分离。使用 DMEM-comp 冲洗过滤器。将毛细管取回,将悬浮液池入 50 mL 离心管中。
- 在DMEM-comp中重新增加毛细血管,加入DNase I(170 U/mL)、胶原酶III型(200 U/mL)和三辛(90 U/mL)的酶混合物。将悬浮液留在 37°C 水浴中,以消化毛细管。
- 通过 200 μm 网格滤波器运行悬浮液,并在 FBS 中用 10% 二甲基硫化物 (DMSO) 重新悬浮。将毛细管在-80°C下冷冻过夜,并在第二天将它们移动到液氮中进行长期储存。
注意:可以在这里暂停协议。
3. 牛毛细血管的播种和栽培
- 第 0 天: 将0.7 mL的胶原蛋白IV库存与6.3 mL的PBS混合。将溶液加入 T75 烧瓶中,在室温 (RT) 下将烧瓶留 2 小时,或在 4 °C 下过夜。
- 从烧瓶中去除胶原蛋白溶液,用PBS洗涤三次。
- 添加 7 mL 的纤维素工作溶液,将烧瓶留在 RT 30 分钟。然后,取出纤维素溶液,并在后立即播种毛细管。
- 在30分钟的等待时间中,在37°C水浴中解冻一小瓶毛细管。
- 当毛细管解冻时,立即转移到离心管与30 mEM-comp和离心机5分钟在500 x g 和RT. 从管中去除DMEM-comp,并在10 mL的新鲜DMEM-comp重新悬浮毛细管颗粒。
- 将 10 mL 悬架转移到涂层的 T75 瓶,让毛细管在 37 °C 培养箱中粘附在烧瓶底部 4-6 h,温度为 10% CO2。
注:细胞生长速率高于常规的5%CO2。 - 孵育4-6小时后,在光学显微镜下检查烧瓶。毛细管的分数现在应该附在烧瓶的底部(图1,第0天)。
- 准备转基因,并吸出DMEN-comp介质非常小心从毛细管,并更换它与10 mL的新鲜制造的转基因。
- 第2天: 从毛细管中去除转基因,代之以10 mL的新鲜制造转基因。 此时,在光显微镜下应可以看到毛细管中的细胞外化(图1,第2-3天)。
4. 与牛脑毛细血管分离原发性胸毛
-
第4天: 在光学显微镜下检查毛细管。
注:烧瓶现在应约60-70%的汇合,以提供适当数量的中长(图1,第4天)。如果不是这样,就说是这样。用10mL的新鲜介质代替转基因,将烧瓶留在孵化器中再留一天。 - 吸气介质,并在PBS中轻轻清洗细胞。
- 为内皮细胞添加2 mL解冻的 Trypsin-EDTA,并将烧瓶留在培养箱中1-3分钟。在此期间,经常拿出烧瓶,用显微镜观察。
注:内皮细胞应四舍五入,从烧瓶中分离出来;周分物应可见为具有"幽灵"形态的细胞,并且仍然附着在烧瓶表面。 这是一个棘手而重要的步骤。 必须去除大多数内皮细胞,以避免对单培养物的污染,但长时间的三辛化也可以分离的内皮细胞。试鸣时间可能不时略有不同,因此在治疗过程中用显微镜频繁观察烧瓶至关重要。 - 轻轻敲击烧瓶,当内皮细胞开始四舍五入时,分离松动的内皮细胞。
- 要停止尝试性,请向烧瓶中加入 10 mL 的 DMEM-comp。用介质小心冲洗烧瓶几次,以去除内皮细胞。从烧瓶中吸出内皮细胞悬浮液。内皮细胞现在可用于其他目的。
- 将 10 mL 的 DMEM-comp 添加到烧瓶中。在光显微镜下观察,以确保周利未得到物仍然存在并附着在底部。将烧瓶放回孵化器,让富含字节的养殖者生长。
注:在以下几天观察文化非常重要。如果仍有相当数量的内皮细胞生长另一个尝试性治疗可以执行。 - 允许百分单栽随着DMEM-comp的变化而增长。中等每第二天。在光显微镜下检查细胞的生长(图1,第5-8天)。
5. 生成和储存原牛的单一栽培
-
第8-9天: 在光学显微镜下检查毛细管
注:目前,这些海西特应该已经达到70-80%的汇合,并在烧瓶中的岛屿中生长(图1,第9天)。如果中长的汇合小于70%,则允许细胞再生长一天。与内皮细胞一样,年期末体不会形成一个完整的单层。 - 吸气DMEM-comp和洗与7 mL的PBS的周吸入器。
- 将2 mL的尝试素-EDTA添加到烧瓶中,并将其留在培养箱中2-3分钟。经常将烧瓶放在光学显微镜下,以观察围莉的环状和从烧瓶中分离出来时。当围莉丝开始围起来时,可以轻轻敲击烧瓶以分离细胞。
- 轻轻敲击烧瓶,当围莉开始围起来,分离细胞。
- 将 10 mL 的 DMEM-comp 添加到烧瓶中,以停止三辛化过程。用介质冲洗烧瓶几次,以帮助分离最后一个过花。
- 将 12 mL 电池悬浮液转移到 50 mL 离心管中,用 DMEM-comp 填充高达 30 mL。
- 在 500 x g 和 RT. 吸气 Dmem - comp 时将电池悬浮液离心 5 分钟。小心,不要接触细胞颗粒。将细胞颗粒用 10% DMSO 重新在 3 mL 的 FBS 中。
- 将细胞悬浮液转移到低温;在每个 T75 瓶中添加 1 mL, 因此每 T75 瓶的百花口水总共有 3 瓶。将过氧生物冷冻在-80°C下过夜,并在第二天将它们移动到液氮中进行长期储存。
注:细胞在冷冻前可以计数,以对生存百分比进行稍后的估计。可以在这里暂停协议。
6. 为实验建立一种单一栽培
- 使用与第 3.1-3.4 节所述相同的程序,用胶原蛋白 IV 和纤维素涂装 T75-烧瓶。
- 当烧瓶被涂上纤维素时,在37°C水浴中解冻一小瓶的心状物。
- 将现在解冻的卵热生物从冷冻室转移到离心管,具有 30 mL 的 DMEM-comp。在500 x g、RT下将电池悬浮液离心5分钟。
- 小心吸气介质,将细胞颗粒留在管的底部。在 10 mL DMEM-comp 中重新悬浮颗粒。
- 收集细胞悬浮液并转移到涂层烧瓶中。将烧瓶与中长质留在 37 °C 培养箱中,以 10% CO2 生长。
- 每隔第二天,用10 mL的新鲜DMEM-comp刷新介质。
注:经过5天的生长,中长体应达到约80%的汇合。如果汇合较少,让细胞再生长一两天。细胞现在应该准备好播种,以进行进一步的实验。
7. 在涂层的 96 井板中播种中。
- 稀释胶原蛋白IV,如步骤3.1所述。在96井板中向每一井加入100μL,在RT下孵育2小时,或在4°C下过夜。
- 吸溶液,用PBS洗井三次。
- 将100μL稀释的纤维素添加到每一个井中,并在RT中孵育30分钟。拆下纤维素溶液并立即使用板。
注:根据周分数批次的生长情况,应该有足够的细胞来播种两个板。 - 从培养箱中取出心肺,吸气介质。用 PBS 清洗细胞。
- 将 2 mL 的 trypsin-EDTA 添加到中周数,并遵循与步骤 5.3-5.6 中相同的过程。
- 吸气介质,不伤害细胞颗粒,并在1 mL新鲜DMEM复合中重新悬浮颗粒。
- 拿出12μL的细胞悬浮液,并添加到计数室。在光显微镜下,至少计算 3x3 网格中的 3 个,并使用每个网格的平均细胞计数。
- 使用下面的方程计算应添加到每井的种子10.000个细胞的细胞悬浮量,在96井板。
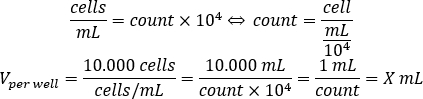
- 将 DMEM-comp 和每个井中计算的细胞悬浮量添加到每个孔中,以达到 200 μL 的最终体积。
- 将96井板放在37°C培养箱中,以10%的CO2。让细胞在2天后改变介质,生长4天。
8. 为 Ca2+ 成像准备缓冲液和解决方案
- 自动起占地面积盖玻片单元室和盖玻片。
- 测定缓冲液:在500 mSS缓冲液中加入1.19克的HPSS缓冲液,最终浓度为10 mM HEPES。将 pH 调整为 7.4。
- 在玻璃小瓶中溶解 0.5 g 的 Pluronic F127 中 2.5 g 无水 DMSO 中,准备 20%(w/v)普卢气 F127 = 1%(v/v)聚氧层铸板油库存溶液。加热至40°C约30分钟或溶解和涡流。加入 25 μL 的聚氧基板油,储存在 RT 中。不要冻结。
- 通过溶解 500 μL 中 500 μL 的 500 μL 中 1 mg 的 Fura-2 AM 库存,准备 2 mM Fura-2 AM 库存。以-20°C的20μL等分储存,防止光线。
- 通过将 20 μL 的 20% Pluronic F-127 = 1% 多氧基脚轮油库存溶液与 20 μL 的 2 mM Fura-2 AM 等分液混合,制备 5 μM Fura-2 AM 装载溶液。加入500μL的测定缓冲液和涡流。将测定缓冲液添加到 8 mL 的最终体积中。解决方案应在使用前立即准备好,并防光。
- 通过溶解 226.7 μL 无水 DMSO 中的 1 mg 来制备 4 mM Cal-520 AM。以-20°C的20μL等分储存,防止光线。
- 通过将 20 μM Cal-520 AM 装载溶液与 20 μL 4 mM Cal-520 等同质混合,制备 20 μM Cal-520 负载溶液,以混合 20 μM Cal-520 等离子。加入500μL的测定缓冲液和涡流。将检测缓冲液添加到 4 mL 的最终体积中。解决方案应在使用前立即准备好,并防光。
9. 在板读卡器设置中,使用 Fura-2 AM 钙指示器染料加载心小
注意:所有解决方案应在实验开始前处于 RT。
- 从培养箱中取出96孔板,从培养箱中取出细胞,从井中吸出培养物。用测定缓冲液清洗细胞两次。
- 在每个井中加入 100 μL 的装载溶液,用锡箔包裹板,避免照片漂白。孵育45分钟,在RT下30转/分摇晃。
注:请勿在 37°C 下装载 Fura-2 AM,因为它可能会装载内部隔间。记得在测定缓冲液中留下带细胞的井,而不是加载缓冲液;这些是用于测量背景荧光的"空白"。 - 吸气缓冲液,用测定缓冲液清洗细胞两次。加入100μL的新鲜检测缓冲液,让细胞在RT下孵育30分钟;这允许 AM-ester 的连续裂解,从而将 Fura-2 AM 困在细胞内。
- 在 Ca2+ 成像之前,用 100 μL 的新鲜检测缓冲液清洗和更换缓冲液。
10. 板读器设置中围热物的井板荧光读数
- 将板读卡器的温度设置为 37 °C,将带电池的 96 井板转移到 样品板 位置。将带激动剂的试剂板放在 试剂板位置 。
- 首先测量电池的负载,以确保在所有油井中均等的 Fura-2 AM 负载。
- 在 340 nm/380 nm 时以激发荧光波长进行测量,在 510 nm 时执行发射波长。将 50 μL 的激动剂以 150 μL/s 的速度从试剂板添加到每个井中,每个井的 细胞处于样品板 位置。
- 保存数据并导出为 xlsx 文件,以进行进一步分析。 图 2 显示了细胞因子 Ca2+响应,测量为两个激发波长之间在一定时间之间的比率,其中背景荧光被减去。
注:板式读卡器需要具有双微孔板读取器,具有"电池托盘"和"样品托盘"的空间,以及集成的移液器系统。
11. 在涂层细胞室中播种过密的膜,用于活成像
注:盖玻片也可以放置在培养井的底部,如上文所述,涂上和播种过面体,然后在实验前安装在腔室中。
- 将盖玻片安装到细胞室中,使其紧固,以避免漏水。
- 稀释胶原蛋白IV,如步骤3.1所述。在每个细胞腔中加入500μL,在RT下孵育2小时,或在4°C下过夜。
- 吸原蛋白溶液,用500μL的PBS洗涤三次。
- 将500μL稀释的纤维素添加到每一个井中,并在RT中孵育30分钟。拆下纤维素溶液,然后直接使用细胞室。
- 同时,拿出与汇合的中西提剂的烧瓶,用7 mL的PBS洗涤。
- 将 2 mL 的 trypsin-EDTA 添加到中周数,并遵循与步骤 5.3-5.6 中相同的过程。
- 按照步骤 8.6-8.7 中的步骤继续。
- 使用下面的方程计算细胞悬浮量,该体积应添加到每个腔室中,以每个腔室播种 90.000 个细胞。
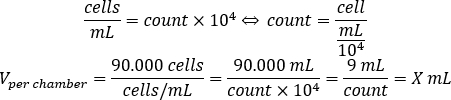
- 在每个腔室中添加 DMEM-comp 和计算的细胞悬浮量,以达到 500 μL 的最终体积。
- 将细胞室放在37°C,10%CO2的培养箱中。让细胞生长6天(或直到汇合)。
注:与塑料相比,在玻璃滑梯上,高利器生长较慢;更多的增长日是必要的。
12. 用Cal-520 AM钙指示器染料装载过小,用于实时成像
注意:所有解决方案应在实验开始前处于 RT。
- 准备 20 μM Cal-520 AM 负载缓冲液:将 20 μL 的 20% Pluronic F-127 = 1% 多氧基脚轮油库存溶液与 20 μL 4 mM Cal-520 等同质液混合。加入500个μL测定缓冲液和涡流。将检测缓冲液添加到 4 mL 的最终体积中。解决方案应在使用前立即准备好,并防光。
注:保护包含 Cal-520 AM 的解决方案免受光照射。 - 从培养箱中取出细胞室,吸气培养素。用测定缓冲液清洗细胞两次。
- 将 500 μL 的装载缓冲液添加到每个腔室中,并在 RT 下孵育 45 分钟。
- 吸气缓冲液,用测定缓冲液洗两次细胞。
- 在每个腔室中加入500μL的新鲜检测缓冲液,并在RT中孵育30分钟,以允许 AM-酯的裂解。
- 在共体显微镜下进行实时成像之前,用 500 μL 的新鲜检测缓冲液更换缓冲液。
13. 细胞内 Ca2+ 水平的实时成像
注:各种显微镜类型可用于成像。可以使用直立或倒置的传统荧光显微镜,以及具有适当激发源(488 nm)和发射过滤器(510-520 nm)的直立或倒置共合激光扫描显微镜。目标应适合荧光,具有高质量和高数值孔径 (NA)。
- 尽可能温和地将细胞室安装在共合显微镜的舞台上,以避免细胞受到干扰。
- 选择 488 nm 的激发波长、515 nm 的发射、5 秒间隔的连续图像采集、512 x 512 像素的 XY 图像大小和测量 2 分钟以测量基线钙信号。
- 使用移液器将 3 μL 的 100 mM ATP 添加到细胞室,并继续顺序图像采集。缓慢而轻轻地执行添加,不干扰制备,使细胞离开焦点。
- 观察变化的程度,并根据需要增加时间间隔约18分钟,直到没有进一步的形态变化(图3)。
- 保存延时图像,并将它们导出为 TIFF 和/或 AVI 文件,以进行进一步分析。
注:一小瓶的中分细胞应能给足够的细胞,用于在1-2 96孔板和几个盖玻片中播种,这意味着您可以为这两种类型的钙测量准备细胞。
结果
牛脑毛细管从新鲜脑组织分离 出来,图1 呈现了毛细管播种和细胞生长在几天内,随后的胸腺细胞纯化。毛细管在第1天完全附着在烧瓶上,第2天内皮发芽变得可见(图1,第2天)。4天后,细胞外生长高度独特(图1,第4a天),内皮细胞根据所述协议通过温和的三辛化被去除。毛细管的残余物在试鸣后可?...
讨论
在这项研究中,我们提出了一种将原发性胸椎动物与牛脑分离的方法。所述协议允许培养这种本来相当不可接近的单元类型。随后获得的细胞培养物是近同质的性年期,以细胞形态和蛋白质表达12为基础,内皮细胞和胶质细胞几乎没有污染。此外,我们演示了一种简单明了的方法,使用两种不同的方法,根据预期结果,用钙染料为 Ca2+成像加载过白剂。
披露声明
提交人声明没有相互竞争的经济利益。
致谢
作者希望感谢伦德贝克基金会关于脑障碍和药物输送的研究倡议(RIBBDD)和西蒙·胡格纳斯家庭基金会的资助。
材料
| Name | Company | Catalog Number | Comments |
| ATP | Tocris | 3245 | |
| Cal-520 AM | AAT Bioquest | 21130 | |
| Cell incubator | Thermo Fisher | ||
| Centrifuge | Thermo Fisher | Heraeus Multifuge 3SR+ | Standard large volume centrifuge for spinning down cells |
| Collagen IV | Sigma Aldrich | C5533 | |
| Confocal laser scanning microscope | Carl Zeiss | Zeiss LSM 510 | Inverted microscope |
| Counting chamber | FastRead | 102 | |
| Coverslip cell chamber | Airekacells | SC15022 | |
| Cremophor EL | Sigma Aldrich | C5135 | Formerly known as Kolliphor EL |
| DMSO | Sigma Aldrich | 471267 | |
| Dulbecco's Modified Eagles Medium | Sigma Aldrich | D0819 | |
| Fetal bovine serum (FBS) | PAA/GE Healthcare | A15-101 | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Fura-2 AM | Thermo Fisher | F1201 | |
| Glass coverslips 22x22 mm | VWR International | 631-0123 | |
| HBSS | Gibco | 14065-049 | |
| Heparin | Sigma Aldrich | H3149 | |
| HEPES | AppliChem Panreac | A1069 | |
| Light microscope | Olympus | Olympus CK2 | Upright light microscope with phase contrast |
| MEM nonessential amino acids | Sigma Aldrich | M7145 | |
| Microplate Reader | BMG LabTech | NOVOstar | |
| PBS | Sigma Aldrich | D8537 | Phosphate-buffered saline |
| penicillin G sodium/streptomycin sulfate | Sigma Aldrich | P0781 | |
| Pluronic F127 | Sigma Aldrich | P2443 | |
| Trypsin-EDTA | Sigma Aldrich | T4299 | |
| T-75 flask | Sigma Aldrich | CLS3972 | |
| 96-well plate | Corning incorporated | 3603 |
参考文献
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: Developmental, Physiological, and Pathological Perspectives, Problems, and Promises. Developmental Cell. 21 (2), 193-215 (2011).
- Abbott, N. J., Ronnback, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Mathiisen, T. M., Lehre, K. P., Danbolt, N. C., Ottersen, O. P. The Perivascular Astroglial Sheath Provides a Complete Covering of the Brain Microvessels: An Electron Microscopic 3D Reconstruction. Glia. 58 (9), 1094-1103 (2010).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Zhou, L., Sohet, F., Daneman, R. Purification of Pericytes from Rodent Optic Nerve by Immunopanning. Cold Spring Harbor Protocols. , 608-617 (2014).
- Liu, G. H., et al. Isolation, Purification, and Cultivation of Primary Retinal Microvascular Pericytes: A Novel Model Using Rats. Microcirculation. 21 (6), 478-489 (2014).
- Nayak, R. C., Herman, I. M. Bovine retinal microvascular pericytes: isolation, propagation, and identification. Methods In Molecular Medicine. 46, 247-263 (2001).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology-Heart and Circulatory Physiology. 302 (1), H69-H84 (2012).
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Helms, H. C., Brodin, B., Milner, R. Methods in Molecular Biology. Cerebral Angiogenesis: Methods and Protocols. 1135, 365-382 (2014).
- Abbracchio, M. P., Burnstock, G., Verkhratsky, A., Zimmermann, H. Purinergic signalling in the nervous system: an overview. Trends in Neurosciences. 32 (1), 19-29 (2009).
- Cai, C., et al. Stimulation-induced rises in cerebral blood flow and local capillary vasoconstriction depend on conducted vascular responses in brain capillaries. PNAS. , (2018).
- Tigges, U., Welser-Alves, J. V., Boroujerdi, A., Milner, R. A novel and simple method for culturing pericytes from mouse brain. Microvascular Research. 84 (1), 74-80 (2012).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant Outgrowth, Propagation and Characterization of Human Pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Orlidge, A., Damore, P. A. Cell specific effects of glycosaminoglycans on the attachment and proliferation of vascular wall components. Microvascular Research. 31 (1), 41-53 (1986).
- Rhinehart, K., Zhang, Z., Pallone, T. L. Ca2+ signaling and membrane potential in descending vasa recta pericytes and endothelia. American Journal of Physiology-Renal Physiology. 283, F852-F860 (2002).
- Bintig, W., et al. Purine receptors and Ca2+ signalling in the human blood-brain barrier endothelial cell line hCMEC/D3. Purinergic Signalling. 8 (1), 71-80 (2012).
- Neuhaus, A. A., Couch, Y., Sutherland, B. A., Buchan, A. M. Novel method to study pericyte contractility and responses to ischaemia in vitro using electrical impedance. Journal of Cerebral Blood Flow and Metabolism. 37 (6), 2013-2024 (2017).
- Kamouchi, M., et al. Calcium influx pathways in rat CNS pericytes. Molecular Brain Research. 126 (2), 114-120 (2004).
- Das, A., et al. ATP Causes Retinal Pericytes to Contract In vitro. Experimental Eye Research. 46, 349-362 (1988).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。