Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Culture des péricytes capillaires cérébraux pour les mesures cytosoliques du calcium et les études d’imagerie calcique
Dans cet article
Résumé
Les péricytes capillaires cérébraux sont des acteurs essentiels dans la régulation des propriétés de la barrière céphalo-cérébrale et du flux sanguin. Ce protocole décrit comment les péricytes capillaires cérébraux peuvent être isolés, cultivés, caractérisés en ce qui concerne le type de cellule et appliqués pour des investigations de signalisation intracellulaire de calcium avec des sondes fluorescentes.
Résumé
Les péricytes sont associés aux cellules endothéliales et à l’endfeet astrocytique dans une structure connue sous le nom d’unité neurovasculaire (NVU). La fonction capillaire de pericyte de cerveau n’est pas entièrement connue. Des péricytes ont été suggérés pour être impliqués dans le développement capillaire, la régulation de l’étanchéité endothéliale de barrière et de l’activité de trancytosis, la régulation du tonus capillaire et pour jouer des rôles cruciaux dans certaines pathologies de cerveau.
Les péricytes sont difficiles à étudier dans le cerveau intact en raison des difficultés à visualiser les processus dans le parenchyme cérébral, ainsi que la proximité avec les autres cellules de l’INN. Le présent protocole décrit une méthode d’isolement et de culture des péricytes capillaires capillaires primaires du cerveau bovin et leur utilisation suivante dans les études d’imagerie calcique, où les effets des agonistes impliqués dans la signalisation cérébrale et les pathologies peuvent être étudiés. Les fragments capillaires corticals sont autorisés à s’attacher au fond des flacons de culture et, après 6 jours, les cellules endothéliales et les péricytes sont sortis des fragments capillaires. Les cellules endothéliales sont enlevées par trypsinisation douce et les péricytes sont cultivés pendant 5 jours supplémentaires avant de passer.
Les péricytes isolés sont ensemencés dans des plaques de culture de 96 puits et chargés du colorant indicateur de calcium (Fura-2 acéoxyméthyle (AM)) pour permettre des mesures des niveaux intracellulaires de calcium dans une configuration de lecteur de plaque. Alternativement, les péricytes sont ensemencés sur des coverslips et montés dans des chambres cellulaires. Après chargement avec l’indicateur de calcium (Cal-520 AM), la formation image vivante de calcium peut être exécutée utilisant la microscopie confocale à une longueur d’onde d’excitation de 488 nm et la longueur d’onde d’émission de 510-520 nm.
La méthode décrite ici a été utilisée pour obtenir les premières mesures intracellulaires de calcium à partir de péricytes capillaires cérébraux primaires, démontrant que les péricytes sont stimulés par ATP et sont capables de se contracter in vitro.
Introduction
Les péricytes capillaires cérébraux, ainsi que les cellules endothéliales et les astrocytes, constituent le NVU1,2,3. Les cellules endothéliales, qui forment la base structurelle des capillaires, forment de longs tubes cylindriques d’un diamètre de 5 à 8 μm. Les cellules endothéliales sont sporadiquement couvertes de péricytes et entourées de saillies d’astrocytes; l’endfeet d’astrocyte.
La barrière céphalo-encéphalique (BBB), située aux capillaires cérébraux, est le principal site d’échange de nutriments, de gaz et de déchets entre le cerveau et le sang. Le BBB protège également le cerveau contre les neurotoxines endogènes et exogènes et sert de barrière pour la livraison d’un grand nombre de composés médicamenteux. La fonction barrière est un domaine d’intérêt, ainsi qu’un obstacle, pour les compagnies pharmaceutiques qui développent des médicaments du système nerveux central (SNC). Cela a suscité un grand intérêt dans l’étude des cellules de l’OND dans la culture4. Les astrocytes cérébraux et les cellules endothéliales ont été cultivés et caractérisés dans un certain nombre d’études, tandis que les études et les protocoles pour la culture péricyte sont clairsemés.
Les protocoles précédemment édités ont décrit la génération des cultures capillaires de péricyte capillaire de cerveau dans une certaine mesure, utilisant une gamme de différentes approches telles que l’immunopannage5,les médias à haut et à faible glucose6,le tri cellulairefluorescent-activé 7,centrifugation de gradient dedensité 8,etc. Bien que ces méthodes semblent suffisantes pour obtenir des cultures de péricytes, certaines prennent beaucoup de temps, coûtent cher et les péricytes obtenus pourraient ne pas être idéales en raison du nombre de passages de culture qui peuvent différencier les péricytes9. En outre, le potentiel des péricytes cultivés dans les études de signalisation in vitro a été assez inexploré jusqu’à présent.
Les travaux actuels portent sur la génération de cultures péricyte à partir de capillaires cérébraux bovins isolés et sur la configuration subséquente pour les mesures et les études d’imagerie des changements dans le calcium intracellulaire, un deuxième messager intracellulaire important. Nous décrivons brièvement l’isolement des capillaires de la matière grise corticale (pour plus de détails voir Helms et coll.10)et l’isolement et la culture des péricytes en monoculture pure sans contamination par des cellules endothéliales ou gliales. Nous fournissons ensuite un protocole pour l’ensemencement des péricytes dans des plaques de 96 puits et des protocoles de chargement pour la sonde de calcium Fura-2 AM. Enfin, nous montrons comment les péricytes peuvent être utilisés en imagerie confocale en temps réel dans les chambres de culture au microscope et décrivons les protocoles pour cela.
Protocole
1. Préparation de tampons et de solutions pour la culture cellulaire
- Préparer la solution de stock de collagène en dissolvant 5 mg de collagène IV du placenta humain dans 50 mL de PBS pendant la nuit à 4 °C. Aliquot la solution de stock en portions de 5 mL et stocker à -20 °C.
- Préparer la solution de stock de fibronectine en dissolvant 5 mg de fibronectine dans 5 mL d’eau stérile pendant la nuit. Conserver les stocks de fibronectine en aliquots de 500 μL à -20 °C. Lors du dégel, ajouter le PBS à un volume final de 50 mL pour préparer la solution de travail et la stocker à 4 °C.
- Préparer le milieu complet de l’aigle modifié (DMEM) de Dulbecco en ajoutant 50 mL de sérum bovin fœtal (FBS), 5 mL d’acides aminés non essentiels MEM et 5 mL de pénicil streptomycine (0,1 g/L de sulfate de streptomycine et 100 000 U/L de pénicilline G sodium) à 500 mL de DMEM.
- Préparer une solution de stock d’héparine de 5 mg/mL en dissolvant le sel de sodium de l’héparine dans le PBS et le passer à travers un filtre de 0,2 μm pour la stérilisation. Conserver la solution de stock à 4 °C.
- Préparer le milieu de croissance (GM) immédiatement avant l’utilisation; mélanger 10 mL de DMEM-comp et 250 μL de solution de stock d’héparine par flacon T75.
2. Isolement des capillaires du cerveau bovin frais
REMARQUE : Les capillaires cérébraux bovins sont isolés et cultivés comme décrit précédemment (Helms et coll.10).
- Recueillir le cerveau des veaux, pas plus de 12 mois, dans un abattoir et apporter directement au laboratoire sur la glace.
- Enlever les méninges et recueillir toute la matière grise du cerveau à l’aide d’un scalpel. Identifiez les méninges comme le film couvrant le cerveau et la matière grise par sa couleur grise.
- Utilisez un broyeur de tissu Dounce de 40 mL pour homogénéiser la matière grise dans le medium aigle modifié (DMEM) de Dulbecco. Remplissez la partie mince du broyeur de tissu 1/5 avec la suspension de matière grise et ajoutez DMEM jusqu’à ce que la partie mince soit remplie.
- Séparez les capillaires des cellules libres et des petits morceaux de tissu par filtration de l’homogénéité à travers un filtre net en nylon de 160 μm. Rincer les filtres avec DMEM-comp. Récupérer les capillaires et mettre les suspensions en tubes centrifugeuses de 50 mL.
- Resuspendez les capillaires dans DMEM-comp et ajoutez un mélange enzymatique de DNase I (170 U/mL), de collagène de type III (200 U/mL) et de trypsine (90 U/mL). Laissez la suspension pendant 1 h dans un bain d’eau de 37 °C pour la digestion des capillaires.
- Exécutez la suspension à travers un filtre à mailles de 200 μm et résuspendez en FBS avec du sulfure de diméthyle (DMSO) de 10 %. Congeler les capillaires pendant la nuit à -80 °C et les déplacer vers l’azote liquide le lendemain pour le stockage à long terme.
REMARQUE : Le protocole peut être mis en pause ici.
3. Ensemencement et élevage de capillaires bovins
- Jour 0: Mélanger 0,7 mL de bouillon de collagène IV avec 6,3 mL de PBS. Ajouter la solution à un flacon T75 et laisser le flacon pendant 2 h à température ambiante (RT) ou le laisser toute la nuit à 4 °C.
- Retirer la solution de collagène du flacon et laver trois fois avec PBS.
- Ajouter 7 mL de solution de travail fibronectine et laisser le flacon pendant 30 min à RT. Ensuite, retirez la solution fibronectine et ensemencez les capillaires immédiatement après.
- Pendant les 30 minutes d’attente, décongeler un flacon de capillaires dans un bain d’eau de 37 °C.
- Lorsque les capillaires sont décongelés, transférer immédiatement dans un tube de centrifugation avec 30 mL de DMEM-comp et centrifugeuse pendant 5 min à 500 x g et RT. Retirer le DMEM-comp du tube et suspendre à nouveau la pastille capillaire dans 10 mL de DMEM-comp frais.
- Transférer la suspension de 10 mL dans le flacon T75 enduit et laisser les capillaires adhérer au fond du flacon pendant 4-6 h dans un incubateur de 37 °C à 10 % de CO2.
REMARQUE : Le taux de croissance cellulaire est plus élevé à 10 % de CO2 que le CO2conventionnel de 5 %. - Après 4-6 h d’incubation inspecter le flacon sous un microscope léger. Des fractions de capillaires doivent maintenant être fixées au fond du flacon(figure 1, jour 0).
- Préparer GM et aspirer le DMEN-comp moyen très prudent à partir des capillaires et le remplacer par 10 mL de GM fraîchement fait.
- Jour 2: Retirer gm des capillaires et remplacer par 10 mL de GM fraîchement fait. L’excroissance cellulaire des capillaires devrait être visible sous un microscope léger à ce stade (figure 1, jour 2-3).
4. Isolement des péricytes primaires des capillaires cérébraux bovins
-
Jour 4: Inspecter les capillaires au microscope léger.
REMARQUE : Le flacon doit maintenant être d’environ 60 à 70 % confluent pour fournir une quantité appropriée de péricytes(figure 1,jour 4). Si ce n’est pas le cas; remplacer le GM par 10 mL de milieu frais et laisser le flacon dans l’incubateur pour un autre jour. - Aspirer le milieu et laver les cellules doucement dans PBS.
- Ajouter 2 mL de Trypsin-EDTA décongelé pour les cellules endothéliales et laisser le flacon dans l’incubateur pendant 1-3 min. Sortez fréquemment le flacon et observez avec le microscope pendant cette période.
REMARQUE : Les cellules endothéliales doivent se arrondir et se détacher du flacon; les péricytes doivent être visibles sous forme de cellules avec une morphologie « fantôme » et encore être fixés à la surface du flacon. Il s’agit d’une étape délicate et importante. Il est essentiel d’enlever la plupart des cellules endothéliales pour éviter la contamination de la monoculture péricyte, mais la trypsinisation prolongée peut également détacher les péricytes. Le temps de trypsinisation peut varier légèrement de temps en temps, et il est donc de la plus haute importance d’observer fréquemment le flacon avec le microscope pendant le traitement. - Appuyez doucement sur le flacon, lorsque les cellules endothéliales ont commencé à arrondir, pour détacher les cellules endothéliales desserrées.
- Pour arrêter la trypsinisation, ajouter 10 mL de DMEM-comp au flacon. Rincer soigneusement le flacon à quelques reprises avec le milieu pour enlever les cellules endothéliales. Aspirer la suspension des cellules endothéliales du flacon. Les cellules endothéliales peuvent maintenant être utilisées à d’autres fins.
- Ajouter 10 mL de DMEM-comp au flacon. Regardez sous le microscope léger pour vous assurer que les péricytes sont toujours présents et fixés au fond. Remettre le flacon dans l’incubateur pour permettre à la culture enrichie de péricyte de croître.
REMARQUE : Il est important d’observer la culture au cours des jours suivants. S’il ya encore une bonne quantité de cellules endothéliales de plus en plus un autre trypsine-traitement peut être effectuée. - Permettre à la monoculture péricyte de croître avec le changement de DMEM-comp. moyen tous les deux jours. Vérifiez la croissance des cellules au microscope léger(figure 1,jour 5-8).
5. Production et stockage d’une monoculture de péricytes bovins primaires
-
Jour 8-9: Inspecter les capillaires au microscope léger
REMARQUE : Les péricytes devraient maintenant avoir atteint une confluence de 70 à 80 % et se développer dans les îles du flacon(figure 1,jour 9). Si la confluence des péricytes est inférieure à 70%, laissez les cellules se développer pendant un autre jour. Les péricytes ne formeront pas un monocouche complet comme le feraient les cellules endothéliales. - Aspirer DMEM-comp et laver les péricytes avec 7 mL de PBS.
- Ajouter 2 mL de trypsine-EDTA au flacon et le laisser dans l’incubateur pendant 2-3 min. Placez fréquemment le flacon sous le microscope léger pour observer quand les péricytes s’arrondir et se détacher de la fiole. Lorsque les péricytes ont commencé à arrondir, le flacon peut être doucement tapé pour détacher les cellules.
- Appuyez doucement sur le flacon, lorsque les péricytes ont commencé à arrondir, pour détacher les cellules.
- Ajouter 10 mL de DMEM-comp au flacon pour arrêter le processus de trypsinisation. Rincer le flacon à quelques reprises avec le milieu pour aider à détacher les derniers péricytes.
- Transférer la suspension cellulaire de 12 mL dans un tube de centrifugation de 50 mL et remplir jusqu’à 30 mL de DMEM-comp.
- Centrifugeuse de la suspension cellulaire pendant 5 min à 500 x g et RT. Aspirer le DMEM-comp. soigneusement sans toucher la pastille cellulaire. Resuspendez la pastille cellulaire dans 3 mL de FBS avec 10% de DMSO.
- Transférer la suspension cellulaire en cryovials; ajouter 1 mL à chacun, de sorte qu’il y aura un total de 3 flacons par T75-flacon de péricytes. Congeler les péricytes à -80 °C pendant la nuit et les déplacer vers l’azote liquide le lendemain pour le stockage à long terme.
REMARQUE : Les cellules peuvent être comptées avant de geler pour une estimation ultérieure du pourcentage de survie. Le protocole peut être mis en pause ici.
6. Mise en place d’une monoculture péricyte pour les expériences
- Enduire un flacon T75 de collagène IV et de fibronectine en utilisant la même procédure que mentionnée dans la section 3.1-3.4.
- Pendant que le flacon est recouvert de fibronectine, décongeler un flacon de péricytes dans un bain d’eau de 37 °C.
- Transférer les péricytes maintenant décongelés du cryovial dans un tube de centrifugation avec 30 mL de DMEM-comp. Centrifugeuse de la suspension cellulaire pendant 5 min à 500 x g,RT.
- Aspirez soigneusement le milieu, en laissant la pastille cellulaire au fond du tube. Suspendre à nouveau la pastille dans 10 mL DMEM-comp.
- Recueillir et transférer la suspension cellulaire dans le flacon enduit. Laissez le flacon avec des péricytes pousser dans un incubateur de 37 °C à 10 % de CO2.
- Tous les deux jours, rafraîchissez le milieu avec 10 mL de DMEM-comp frais.
REMARQUE : Après 5 jours de croissance, les péricytes devraient avoir atteint environ 80 % de confluence. Si la confluence est inférieure, laissez les cellules se développer pendant un autre jour ou deux. Les cellules devraient maintenant être prêtes pour l’ensemencement pour d’autres expériences.
7. Ensemencement des péricytes dans une plaque enduite de 96 puits
- Diluer le collagène IV tel que décrit à l’étape 3.1. Ajouter 100 μL à chaque puits dans une assiette de 96 puits et incuber pendant 2 h à RT ou toute la nuit à 4 °C.
- Aspirer la solution et laver les puits trois fois avec PBS.
- Ajouter 100 μL de fibronectine diluée à chaque puits et incuber à RT pendant 30 min. Retirez la solution fibronectine et utilisez la plaque immédiatement.
REMARQUE : Selon la croissance du lot de péricyte, il devrait y avoir suffisamment de cellules pour l’ensemencement de deux plaques. - Sortez les péricytes de l’incubateur et aspirez le milieu. Laver les cellules avec du PBS.
- Ajouter 2 mL de trypsine-EDTA aux péricytes et suivre la même procédure qu’à l’étape 5.3-5.6.
- Aspirer le milieu, sans nuire à la pastille cellulaire et re-suspendre la pastille dans 1 mL de DMEM-comp frais.
- Sortez 12 μL de suspension cellulaire et ajoutez-le à une chambre de comptage. Au microscope léger, comptez au moins 3 grilles 3x3 et utilisez le nombre moyen de cellules par grille.
- Utilisez l’équation ci-dessous pour calculer le volume de suspension cellulaire qui devrait être ajouté à chaque puits pour ensemencer 10.000 cellules par puits, dans la plaque de 96 puits.
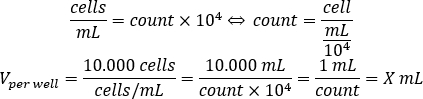
- Ajoutez DMEM-comp et le volume calculé de suspension cellulaire dans chaque puits pour atteindre un volume final de 200 μL.
- Placer la plaque de 96 puits dans un incubateur de 37 °C à 10 % de CO2. Laissez les cellules se développer pendant 4 jours avec un changement de milieu après 2 jours.
8. Préparation de tampons et de solutions pour Ca2+-imaging
- Autoclave coverslip chambres cellulaires et coverslips.
- Tampon d’essai : Ajouter 1,19 g de HEPES à 500 mL de tampon HBSS pour une concentration finale de 10 mM HEPES. Réglez le pH à 7,4.
- Préparer 20% (w/v) Pluronic F127 + 1% (v/v) solution de stock d’huile de ricin polyethoxylatée en dissolvant 0,5 g de solution Pluronique F127 en 2,5 mL de DMSO anhydre dans un flacon de verre. Chauffer à 40 °C pendant environ 30 minutes ou jusqu’à dissolution et vortex. Ajouter 25 μL d’huile de ricin polyéthoxylatée et conserver à RT. Ne pas geler.
- Préparer 2 mM de bouillon Fura-2 AM en dissolvant 1 mg dans 500 μL de DMSO anhydre. Conserver en aliquots de 20 μL à -20 °C à l’abri de la lumière.
- Préparer 5 μM Fura-2 AM solution de chargement en mélangeant 20 μL de 20% Pluronique F-127 + 1% polyethoxylated solution de stock d’huile de ricin avec le 20 μL de 2 mM Fura-2 AM aliquot. Ajouter 500 μL de tampon d’analyse et de vortex. Ajouter le tampon d’essai à un volume final de 8 mL. La solution doit être préparée immédiatement avant l’utilisation et protégée de la lumière.
- Préparer 4 mM Cal-520 AM en dissolvant 1 mg dans 226,7 μL de DMSO anhydre. Conserver en aliquots de 20 μL à -20 °C à l’abri de la lumière.
- Préparer 20 μM Cal-520 AM solution de chargement en mélangeant 20 μL de 20% Pluronique F-127 + 1% polyethoxylated solution de stock d’huile de ricin avec le 20 μL 4 mM Cal-520 aliquot. Ajouter 500 μL de tampon d’analyse et de vortex. Ajouter le tampon d’essai à un volume final de 4 mL. La solution doit être préparée immédiatement avant l’utilisation et protégée de la lumière.
9. Chargement de péricytes avec colorant indicateur de calcium Fura-2 AM dans une configuration plaque-lecteur
REMARQUE : Toutes les solutions doivent être à RT avant le début de l’expérience.
- Sortez la plaque de 96 puits avec des cellules de l’incubateur et aspirez le milieu des puits. Lavez les cellules deux fois avec un tampon d’essai.
- Ajouter 100 μL de solution de chargement à chaque puits et envelopper la plaque avec du papier d’aluminium, pour éviter le blanchiment photo. Incuber pendant 45 min avec 30 tr/min secouant à RT.
REMARQUE : Ne chargez pas Fura-2 AM à 37 °C, car il peut charger des compartiments internes. N’oubliez pas de laisser les puits avec des cellules dans le tampon d’essai au lieu de charger tampon; ce sont les « blancs » utilisés pour mesurer la fluorescence de fond. - Aspirer le tampon de chargement et laver les cellules avec tampon d’essai deux fois. Ajouter 100 μL de tampon d’essai frais et laisser les cellules couver pendant 30 min à RT; cela permet un clivage continu de l’AM-ester et donc le piégeage fura-2 AM à l’intérieur des cellules.
- Avant l’imagerie Ca2+,lavez et remplacez le tampon par 100 μL de tampon d’analyse frais.
10. Lecture de fluorescence de puits-plaque des péricytes dans une configuration de plaque-lecteur
- Réglez la température du lecteur de plaque à 37 °C et transférez la plaque de 96 puits avec des cellules à la position de la plaque d’échantillon. Placez la plaque de reagent avec agoniste à la position de plaque de reagent.
- Commencez par mesurer la charge des cellules pour assurer une charge égale de Fura-2 AM dans tous les puits.
- Effectuez les mesures avec la longueur d’onde de fluorescence d’excitation à 340 nm/380 nm et la longueur d’onde d’émission à 510 nm. Ajouter 50 μL d’agoniste à une vitesse de 150 μL/s de la plaque de reagent à chaque puits avec des cellules en position de plaque d’échantillon.
- Enregistrez les données et exportez sous forme de fichiers xlsx pour une analyse plus approfondie. La figure 2 montre la réponse cytostolique Ca2+mesurée comme le rapport entre les deux longueurs d’onde d’excitation au fil du temps, où la fluorescence de fond est soustraite.
REMARQUE : Le lecteur de plaques doit être un lecteur double microplaque avec de la place pour un « plateau cellulaire » et un « plateau d’échantillons » et un système de pipettor intégré.
11. Ensemencement de péricytes dans une chambre cellulaire enduite pour l’imagerie vivante
REMARQUE : Les coverslips peuvent également être placés au fond des puits de culture, enduits et ensemencés de péricytes comme décrit ci-dessus, puis montés dans la chambre avant les expériences.
- Montez un coverslip dans la chambre cellulaire et le rendre serré pour éviter les fuites.
- Diluer le collagène IV tel que décrit à l’étape 3.1. Ajouter 500 μL à chaque chambre cellulaire et incuber pendant 2 h à RT ou toute la nuit à 4 °C.
- Aspirer la solution de collagène et laver les chambres trois fois avec 500 μL de PBS.
- Ajouter 500 μL de fibronectine diluée à chaque puits et incuber à RT pendant 30 min. Retirez la solution fibronectine et utilisez la chambre cellulaire tout de suite après.
- Entre-temps, sortir le flacon avec des péricytes confluents et laver avec 7 mL de PBS.
- Ajouter 2 mL de trypsine-EDTA aux péricytes et suivre la même procédure qu’à l’étape 5.3-5.6.
- Procédez en suivant les mêmes étapes qu’à l’étape 8.6-8.7.
- Utilisez l’équation ci-dessous pour calculer le volume de suspension cellulaire, qui doit être ajouté à chaque chambre pour ensemencer 90.000 cellules par chambre.
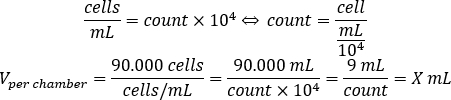
- Ajoutez DMEM-comp et le volume calculé de suspension cellulaire dans chaque chambre pour atteindre un volume final de 500 μL.
- Placer les chambres cellulaires dans l’incubateur à 37 °C, 10 % de CO2. Laissez les cellules se développer pendant 6 jours (ou jusqu’à ce qu’elles soient confluentes).
REMARQUE : Les péricytes poussent plus lentement sur les glissières de verre que sur le plastique; plus de jours de croissance sont nécessaires.
12. Chargement de péricytes avec colorant indicateur cal-520 AM de calcium pour l’imagerie vivante
REMARQUE : Toutes les solutions doivent être à RT avant le début de l’expérience.
- Préparer le tampon de chargement Cal-520 AM de 20 μM : Mélangez 20 μL de 20 % pluronique F-127 + 1 % de solution de stock d’huile de ricin polyéthoxylatée avec la solution de stock d’huile de ricin de 20 μL 4 mM Cal-520 aliquot. Ajouter 500 tampons d’analyse de μL et vortex. Ajouter le tampon d’essai à un volume final de 4 mL. La solution doit être préparée immédiatement avant l’utilisation et protégée de la lumière.
REMARQUE : Protégez les solutions contenant cal-520 AM contre l’exposition à la lumière. - Sortez les chambres cellulaires de l’incubateur et aspirez le milieu. Lavez les cellules deux fois avec un tampon d’essai.
- Ajouter 500 μL de tampon de chargement à chaque chambre et incuber à RT pendant 45 min.
- Aspirer le tampon de chargement et laver les cellules deux fois avec tampon d’essai.
- Ajouter 500 μL de tampon d’essai frais à chaque chambre et incuber pendant 30 min à RT pour permettre le clivage de l’AM-ester.
- Remplacez le tampon par 500 μL de tampon d’analyse frais avant d’effectuer l’imagerie en direct au microscope confocal.
13. Imagerie en direct des niveaux intracellulaires Ca2+
REMARQUE : Une variété de types de microscope peuvent être utilisés pour l’imagerie. Des microscopes conventionnels de fluorescence droits ou inversés, ainsi que des microscopes à balayage laser confocaux droits ou inversés avec source d’excitation appropriée (488 nm) et des filtres d’émission (510-520 nm) peuvent être utilisés. Les objectifs devraient être adaptés à la fluorescence et être de haute qualité et avec une ouverture numérique élevée (NA).
- Monter la chambre cellulaire sur la scène du microscope confocal aussi doux que possible, afin d’éviter la perturbation des cellules.
- Sélectionnez une longueur d’onde excitation de 488 nm, émission à 515 nm, acquisition d’image séquentielle avec intervalles de 5 secondes, une taille d’image XY de 512 x 512 pixels et mesurez pendant 2 min pour mesurer les signaux de calcium de base.
- Ajouter 3 μL de 100 mM ATP à la chambre cellulaire avec une pipette, et poursuivre l’acquisition d’image séquentielle. Effectuez l’addition lentement et doucement pour ne pas perturber la préparation et déplacer les cellules hors de discussion.
- Observez le degré de changements et augmentez l’intervalle de temps au fil du temps au besoin pendant environ 18 minutes jusqu’à ce qu’aucun autre changement morphologique ne soit noté (figure 3).
- Enregistrez les images en accéléré et exportez-les sous forme de fichiers TIFF et/ou AVI pour une analyse plus approfondie.
REMARQUE : Un flacon de péricytes devrait donner suffisamment de cellules pour l’ensemencement dans 1-2 plaques de 96 puits et plusieurs coverslips, ce qui signifie que vous pouvez préparer des cellules pour les deux types de calcium-mesures.
Résultats
Les capillaires du cerveau bovin ont été isolés du tissu cérébral frais et la figure 1 présente l’ensemencement capillaire et l’excroissance cellulaire pendant des jours et la purification subséquente des péricytes. Les capillaires sont entièrement fixés au flacon au jour 1 et le jour 2, la germination endothéliale est devenue visible (figure 1, jour 2). Après 4 jours, l’excroissance cellulaire est très distinc...
Discussion
Dans cette étude, nous avons présenté une méthode pour isoler les péricytes primaires des cerveaux bovins. Le protocole décrit permet la culture de ce type de cellule autrement plutôt inaccessible. La culture cellulaire obtenue par la suite était une population presque homogène de péricytes, avec peu ou pas de contamination avec des cellules endothéliales et des cellules gliales basées sur la morphologie cellulaire et l’expression protéique12. En outre, nous avons démontré une mé...
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Les auteurs souhaitent souligner le financement de l’initiative de recherche de la Fondation Lundbeck sur les barrières cérébrales et la livraison de médicaments (RIBBDD) et de la Fondation de la famille Simon Hougners.
matériels
| Name | Company | Catalog Number | Comments |
| ATP | Tocris | 3245 | |
| Cal-520 AM | AAT Bioquest | 21130 | |
| Cell incubator | Thermo Fisher | ||
| Centrifuge | Thermo Fisher | Heraeus Multifuge 3SR+ | Standard large volume centrifuge for spinning down cells |
| Collagen IV | Sigma Aldrich | C5533 | |
| Confocal laser scanning microscope | Carl Zeiss | Zeiss LSM 510 | Inverted microscope |
| Counting chamber | FastRead | 102 | |
| Coverslip cell chamber | Airekacells | SC15022 | |
| Cremophor EL | Sigma Aldrich | C5135 | Formerly known as Kolliphor EL |
| DMSO | Sigma Aldrich | 471267 | |
| Dulbecco's Modified Eagles Medium | Sigma Aldrich | D0819 | |
| Fetal bovine serum (FBS) | PAA/GE Healthcare | A15-101 | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Fura-2 AM | Thermo Fisher | F1201 | |
| Glass coverslips 22x22 mm | VWR International | 631-0123 | |
| HBSS | Gibco | 14065-049 | |
| Heparin | Sigma Aldrich | H3149 | |
| HEPES | AppliChem Panreac | A1069 | |
| Light microscope | Olympus | Olympus CK2 | Upright light microscope with phase contrast |
| MEM nonessential amino acids | Sigma Aldrich | M7145 | |
| Microplate Reader | BMG LabTech | NOVOstar | |
| PBS | Sigma Aldrich | D8537 | Phosphate-buffered saline |
| penicillin G sodium/streptomycin sulfate | Sigma Aldrich | P0781 | |
| Pluronic F127 | Sigma Aldrich | P2443 | |
| Trypsin-EDTA | Sigma Aldrich | T4299 | |
| T-75 flask | Sigma Aldrich | CLS3972 | |
| 96-well plate | Corning incorporated | 3603 |
Références
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: Developmental, Physiological, and Pathological Perspectives, Problems, and Promises. Developmental Cell. 21 (2), 193-215 (2011).
- Abbott, N. J., Ronnback, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Mathiisen, T. M., Lehre, K. P., Danbolt, N. C., Ottersen, O. P. The Perivascular Astroglial Sheath Provides a Complete Covering of the Brain Microvessels: An Electron Microscopic 3D Reconstruction. Glia. 58 (9), 1094-1103 (2010).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Zhou, L., Sohet, F., Daneman, R. Purification of Pericytes from Rodent Optic Nerve by Immunopanning. Cold Spring Harbor Protocols. , 608-617 (2014).
- Liu, G. H., et al. Isolation, Purification, and Cultivation of Primary Retinal Microvascular Pericytes: A Novel Model Using Rats. Microcirculation. 21 (6), 478-489 (2014).
- Nayak, R. C., Herman, I. M. Bovine retinal microvascular pericytes: isolation, propagation, and identification. Methods In Molecular Medicine. 46, 247-263 (2001).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology-Heart and Circulatory Physiology. 302 (1), H69-H84 (2012).
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Helms, H. C., Brodin, B., Milner, R. Methods in Molecular Biology. Cerebral Angiogenesis: Methods and Protocols. 1135, 365-382 (2014).
- Abbracchio, M. P., Burnstock, G., Verkhratsky, A., Zimmermann, H. Purinergic signalling in the nervous system: an overview. Trends in Neurosciences. 32 (1), 19-29 (2009).
- Cai, C., et al. Stimulation-induced rises in cerebral blood flow and local capillary vasoconstriction depend on conducted vascular responses in brain capillaries. PNAS. , (2018).
- Tigges, U., Welser-Alves, J. V., Boroujerdi, A., Milner, R. A novel and simple method for culturing pericytes from mouse brain. Microvascular Research. 84 (1), 74-80 (2012).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant Outgrowth, Propagation and Characterization of Human Pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Orlidge, A., Damore, P. A. Cell specific effects of glycosaminoglycans on the attachment and proliferation of vascular wall components. Microvascular Research. 31 (1), 41-53 (1986).
- Rhinehart, K., Zhang, Z., Pallone, T. L. Ca2+ signaling and membrane potential in descending vasa recta pericytes and endothelia. American Journal of Physiology-Renal Physiology. 283, F852-F860 (2002).
- Bintig, W., et al. Purine receptors and Ca2+ signalling in the human blood-brain barrier endothelial cell line hCMEC/D3. Purinergic Signalling. 8 (1), 71-80 (2012).
- Neuhaus, A. A., Couch, Y., Sutherland, B. A., Buchan, A. M. Novel method to study pericyte contractility and responses to ischaemia in vitro using electrical impedance. Journal of Cerebral Blood Flow and Metabolism. 37 (6), 2013-2024 (2017).
- Kamouchi, M., et al. Calcium influx pathways in rat CNS pericytes. Molecular Brain Research. 126 (2), 114-120 (2004).
- Das, A., et al. ATP Causes Retinal Pericytes to Contract In vitro. Experimental Eye Research. 46, 349-362 (1988).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon