Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Cultivo de pericitos capilares cerebrales para mediciones de calcio citosólico y estudios de imágenes de calcio
En este artículo
Resumen
Los pericitos capilares cerebrales son actores esenciales en la regulación de las propiedades de la barrera hematoencefálica y el flujo sanguíneo. Este protocolo describe cómo los pericitos capilares cerebrales pueden ser aislados, cultivados, caracterizados con respecto al tipo de célula y aplicados para investigaciones de señalización de calcio intracelular con sondas fluorescentes.
Resumen
Los pericitos se asocian con células endoteliales y endfeet astrocíticos en una estructura conocida como unidad neurovascular (NVU). La función del pericito capilar cerebral no se conoce completamente. Se ha sugerido que los pericitos participan en el desarrollo capilar, la regulación de la opresión de la barrera endotelial y la actividad de la transcitosa, la regulación del tono capilar y desempeñan un papel crucial en ciertas patologías cerebrales.
Los pericitos son difíciles de investigar en el cerebro intacto debido a las dificultades en la visualización de los procesos en el parénquima cerebral, así como la proximidad a las otras células de la NVU. El presente protocolo describe un método para el aislamiento y el cultivo de pericitos capilares primarios del cerebro bovino y su siguiente uso en estudios de imágenes de calcio, donde se pueden investigar los efectos de los agonistas involucrados en la señalización cerebral y las patologías. Se permite que los fragmentos capilares corticales se adhieran al fondo de los matraces de cultivo y, después de 6 días, las células endoteliales y los pericitos han crecido a partir de los fragmentos capilares. Las células endoteliales se eliminan mediante la trippsinación suave y los pericitos se cultivan durante 5 días adicionales antes de la transeúncia.
Los pericitos aislados se siembran en placas de cultivo de 96 pozos y se cargan con el tinte indicador de calcio (Fura-2 acetoximetil (AM)) para permitir mediciones de los niveles de calcio intracelular en una configuración del lector de placas. Alternativamente, los pericitos se siembran en los cubreobjetos y se montan en cámaras celulares. Después de la carga con el indicador de calcio (Cal-520 AM), las imágenes en vivo de calcio se pueden realizar utilizando microscopía confocal a una longitud de onda de excitación de 488 nm y una longitud de onda de emisión de 510-520 nm.
El método descrito aquí se ha utilizado para obtener las primeras mediciones intracelulares de calcio de pericitos capilares primarios del cerebro, demostrando que los pericitos se estimulan a través de ATP y son capaces de contraerse in vitro.
Introducción
Los pericitos capilares cerebrales, junto con las células endoteliales y los astrocitos, constituyen el NVU1,2,3. Las células endoteliales, que forman la base estructural de los capilares, forman largos tubos cilíndricos con un diámetro de 5-8 m. Las células endoteliales están esporádicamente cubiertas de pericitos y rodeadas de protuberancias de astrocitos; el final del astrocito.
La barrera hematoencefálica (BBB), situada en los capilares cerebrales, es el sitio principal para el intercambio de nutrientes, gases y productos de desecho entre el cerebro y la sangre. El BBB también protege el cerebro de las neurotoxinas endógenas y exógenas y sirve como una barrera para la entrega de un gran número de compuestos de drogas. La función de barrera es un área de enfoque, así como un obstáculo, para las compañías farmacéuticas que desarrollan medicamentos del sistema nervioso central (SNC). Esto ha suscitado un gran interés en investigar las células de la NVU en el cultivo4. Los astrocitos cerebrales y las células endoteliales se han cultivado y caracterizado en una serie de estudios, mientras que los estudios y protocolos para el cultivo de pericitos son escasos.
Los protocolos publicados anteriormente han descrito la generación de cultivos de pericito capilar cerebral hasta cierto punto, utilizando una gama de enfoques diferentes como inmunopanning5,medios de alta y baja glucosa6,clasificación celular activada por fluorescentes7, centrifugación de gradiente de densidad8,etc. Aunque estos métodos parecen suficientes para obtener cultivos de pericitos, algunos consumen mucho tiempo, son costosos y los pericitos obtenidos podrían no ser ideales debido al número de pasajes de cultivo que pueden des-diferenciar los pericitos9. Además, el potencial de los pericitos cultivados en estudios de señalización in vitro ha sido bastante inexplorado hasta ahora.
El presente trabajo se centra en la generación de cultivos de pericitos a partir de capilares cerebrales bovinos aislados y la posterior configuración para mediciones y estudios por imágenes de cambios en el calcio intracelular, un importante segundo mensajero intracelular. Describimos brevemente el aislamiento de capilares de materia gris cortical (para más detalles ver Helms et al.10) y el aislamiento y cultivo de pericitos en monocultivo puro sin contaminación con células endoteliales o gliales. A continuación, proporcionamos un protocolo para la siembra de pericitos en placas de 96 pozos y protocolos de carga para la sonda de calcio Fura-2 AM. Por último, mostramos cómo se pueden utilizar pericitos en imágenes confocales en tiempo real en cámaras de cultivo de microscopio y describimos los protocolos para ello.
Protocolo
1. Preparación de tampones y soluciones para el cultivo celular
- Preparar la solución de stock de colágeno disolviendo 5 mg de colágeno IV de la placenta humana en 50 ml de PBS durante la noche a 4 oC. Aliquot la solución de stock en porciones de 5 ml y almacenar a -20 oC.
- Preparar la solución de stock de fibronectina disolviendo 5 mg de fibronectina en 5 ml de agua estéril durante la noche. Conservar las existencias de fibronectina en alícuotas de 500 oL a -20 oC. Al descongelar, añadir PBS a un volumen final de 50 ml para preparar la solución de trabajo y almacenarla a 4 oC.
- Preparar el medio de águila modificada de Dulbecco (DMEM) añadiendo 50 ml de suero bovino fetal (FBS), 5 ml de aminoácidos no esenciales MEM y 5 ml de penicilina/estreptomicina (0,1 g/L de sulfato de estreptomicina y 100.000 U/L de penicilina Sódica G) a 500 mL de DMEM.
- Preparar la solución de heparina de 5 mg/ml disolviendo la sal sódica de heparina en PBS y pasarla a través de un filtro de 0,2 m para la esterilización. Almacene la solución de stock a 4oC.
- Preparar el medio de crecimiento (GM) inmediatamente antes de su uso; mezclar 10 ml de DMEM-comp y 250 ml de solución en stock de heparina por T75-flask.
2. Aislamiento de capilares del cerebro bovino fresco
NOTA: Los capilares cerebrales bovinos se aíslan y se cultivan como se ha descrito anteriormente (Helms et al.10).
- Recoger cerebros de terneros, no mayores de 12 meses de edad, de un matadero y llevar directamente al laboratorio sobre hielo.
- Retire las meninges y recoja toda la materia gris del cerebro usando un bisturí. Identifique las meninges como la película que cubre el cerebro y la materia gris por su color gris.
- Utilice una amoladora de tejido Dounce de 40 ml para homogeneizar la materia gris en el medio de águila modificada (DMEM) de Dulbecco. Llene la parte delgada de la amoladora de tejido 1/5 con suspensión de materia gris y agregue DMEM hasta que se llene la parte delgada.
- Separe los capilares de las células libres y las piezas de tejido más pequeñas por filtración del homogenerato a través de un filtro de red de nylon de 160 m. Vacíe los filtros con DMEM-comp. Recuperar los capilares y agrupar las suspensiones en tubos de centrifugación de 50 ml.
- Resuspender los capilares en DMEM-comp y añadir una mezcla enzimática de DNase I (170 U/mL), colagenasa tipo III (200 U/ml) y tripina (90 U/mL). Dejar la suspensión durante 1 h en un baño de agua a 37oC para la digestión de los capilares.
- Ejecute la suspensión a través de un filtro de malla de 200 m y resuspend en FBS con un 10% de sulfóxido de dimetil (DMSO). Congele los capilares durante la noche a -80 oC y muévalos al nitrógeno líquido al día siguiente para su almacenamiento a largo plazo.
NOTA: El protocolo se puede pausar aquí.
3. Siembra y cultivo de capilares bovinos
- Día 0: Mezclar 0,7 ml de colágeno IV con 6,3 ml de PBS. Añadir la solución a un matraz T75 y dejar el matraz durante 2 h a temperatura ambiente (RT) o dejarlo durante la noche a 4oC.
- Retire la solución de colágeno del matraz y lávela tres veces con PBS.
- Añadir 7 ml de solución de trabajo de fibronectina y dejar el matraz durante 30 minutos en RT. A continuación, retire la solución de fibronectina y sembra los capilares inmediatamente después.
- Durante el tiempo de espera de 30 minutos, descongele un vial de capilares en un baño de agua de 37oC.
- Cuando los capilares se descongelen, transfiera inmediatamente a un tubo de centrifugación con 30 ml de DMEM-comp y centrífuga durante 5 min a 500 x g y RT. Retire DMEM-comp del tubo y vuelva a suspender el capilar-pellet en 10 ml de DMEM-comp fresco.
- Transfiera la suspensión de 10 ml al matraz T75 recubierto y deje que los capilares se adhieran a la parte inferior del matraz durante 4-6 h en una incubadora de 37oC al 10% co2.
NOTA: La tasa de crecimiento celular es mayor en 10% CO2 en lugar del 5% convencional de CO2. - Después de 4-6 h de incubación inspeccionar el matraz bajo un microscopio de luz. Ahora las fracciones de capilares deben estar unidas a la parte inferior del matraz(Figura 1, día 0).
- Preparar GM y aspirar el medio DMEN-comp muy cuidadoso de los capilares y reemplazarlo con 10 ml de GM recién hecho.
- Día 2: Retire el GM de los capilares y sustitúyalo con 10 ml de GM recién hecho. El crecimiento celular de los capilares debe ser visible bajo un microscopio de luz en este punto(Figura 1, día 2-3).
4. Aislamiento de pericitos primarios de capilares cerebrales bovinos
-
Día 4: Inspeccione los capilares bajo un microscopio de luz.
NOTA: El matraz debe ser ahora aproximadamente 60-70% confluente para proporcionar una cantidad adecuada de pericitos (Figura 1, día 4). Si este no es el caso; sustituir el GM por 10 ml de medio fresco y dejar el matraz en la incubadora durante otro día. - Aspirar el medio y lavar las células suavemente en PBS.
- Añadir 2 ml de Trypsin-EDTA descongelado para células endoteliales y dejar el matraz en la incubadora durante 1-3 min. Saque el matraz con frecuencia y observe con el microscopio durante este período de tiempo.
NOTA: Las células endoteliales deben redondear hacia arriba y separarse del matraz; pericitos deben ser visibles como células con un "fantasma" -morfología y todavía deben estar unidos a la superficie del matraz. Este es un paso complicado e importante. Es esencial eliminar la mayoría de las células endoteliales para evitar la contaminación del monocultivo de pericitos, pero la trippsinación prolongada también puede separar los per pericitos. El tiempo de tripsinación puede variar ligeramente de vez en cuando, por lo que es de suma importancia observar el matraz con frecuencia con el microscopio durante el tratamiento. - Toque suavemente el matraz, cuando las células endoteliales hayan comenzado a redondear hacia arriba, para separar las células endoteliales aflojadas.
- Para detener la tripsinación, añada 10 ml de DMEM-comp al matraz. Enjuague el matraz con cuidado unas cuantas veces con el medio para eliminar las células endoteliales. Aspirar la suspensión de la célula endotelial del matraz. Las células endoteliales ahora se pueden utilizar para otros fines.
- Añadir 10 ml de DMEM-comp al matraz. Mira bajo el microscopio de luz para asegurar que los pericitos todavía están presentes y unidos a la parte inferior. Vuelva a colocar el matraz en la incubadora para permitir que el cultivo enriquecido con pericitos crezca.
NOTA: Es importante observar la cultura durante los días siguientes. Si todavía hay una cantidad justa de células endoteliales que crecen otro tratamiento de trippsina se puede realizar. - Permita que el monocultivo de pericitos crezca con el cambio de DMEM-comp. medio cada segundo día. Compruebe el crecimiento de las células bajo el microscopio de luz(Figura 1, día 5-8).
5. Generación y almacenamiento de un monocultivo de pericitos primarios bovinos
-
Día 8-9: Inspeccione los capilares bajo un microscopio ligero
NOTA: Los pericitos deberían haber alcanzado ahora el 70-80% de confluencia y crecer en islas en el matraz(Figura 1, día 9). Si la confluencia de los pericitos es inferior al 70%, permita que las células crezcan durante otro día. Los pericitos no formarán una monocapa completa como lo harían las células endoteliales. - Aspirar DMEM-comp y lavar los pericitos con 7 ml de PBS.
- Añadir 2 ml de tripsina-EDTA al matraz y dejarlo en la incubadora durante 2-3 min. Coloque el matraz con frecuencia debajo del microscopio de luz para observar cuando los pericitos se redondeen hacia arriba y se desprendan del matraz. Cuando los pericitos han comenzado a redondear hacia arriba, el matraz se puede tocar suavemente para separar las células.
- Toque suavemente el matraz, cuando los pericitos hayan comenzado a redondear hacia arriba, para separar las células.
- Agregue 10 ml de DMEM-comp al matraz para detener el proceso de tripsinancia. Enjuague el matraz unas cuantas veces con el medio para ayudar a separar los últimos pericitos.
- Transfiera la suspensión de 12 ml de célula a un tubo de centrifugación de 50 ml y llene hasta 30 ml con DMEM-comp.
- Centrifugar la suspensión celular durante 5 min a 500 x g y RT. Aspirar el DMEM-comp. cuidadosamente sin tocar el pellet celular. Resuspender el pellet celular en 3 ml de FBS con 10% DMSO.
- Transfiera la suspensión celular a crioviales; añadir 1 ml a cada uno, por lo que habrá un total de 3 viales por matraz T75 de pericitos. Congele los pericitos a -80 oC durante la noche y muévalos al nitrógeno líquido el día siguiente para su almacenamiento a largo plazo.
NOTA: Las células se pueden contar antes de congelarse para una estimación posterior del porcentaje de supervivencia. El protocolo se puede pausar aquí.
6. Creación de un monocultivo de pericitos para experimentos
- Recubrir un matraz T75 con colágeno IV y fibronectina utilizando el mismo procedimiento que se menciona en la sección 3.1-3.4.
- Mientras el matraz está recubierto con fibronectina, descongele un vial de pericitos en un baño de agua de 37oC.
- Transfiera los pericitos ahora descongelados del criovial a un tubo de centrifugación con 30 ml de DMEM-comp. Centrifugar la suspensión celular durante 5 min a 500 x g,RT.
- Aspirar cuidadosamente el medio, dejando el pellet celular en la parte inferior del tubo. Vuelva a suspender el pellet en 10 ml DMEM-comp.
- Recoja y transfiera la suspensión celular al matraz recubierto. Dejar crecer el matraz con pericitos en una incubadora de 37oC al 10% deCO2.
- Cada segundo día, refresque el medio con 10 ml de DMEM-comp fresco.
NOTA: Después de 5 días de crecimiento, los pericitos deben haber alcanzado aproximadamente el 80% de confluencia. Si la confluencia es menor, deje que las células crezcan durante uno o dos días más. Las células ahora deben estar listas para la siembra para otros experimentos.
7. Siembra de pericitos en una placa recubierta de 96 pozos
- Diluir el colágeno IV como se describe en el paso 3.1. Añadir 100 l a cada pocócil en una placa de 96 pocillos e incubar durante 2 horas a RT o durante la noche a 4oC.
- Aspirar la solución y lavar los pozos tres veces con PBS.
- Añadir 100 l de fibronectina diluida a cada pocómo e incubar a RT durante 30 min. Retire la solución de fibronectina y utilice la placa inmediatamente.
NOTA: Dependiendo de lo bien que esté creciendo el lote de pericitos, debe haber suficientes células para sembrar dos placas. - Saque los pericitos de la incubadora y aspire el medio. Lave las células con PBS.
- Agregue 2 ml de tripsina-EDTA a los pericitos y siga el mismo procedimiento que en el paso 5.3-5.6.
- Aspirar el medio, sin dañar el pellet celular y volver a suspender el pellet en 1 ml de DMEM-comp fresco.
- Saque 12 l de suspensión celular y agréguelo a una cámara de conteo. Bajo el microscopio de luz, cuente al menos 3 de 3x3 rejillas y utilice el recuento promedio de células por cuadrícula.
- Utilice la ecuación siguiente para calcular el volumen de suspensión de celda que se debe agregar a cada pozo a la semilla de 10.000 células por pozo, en la placa de 96 pozos.
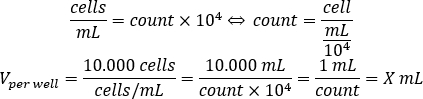
- Añadir DMEM-comp y el volumen calculado de suspensión celular en cada pozo para alcanzar un volumen final de 200 l.
- Colocar la placa de 96 pozos en una incubadora de 37oC al 10% deCO2. Deje que las células crezcan durante 4 días con un cambio de medio después de 2 días.
8. Preparación de tampones y soluciones para Ca2+-imágenes
- Autoclave cubre las cámaras de celda y los cubreobjetos.
- Tampón de ensayo: Añadir 1,19 g de HEPES a 500 ml de tampón HBSS para una concentración final de 10 mM HEPES. Ajuste el pH a 7.4.
- Preparar 20% (p/v) Solución de material de aceite de ricino polietillado Pluronic F127 + 1% (v/v) disolviendo 0,5 g de solución de Pluronic F127 en 2,5 ml de DMSO anhidro en un vial de vidrio. Calentar a 40oC durante aproximadamente 30 min o hasta que se disuelvan y vórtice. Añadir 25 l de aceite de ricino polietoxilado y conservar en RT. No se congele.
- Preparar 2 mM Fura-2 AM en stock disolviendo 1 mg en 500 ml de DMSO anhidro. Conservar en alícuotas de 20 oL a -20 oC protegidas de la luz.
- Preparar una solución de carga de 5 m fura-2 AM mezclando 20 ml de solución de aceite de ricino polietilellado 20% Pluronic F-127 + 1% con la solución de 20 ml de alícuota De 2 mM Fura-2 AM. Agregue 500 l de tampón de ensayo y vórtice. Agregue el búfer de ensayo a un volumen final de 8 ml. La solución debe prepararse inmediatamente antes de su uso y protegerse de la luz.
- Preparar 4 mM de Cal-520 AM disolviendo 1 mg en 226,7 ml de DMSO anhidro. Conservar en alícuotas de 20 oL a -20 oC protegidas de la luz.
- Preparar una solución de carga cal-520 AM de 20 m mezclando 20 ml de 20% de solución de aceite de ricino polietillado Pluronic F-127 + 1% con la solución alícuota Cal-520 de 20 ml de 4 ml. Agregue 500 l de tampón de ensayo y vórtice. Agregue el búfer de ensayo a un volumen final de 4 ml. La solución debe prepararse inmediatamente antes de su uso y protegerse de la luz.
9. Carga de pericitos con tinte indicador de calcio Fura-2 AM en una configuración de lector de placas
NOTA: Todas las soluciones deben estar en RT antes de que comience el experimento.
- Saque la placa de 96 pozos con células de la incubadora y aspire el medio de los pozos. Lave las células dos veces con el tampón del ensayo.
- Añadir 100 l de solución de carga a cada pocóvolo y envolver la placa con papel de aluminio, para evitar el blanqueo fotográfico. Incubar durante 45 min con 30 rpm agitando a RT.
NOTA: No cargue Fura-2 AM a 37oC, ya que puede cargar compartimentos internos. Recuerde dejar pozos con celdas en el búfer de ensayo en lugar de cargar el búfer; estos son los "espacios en blanco" utilizados para medir la fluorescencia de fondo. - Aspirar el búfer de carga y lavar las células con el búfer de ensayo dos veces. Añadir 100 l de tampón de ensayo fresco y dejar que las células se incuban durante 30 minutos en RT; esto permite un escote continuo del éster AM y así atrapar Fura-2 AM dentro de las células.
- Antes de la imagen Ca2+,lave y reemplace el tampón con 100 ml de tampón de ensayo fresco.
10. Lectura de fluorescencia de placas de pozo de pericitos en una configuración de lector de placas
- Ajuste la temperatura del lector de placas a 37 oC y transfiera la placa de 96 pozos con celdas a la posición de la placa de muestra. Coloque la placa de reactivo con agonista en la posición de la placa de reactivo.
- Comience midiendo la carga de las células para asegurar la carga igual de Fura-2 AM en todos los pozos.
- Realice las mediciones con longitud de onda de fluorescencia de excitación a 340 nm/380 nm y la longitud de onda de emisión a 510 nm. Añadir 50 l de agonista a velocidad 150 l/s desde la placa de reactivo a cada pocólero con células en la posición de la placa de muestra.
- Guarde los datos y exporte como archivos xlsx para su posterior análisis. La Figura 2 muestra la respuesta citosólica Ca2+medida como la relación entre las dos longitudes de onda de excitación a lo largo del tiempo, donde se resta la fluorescencia de fondo.
NOTA: El lector de placas debe ser un lector de microplacas doble con espacio para una "bandeja de celda" y una "bandeja de muestra" y un sistema de pipeteador integrado.
11. Siembra de pericitos en una cámara de células recubiertas para imágenes en vivo
NOTA: Los cubreobjetos también pueden colocarse en la parte inferior de los pozos de cultivo, recubiertos y sembrados con pericitos como se describió anteriormente, y luego montarse en la cámara antes de los experimentos.
- Monte un cubreobjetos en la cámara de la célula y hálo apretar para evitar fugas.
- Diluir el colágeno IV como se describe en el paso 3.1. Añadir 500 l a cada cámara celular e incubar durante 2 h a RT o durante la noche a 4oC.
- Aspirar la solución de colágeno y lavar las cámaras tres veces con 500 l de PBS.
- Añadir 500 l de fibronectina diluida a cada pocómo e incubar a RT durante 30 min. Retire la solución de fibronectina y utilice la cámara celular inmediatamente después.
- Mientras tanto, saque el matraz con pericitos confluentes y lave con 7 ml de PBS.
- Agregue 2 ml de tripsina-EDTA a los pericitos y siga el mismo procedimiento que en el paso 5.3-5.6.
- Continúe siguiendo los mismos pasos que en el paso 8.6-8.7.
- Utilice la ecuación siguiente para calcular el volumen de suspensión de la celda, que se debe agregar a cada cámara para sembrar 90.000 células por cámara.
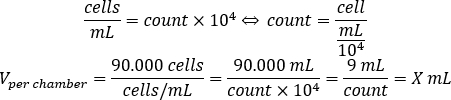
- Añadir DMEM-comp y el volumen calculado de suspensión celular en cada cámara para alcanzar un volumen final de 500 l.
- Colocar las cámaras celulares en la incubadora a 37oC, 10% CO2. Deje que las células crezcan durante 6 días (o hasta que confluen).
NOTA: Los pericitos crecen más lentamente en los portaobjetos de vidrio en comparación con el plástico; más días de crecimiento son necesarios.
12. Carga de pericitos con tinte indicador de calcio Cal-520 AM para imágenes en vivo
NOTA: Todas las soluciones deben estar en RT antes de que comience el experimento.
- Preparar el tampón de carga cal-520 AM de 20 m: Mezclar 20 ml de 20% Pluronic F-127 + 1% solución de material de fundición polietoxilated con la solución alícuota Cal-520 de 20 ml de 4 mM. Agregue 500 de búfer de ensayo y vórtice. Agregue el búfer de ensayo a un volumen final de 4 ml. La solución debe prepararse inmediatamente antes de su uso y protegerse de la luz.
NOTA: Proteja las soluciones que contienen Cal-520 AM de la exposición a la luz. - Saque las cámaras celulares de la incubadora y aspire el medio. Lave las células dos veces con el tampón del ensayo.
- Añadir 500 l de tampón de carga a cada cámara e incubar a RT durante 45 min.
- Aspirar el búfer de carga y lavar las células dos veces con el búfer de ensayo.
- Añadir 500 l de tampón de ensayo fresco a cada cámara e incubar durante 30 minutos en RT para permitir la escisión del éster AM.
- Sustituya el tampón por 500 ml de tampón de ensayo fresco antes de realizar la toma de imágenes en vivo a un microscopio confocal.
13. Imágenes en vivo de los niveles intracelulares Ca2+
NOTA: Se puede utilizar una variedad de tipos de microscopios para la toma de imágenes. Se pueden utilizar microscopios de fluorescencia convencionales verticales o invertidos, así como microscopios de escaneo láser confocal verticales o invertidos con fuente de excitación adecuada (488 nm) y filtros de emisión (510-520 nm). Los objetivos deben ser adecuados para la fluorescencia y ser de alta calidad y con alta apertura numérica (NA).
- Monte la cámara celular en el escenario del microscopio confocal lo más suave posible, con el fin de evitar la alteración de las células.
- Seleccione una longitud de onda de excitación de 488 nm, emisión a 515 nm, adquisición secuencial de imagen con intervalos de 5 segundos, un tamaño de imagen XY de 512 x 512 píxeles y medida durante 2 minutos para medir las señales de calcio basales.
- Agregue 3 l de 100 mM de ATP a la cámara de celda con una pipeta y continúe con la adquisición de imágenes secuenciales. Realice la adición lenta y suavemente para no perturbar la preparación y mover las células fuera de foco.
- Observe el grado de cambios y aumente el intervalo de tiempo con el tiempo según sea necesario durante aproximadamente 18 minutos hasta que no se observe ningún cambio morfológico adicional (Figura 3).
- Guarde imágenes de lapso de tiempo y expórtelas como archivos TIFF y/o AVI para su posterior análisis.
NOTA: Un vial de pericitos debe dar suficientes células para la siembra en placas de 1-2 96 pozos y varios cubreobjetos, lo que significa que puede preparar las células para ambos tipos de mediciones de calcio.
Resultados
Los capilares cerebrales bovinos fueron aislados del tejido cerebral fresco y la Figura 1 presenta la siembra capilar y el crecimiento celular durante los días y la posterior purificación de pericitos. Los capilares están completamente unidos al matraz en el día 1 y el día 2 la brotación endotelial se ha hecho visible(Figura 1, día 2). Después de 4 días, el crecimiento celular es altamente distintivo...
Discusión
En este estudio, hemos presentado un método para aislar pericitos primarios de cerebros bovinos. El protocolo descrito permite la referencia cultural de este tipo de celda bastante inaccesible. El cultivo celular obtenido posteriormente fue una población casi homogénea de pericitos, con poca o ninguna contaminación con células endoteliales y células gliales basadas en morfología celular y expresión proteica12. Además, demostramos un método simple y sencillo para cargar los pericitos con ...
Divulgaciones
Los autores no declaran intereses financieros competidores.
Agradecimientos
Los autores desean reconocer la financiación de la iniciativa de investigación de la Fundación Lundbeck sobre barreras cerebrales y entrega de drogas (RIBBDD) y la Fundación de la Familia Simon Hougners.
Materiales
| Name | Company | Catalog Number | Comments |
| ATP | Tocris | 3245 | |
| Cal-520 AM | AAT Bioquest | 21130 | |
| Cell incubator | Thermo Fisher | ||
| Centrifuge | Thermo Fisher | Heraeus Multifuge 3SR+ | Standard large volume centrifuge for spinning down cells |
| Collagen IV | Sigma Aldrich | C5533 | |
| Confocal laser scanning microscope | Carl Zeiss | Zeiss LSM 510 | Inverted microscope |
| Counting chamber | FastRead | 102 | |
| Coverslip cell chamber | Airekacells | SC15022 | |
| Cremophor EL | Sigma Aldrich | C5135 | Formerly known as Kolliphor EL |
| DMSO | Sigma Aldrich | 471267 | |
| Dulbecco's Modified Eagles Medium | Sigma Aldrich | D0819 | |
| Fetal bovine serum (FBS) | PAA/GE Healthcare | A15-101 | |
| Fibronectin | Sigma Aldrich | F1141 | |
| Fura-2 AM | Thermo Fisher | F1201 | |
| Glass coverslips 22x22 mm | VWR International | 631-0123 | |
| HBSS | Gibco | 14065-049 | |
| Heparin | Sigma Aldrich | H3149 | |
| HEPES | AppliChem Panreac | A1069 | |
| Light microscope | Olympus | Olympus CK2 | Upright light microscope with phase contrast |
| MEM nonessential amino acids | Sigma Aldrich | M7145 | |
| Microplate Reader | BMG LabTech | NOVOstar | |
| PBS | Sigma Aldrich | D8537 | Phosphate-buffered saline |
| penicillin G sodium/streptomycin sulfate | Sigma Aldrich | P0781 | |
| Pluronic F127 | Sigma Aldrich | P2443 | |
| Trypsin-EDTA | Sigma Aldrich | T4299 | |
| T-75 flask | Sigma Aldrich | CLS3972 | |
| 96-well plate | Corning incorporated | 3603 |
Referencias
- Armulik, A., Genove, G., Betsholtz, C. Pericytes: Developmental, Physiological, and Pathological Perspectives, Problems, and Promises. Developmental Cell. 21 (2), 193-215 (2011).
- Abbott, N. J., Ronnback, L., Hansson, E. Astrocyte-endothelial interactions at the blood-brain barrier. Nature Reviews Neuroscience. 7 (1), 41-53 (2006).
- Mathiisen, T. M., Lehre, K. P., Danbolt, N. C., Ottersen, O. P. The Perivascular Astroglial Sheath Provides a Complete Covering of the Brain Microvessels: An Electron Microscopic 3D Reconstruction. Glia. 58 (9), 1094-1103 (2010).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow and Metabolism. 36 (5), 862-890 (2016).
- Zhou, L., Sohet, F., Daneman, R. Purification of Pericytes from Rodent Optic Nerve by Immunopanning. Cold Spring Harbor Protocols. , 608-617 (2014).
- Liu, G. H., et al. Isolation, Purification, and Cultivation of Primary Retinal Microvascular Pericytes: A Novel Model Using Rats. Microcirculation. 21 (6), 478-489 (2014).
- Nayak, R. C., Herman, I. M. Bovine retinal microvascular pericytes: isolation, propagation, and identification. Methods In Molecular Medicine. 46, 247-263 (2001).
- Nees, S., et al. Isolation, bulk cultivation, and characterization of coronary microvascular pericytes: the second most frequent myocardial cell type in vitro. American Journal of Physiology-Heart and Circulatory Physiology. 302 (1), H69-H84 (2012).
- Armulik, A., Abramsson, A., Betsholtz, C. Endothelial/pericyte interactions. Circulation Research. 97 (6), 512-523 (2005).
- Helms, H. C., Brodin, B., Milner, R. Methods in Molecular Biology. Cerebral Angiogenesis: Methods and Protocols. 1135, 365-382 (2014).
- Abbracchio, M. P., Burnstock, G., Verkhratsky, A., Zimmermann, H. Purinergic signalling in the nervous system: an overview. Trends in Neurosciences. 32 (1), 19-29 (2009).
- Cai, C., et al. Stimulation-induced rises in cerebral blood flow and local capillary vasoconstriction depend on conducted vascular responses in brain capillaries. PNAS. , (2018).
- Tigges, U., Welser-Alves, J. V., Boroujerdi, A., Milner, R. A novel and simple method for culturing pericytes from mouse brain. Microvascular Research. 84 (1), 74-80 (2012).
- Maier, C. L., Shepherd, B. R., Yi, T., Pober, J. S. Explant Outgrowth, Propagation and Characterization of Human Pericytes. Microcirculation. 17 (5), 367-380 (2010).
- Orlidge, A., Damore, P. A. Cell specific effects of glycosaminoglycans on the attachment and proliferation of vascular wall components. Microvascular Research. 31 (1), 41-53 (1986).
- Rhinehart, K., Zhang, Z., Pallone, T. L. Ca2+ signaling and membrane potential in descending vasa recta pericytes and endothelia. American Journal of Physiology-Renal Physiology. 283, F852-F860 (2002).
- Bintig, W., et al. Purine receptors and Ca2+ signalling in the human blood-brain barrier endothelial cell line hCMEC/D3. Purinergic Signalling. 8 (1), 71-80 (2012).
- Neuhaus, A. A., Couch, Y., Sutherland, B. A., Buchan, A. M. Novel method to study pericyte contractility and responses to ischaemia in vitro using electrical impedance. Journal of Cerebral Blood Flow and Metabolism. 37 (6), 2013-2024 (2017).
- Kamouchi, M., et al. Calcium influx pathways in rat CNS pericytes. Molecular Brain Research. 126 (2), 114-120 (2004).
- Das, A., et al. ATP Causes Retinal Pericytes to Contract In vitro. Experimental Eye Research. 46, 349-362 (1988).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados