需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
银鲤鱼中吉尔 · 拉克 · 穆库斯的宏观流变特征, 低语种米希里斯 · 莫利特里克斯
摘要
此协议提出了一种方法,以执行粘液的流变特征,居住在银鲤的刺rakers (GRs) 上。通过测量粘度、储存和损失模组获得的 GR 粘液的粘度弹性特性,用于评估表观产量应力,以了解 GRs 中的滤送机制。
摘要
银鲤鱼, 假发性毛利特里克斯,是一种侵入性的浮游生物过滤器喂食鱼,由于其高效的过滤喂养机制,侵扰了密西西比河上游流域的天然水道。在许多此类过滤器中发现称为刺拉克(GRs)的特征器官,有助于有效过滤大小只有几微米的食物颗粒,如浮游植物。
研究GR粘液的流变学的动机源于我们渴望了解它在帮助银鲤鱼过滤喂养过程中的作用。富含粘液的液体,在"厚和粘性"状态可能促进食物颗粒的粘附。通过 GR 膜的渗透和运输由外部剪切力作用促进,这些切变率会变化。因此,粘液流变学可以为过滤鱼池中银鲤的巨大超能力提供重要线索。在此基础上,GR粘液可以为食物颗粒提供粘合功能,并作为运输工具协助过滤器喂养过程。
该协议的主要目标是确定粘液的产量应力,归因于启动流所需的最小剪切应力,在结构粘胶材料上首先观察不可逆的塑料变形。因此,GR粘液的流变特性,即粘度、储存和损失模组,使用旋转测温仪对其非牛顿、剪薄性质进行了调查。
这里提出的一个协议被用来分析从银鲤鱼的刺车中提取的粘液的流变特性,在密苏里河的哈特克里克位置捕鱼。该协议旨在制定一个有效的策略,用于风湿学测试和粘液的材料特征,假定是一种结构化粘性材料。
引言
银鲤鱼,假体,是浮游生物过滤器,是一种侵入性物种,已经渗透到美国的几个天然水道。该物种最初是在密西西比河上游流域引进的,以控制藻类开花1、2、3。银鲤是一种非常高效的喂食器。通常,其消耗性食物颗粒大小从4到20μm到更大的浮游动物,大约是80μm 3,4,5。该物种已经超过其他本地鱼类,并可能造成巨大的损害,本地水道限制可用资源1,2,6。因此,过滤喂养鱼类,如银鲤鱼和大头鲤鱼对五大湖1,2,6,7,8构成重大威胁。
过滤器喂养鱼具有特殊的器官称为刺rakers(GRs),其表面有一层薄薄的粘液。这些器官可提高从传入的液体中过滤和聚合小颗粒的效率。此处提出的协议的目标是描述非牛顿、剪薄材料特性和从银鲤刺拉克尔内部表面获得的 GR 粘液的产生应力。使用旋转流变计确定的GR粘液的产量应力值对本研究很感兴趣。测得的产量应力又称"表观产量应激",取决于稳定剪切率或动态振荡应变型9、10等测试方法。剪切变薄的"产应力流体"在关键的应用应力9、11中经历了从固体状到液体状行为的过渡。明显的产量应力是启动流所需的最小剪切应力,或者当粘液从凝胶状材料过渡到液体状材料时,首先观察到不可逆的塑料变形。这种行为可以在结构粘性材料中观察到。GR 粘液从凝胶状行为过渡到液体状行为需要两个功能,即收集食物颗粒物的粘合作用和运输车辆的作用,以协助颗粒物的输送和过滤过程。粘液的扩展功能包括在抗病和呼吸方面创造扩散屏障,提供营养因子、有毒成分和排泄物的可控释放,为喂养和筑巢创造代谢途径,帮助保护捕食者,以及产生边界层的改变,提高运动和推进效率12,13,14。
与简单的流体不同,粘液等复杂流体具有随流条件变化的特性,需要额外的测量参数来定义其体积尺度物理行为。为了监测 GR 粘液的粘度和产量应力,使用旋转流变计进行流变测量。旋转测流仪通过与流体样品接触的旋转盘施加稳定或振荡的剪切应力或应变,并测量其反应。使用这种仪器和技术的理由是,测流仪可以提供一组测量来描述银鲤的GR粘液的物质特性,而这种物质特性不能仅靠粘度来定义。
粘液是一种粘性材料,它对强加变形的机械反应是纯固体(由胡克的弹性定律控制)和纯液体(受牛顿粘度定律控制)之间的。粘液中包含的复杂大分子网络可以根据外部力或变形进行拉伸和重新定位。旋转测流仪由圆锥形几何和 Peltier 板组成,如图1和图 2中所示(参见仪表规格表 1)。这项研究的目的是制定一个协议,以确定GR粘液的流变特性。旋转测流仪比粘度计的优点是它能够使用较小的样品量进行动态测量。本研究中的 GR 粘液样本量约为 1.4 mL。另一方面,粘度计仅限于恒定的剪切速率,需要大量的样品量。
粘液的流变特性在银鲤解剖学中预计会有很大的不同。例如,居住在 GR 表面的粘液的特性可能与表皮器官不同。为了说明鱼不同区域粘液特性的潜在变异性,对获得的GR粘液样品进行了稀释,并利用旋转测血仪创建并测试了三种浓度的溶液。执行协议后报告的粘液流变学数据和结果证明了测量技术的有效性。本文中提出的说明性数据并不是要在整个银鲤种群中推广。此处提出的协议可以扩展,以调查较大样本集的粘液流变学,以测试其他假设。
本研究的目的是用三种不同的粘液浓度(400毫克/毫升、200毫克/毫升和100毫克/毫升)来证明GR粘液流变学的流变特性。400毫克/mL浓度代表从鱼类GRs中采集的生粘液样品。 去离子化水(DI)用于将生粘液样品稀释成200毫克/mL和100毫克/mL浓度。稀释粘液样本可以评估剪切变薄和明显产量应力的程度,作为浓度的函数,并确定 GR 粘液过渡到非牛顿行为的浓度。摇床用于分解样品中任何大块粘液,以减轻由于不血源性导致的流变数据错误。
在大多数脊椎动物,包括鱼类,主要的粘液形成大分子是糖蛋白(粘液),往往膨胀在水中纠缠或化学交叉连接,并产生凝胶状材料12,13,17,18,19,20。高分子量、凝胶形成大分子和高含水量反映了粘液13中的滑度。高度的大分子间相互作用导致凝胶形成,而低水平的间大分子相互作用或断裂的键导致高粘度流体21。
过滤器喂养鱼类中的食物颗粒过滤过程得益于GR粘液相关特性,如粘性和粘度,这些特性决定了其粘附和粘附的潜力。粘液粘附的强度取决于特定的间质、静电或疏水相互作用23。桑德森等人24日对黑鱼进行了暂停喂养研究,结果发现了粘液粘附的证据。他们指出,悬浮食物颗粒与粘膜表面的粘附,其后由指示水流在粘膜表面上进行定向水流,将聚集的颗粒团与粘液结合在一起。水流产生的切变率暴露在剪切应变率下的粘液有助于将食物颗粒输送到消化器官。内窥镜技术用于观察过滤颗粒24。
关于 GR 粘液流变学测试的剪切率范围和实际限制的文献很少。因此,从胃、鼻腔、宫颈和肺粘液、鲑鱼皮肤粘液、黑鱼粘液和骨关节表面润滑剂的流变学研究中寻求指导,其中流变特征和非牛顿属性研究了11、12、25、26、27、28、29、30、31。最近,利用恒定的剪切率粘度研究了鱼皮粘液对运动和推进效率的影响。皮肤粘液流变学研究(没有任何稀释或同质化)有关海布雷姆,海贝和微薄证明非牛顿行为在典型的低剪率14。 在另一项相关研究中,从塞内加尔鞋底的腹腔和腹腔两侧的原始皮肤粘液样本被发现表现出非牛顿行为,表明在所有剪切率被认为是32的较高粘度。其他与水凝胶脚手架开发有关的流变方案,以及使用恒定剪切速度粘度计的高浓度悬架的流变方案,也已报告在文献33,34。
在这项研究中,GR粘液的特性被研究使用应变率控制,旋转流变计,已广泛应用于流变实验的复杂生物流体25。对于牛顿流体,表面粘度保持不变,是剪切率独立和剪切应力线性变化与剪切应变率(图3A,B)。对于非牛顿流体(如剪薄液)的粘度是切变率依赖或变形历史依赖(图3A,B)。损失模态(G)表示材料抵抗流动趋势的程度,并代表流体粘度(图4)。存储模组 (G') 表示材料在应力诱导变形后恢复其原始形状的趋势,相当于弹性(图 4)。相位角(δ)或损失切线值,根据 G"/G'的反切线计算。它代表能量损失和存储之间的平衡,也是描述粘性弹性材料(胡克固体δ = 0°;粘性液体δ = 90°;粘性固体δ < 45°,粘性液体δ > 45° (图 4)25。结构化流体中的表观屈产应力(σy)表示状态的变化,可从稳定的状态扫描和动态应激扫描10的流变数据中观察到。如果外部施加应力小于明显的产量应力,则材料会弹性变形。当应力超过表观产量应力(图3B中标记为"平均应力")时,材料将从弹性过渡到塑料变形,并开始在其液态35中流动。测量粘液样本中的存储模态 (G') 和损失模态 (G)在振荡应力 (或应变) 条件下的变量,可量化材料状态从凝胶状到粘性液体样行为的变化。
此处描述了为监控存储模态 (G')、损失模态 (G) 和明显粘度 (η) 相关数据而执行的测速仪测试类型。动态振荡测试(应变扫描和频率扫描)在锥形几何的受控振荡下监测G'和G"。动态应变扫描测试通过监测内在材料响应(图4)确定了粘液的线性粘度区域(LVR)。应变扫描用于确定在恒定振荡频率和温度下的产生行为。动态频率扫描测试以恒定振幅(应变或应力)和温度监测材料对增加频率(变形速率)的反应。应变保持在线性粘性区域 (LVR) 进行动态频率扫描测试。稳定状态剪切速率测试监测锥体几何稳定旋转下的明显粘度(η)。GR 粘液受到增量应力步骤的约束,并监测明显的粘度(η,Pa.s)的剪切率变化(+,1/s)。
本文提出的协议将GR粘液视为具有一定线性粘度响应范围的未知粘度的复杂结构材料。1、2、36日,帕特里夏·埃尔南德斯教授(乔治·华盛顿大学生物科学系)在密苏里河哈特溪进行捕鱼考察时,从银鲤的GRS中提取了鱼粘液。 图5A显示银鲤口内的GRS阵列,图5B中显示示意图图。图 5C中显示了一个切除的GR。 从银鲤的GRS中提取粘液,作为示意图图的示例,图5D,E。所有的测流仪测试都是在恒定的,受控的温度22±0.002°C,温度记录在捕鱼地点1,2,36。 每个粘液样本用流变计测试了三次,平均结果与统计误差条一起呈现。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 准备各种浓度的粘液溶液
注:为本实验准备了三浓度的粘液溶液(400毫克/mL、200毫克/mL 和 100 毫克/mL,体积分别为 1 mL、1 mL 和 2 mL)。
- 要计算粘液的质量,用(M带粘液)测量小瓶的平均质量:毫克)和没有粘液(M瓶:毫克) 。然后减去小瓶的质量与粘液没有粘液(M粘液= M与粘液- M瓶;毫克) 。
- 将粘液稀释成三浓度(400、200、100、mg/mL),并加入去离子(DI)水。
- 使用微管将 0.6 mL DI 水添加到粘液中,准备粘液溶液的第一浓度 400 毫克/毫升。
注:由于提取粘液的大致体积为 1.4 mL,400 毫克/mL 溶液的总体积为 ±2 mL。 - 将 400 毫克/mL 粘液液小瓶放在摇床上,以确保粘液溶液充分均匀化,并缓解任何粘液颗粒聚集。
- 准备粘液溶液的第二浓度,200毫克/mL,通过使用微管将第一浓度粘液溶液的一半体积绘制到新瓶中,并在新小瓶中加入1mL的DI水。
- 重复步骤 1.2.2 的第一个和第二瓶与粘液解决方案。
- 使用微管将 200 毫克/mL 溶液的一半体积(1 mL)绘制成新小瓶,并将 DI 水加入新小瓶中,从而准备粘液溶液的第三浓度 100 毫克/mL。
- 重复步骤1.2.2的所有三浓度的粘液溶液在各自的瓶(见补充图1)。
- 将粘液溶液小瓶存放在冰箱中,直到进行测速仪校准和测试。
- 使用微管将 0.6 mL DI 水添加到粘液中,准备粘液溶液的第一浓度 400 毫克/毫升。
2. 使用测流仪进行测量和数据采集
注:此协议中用于使用测速仪进行仪器控制和数据采集的软件在 材料表 中注明。此软件将被称为"测速仪控制软件"。
- 设置和校准测速仪。
- 打开流变器的压缩空气供应,确保气动表和流变计使用气泡计调平。拧开测流仪轴上的保护帽,在拧开时保持轴静止。
- 打开测流仪主开关以激活流变计的磁性轴承。
- 打开流变器控制计算机,其中安装了流变仪控制软件,并启动流变仪控制软件(见补充图2)。
- 通过选择选项卡进行仪器校准,"校准|仪器'从软件窗口。选择"仪器"选项。单击"惯性"下的"校准"。将仪器惯性校准值记录在μN .m.s2中,重复校准至少 3 倍,以确保校准值彼此在 10% 以内(参见补充图 3)。
- 在流变计的轴上安装流变计几何形状。
- 单击测速仪仪器控制软件中的"几何"选项卡。
- 用所需的几何形状(直径为 40 毫米、直径为 1= 0' 11'')和 Peltier 板用异丙醇清洁圆锥体(参见表 1、材料表、图 1和图 2)。
注:在测流仪上安装佩尔蒂埃板;它可以用同位素清洁,而它直接固定在测流仪上。 - 确保 Peltier 板夹具不含任何可见的灰尘,并在必要时使用同丙酚清洁。如果没有在测温仪中预装并连接散热器连接,则安装 Peltier 板。
- 按测速仪上的"锁按钮"到连接到圆锥体几何形状的锁轴。这会阻约轴的位置,但它可以在位置自由旋转。
- 单击"智能交换|启用"在测流仪仪器控制软件选项卡,以便自动检测几何形状(见补充图4)。
- 将测流仪顶部的轴拧在几何形状上。该软件将检测40毫米直径,1+ 0'11'圆锥角几何在这个阶段(见 表1 和 材料表)。
- 重复步骤 2.2.5 和 2.2.6 以确保检测到几何形状。
- 在测速仪仪器控制软件的"控制面板"下选择"差距",单击"选项"图标并选择"轴向力"选项。将轴向力设置为"1 牛顿";这是为了确保圆锥体几何接触佩尔蒂埃板零间隙初始化(见补充图5)。
- 执行流变计几何校准。
- 从软件窗口中选择选项卡"几何"。单击"惯性"下的"校准"。将几何惯性校准值记录在μN .m.s2中,并重复此 2-3 次,以确保校准值彼此的 10% 以内。
- 单击软件窗口中的"摩擦"下的"校准"。记录μN.m//(rad/s)中的几何摩擦校准值,并重复此 2-3 次,以确保校准值彼此的 10% 以内(参见补充图 6)。
- 执行零间隙初始化
注:由于在没有参考"零"位置的情况下,无法准确将几何形状提升到 Peltier 板上方以执行测量,可以执行零间隙初始化。用于测量目的,几何形状内置几何间隙为 24 μm,修剪间隙为 28 μm。修剪间隙旨在有效清洁可能溢出几何表面积外的多余流体。这些间隙对于使用样品和测温仪准确测量数据至关重要。步骤 2.4.1 是绝对必要的,以确保几何设置为零间隙,以实现几何学和修剪间隙分别为 24 μm 和 28 μm。- 单击软件窗口中"控制面板"中的"差距"选项卡下的"零间隙"图标。当几何体经历的轴向力大于或等于 1 N 时,初始化就完成了,因为它触及了 Peltier 板。确保测流仪间隙为零,使其参考位置准确(参见附图 7和辅助图 8)。
- 在测流仪仪器控制软件的"Gap"选项卡下按"上下箭头"控制流变仪仪器或"几何升降"图标,将几何形状提升到任意高度。流变仪仪表上的控制屏幕和流变仪控制软件的控制面板将显示(相同的)间隙高度。
- 在测流仪控制软件中设置实验程序。在 22 °C 下使用锥体上 Peltier 板几何,执行流变特性的特征。
注:美国地质调查局网站于2018年9月20日用于确定河流水温,当时用于GR粘液实验的银鲤鱼在哈特溪36号地点被捕捞。粘液的温度会影响风湿性。将值调整到河流温度的意义在于大致匹配粘液特性的温度,从而可以现实地估计粘液特性。- 在测流仪控制软件中选择标签"实验",并填写相关信息,如"名称","操作员","项目"等。 (见补充图9)
- 选择选项卡"几何",并确保信息与步骤 2.2.5 一致。- 2.2.7.(见补充图10)。
- 选择选项卡"程序",并使用设置"1:振荡振幅"程序的箭头键。(见补充图11)。
- 初始化"环境控制"设置如下:"温度 = 22 °C";"浸泡时间 = 120s",并检查框"等待温度"(参见补充图 11)。
- 初始化"测试参数"设置如下:"频率 = 1 Hz";设置"数向扫描";"扭矩 = 10 到 10000 μN.m";"每十年加分 = 5 点"(见补充图 11)。
- 设置实验以确定已知浓度粘液的线性粘胶弹性范围 (LVR) (100 毫克/毫升)
- 使用适当的微管和移液器尖端绘制约0.3 mL的鱼粘液溶液浓度100毫克/mL(见步骤1.2, 材料表)。
- 使用微管将粘液溶液引入 Peltier 板(见图 2)。
- 按测速仪上的"修剪间隙"按钮,将几何形状降低到 Peltier 板上。或者,单击测速仪控制软件中"控制面板"选项中的"盖普"选项中的"修剪间隙"图标(参见附图 12)。
- 使用带移液器尖端的微管切除任何多余的粘液溶液,并确保流体在几何形状下方,不会在几何外围附近溢出。
注:液体装载不当将导致测量错误。填充样本下将降低扭矩分布,过度填充的样品将导致错误的压力分布,由于沿边缘溢出。 - 交替选择"电机"和"速度"选项卡到 5 rad/s 和 0 rad/s,直到几何下方样品中具有最小的惯性和速度。测速仪仪表上的控制屏幕和测流仪控制软件的控制面板将显示速度(见补充图13)。
- 按测流仪上的"几何差距"按钮,将几何形状降低到每个特定几何形状的预设适当间隙。或者,单击测速仪控制软件中"控制面板"选项中的"盖普"选项中的"几何间隙"图标(参见附图 14)。
- 运行实验以确定已知浓度粘液的线性粘胶范围 (LVR)(100 毫克/毫升)。
- 单击测速仪仪器控制软件上的"开始"图标(参见附图 15)。
注:测流仪执行自动测量:按下"开始"按钮后,测速仪大约需要 20 分钟才能完成测试。第 2.5.5 步中的"每十年点"设置决定了测流仪完成测量所需的时间。 - 通过单击弹出框上的"是"来运行实验,并建议将几何间隙降低到正确的距离以开始实验,如果不是已经降低的话。
- 观察报告存储 (G') 和损失 (G') 模组的测流仪生成的实时图。
注:G'和G"分别是存储和损失模组。存储模态表示材料在应力诱导变形后恢复其原始形状的趋势,相当于弹性。损失模态表示材料抵抗流动趋势的程度,并代表流体粘度(见图4)。 - 将绘图的 X 轴设置为"振荡应变百分比"。要做到这一点,请直接点击显示的图形并选择"图形变量"选项卡(参见补充图 16)。
- 在材料进入非线性粘胶弹性范围之前,记录振荡应变百分比范围,一旦测试完成。
- 在测流仪仪器控制软件的"Gap"选项卡下按"上下箭头"控制流变仪仪表或"几何升降"图标,将几何形状提升到 Peltier 板上方的任何任意高度。
- 保存包含实验过程的文件,并以测血仪仪器控制软件的原生文件格式结果,以确定粘液样本的线性粘度区域 (LVR)。
注:这可以通过在 数据进入非线性粘度区域 (NLVR) 之前将图兹的 X 轴设置为应变振幅 (%) 和/或振荡应力来完成(见补充图 16)。
数据进入非线性粘度区域 (NLVR) 之前将图兹的 X 轴设置为应变振幅 (%) 和/或振荡应力来完成(见补充图 16)。
- 单击测速仪仪器控制软件上的"开始"图标(参见附图 15)。
- 在线性粘胶弹性范围 (LVR) 中运行动态扫描和稳定状态剪切速率流量测试实验,以检测已知浓度 100 mg/mL 的粘液,从 100 毫克/mL 的三个独立粘液样本中生成结果。在可用粘液浓度样本上单独执行这些步骤。
- 重复步骤 2.5.1 和 2.5.4。
- 初始化"测试参数"设置如下:"频率 = 1 Hz";设置"数向扫描";"应变 % = 100 至 10000%;"每十年加分 = 10 分"。
- 选择"程序"选项卡,并使用设置"2:振荡频率"程序的箭头键。
- 初始化"环境控制"设置如下:"温度 = 22 °C";"浸泡时间 = 0.0 s" 。
- 初始化"测试参数"设置如下:"应变 % = 1%";设置"数向扫描";"频率 = 20 至 1 Hz";"每十年加分 = 10 分"。
- 选择"程序"选项卡,并使用设置"3:流扫描"程序的箭头键。
- 初始化"环境控制"设置如下:"温度 = 22 °C";"浸泡时间 = 0.0 s" 。
- 初始化"测试参数"设置如下:"剪切率 = 1 到 10000 1/s";"每十年加分 = 10 分";复选框"稳定状态感应"。
- 重复步骤 2.7.1 和 2.7.2,等待实验完成,大约 45 分钟。
- 在测流仪仪器控制软件的"Gap"选项卡下按"上下箭头"控制测流仪或"几何升降"图标,将几何形状提升到任意高度。
- 使用一次性湿巾和手套,用同位素溶液去除和清洁 Peltier 板上的粘液(参见 材料表)。
- 保存包含实验过程的文件,并在测速仪仪器控制软件的原生文件格式中结果。
3. 重复 200 毫克/mL 和 400 毫克/mL 的其他粘液溶液浓度的协议。
- 执行步骤 2.5 + 2.8,包括其中列出的其余两个粘液溶液浓度的所有子步骤,200 毫克/mL 和 400 毫克/mL。
4. 图形表示和数据分析
注:补充代码文件中提供的代码执行数据平均值并生成可重复性错误,覆盖所有实验的数据。测速仪仪器控制软件中不提供标准偏差计算功能。代码以编程语言编写,用于数据分析、后处理和图形表示(详情请参阅 材料表 )。
- 从第 2.8 步生成的出口数据与 100 毫克/mL GR 粘液浓度有关,第 3.1 步与 200mg/mL 和 400 毫克/mL GR 粘液浓度相关,通过单击选项卡将粘液浓度转化为电子表格格式,"文件|出口|在测流仪仪器控制软件中Excel(见补充图17)。
- 运行补充代码,生成不同剪切应变率 () 和损失模态 (G) 的明显粘度 (η) 的地块
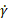 ,存储模态 (G') 和相位角度 (δ) 用于不同的振荡应力
,存储模态 (G') 和相位角度 (δ) 用于不同的振荡应力  () 并生成具有代表性的结果。
() 并生成具有代表性的结果。
Access restricted. Please log in or start a trial to view this content.
结果
在本节中,我们使用圆锥体几何(直径为 40 mm,1° 0' 11')和 Peltier 板的旋转流变计介绍 GR 粘液实验的结果。这些实验有助于描述GR粘液的非牛顿剪薄行为和描述粘液从凝胶状材料向液体状材料过渡的明显产量应力。具有代表性的结果包括对旋转测流仪仪器的低扭矩极限和二次流动效应的定量描述。仪器极限和稳定状态和动态应变率测量有助于准确确定 GR 粘液的粘性行为趋势和明显产量应力。明?...
Access restricted. Please log in or start a trial to view this content.
讨论
制定此协议的主要目标之一是确定它非常适合在样本量非常小时对 GR 粘液进行流变特征。我们承认,需要更多的银鲤鱼学校样本,以充分描述GR粘液的流变特性,此处提供的数据不是整个银鲤鱼种群的泛泛而论。我们的技术是合理的,因为它的功效与流变特征的小样本量和扩展调查涉及较大的粘液样本合奏。
协议中的关键步骤是使用旋转测速仪准备各种浓度、测量和数据采?...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有宣布任何利益冲突。
致谢
作者感谢GW生物识别和生物灵感工程中心的支持和资助。我们感谢乔治华盛顿大学生物科学系的L.Patricia Hernandez教授鼓励调查和持续的合作,提供银鲤生理学方面的生物学专业知识,并提供粘液样本。我们感谢学生,大卫·帕伦博先生、卡莉·科恩女士、艾萨克·芬伯格先生、多米尼克·彼得罗西诺先生、亚历克西斯·伦登多斯先生、普里西拉·瓦尔盖斯先生、卡特·泰根先生和拉加夫·帕朱尔先生在实验室中提供帮助,以及TA仪器公司的托马斯·埃文斯先生和詹姆斯·托马斯先生,新城堡、DE支持测速仪的培训和维护。图5A,C的图像是在乔治华盛顿大学生物科学系的L.帕特里夏·埃尔南德斯教授进行解剖时拍摄的。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Kim Wipes | VWR | 470224-038 | To clean Sample from plate |
| Gloves | VWR | 89428-750 | To prevent contamination of sample |
| Pipette | VWR | 89079-974 | To transport sample from vial to rheometer |
| Pipette Tips | Thermo Scientific | 72830-042 | To transport sample from vial to rheometer |
| Shaker | VWR | 89032-094 | To homogenously mix sample of mucus |
| Vials | VWR | 66008-710 | Contains measured sample volumes |
| Weigh Scale | Ohaus | Scout –SPX Balances | To weigh mass of mucus samples |
| Chemical Reagents | |||
| De-Ionized Water (H20) | - | - | Liquid |
| Sterile 70% Isopropanol (C3H8O) | VWR | 89108-162 | Liquid |
| GR Mucus | |||
| 100 mg/mL concentration, 2mL | - | - | Viscoelastic Material |
| 400 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| 200 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| Software | |||
| MATLAB | Mathworks | R2017a | Data analysis, post-processing and graphical representation |
| Trios | TA Instruments | v4.5.042498 | Rheometer instrument control and analysis software |
参考文献
- Cohen, K. E., Hernandez, L. P. The complex trophic anatomy of silver carp, Hypophthalmichthys molitrix, highlighting a novel type of epibranchial organ. Journal of Morphology. 279, 1615-1628 (2018).
- Cohen, K. E., Hernandez, L. P. Making a master filterer: Ontogeny of specialized filtering plates in silver carp (Hypophthalmichthys molitrix). Journal of Morphology. 279, 925-935 (2018).
- Cremer, M., Smitherman, R. Food habits and growth of silver and bighead carp in cages and ponds. Aquaculture. 20 (1), 57-64 (1980).
- Battonyai, I., et al. Relationship between gill raker morphology and feeding habits of hybrid bigheaded carps (Hypophthalmichthys spp.). Knowledge and Management of Aquatic Ecosystems. 416, 36(2015).
- Zhou, Q., Xie, P., Xu, J., Ke, Z., Guo, L. Growth and food availability of silver and bighead carps: Evidence from stable isotope and gut content analysis. Aquaculture Research. 40 (14), 1616-1625 (2009).
- Freedman, J. A., Butler, S. E., Wahl, D. H. Impacts of invasive Asian carps on native food webs (Final Report). , University of Illinois, Kaskaskia Biological Station. Urbana-Champaign, IL. (2012).
- Nico, L., Fuller, P., Li, J. Silver carp (Hypophthalmichthys molitrix)-FactSheet. , (2017).
- Walleser, L., Howard, D., Sandheinrich, M., Gaikowski, M., Amberg, J. Confocal microscopy as a useful approach to describe gill rakers of Asian species of carp and native filter-feeding fishes of the upper Mississippi River system. Journal of Fish Biology. 85 (5), 1777-1784 (2014).
- Nelson, A. Z., Ewoldt, R. H. Design of yield-stress fluids: a rheology-to-structure inverse problem. Soft Matter. 13, 7578-7594 (2017).
- Chen, T. Rheological Techniques for Yield Stress Analysis. TA Instruments Applications Note, RH025. , (2020).
- Ewoldt, R. H., Johnston, M. T., Caretta, L. M. Experimental challenges of shear rheology: how to avoid bad data. Complex Fluids in Biological Systems. Spagnolie, S. , Springer. (2015).
- Thornton, D. J., Sheehan, J. K. From Mucins to Mucus: Toward a more coherent understanding of this essential barrier. Proceedings of the American Thoracic Society. 1, 54-61 (2004).
- Shepard, K. L. Functions for fish mucus. Reviews in Fish Biology and Fisheries. 4, 401-429 (1994).
- Fernández-Alacid, L., et al. Skin mucus metabolites in response to physiological challenges: A valuable non-invasive method to study teleost marine species. Science of the Total Environment. 644, 1323-1335 (2018).
- Wagner, C. E., Wheeler, K. M., Ribbeck, K. Mucins and Their Role in Shaping the Functions of Mucus Barriers. Annual Reviews in Cell and Developmental Biology. 34, 189-215 (2018).
- Bird, R. B., Armstrong, R. C., Hassager, O. Dynamics of Polymeric Liquids, Volume 1: Fluid Mechanics. , Wiley. New York. 1255-1284 (1987).
- Mantle, M., Allen, A. Isolation and characterisation of the native glycoprotein from pig small intestinal mucus. Biochemical Journal. 195, 267-275 (1981).
- Allen, A., Hutton, D. A., Pearson, J. P., Sellers, L. A. Mucus glycoprotein structure, gel formation and gastrointestinal mucus function. Mucus and Mucosa (Ciba Foundation Symposium). Nugent, J., O'Conner, M. , Pitman. London. 137-156 (1984).
- Asakawa, M. Histochemical studies of the mucus on the epidermis of eel, Anguillajaponica. Bulletin of Japanese Society of Scientific Fisheries. 36, 83-87 (1970).
- Fletcher, T. C., Jones, R., Reid, L. Identification of glycoproteins in goblet cells of epidermis and gill of plaice (Pleuroneces platessa L.), flounder (Platichthys flesus (L.)) and rainbow trout (Salmo gairdneri Richardson). Histochemical Journal. 8, 597-608 (1976).
- Silberberg, A. Mucus glycoprotein, its biophysical and gel forming properties. Symposia of the Society for Experimental Biology. 43, 43-64 (1989).
- Hills, B. The Biology of Surfactants. , Cambridge Univ. Press. Cambridge. 408(1988).
- Aubert, H., Brook, A. J., Shephard, K. L. Measurement of the adhesion of a desmid to a substrate. British Phycology Journal. 24, 293-295 (1989).
- Sanderson, S. L., Cech, J. J., Patterson, M. R. Fluid dynamics in suspension feeding black fish. Science. 251, 1346-1348 (1991).
- Lai, S. K., Wang, Y. Y., Wirtz, D., Hanes, J. Micro- and macrorheology of mucus. Advanced Drug Delivery Reviews. 61 (2), 86-100 (2009).
- Chaudhary, G., Ewoldt, R. H., Thiffeault, J. L. Unravelling hagfish slime. Journal of Royal Society Interface. 16 (150), 20180710(2019).
- Downing, S., Salo, W., Spitzer, R., Koch, E. The hagfish slime gland: a model system for studying the biology of mucus. Science. 214, 1143-1145 (1981).
- Hwang, S. H., Litt, M., Forsman, W. C. Rheological properties of mucus. Rheologica Acta. 8, 438-448 (1969).
- Litt, M. Mucus rheology. Archives of Internal Medicine. 126, 417-423 (1970).
- Quarishi, M. S., Jones, N. S., Mason, J. The rheology of nasal mucus: a review. Clinical Otolaryngology. 23, 403-413 (1998).
- Nordgård, C. T., Draget, K. I., Seternes, T. Rheology of salmon skin mucus. Annual Transactions - The Nordic Rheology Society. 23, 175-179 (2015).
- Fernández-Alacid, L., et al. Comparison between properties of dorsal and ventral skin mucus in Senegalese sole: Response to an acute stress. Aquaculture. 513, 734410(2019).
- Yüce, C., Willenbacher, N. Challenges in Rheological Characterization of Highly Concentrated Suspensions - Case Study for Screen-printing Silver Pastes. Journal of Visualized Experiments. (122), e55377(2017).
- Sultan, S., Mathew, A. P. 3D Printed Porous Cellulose Nanocomposite Hydrogel Scaffolds. J. Vis. Exp. (146), (2019).
- Barnes, H. A., Hutton, J. F., Walters, K. An Introduction to Rheology. , Elsevier. Amsterdam. (1989).
- National Water Information System. USGS Current Conditions for USGS 06910450 Missouri River at Jefferson City, MO. U.S. Geological Survey. , Available from: https://nwis.waterdata.usgs.gov/usa/nwis/uv/?cb_00010=on&cb_00060=on&cb_00065=on&format=gif_default&site_no=0691045&p09-19&end_date=2018-09-21 (2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。