È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Caratterizzazione macro-reologica del muco Gill Raker nella carpa argentata, Hypophthalmichthys molitrix
In questo articolo
Riepilogo
Questo protocollo presenta un metodo per eseguire la caratterizzazione reologica del muco che risiede sui rastrellatori branchiali (GRI) della carpa argentata. Le caratteristiche viscoelastiche del GR-muco, ottenute misurando la viscosità, lo stoccaggio e i moduli di perdita, vengono valutate per l'apparente stress di snervamento per comprendere il meccanismo di alimentazione del filtro nelle GR.
Abstract
La carpa argentata, Hypophthalmichthys molitrix,è un pesce filtrante planctivoro invasivo che ha infestato i corsi d'acqua naturali del bacino superiore del fiume Mississippi grazie al suo meccanismo di alimentazione del filtro altamente efficiente. Gli organi caratteristici chiamati rastrellatori branchiali (GRI), che si trovano in molti di questi filtratori, facilitano la filtrazione efficiente di particelle di cibo come il fitoplancton che hanno dimensioni di pochi micron.
La motivazione per indagare la reologia del muco GR deriva dal nostro desiderio di capire il suo ruolo nell'aiutare il processo di alimentazione del filtro nella carpa argentata. Il fluido ricco di muco, in uno stato "denso e appiccicoso" può facilitare l'adesione del particolato alimentare. La permeazione e il trasporto attraverso la membrana GR sono facilitati dall'azione di forze di taglio esterne che inducono velocità di deformazione al taglio variabili. Pertanto, la reologia del muco può fornire un indizio vitale sulla tremenda natura di outcompeting della carpa argentata all'interno del pool di pesci che alimentano il filtro. Sulla base di ciò è stato ipotizzato che il muco GR possa fornire una funzione adesiva alle particelle alimentari e fungere da veicolo di trasporto per assistere nel processo di alimentazione del filtro.
L'obiettivo principale del protocollo è determinare lo stress di snervamento del muco, attribuito allo sforzo minimo di taglio richiesto per avviare il flusso al quale si osserva per la prima volta una deformazione plastica irreversibile attraverso un materiale viscoelastico strutturato. Di conseguenza, le proprietà reologiche del muco GR, cioè viscosità, stoccaggio e moduli di perdita, sono state studiate per la sua natura non newtoniana, di assottigliamento del taglio utilizzando un reometro rotazionale.
Un protocollo qui presentato è impiegato per analizzare le proprietà reologiche del muco estratto dai rastrellatori branchiali di una carpa argentata, pescato nella posizione di Hart Creek del fiume Missouri. Il protocollo mira a sviluppare una strategia efficace per i test reologici e la caratterizzazione materiale del muco assunto come materiale viscoelastico strutturato.
Introduzione
La carpa argentata, Hypophthalmichthys molitrix, è un alimentatore filtrante planctivoro e una specie invasiva che si è infiltrata in diversi corsi d'acqua naturali negli Stati Uniti. Questa specie è stata inizialmente introdotta nel bacino superiore del fiume Mississippi per controllare le fioriture algali1,2,3. La carpa argentata è un alimentatore estremamente efficiente. Tipicamente, le sue dimensioni delle particelle alimentari consumabili vanno da 4 a 20 μm a zooplancton più grandi che sono circa 80 μm3,4,5. Questa specie ha superato altri pesci nativi e può potenzialmente causare enormi danni ai corsi d'acqua nativi limitando le risorse disponibili1,2,6. Pertanto, l'alimentazione del filtro di pesci come la carpa argentata e la carpa bighead rappresentano una grave minaccia per i Grandi Laghi1,2,6,7,8.
I pesci che si nutrono di filtri possiedono organi speciali chiamati rastrellatori branchiali (GRI) con un sottile strato di muco che risiede sulla loro superficie. Questi organi migliorano l'efficienza della filtrazione e dell'aggregazione di piccole particelle dal fluido in entrata. L'obiettivo del protocollo qui presentato è quello di caratterizzare la proprietà non newtoniana del materiale di assottigliamento del taglio e lo stress di resa del muco GR acquisito dalla superficie interna dei rastrelli branchiali nella carpa argentata. Il valore dello stress di resa del GR-muco, accertato utilizzando un reometro rotazionale, è di interesse in questo studio. La tensione di snervamento misurata, chiamata anche "tensione di snervamento apparente", dipende dai metodi di prova come la velocità di taglio costante o la deformazione oscillatoria dinamica di tipo9,10. Il diradamento di taglio, "fluido di snervamento- stress", subisce una transizione dal comportamento solido a quello simile a quello liquido a una sollecitazione critica applicata9,11. Lo sforzo di snervamento apparente è lo sforzo di taglio minimo richiesto per avviare il flusso o quello in cui si osserva per la prima volta una deformazione plastica irreversibile quando il muco passa da un materiale gelatinoso a un materiale simile al fluido. Questo comportamento può essere osservato in materiali viscoelastici strutturati. La transizione dal comportamento gelatinoso a quello fluido del muco GR comporta due funzioni, ovvero un ruolo adesivo per raccogliere le particelle alimentari e un ruolo di veicolo di trasporto per assistere nel processo di consegna e filtrazione del particolato. La funzione estesa del muco include la creazione di barriere di diffusione nella resistenza alle malattie e nella respirazione, fornendo un rilascio controllato di fattori nutrizionali, componenti tossici ed escrezione, creando vie metaboliche per l'alimentazione e la nidificazione, aiutando nella protezione dei predatori e producendo modifiche dello strato limite che migliorano la locomozione e l'efficienza propulsiva12,13,14.
A differenza dei fluidi semplici, i fluidi complessi come il muco possiedono proprietà che variano con le condizioni di flusso e richiedono parametri di misurazione aggiuntivi per definire il loro comportamento fisico su scala di massa. Per monitorare la viscosità e lo stress di snervamento del muco GR, le misurazioni reologiche vengono eseguite utilizzando un reometro rotazionale. Il reometro rotazionale applica una sollecitazione o una deformazione di taglio costante o oscillatoria per mezzo di un disco rotante a contatto con il campione di fluido e ne misura la risposta. La logica alla base dell'utilizzo di questo strumento e tecnica è che il reometro può fornire una serie di misurazioni per descrivere le proprietà del materiale del muco GR della carpa argentata, che non può essere definito dalla sola viscosità.
Il muco è un materiale viscoelastico e la sua risposta meccanica ad una deformazione imposta è compresa tra quella di un solido puro (governato dalla legge di elasticità di Hooke) e quella di un liquido puro (governato dalla legge di viscosità di Newton)15,16. La complessa rete macromolecolare contenuta all'interno del muco può allungarsi e riorientarsi in risposta a forze esterne o deformazioni. Un reometro rotazionale è costituito da una geometria a cono e da una piastra di Peltier, come mostrato in Figura 1 e Figura 2 (vedere Tabella 1 per le specifiche della strumentazione). L'obiettivo di questo studio era quello di sviluppare un protocollo per determinare le proprietà reologiche del muco GR. Un vantaggio del reometro rotazionale rispetto a un viscosimetro è la sua capacità di effettuare misurazioni dinamiche utilizzando piccoli volumi di campione. Il volume del campione di muco GR in questo studio era di circa 1,4 ml. Il viscosimetro, d'altra parte, è limitato a velocità di taglio costanti e richiede grandi volumi di campione.
Si prevede che le proprietà reologiche del muco varieranno notevolmente all'interno dell'anatomia della carpa argentata. Ad esempio, le proprietà del muco che risiede sulle superfici GR possono essere diverse dall'organo epibranchiale. Per tenere conto della potenziale variabilità delle proprietà del muco in diverse regioni del pesce, il campione di muco GR acquisito è stato diluito e sono state create e testate soluzioni di tre concentrazioni utilizzando il reometro rotazionale. I dati e i risultati relativi alla reologia del muco riportati dopo l'esecuzione del protocollo hanno dimostrato l'efficacia della tecnica di misurazione. I dati illustrativi presentati in questo documento non sono destinati ad essere generalizzati all'intera popolazione di carpe argentate. Il protocollo qui presentato può essere esteso per studiare la reologia del muco su set di campioni più grandi per testare altre ipotesi.
Lo scopo di questo studio è dimostrare la variazione delle proprietà reologiche della reologia del muco GR con tre diverse concentrazioni di muco (400 mg/mL, 200 mg/mL e 100 mg/mL). La concentrazione di 400 mg/mL rappresenta il campione di muco crudo raccolto dai PR del pesce. L'acqua deionizzata (DI) è stata utilizzata per diluire il campione di muco crudo in concentrazioni di 200 mg/mL e 100 mg/mL. La diluizione dei campioni di muco ha permesso la valutazione del grado di assottigliamento del taglio e dello stress di resa apparente in funzione della concentrazione e la determinazione della concentrazione alla quale il muco GR passa al comportamento non newtoniano. Uno shaker è stato utilizzato per abbattere eventuali grandi grumi di muco nei campioni per mitigare gli errori nei dati reologici dovuti alla disomogeneità.
Nella maggior parte dei vertebrati, compresi i pesci, le macromolecole predominanti che formano muco sono glicoproteine (mucine) che tendono a gonfiarsi in acqua per intrecci o reticolazione chimica e creano un materiale gelatinoso12,13,17,18,19,20. Le macromolecole ad alto peso molecolare, che formano gel e l'alto contenuto di acqua riflettono la scivolosità nelmuco 13. Un alto grado di interazioni inter-macromolecolari porta alla formazione di gel, mentre livelli più bassi di interazioni inter-macromolecolari o legami rotti provocano fluidi ad alta viscosità21.
I processi di filtrazione del particolato alimentare nell'alimentazione del filtro per pesci sono aiutati da proprietà legate al muco GR come la coesione e la viscosità che determinano il suo potenziale di adesione e tack22. La forza dell'adesione a base di muco dipende da specifiche interazioni intermolecolari, elettrostatiche o idrofobiche23. Sanderson et al.24 hanno condotto uno studio sull'alimentazione in sospensione nel pesce nero in cui hanno trovato le prove dell'adesione a base di muco. Hanno affermato che l'adesione di particolati alimentari sospesi con una superficie mucosale è seguita dal trasporto di grumi aggregati di particelle legate insieme al muco da un flusso d'acqua diretto che agisce su di esso24. Il muco esposto a velocità di taglio generate dal flusso d'acqua facilita la consegna di particolato alimentare agli organi digestivi. Le tecniche endoscopiche sono state utilizzate per osservare le particelle filtrate24.
La letteratura sulla gamma di velocità di taglio e limiti pratici nei test reologici del muco GR è scarsa. Pertanto, è stata richiesta una guida da studi reologici su muco gastrico, nasale, cervicale e polmonare, muco della pelle di salmone, melma di hagfish e lubrificante superficiale osseo-articolare in cui sono stati studiati la caratterizzazione reologica e gli attributi non newtoniani11,12,25, 26,27,28,29,30,31. Più recentemente, l'effetto del muco della pelle di pesce sulla locomozione e sull'efficienza propulsiva è stato studiato utilizzando la viscosimetria a velocità di taglio costante. Studi di reologia del muco cutaneo (senza alcuna diluizione o omogeneizzazione) relativi a orate, spigole e magre hanno dimostrato un comportamento non newtoniano a velocità di taglio tipicamente basse14. In un altro studio correlato, i campioni di muco della pelle grezza dai lati dorsale e ventrale della sogliola senegalese sono risultati esibire un comportamento non newtoniano, indicando una maggiore viscosità del muco ventrale a tutte le velocità di taglio considerate32. Altri protocolli reologici relativi allo sviluppo dello scaffold idrogel e per sospensioni altamente concentrate mediante viscosimetro a velocità di taglio costante sono stati riportati anche in letteratura33,34.
In questo studio, le proprietà del muco GR sono state studiate utilizzando un reometro rotazionale controllato dalla velocità di deformazione che è stato ampiamente utilizzato in esperimenti di reologia su fluidi biologici complessi25. Per i fluidi newtoniani, la viscosità apparente rimane costante, è indipendente dalla velocità di taglio e le sollecitazioni di taglio variano linearmente con le velocità di deformazione di taglio (Figura 3A, B). Per i fluidi non newtoniani (come i fluidi di assottigliamento del taglio) la viscosità è dipendente dalla velocità di taglio o dalla storia della deformazione (Figura 3A, B). Il modulo di perdita (G") rappresenta la misura in cui il materiale resiste alla tendenza al flusso ed è rappresentativo della viscosità del fluido (Figura 4). Il modulo di stoccaggio (G') rappresenta la tendenza del materiale a recuperare la sua forma originale a seguito di deformazioni indotte da sollecitazioni ed è equivalente all'elasticità (Figura 4). L'angolo di fase (δ) o valore tangente di perdita, è calcolato dalla tangente inversa di G"/G'. Rappresenta l'equilibrio tra perdita di energia e stoccaggio ed è anche un parametro comune per caratterizzare i materiali viscoelastici (δ = 0° per un solido di Hookean; δ = 90° per un liquido viscoso; δ < 45° per un solido viscoelastico e δ > 45° per un liquido viscoelastico) (Figura 4)25. La tensione di snervamento apparente (σy) nei fluidi strutturati rappresenta un cambiamento di stato che può essere osservato nei dati reologici da sweep allo stato stazionario e sweep dinamici stress-deformazione10. Se la sollecitazione esterna applicata è inferiore alla sollecitazione di snervata apparente, il materiale si deformerà elasticamente. Quando la sollecitazione supera la sollecitazione di snervamento apparente (contrassegnata come "sollecitazione media" nella Figura 3B), il materiale passerà dalla deformazione elastica a quella plastica e inizierà a fluire allo stato liquido35. La misurazione del modulo di stoccaggio (G') e del modulo di perdita (G") nel campione di muco in condizioni di stress oscillatorio (o deformazione) quantifica il cambiamento dello stato materiale dal comportamento gelatinoso a quello viscoelastico simile al liquido.
I tipi di prove reometriche eseguite per monitorare i dati relativi al modulo di memorizzazione (G'), al modulo di perdita (G") e alla viscosità apparente (η) sono qui descritti. I test di oscillazione dinamica (sweep di deformazione e sweep di frequenza) hanno monitorato G' e G" sotto oscillazione controllata della geometria del cono. I test dinamici di deformazione hanno determinato la regione viscoelastica lineare (LVR) del muco monitorando la risposta intrinseca del materiale (Figura 4). Le sweep di deformazione sono state utilizzate per determinare il comportamento di resa a frequenza e temperatura di oscillazione costanti. I test di sweep a frequenza dinamica hanno monitorato la risposta del materiale all'aumento della frequenza (velocità di deformazione) a un'ampiezza costante (deformazione o sollecitazione) e temperatura. La deformazione è stata mantenuta nella regione viscoelastica lineare (LVR) per i test di sweep a frequenza dinamica. I test della velocità di taglio allo stato stazionario hanno monitorato la viscosità apparente (η) sotto rotazione costante della geometria del cono. Il muco GR è stato sottoposto a fasi di sollecitazione incrementali e la viscosità apparente (η, Pa.s) è stata monitorata per la variazione della velocità di taglio (ý, 1/s).
Il protocollo presentato in questo articolo tratta il muco GR come un materiale strutturato complesso di viscoelasticità sconosciuta con un certo intervallo di risposta viscoelastica lineare. Il muco del pesce è stato estratto dai GRI della carpa argentata durante una spedizione di pesca nella posizione del torrente Hart nel fiume Missouri dalla professoressa L. Patricia Hernandez (Dipartimento di Scienze Biologiche, The George Washington University) 1,2,36. Una matrice di GRI all'interno della bocca di una carpa argentata è mostrata nella Figura 5A e un disegno schematico è presentato nella Figura 5B. Un GR asportato è mostrato nella Figura 5C. L'estrazione del muco dai GRI della carpa argentata è presentata come esempio nei disegni schematici, Figura 5D,E. Tutte le prove del reometro sono state eseguite a temperatura costante e controllata di 22 ± 0,002 °C, la temperatura registrata nel sito di pesca1,2,36. Ogni campione di muco è stato testato tre volte con il reometro e i risultati medi sono presentati insieme alle barre di errore statistiche.
Access restricted. Please log in or start a trial to view this content.
Protocollo
1. Preparazione delle soluzioni di muco di varie concentrazioni
NOTA: Tre concentrazioni della soluzione di muco (400 mg/mL, 200 mg/mL e 100 mg/mL con volumi approssimativi, rispettivamente 1 mL, 1 mL e 2 mL) sono preparate per questo esperimento.
- Per calcolare la massa del muco, misurare la massa media delle fiale con (Mcon-muco ; mg) e senza muco (Mfiale ; mg). Quindi sottrarre la massa delle fiale con muco con quella senza muco (Mmuco = Mcon-muco - Mfiale ; mg).
- Diluire il muco in tre concentrazioni (400, 200, 100, mg/mL) con acqua deionizzata (DI).
- Preparare la prima concentrazione della soluzione di muco, 400 mg/mL aggiungendo 0,6 mL di acqua DI al muco usando una micropipetta.
NOTA: Poiché il volume approssimativo del muco estratto era di 1,4 ml, la soluzione da 400 mg/mL avrà un volume totale di ~ 2 ml. - Posizionare il flaconcino di soluzione di muco da 400 mg/mL su uno shaker per assicurarsi che la soluzione di muco sia adeguatamente omogeneizzata e che qualsiasi agglomerato di particolato di muco sia mitigato.
- Preparare la seconda concentrazione della soluzione di muco, 200 mg/mL, prelevando metà del volume della soluzione di muco di prima concentrazione in un nuovo flaconcino utilizzando una micropipetta e aggiungendo 1 mL di acqua DI nel nuovo flaconcino.
- Ripetere il passaggio 1.2.2 per il primo e il secondo flaconcino con soluzioni di muco.
- Preparare la terza concentrazione della soluzione di muco, 100 mg/mL, prelevando metà del volume (1 mL) della soluzione da 200 mg/mL in un nuovo flaconcino utilizzando una micropipetta e aggiungendo acqua DI nel nuovo flaconcino.
- Ripetere la fase 1.2.2 per tutte e tre le concentrazioni di soluzioni di muco nei rispettivi flaconcini (vedere Figura 1 supplementare).
- Conservare i flaconcini di soluzione di muco in frigorifero fino a quando non viene eseguita la calibrazione e il test del reometro.
- Preparare la prima concentrazione della soluzione di muco, 400 mg/mL aggiungendo 0,6 mL di acqua DI al muco usando una micropipetta.
2. Misurazioni e acquisizione dati mediante reometro
NOTA: I software utilizzati in questo protocollo per il controllo dello strumento e l'acquisizione dati con reometro sono indicati nella Tabella dei materiali. Questo software sarà indicato come "software di controllo dello strumento del reometro".
- Impostare e calibrare lo strumento reometro.
- Accendere l'alimentazione di aria compressa al reometro e assicurarsi che la tavola pneumatica e il reometro siano livellati utilizzando un misuratore di bolle. Togliere il cappuccio protettivo sull'albero del reometro e tenere fermo l'albero durante lo svitamento.
- Accendere gli interruttori principali del reometro per attivare i cuscinetti magnetici sul reometro.
- Accendere il computer di controllo del reometro con il software di controllo dello strumento del reometro installato al suo dentro e avviare il software di controllo dello strumento del reometro (vedere la Figura supplementare 2).
- Eseguire la calibrazione dello strumento selezionando le schede,'Calibrazione | Strumento' dalla finestra del software. Scegli l'opzione'Strumento'. Clicca su'Calibra'sotto'Inerzia'. Registrare il valore di calibrazione dell'inerzia dello strumento in μN.m.s2 e ripetere la calibrazione almeno 3 volte per assicurarsi che i valori di calibrazione siano entro il 10% l'uno dall'altro (vedere figura supplementare 3).
- Installare la geometria del reometro sull'albero del reometro.
- Fare clic sulla scheda'Geometrie'nel software di controllo dello strumento del reometro.
- Pulire il cono con la geometria desiderata(diametro 40 mm, cono 1 ◦0' 11'') e la piastra di Peltier con isopropanolo (vedere Tabella 1, Tabella dei materiali, Figura 1e Figura 2).
NOTA: La piastra Peltier viene installata sul reometro; può essere pulito con isopropanolo mentre è fissato direttamente al reometro. - Assicurarsi che il dispositivo della piastra Peltier sia privo di polvere visibile e pulito, se necessario, con isopropanolo. Installare la piastra Peltier se non è preinstallata nel reometro e collegare le connessioni del dissipatore di calore.
- Premere il 'pulsante diblocco ' sul reometro sull'albero di blocco collegato alla geometria del cono. Questo arresta la posizione dell'albero, ma può ruotare liberamente nella posizione.
- Clicca su'Smart Swap | Abilitato' nella scheda del software di controllo dello strumento reometro per consentire il rilevamento automatico della geometria (vedi Figura supplementare 4).
- Ruotare l'albero sulla parte superiore del reometro per avvitare la geometria. Il software rileverà la geometria dell'angolo del cono di 40 mm di diametro, 1◦ 0' 11 '' in questa fase (vedere Tabella 1 e Tabella dei materiali).
- Ripetere i passaggi 2.2.5 – 2.2.6 per assicurarsi che la geometria venga rilevata.
- Seleziona'Gap'sotto il'Pannellodi controllo' del software di controllo dello strumento reometro, fai clic sull'icona'Opzioni'e scegli l'opzione'Forza assiale'. Impostare la forza assiale su '1 Newton'; questo per garantire che la geometria del cono tocchi la piastra di Peltier per l'inizializzazione dello spazio zero (vedere figura supplementare 5).
- Eseguire la calibrazione della geometria del reometro.
- Selezionare la scheda 'Geometria' dalla finestra del software. Clicca su'Calibra'sotto'Inerzia'. Registrare il valore di calibrazione dell'inerzia geometrica in μN.m.s2 e ripeterlo 2-3 volte per assicurarsi che i valori di calibrazione siano entro il 10% l'uno dall'altro.
- Fare clic su'Calibra'sotto'Attrito'nella finestra del software. Registrare il valore di calibrazione dell'attrito geometrico in μN.m/(rad/s) e ripeterlo 2-3 volte per assicurarsi che i valori di calibrazione siano entro il 10% l'uno dall'altro (vedere figura supplementare 6).
- Eseguire l'inizializzazione zero-gap
NOTA: poiché la geometria non può essere sollevata con precisione sopra la piastra di Peltier per eseguire misurazioni senza una posizione "zero" di riferimento, viene eseguita l'inizializzazione zero-gap. Ai fini della misurazione, la geometria ha uno spazio geometrico incorporato di 24 μm e uno spazio di assetto di 28 μm. Lo spazio di assetto è impostato per pulire efficacemente il fluido in eccesso che potrebbe fuoriuscire al di fuori della superficie della geometria. Queste lacune sono indispensabili per misurare con precisione i dati utilizzando il campione e il reometro. Il passaggio 2.4.1 è assolutamente necessario per assicurarsi che la geometria sia impostata su zero gap per ottenere la geometria e gli spazi di taglio di 24 μm e 28 μm, rispettivamente.- Fai clic sull'icona'Zero gap'sotto la scheda'Gap'nel'Pannello di controllo'nella finestra del software. L'inizializzazione è completa quando la forza assiale sperimentata dalla geometria è maggiore o uguale a 1 N, in quanto tocca la piastra di Peltier. Assicurarsi che lo spazio del reometro sia azzerato in modo che la sua posizione di riferimento sia accurata (vedere la figura supplementare 7 e la figura supplementare 8).
- Premere i controlli 'freccia su e giù' sullo strumento reometro o 'geometria alza e abbassa' icone sotto la scheda 'Gap' nel software di controllo dello strumento reometro per aumentare la geometria a qualsiasi altezza arbitraria. La schermata di controllo sullo strumento reometro e il pannello di controllo del software di controllo dello strumento reometro visualizzeranno la (stessa) altezza dello spazio.
- Impostare la procedura sperimentale nel software di controllo dello strumento reometro. Eseguire la caratterizzazione delle proprietà reologiche utilizzando una geometria a piastra di cono su Peltier a 22 °C.
NOTA: Il sito web dell'US Geological Survey è stato utilizzato per accertare la temperatura dell'acqua del fiume Il 20 settembre 2018, quando la carpa argentata utilizzata per gli esperimenti di muco GR è stata pescata nella posizione di Hart Creek36. La temperatura del muco può influenzare le proprietà reologiche. Il significato di regolare i valori alla temperatura del fiume è quello di corrispondere approssimativamente alla temperatura sotto la quale le proprietà del muco possono essere realisticamente stimate.- Seleziona la scheda'Esperimenti'nel software di controllo dello strumento reometro e inserisci le informazioni pertinenti come'Nome','Operatore','Progetto'ecc. (cfr. figura 9 supplementare)
- Selezionare la scheda 'Geometria' e assicurarsi che le informazioni siano conformi ai passaggi 2.2.5. - 2.2.7. (cfr. figura 10 supplementare).
- Selezionare la scheda''Procedura',e utilizzare i tasti freccia impostare '1: Ampiezza di oscillazione' procedura. (cfr. figura 11 supplementare).
- Inizializzare le impostazioni di'Controllo ambientale'come segue: 'Temperatura = 22 °C'; 'Tempo di ammollo = 120 s' e selezionare la casella 'Attendi la temperatura' (vedi Figura supplementare 11).
- Inizializzare le impostazioni di 'Parametri di test' come segue: 'Frequenza = 1 Hz'; impostare 'Sweep logaritmico'; «Coppia = da 10 a 10000 μN.m»; «Punti per decennio = 5» (cfr. figura supplementare 11).
- Impostare l'esperimento per determinare il lineare viscoelastico range (LVR) del muco di concentrazione nota (100 mg/mL)
- Utilizzando un'appropriata micropipetta e punta della pipetta si aspirano circa 0,3 mL di soluzione di muco di pesce di concentrazione 100 mg/mL (vedere Fase 1.2, Tabella dei materiali).
- Introdurre la soluzione di muco sulla piastra di Peltier usando la micropipetta (vedere Figura 2).
- Premere il pulsante'Trim Gap'sul reometro per abbassare la geometria sulla piastra peltier. In alternativa, fare clic sull'icona'Trim Gap'sotto la scheda'Gap'nell'opzione'Pannello di controllo'nel software di controllo dello strumento reometro (vedere Figura supplementare 12).
- Utilizzare la micropipetta con la punta della pipetta per rimuovere qualsiasi soluzione di muco in eccesso e assicurarsi che il fluido si trova sotto la geometria senza fuoriuscite vicino alla periferia della geometria.
NOTA: il caricamento improprio del fluido porterà a errori nelle misurazioni. Il campione sotto riempito ridurrà la distribuzione della coppia e il campione sovrasempito porterà a distribuzioni di stress errate a causa della fuoriuscita lungo i bordi. - Selezionare alternativamente le schede'Motor'e 'Velocity' a 5 rad/s e 0 rad/s, fino a quando non c'è inerzia e velocità minime nel campione sotto la geometria. La schermata di controllo sullo strumento reometro e il pannello di controllo del software di controllo dello strumento reometro visualizzeranno la velocità (vedere figura supplementare 13).
- Premere il pulsante'Geometry Gap'sul reometro per abbassare la geometria allo spazio adatto preimpostato per geometria specifica. In alternativa, fare clic sull'icona'Geometry Gap'sotto la scheda'Gap'nell'opzione'Pannello di controllo'nel software di controllo dello strumento reometro (vedere figura supplementare 14).
- Eseguire l'esperimento per determinare l'intervallo viscoelastico lineare (LVR) del muco della concentrazione nota (100 mg / mL).
- Fare clic sull'icona'Start'sul software di controllo dello strumento del reometro (vedere la Figura supplementare 15).
NOTA: Il reometro esegue misurazioni automatiche; una volta premuto il pulsante'Start',il reometro impiegherà circa 20 minuti per completare il test. L'impostazione "Punti per decennio" nel passaggio 2.5.5 determina quanto tempo avrà bisogno il reometro per completare le misurazioni. - Esegui l'esperimento facendo clic su "Sì" nella finestra pop-up che appare e suggerisce che lo spazio geometrico venga abbassato alla distanza corretta per iniziare l'esperimento, se non già abbassato.
- Osservare il grafico in tempo reale generato dal reometro che riporta i moduli di stoccaggio (G') e perdita (G'').
NOTA: G' e G' sono rispettivamente i moduli di stoccaggio e perdita. Il modulo di stoccaggio rappresenta la tendenza del materiale a recuperare la sua forma originale a seguito di deformazioni indotte da sollecitazioni ed è equivalente all'elasticità. Il modulo di perdita rappresenta la misura in cui il materiale resiste alla tendenza al flusso ed è rappresentativo della viscosità del fluido (vedi Figura 4). - Impostate l'asse X del plottaggio su 'Percentuale di deformazione dell'oscillazione'. Per fare ciò, fare clic con il pulsante destro del mouse sul grafico presentato e scegliere lascheda 'Variabili grafico' (vedere Figura supplementare 16).
- Registrare l'intervallo percentuale di deformazione dell'oscillazione dal grafico prima che il materiale entri nell'intervallo viscoelastico non lineare, una volta completato il test.
- Premere i controlli 'freccia su e giù' sullo strumento del reometro o le icone 'geometry raise and lower' sotto la scheda 'Gap' nel software di controllo dello strumento del reometro per elevare la geometria a qualsiasi altezza arbitraria sopra la piastra di Peltier.
- Salvare il file che contiene sia la procedura sperimentale che i risultati nel formato di file nativo del software di controllo dello strumento reometro per accertare la regione viscoelastica lineare (LVR) del campione di muco.
NOTA: questo può essere fatto impostando l'asse X del grafico sull'ampiezza di deformazione (%) e/o sulla sollecitazione di oscillazione prima che i dati entrino nella regione viscoelastica non lineare (NLVR) (vedere figura supplementare 16).
oscillazione prima che i dati entrino nella regione viscoelastica non lineare (NLVR) (vedere figura supplementare 16).
- Fare clic sull'icona'Start'sul software di controllo dello strumento del reometro (vedere la Figura supplementare 15).
- Eseguire gli sweep dinamici e gli esperimenti di prova del flusso di taglio allo stato stazionario in Linear Viscoelastic Range (LVR) per il muco di concentrazione nota 100, mg / mL per generare risultati da tre campioni di muco indipendenti di 100 mg / mL. Eseguire questi passaggi sui campioni di concentrazione di muco disponibili singolarmente.
- Ripetere i passaggi 2.5.1 – 2.5.4.
- Inizializzare le impostazioni di 'Parametri di test' come segue: 'Frequenza = 1 Hz'; impostare 'Sweep logaritmico'; «Ceppo % = da 100 a 10000 %; 'Punti per decennio = 10'.
- Seleziona la scheda'Procedura'e usa i tasti freccia impostati sulla procedura '2: Frequenza di oscillazione'.
- Inizializzare le impostazioni di'Controllo ambientale'come segue: 'Temperatura = 22 °C'; 'Tempo di ammollo = 0,0 s'.
- Inizializzare le impostazioni di'Parametri di prova'come segue: 'Strain % = 1 %'; impostare 'Sweep logaritmico'; «Frequenza = da 20 a 1 Hz»; 'Punti per decennio = 10'.
- Selezionare la scheda'Procedura'e utilizzare i tasti freccia impostare la procedura '3: Flow Sweep'.
- Inizializzare le impostazioni di'Controllo ambientale'come segue: 'Temperatura = 22 °C'; 'Tempo di ammollo = 0,0 s'.
- Inizializzare le impostazioni di 'Parametri di prova' come segue: 'Velocità di taglio = da 1 a 10000 1/s'; «Punti per decennio = 10»; casella di controllo 'Rilevamento dello stato stazionario'.
- Ripeti i passaggi 2.7.1 – 2.7.2 e attendi fino al completamento dell'esperimento, circa 45 minuti.
- Premere i controlli 'freccia su e giù' sullo strumento reometro o le icone 'geometry raise and lower' nella scheda 'Gap' nel software di controllo dello strumento reometro per elevare la geometria a qualsiasi altezza arbitraria.
- Utilizzare salviette e guanti monouso per rimuovere e pulire il muco sulla piastra di Peltier con soluzione di isopropanolo (vedere Tabella dei materiali).
- Salvare il file che contiene sia la procedura sperimentale che i risultati nel formato di file nativo del software di controllo dello strumento del reometro.
3. Ripetere il protocollo per altre concentrazioni di soluzioni di muco di 200 mg/mL e 400 mg/mL.
- Eseguire i passaggi 2.5 – 2.8 includendo tutte le sotto-fasi ivi elencate per le restanti due concentrazioni di soluzioni di muco, 200 mg / mL e 400 mg / mL.
4. Rappresentazione grafica e analisi dei dati
NOTA: il codice fornito nel file di codice supplementare esegue la media dei dati e genera errori di ripetibilità, sovrappone i dati di tutti gli esperimenti. Le funzioni di calcolo della deviazione standard non sono disponibili nel software di controllo dello strumento del reometro. Il codice è scritto in un linguaggio di programmazione per l'analisi dei dati, la post-elaborazione e la rappresentazione grafica (vedi Tabella dei materiali per i dettagli).
- Esportare i dati generati dal passo 2.8 relativo alla concentrazione di muco 100 mg/mL GR e dal passo 3.1 relativo alle concentrazioni di muco 200 mg/mL e 400 mg/mL GR in formato foglio di calcolo facendo clic sulla scheda 'File | Esporta | Excel' nel software di controllo dello strumento reometro (vedi Figura supplementare 17).
- Eseguire codici supplementari per generare grafici di viscosità apparente (η) per velocità di deformazione di taglio variabili (
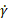 ) e modulo di perdita (G), modulo di stoccaggio (G') e angolo di fase (δ) per variare lo stress di oscillazione ( ) e
) e modulo di perdita (G), modulo di stoccaggio (G') e angolo di fase (δ) per variare lo stress di oscillazione ( ) e  generare risultati rappresentativi.
generare risultati rappresentativi.
Access restricted. Please log in or start a trial to view this content.
Risultati
In questa sezione presentiamo i risultati degli esperimenti sul muco GR utilizzando un reometro rotazionale con geometria a cono (diametro 40 mm, 1° 0' 11'') e una piastra di Peltier. Gli esperimenti hanno contribuito a caratterizzare il comportamento non newtoniano di assottigliamento al taglio del muco GR e l'apparente stress di resa che raffigura la transizione del muco da un materiale simile al gel a un materiale simile a un fluido. I risultati rappresentativi comportano descrizioni quantitative dei limiti di coppia...
Access restricted. Please log in or start a trial to view this content.
Discussione
Uno degli obiettivi principali dello sviluppo di questo protocollo è quello di stabilire che è adatto per la caratterizzazione reologica del muco GR quando sono disponibili volumi di campione molto piccoli. Riconosciamo che sono necessari più campioni da una scuola di carpa argentata per caratterizzare pienamente le proprietà reologiche del muco GR e i dati qui presentati non sono una generalizzazione sull'intera popolazione di carpe argentee. La nostra tecnica è giustificata dalla sua efficacia con la caratterizzaz...
Access restricted. Please log in or start a trial to view this content.
Divulgazioni
Nessun conflitto di interessi dichiarato.
Riconoscimenti
Gli autori riconoscono il sostegno e il finanziamento del GW Center for Biomimetics and Bioinspired Engineering. Ringraziamo la professoressa L. Patricia Hernandez del Dipartimento di Scienze Biologiche della George Washington University per aver ispirato l'indagine e la collaborazione in corso, fornendo competenze biologiche sulla fisiologia della carpa argentata e fornendo i campioni di muco. Ringraziamo gli studenti, David Palumbo, Carly Cohen, Isaac Finberg, Dominick Petrosino, Alexis Renderos, Priscilla Varghese, Carter Tegen e Raghav Pajjur per l'aiuto in laboratorio e Thomas Evans e James Thomas di TA Instruments, New Castle, DE per il supporto con la formazione e la manutenzione del reometro. Le immagini per le figure 5A, C sono state scattate durante una dissezione eseguita dalla professoressa L. Patricia Hernandez del Dipartimento di Scienze Biologiche della George Washington University.
Access restricted. Please log in or start a trial to view this content.
Materiali
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Kim Wipes | VWR | 470224-038 | To clean Sample from plate |
| Gloves | VWR | 89428-750 | To prevent contamination of sample |
| Pipette | VWR | 89079-974 | To transport sample from vial to rheometer |
| Pipette Tips | Thermo Scientific | 72830-042 | To transport sample from vial to rheometer |
| Shaker | VWR | 89032-094 | To homogenously mix sample of mucus |
| Vials | VWR | 66008-710 | Contains measured sample volumes |
| Weigh Scale | Ohaus | Scout –SPX Balances | To weigh mass of mucus samples |
| Chemical Reagents | |||
| De-Ionized Water (H20) | - | - | Liquid |
| Sterile 70% Isopropanol (C3H8O) | VWR | 89108-162 | Liquid |
| GR Mucus | |||
| 100 mg/mL concentration, 2mL | - | - | Viscoelastic Material |
| 400 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| 200 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| Software | |||
| MATLAB | Mathworks | R2017a | Data analysis, post-processing and graphical representation |
| Trios | TA Instruments | v4.5.042498 | Rheometer instrument control and analysis software |
Riferimenti
- Cohen, K. E., Hernandez, L. P. The complex trophic anatomy of silver carp, Hypophthalmichthys molitrix, highlighting a novel type of epibranchial organ. Journal of Morphology. 279, 1615-1628 (2018).
- Cohen, K. E., Hernandez, L. P. Making a master filterer: Ontogeny of specialized filtering plates in silver carp (Hypophthalmichthys molitrix). Journal of Morphology. 279, 925-935 (2018).
- Cremer, M., Smitherman, R. Food habits and growth of silver and bighead carp in cages and ponds. Aquaculture. 20 (1), 57-64 (1980).
- Battonyai, I., et al. Relationship between gill raker morphology and feeding habits of hybrid bigheaded carps (Hypophthalmichthys spp.). Knowledge and Management of Aquatic Ecosystems. 416, 36(2015).
- Zhou, Q., Xie, P., Xu, J., Ke, Z., Guo, L. Growth and food availability of silver and bighead carps: Evidence from stable isotope and gut content analysis. Aquaculture Research. 40 (14), 1616-1625 (2009).
- Freedman, J. A., Butler, S. E., Wahl, D. H. Impacts of invasive Asian carps on native food webs (Final Report). , University of Illinois, Kaskaskia Biological Station. Urbana-Champaign, IL. (2012).
- Nico, L., Fuller, P., Li, J. Silver carp (Hypophthalmichthys molitrix)-FactSheet. , (2017).
- Walleser, L., Howard, D., Sandheinrich, M., Gaikowski, M., Amberg, J. Confocal microscopy as a useful approach to describe gill rakers of Asian species of carp and native filter-feeding fishes of the upper Mississippi River system. Journal of Fish Biology. 85 (5), 1777-1784 (2014).
- Nelson, A. Z., Ewoldt, R. H. Design of yield-stress fluids: a rheology-to-structure inverse problem. Soft Matter. 13, 7578-7594 (2017).
- Chen, T. Rheological Techniques for Yield Stress Analysis. TA Instruments Applications Note, RH025. , (2020).
- Ewoldt, R. H., Johnston, M. T., Caretta, L. M. Experimental challenges of shear rheology: how to avoid bad data. Complex Fluids in Biological Systems. Spagnolie, S. , Springer. (2015).
- Thornton, D. J., Sheehan, J. K. From Mucins to Mucus: Toward a more coherent understanding of this essential barrier. Proceedings of the American Thoracic Society. 1, 54-61 (2004).
- Shepard, K. L. Functions for fish mucus. Reviews in Fish Biology and Fisheries. 4, 401-429 (1994).
- Fernández-Alacid, L., et al. Skin mucus metabolites in response to physiological challenges: A valuable non-invasive method to study teleost marine species. Science of the Total Environment. 644, 1323-1335 (2018).
- Wagner, C. E., Wheeler, K. M., Ribbeck, K. Mucins and Their Role in Shaping the Functions of Mucus Barriers. Annual Reviews in Cell and Developmental Biology. 34, 189-215 (2018).
- Bird, R. B., Armstrong, R. C., Hassager, O. Dynamics of Polymeric Liquids, Volume 1: Fluid Mechanics. , Wiley. New York. 1255-1284 (1987).
- Mantle, M., Allen, A. Isolation and characterisation of the native glycoprotein from pig small intestinal mucus. Biochemical Journal. 195, 267-275 (1981).
- Allen, A., Hutton, D. A., Pearson, J. P., Sellers, L. A. Mucus glycoprotein structure, gel formation and gastrointestinal mucus function. Mucus and Mucosa (Ciba Foundation Symposium). Nugent, J., O'Conner, M. , Pitman. London. 137-156 (1984).
- Asakawa, M. Histochemical studies of the mucus on the epidermis of eel, Anguillajaponica. Bulletin of Japanese Society of Scientific Fisheries. 36, 83-87 (1970).
- Fletcher, T. C., Jones, R., Reid, L. Identification of glycoproteins in goblet cells of epidermis and gill of plaice (Pleuroneces platessa L.), flounder (Platichthys flesus (L.)) and rainbow trout (Salmo gairdneri Richardson). Histochemical Journal. 8, 597-608 (1976).
- Silberberg, A. Mucus glycoprotein, its biophysical and gel forming properties. Symposia of the Society for Experimental Biology. 43, 43-64 (1989).
- Hills, B. The Biology of Surfactants. , Cambridge Univ. Press. Cambridge. 408(1988).
- Aubert, H., Brook, A. J., Shephard, K. L. Measurement of the adhesion of a desmid to a substrate. British Phycology Journal. 24, 293-295 (1989).
- Sanderson, S. L., Cech, J. J., Patterson, M. R. Fluid dynamics in suspension feeding black fish. Science. 251, 1346-1348 (1991).
- Lai, S. K., Wang, Y. Y., Wirtz, D., Hanes, J. Micro- and macrorheology of mucus. Advanced Drug Delivery Reviews. 61 (2), 86-100 (2009).
- Chaudhary, G., Ewoldt, R. H., Thiffeault, J. L. Unravelling hagfish slime. Journal of Royal Society Interface. 16 (150), 20180710(2019).
- Downing, S., Salo, W., Spitzer, R., Koch, E. The hagfish slime gland: a model system for studying the biology of mucus. Science. 214, 1143-1145 (1981).
- Hwang, S. H., Litt, M., Forsman, W. C. Rheological properties of mucus. Rheologica Acta. 8, 438-448 (1969).
- Litt, M. Mucus rheology. Archives of Internal Medicine. 126, 417-423 (1970).
- Quarishi, M. S., Jones, N. S., Mason, J. The rheology of nasal mucus: a review. Clinical Otolaryngology. 23, 403-413 (1998).
- Nordgård, C. T., Draget, K. I., Seternes, T. Rheology of salmon skin mucus. Annual Transactions - The Nordic Rheology Society. 23, 175-179 (2015).
- Fernández-Alacid, L., et al. Comparison between properties of dorsal and ventral skin mucus in Senegalese sole: Response to an acute stress. Aquaculture. 513, 734410(2019).
- Yüce, C., Willenbacher, N. Challenges in Rheological Characterization of Highly Concentrated Suspensions - Case Study for Screen-printing Silver Pastes. Journal of Visualized Experiments. (122), e55377(2017).
- Sultan, S., Mathew, A. P. 3D Printed Porous Cellulose Nanocomposite Hydrogel Scaffolds. J. Vis. Exp. (146), (2019).
- Barnes, H. A., Hutton, J. F., Walters, K. An Introduction to Rheology. , Elsevier. Amsterdam. (1989).
- National Water Information System. USGS Current Conditions for USGS 06910450 Missouri River at Jefferson City, MO. U.S. Geological Survey. , Available from: https://nwis.waterdata.usgs.gov/usa/nwis/uv/?cb_00010=on&cb_00060=on&cb_00065=on&format=gif_default&site_no=0691045&p09-19&end_date=2018-09-21 (2020).
Access restricted. Please log in or start a trial to view this content.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon