É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Caracterização macro-reologia de Gill Raker Mucus na Carpa de Prata, Hipophthalmichthys molitrix
Neste Artigo
Resumo
Este protocolo apresenta um método para realizar a caracterização da reologia do muco que reside em rakers de brânquias (GRs) da carpa prateada. Características viscoelásticas do GR-muco, obtidas pela medição da viscosidade, armazenamento e moduli de perda, são avaliadas pelo estresse de rendimento aparente para entender o mecanismo de alimentação do filtro em RGs.
Resumo
A carpa prateada, Hypophthalmichthys molitrix,é um peixe alimentador de filtros plâncido invasivo que infestava as vias navegáveis naturais da bacia do alto rio Mississippi devido ao seu mecanismo de alimentação de filtro altamente eficiente. Os órgãos característicos chamados gill rakers (GRs), encontrados em muitos desses alimentadores de filtros, facilitam a filtragem eficiente de partículas alimentares como fitoplâncton que são de alguns mícrons de tamanho.
A motivação para investigar a reologia do muco GR decorre do nosso desejo de entender seu papel em auxiliar o processo de alimentação do filtro na carpa prateada. O fluido rico em muco, em um estado "espesso e pegajoso", pode facilitar a adesão de partículas alimentares. A permeação e o transporte através da membrana GR são facilitados pela ação de forças externas de tesoura que induzem taxas variadas de tensão de tesoura. Portanto, a reologia da muco pode fornecer uma pista vital para a tremenda natureza supercompetitante da carpa prateada dentro da piscina de peixes de alimentação de filtros. Com base nisso, foi postulado que o muco GR pode fornecer uma função adesiva às partículas alimentares e atuar como um veículo de transporte para auxiliar no processo de alimentação do filtro.
O principal objetivo do protocolo é determinar o estresse de rendimento do muco, atribuído ao estresse mínimo de cisalhamento necessário para iniciar o fluxo no qual a deformação plástica irreversível é observada pela primeira vez através de um material viscoelástico estruturado. Assim, as propriedades reológicas do muco GR, ou seja, viscosidade, armazenamento e moduli de perda, foram investigadas por sua natureza não newtoniana, de corte-afinamento usando um reômetro rotacional.
Um protocolo apresentado aqui é empregado para analisar as propriedades reológicas do muco extraído dos rakers de uma carpa prateada, pescada na localização de Hart Creek do rio Missouri. O protocolo visa desenvolver uma estratégia eficaz para testes reológicos e caracterização material do muco considerado um material viscoelástico estruturado.
Introdução
A carpa prateada, Hypophthalmichthys molitrix,é um alimentador de filtros plâncido e uma espécie invasora que se infiltrou em várias vias navegáveis naturais nos Estados Unidos. Esta espécie foi inicialmente introduzida na bacia do alto rio Mississippi para controlar as flores de algas1,2,3. A carpa prateada é um alimentador extremamente eficiente. Normalmente, seus tamanhos de partículas de alimentos consumíveis variam de 4 a 20 μm a zooplâncton maior que são em torno de 80 μm3,4,5. Esta espécie superou outros peixes nativos e pode potencialmente causar enormes danos às vias navegáveis nativas limitando os recursos disponíveis1,2,6. Assim, filtrar peixes que alimentam como a carpa prateada e a carpa cabeça grande representam uma grande ameaça para os Grandes Lagos1,2,6,7,8.
Os peixes de alimentação de filtros possuem órgãos especiais chamados de rakers de brânquias (GRs) com uma fina camada de muco residente em sua superfície. Esses órgãos melhoram a eficiência da filtração e agregação de pequenas partículas do fluido de entrada. O objetivo do protocolo aqui apresentado é caracterizar a propriedade material não newtoniana, de corte e produzir estresse do muco GR adquirido da superfície interna dos rakers de brânquia na carpa prateada. O valor do estresse de rendimento do GR-muco, verificado por meio de um reômetro rotacional, é de interesse neste estudo. O estresse de rendimento medido também chamado de "estresse de rendimento aparente" depende dos métodos de teste, como taxa de corte constante ou tensão oscilatória dinâmica tipo9,10. O "fluido de estresse de rendimento", sofre uma transição do comportamento sólido para o líquido em um estresse aplicado crítico9,11. O estresse de rendimento aparente é o estresse mínimo de cisalhamento necessário para iniciar o fluxo ou aquele em que a deformação plástica irreversível é observada pela primeira vez quando o muco transita de um material semelhante a gel para um material semelhante a um fluido. Esse comportamento pode ser observado em materiais viscoelásticos estruturados. A transição do comportamento em gel para fluido do muco GR implica duas funções, ou seja, um papel adesivo para coletar partículas de alimentos e um papel de veículo de transporte para auxiliar no processo de entrega e filtragem de partículas. A função estendida do muco inclui a criação de barreiras de difusão na resistência e respiração da doença, fornecendo liberação controlada de fatores nutricionais, componentes tóxicos e excreção, criação de vias metabólicas para alimentação e aninhamento, auxiliando na proteção de predadores e produzindo modificações de camadas de fronteira que melhoram a locomoção e eficiência propulsiva12,13,14.
Ao contrário dos fluidos simples, fluidos complexos como o muco possuem propriedades que variam com as condições de fluxo e requerem parâmetros adicionais de medição para definir seu comportamento físico em escala a granel. Para monitorar a viscosidade e o estresse de rendimento do muco GR, as medições reológicas são realizadas utilizando um reômetro rotacional. O reômetro rotacional aplica um estresse ou tensão de tesoura estável ou oscilatória por meio de um disco rotativo em contato com a amostra de fluido e mede sua resposta. A lógica por trás do uso deste instrumento e técnica é que o reômetro pode fornecer um conjunto de medidas para descrever as propriedades materiais do muco GR da carpa prateada, que não pode ser definida apenas pela viscosidade.
O muco é um material viscoelástico e sua resposta mecânica a uma deformação imposta é entre a de um sólido puro (regido pela lei de elasticidade de Hooke) e o de um líquido puro (regido pela lei de viscosidade de Newton)15,16. A complexa rede macromolecular contida no muco pode esticar e reorientar em resposta a forças externas ou deformação. Um reômetro rotacional é composto por uma geometria de cone e uma placa Peltier, como mostrado na Figura 1 e Figura 2 (ver Tabela 1 para especificações de instrumentação). O objetivo deste estudo foi desenvolver um protocolo para determinar as propriedades reológicas do muco gr. Uma vantagem do reômetro rotacional sobre um viscometro é sua capacidade de fazer medições dinâmicas usando pequenos volumes de amostra. O volume da amostra de muco GR neste estudo foi de aproximadamente 1,4 mL. O viscometro, por outro lado, limita-se a taxas constantes de tesoura e requer grandes volumes amostrais.
Espera-se que as propriedades reológicas do muco variem muito dentro da anatomia da carpa prateada. Por exemplo, as propriedades do muco residente nas superfícies gr podem ser diferentes do órgão epibranchial. Para explicar a potencial variabilidade das propriedades do muco em diferentes regiões do peixe, a amostra de muco GR adquirida foi diluída, e soluções de três concentrações foram criadas e testadas utilizando-se o reômetro rotacional.. Os dados e resultados relativos à reologia muco relatados após a execução do protocolo demonstraram a eficácia da técnica de medição. Os dados ilustrativos apresentados neste artigo não devem ser generalizados em toda a população de carpas de prata. O protocolo aqui apresentado pode ser estendido para investigar a reologia do muco em conjuntos de amostras maiores para testar outras hipóteses.
O objetivo deste estudo é demonstrar a variação das propriedades reológicas da reologia do muco GR com três concentrações diferentes de muco (400 mg/mL, 200 mg/mL e 100 mg/mL). A concentração de 400 mg/mL representa a amostra de muco cru colhida do peixe GRs. A água desionizada (DI) foi utilizada para diluir a amostra de muco cru em concentrações de 200 mg/mL e 100 mg/mL. Diluir as amostras de muco permitiu a avaliação do grau de afinamento da tesoura e do estresse de rendimento aparente em função da concentração e da determinação da concentração em que o muco gr transita para o comportamento não newtoniano. Um shaker foi usado para quebrar qualquer grande aglomerado de muco nas amostras para mitigar erros nos dados reológicos devido à inhomogeneidade.
Na maioria dos vertebrados, incluindo os peixes, as macromoléculas predominantes formadoras de muco são glicoproteínas (mucinas) que tendem a inchar na água por emaranhados ou cruzamentos químicos e criam um material semelhante a gel12,13,17,18,19,20. As macromoléculas de alto peso molecular, formadoras de gel e o alto teor de água refletem a escorregadia no muco13. Um alto grau de interações intermoleculares leva à formação de gel, enquanto níveis mais baixos de interações intermoleculares ou ligações quebradas resultam em fluidos de alta viscosidade21.
Os processos de filtragem de partículas alimentares em peixes de alimentação de filtros são auxiliados por propriedades relacionadas ao muco GR, como coesão e viscosidade que determinam seu potencial de adesão e aderência22. A força da adesão à base de muco depende de interações intermoleculares, eletrostáticas ou hidrofóbicas específicas23. Sanderson et al.24 realizaram um estudo de alimentação suspensa em peixes negros onde encontraram evidências de adesão à base de muco. Eles afirmaram que a adesão de partículas de alimentos suspensas com uma superfície mucosa é seguida pelo transporte de aglomerados agregados de partículas ligadas ao muco por fluxo de água direcionado agindo sobre ele24. O muco exposto às taxas de cisalhamento geradas a partir do fluxo de água facilita a entrega de partículas alimentares para órgãos digestivos. Técnicas endoscópicas foram utilizadas para observar partículas filtradas24.
A literatura sobre a gama de taxas de tesoura e limites práticos nos testes reológicos do muco gr é escassa. Assim, foram buscadas orientações de estudos reológicos sobre muco gástrico, nasal, cervical e pulmonar, muco da pele de salmão, lodo de peixe-bruxa e lubrificante da superfície da articulação óssea em que foram estudados os atributos reológicos e não newtonianos11,12,25,26,27,28,29,30,31. Mais recentemente, o efeito do muco da pele do peixe na locomoção e eficiência propulsiva tem sido estudado usando viscometria constante da taxa de corte. Estudos de reologia do muco da pele (sem qualquer diluição ou homogeneização) relativos ao seabream, sea bass e mísero demonstraram comportamento não newtoniano a taxas tipicamente baixas de tesoura14. Em outro estudo relacionado, as amostras de muco de pele crua dos lados dorsal e ventral da sola senegalesa apresentaram comportamento não newtoniano, indicando maior viscosidade do muco ventral em todas as taxas de corte consideradas32. Outros protocolos reológicos relativos ao desenvolvimento de andaimes de hidrogel e para suspensões altamente concentradas utilizando um viscometro de taxa de corte constante também foram relatados na literatura33,34.
Neste estudo, as propriedades de muco GR foram investigadas utilizando-se um reômetro controlado e rotacional controlado pela taxa de tensão que tem sido amplamente utilizado em experimentos de reologia em fluidos biológicos complexos25. Para os fluidos newtonianos, a viscosidade aparente permanece constante, é independente da taxa de corte e as tensões de tesoura variam linearmente com as taxas de tensão de tesoura(Figura 3A, B). Para fluidos não newtonianos (como fluidos de corte), a viscosidade é dependente da taxa de corte ou dependente da história de deformação(Figura 3A,B). O módulo de perda (G) representa até que ponto o material resiste à tendência ao fluxo e representa a viscosidade fluida(Figura 4). O módulo de armazenamento (G') representa a tendência do material de recuperar sua forma original após a deformação induzida pelo estresse e equivale à elasticidade(Figura 4). O ângulo de fase (δ) ou o valor tangente de perda, é calculado a partir da tangente inversa de G"/G'. Representa o equilíbrio entre perda de energia e armazenamento e também é parâmetro comum para caracterização de materiais viscoelásticos (δ = 0° para um sólido hookean; δ = 90° para um líquido viscoso; δ < 45° para um sólido viscoelástico e δ > 45° para um líquido viscoelástico) (Figura 4)25. O estresse de rendimento aparente (σy) em fluidos estruturados representa uma mudança de estado que pode ser observada em dados reológicos de varredura de estado constante e varreduras dinâmicas de tensão de estresse10. Se o estresse aplicado externo for menor do que o estresse aparente de rendimento, o material se deformará esteticamente. Quando o estresse excede o estresse aparente de rendimento (marcado como "estresse médio" na Figura 3B), o material passará do elástico para a deformação plástica e começará a fluir em seu estado líquido35. Medir o módulo de armazenamento (G') e o módulo de perda (G") na amostra de muco sob condições de estresse oscilatório (ou tensão) quantifica a mudança no estado material de comportamento líquido semelhante ao gel para o líquido viscoelástico.
Os tipos de testes de reômetro realizados para monitorar dados relativos ao módulo de armazenamento (G'), módulo de perda (G") e viscosidade aparente (η) são descritos aqui. Os testes de oscilação dinâmica (varreduras de tensão e varreduras de frequência) monitoraram G' e G" sob oscilação controlada da geometria do cone. Os testes dinâmicos de varredura de tensão determinaram a região viscoelástica linear (LVR) do muco monitorando a resposta intrínseca do material(Figura 4). As varreduras de tensão foram utilizadas para determinar o comportamento de rendimento na frequência e temperatura constantes de oscilação. Os testes dinâmicos de varredura de frequência monitoraram a resposta do material ao aumento da frequência (taxa de deformação) em uma amplitude constante (tensão ou estresse) e temperatura. A cepa foi mantida na região viscoelástica linear (LVR) para os testes dinâmicos de varredura de frequência. Os testes de taxa de corte de estado estável monitoraram a viscosidade aparente (η) sob rotação constante da geometria do cone. O muco gr foi submetido a etapas de estresse incremental e viscosidade aparente (η, Pa.s) foi monitorado para taxa de corte variada (ý, 1/s).
O protocolo apresentado neste artigo trata o muco GR como um material estruturado complexo de viscoelasticidade desconhecida com uma certa faixa de resposta viscoelástica linear. O muco de peixe foi extraído das RRs da carpa prateada durante uma expedição de pesca no riacho Hart no rio Missouri pela professora L. Patricia Hernandez (Departamento de Ciências Biológicas da Universidade George Washington) 1,2,36. Uma matriz de GRs dentro da boca de uma carpa prateada é mostrada na Figura 5A e um desenho esquemático é apresentado na Figura 5B. Um GR excised é mostrado na Figura 5C. A extração de muco de GRs da carpa prateada é apresentada como exemplo nos desenhos esquemáticos, Figura 5D, E. Todos os testes de reômetro foram realizados sob uma temperatura constante e controlada de 22 ± 0,002 °C, temperatura registrada no local de pesca1,2,36. Cada amostra de muco foi testada três vezes com o reômetro, e os resultados médios são apresentados juntamente com as barras de erro estatístico.
Protocolo
1. Preparação das soluções de muco de várias concentrações
NOTA: Três concentrações da solução de muco (400 mg/mL, 200 mg/mL e 100 mg/mL com volumes aproximados, 1 mL, 1 mL e 2 mL, respectivamente) estão preparadas para este experimento.
- Para calcular a massa do muco, meça a massa média dos frascos com (Mcom muco ; mg) e sem muco (frascos M; mg). Em seguida, subtraia a massa dos frascos com muco com isso sem muco(Mmucus = M commuco - frascos M ; mg).
- Diluir o muco em três concentrações (400, 200, 100, mg/mL) com água deionizada (DI).
- Prepare a primeira concentração da solução de muco, 400 mg/mL adicionando 0,6 mL de água DI ao muco usando uma micropipette.
NOTA: Como o volume aproximado do muco extraído foi de 1,4 mL, a solução de 400 mg/mL terá um volume total de ~ 2 mL. - Coloque o frasco de solução de muco de 400 mg/mL em um agitador para garantir que a solução de muco esteja adequadamente homogeneizada, e qualquer aglomeração de partículas de muco seja atenuada.
- Prepare a segunda concentração da solução de muco, 200 mg/mL, desenhando metade do volume da solução de muco de primeira concentração em um novo frasco usando uma micropipette e adicionando 1 mL de água DI no novo frasco.
- Repita o passo 1.2.2 para o primeiro e segundo frascos com soluções de muco.
- Prepare a terceira concentração da solução de muco, 100 mg/mL, desenhando metade do volume (1 mL) da solução de 200 mg/mL em um novo frasco usando uma micropipette e adicione água DI no novo frasco.
- Repita o passo 1.2.2 para todas as três concentrações de soluções de muco em seus respectivos frascos (ver Figura Suplementar 1).
- Armazene os frascos de solução de muco em uma geladeira até que a calibração e o teste do reômetro seja realizado.
- Prepare a primeira concentração da solução de muco, 400 mg/mL adicionando 0,6 mL de água DI ao muco usando uma micropipette.
2. Medições e aquisição de dados utilizando um reômetro
NOTA: O software utilizado neste protocolo para controle de instrumentos e aquisição de dados com reômetro são observados na Tabela de Materiais. Este software será chamado de "software de controle de instrumentos reômetro".
- Configure e calibrar o instrumento de reômetro.
- Ligue a fonte de ar comprimido ao reômetro e certifique-se de que a tabela pneumática e o reômetro sejam nivelados usando um medidor de bolhas. Gire a tampa protetora no eixo do reômetro e segure o eixo ainda enquanto desaparafusa.
- Ligue os interruptores principais do reômetro para ativar os rolamentos magnéticos no reômetro.
- Ligue o computador de controle do reômetro com o software de controle do instrumento reômetro instalado nele e inicie o software de controle de instrumentos reômetro (ver Figura Suplementar 2).
- Execute a calibração do instrumento selecionando as guias,'Calibração | Instrumento' da janela do software. Escolha a opção'Instrumento'. Clique em 'Calibrar' em 'Inércia'. Registo o valor de calibração da inércia do instrumento em μN.m.s2 e a calibração repetida pelo menos 3x para garantir que os valores de calibração estejam dentro de 10% um do outro (ver Figura Suplementar 3).
- Instale a geometria do reômetro no eixo do reômetro.
- Clique na guia'Geometrias'no software de controle de instrumentos reômetro.
- Limpe o cone com a geometria desejada, (40 mm de diâmetro, 1◗ 0' 11'' cone) e placa peltier com isopropanol (ver Tabela 1, Tabela de Materiais, Figura 1e Figura 2).
NOTA: A placa peltier vem instalada no reômetro; pode ser limpo com isopropanol enquanto está diretamente fixado ao reômetro. - Certifique-se de que a fixação da placa Peltier esteja livre de qualquer pó visível e limpe, se necessário, com isopropanol. Instale a placa Peltier se não estiver pré-instalada no reômetro e conecte as conexões do dissipador de calor.
- Pressione o 'botão de bloqueio' no reômetro para o eixo de bloqueio que está conectado à geometria do cone. Isso prende a posição do eixo, mas pode girar livremente na posição.
- Clique em 'Smart Swap | Habilitadona guia de software de controle de instrumentos reômetro para permitir a detecção automática da geometria (ver Figura Suplementar 4).
- Gire o eixo em cima do reômetro para aparafusar a geometria. O software detectará a geometria de ângulo de cone de 40 mm, 1◗ 0' 11'' nesta fase (ver Tabela 1 e Tabela de Materiais).
- Repita as etapas 2.2.5 – 2.2.6 para garantir que a geometria seja detectada.
- Selecione 'Gap' sob o ' Painel deControle' do software de controle de instrumentos reômetro, clique em 'Options' ícone e escolha 'Axial Force' opção. Definir força axial para '1 Newton'; isto é para garantir que a geometria do cone toque na placa Peltier para inicialização de lacuna zero (ver Figura Suplementar 5).
- Realize a calibração da geometria do reômetro.
- Selecione a guia 'Geometria' na janela do software. Clique em 'Calibrar' em 'Inércia'. Regisso valor de calibração da inércia geometria em μN.m.s2 e repita isso 2-3 vezes para garantir que os valores de calibração estejam dentro de 10% um do outro.
- Clique em 'Calibrar' em 'Atrito' na janela do software. Regissua o valor de calibração do atrito da geometria em μN.m/(rad/s) e repita isso 2-3 vezes para garantir que os valores de calibração estejam dentro de 10% um do outro (ver Figura Suplementar 6).
- Realize a inicialização de lacuna zero
NOTA: Uma vez que a geometria não pode ser levantada com precisão acima da Placa Peltier para realizar medições sem uma posição "zero" de referência, a inicialização de lacuna zero é realizada. Para efeitos de medição, a geometria tem uma lacuna de geometria embutida de 24 μm e uma abertura de corte de 28 μm. A abertura de corte é definida para limpar efetivamente o excesso de fluido que pode derramar fora da área de superfície da geometria. Essas lacunas são imprescindíveis para medir com precisão os dados usando a amostra e o reômetro. A etapa 2.4.1 é absolutamente necessária para garantir que a geometria seja definida como lacuna zero para alcançar a geometria e aparar lacunas de 24 μm e 28 μm, respectivamente.- Clique no ícone 'Zero gap' na guia 'Gap' no ' Painelde Controle' na janela do software. A inicialização é completa quando a força axial experimentada pela geometria é maior ou igual a 1 N, pois toca a placa peltier. Certifique-se de que a lacuna do reômetro seja zerada para que sua posição de referência seja precisa (ver Figura Suplementar 7 e Figura Suplementar 8).
- Pressione os controles desetapara cima e para baixo no instrumento reômetro ou 'geometria levantar e baixar' ícones sob a guia 'Gap' no software de controle de instrumentos de reômetro para elevar a geometria a qualquer altura arbitrária. A tela de controle no instrumento reômetro e no painel de controle do software de controle de instrumentos reômetro exibirão a (mesma) altura de lacuna.
- Configure o procedimento experimental no software de controle do instrumento reômetro. Realize a caracterização das propriedades reológicas usando uma geometria da placa cone-on-Peltier a 22 °C.
NOTA: O site do Serviço Geológico dos EUA foi usado para verificar a temperatura da água do rio em 20 de setembro de 2018, quando a carpa prateada usada para os experimentos de muco GR foram pescadas na localização36de Hart Creek . A temperatura do muco pode afetar as propriedades reológicas. A importância de ajustar os valores à temperatura do rio é aproximadamente igualar a temperatura sob a qual as propriedades do muco podem ser estimadas realisticamente.- Selecione a guia ' Experimentos ' no software de controle deinstrumentosde reômetro e preencha as informações relevantes como 'Name', 'Operator', 'Project' etc. (ver Figura Suplementar 9)
- Selecione a guia 'Geometria' e certifique-se de que as informações concordem com as etapas 2.2.5. - 2.2.7. (ver Figura Suplementar 10).
- Selecione a guia 'Procedimento', e use as teclas de seta configuradas '1: Amplitude de oscilação' procedimento. (ver Figura Suplementar 11).
- Inicialize as configurações do 'Controle Ambiental' como as seguintes: 'Temperatura = 22 °C'; 'Soak Time = 120 s' e marque a caixa 'Aguarde a Temperatura' (ver Figura Suplementar 11).
- Inicialize as configurações dosparâmetros de testecomo as seguintes: 'Frequência = 1 Hz'; definir 'varredura logarítmica'; 'Torque = 10 a 10000 μN.m'; 'Pontos por década = 5' (ver Figura Suplementar 11).
- Configure o experimento para determinar a Faixa Viscoelástica Linear (LVR) do muco da concentração conhecida (100 mg/mL)
- Utilizando uma dica de micropipette e pipeta adequada, desenhe aproximadamente 0,3 mL de solução de muco de peixe de concentração de 100 mg/mL (ver Passo 1.2, Tabela de Materiais).
- Introduza a solução de muco na placa Peltier usando a micropipette (ver Figura 2).
- Pressione o botão 'Trim Gap' no reômetro para baixar a geometria sobre a placa Peltier. Alternativamente, clique em 'Trim Gap' ícone na guia 'Gap' na opção ' Painelde Controle' no software de controle de instrumentos reômetro (ver Figura Suplementar 12).
- Use a micropipette com a ponta da pipeta para remover qualquer solução de muco em excesso e garantir que o fluido esteja sob a geometria sem qualquer derramamento perto da periferia da geometria.
NOTA: O carregamento inadequado do fluido levará a erros nas medições. Sob amostra preenchida, a distribuição do torque diminuirá e a amostra sobre a amostra preenchida levará distribuições de estresse errôneas devido ao derramamento ao longo das bordas. - Selecione as guias 'Motor' e 'Velocity' para 5 rad/s e 0 rad/s alternadamente, até que haja inércia mínima e velocidade na amostra sob a geometria. A tela de controle do instrumento reômetro e o painel de controle do software de controle de instrumentos reômetro exibirão a velocidade (ver Figura Suplementar 13).
- Pressione o botão 'Geometry Gap' no reômetro para diminuir a geometria para a lacuna adequada predefinida por geometria específica. Alternativamente, clique em 'Geometry Gap' ícone em 'Gap' na opção 'Painel de Controle' no software de controle de instrumentos reômetro (ver Figura Suplementar 14).
- Execute o experimento para determinar a Faixa Viscoelástica Linear (LVR) do muco da concentração conhecida (100 mg/mL).
- Clique no ícone 'Iniciar' no software de controle de instrumentos reômetro (ver Figura Suplementar 15).
NOTA: O reômetro realiza medições automáticas; uma vez que o botão'Iniciar' é pressionado, o reômetro levará aproximadamente 20 minutos para completar o teste. A configuração 'Pontos por década' na Etapa 2.5.5 determina quanto tempo o reômetro precisará para completar as medições. - Execute o experimento clicando em 'Sim' na caixa pop-up que aparece e sugere que a lacuna de geometria seja reduzida à distância correta para iniciar o experimento, se ainda não abaixado.
- Observe o gráfico em tempo real gerado pelo reômetro que relata o moduli de armazenamento (G') e perda (G'').
NOTA: Os G' e G" são o moduli de armazenamento e perda, respectivamente. O módulo de armazenamento representa a tendência do material recuperar sua forma original após a deformação induzida pelo estresse e equivale à elasticidade. O módulo de perda representa até que ponto o material resiste à tendência ao fluxo e representa a viscosidade fluida (ver Figura 4). - Defina o eixo X da trama como ' porcentagem detensão de oscilação'. Para isso, clique com o botão direito do mouse no gráfico apresentado e escolha aguia 'Variáveis de Gráfico' (ver Figura Suplementar 16).
- Regisso recorde a porcentagem de tensão de oscilação da trama antes que o material entre na faixa viscoelástica não linear, uma vez que o teste esteja concluído.
- Pressione os controles desetapara cima e para baixo no instrumento reômetro ou 'geometria levantar e baixar' ícones sob a guia 'Gap' no software de controle de instrumentos de reômetro para elevar a geometria a qualquer altura arbitrária acima da placa Peltier.
- Salve o arquivo que contém tanto o procedimento experimental quanto resulta no formato de arquivo nativo do software de controle do instrumento reômetro para verificar a região viscoelástica linear (LVR) da amostra de muco.
NOTA: Isso pode ser feito definindo o eixo X da trama para coar amplitude (%) e/ou tensão de oscilação antes que os dados entrem na região viscoelástica não linear (NLVR) (ver Figura Suplementar 16).
antes que os dados entrem na região viscoelástica não linear (NLVR) (ver Figura Suplementar 16).
- Clique no ícone 'Iniciar' no software de controle de instrumentos reômetro (ver Figura Suplementar 15).
- Execute as varreduras dinâmicas e os experimentos de teste de fluxo de taxa de cisalhamento de estado constante em Faixa Viscoelástica Linear (LVR) para o muco da concentração conhecida 100, mg/mL para gerar resultados de três amostras independentes de muco de 100 mg/mL. Realize estas etapas nas amostras de concentração de muco disponíveis individualmente.
- Repetição passos 2.5.1 – 2.5.4.
- Inicialize as configurações dosparâmetros de testecomo as seguintes: 'Frequência = 1 Hz'; definir 'varredura logarítmica'; 'Coe % = 100 a 10000 %; 'Pontos por década = 10'.
- Selecione a guia'Procedimento'e use as teclas de seta configuradas '2: Frequência de oscilação'.
- Inicialize as configurações do 'Controle Ambiental' como as seguintes: 'Temperatura = 22 °C'; 'Soak Time = 0.0 s'.
- Inicialize as configurações dosparâmetros de testecomo as seguintes: 'Coestirão % = 1 %'; definir 'varredura logarítmica'; 'Frequência = 20 a 1 Hz'; 'Pontos por década = 10'.
- Selecione a guia'Procedimento'e use as teclas de seta configuradas '3: Varredura de fluxo'.
- Inicialize as configurações do 'Controle Ambiental' como as seguintes: 'Temperatura = 22 °C'; 'Soak Time = 0.0 s'.
- Inicialize as configurações dos' parâmetrosde teste ' como as seguintes: 'Taxa de tesoura = 1 a 10000 1/s'; 'Pontos por década = 10'; caixa de seleção 'Detecção de estado constante'.
- Repita as etapas 2.7.1 – 2.7.2 e espere até que o experimento esteja concluído, aproximadamente 45 minutos.
- Pressione os controles deseta' para cima e para baixo ' no instrumento reômetro ou ícones de 'geometria aumentar e diminuir' na guia 'Gap' no software de controle de instrumentos de reômetro para elevar a geometria a qualquer altura arbitrária.
- Use lenços e luvas descartáveis para remover e limpar o muco na placa Peltier com solução isopropanol (ver Tabela de Materiais).
- Salve o arquivo que contém tanto o procedimento experimental quanto os resultados no formato de arquivo nativo do software de controle do instrumento reômetro.
3. Repita o protocolo para outras concentrações de soluções de muco de 200 mg/mL e 400 mg/mL.
- Realizar as etapas 2.5 – 2.8 incluindo todas as sub-etapas listadas para as duas concentrações restantes de soluções de muco, 200 mg/mL e 400 mg/mL.
4. Representação gráfica e análise de dados
NOTA: O código fornecido no arquivo de código suplementar executa a média de dados e gera erros de repetibilidade, sobreponha os dados de todos os experimentos. Os recursos de cálculo de desvio padrão não estão disponíveis no software de controle de instrumentos reômetro. O código está escrito em uma linguagem de programação para análise de dados, pós-processamento e representação gráfica (ver Tabela de Materiais para obter detalhes).
- Dados de exportação gerados a partir da etapa 2.8 relativa à concentração de muco gr de 100 mg/mL e passo 3.1 relativos às concentrações de muco GR de 200mg/mL e 400 mg/mL em formato de planilha clicando na guia, 'Arquivo | | de exportação Excel' no software de controle de instrumentos reômetro (ver Figura Suplementar 17).
- Execute códigos suplementares para gerar parcelas de viscosidade aparente (η) para taxas variadas de tensão de
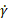 cisalhamento () e módulo de perda (G"), módulo de armazenamento (G') e ângulo de fase (δ) para tensão de oscilação variada
cisalhamento () e módulo de perda (G"), módulo de armazenamento (G') e ângulo de fase (δ) para tensão de oscilação variada  () e gerar resultados representativos.
() e gerar resultados representativos.
Resultados
Nesta seção, apresentamos os resultados dos experimentos em muco GR utilizando um reômetro rotacional com geometria de cone (40 mm de diâmetro, 1° 0' 11'') e uma placa peltier. Os experimentos ajudaram a caracterizar o comportamento não newtoniano, desbaste do muco GR e o estresse aparente de rendimento representando a transição do muco de um material semelhante a gel para um material semelhante a um fluido. Os resultados representativos envolvem descrições quantitativas de limites de baixo torque e efeitos sec...
Discussão
Um dos principais objetivos do desenvolvimento deste protocolo é estabelecer que ele é adequado para a caracterização reológica do muco GR quando são disponíveis volumes amostrais muito pequenos. Reconhecemos que mais amostras de uma escola de carpas prateadas são necessárias para caracterizar totalmente as propriedades reológicas do muco GR e os dados aqui apresentados não são uma generalização em toda a população de carpas de prata. Nossa técnica se justifica por sua eficácia com caracterização reol...
Divulgações
Nenhum conflito de interesses declarado.
Agradecimentos
Os autores reconhecem o apoio e o financiamento do GW Center for Biomimetics and Bioinspired Engineering. Agradecemos à professora L. Patricia Hernandez, do Departamento de Ciências Biológicas da Universidade George Washington, por inspirar a investigação e a colaboração em andamento, fornecendo conhecimento biológico sobre a fisiologia da carpa prateada e fornecendo amostras de muco. Agradecemos aos alunos, Sr. David Palumbo, Sra. Carly Cohen, Sr. Isaac Finberg, Sr. Dominick Petrosino, Sr. Alexis Renderos, Sra. Priscilla Varghese, Sr. Carter Tegen e Sr. Raghav Pajjur pela ajuda no laboratório e Sr. Thomas Evans e Sr. James Thomas da TA Instruments, New Castle, DE para apoio com treinamento e manutenção do reômetro. Imagens para figuras 5A,C foram tiradas durante uma dissecção realizada pela professora L. Patricia Hernandez, do Departamento de Ciências Biológicas da Universidade George Washington.
Materiais
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Kim Wipes | VWR | 470224-038 | To clean Sample from plate |
| Gloves | VWR | 89428-750 | To prevent contamination of sample |
| Pipette | VWR | 89079-974 | To transport sample from vial to rheometer |
| Pipette Tips | Thermo Scientific | 72830-042 | To transport sample from vial to rheometer |
| Shaker | VWR | 89032-094 | To homogenously mix sample of mucus |
| Vials | VWR | 66008-710 | Contains measured sample volumes |
| Weigh Scale | Ohaus | Scout –SPX Balances | To weigh mass of mucus samples |
| Chemical Reagents | |||
| De-Ionized Water (H20) | - | - | Liquid |
| Sterile 70% Isopropanol (C3H8O) | VWR | 89108-162 | Liquid |
| GR Mucus | |||
| 100 mg/mL concentration, 2mL | - | - | Viscoelastic Material |
| 400 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| 200 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| Software | |||
| MATLAB | Mathworks | R2017a | Data analysis, post-processing and graphical representation |
| Trios | TA Instruments | v4.5.042498 | Rheometer instrument control and analysis software |
Referências
- Cohen, K. E., Hernandez, L. P. The complex trophic anatomy of silver carp, Hypophthalmichthys molitrix, highlighting a novel type of epibranchial organ. Journal of Morphology. 279, 1615-1628 (2018).
- Cohen, K. E., Hernandez, L. P. Making a master filterer: Ontogeny of specialized filtering plates in silver carp (Hypophthalmichthys molitrix). Journal of Morphology. 279, 925-935 (2018).
- Cremer, M., Smitherman, R. Food habits and growth of silver and bighead carp in cages and ponds. Aquaculture. 20 (1), 57-64 (1980).
- Battonyai, I., et al. Relationship between gill raker morphology and feeding habits of hybrid bigheaded carps (Hypophthalmichthys spp.). Knowledge and Management of Aquatic Ecosystems. 416, 36 (2015).
- Zhou, Q., Xie, P., Xu, J., Ke, Z., Guo, L. Growth and food availability of silver and bighead carps: Evidence from stable isotope and gut content analysis. Aquaculture Research. 40 (14), 1616-1625 (2009).
- Freedman, J. A., Butler, S. E., Wahl, D. H. . Impacts of invasive Asian carps on native food webs (Final Report). , (2012).
- Nico, L., Fuller, P., Li, J. . Silver carp (Hypophthalmichthys molitrix)-FactSheet. , (2017).
- Walleser, L., Howard, D., Sandheinrich, M., Gaikowski, M., Amberg, J. Confocal microscopy as a useful approach to describe gill rakers of Asian species of carp and native filter-feeding fishes of the upper Mississippi River system. Journal of Fish Biology. 85 (5), 1777-1784 (2014).
- Nelson, A. Z., Ewoldt, R. H. Design of yield-stress fluids: a rheology-to-structure inverse problem. Soft Matter. 13, 7578-7594 (2017).
- Chen, T. Rheological Techniques for Yield Stress Analysis. TA Instruments Applications Note, RH025. , (2020).
- Ewoldt, R. H., Johnston, M. T., Caretta, L. M., Spagnolie, S. Experimental challenges of shear rheology: how to avoid bad data. Complex Fluids in Biological Systems. , (2015).
- Thornton, D. J., Sheehan, J. K. From Mucins to Mucus: Toward a more coherent understanding of this essential barrier. Proceedings of the American Thoracic Society. 1, 54-61 (2004).
- Shepard, K. L. Functions for fish mucus. Reviews in Fish Biology and Fisheries. 4, 401-429 (1994).
- Fernández-Alacid, L., et al. Skin mucus metabolites in response to physiological challenges: A valuable non-invasive method to study teleost marine species. Science of the Total Environment. 644, 1323-1335 (2018).
- Wagner, C. E., Wheeler, K. M., Ribbeck, K. Mucins and Their Role in Shaping the Functions of Mucus Barriers. Annual Reviews in Cell and Developmental Biology. 34, 189-215 (2018).
- Bird, R. B., Armstrong, R. C., Hassager, O. . Dynamics of Polymeric Liquids, Volume 1: Fluid Mechanics. , 1255-1284 (1987).
- Mantle, M., Allen, A. Isolation and characterisation of the native glycoprotein from pig small intestinal mucus. Biochemical Journal. 195, 267-275 (1981).
- Allen, A., Hutton, D. A., Pearson, J. P., Sellers, L. A., Nugent, J., O'Conner, M. Mucus glycoprotein structure, gel formation and gastrointestinal mucus function. Mucus and Mucosa (Ciba Foundation Symposium). , 137-156 (1984).
- Asakawa, M. Histochemical studies of the mucus on the epidermis of eel, Anguillajaponica. Bulletin of Japanese Society of Scientific Fisheries. 36, 83-87 (1970).
- Fletcher, T. C., Jones, R., Reid, L. Identification of glycoproteins in goblet cells of epidermis and gill of plaice (Pleuroneces platessa L.), flounder (Platichthys flesus (L.)) and rainbow trout (Salmo gairdneri Richardson). Histochemical Journal. 8, 597-608 (1976).
- Silberberg, A. Mucus glycoprotein, its biophysical and gel forming properties. Symposia of the Society for Experimental Biology. 43, 43-64 (1989).
- Hills, B. . The Biology of Surfactants. , 408 (1988).
- Aubert, H., Brook, A. J., Shephard, K. L. Measurement of the adhesion of a desmid to a substrate. British Phycology Journal. 24, 293-295 (1989).
- Sanderson, S. L., Cech, J. J., Patterson, M. R. Fluid dynamics in suspension feeding black fish. Science. 251, 1346-1348 (1991).
- Lai, S. K., Wang, Y. Y., Wirtz, D., Hanes, J. Micro- and macrorheology of mucus. Advanced Drug Delivery Reviews. 61 (2), 86-100 (2009).
- Chaudhary, G., Ewoldt, R. H., Thiffeault, J. L. Unravelling hagfish slime. Journal of Royal Society Interface. 16 (150), 20180710 (2019).
- Downing, S., Salo, W., Spitzer, R., Koch, E. The hagfish slime gland: a model system for studying the biology of mucus. Science. 214, 1143-1145 (1981).
- Hwang, S. H., Litt, M., Forsman, W. C. Rheological properties of mucus. Rheologica Acta. 8, 438-448 (1969).
- Litt, M. Mucus rheology. Archives of Internal Medicine. 126, 417-423 (1970).
- Quarishi, M. S., Jones, N. S., Mason, J. The rheology of nasal mucus: a review. Clinical Otolaryngology. 23, 403-413 (1998).
- Nordgård, C. T., Draget, K. I., Seternes, T. Rheology of salmon skin mucus. Annual Transactions - The Nordic Rheology Society. 23, 175-179 (2015).
- Fernández-Alacid, L., et al. Comparison between properties of dorsal and ventral skin mucus in Senegalese sole: Response to an acute stress. Aquaculture. 513, 734410 (2019).
- Yüce, C., Willenbacher, N. Challenges in Rheological Characterization of Highly Concentrated Suspensions - Case Study for Screen-printing Silver Pastes. Journal of Visualized Experiments. (122), e55377 (2017).
- Sultan, S., Mathew, A. P. 3D Printed Porous Cellulose Nanocomposite Hydrogel Scaffolds. J. Vis. Exp. (146), (2019).
- Barnes, H. A., Hutton, J. F., Walters, K. . An Introduction to Rheology. , (1989).
- USGS Current Conditions for USGS 06910450 Missouri River at Jefferson City, MO. U.S. Geological Survey Available from: https://nwis.waterdata.usgs.gov/usa/nwis/uv/?cb_00010=on&cb_00060=on&cb_00065=on&format=gif_default&site_no=0691045&p09-19&end_date=2018-09-21 (2020)
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados