JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
실버 잉어, 하이포팔미치티스 몰리트리스의 길 레이크머 점액의 매크로-리로지 특성화
요약
이 프로토콜은 은잉어의 길 레이커 (GRs)에 상주하는 점액의 유변학 특성화를 수행하는 방법을 제시한다. 점도, 저장 및 손실 계수를 측정하여 얻은 GR-점액의 점성탄성 특성은 GR의 필터 공급 메커니즘을 이해하기 위한 명백한 수율 응력에 대해 평가된다.
초록
실버 잉어, Hypophthalmichthys molitrix,때문에 매우 효율적인 필터 공급 메커니즘으로 인해 상부 미시시피 강 유역의 자연 수로를 감염 침략 플랑크티버 필터 피더 물고기입니다. 많은 필터 피더에서 발견되는 길 레이커 (GRs)라고 불리는 특징적인 장기는 크기가 몇 미크론인 식물 플랑크톤과 같은 식품 입자의 효율적인 여과를 용이하게합니다.
GR 점액의 유변학을 조사하는 동기는 은잉어의 필터 공급 과정을 돕는 역할을 이해하고자 하는 우리의 욕구에서 비롯됩니다. 점액이 풍부한 유체는 '두껍고 끈적끈적한' 상태에서 식품 미립자의 접착을 용이하게 할 수 있습니다. GR 멤브레인을 통한 투과 및 수송은 다양한 전단 변형률을 유도하는 외부 전단력의 작용에 의해 촉진된다. 따라서 점액 유변학은 필터 먹이 물고기 풀 내에서 은 잉어의 엄청난 경쟁 특성에 대한 중요한 단서를 제공 할 수 있습니다. 이를 바탕으로 GR 점액은 식품 입자에 접착제 기능을 제공하고 필터 공급 공정을 지원하는 운송 수단으로 작용할 수 있음을 양수하였다.
프로토콜의 주요 목적은 점액의 수율 응력, 돌이킬 수없는 플라스틱 변형이 먼저 구조화 점탄성 물질에 걸쳐 관찰되는 흐름을 시작하는 데 필요한 최소 전단 응력에 기인한다. 이에 따라, GR 점액, 즉 점도, 저장 및 손실 계열의 유변학적 특성은 회전 계를 사용하여 비뉴턴, 전단 숱이 있는 자연에 대해 조사되었다.
여기에 제시 된 프로토콜은 미주리 강의 하트 크릭 위치에서 물고기 실버 잉어의 길빛 레이커에서 추출 점액의 유변학적 특성을 분석하기 위해 사용된다. 이 프로토콜은 구조화 점탄성 물질로 가정된 점액의 유변학 테스트 및 물질 특성화를 위한 효과적인 전략을 개발하는 것을 목표로 합니다.
서문
실버 잉어, Hypophthalmichthys molitrix는플랑크 필터 피더와 미국에서 여러 자연 수로에 침투 한 침략적인 종입니다. 이 종은 처음에 조류꽃1,2,3을제어하기 위해 상부 미시시피 강 유역에 도입되었다. 실버 잉어는 매우 효율적인 피더입니다. 전형적으로, 소모성 식품 입자 크기는 4에서 20 μm에서 약 80 μm3,4,5의더 큰 동물 플랑크톤에 구역 수색합니다. 이 종은 다른 토착 물고기를 능가하고 잠재적으로 사용 가능한자원1,2,6을제한하여 토착 수로에 엄청난 손상을 일으킬 수 있습니다. 따라서, 은잉어와 큰 머리 잉어와 같은 필터 먹이 물고기는 그레이트 레이크1,2,6,7,8에큰 위협이됩니다.
필터 먹이 물고기는 표면에 서있는 점액의 얇은 층과 길러 레이커 (GRs)라는 특별한 장기를 가지고 있습니다. 이러한 장기는 들어오는 유체에서 작은 입자의 여과 및 응집의 효율성을 향상시킵니다. 본 원에 제시된 프로토콜의 목적은 비뉴턴, 전단 숱이 물질 특성및 은잉어의 아가미 레이커의 내부 표면에서 획득한 GR 점액의 응력의 수율 응력의 특성화이다. 회전 류미터를 사용하여 확인된 GR-점액의 수율 응력의 가치는 이 연구에 관심이 있습니다. 측정된 수율 응력은 "명백한 수율 응력"이라고도 하는 것은 꾸준한 전단 속도 또는 동적 진동 균주 유형9,10과같은 테스트 방법에 따라 달라집니다. 전단 숱이 '수율 응력 유체'는 중요한 적용 응력9,11에서고체와 같은 동작에서 액체와 같은 동작으로의 전환을 겪습니다. 명백한 항복 응력은 흐름을 개시하는 데 필요한 최소 전단 응력또는 점액이 젤과 같은 재료에서 유체와 같은 재료로 전환될 때 돌이킬 수 없는 플라스틱 변형이 처음 관찰되는 것입니다. 이러한 동작은 구조화된 점탄성 물질에서 관찰될 수 있다. GEL-like에서 GR 점액의 유체와 같은 동작으로의 전환은 식품 미립자를 수집하는 접착제 역할과 미립자 전달 및 여과 공정을 지원하는 운송 차량 역할이라는 두 가지 기능을 수반합니다. 점액의 확장된 기능에는 질병 내성 및 호흡의 확산 장벽을 조성하고, 영양 적 인자의 통제 방출을 제공하고, 독성 성분 및 배설물을 제공하고, 먹이및 중첩을위한 대사 경로를 만들고, 포식자 보호에 도움, 운동 및 추진 효율을 향상시키는 경계 층 수정을 생성하는 것을 포함한다12,13,14.
간단한 유체와 달리 점액과 같은 복잡한 유체는 유량 조건에 따라 다양한 특성을 가지고 있으며 벌크 스케일 물리적 동작을 정의하기 위해 추가 측정 매개 변수가 필요합니다. GR 점액의 점도와 수율 응력모니터링을 위해 회전 계측기를 사용하여 유변 측정이 수행됩니다. 회전 계는 유체 샘플과 접촉하는 회전 디스크를 통해 꾸준하거나 진동적인 전단 응력 또는 변형을 적용하고 그 반응을 측정합니다. 이 계측기와 기술을 사용하는 것의 근거는 레오미터가 점도만으로는 정의할 수 없는 은잉어의 GR 점액의 재료 특성을 설명하기 위한 일련의 측정을 제공할 수 있다는 것입니다.
점액은 점탄성 물질이며 부과 된 변형에 대한 기계적 반응은 순수한 고체 (후크의 탄성의 법칙에 의해 지배) 및 순수한 액체 (점도의 뉴턴의 법칙에 의해 지배)15,16사이에 있다. 점액 내에 포함된 복잡한 거대 분자 네트워크는 외부 력 또는 변형에 대응하여 스트레칭및 방향을 조정할 수 있습니다. 회전 류미터는 도 1 및 도 2에 표시된 콘 형상 및 펠티에 플레이트로 구성됩니다(계측 사양의 표 1 참조). 이 연구의 목적은 GR 점액의 유변학적 특성을 결정하는 프로토콜을 개발하는 것이었습니다. 비스코머를 통해 회전 계의 장점은 작은 샘플 볼륨을 사용하여 동적 측정을 할 수있는 능력입니다. 이 연구에서 GR 점액 샘플 부피는 약 1.4 mL이었다. 반면에 바이스컴터는 일정한 전단 속도로 제한되며 대량의 시료량이 필요합니다.
점액의 유변학적 특성은 은잉어 해부학 내에서 크게 달라질 것으로 예상된다. 예를 들어, GR 표면에 서식하는 점액의 특성은 에피브랜치 오르간과 다를 수 있다. 물고기의 다른 영역에서 점액 특성의 잠재적 인 가변성을 고려하기 위해, 획득 된 GR 점액 샘플은 희석되었고, 3 개의 농도의 용액이 회전 류미터를 사용하여 생성및 테스트되었습니다. 프로토콜을 실행한 후 보고된 점액 유변학에 관한 데이터 및 결과는 측정 기술의 효능을 입증하였다. 이 논문에 제시된 예시데이터는 전체 은잉어 인구에 걸쳐 일반화될 수 있는 것이 아닙니다. 본 명세서에 제시된 프로토콜은 다른 가설을 테스트하기 위해 더 큰 샘플 세트에 걸쳐 점액 재학을 조사하기 위해 확장될 수 있다.
이 연구의 목적은 3개의 다른 점액 농도를 가진 GR 점액류학의 유변학적 특성의 변이를 입증하는 것입니다 (400 mg/mL, 200 mg/mL 및 100 mg/mL). 400 mg/mL 농도는 생선 GRs로부터 수확된 생 점액 샘플을 나타낸다. Deionized water(DI)는 원료 점액 샘플을 200 mg/mL 및 100 mg/mL 농도로 희석하는 데 사용되었다. 점액 샘플을 희석시키는 것은 GR 점액이 비 뉴턴 행동으로 전환하는 농도의 함수로서 전단 숱이 및 명백한 항복 응력의 정도를 평가할 수 있었습니다. 셰이커는 비균일성으로 인한 유변학적 데이터의 오류를 완화하기 위해 샘플에 있는 점액의 큰 덩어리를 분해하는 데 사용되었습니다.
물고기를 포함한 대부분의 척추동물에서, 우세한 점액 형성 거대 분자는 얽힘 또는 화학적 교차 연결에 의해 물에 팽창하는 경향이 있는 당단백질(mucins)이며 겔과 같은 물질을생성한다(12,13,17,18,19,20). 고분자- 분자, 겔 형성 거대 분자 및 높은 수분 함량은점액(13)의미끄러움을 반영한다. 대시분자 간 상호 작용의 높은 수준은 겔 형성으로 이어지는 반면, 중대분자 상호 작용 또는 깨진 결합의 낮은 수준은 고점도 유체21귀착됩니다.
필터 먹이 물고기의 식품 미립자 여과 과정은 접착력 및압정(22)의잠재력을 결정하는 응집력 및 점도와 같은 GR 점액 관련 특성에 의해 지원된다. 점액 계 접착강도는 특정 분자 간, 정전기 또는 소수성 상호작용(23)에따라 달라집니다. 샌더슨 외.24 그들은 점액 기반 접착에 대 한 증거를 발견 하는 블랙 피시에 현탁 액 수 연구를 실시. 그들은 점막 표면을 가진 중단된 음식 미립자의 접착이 그것에 작용하는 지시된 물 흐름에 의해 점액과 함께 결합된 입자의 응집된 덩어리의 수송에 선행된다는 것을 진술했습니다24. 물 흐름에서 생성 된 전단 균주 율에 노출 된 점액은 소화 기관에 식품 미립자의 전달을 용이하게합니다. 내시경 기술은 여과된입자(24)를관찰하는 데 사용되었다.
GR 점액의 유변학적 검사에서 전단 속도 및 실질적인 한계에 대한 문헌은 부족합니다. 따라서 위, 비강, 자궁경부 및 폐 점액, 연어 피부 점액, hagfish 점액 및 뼈 관절 표면 윤활유에 대한 유변학적 연구에서 지도를 모색하여 유변학적 특성화 및 비뉴턴 특성을 연구하였으며11,12,26,27,28, 29,30,30, 31. 최근에는 생선 피부 점액이 운동 및 추진 효율에 미치는 영향은 일정한 전단 속도 의 내장을 사용하여 연구되고 있습니다. 피부 점액 유변학 연구(희석 또는 균질화 없이)는 선조, 농어 및 빈약한에 관련되어 일반적으로 낮은 전단비율(14)에서비뉴턴의 행동을 입증하였다. 또 다른 관련 연구에서는, 세네갈 발바닥의 등쪽 및 복부 측에서 원시 피부 점액 샘플은32로간주된 모든 전단 비율에서 복부 점액의 더 높은 점도를 나타내는 비 뉴턴 의 행동을 나타내는 것으로 나타났습니다. 하이드로겔 스캐폴드 개발 및 상수 전단 속도 비스코머를 이용한 고농축 현탁액에 대한 다른 유변학적 프로토콜도문헌(33,34)에서보고되었다.
본 연구에서, GR 점액 특성은 복잡한 생물학적유체(25)에대한 유변학 실험에서 널리 사용되고 있는 변형률 조절, 회전 류미터를 사용하여 조사되었다. 뉴턴 유체의 경우, 명백한 점도는 일정하게 유지되며, 전단 속도-독립적이며 전단 응력은 전단 변형률(그림3A,B)으로선형적으로 다릅니다. 비 뉴턴 유체(예: 전단-숱이 유체)의 경우 점도는 전단 속도 의존성 또는 변형-역사에 의존한다(그림3A,B). 손실 계수(G")는 재료가 흐르는 경향에 저항하고 유체 점도(도4)를대표하는 정도를 나타낸다. 저장 계수(G')는 응력 유도 변형에 따른 원래 형상을 회복하는 재료의 경향을 나타내며 탄성(도4)과동일하다. 위상 각(δ) 또는 손실 접선 값은 G"/G의 역 접선에서 계산됩니다. 이는 에너지 손실과 저장 사이의 균형을 나타내며 점성탄성 물질(δ = 0°) 점성 액체의 경우 0°, 점성 액체의 경우 δ = 90°, 점성탄성 고체에 대한 δ < 45° 및 점성탄성 액체의 δ > 경우 45°)를 특성화하기 위한 일반적인 파라미터이다(그림4)25. 구조화 된 유체의 명백한 수율 응력 (σy)은정상 상태 스윕 및 동적 응력 스트레인 스윕(10)에서유변학적 데이터에서 관찰 될 수있는 상태의 변화를 나타낸다. 외부 가도 응력이 명백한 수율 응력보다 작으면 재료가 탄력적으로 변형됩니다. 응력이 명백한 수율 응력(도 3B의"평균 응력"으로 표시됨)을 초과하면 재료는 탄성에서 플라스틱 변형으로 전환되어 액체상태(35)에서흐르기 시작합니다. 진동 응력(또는 균주) 조건 하에서 점액 샘플에서 저장 계수(G') 및 손실 계수(G")를 측정하는 것은 젤과 같은 점성탄성 액체와 같은 동작으로 재료 상태의 변화를 정량화한다.
저장 계수(G'), 손실 계수(G") 및 명백한 점도(η)와 관련된 데이터를 모니터링하기 위해 수행된 레오미터 테스트의 유형이 여기에 설명되어 있습니다. 동적 진동 테스트(스트레인 스윕 및 주파수 스윕)는 콘 형상의 제어진동하에서 G'와 G를 모니터링했습니다. 동적 스트레인 스윕 테스트는 본질적인 재료반응(도 4)을모니터링하여 점액의 선형 점탄성 영역(LVR)을 결정하였다. 스트레인 스윕은 일정한 진동 주파수 및 온도에서 항복 거동을 결정하는 데 사용되었습니다. 동적 주파수 스윕 테스트는 일정한 진폭(변형 속도) 및 온도에서 증가하는 주파수(변형 속도)에 대한 재료 반응을 모니터링했습니다. 스트레인은 동적 주파수 스윕 테스트를 위해 선형 점탄성 영역(LVR)에서 유지되었다. 정상 상태 전단 속도 테스트는 원뿔 형상의 꾸준한 회전 하에서 명백한 점도(η)를 모니터링했습니다. GR 점액은 증분 응력 단계를 거쳤으며 명백한 점도(η, Pa.s)는 다양한 전단 속도(ý, 1/s)를 모니터링하였다.
이 논문에 제시된 프로토콜은 GR 점액을 특정 선형 점성탄성 반응 범위로 알 수 없는 점성탄성의 복잡한 구조화 물질로 취급합니다. 물고기 점액은 교수 L. 패트리샤 에르난데스에 의해 미주리 강의 하트 크릭 위치에서 낚시 탐험 하는 동안 은 잉어의 GRs에서 추출 되었다 (생물 과학의 학과, 조지 워싱턴 대학) 1,2,36. 실버 잉어의 입 안쪽에 있는 GRs의 배열은 도 5A에 표시되고 회로도 도면은 도 5B에제시됩니다. 절제된 GR은 도 5C에표시됩니다. 은잉어의 GR로부터 점액추출은 회로도, 도 5D,E의예로 제시된다. 모든 레오미터 시험은 22± 0.002°C의 상수, 제어 온도하에서 수행되었으며, 어장1,2,36에서기록된 온도. 각 점액 샘플은 레오미터를 사용하여 세 번 시험되었고, 평균 결과는 통계적 오차 막대와 함께 제시된다.
프로토콜
1. 다양한 농도의 점액 솔루션 준비
참고: 점액 용액의 3개의 농도(400 mg/mL, 200 mg/mL 및 대략적인 부피를 가진 100 mg/mL, 각각 1mL, 1 mL 및 2 mL)이 실험에 대비하고 있습니다.
- 점액의 질량을 계산하려면 바이알의 평균 질량을측정합니다(점액이 있는 M; mg) 점액없이(M바이알; mg). 그런 다음 점액없이 점액으로 바이알의 질량을 빼는(M점액 = M 과점액 - M바이알; mg).
- 점액을 3개의 농도(400, 200, 100, mg/mL)로 희석하여 탈온화(DI) 물로 희석합니다.
- 요압액의 첫 번째 농도를 준비하여, 400 mg/mL은 마이크로피펫을 사용하여 점액에 0.6mL DI 물을 첨가한다.
참고: 추출된 점액의 대략적인 부피는 1.4mL이었기 때문에, 400 mg/mL 용액은 ~ 2mL의 총 부피를 갖게 된다. - 점액용액이 적절하게 균질화되고 점액 미립자 응집이 완화되도록 셰이커에 400 mg/mL 점액 용액 바이알을 배치합니다.
- 액액200 mg/mL의 제2 농도를 마이크로피펫을 사용하여 새로운 바이알에 제1 농도 점액 용액의 절반을 끌어들이고 새로운 유리병에 1mL의 DI 물을 추가하여 준비한다.
- 점액 용액을 사용하여 첫 번째 및 두 번째 바이알에 대해 1.2.2 단계를 반복합니다.
- 200 mg/mL용액의 절반의 부피(1mL)를 마이크로파이프를 이용하여 새로운 바이알에 DI 물을 추가하여 점액 용액의 세 번째 농도인 100 mg/mL을 준비한다.
- 각 바이알에서 점액 용액의 세 농도 모두에 대해 1.2.2를 반복하십시오(보충 도 1참조).
- 레오미터 교정 및 테스트가 수행될 때까지 점액 용액바이알을 냉장고에 보관합니다.
- 요압액의 첫 번째 농도를 준비하여, 400 mg/mL은 마이크로피펫을 사용하여 점액에 0.6mL DI 물을 첨가한다.
2. 레오미터를 이용한 측정 및 데이터 수집
참고: 계측기 제어 및 계측기와 데이터 수집을 위해 이 프로토콜에 사용되는 소프트웨어는 재료 표에 기록되어 있습니다. 이 소프트웨어는 '레오미터 계측기 제어 소프트웨어'라고합니다.
- 레오미터 계측기를 설정하고 보정합니다.
- 압축 공기 공급을 류미터로 켜고 공압 테이블과 류미터가 버블 게이지를 사용하여 수평을 유지합니다. 류미터 샤프트의 보호 캡을 비틀고 샤프트를 고정하는 동안 샤프트를 고정합니다.
- 레오미터 메인 스위치를 켜면 레오미터의 자기 베어링을 활성화합니다.
- 레오미터 제어 소프트웨어를 설치하여 레오미터 제어 컴퓨터를 켜고 레오미터 계측기 제어 소프트웨어를 실행합니다(보충 도 2참조).
- 탭을 선택하여 계측기 보정을수행합니다| 소프트웨어창에서 악기 ' '악기' 옵션을 선택합니다. '관성'아래'교정'을클릭합니다. μN.m.s2의 계측기 관성 교정 값을 기록하고 교정 값이 서로의 10% 이내인지 확인하기 위해 최소 3배 이상 교정을 반복합니다(보충 도 3참조).
- 레오미터의 샤프트에 레오미터 형상을 설치합니다.
- 레오미터 계측기 제어 소프트웨어의'형상'탭을 클릭합니다.
- 원하는 형상으로 콘을 청소(직경 40mm,◦ 0' 11'콘) 및 펠티에 플레이트와 이소프로판올(표 1, 재료 표, 그림 1, 그림 2참조).
참고 : 펠티에 플레이트는 류미터에 설치됩니다; 그것은 직접 레오미터에 고정하는 동안 이소 프로판놀로 청소 할 수 있습니다. - 펠티에 플레이트 설비가 가시적인 먼지로부터 자유롭고 필요한 경우 이소프로파놀로 깨끗하게 청소하십시오. 레오미터에 사전 설치되지 않은 경우 펠티에 플레이트를 설치하고 방열판 연결을 연결합니다.
- 원뿔 형상에 연결된 잠금 샤프트에 레오미터의'잠금 버튼'을누릅니다. 이것은 샤프트의 위치를 체포하지만 위치에서 자유롭게 회전 할 수 있습니다.
- '스마트스왑 | 클릭 지오메트리를 자동으로 감지할 수 있도록 레오미터 계측기 제어 소프트웨어 탭에서 활성화된'(보충 도 4참조).
- 레오미터 상단의 샤프트를 돌려 형상을 나사로 연결합니다. 이 소프트웨어는 이 단계에서 직경 40mm,1 ◦ 0' 11'' 원뿔 각도 형상을 감지합니다(표 1 및 재료 표 참조).
- 2.2.5 - 2.2.6 단계를 반복하여 형상이 감지되도록 합니다.
- '간격'을선택 ' 권면 제어 소프트웨어의 제어판아래', 클릭 '옵션' 아이콘을 클릭 하 고 선택 ' 축힘'옵션. '1뉴턴'으로축력을 설정합니다. 이는 원뿔 형상이 펠티에 플레이트에 닿도록 하여 0갭 초기화를 위한 것입니다(보충 도 5참조).
- 레오미터 형상 보정을 수행합니다.
- 소프트웨어 창에서 탭'형상'을선택합니다. '관성'아래'교정'을클릭합니다. μN.m.s2에서 형상 관성 교정 값을 기록하고 이 2-3회 반복하여 교정 값이 서로의 10% 이내인지 확인합니다.
- 소프트웨어 창에서'마찰'아래'교정'을클릭합니다. 형상 마찰 보정 값을 μN.m/(rad/s)에 기록하고 교정 값이 서로의 10% 이내인지 확인하기 위해 이 2-3번 반복합니다(보충 도 6참조).
- 제로 갭 초기화 수행
참고: 형상을 Peltier 플레이트 위로 정확하게 올릴 수 없으므로 참조 "0" 위치 없이 측정을 수행할 수 없으므로 제로 갭 초기화가 수행됩니다. 측정을 위해 형상은 24 μm의 내장 형상 갭과 28 μm의 트림 갭을 가지고 있습니다. 트림 갭은 형상의 표면적 외부에 유출될 수 있는 과도한 유체를 효과적으로 세척하도록 설정됩니다. 이러한 간격은 샘플과 계측기를 사용하여 데이터를 정확하게 측정하는 데 필수적입니다. 단계 2.4.1은 형상이 각각 24 μm 및 28 μm의 형상 및 트림 간격을 달성하기 위한 간격이 0으로 설정되어 있는지 확인하는 데 절대적으로 필요합니다.- 소프트웨어 창에서'제어판'탭'갭'아래'제로 갭'아이콘을 클릭합니다. 초기화는 형상에 의해 경험된 축력이 펠티에 플레이트에 닿을 때 1 N보다 크거나 같을 때 완료됩니다. 기준 위치가 정확하도록 레오미터 간격이 0이 되도록 해야 합니다(보충 도 7 및 보충 도 8참조).
- 류미터 계측기또는'형상상승'아이콘의'위쪽 및 하하 화살표'컨트롤을 눌러 류미터 계측기 제어 소프트웨어의'갭'탭 아래아이콘을 눌러 형상을 임의 높이로 올립니다. 레오미터 계측기의 제어 화면과 레오미터 계측기 제어 소프트웨어의 제어판은 (동일한) 갭 높이를 표시합니다.
- 레오미터 계측기 제어 소프트웨어에서 실험 절차를 설정합니다. 22°C에서 콘 온 펠티에 플레이트 형상을 사용하여 유변학적 특성의 특성화를 수행합니다.
참고: 미국 지질조사국은 2018년 9월 20일, GR 점액 실험에 사용된 은잉어가 하트 크릭(Hart Creek)위치(36)에서어획되었을 때 강 수온 강을 확인하는 데 사용되었습니다. 점액의 온도는 유변학적 특성에 영향을 줄 수 있습니다. 강 온도에 값을 조정하는 의의는 점액 특성이 현실적으로 추정될 수 있는 온도와 거의 일치한다는 것입니다.- 레오미터 계측기 제어 소프트웨어에서 탭 ,'실험'을선택하고'이름','연산자','프로젝트'등과 같은 관련 정보를 입력합니다. (보충도 9참조)
- 탭'형상'을선택하고 정보가 2.2.5 단계에 동의하는지 확인합니다. - 2.2.7. (보충 도 10참조).
- 탭'프로시저'를선택하고 설정된 화살표 키'1: 진동 진폭'절차를 사용합니다. (보충 도 11참조).
- '환경통제'설정을 다음과 같이 초기화: '온도 = 22°C'; '시간을 담그다 = 120'과 '온도 대기'상자를 확인하십시오(보충 그림 11참조).
- '테스트매개 변수' 설정 :'주파수 = 1 Hz'를 초기화; 세트 '로지산스믹 스윕'; '토크 = 10 ~ 10000 μN.m '10년당 포인트 = 5' (보충 도 11참조).
- 공지된 농도(100 mg/mL)의 점액의 선형 점탄성 범위(LVR)를 결정하기 위한 실험 설정
- 적절한 마이크로피펫 과 파이펫 팁을 사용하여 농도 100 mg/mL의 물고기 점액 용액 약 0.3mL을 그립니다(1.2단계, 재료 표참조).
- 마이크로 피펫을 사용하여 펠티에 플레이트에 점액 용액을 소개합니다(그림 2참조).
- '트림갭'레오미터의 버튼을 눌러 펠티에 플레이트에 형상을 낮춥니다. 또는 레오미터 계측기 제어 소프트웨어에서'제어판'옵션에서'갭'탭 아래'트림 갭'아이콘을 클릭합니다(보충 도 12참조).
- 파이펫 팁이 있는 마이크로파이프를 사용하여 과도한 점액 용액을 제거하고 유체가 형상 주변 부근에서 흘리지 않고 기하학 아래에 있는지 확인합니다.
참고: 유체의 부적절한 하중은 측정에 오류가 발생합니다. 채워진 샘플 에서 토크 분포를 낮추고 채워진 샘플은 가장자리를 따라 유출로 인해 잘못된 응력 분포를 이끌 것입니다. - 지오메트리 아래에 샘플에 최소한의 관성 및 속도가 있을 때까지'모터'와'속도'탭을 5개의 라드/s와 0 개의 라드/s로 선택합니다. 레오미터 계측기의 제어 화면과 레오미터 계측기 제어 소프트웨어의 제어판은 속도를 표시합니다(보충 도 13참조).
- '기하학 갭'버튼을 레오미터의 버튼을 눌러 특정 형상당 미리 설정된 적합한 간격으로 형상을 낮춥니다. 또는 레오미터 계측기 제어 소프트웨어에서'제어판'옵션에서'갭'탭 아래'지오메트리 갭'아이콘을 클릭합니다(보충 도 14참조).
- 실험은 공지된 농도(100 mg/mL)의 점액의 선형 점탄성 범위(LVR)를 결정하도록 하였다.
- '시작'표시계 계측기 제어 소프트웨어아이콘을 클릭합니다(보충 도 15참조).
참고: 레오미터는 자동 측정을 수행합니다. '시작'버튼을 누르면, 레오미터는 테스트를 완료하는 데 약 20 분이 소요됩니다. 2.5.5 단계의 '10년당 포인트' 설정은 레오미터가 측정을 완료하는 데 필요한 시간을 결정합니다. - 나타나는 팝업 박스에서'예'를클릭하여 실험을 실행하고 이미 낮지 않은 경우 형상 간격을 올바른 거리로 낮게 하여 실험을 시작하도록 제안합니다.
- 저장(G') 및 손실(G') 모툴리(G')를 보고하는 레오미터에 의해 생성된 실시간 플롯을 관찰한다.
참고 : G'와 G"는 각각 저장 및 손실 moduli입니다. 저장 계수는 응력 유도 변형에 따라 재료가 원래 모양을 회복하는 경향을 나타내며 탄성과 동일합니다. 손실 계수는 재료가 흐르는 경향에 저항하고 유체 점도를 나타내는 정도를 나타냅니다(그림 4참조). - 플롯의 X축을'진동 변형 률'로 설정합니다. 이렇게 하려면 제시된 그래프를 마우스 오른쪽 단추로 클릭하고'그래프 변수' 탭을 선택합니다(보충 그림 16참조).
- 시험이 완료되면 재료가 비선형 점성 탄성 범위에 들어가기 전에 플롯에서 진동 변형 백분율 범위 범위를 기록합니다.
- 레오미터 계측기의'위아래 화살표'컨트롤 또는'형상 상승 및 하부'아이콘을 류미터 계측기 제어 소프트웨어의'갭'탭으로 눌러 펠티에 플레이트 위의 임의 높이로 형상을 올립니다.
- 경하계 계측기 제어 소프트웨어의 기본 파일 형식을 모두 포함하는 파일을 저장하여 점액 샘플의 선형 점성탄성 영역(LVR)을 확인합니다.
참고: 데이터가 비선형 점성탄성 영역(NLVR)에 들어가기 전에 플롯의 X축을 변형 진폭(%) 및/또는 진동 응력으로 설정하여 수행할 수 있습니다(보충 도 16참조).
데이터가 비선형 점성탄성 영역(NLVR)에 들어가기 전에 플롯의 X축을 변형 진폭(%) 및/또는 진동 응력으로 설정하여 수행할 수 있습니다(보충 도 16참조).
- '시작'표시계 계측기 제어 소프트웨어아이콘을 클릭합니다(보충 도 15참조).
- 공지된 농도 100, mg/mL의 점액에 대해 선형 점막 범위(LVR)에서 동적 스윕 및 꾸준한 상태 전단 속도 유량 시험 실험을 실행하여 100 mg/mL의 3개의 독립적인 점액 샘플로부터 결과를 생성한다. 사용 가능한 점액 농도 샘플에서 이러한 단계를 개별적으로 수행하십시오.
- 2.5.1 – 2.5.4 단계를 반복합니다.
- '테스트매개 변수' 설정 :'주파수 = 1 Hz'를 초기화; 세트 '로지산스믹 스윕'; '스트레인% = 100 ~ 10000%; '10년당 포인트 = 10'.
- '절차' 탭을 선택하고 설정 화살표 키를 사용 '2: 진동 주파수' 절차.
- '환경통제'설정을 다음과 같이 초기화: '온도 = 22°C'; '시간을 담그다 = 0.0'.
- '테스트매개 변수'설정을 다음과 같이 초기화합니다: '변형 % = 1 %'; 세트 '로지산스믹 스윕'; '주파수 = 20 ~ 1 Hz'; '10년당 포인트 = 10'.
- '프로시저' 탭을 선택하고 설정 된 화살표 키를 사용 '3: 흐름 스윕' 프로시저.
- '환경통제'설정을 다음과 같이 초기화: '온도 = 22°C'; '시간을 담그다 = 0.0'.
- '테스트매개 변수'설정을 다음과 같이 초기화합니다: '전단 속도 = 1 ~ 10000 1/s'; '10년당 포인트 = 10'; 확인란 '꾸준한 상태 감지'.
- 2.7.1 – 2.7.2 단계를 반복하고 실험이 완료될 때까지 약 45분 정도 기다립니다.
- 류미터 계측기의'위아래 화살표'컨트롤 또는 류미터 계측기 제어 소프트웨어의 'Gap' 탭 아래 '형상 인상 및 하부' 아이콘을 눌러 형상을 임의 높이로 올립니다.
- 일회용 물티슈와 장갑을 사용하여 펠티에 플레이트의 점액을 이소프로판올 용액으로 제거하고 청소합니다(재료 표참조).
- 실험 프로시저를 모두 포함하는 파일을 저장하고 레오미터 계측기 제어 소프트웨어의 기본 파일 형식으로 결과를 초래합니다.
3. 점액 용액의 다른 농도에 대한 프로토콜을 반복 200 mg / mL 과 400 mg / mL.
- 단계 수행 2.5 – 2.8 점액 용액의 나머지 두 농도에 대한 그 안에 나열된 모든 하위 단계를 포함, 200 mg /mL 및 400 mg/mL.
4. 그래픽 표현 및 데이터 분석
참고: 보충 코드 파일에 제공된 코드는 데이터 평균을 수행하고 반복성 오류를 생성하고 모든 실험에서 데이터를 오버레이합니다. 표준 편차 계산 기능은 레오미터 계측기 제어 소프트웨어에서는 사용할 수 없습니다. 코드는 데이터 분석, 사후 처리 및 그래픽 표현을 위한 프로그래밍 언어로 작성됩니다(자세한 내용은 재료 표 참조).
- 2.8단계에서 생성된 내보내기 데이터는 100 mg/mL GR 점액 농도 및 200mg/mL 및 400 mg/mL GR 점액 농도에 관한 3.1 단계와 탭을 클릭하여 스프레드시트 형식으로 | 수출 | 레오미터 계측기 제어 소프트웨어에서 Excel ' (보충 도 17참조).
- 다양한 전단 변형률()
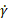 및 손실 계수(G"), 스토리지 계수(G') 및 위상 각(δ)에 대한 명백한 점도(η)의 플롯을 생성하고, 다양한 진동 응력()을 생성하고 대표적인 결과를 생성하기 위한 보조 코드를
및 손실 계수(G"), 스토리지 계수(G') 및 위상 각(δ)에 대한 명백한 점도(η)의 플롯을 생성하고, 다양한 진동 응력()을 생성하고 대표적인 결과를 생성하기 위한 보조 코드를  실행한다.
실행한다.
결과
이 섹션에서는 원뿔 형상(직경 40mm, 1° 0' 11')과 펠티에 플레이트가 있는 회전 류미터를 사용하여 GR 점액에 대한 실험 결과를 제시합니다. 이 실험은 GR 점액의 비 뉴턴, 전단 숱이 있는 동작 및 점액전환을 묘사한 명백한 수율 응력의 특징을 젤과 같은 재료에서 유체와 같은 물질로 특성화하는 데 도움이 되었습니다. 대표적인 결과는 낮은 토크 제한에 대한 정량적 설명과 회전 류미터 계측기의 이?...
토론
이 프로토콜을 개발하는 주요 목표 중 하나는 매우 작은 샘플 볼륨을 사용할 수 있을 때 GR 점액의 유변학적 특성화에 적합하다는 것을 확립하는 것입니다. 우리는 실버 잉어 의 학교에서 더 많은 샘플이 완전히 GR 점액의 유변학적 특성을 특성화하는 데 필요한 것을 인정하고 여기에 제시 된 데이터는 전체 은 잉어 인구에 걸쳐 일반화되지 않습니다. 우리의 기술은 작은 견본 볼륨의 유변학적 특성...
공개
이해 상충이 선언되지 않았습니다.
감사의 말
저자는 바이오미메틱스 및 바이오영감 엔지니어링 GW 센터의 지원과 자금을 인정합니다. 우리는 조지 워싱턴 대학의 생물 과학학과의 L. 패트리샤 에르난데스 교수에게 실버 잉어의 생리학에 대한 생물학적 전문 지식을 제공하고 점액 샘플을 제공, 조사 및 지속적인 협력을 고무. 우리는 학생들, 데이비드 팔룸보 씨, 칼리 코헨 씨, 씨 아이작 핀버그, 씨 도미닉 페트로시노, 씨 알렉시스 렌더로스, 씨 프리실라 바르게세, 카터 테겐씨와 씨 라그하브 파주르는 실험실에서 도움을 준 씨, 토마스 에반스씨와 TA 인스트루먼트의 씨. 토마스 토마스, 뉴 캐슬, 유지 보수 및 유지 보수 와 함께 DE. 그림 5A에 대한 이미지는, C는 조지 워싱턴 대학에서 생물 과학학과의 교수 L. 패트리샤 에르난데스에 의해 수행 해부 동안 촬영되었다.
자료
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Kim Wipes | VWR | 470224-038 | To clean Sample from plate |
| Gloves | VWR | 89428-750 | To prevent contamination of sample |
| Pipette | VWR | 89079-974 | To transport sample from vial to rheometer |
| Pipette Tips | Thermo Scientific | 72830-042 | To transport sample from vial to rheometer |
| Shaker | VWR | 89032-094 | To homogenously mix sample of mucus |
| Vials | VWR | 66008-710 | Contains measured sample volumes |
| Weigh Scale | Ohaus | Scout –SPX Balances | To weigh mass of mucus samples |
| Chemical Reagents | |||
| De-Ionized Water (H20) | - | - | Liquid |
| Sterile 70% Isopropanol (C3H8O) | VWR | 89108-162 | Liquid |
| GR Mucus | |||
| 100 mg/mL concentration, 2mL | - | - | Viscoelastic Material |
| 400 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| 200 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| Software | |||
| MATLAB | Mathworks | R2017a | Data analysis, post-processing and graphical representation |
| Trios | TA Instruments | v4.5.042498 | Rheometer instrument control and analysis software |
참고문헌
- Cohen, K. E., Hernandez, L. P. The complex trophic anatomy of silver carp, Hypophthalmichthys molitrix, highlighting a novel type of epibranchial organ. Journal of Morphology. 279, 1615-1628 (2018).
- Cohen, K. E., Hernandez, L. P. Making a master filterer: Ontogeny of specialized filtering plates in silver carp (Hypophthalmichthys molitrix). Journal of Morphology. 279, 925-935 (2018).
- Cremer, M., Smitherman, R. Food habits and growth of silver and bighead carp in cages and ponds. Aquaculture. 20 (1), 57-64 (1980).
- Battonyai, I., et al. Relationship between gill raker morphology and feeding habits of hybrid bigheaded carps (Hypophthalmichthys spp.). Knowledge and Management of Aquatic Ecosystems. 416, 36 (2015).
- Zhou, Q., Xie, P., Xu, J., Ke, Z., Guo, L. Growth and food availability of silver and bighead carps: Evidence from stable isotope and gut content analysis. Aquaculture Research. 40 (14), 1616-1625 (2009).
- Freedman, J. A., Butler, S. E., Wahl, D. H. . Impacts of invasive Asian carps on native food webs (Final Report). , (2012).
- Nico, L., Fuller, P., Li, J. . Silver carp (Hypophthalmichthys molitrix)-FactSheet. , (2017).
- Walleser, L., Howard, D., Sandheinrich, M., Gaikowski, M., Amberg, J. Confocal microscopy as a useful approach to describe gill rakers of Asian species of carp and native filter-feeding fishes of the upper Mississippi River system. Journal of Fish Biology. 85 (5), 1777-1784 (2014).
- Nelson, A. Z., Ewoldt, R. H. Design of yield-stress fluids: a rheology-to-structure inverse problem. Soft Matter. 13, 7578-7594 (2017).
- Chen, T. Rheological Techniques for Yield Stress Analysis. TA Instruments Applications Note, RH025. , (2020).
- Ewoldt, R. H., Johnston, M. T., Caretta, L. M., Spagnolie, S. Experimental challenges of shear rheology: how to avoid bad data. Complex Fluids in Biological Systems. , (2015).
- Thornton, D. J., Sheehan, J. K. From Mucins to Mucus: Toward a more coherent understanding of this essential barrier. Proceedings of the American Thoracic Society. 1, 54-61 (2004).
- Shepard, K. L. Functions for fish mucus. Reviews in Fish Biology and Fisheries. 4, 401-429 (1994).
- Fernández-Alacid, L., et al. Skin mucus metabolites in response to physiological challenges: A valuable non-invasive method to study teleost marine species. Science of the Total Environment. 644, 1323-1335 (2018).
- Wagner, C. E., Wheeler, K. M., Ribbeck, K. Mucins and Their Role in Shaping the Functions of Mucus Barriers. Annual Reviews in Cell and Developmental Biology. 34, 189-215 (2018).
- Bird, R. B., Armstrong, R. C., Hassager, O. . Dynamics of Polymeric Liquids, Volume 1: Fluid Mechanics. , 1255-1284 (1987).
- Mantle, M., Allen, A. Isolation and characterisation of the native glycoprotein from pig small intestinal mucus. Biochemical Journal. 195, 267-275 (1981).
- Allen, A., Hutton, D. A., Pearson, J. P., Sellers, L. A., Nugent, J., O'Conner, M. Mucus glycoprotein structure, gel formation and gastrointestinal mucus function. Mucus and Mucosa (Ciba Foundation Symposium). , 137-156 (1984).
- Asakawa, M. Histochemical studies of the mucus on the epidermis of eel, Anguillajaponica. Bulletin of Japanese Society of Scientific Fisheries. 36, 83-87 (1970).
- Fletcher, T. C., Jones, R., Reid, L. Identification of glycoproteins in goblet cells of epidermis and gill of plaice (Pleuroneces platessa L.), flounder (Platichthys flesus (L.)) and rainbow trout (Salmo gairdneri Richardson). Histochemical Journal. 8, 597-608 (1976).
- Silberberg, A. Mucus glycoprotein, its biophysical and gel forming properties. Symposia of the Society for Experimental Biology. 43, 43-64 (1989).
- Hills, B. . The Biology of Surfactants. , 408 (1988).
- Aubert, H., Brook, A. J., Shephard, K. L. Measurement of the adhesion of a desmid to a substrate. British Phycology Journal. 24, 293-295 (1989).
- Sanderson, S. L., Cech, J. J., Patterson, M. R. Fluid dynamics in suspension feeding black fish. Science. 251, 1346-1348 (1991).
- Lai, S. K., Wang, Y. Y., Wirtz, D., Hanes, J. Micro- and macrorheology of mucus. Advanced Drug Delivery Reviews. 61 (2), 86-100 (2009).
- Chaudhary, G., Ewoldt, R. H., Thiffeault, J. L. Unravelling hagfish slime. Journal of Royal Society Interface. 16 (150), 20180710 (2019).
- Downing, S., Salo, W., Spitzer, R., Koch, E. The hagfish slime gland: a model system for studying the biology of mucus. Science. 214, 1143-1145 (1981).
- Hwang, S. H., Litt, M., Forsman, W. C. Rheological properties of mucus. Rheologica Acta. 8, 438-448 (1969).
- Litt, M. Mucus rheology. Archives of Internal Medicine. 126, 417-423 (1970).
- Quarishi, M. S., Jones, N. S., Mason, J. The rheology of nasal mucus: a review. Clinical Otolaryngology. 23, 403-413 (1998).
- Nordgård, C. T., Draget, K. I., Seternes, T. Rheology of salmon skin mucus. Annual Transactions - The Nordic Rheology Society. 23, 175-179 (2015).
- Fernández-Alacid, L., et al. Comparison between properties of dorsal and ventral skin mucus in Senegalese sole: Response to an acute stress. Aquaculture. 513, 734410 (2019).
- Yüce, C., Willenbacher, N. Challenges in Rheological Characterization of Highly Concentrated Suspensions - Case Study for Screen-printing Silver Pastes. Journal of Visualized Experiments. (122), e55377 (2017).
- Sultan, S., Mathew, A. P. 3D Printed Porous Cellulose Nanocomposite Hydrogel Scaffolds. J. Vis. Exp. (146), (2019).
- Barnes, H. A., Hutton, J. F., Walters, K. . An Introduction to Rheology. , (1989).
- USGS Current Conditions for USGS 06910450 Missouri River at Jefferson City, MO. U.S. Geological Survey Available from: https://nwis.waterdata.usgs.gov/usa/nwis/uv/?cb_00010=on&cb_00060=on&cb_00065=on&format=gif_default&site_no=0691045&p09-19&end_date=2018-09-21 (2020)
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유