Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Caractérisation macro-rhéologique du mucus gill raker chez la carpe argentée, Hypophthalmichthys molitrix
Dans cet article
Résumé
Ce protocole présente une méthode pour effectuer la caractérisation rhéologique du mucus qui réside sur les râteaux branchiaux (GR) de la carpe argentée. Les caractéristiques viscoélastiques du MUCUS GR, obtenues en mesurant la viscosité, le stockage et les modules de perte, sont évaluées pour la limite d’élasticité apparente afin de comprendre le mécanisme d’alimentation du filtre dans les GR.
Résumé
La carpe argentée, Hypophthalmichthys molitrix,est un poisson filtre planktivore envahissant qui a infesté les cours d’eau naturels du bassin supérieur du Mississippi en raison de son mécanisme d’alimentation par filtre très efficace. Les organes caractéristiques appelés râteaux branchiaux (GR), que l’on trouve dans de nombreux filtreurs de ce type, facilitent la filtration efficace des particules alimentaires telles que le phytoplancton de quelques microns.
La motivation pour étudier la rhéologie du mucus GR provient de notre désir de comprendre son rôle dans l’aide au processus d’alimentation par filtre chez la carpe argentée. Le liquide riche en mucus, dans un état « épais et collant » peut faciliter l’adhésion des particules alimentaires. La perméation et le transport à travers la membrane GR sont facilités par l’action de forces de cisaillement externes qui induisent des taux de déformation de cisaillement variables. Par conséquent, la rhéologie du mucus peut fournir un indice vital sur la nature extrêmement compensante de la carpe argentée dans le bassin de poissons filtreurs. Sur cette base, il a été postulé que le mucus GR peut fournir une fonction adhésive aux particules alimentaires et agir comme un véhicule de transport pour aider au processus d’alimentation par filtre.
L’objectif principal du protocole est de déterminer la limite d’élasticité du mucus, attribuée à la contrainte de cisaillement minimale requise pour initier l’écoulement à laquelle une déformation plastique irréversible est observée pour la première fois sur un matériau viscoélastique structuré. En conséquence, les propriétés rhéologiques du mucus GR, c’est-à-dire la viscosité, le stockage et les modules de perte, ont été étudiées pour sa nature non newtonienne, amincissante par cisaillement, à l’aide d’un rhéomètre rotatif.
Un protocole présenté ici est utilisé pour analyser les propriétés rhéologiques du mucus extrait des râteaux branchiaux d’une carpe argentée, pêchée à l’emplacement de Hart Creek de la rivière Missouri. Le protocole vise à développer une stratégie efficace pour les tests rhéologiques et la caractérisation matérielle du mucus supposé être un matériau viscoélastique structuré.
Introduction
La carpe argentée, Hypophthalmichthys molitrix,est un filtreur planctonivore et une espèce envahissante qui s’est infiltrée dans plusieurs cours d’eau naturels aux États-Unis. Cette espèce a été initialement introduite dans le bassin supérieur du Mississippi pour contrôler les proliférations d’algues1,2,3. La carpe argentée est un alimentateur extrêmement efficace. Typiquement, ses tailles de particules alimentaires consommables vont de 4 à 20 μm à un zooplancton plus grand qui est d’environ 80 μm3,4,5. Cette espèce a surpassé les autres poissons indigènes et peut potentiellement causer d’énormes dommages aux cours d’eau indigènes en limitant les ressources disponibles1,2,6. Ainsi, les poissons filtres tels que la carpe argentée et la carpe à grosse tête constituent une menace majeure pour les Grands Lacs1,2,6,7,8.
Les poissons filtreurs possèdent des organes spéciaux appelés râteaux branchiaux (GR) avec une fine couche de mucus résidant à leur surface. Ces organes améliorent l’efficacité de la filtration et de l’agrégation des petites particules du fluide entrant. L’objectif du protocole présenté ici est de caractériser la propriété non newtonienne du matériau d’amincissement par cisaillement et la contrainte d’élasticité du mucus GR acquis à partir de la surface interne des râteaux branchiaux de la carpe argentée. La valeur de la limite d’élasticité du GLaire GR, déterminée à l’aide d’un rhéomètre rotatif, est intéressante dans cette étude. La limite d’élasticité mesurée, également appelée « contrainte d’élasticité apparente », dépend des méthodes d’essai telles que la vitesse de cisaillement constante ou la déformation oscillatoire dynamique de type9,10. L’amincissement par cisaillement, « fluide de contrainte d’élasticité », subit une transition d’un comportement de type solide à un comportement de type liquide à une contrainte critique appliquée9,11. La limite d’élasticité apparente est la contrainte de cisaillement minimale requise pour initier l’écoulement ou celle à laquelle une déformation irréversible du plastique est observée pour la première fois lorsque le mucus passe d’un matériau semblable à un gel à un matériau de type fluide. Ce comportement peut être observé dans les matériaux viscoélastiques structurés. La transition du mucus gélifiant à un comportement fluide implique deux fonctions, à voir un rôle adhésif pour recueillir les particules alimentaires et un rôle de véhicule de transport pour aider au processus de livraison et de filtration des particules. La fonction étendue du mucus comprend la création de barrières de diffusion dans la résistance aux maladies et la respiration, la libération contrôlée de facteurs nutritionnels, de composants toxiques et d’excrétion, la création de voies métaboliques pour l’alimentation et la nidification, l’aide à la protection des prédateurs et la production de modifications de la couche limite qui améliorent la locomotion et l’efficacité propulsive12,13,14.
Contrairement aux fluides simples, les fluides complexes comme le mucus possèdent des propriétés qui varient en fonction des conditions d’écoulement et nécessitent des paramètres de mesure supplémentaires pour définir leur comportement physique à l’échelle de masse. Pour surveiller la viscosité et la limite d’élasticité du mucus GR, des mesures rhéologiques sont effectuées à l’aide d’un rhéomètre rotatif. Le rhéomètre rotatif applique une contrainte ou une déformation de cisaillement stable ou oscillatoire au moyen d’un disque rotatif en contact avec l’échantillon de fluide et mesure sa réponse. La raison d’être de l’utilisation de cet instrument et de cette technique est que le rhéomètre peut fournir un ensemble de mesures pour décrire les propriétés matérielles du mucus GR de la carpe argentée, qui ne peuvent pas être définies par la viscosité seule.
Le mucus est un matériau viscoélastique et sa réponse mécanique à une déformation imposée est comprise entre celle d’un solide pur (régi par la loi d’élasticité de Hooke) et celle d’un liquide pur (régi par la loi de viscosité de Newton)15,16. Le réseau macromoléculaire complexe contenu dans le mucus peut s’étirer et se réorienter en réponse à des forces externes ou à une déformation. Un rhéomètre rotatif est composé d’une géométrie de cône et d’une plaque de Peltier comme illustré à la Figure 1 et à la Figure 2 (voir le tableau 1 pour les spécifications d’instrumentation). L’objectif de cette étude était de développer un protocole pour déterminer les propriétés rhéologiques du mucus GR. Un avantage du rhéomètre rotatif par rapport à un viscosimètre est sa capacité à effectuer des mesures dynamiques en utilisant de petits volumes d’échantillons. Le volume d’échantillon de mucus GR dans cette étude était d’environ 1,4 mL. Le viscosimètre, en revanche, est limité à des taux de cisaillement constants et nécessite de grands volumes d’échantillons.
Les propriétés rhéologiques du mucus devraient varier considérablement au sein de l’anatomie de la carpe argentée. Par exemple, les propriétés du mucus résidant sur les surfaces GR peuvent être différentes de celles de l’organe épibranchial. Pour tenir compte de la variabilité potentielle des propriétés du mucus dans différentes régions du poisson, l’échantillon de mucus GR acquis a été dilué et des solutions de trois concentrations ont été créées et testées à l’aide du rhéomètre rotatif. Les données et les résultats concernant la rhéologie du mucus rapportés après l’exécution du protocole ont démontré l’efficacité de la technique de mesure. Les données illustratives présentées dans le présent document ne sont pas destinées à être généralisées à l’ensemble de la population de carpes argentées. Le protocole présenté ici peut être étendu pour étudier la rhéologie du mucus sur des ensembles d’échantillons plus grands afin de tester d’autres hypothèses.
Le but de cette étude est de démontrer la variation des propriétés rhéologiques de la rhéologie du mucus GR avec trois concentrations de mucus différentes (400 mg/mL, 200 mg/mL et 100 mg/mL). La concentration de 400 mg/mL représente l’échantillon de mucus brut prélevé dans les GR de poisson. De l’eau désionisée (ID) a été utilisée pour diluer l’échantillon de mucus brut en concentrations de 200 mg/mL et 100 mg/mL. La dilution des échantillons de mucus a permis d’évaluer le degré d’amincissement par cisaillement et la limite d’élasticité apparente en fonction de la concentration et de déterminer la concentration à laquelle le mucus GR passe à un comportement non newtonien. Un agitateur a été utilisé pour décomposer les gros amas de mucus dans les échantillons afin d’atténuer les erreurs dans les données rhéologiques dues à l’inhomogénéité.
Chez la plupart des vertébrés, y compris les poissons, les macromolécules formant du mucus prédominants sont des glycoprotéines (mucines) qui ont tendance à gonfler dans l’eau par enchevêtrements ou réticulation chimique et à créer un matériau semblable à un gel12,13,17,18,19,20. Les macromolécules de haut poids moléculaire, formant des gels et la teneur élevée en eau reflètent la gélinance du mucus13. Un degré élevé d’interactions inter-macromoléculaires conduit à la formation de gel alors que des niveaux plus faibles d’interactions inter-macromoléculaires ou de liaisons rompues entraînent des fluides à haute viscosité21.
Les processus de filtration des particules alimentaires dans les poissons filtreurs sont aidés par des propriétés liées au mucus GR telles que la cohésion et la viscosité qui déterminent son potentiel d’adhérence et d’adhérence22. La force de l’adhérence à base de mucus dépend d’interactions intermoléculaires, électrostatiques ou hydrophobes spécifiques23. Sanderson et al.24 ont mené une étude d’alimentation en suspension chez le poisson noir dans laquelle ils ont trouvé des preuves d’une adhésion à base de mucus. Ils ont déclaré que l’adhésion des particules alimentaires en suspension avec une surface muqueuse est suivie du transport d’amas agrégés de particules liées ensemble au mucus par un écoulement d’eau dirigé agissant sur celui-ci24. Le mucus exposé aux taux de déformation de cisaillement générés par l’écoulement de l’eau facilite l’administration de particules alimentaires aux organes digestifs. Des techniques endoscopiques ont été utilisées pour observer les particules filtrées24.
La littérature sur la gamme des taux de cisaillement et les limites pratiques dans les tests rhéologiques du mucus GR est rare. Par conséquent, des conseils ont été recherchés à partir d’études rhéologiques sur la glaire gastrique, nasale, cervicale et pulmonaire, le mucus de la peau de saumon, la boue de poisson et le lubrifiant de surface des articulations osseuses dans lesquelles la caractérisation rhéologique et les attributs non newtoniens ont été étudiés11,12,25,26,27, 28,29,30,31. Plus récemment, l’effet du mucus de la peau de poisson sur la locomotion et l’efficacité propulsive a été étudié en utilisant la viscométrie à taux de cisaillement constant. Les études de rhéologie du mucus cutané (sans aucune dilution ni homogénéisation) concernant la daurade, le bar et le maigre comportement non newtonien ont démontré un comportement non newtonien à des taux de cisaillement généralement faibles14. Dans une autre étude connexe, les échantillons de mucus cutané brut des côtés dorsal et ventral de la sole sénégalaise se sont avérés présenter un comportement non newtonien, indiquant une viscosité plus élevée du mucus ventral à tous les taux de cisaillement considérés32. D’autres protocoles rhéologiques relatifs au développement de l’échafaudage d’hydrogel et pour les suspensions hautement concentrées utilisant un viscosimètre à vitesse de cisaillement constante ont également été rapportés dans la littérature33,34.
Dans cette étude, les propriétés du mucus GR ont été étudiées à l’aide d’un rhéomètre rotatif contrôlé par taux de déformation qui a été largement utilisé dans des expériences de rhéologie sur des fluides biologiques complexes25. Pour les fluides newtoniens, la viscosité apparente reste constante, est indépendante de la vitesse de cisaillement et les contraintes de cisaillement varient linéairement avec les taux de déformation de cisaillement (Figure 3A, B). Pour les fluides non newtoniens (tels que les fluides d’amincissement par cisaillement), la viscosité dépend du taux de cisaillement ou de l’historique de déformation (Figure 3A, B). Le module de perte (G ») représente la mesure dans laquelle le matériau résiste à la tendance à l’écoulement et est représentatif de la viscosité du fluide(Figure 4). Le module de stockage (G') représente la tendance du matériau à retrouver sa forme d’origine après une déformation induite par les contraintes et est équivalent à l’élasticité (Figure 4). L’angle de phase (δ) ou la valeur de la tangente de perte, est calculé à partir de la tangente inverse de G"/G'. Il représente l’équilibre entre perte d’énergie et stockage et est également un paramètre commun pour caractériser les matériaux viscoélastiques (δ = 0° pour un solide hookéen; δ = 90° pour un liquide visqueux; δ < 45° pour un solide viscoélastique et δ > 45° pour un liquide viscoélastique)(Figure 4)25. La limite d’élasticité apparente (σy)dans les fluides structurés représente un changement d’état qui peut être observé dans les données rhéologiques à partir du balayage à l’état d’équilibre et des balayages dynamiques contrainte-déformation10. Si la contrainte externe appliquée est inférieure à la limite d’élasticité apparente, le matériau se déformera élastiquement. Lorsque la contrainte dépasse la limite d’élasticité apparente (marquée comme « contrainte moyenne » à la figure 3B), le matériau passe de la déformation élastique à la déformation plastique et commence à s’écouler à l’état liquide35. La mesure du module de stockage (G') et du module de perte (G ») dans l’échantillon de mucus dans des conditions de contrainte oscillatoire (ou de déformation) quantifie le changement de l’état du matériau d’un comportement semblable à un gel à un comportement viscoélastique de type liquide.
Les types d’essais de rhéomètre effectués pour surveiller les données relatives au module de stockage (G'), au module de perte (G ») et à la viscosité apparente (η) sont décrits ici. Les essais d’oscillation dynamique (balayages de déformation et balayages de fréquence) ont surveillé G' et G » sous oscillation contrôlée de la géométrie du cône. Les essais de balayage de déformation dynamique ont déterminé la région viscoélastique linéaire (LVR) du mucus en surveillant la réponse intrinsèque du matériau(Figure 4). Des balayages de déformation ont été utilisés pour déterminer le comportement de rendement à une fréquence d’oscillation et une température constantes. Les essais de balayage dynamique de fréquence ont surveillé la réponse du matériau à l’augmentation de la fréquence (taux de déformation) à une amplitude (déformation ou contrainte) et à une température constantes. La déformation a été maintenue dans la région viscoélastique linéaire (LVR) pour les essais de balayage dynamique de fréquence. Les essais de vitesse de cisaillement à l’état d’équilibre ont surveillé la viscosité apparente (η) sous rotation constante de la géométrie du cône. Le mucus GR a été soumis à des étapes de contrainte incrémentielles et la viscosité apparente (η, Pa.s) a été surveillée pour une vitesse de cisaillement variable (ý, 1/s).
Le protocole présenté dans cet article traite le mucus GR comme un matériau structuré complexe de viscoélasticité inconnue avec une certaine gamme de réponse viscoélastique linéaire. Le mucus de poisson a été extrait des RON de la carpe argentée lors d’une expédition de pêche à l’emplacement du ruisseau Hart dans la rivière Missouri par le professeur L. Patricia Hernandez (Département des sciences biologiques, Université George Washington) 1,2,36. Un tableau de GO à l’intérieur de l’embouchure d’une carpe argentée est représenté à la figure 5A et un dessin schématique est présenté à la figure 5B. Un GR excisé est représenté à la figure 5C. L’extraction du mucus des GN de la carpe argentée est présentée à titre d’exemple dans les dessins schématiques, Figure 5D, E. Tous les essais rhéométriques ont été effectués sous une température constante et contrôlée de 22 ± 0,002 °C, la température enregistrée sur le site de pêche1,2,36. Chaque échantillon de mucus a été testé trois fois avec le rhéomètre, et les résultats moyens sont présentés avec les barres d’erreur statistiques.
Protocole
1. Préparation des solutions de mucus de différentes concentrations
REMARQUE: Trois concentrations de la solution de mucus (400 mg/mL, 200 mg/mL et 100 mg/mL avec des volumes approximatifs, 1 mL, 1 mL et 2 mL, respectivement) sont préparées pour cette expérience.
- Pour calculer la masse du mucus, mesurer la masse moyenne des flacons avec (Mavec-mucus ; mg) et sans mucus (flacons M ; mg). Soustrayez ensuite la masse des flacons avec du mucus avec celle sans mucus (Mmucus = Mavec-mucus - Mflacons ; mg).
- Diluer le mucus en trois concentrations (400, 200, 100, mg/mL) avec de l’eau désionisée (DI).
- Préparer la première concentration de la solution de mucus, 400 mg/mL en ajoutant 0,6 mL d’eau DI au mucus à l’aide d’une micropipette.
REMARQUE: Étant donné que le volume approximatif du mucus extrait était de 1,4 mL, la solution de 400 mg / mL aura un volume total d’environ 2 mL. - Placez le flacon de solution de mucus de 400 mg / mL sur un agitateur pour vous assurer que la solution de mucus est correctement homogénéisée et que toute agglomération de particules de mucus est atténuée.
- Préparer la deuxième concentration de la solution de mucus, 200 mg/mL, en tirant la moitié du volume de la solution de mucus à première concentration dans un nouveau flacon à l’aide d’une micropipette et en ajoutant 1 mL d’eau DI dans le nouveau flacon.
- Répétez l’étape 1.2.2 pour les premier et deuxième flacons avec des solutions de mucus.
- Préparer la troisième concentration de la solution de mucus, 100 mg/mL, en tirant la moitié du volume (1 mL) de la solution de 200 mg/mL dans un nouveau flacon à l’aide d’une micropipette et ajouter de l’eau DI dans le nouveau flacon.
- Répétez l’étape 1.2.2 pour les trois concentrations de solutions de mucus dans leurs flacons respectifs (voir la figure supplémentaire 1).
- Conservez les flacons de solution de mucus dans un réfrigérateur jusqu’à ce que l’étalonnage et les tests du rhéomètre aient été effectués.
- Préparer la première concentration de la solution de mucus, 400 mg/mL en ajoutant 0,6 mL d’eau DI au mucus à l’aide d’une micropipette.
2. Mesures et acquisition de données à l’aide d’un rhéomètre
REMARQUE: Les logiciels utilisés dans ce protocole pour le contrôle des instruments et l’acquisition de données avec rhéomètre sont notés dans la table des matériaux. Ce logiciel sera appelé « logiciel de contrôle de l’instrument rhéomètre ».
- Installez et étalonnez l’instrument rhéomètre.
- Allumez l’alimentation en air comprimé du rhéomètre et assurez-vous que la table pneumatique et le rhéomètre sont niveler à l’aide d’une jauge à bulles. Dérissez le capuchon de protection de l’arbre du rhéomètre et maintenez l’arbre immobile pendant le dévissage.
- Allumez les interrupteurs principaux du rhéomètre pour activer les paliers magnétiques du rhéomètre.
- Allumez l’ordinateur de commande du rhéomètre avec le logiciel de contrôle de l’instrument rhéomètre installé et lancez le logiciel de contrôle de l’instrument rhéomètre (voir la figure supplémentaire 2).
- Effectuez l’étalonnage de l’instrument en sélectionnant les onglets , 'Calibration | Instrument' à partir de la fenêtre du logiciel. Choisissez l’option 'Instrument'. Cliquez sur 'Calibrer' sous 'Inertie'. Enregistrez la valeur d’étalonnage de l’inertie de l’instrument en μN.m.s2 et répétez l’étalonnage au moins 3x pour vous assurer que les valeurs d’étalonnage sont à moins de 10 % les unes des autres (voir la figure supplémentaire 3).
- Installez la géométrie du rhéomètre sur l’arbre du rhéomètre.
- Cliquez sur l’onglet 'Géométries' dans le logiciel de contrôle de l’instrument rhéomètre.
- Nettoyez le cône avec la géométrie souhaitée (diamètre 40 mm, cône 1◦ 0' 11'') et la plaque Peltier avec de l’isopropanol (voir Tableau 1, Tableau des matériaux, Figure 1et Figure 2).
REMARQUE: La plaque Peltier est installée sur le rhéomètre; il peut être nettoyé avec de l’isopropanol alors qu’il est directement fixé au rhéomètre. - Assurez-vous que le luminaire à plaque Peltier est exempt de toute poussière visible et nettoyez, si nécessaire, avec de l’isopropanol. Installez la plaque Peltier si elle n’est pas préinstallée dans le rhéomètre et connectez les connexions du dissipateur de chaleur.
- Appuyez sur le bouton deverrouillagedu rhéomètre jusqu’à l’arbre de verrouillage connecté à la géométrie du cône. Cela arrête la position de l’arbre, mais il peut tourner librement à la position.
- Cliquez sur 'Smart Swap | Activé' dans l’onglet du logiciel de contrôle de l’instrument rhéomètre pour permettre la détection automatique de la géométrie (voir figure supplémentaire 4).
- Tournez l’arbre sur le dessus du rhéomètre pour visser la géométrie. Le logiciel détectera la géométrie de l’angle du cône de 40 mm de diamètre, 1◦ 0' 11'' à ce stade (voir tableau 1 et tableau des matériaux).
- Répétez les étapes 2.2.5 à 2.2.6 pour vous assurer que la géométrie est détectée.
- Sélectionnez 'Gap' sous le 'Panneaude commande ' du logiciel de contrôle de l’instrument du rhéomètre, cliquez sur l’icône 'Options' et choisissez l’option 'Force axiale'. Définir la force axiale sur '1 Newton'; il s’agit de s’assurer que la géométrie du cône touche la plaque de Peltier pour l’initialisation de l’écart zéro (voir la figure supplémentaire 5).
- Effectuez l’étalonnage de la géométrie du rhéomètre.
- Sélectionnez l’onglet 'Géométrie' dans la fenêtre du logiciel. Cliquez sur 'Calibrer' sous 'Inertie'. Enregistrez la valeur d’étalonnage de l’inertie géométrique en μN.m.s2 et répétez-la 2 à 3 fois pour vous assurer que les valeurs d’étalonnage sont à moins de 10 % les unes des autres.
- Cliquez sur 'Calibrer' sous 'Friction' dans la fenêtre du logiciel. Enregistrez la valeur d’étalonnage du frottement géométrique en μN.m/(rad/s) et répétez-la 2 à 3 fois pour vous assurer que les valeurs d’étalonnage sont à moins de 10 % les unes des autres (voir la figure supplémentaire 6).
- Effectuer l’initialisation à intervalle zéro
REMARQUE: Étant donné que la géométrie ne peut pas être élevée avec précision au-dessus de la plaque Peltier pour effectuer des mesures sans position de référence « zéro », l’initialisation de l’écart zéro est effectuée. Aux fins de la mesure, la géométrie a un écart géométrique intégré de 24 μm et un écart d’assiette de 28 μm. L’espace de coupe est réglé pour nettoyer efficacement l’excès de liquide qui peut se déverser en dehors de la surface de la géométrie. Ces lacunes sont impératives pour mesurer avec précision les données à l’aide de l’échantillon et du rhéomètre. L’étape 2.4.1 est absolument nécessaire pour s’assurer que la géométrie est réglée sur un écart nul pour atteindre la géométrie et des écarts de coupe de 24 μm et 28 μm, respectivement.- Cliquez sur l’icône 'Zéro écart' sous l’onglet 'Écart' dans le ' Panneaude configuration' dans la fenêtre du logiciel. L’initialisation est complète lorsque la force axiale subie par la géométrie est supérieure ou égale à 1 N, car elle touche la plaque de Peltier. Assurez-vous que l’écart du rhéomètre est mis à zéro afin que sa position de référence soit exacte (voir la figure supplémentaire 7 et la figure supplémentaire 8).
- Appuyez sur les commandes 'flèche haut et bas' sur l’instrument rhéomètre ou ' géométrie haut etbas' icônes sous l’onglet 'Espace' dans le logiciel de contrôle de l’instrument rhéomètre pour élever la géométrie à n’importe quelle hauteur arbitraire. L’écran de commande de l’instrument rhéomètre et le panneau de commande du logiciel de commande de l’instrument rhéomètre afficheront la (même) hauteur d’écart.
- Configurez la procédure expérimentale dans le logiciel de contrôle de l’instrument rhéomètre. Effectuer la caractérisation des propriétés rhéologiques en utilisant une géométrie de plaque cône sur Peltier à 22 °C.
REMARQUE: Le site Web de l’US Geological Survey a été utilisé pour déterminer la température de l’eau de la rivière le 20 septembre 2018, lorsque la carpe argentée utilisée pour les expériences sur le mucus GR a été pêchée à l’emplacement36de Hart Creek. La température du mucus peut affecter les propriétés rhéologiques. L’importance de l’ajustement des valeurs à la température de la rivière est de correspondre approximativement à la température sous laquelle les propriétés du mucus peuvent être estimées de manière réaliste.- Sélectionnez l’onglet 'Expériences' dans le logiciel de contrôle de l’instrument rhéomètre et remplissez les informations pertinentes telles que 'Nom', 'Opérateur', 'Projet', etc. (voir la figure supplémentaire 9)
- Sélectionnez l’onglet 'Géométrie' et assurez-vous que les informations concordent avec les étapes 2.2.5. - 2.2.7. (voir la figure supplémentaire 10).
- Sélectionnez l’onglet 'Procédure', et utilisez les touches fléchées configurées '1: Amplitude d’oscillation' procédure. (voir la figure supplémentaire 11).
- Initialisez les paramètres 'Contrôle de l’environnement' comme suit: 'Température = 22 °C'; 'Temps de trempage = 120 s’et cochez la case 'Attendre la température' (voir figure supplémentaire 11).
- Initialisez les paramètres 'Paramètres de test' comme suit: 'Fréquence = 1 Hz'; définir 'Balayage logarithmique'; « Couple = 10 à 10000 μN.m »; « Points par décennie = 5 » (voir figure supplémentaire 11).
- Mettre en place l’expérience pour déterminer la gamme viscoélastique linéaire (LVR) du mucus de concentration connue (100 mg / mL)
- À l’aide d’une micropipette et d’une pointe de pipette appropriées, prélever environ 0,3 mL de solution de mucus de poisson à une concentration de 100 mg/mL (voir l’étape 1.2, Tableau des matériaux).
- Introduire la solution de mucus sur la plaque Peltier à l’aide de la micropipette (voir Figure 2).
- Appuyez sur le bouton 'Trim Gap' du rhéomètre pour abaisser la géométrie sur la plaque Peltier. Vous pouvez également cliquer sur l’icône 'Trim Gap' sous l’onglet 'Gap' dans l’option ' Panneaude configuration' dans le logiciel de contrôle de l’instrument du rhéomètre (voir la figure supplémentaire 12).
- Utilisez la micropipette avec la pointe de la pipette pour éliminer tout excès de solution de mucus et vous assurer que le fluide se trouve sous la géométrie sans déversement près de la périphérie de la géométrie.
REMARQUE: Un chargement incorrect du fluide entraînera des erreurs dans les mesures. Un échantillon sous rempli réduira la distribution du couple et un échantillon trop rempli entraînera des distributions de contraintes erronées en raison d’un déversement le long des bords. - Sélectionnez les onglets 'Moteur' et 'Vitesse' à 5 rad/s et 0 rad/s alternativement, jusqu’à ce qu’il y ait une inertie et une vitesse minimales dans l’échantillon sous la géométrie. L’écran de commande de l’instrument rhéomètre et le panneau de commande du logiciel de commande de l’instrument rhéomètre affichent la vitesse (voir la figure supplémentaire 13).
- Appuyez sur le bouton 'Geometry Gap' du rhéomètre pour abaisser la géométrie à l’écart approprié prédéfini par géométrie spécifique. Vous pouvez également cliquer sur l’icône «Écart géométrique» sous l’onglet «Écart» dans l’option « Panneaude configuration» du logiciel de commande de l’instrument du rhéomètre (voir la figure supplémentaire 14).
- Exécutez l’expérience pour déterminer la gamme viscoélastique linéaire (LVR) du mucus de la concentration connue (100 mg / mL).
- Cliquez sur l’icône 'Démarrer' sur le logiciel de contrôle de l’instrument rhéomètre (voir figure supplémentaire 15).
REMARQUE: Le rhéomètre effectue des mesures automatiques; une fois que le bouton 'Démarrer' est enfoncé, le rhéomètre prendra environ 20 minutes pour terminer le test. Le paramètre « Points par décennie » de l’étape 2.5.5 détermine le temps dont le rhéomètre aura besoin pour effectuer les mesures. - Exécutez l’expérience en cliquant sur 'Oui' dans la fenêtre contextuelle qui apparaît et suggère que l’écart géométrique soit abaissé à la bonne distance pour démarrer l’expérience, si ce n’est déjà fait.
- Observez le tracé en temps réel généré par le rhéomètre qui signale les modules de stockage (G') et de perte (G'').
REMARQUE: Le G' et le G » sont les modules de stockage et de perte, respectivement. Le module de stockage représente la tendance du matériau à retrouver sa forme d’origine après une déformation induite par les contraintes et équivaut à l’élasticité. Le module de perte représente la mesure dans laquelle le matériau résiste à la tendance à l’écoulement et est représentatif de la viscosité du fluide (voir figure 4). - Définissez l’axe X du tracé sur 'Pourcentage de déformation d’oscillation'. Pour ce faire, faites un clic droit sur le graphique présenté et choisissez l’onglet 'Variables graphiques' (voir Figure supplémentaire 16).
- Enregistrez la plage de pourcentage de déformation d’oscillation à partir du graphique avant que le matériau n’entre dans la plage viscoélastique non linéaire, une fois le test terminé.
- Appuyez sur les commandes 'flèche haut et bas' de l’instrument rhéomètre ou sur les icônes ' géométriemontante et inférieure' sous l’onglet 'Gap' du logiciel de contrôle de l’instrument rhéomètre pour élever la géométrie à n’importe quelle hauteur arbitraire au-dessus de la plaque Peltier.
- Enregistrez le fichier qui contient à la fois la procédure expérimentale et les résultats dans le format de fichier natif du logiciel de contrôle de l’instrument rhéomètre pour déterminer la région viscoélastique linéaire (LVR) de l’échantillon de mucus.
REMARQUE: Cela peut être fait en réglant l’axe X du graphique sur l’amplitude de déformation (%) et / ou la contrainte d’oscillation avant que les données n’entrent dans la région viscoélastique non linéaire (NLVR) (voir la figure supplémentaire 16).
avant que les données n’entrent dans la région viscoélastique non linéaire (NLVR) (voir la figure supplémentaire 16).
- Cliquez sur l’icône 'Démarrer' sur le logiciel de contrôle de l’instrument rhéomètre (voir figure supplémentaire 15).
- Exécutez les balayages dynamiques et les expériences d’essai de débit de taux de cisaillement à l’état d’équilibre dans la gamme viscoélastique linéaire (LVR) pour le mucus de concentration connue 100, mg / mL afin de générer des résultats à partir de trois échantillons de mucus indépendants de 100 mg / mL. Effectuez ces étapes sur les échantillons de concentration de mucus disponibles individuellement.
- Répétez les étapes 2.5.1 à 2.5.4.
- Initialisez les paramètres 'Paramètres de test' comme suit: 'Fréquence = 1 Hz'; définir 'Balayage logarithmique'; « % de déformation = 100 à 10000 %; 'Points par décennie = 10'.
- Sélectionnez l’onglet 'Procédure' et utilisez les touches fléchées configurées pour la procédure '2: Fréquence d’oscillation'.
- Initialisez les paramètres 'Contrôle de l’environnement' comme suit: 'Température = 22 °C'; 'Temps de trempage = 0,0 s'.
- Initialisez les paramètres 'Paramètres de test' comme suit: 'Strain % = 1 %'; définir 'Balayage logarithmique'; « Fréquence = 20 à 1 Hz »; 'Points par décennie = 10'.
- Sélectionnez l’onglet 'Procédure' et utilisez les touches fléchées configurées pour la procédure '3: Flow Sweep'.
- Initialisez les paramètres 'Contrôle de l’environnement' comme suit: 'Température = 22 °C'; 'Temps de trempage = 0,0 s'.
- Initialisez les paramètres 'Paramètresde test ' comme suit: 'Taux de cisaillement = 1 à 10000 1/s'; « Points par décennie = 10 »; case à cocher 'Détection à l’état d’équilibre'.
- Répétez les étapes 2.7.1 à 2.7.2 et attendez que l’expérience soit terminée, environ 45 minutes.
- Appuyez sur les commandes 'flèche haut et bas' sur l’instrument rhéomètre ou sur les icônes 'géométrie haut et bas' sous l’onglet 'Gap' dans le logiciel de contrôle de l’instrument rhéomètre pour élever la géométrie à n’importe quelle hauteur arbitraire.
- Utilisez des lingettes et des gants jetables pour enlever et nettoyer le mucus sur la plaque Peltier avec une solution d’isopropanol (voir tableau des matériaux).
- Enregistrez le fichier qui contient à la fois la procédure expérimentale et les résultats dans le format de fichier natif du logiciel de contrôle de l’instrument de rhéomètre.
3. Répétez le protocole pour d’autres concentrations de solutions de mucus de 200 mg/mL et 400 mg/mL.
- Effectuer les étapes 2.5 à 2.8, y compris toutes les sous-étapes qui y sont énumérées pour les deux concentrations restantes de solutions de mucus, 200 mg/mL et 400 mg/mL.
4. Représentation graphique et analyse des données
REMARQUE : Le code fourni dans le fichier de code supplémentaire effectue la moyenne des données et génère des erreurs de répétabilité, superpose les données de toutes les expériences. Les fonctions de calcul de l’écart type ne sont pas disponibles dans le logiciel de contrôle de l’instrument rhéomètre. Le code est écrit dans un langage de programmation pour l’analyse des données, le post-traitement et la représentation graphique (voir Table des matériaux pour plus de détails).
- Exportez les données générées à partir de l’étape 2.8 concernant la concentration de mucus GR de 100 mg/mL et de l’étape 3.1 concernant les concentrations de mucus GR de 200 mg/mL et 400 mg/mL dans un format de feuille de calcul en cliquant sur l’onglet 'Fichier | | d’exportation Excel' dans le logiciel de contrôle de l’instrument rhéomètre (voir figure supplémentaire 17).
- Exécuter des codes supplémentaires pour générer des diagrammes de viscosité apparente (η) pour les taux de déformation de cisaillement (
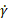 ) variables et le module de perte (G »), le module de stockage (G') et l’angle de phase (δ) pour la variation de la contrainte d’oscillation ( ) et générer des résultats
) variables et le module de perte (G »), le module de stockage (G') et l’angle de phase (δ) pour la variation de la contrainte d’oscillation ( ) et générer des résultats  représentatifs.
représentatifs.
Résultats
Dans cette section, nous présentons les résultats des expériences sur le mucus GR à l’aide d’un rhéomètre rotatif avec une géométrie de cône (40 mm de diamètre, 1° 0' 11'') et une plaque de Peltier. Les expériences ont aidé à caractériser le comportement non newtonien d’amincissement par cisaillement du mucus GR et la contrainte d’élasticité apparente représentant la transition du mucus d’un matériau semblable à un gel à un matériau de type fluide. Les résultats représentatifs comprennen...
Discussion
L’un des principaux objectifs de l’élaboration de ce protocole est d’établir qu’il est bien adapté à la caractérisation rhéologique du mucus GR lorsque de très petits volumes d’échantillons sont disponibles. Nous reconnaissons que davantage d’échantillons provenant d’un groupe de carpes argentées sont nécessaires pour caractériser pleinement les propriétés rhéologiques du mucus GR et les données présentées ici ne sont pas une généralisation à l’ensemble de la population de carpes arge...
Déclarations de divulgation
Aucun conflit d’intérêts n’a été déclaré.
Remerciements
Les auteurs reconnaissent le soutien et le financement du GW Center for Biomimetics and Bioinspired Engineering. Nous remercions le professeur L. Patricia Hernandez du Département des sciences biologiques de l’Université George Washington d’avoir inspiré l’enquête et la collaboration continue, d’avoir fourni une expertise biologique sur la physiologie de la carpe argentée et d’avoir fourni les échantillons de mucus. Nous remercions les étudiants, M. David Palumbo, Mme Carly Cohen, M. Isaac Finberg, M. Dominick Petrosino, M. Alexis Renderos, Mme Priscilla Varghese, M. Carter Tegen et M. Raghav Pajjur pour leur aide dans le laboratoire et M. Thomas Evans et M. James Thomas de TA Instruments, New Castle, DE pour leur soutien à la formation et à l’entretien du rhéomètre. Les images des figures 5A,C ont été prises lors d’une dissection effectuée par le professeur L. Patricia Hernandez du Département des sciences biologiques de l’Université George Washington.
matériels
| Name | Company | Catalog Number | Comments |
| Materials | |||
| Kim Wipes | VWR | 470224-038 | To clean Sample from plate |
| Gloves | VWR | 89428-750 | To prevent contamination of sample |
| Pipette | VWR | 89079-974 | To transport sample from vial to rheometer |
| Pipette Tips | Thermo Scientific | 72830-042 | To transport sample from vial to rheometer |
| Shaker | VWR | 89032-094 | To homogenously mix sample of mucus |
| Vials | VWR | 66008-710 | Contains measured sample volumes |
| Weigh Scale | Ohaus | Scout –SPX Balances | To weigh mass of mucus samples |
| Chemical Reagents | |||
| De-Ionized Water (H20) | - | - | Liquid |
| Sterile 70% Isopropanol (C3H8O) | VWR | 89108-162 | Liquid |
| GR Mucus | |||
| 100 mg/mL concentration, 2mL | - | - | Viscoelastic Material |
| 400 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| 200 mg/mL concentration, 1mL | - | - | Viscoelastic Material |
| Software | |||
| MATLAB | Mathworks | R2017a | Data analysis, post-processing and graphical representation |
| Trios | TA Instruments | v4.5.042498 | Rheometer instrument control and analysis software |
Références
- Cohen, K. E., Hernandez, L. P. The complex trophic anatomy of silver carp, Hypophthalmichthys molitrix, highlighting a novel type of epibranchial organ. Journal of Morphology. 279, 1615-1628 (2018).
- Cohen, K. E., Hernandez, L. P. Making a master filterer: Ontogeny of specialized filtering plates in silver carp (Hypophthalmichthys molitrix). Journal of Morphology. 279, 925-935 (2018).
- Cremer, M., Smitherman, R. Food habits and growth of silver and bighead carp in cages and ponds. Aquaculture. 20 (1), 57-64 (1980).
- Battonyai, I., et al. Relationship between gill raker morphology and feeding habits of hybrid bigheaded carps (Hypophthalmichthys spp.). Knowledge and Management of Aquatic Ecosystems. 416, 36 (2015).
- Zhou, Q., Xie, P., Xu, J., Ke, Z., Guo, L. Growth and food availability of silver and bighead carps: Evidence from stable isotope and gut content analysis. Aquaculture Research. 40 (14), 1616-1625 (2009).
- Freedman, J. A., Butler, S. E., Wahl, D. H. . Impacts of invasive Asian carps on native food webs (Final Report). , (2012).
- Nico, L., Fuller, P., Li, J. . Silver carp (Hypophthalmichthys molitrix)-FactSheet. , (2017).
- Walleser, L., Howard, D., Sandheinrich, M., Gaikowski, M., Amberg, J. Confocal microscopy as a useful approach to describe gill rakers of Asian species of carp and native filter-feeding fishes of the upper Mississippi River system. Journal of Fish Biology. 85 (5), 1777-1784 (2014).
- Nelson, A. Z., Ewoldt, R. H. Design of yield-stress fluids: a rheology-to-structure inverse problem. Soft Matter. 13, 7578-7594 (2017).
- Chen, T. Rheological Techniques for Yield Stress Analysis. TA Instruments Applications Note, RH025. , (2020).
- Ewoldt, R. H., Johnston, M. T., Caretta, L. M., Spagnolie, S. Experimental challenges of shear rheology: how to avoid bad data. Complex Fluids in Biological Systems. , (2015).
- Thornton, D. J., Sheehan, J. K. From Mucins to Mucus: Toward a more coherent understanding of this essential barrier. Proceedings of the American Thoracic Society. 1, 54-61 (2004).
- Shepard, K. L. Functions for fish mucus. Reviews in Fish Biology and Fisheries. 4, 401-429 (1994).
- Fernández-Alacid, L., et al. Skin mucus metabolites in response to physiological challenges: A valuable non-invasive method to study teleost marine species. Science of the Total Environment. 644, 1323-1335 (2018).
- Wagner, C. E., Wheeler, K. M., Ribbeck, K. Mucins and Their Role in Shaping the Functions of Mucus Barriers. Annual Reviews in Cell and Developmental Biology. 34, 189-215 (2018).
- Bird, R. B., Armstrong, R. C., Hassager, O. . Dynamics of Polymeric Liquids, Volume 1: Fluid Mechanics. , 1255-1284 (1987).
- Mantle, M., Allen, A. Isolation and characterisation of the native glycoprotein from pig small intestinal mucus. Biochemical Journal. 195, 267-275 (1981).
- Allen, A., Hutton, D. A., Pearson, J. P., Sellers, L. A., Nugent, J., O'Conner, M. Mucus glycoprotein structure, gel formation and gastrointestinal mucus function. Mucus and Mucosa (Ciba Foundation Symposium). , 137-156 (1984).
- Asakawa, M. Histochemical studies of the mucus on the epidermis of eel, Anguillajaponica. Bulletin of Japanese Society of Scientific Fisheries. 36, 83-87 (1970).
- Fletcher, T. C., Jones, R., Reid, L. Identification of glycoproteins in goblet cells of epidermis and gill of plaice (Pleuroneces platessa L.), flounder (Platichthys flesus (L.)) and rainbow trout (Salmo gairdneri Richardson). Histochemical Journal. 8, 597-608 (1976).
- Silberberg, A. Mucus glycoprotein, its biophysical and gel forming properties. Symposia of the Society for Experimental Biology. 43, 43-64 (1989).
- Hills, B. . The Biology of Surfactants. , 408 (1988).
- Aubert, H., Brook, A. J., Shephard, K. L. Measurement of the adhesion of a desmid to a substrate. British Phycology Journal. 24, 293-295 (1989).
- Sanderson, S. L., Cech, J. J., Patterson, M. R. Fluid dynamics in suspension feeding black fish. Science. 251, 1346-1348 (1991).
- Lai, S. K., Wang, Y. Y., Wirtz, D., Hanes, J. Micro- and macrorheology of mucus. Advanced Drug Delivery Reviews. 61 (2), 86-100 (2009).
- Chaudhary, G., Ewoldt, R. H., Thiffeault, J. L. Unravelling hagfish slime. Journal of Royal Society Interface. 16 (150), 20180710 (2019).
- Downing, S., Salo, W., Spitzer, R., Koch, E. The hagfish slime gland: a model system for studying the biology of mucus. Science. 214, 1143-1145 (1981).
- Hwang, S. H., Litt, M., Forsman, W. C. Rheological properties of mucus. Rheologica Acta. 8, 438-448 (1969).
- Litt, M. Mucus rheology. Archives of Internal Medicine. 126, 417-423 (1970).
- Quarishi, M. S., Jones, N. S., Mason, J. The rheology of nasal mucus: a review. Clinical Otolaryngology. 23, 403-413 (1998).
- Nordgård, C. T., Draget, K. I., Seternes, T. Rheology of salmon skin mucus. Annual Transactions - The Nordic Rheology Society. 23, 175-179 (2015).
- Fernández-Alacid, L., et al. Comparison between properties of dorsal and ventral skin mucus in Senegalese sole: Response to an acute stress. Aquaculture. 513, 734410 (2019).
- Yüce, C., Willenbacher, N. Challenges in Rheological Characterization of Highly Concentrated Suspensions - Case Study for Screen-printing Silver Pastes. Journal of Visualized Experiments. (122), e55377 (2017).
- Sultan, S., Mathew, A. P. 3D Printed Porous Cellulose Nanocomposite Hydrogel Scaffolds. J. Vis. Exp. (146), (2019).
- Barnes, H. A., Hutton, J. F., Walters, K. . An Introduction to Rheology. , (1989).
- USGS Current Conditions for USGS 06910450 Missouri River at Jefferson City, MO. U.S. Geological Survey Available from: https://nwis.waterdata.usgs.gov/usa/nwis/uv/?cb_00010=on&cb_00060=on&cb_00065=on&format=gif_default&site_no=0691045&p09-19&end_date=2018-09-21 (2020)
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon