Method Article
使用商业自动化系统和软件对斑马鱼幼鱼惊吓反应的脉冲抑制进行药理学验证
摘要
在这里,我们描述了一种方案,该方案利用市售的自动化系统对斑马鱼幼鱼中的前脉冲抑制 (PPI) 测定进行药理学验证。
摘要
虽然有大量商业和标准化的自动化系统和软件用于对啮齿动物进行前脉冲抑制 (PPI) 检测,但据我们所知,到目前为止,在斑马鱼中进行的所有 PPI 检测都是使用定制的系统完成的,这些系统仅适用于个别群体。因此,这带来了挑战,尤其是在数据可重复性和标准化问题方面。在本工作中,我们生成了一个方案,该方案利用市售的自动化系统对斑马鱼幼虫中的 PPI 测定进行药理学验证。与已发表的研究结果一致,我们能够复制阿扑吗啡、氟哌啶醇和氯胺酮对斑马鱼幼虫受精后 6 天 PPI 反应的结果。
引言
斑马鱼 (Danio rerio) 幼虫是模拟精神分裂症等精神疾病的合适候选者(由 Gawel 等人审查1),因为它拥有众多优势。这些包括与人类直系同源物具有 70% 序列同源性的完全测序基因组2,存在正向和反向遗传工具来纵基因组并识别给定基因对发育或疾病的贡献3,以及斑马鱼大脑中存在主要的人类/啮齿动物神经递质4。斑马鱼中有几个神经表型结构域可用,例如焦虑、学习和记忆3。光学透明度和对主要类神经毒性药物的敏感性使其成为药理学作和表型药物筛选的理想选择 5,6。
为了进行高通量药物筛选,自动化和稳健内表型的存在非常重要7。例如,已经开发了多种自动记录技术来测量斑马鱼幼鱼的行为,例如触觉性、惊吓反应、视动反应、视运动反应、习惯化、猎物捕获、睡眠/觉醒行为、运动行为等6。虽然一些实验室开发了定制的系统来自动测量和分析其中一些行为,但也有市售的成像和软件系统 8,9,10,11。前脉冲抑制 (PPI) 是一种感觉运动门控形式,当在惊吓刺激之前短暂出现微弱的非惊吓刺激时,惊吓反应会降低,已被用作动物模型中研究精神分裂症的内表型(由12,13 评论)。此外,声学惊吓反应 (ASR) 和 PPI 在研究包括斑马鱼14,15 在内的动物模型的听力和听觉功能方面发挥了有用的作用。斑马鱼幼虫表现出特征性的 C 启动,以响应一种意想不到的惊人刺激,这种刺激被一种较弱的刺激(称为前脉冲)所减轻。长期以来,C-start 一直被描述为由不同神经细胞群控制的逃逸行为,并且在斑马鱼幼虫中得到了彻底的表征 15,16,17。
有大量商业和标准化的自动化系统和软件用于对啮齿动物18、19、20 进行 PPI 检测。然而,据我们所知,到目前为止,在斑马鱼中进行的所有 PPI 检测都是使用定制的系统完成的,这些系统仅适用于单个组 15,16,21,22。这为实现标准化方面的数据再现性和可再现性带来了挑战23.
最近,斑马鱼社区的一家知名供应商开发了一种嵌入了快速相机和 PPI 生成器附加组件的装置,用于在斑马鱼幼鱼24 中进行 PPI 检测。摄像头以每秒 1000 帧的速度录制,从而能够记录快速反应的行为,例如 C 启动,而 PPI 发生器允许用户控制各种声学刺激的传递,以引起惊吓反应24。在这里,我们将上述系统与市售的综合软件包相结合,该软件包旨在自动分析复杂行为11,以生成在斑马鱼幼虫中进行 PPI 反应测定的方案。我们使用 1) 阿扑吗啡,一种已知会导致 PPI 缺陷的多巴胺激动剂;2) 氟哌啶醇,一种已知可增强 PPI 的多巴胺拮抗剂和抗精神病药,以及 3) 氯胺酮,一种已知可调节 PPI 的 NMDA 受体拮抗剂。
研究方案
所有动物实验均获得挪威食品安全局实验动物管理局监督和应用系统 (FOTS-18/106800-1) 的批准。
1. 斑马鱼饲养
- 建立野生型成年雄性和雌性斑马鱼 (Danio rerio) 种群的交配,前一天晚上在标准条件下维持25 。这里使用 Tupfel 长鳍 (TL) 菌株。
- 第二天早上移除障碍物,让它们通过自然产卵进行交配。
- 从交配池中收集卵。
- 去除未受精的鸡蛋和其他碎片,然后将鸡蛋转移到培养皿 (n = 60) 中,并在 28 °C 的培养箱中在胚胎培养基中培养:1.5 mM HEPES,pH 7.6,17.4 mM NaCl,0.21 mM KCl,0.12 mM MgSO 4 和 0.18 mM Ca(NO3)2。
- 每天更新一半的胚胎培养基并去除死亡幼虫,直到 6 dpf。
注意:所有实验均在受精后 6 天 (dpf) 对单个幼虫进行。
2. 幼虫的药剂和前处理
- 将阿扑吗啡和氯胺酮溶解在 E3 培养基中,分别制备 500 μM 和 10 mM 储备溶液。
- 将氟哌啶醇溶于 100% 二甲基亚砜 (DMSO) 中,制成 10 mM 储备液。所用 DMSO 的最终浓度为 0.1%。
- 使用 0.1% DMSO 和 E3 培养基作为载体对照。
- 使用以下最终浓度的药物:10 mg/mL 阿扑吗啡、1 mM 氯胺酮和 20 μM 氟哌啶醇16。
- 将阿扑吗啡和氯胺酮组幼虫预暴露 10 分钟,将氟哌啶醇和 DMSO 载体对照组预暴露 20 分钟16。
3. 行为测试前的设置
- 在实验当天,将幼虫和所有相关材料转移到实验室。将实验室的温度设置为 27 ± 1 °C。
- 确保 测试暗室 中的背景噪声尽可能低,最好不超过 45 dB 声压级 (SPL)。
- 将分贝 (dB) 计的声波计麦克风安装在测试室中(制造商已经钻了安装口)。
- 为了减少房间内的背景噪音,用定制的声室对测试室进行隔离(参见 图 1B 了解设置概述)。
- 准备一个 96 孔板用于前脉冲抑制测试。
注:摄像机具有 2048 × 500 像素的分辨率,这意味着一次最多只能对 3 个泳道(33 个孔)进行成像。- 使用 96 孔规格的定制亚克力板以减少阴影干扰。
注意:定制板的测量值可在以下网站上找到:https://zenodo.org/record/3739378#.XooyLW5uKas
- 使用 96 孔规格的定制亚克力板以减少阴影干扰。
- 在移液管的帮助下,将 310 μL 暴露溶液/培养基和一只幼虫转移到每个孔中。
- 分别使用立体声放大器的音量旋钮和分贝计校准和测量刺激强度。
- 在 “Level reference” 部分注册最大声音强度。
4. 刺激参数和视频采集
- 打开计算机、放大器系统和 dB 表(有关设置的概述,请参见 图 1A )。
- 通过将音量旋钮旋转到最小或最大来调整声音强度。
- 每次用 dB 表检查声级,音量旋钮可调。这对于找到设置可以产生的最大和最小声强非常重要。
注:dB 表计算激励的 RMS dB 输出。该系统在测试室的固体部件内部产生声音,保持板块坚固,同时在整个板支架的水平面上产生振动。- 将音量旋钮调到最大,用 dB 表测量声音强度并使用该值。
- 每次用 dB 表检查声级,音量旋钮可调。这对于找到设置可以产生的最大和最小声强非常重要。
- 在 PPI 生成器的界面上,定义参数: stimulus inter-stimulus interval 表示 为 Delay;试验间隔表示为 Acquisition delta 时间;预脉冲持续时间等。
- 对于单独前脉冲试验,请确保将 Startle 参数的 “Amplitude” 或 Duration of stimulus (刺激的幅度) 或 Duration of stimulus (持续时间) 参数设置为零,反之亦然。
- 要生成试用列表,请选择 Add >为试用命名。例如,“单独预脉冲 50 dB”。
注意:可以根据需要生成任意数量的 trial,但要注意列表的长度,因为这可能会导致程序崩溃。- 在所有 PPI 实验中使用伪随机顺序交错前脉冲试验和单独脉冲试验。当实验中存在多个刺激时,使用 30 秒的试验间隔 (ITI)。
注意:在本研究中,使用了 660 Hz 的 100 ms 惊吓刺激(脉冲)和 5 Hz 的 440 ms 前脉冲刺激。对于 PPI 实验,刺激间隔 (ISI) 为 100 毫秒。
- 在所有 PPI 实验中使用伪随机顺序交错前脉冲试验和单独脉冲试验。当实验中存在多个刺激时,使用 30 秒的试验间隔 (ITI)。
- 要保存协议,请选择 File > Save as。
- 按如下方式调整测试室中的照明条件。
- 启动 USB 测量计算,选择 模拟输出 ,然后 转到 D/A OUT O (P13) 以更改照明。值为零表示无光,而增加 D/A OUT O 值会增加盒子中的光强度。所有实验均使用 100 的光强度。
- 设置摄像机
- 启动软件并等待相机加载。
- 选择 调整 (位于右侧)并将采集帧速率设置为 1,000,然后单击 应用 以使更改生效。
- 在实验开始前,将幼虫适应 100% 光照的测试室 5 分钟。
- 要开始实验,请选择 PPI 生成器上的 Experiment 菜单,单击 Run 并选择孔格式(例如,33 孔)。
- 在运行实验之前,请始终确保以正确的设置启动相机软件。
- 每次试用获取 2 秒视频。
- 确保采集帧速率设置为 1,000。
5. 自动跟踪和分析声学惊吓响应和 PPI
- 协议设置。
- 启动分析软件(参见 材料表)。选择 New from template > Apply a predefined template ,然后浏览其他菜单(详细信息如下)。
- 在 Video Source 下从 video file 中选择。
- 浏览视频文件。将主题设置为鱼>斑马鱼幼虫>区域模板(无模板)。在 Arenas (竞技场) 下指定 Number of arenas (竞技场数)。
- 在 Subjects(主题)下指定每个领域的主题数(设置为 1)。
- 在跟踪特征下选择中心点、鼻子点和尾部底部检测(参见图 2A、B)。
注意:这对于计算 C 启动响应的体角很重要(参见 图 2C)。 - 单击 Name > save as(名称另存为)。使用的单位是 mm、s、deg 分别表示距离、时间和旋转。
注意: 请记住使用相同的单位校准秤。
- 选择 Arena setting (竞技场设置)。
- 单击 Grab background image(抓取背景图片)。
- 完成右侧菜单上的步骤(如有疑问,请使用 Help 菜单)。
- 选择圆形绘制工具来绘制竞技场。
- 选择 Trial control settings (试用控制设置 ) > 创建新的 > 名称。
- 选择 Detection settings (检测设置),完成右侧菜单上的步骤。
- 将 Sample Rate 设置为 25。选择 Advanced detection settings (高级检测设置)。 在 “方法”下,选择 “动态减法”、“ 高级模型/成年鱼”,然后将 “主体颜色与背景相比 ”设置为 “较暗 ”,并移动滑块以定义幼虫的对比度。
- 在主体轮廓下,首先选择 erode,然后扩张并增加轮廓 erotion 和 dilation 值,直到完全检测到动物。
- 保存协议并用于对获得的 PPI 视频进行后续分析。
- 启动分析软件(参见 材料表)。选择 New from template > Apply a predefined template ,然后浏览其他菜单(详细信息如下)。
- 试用列表设置。
- 选择 试验列表,定义自变量,例如幼虫 ID、治疗、刺激类型等。选择视频路径并定义用于批量采集的试用列表。
- 客户获取设置。
注意:如果已生成试用列表,则可以对视频执行批量采集。- 如果某些轨迹丢失,请使用轨迹编辑器调整追踪要素。
- 从分析中排除使用轨迹编辑器后仍未解决的追踪错误。
- 将 Track Smoothing Profile 设置为 1 mm 以减少数据中的杂色。这可以根据幼虫的背景活动进行调整。
- 分析设置。
- 要选择要分析的试验,请选择 Data profiles (数据配置文件 ) 并根据感兴趣的自变量定义轨迹。
注意:如果组件被隐藏,请单击右上角的眼睛符号进行显示。- 过滤 要分析的试验部分(例如,根据治疗或刺激组的类型)。
- 选择要分析(嵌套)的轨道部分。在这项研究中,数据嵌套了刺激开始和刺激开始后 100 ms 之间的轨迹。
- 请记住用箭头线连接所有过滤器和嵌套框以完成说明。
- 定义要分析的因变量,选择 分析配置文件 并指定感兴趣的变量(关注因变量下的 正文)。
注意:如果组件被隐藏,请单击右上角的眼睛符号进行显示。- 双击 Body angle (实体角度)。选择 绝对折弯。浏览 Trial settings 并选择 maximum,然后单击 add。
- 双击 body angle state (主体角度状态)。将平均间隔设置为 5 个样本。设置弯曲角度阈值。要计算 bent 的统计信息,请浏览 Trial statistics 并选择 latency to first > add.重复步骤,直到获得不同的阈值(使用 20-80° 之间)并相应地命名。
- 生成 统计数据和图表。
- >统计数据和图表中选择分析>结果,然后点击计算。
- 确保将 data and analysis profiles 设置为正确的模板,因为每个部分下都可以创建多个模板。
- 将试验和小组统计信息导出为电子表格文件,以便进行处理和分析。
- 要选择要分析的试验,请选择 Data profiles (数据配置文件 ) 并根据感兴趣的自变量定义轨迹。
6. 数据分析
- 打开包含试用统计信息的电子表格文件。
- 选择 Body angle (体角) Maximum deg(最大度)、Bent latency (各种体角阈值)列。
- 将刺激开始后 30 ms 截止潜伏期内体角≥ 30° 的每一个变化视为积极的 C 启动响应(即响应者);体角< 30° 的患者为无反应者。
- 以二进制方式,将 1 分配给每个板的响应幼虫,将 0 分配给无响应的幼虫。
- 计算每个板的反应者和无反应幼虫的总数。计算每种情况下的反应者 (%),计算为 (反应的幼虫数/幼虫总数) × 100。从分析中排除对惊吓刺激反应低于 30% 的幼虫16。
注意:任何能够在等于或超过 70% 的幼虫中引起 C-start 反应的刺激强度都被认为是合适的惊吓刺激16。
- 计算每个板的反应者和无反应幼虫的总数。计算每种情况下的反应者 (%),计算为 (反应的幼虫数/幼虫总数) × 100。从分析中排除对惊吓刺激反应低于 30% 的幼虫16。
- 将 %PPI 计算为 100 ×(对惊吓刺激的反应百分比 - 对前脉冲的反应百分比 + 惊吓序列的反应)/(对惊吓刺激的反应百分比)16。
7. 统计分析
- 将数据表示为平均值±标准差 S.D.(请参阅统计软件 的材料表 )。
- 使用单因素方差分析后跟 Tukey 事后 检验确定不同预脉冲强度对幼虫反应的影响。
- 使用双向方差分析,然后进行 Holm-Sidak 事后 检验来确定药物治疗对具有不同前脉冲强度的 % PPI 反应的影响。
结果
进行了三个实验来验证组合多个系统来分析斑马鱼幼虫声学惊吓反应的前脉冲抑制的方案。首先,测试了准确传递声学刺激和捕捉幼虫对惊吓刺激的反应的能力。接下来,是验证在出现前脉冲刺激时减弱惊吓反应的能力。最后,建立了检测药物阿扑吗啡、氟哌啶醇和氯胺酮对惊吓反应前脉冲抑制的药理学调节的能力。
斑马鱼幼虫对听觉惊吓刺激的反应
以前的工作已经证明,斑马鱼幼鱼在受到惊人的声学刺激时表现出特征性的 C 开始16。测试了激发和捕捉幼虫对惊吓刺激的行为的能力。观察到记录的幼虫显示 C 启动响应(图 2)。70 dB re(100 毫秒,660 Hz, 补充图 1A)的刺激强度足以在 ≥70% 的幼虫中引起反应(图 3A)。当以 30 秒的试验间隔重复出现 30 次时,70 dB re 刺激不会导致幼虫习化(N = 3 次重复;16 只幼虫/重复),如图 3B 所示。
Prepulse 降低斑马鱼幼鱼对声学刺激的惊吓反应
大量证据表明,前脉冲刺激调节幼虫对惊吓刺激的反应 15,21,22,26。使用了双脉冲范式,其中称为前脉冲的微弱刺激位于称为脉冲的惊吓诱导刺激之前。使用的前脉冲刺激比设置为 70 dB re 的脉冲刺激小 20、17 或 14 dB。前脉冲(5 ms,440 Hz)总是在脉冲开始前 100 ms 出现(补充图 1B)。每个测试的前脉冲刺激都显着降低了幼虫对脉搏的反应。在图 4 中,显示了在 E3 培养基中 6 dpf TL 的幼虫对声学惊吓刺激的反应(以 % 为单位),N = 6(16 只幼虫/组)。对惊吓刺激(脉搏)有反应的幼虫百分比为 79.86 ± 9.772。出乎意料的是,当惊吓刺激之前有 50、53 或 56 dB 的前脉冲时,幼虫反应分别下降到± 40.87%、11.30%、39.58% ± 7.345% 和 29.17% ± 9.350%。单因素方差分析显示刺激对幼虫的影响存在统计学差异 (F (3, 48) = 57.23, P < 0.0001),Tukey 多重比较检验揭示了在 95% 置信区间的各组间统计学显着性。
前脉冲抑制的药理学调节
早期研究表明,多巴胺能药物阿扑吗啡和氟哌啶醇以及谷氨酸能药物氯胺酮显着调节幼虫的前脉冲抑制,就像在哺乳动物和啮齿动物中一样16。根据这些研究选择用于验证设置的浓度。所有药理学实验的刺激间隔 (ISI) 为 100 ms。
阿扑吗啡对前脉冲抑制的影响
在 图 5 中,与 E3 对照幼虫相比,用 10 mg/mL 阿扑吗啡预处理 10 分钟的幼虫显示 % PPI 总体降低(双向方差分析,非 RM(因素:治疗和前脉冲强度;处理:F (1, 34) = 16.21,p = 0.0003;前脉冲强度:F (2, 34) = 8.674,P = 0.0009,这显示不显着的相互作用:F (2, 34) = 2.514, p = 0.0959)。为了更详细地研究差异,Holm-Sidak 的 事后 测试显示,在前脉冲强度 53 (p = 0.0126) 和阿扑吗啡处理的幼虫 (p = 0.0044) 但在 50 dB (p = 0.5813) 时没有,E3 对照和阿扑吗啡处理的幼虫之间的惊吓反应存在显着差异。
氟哌啶醇对前脉冲抑制的影响
图 6 显示了与 E3 培养基相比,用 20 μM 氟哌啶醇预处理 20 分钟的幼虫中 %PPI 的总体增加(双向方差分析,非 RM(因素:处理和前脉冲强度;处理:F (1, 32) = 20.75,p < 0.0001;前脉冲强度:F (2, 32) = 3.147,p = 0.0565,无显著交互作用:F (2, 32) = 0.7455, p = 0.4826)。使用 Holm-Sidak 事后 测试,仅在前脉冲强度 53 (p = 0.00489 和 56 (p = 0.0348) 处观察到统计学显着性的存在,但在 50 dB (p = 0.067) 时未观察到。
氯胺酮对前脉冲抑制的影响
图 7 显示,在不同的前脉冲刺激强度下,E3 对照幼虫与在 1.0 mM 氯胺酮中预处理 10 分钟的幼虫之间的惊吓反应存在差异(双向方差分析,非 RM(因素:治疗和前脉冲强度;处理:F (1, 35) = 25.46,p < 0.0001;前脉冲强度:F (2, 35) = 6.018,p = 0.0057,没有显着的相互作用: F (2, 35) = 0.8450,p = 0.4381)。Holm-Sidak 的 事后 测试仅在 50 (p = 0.0039) 和 53 (p = 0.0027) 的预脉冲强度下显示显着性,但在 56 dB (p = 0.0802) 时没有显示显着性。
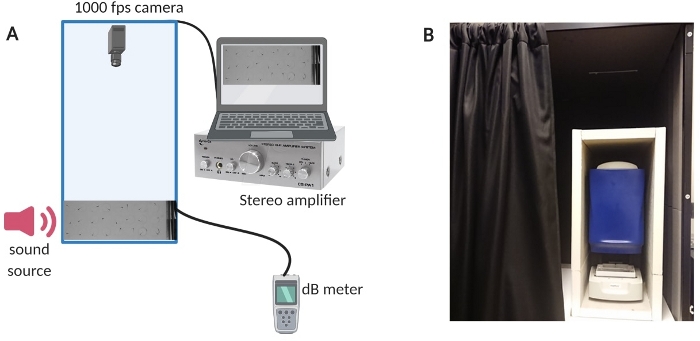
图 1:测试设备。 (A) 设备设置概述。(B) 设置设备的内部绝缘,以最大限度地减少实验期间的背景噪音。 请单击此处查看此图的较大版本。
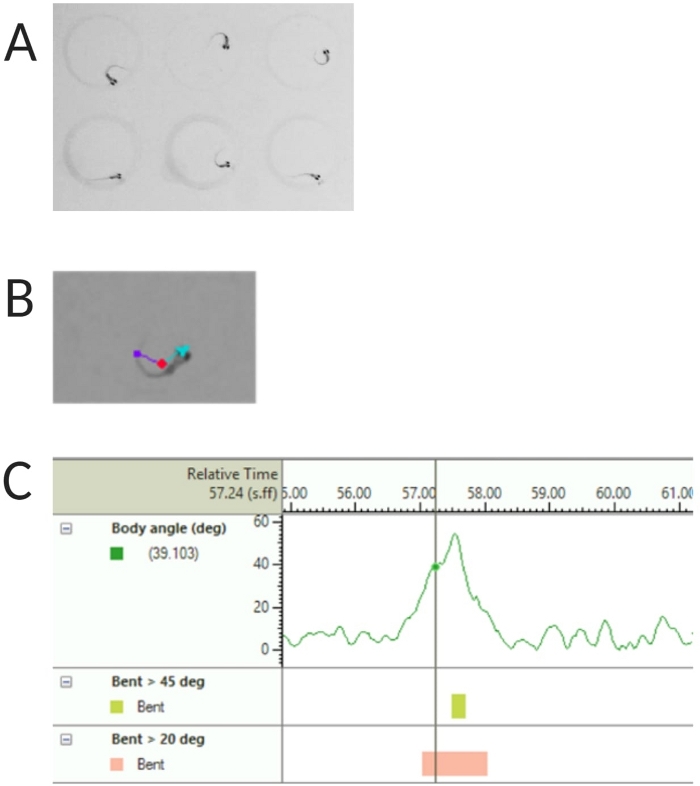
图 2:幼虫斑马鱼声学惊吓反应分析。 (A) 6 只斑马鱼幼虫在 6 dpf 时表现出的特征性 C 开始。(B) 叠加在 6 dpf 幼虫上的三个跟踪特征的代表图像:中心点(红色)、鼻尖(青色)和尾部基部(紫色)。(C) 6 dpf TL 野生型幼虫显示的绝对弯曲角的代表性图像。 请单击此处查看此图的较大版本。
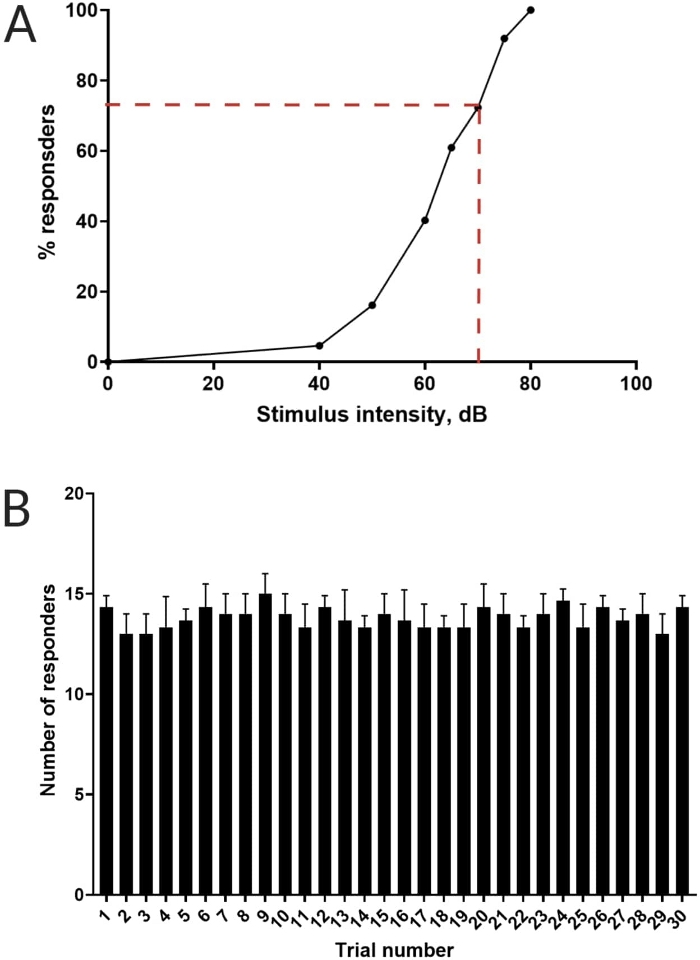
图 3:声学惊吓阈值的测定。 (A) 70 dB 的刺激强度(用红色虚线表示)能够在 >70% 的幼虫 (N = 33;6 dpf TL) 中引起 C 启动反应。(B) 幼虫不习惯在 30 秒的试验间隔内出现 30 次(试验)的 70 dB re刺激(N = 3 次重复;16 只幼虫/重复)。数据以平均值± S.D. 表示。请单击此处查看此图的较大版本。
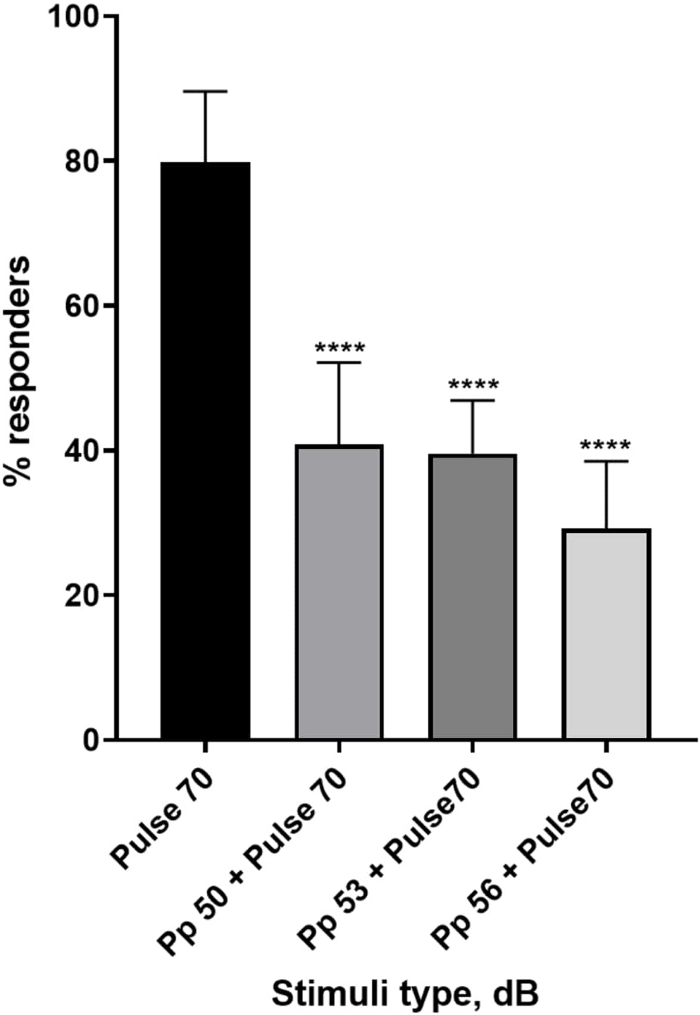
图 4:脉冲前诱导的幼虫反应降低 (%)。 比 70 dB re惊吓刺激低 20、17 和 14 dB 的脉冲前刺激导致野生型 TL 幼虫 C-start 反应者的数量减少。所有数据均表示为均值 ± SD,N = 5(16 只幼虫/组),****p < 0.0001,与单向方差分析后 Tukey 事后 检验的惊吓刺激显着不同。 请单击此处查看此图的较大版本。
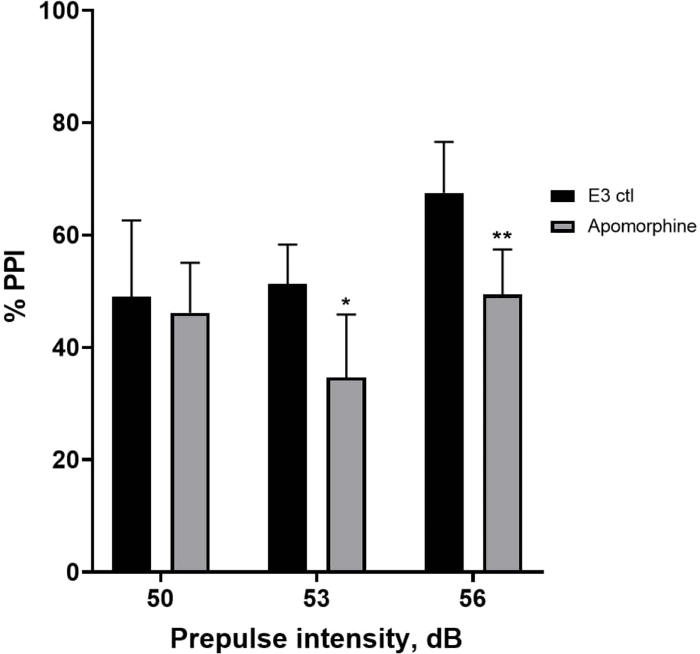
图 5:阿扑吗啡诱导的 %PPI 缺陷。 所有数据均以平均值 ± SD 表示,N = 4\u20125(16 只幼虫/组),通过双向方差分析后 Holm-Sidak 事后 检验的统计学显着差异。*p = 0.0126,E3 ctl/阿扑吗啡处理组在 53 dB 时;**p = 0.0044,E3 ctl/阿扑吗啡处理组在 56 dB 时。 请单击此处查看此图的较大版本。
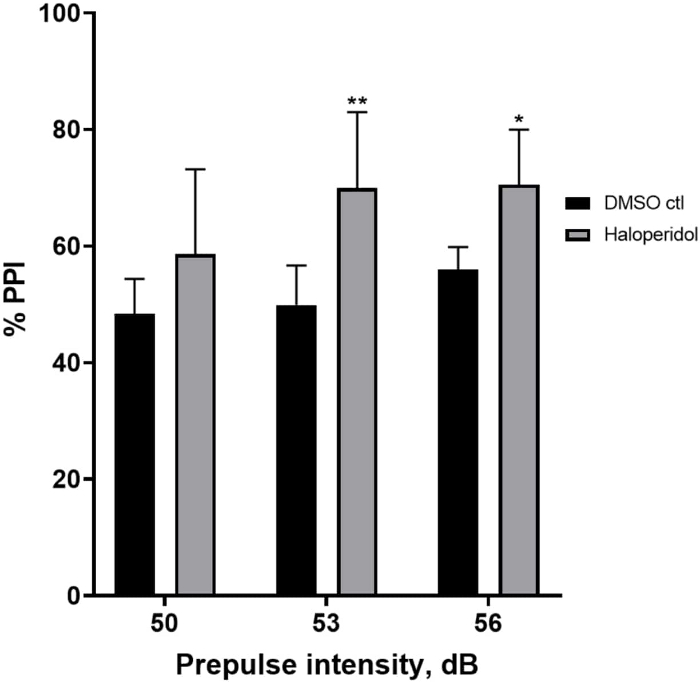
图 6:氟哌啶醇诱导的 %PPI 增强。 所有数据均以平均值 ± SD 表示,N = 4\u20125 (16 只幼虫/组),在双向方差分析后通过 Holm-Sidak 事后 检验得出统计学显着差异。**p = 0.0048,DMSO ctl/阿扑吗啡处理组为 53 dB;*p = 0.0348,DMSO ctl/阿扑吗啡处理组为 56 dB。 请单击此处查看此图的较大版本。
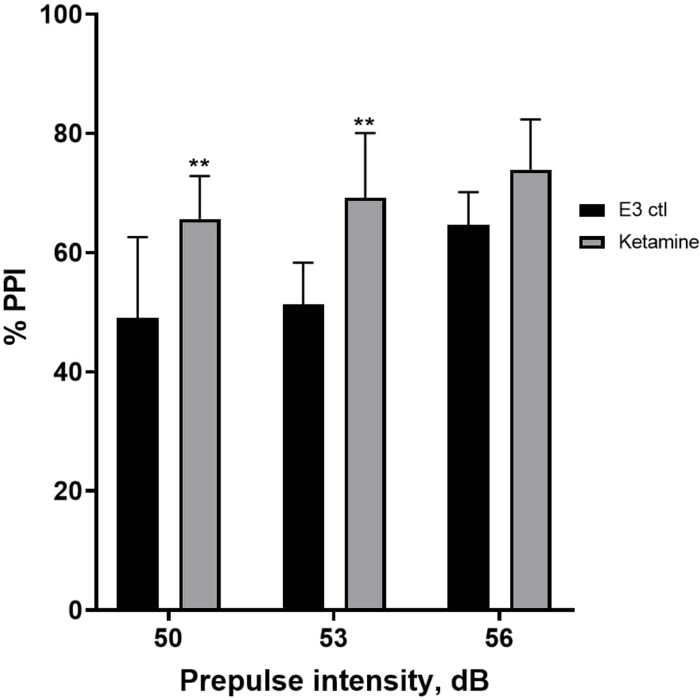
图 7:氯胺酮诱导的 %PPI 增强。 所有数据均表示为平均值± S.D,N = 4\u20125(16 只幼虫/组),双向方差分析后 Holm-Sidak 事后 检验的统计学显着差异 **p = 0.0039,E3 ctl/阿扑吗啡处理组为 50 dB,**p = 0.0027,E3 ctl/阿扑吗啡处理组为 53 dB。 请单击此处查看此图的较大版本。
补充视频 1:幼虫对 70 dB 声学惊吓刺激表现出 C 启动的代表性视频。请点击此处下载此视频。
补充图 1:使用 PPI 生成器生成的刺激条件的代表性示例。 (A) 单独刺激试验,(B) 脉冲前抑制试验(脉冲前 + 脉冲),(C) 无刺激试验来测量未刺激幼虫的阈值基线弯曲角。 请点击此处下载此图表。
讨论
为了改进和完善神经行为研究的方案,验证任何新的行为分析系统都是必不可少的。在目前的调查中,评估了两种市售系统和软件在斑马鱼幼虫中诱导声学惊吓反应以及检测和量化先前描述的此类行为的药理学调节的能力。
执行了大量修改和故障排除以优化设置。用于分析 C-start 反应的默认软件是在获取每个实验的数据后自动进行分析(22 次试验/板构成一个实验)。这减少了每天可以运行的板数量,从而降低了通量(每天 5 块板)。为了避免这一限制,需要将分析软件与数据收集过程分离,从而将通量提高到平均每天 10 块板。因此,事实证明,转向独立分析软件进行非实时分析的决定是成功的,而且效率更高。为避免阴影或其他碎屑的干扰,从而给数据带来噪声,建议用培养基完全填充孔,去除所有气泡,避免食物颗粒或类似物被误认为幼虫,从而在数据中产生噪声。校准声音刺激后,dB 计捕获的放大器系统可达到的最大强度为 85 dB re,而测试室中的初始背景噪声为 60 dB re。这导致了一个狭窄的 dB 窗口。因此,将背景噪音保持在尽可能小至关重要。为了实现这一目标,使用 parafon acoustics 材料(见 材料表)在测试室周围构建额外的绝缘层,并使用声乐室束构建额外的绝缘层(见 材料表)。通过这些绝缘层,测试室内的背景噪声成功地从最初的 60 dB 降低到 45 dB re。
目前,这种设置的一个优点是所有组件都可以在市场上买到,因此,不仅限于少数实验室。编码语言知识有限的人可以使用它,因为该协议相当容易理解和遵循。例如,通过使用 PPI 系统,可以在不同的刺激间隔和试验间隔内传递脉冲和前脉冲,以及捕获幼虫对此类刺激的反应。一旦捕获了这些行为,就可以使用分析软件将它们分为响应者和非响应者。响应组被归类为幼虫,其 C 开始为 30° 或更高,延迟为 <50 毫秒。此外,PPI 反应受靶向多巴胺能和谷氨酸能信号传导的药物的调节(由 Geyer 及其同事审查27)。与以前的研究一致,阿扑吗啡是一种非选择性多巴胺受体激动剂,可降低斑马鱼幼鱼对惊吓反应的前脉冲抑制,而氟哌啶醇是一种多巴胺拮抗剂,可增强反应。在斑马鱼幼鱼中,氯胺酮已被证明可以根据 ISI16 的持续时间差异调节 PPI。在上述研究中,当用氯胺酮预处理时,幼虫 PPI 在 30 毫秒时增强,但在 500 毫秒 ISI 时被抑制。虽然这项研究没有使用可变 ISI,但观察到氯胺酮在 100 毫秒的 ISI 下增强了 PPI,使其与之前研究使用 30 毫秒 ISI 时的数据具有可比性。该研究表明,通过结合这些市售系统,可以进行 PPI 测定并可靠地检测斑马鱼幼虫 PPI 反应的药理学诱导变化。该系统的一个局限性是分析软件跟踪的鼻尖特征总是落在幼虫的一只眼睛上,从而产生一个基线角度。为了克服这个问题,有必要始终确定未受刺激幼虫的基线弯曲角度,发现本研究中使用的幼虫的基线弯曲角度为 ~30°。因此,构成了选择 30° 作为受惊幼虫中被认为是阳性 C-start 反应的阈值的基础。如果考虑到这些要点,应该可以在任何可以使用设置设备的实验室中进行 PPI 分析。由于延迟可变性的范围,本文没有像前面16 报道的那样专注于将惊吓响应的运动学分类为短延迟和长延迟。因此,仅使用刺激开始后 <50 ms 的 C-start 反应15。
据报道,菌株差异会影响斑马鱼在几种分析中的行为28、29、30、31 以及影响听力敏感性32。因此,必须确定每个测试应变的基线弯曲角度。由于听力敏感性也可能不同,因此确定基线惊吓反应、最适合作为每种菌株的前脉冲或惊吓刺激的声音强度以及刺激的持续时间至关重要。ISI 是另一个应该仔细考虑的参数,因为一些药物可以根据前脉冲和惊吓刺激开始之间的间隔来增强或减少 PPI16。预计,对研究认知功能、神经精神疾病和听力(听觉功能)感兴趣的实验室会发现这种 PPI 设置和协议有助于筛选他们的药理学和/或遗传模型。该方案还为化合物库的高通量筛选提供了基础。
披露声明
作者声明没有竞争性的经济利益。
致谢
我们感谢 Ana Tavara 和 João Paulo RP Santana 出色的鱼类护理以及对隔音室测试和设置的宝贵帮助,以及 Wietske van der Ent 博士在设置动物运动轨迹跟踪系统软件方面的初步支持。这项研究由挪威研究委员会 (ISP, BIOTEK2021/ DigiBrain) 资助。
材料
| Name | Company | Catalog Number | Comments |
| Apomorphine | Sigma Aldrich | A4393 | Dopamine agonist |
| dB meter | PCE instruments | PCE-MSM 4 | For measuring stimulus intensity |
| DMSO | Sigma Aldrich | D8418 | For dissolving organic solutes |
| Dynavox Amplifier | Dynavox | CS-PA1 MK | For delivering acoustic stimuli |
| EthoVision XT | Noldus, Netherlands | EthoVision XT, version 14 | Automated tracking software |
| GraphPad Prism | GraphPad Software | Version 8 | Statistical analysis software |
| Haloperidol | Sigma Aldrich | H1512 | Dopamine antagonist |
| Ketamine | Sigma Aldrich | Y0000450 | NMDA receptor antagonist |
| parofon acoustics materials | Paroc | 8528308 | Helps reduce background noise in the test cabinet |
| t.akustik Vocal Booth Bundle | Thormann, Germany | 458543 | Helps reduce background noise in the test cabinet |
| ZebraBox Revo with PPI add-ons | ViewPoint, France | ZebraBox Revo with PPI add-ons | Includes hardware and software |
参考文献
- Gawel, K., Banono, N. S., Michalak, A., Esguerra, C. V. A critical review of zebrafish schizophrenia models: Time for validation. Neuroscience & Biobehavioral Reviews. 107, 6-22 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Kalueff, A. V., Stewart, A. M., Gerlai, R. Zebrafish as an emerging model for studying complex brain disorders. Trends in Pharmacological Sciences. 35 (2), 63-75 (2014).
- Panula, P., et al. The comparative neuroanatomy and neurochemistry of zebrafish CNS systems of relevance to human neuropsychiatric diseases. Neurobiology of Disease. 40 (1), 46-57 (2010).
- Kokel, D., Peterson, R. T. Chemobehavioural phenomics and behaviour-based psychiatric drug discovery in the zebrafish. Briefings in Functional Genomics and Proteomics. 7 (6), 483-490 (2008).
- Basnet, R. M., Zizioli, D., Taweedet, S., Finazzi, D., Memo, M. Zebrafish Larvae as a Behavioral Model in Neuropharmacology. Biomedicines. 7 (1), 23(2019).
- Henry, J., Wlodkowic, D. Towards High-Throughput Chemobehavioural Phenomics in Neuropsychiatric Drug Discovery. Marine Drugs. 17 (6), (2019).
- Behavioural measurement system | Laval zebrafish | Drosophila | Daphnia | insects | Products | Zantiks. , Available from: https://zantiks.com/products/zantiks-mwp (2020).
- Product List - ViewPoint. , Available from: http://www.viewpoint.fr/en/products (2020).
- Observation chamber for zebrafish research - DanioVision. , Available from: https://www.noldus.com/daniovision/observation-chamber (2020).
- EthoVision XT - Video tracking software | Noldus. , Available from: https://www.noldus.com/ethovision-xt (2020).
- Gould, T. D., Gottesman, I. I. Psychiatric endophenotypes and the development of valid animal models. Genes, Brain and Behavior. 5 (2), 113-119 (2006).
- van den Buuse, M. Modeling the Positive Symptoms of Schizophrenia in Genetically Modified Mice: Pharmacology and Methodology Aspects. Schizophrenia Bulletin. 36 (2), 246-270 (2010).
- Acoustic startle modification as a tool for evaluating auditory function of the mouse: Progress, pitfalls, and potential. Abstract - Europe PMC. , Available from: https://europepnc.org/article/PMC/5446932 (2020).
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. Journal of Experimental Biology. 216 (18), 3504-3513 (2013).
- Burgess, H. A., Granato, M. Sensorimotor Gating in Larval Zebrafish. Journal of Neuroscience. 27 (18), 4984-4994 (2007).
- Eaton, R. C., Farley, R. D., Kimmel, C. B., Schabtach, E. Functional development in the mauthner cell system of embryos and larvae of the zebra fish. Journal of Neurobiology. 8 (2), 151-172 (1977).
- SR-LAB - San Diego Instruments Startle Response. San Diego Instruments. , Available from: https://sandiegoinstruments.com/product/sr-lab-startle-response/ (2020).
- Startle packages - Med Associates Inc. Med Associates Inc. , Available from: https://www.med-associates.com/product-category/acoustic-startle-reflex-packages/ (2020).
- Startle response & Pre-pulse inhibition test. O'HARA & CO.,LTD. , Available from: https://ohara-time.co.jp/products/startle-response-pre-pulse-inhibition-test/ (2020).
- Thyme, S. B., et al. Phenotypic Landscape of Schizophrenia-Associated Genes Defines Candidates and Their Shared Functions. Cell. 177 (2), 478-491 (2019).
- Privat, M., et al. Sensorimotor Transformations in the Zebrafish Auditory System. Current Biology. 29 (23), 4010-4023 (2019).
- Gerlai, R. Reproducibility and replicability in zebrafish behavioral neuroscience research. Pharmacology Biochemistry and Behavior. 178, 30-38 (2019).
- Add-on - Fast camera 1000 FPS - ViewPoint. , Available from: http://www.viewpoint.fr/app.php/en/p/equipment/add-on-fast-camera (2020).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. , (2019).
- Bhandiwad, A. A., Sisneros, J. A. Revisiting Psychoacoustic Methods for the Assessment of Fish Hearing. Fish Hearing and Bioacoustics: An Anthology in Honor of Arthur N. Popper and Richard R. Fay. , 157-184 (2016).
- Geyer, M. A., Krebs-Thomson, K., Braff, D. L., Swerdlow, N. R. Pharmacological studies of prepulse inhibition models of sensorimotor gating deficits in schizophrenia: a decade in review. Psychopharmacology. 156 (2-3), 117-154 (2001).
- Lange, M., et al. Inter-Individual and Inter-Strain Variations in Zebrafish Locomotor Ontogeny. PLOS ONE. 8 (8), 70172(2013).
- Liu, X., et al. Strain-dependent differential behavioral responses of zebrafish larvae to acute MK-801 treatment. Pharmacology Biochemistry and Behavior. 127, 82-89 (2014).
- Loucks, E., Carvan, M. J. Strain-dependent effects of developmental ethanol exposure in zebrafish. Neurotoxicology and Teratology. 26 (6), 745-755 (2004).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLOS ONE. 12 (4), 0175420(2017).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hearing research. 341, 220-231 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。