Method Article
Validazione farmacologica dell'inibizione prepulsata della risposta allo spavento nelle larve di pesce zebra utilizzando un sistema e un software automatizzati commerciali
In questo articolo
Riepilogo
Qui descriviamo un protocollo che utilizza sistemi automatizzati disponibili in commercio per convalidare farmacologicamente il saggio di inibizione pre-impulso (PPI) nelle larve di zebrafish.
Abstract
Sebbene esista un'abbondanza di sistemi e software automatizzati commerciali e standardizzati per l'esecuzione del test di inibizione prepulsata (PPI) nei roditori, per quanto ne sappiamo, tutti i test PPI eseguiti nel pesce zebra sono stati, fino ad ora, eseguiti utilizzando sistemi personalizzati che erano disponibili solo per singoli gruppi. Ciò ha quindi presentato delle sfide, in particolare per quanto riguarda le questioni della riproducibilità e della standardizzazione dei dati. Nel presente lavoro, abbiamo generato un protocollo che utilizza sistemi automatizzati disponibili in commercio per convalidare farmacologicamente il saggio PPI nelle larve di zebrafish. Coerentemente con i risultati pubblicati, siamo stati in grado di replicare i risultati di apomorfina, aloperidolo e ketamina sulla risposta PPI di 6 giorni dopo la fecondazione delle larve di zebrafish.
Introduzione
La larva del pesce zebra (Danio rerio) è un candidato adatto per modellare malattie psichiatriche come la schizofrenia (recensito da Gawel et al.1) a causa dei numerosi vantaggi che possiede. Questi includono un genoma completamente sequenziato con il 70% di omologia di sequenza con gli ortologhi umani2, l'esistenza di strumenti genetici diretti e inversi per manipolare il genoma e per identificare il contributo di un dato gene allo sviluppo o alla malattia3 e la presenza di importanti neurotrasmettitori umani/roditori nel cervello del pesce zebra4. C'è una disponibilità di diversi domini neuro-fenotipici nel pesce zebra, come l'ansia, l'apprendimento e la memoria3. La trasparenza ottica e la sensibilità alle principali classi di farmaci neurotropi lo rendono un candidato ideale per le manipolazioni farmacologiche e lo screening fenotipico dei farmaci 5,6.
Per eseguire lo screening dei farmaci ad alto rendimento, l'automazione e la presenza di un endofenotipo robusto sono molto importanti7. Ad esempio, sono state sviluppate una varietà di tecniche di registrazione automatica per misurare il comportamento larvale del pesce zebra come la tigmotassi, la risposta allo spavento, la risposta optocinetica, la risposta optomotoria, l'assuefazione, la cattura delle prede, il comportamento sonno/veglia, il comportamento locomotore e molti altri6. Mentre alcuni laboratori sviluppano sistemi personalizzati per misurazioni e analisi automatizzate di alcuni di questi comportamenti, sono disponibili in commercio sistemi di imaging e software 8,9,10,11. L'inibizione del preimpulso (PPI), una forma di gating sensomotorio in cui la risposta di spavento è ridotta quando uno stimolo debole non di sorpresa viene presentato brevemente prima dello stimolo di sorpresa, è stata utilizzata come endofenotipo per lo studio della schizofrenia in modelli animali (rivisto da12,13). Inoltre, la risposta acustica allo spavento (ASR) e il PPI hanno svolto un ruolo utile nello studio dell'udito e della funzione uditiva in modelli animali, tra cui il pesce zebra14,15. La larva di pesce zebra mostra un caratteristico C-start in risposta a uno stimolo sorprendente inaspettato che viene diminuito da uno stimolo più debole chiamato prepulse. Il C-start è stato a lungo descritto come un comportamento di fuga controllato da distinte popolazioni di cellule neurali ed è stato accuratamente caratterizzato nella larva di zebrafish 15,16,17.
Esiste un'abbondanza di sistemi e software automatizzati commerciali e standardizzati per l'esecuzione del test PPI nei roditori 18,19,20. Tuttavia, per quanto ne sappiamo, tutti i saggi PPI eseguiti nel pesce zebra fino ad ora sono stati eseguiti utilizzando sistemi personalizzati che sono disponibili solo per i singoli gruppi 15,16,21,22. Ciò presenta sfide per il raggiungimento della riproducibilità e della replicabilità dei dati per quanto riguarda la standardizzazione23.
Recentemente, un noto fornitore nella comunità del pesce zebra ha sviluppato un set-up incorporato con una fotocamera veloce e componenti aggiuntivi del generatore PPI per eseguire il test PPI nelle larve di pesce zebra24. La telecamera registra a 1000 fotogrammi al secondo, il che consente la registrazione di comportamenti ad azione rapida come l'avvio C, mentre il generatore PPI consente l'erogazione controllata dall'utente di vari stimoli acustici per evocare una risposta di sorpresa24. Qui, combiniamo il suddetto sistema con un pacchetto software completo disponibile in commercio progettato per l'analisi automatizzata di comportamenti complessi11, per generare un protocollo per l'esecuzione di saggi di risposta PPI nelle larve di pesce zebra. Convalidiamo farmacologicamente la risposta PPI utilizzando 1) apomorfina, un agonista della dopamina noto per causare deficit di PPI; 2) aloperidolo, un antagonista della dopamina e antipsicotico noto per aumentare il PPI e 3) ketamina, un antagonista del recettore NMDA noto per modulare il PPI.
Protocollo
Tutti gli esperimenti sugli animali sono stati approvati dal sistema di supervisione e applicazione dell'Autorità norvegese per la sicurezza alimentare (FOTS-18/106800-1).
1. Allevamento di pesce zebra
- Organizzare accoppiamenti di stock di pesci zebra adulti adulti di tipo selvatico (Danio rerio), mantenuti in condizioni standard25 la sera prima. Qui viene utilizzato il ceppo Tupfel a pinna lunga (TL).
- Rimuovete le barriere la mattina successiva e lasciate accoppiare attraverso la deposizione naturale delle uova.
- Raccogli le uova dalle vasche di accoppiamento.
- Rimuovere le uova non fecondate e altri detriti, quindi trasferire le uova in piastre di Petri (n = 60) e allevarle in un'incubatrice a 28 °C in terreno embrionale: 1,5 mM HEPES, pH 7,6, 17,4 mM NaCl, 0,21 mM KCl, 0,12 mM MgSO4 e 0,18 mM Ca(NO3)2.
- Rinnovare metà del terreno embrionale e rimuovere le larve morte ogni giorno fino a 6 dpf.
NOTA: Tutti gli esperimenti sono stati eseguiti su singole larve a 6 giorni dopo la fecondazione (dpf).
2. Agenti farmacologici e pretrattamento delle larve
- Sciogliere l'apomorfina e la ketamina nel terreno E3 per ottenere soluzioni stock rispettivamente da 500 μM e 10 mM.
- Sciogliere l'aloperidolo in dimetilsolfossido al 100% (DMSO) per ottenere una soluzione madre da 10 mM. La concentrazione finale di DMSO utilizzata è stata dello 0,1%.
- Usa lo 0,1% di DMSO ed E3 medio come controlli del veicolo.
- Utilizzare le seguenti concentrazioni finali di farmaci: 10 mg/mL di apomorfina, 1 mM di ketamina e 20 μM di aloperidolo16.
- Pre-esporre le larve dei gruppi di apomorfina e ketamina per 10 minuti e i gruppi di controllo del veicolo aloperidolo e DMSO per 20 minutie 16.
3. Configurazione prima del test di comportamento
- Il giorno dell'esperimento, trasferire le larve e tutti i materiali pertinenti nella sala esperimenti. Impostare la sala sperimentale a una temperatura di 27 ± 1 °C.
- Assicurarsi che il rumore di fondo nella camera di prova sia il più basso possibile, preferibilmente non superiore a un livello di pressione sonora (SPL) di 45 dB.
- Installare il microfono sonometro del misuratore di decibel (dB) nella camera di prova (l'apertura per l'installazione è già praticata dal produttore).
- Per ridurre il rumore di fondo nella stanza, isolare la camera di prova con una cabina audio costruita su misura (vedere la Figura 1B per una panoramica della configurazione).
- Preparare una piastra a 96 pozzetti per il test di inibizione pre-impulso.
NOTA: La videocamera ha una risoluzione di 2048 × 500 pixel, il che significa che è possibile riprendere solo un massimo di 3 corsie (33 pozzi) alla volta.- Utilizzare una lastra acrilica su misura in formato 96 pozzetti per ridurre l'interferenza delle ombre.
NOTA: Le misure per la targa personalizzata sono disponibili al seguente sito web: https://zenodo.org/record/3739378#.XooyLW5uKas
- Utilizzare una lastra acrilica su misura in formato 96 pozzetti per ridurre l'interferenza delle ombre.
- Con l'aiuto di una pipetta di trasferimento, trasferire 310 μl di soluzione/terreno di esposizione con una larva in ciascun pozzetto.
- Calibrare e misurare l'intensità dello stimolo utilizzando rispettivamente la manopola del volume dell'amplificatore stereo e un misuratore di decibel.
- Registrare l'intensità sonora massima nella sezione "riferimento livello".
4. Parametri di stimolo e acquisizione video
- Accendere il computer, il sistema di amplificazione e il misuratore dB (vedere la Figura 1A per una panoramica della configurazione).
- Utilizzare la manopola del volume ruotandola al minimo o al massimo per regolare l'intensità del suono.
- Controllare ogni volta il livello del suono con il misuratore dB, la manopola del volume viene regolata. Questo è importante per trovare l'intensità sonora massima e minima che può essere prodotta dall'allestimento.
NOTA: Il misuratore di dB calcola l'uscita dB RMS per lo stimolo. Il sistema genera il suono all'interno dei componenti solidi della camera di prova, mantenendo ferma la piastra e producendo una vibrazione sul piano orizzontale dell'intero supporto della piastra.- Regolare la manopola del volume al massimo, misurare l'intensità del suono con il dB meter e utilizzare questo valore.
- Controllare ogni volta il livello del suono con il misuratore dB, la manopola del volume viene regolata. Questo è importante per trovare l'intensità sonora massima e minima che può essere prodotta dall'allestimento.
- Sull'interfaccia del generatore PPI, definire i parametri: intervallo interstimolo rappresentato come Ritardo; intervallo tra le prove rappresentato come tempo delta di acquisizione; durata del preimpulso ecc.
- Per le prove di solo prepulsazione, assicurarsi che i parametri "Ampiezza" o Durata dello stimolo per Startle siano impostati su zero e viceversa per le prove di solo startle.
- Per generare un elenco di prova, selezionare Aggiungi > assegnare un nome alla versione di prova. Ad esempio, "Prepulse 50 dB da solo".
NOTA: È possibile generare tutte le versioni di prova desiderate, ma fare attenzione alla lunghezza dell'elenco poiché ciò può causare l'arresto anomalo del programma.- Interfoliare le prove di preimpulso con le prove di solo impulso in tutti gli esperimenti PPI utilizzando un ordine pseudocasuale. Quando in un esperimento vengono presentati più stimoli, viene utilizzato un intervallo tra le prove (ITI) di 30 s.
NOTA: In questo studio sono stati utilizzati uno stimolo di sorpresa (impulso) di 100 ms di 660 Hz e stimoli di preimpulso di 5 ms di 440 Hz. Per gli esperimenti PPI, l'intervallo interstimolo (ISI) era di 100 ms.
- Interfoliare le prove di preimpulso con le prove di solo impulso in tutti gli esperimenti PPI utilizzando un ordine pseudocasuale. Quando in un esperimento vengono presentati più stimoli, viene utilizzato un intervallo tra le prove (ITI) di 30 s.
- Per salvare il protocollo, selezionare File > Salva con nome.
- Regolare le condizioni di illuminazione nella camera di prova come segue.
- Avviare il calcolo di misurazione USB, selezionare l'uscita analogica , quindi andare su D/A OUT O (P13) per apportare modifiche all'illuminazione. Un valore pari a zero significa assenza di luce, mentre aumentando il valore D/A OUT O, aumenta l'intensità della luce nella scatola. Per tutti gli esperimenti è stata utilizzata un'intensità luminosa di 100.
- Configura la fotocamera
- Avvia il software e attendi il caricamento della fotocamera.
- Seleziona Regolazioni (che si trova sul lato destro) e imposta la frequenza dei fotogrammi di acquisizione su 1.000, quindi fai clic su Applica per effettuare la modifica.
- Acclimatare le larve in una camera di prova illuminata al 100% dalla luce per 5 minuti prima dell'inizio degli esperimenti.
- Per iniziare un esperimento, selezionare il menu Esperimento sul generatore PPI, fare clic su Esegui e selezionare il formato del pozzetto (ad esempio, 33 pozzetti).
- Assicurati sempre che il software della fotocamera sia avviato con le impostazioni corrette prima di eseguire un esperimento.
- Acquisisci un video di 2 secondi per ogni prova.
- Assicurati che la frequenza dei fotogrammi di acquisizione sia impostata su 1.000.
5. Tracciamento e analisi automatizzati della risposta acustica allo spavento e PPI
- Configurazione del protocollo.
- Avviare il software di analisi (vedere la Tabella dei materiali). Scegli Nuovo da modello > Applica un modello predefinito , quindi scorri altri menu (dettagli di seguito).
- Scegli tra i file video in Sorgente video.
- Sfoglia il file video. Imposta il soggetto come pesce > larve di pesce zebra > modello di zona (nessun modello). Specifica il numero di arene in Arene.
- Specificare il numero di soggetti per arena (impostato su 1) in Soggetti.
- Selezionare Rilevamento del punto centrale, del punto di punta e della base di coda in Funzioni tracciate (vedere la Figura 2A,B).
NOTA: Questo è importante per calcolare l'angolo del corpo della risposta C-start (vedere la Figura 2C). - Fai clic su Nome > salva con nome. Le unità utilizzate sono mm, s, gradi rispettivamente per la distanza, il tempo e la rotazione.
NOTA: Ricordarsi di utilizzare la stessa unità per calibrare la bilancia.
- Scegli l'impostazione Arena.
- Fai clic su Cattura immagine di sfondo.
- Segui i passaggi nel menu a destra (in caso di dubbio, usa il menu Aiuto ).
- Scegli lo strumento di disegno del cerchio per disegnare le arene.
- Scegliere Impostazioni di controllo della versione di prova > creare un nuovo nome >.
- Scegli Impostazioni di rilevamento, segui i passaggi nel menu a destra.
- Impostare la frequenza di campionamento su 25. Scegliere le impostazioni di rilevamento avanzate. In Metodo, seleziona la sottrazione dinamica, modello avanzato/pesce adulto, quindi imposta Colore soggetto rispetto allo sfondo su Più scuro e sposta il cursore per definire il contrasto della larva.
- In Contorno soggetto, selezionare prima l'erosione, quindi dilatare e aumentare i valori di erosione e dilatazione del contorno fino a quando l'animale non viene completamente rilevato.
- Salva il protocollo e utilizzalo per le successive analisi dei video PPI acquisiti.
- Avviare il software di analisi (vedere la Tabella dei materiali). Scegli Nuovo da modello > Applica un modello predefinito , quindi scorri altri menu (dettagli di seguito).
- Configurazione dell'elenco di prova.
- Scegli l'elenco di prova, definisci variabili indipendenti come l'ID larvale, il trattamento, il tipo di stimolo, ecc. Seleziona il percorso dei video e definisci un elenco di prove per l'acquisizione in batch.
- Configurazione dell'acquisizione.
NOTA: Se è stato generato un elenco di prova, è possibile eseguire un'acquisizione batch dei video.- Se alcune tracce vengono perse, utilizzare l'editor delle tracce per regolare le funzioni tracciate.
- Escludere dall'analisi gli errori di tracciamento che rimangono irrisolti dopo l'utilizzo dell'editor di tracce.
- Impostare il profilo di livellamento della traccia su 1 mm per ridurre il rumore dei dati. Questo può essere regolato in base all'attività di fondo delle larve.
- Configurazione dell'analisi.
- Per selezionare le prove da analizzare, scegliere Profili dati e definire le tracce in base alla variabile indipendente di interesse.
NOTA: Se i componenti sono nascosti, fare clic sul simbolo dell'occhio nell'angolo in alto a destra per visualizzarli.- Filtrare le parti degli studi da analizzare (ad esempio, in base al trattamento o al tipo di gruppo di stimolo).
- Selezionare parte delle tracce da analizzare (nesting). Per questo studio, i dati sono stati annidati per le tracce tra l'inizio dello stimolo e 100 ms dopo l'inizio dello stimolo.
- Ricordarsi di collegare tutti i filtri e le scatole di nidificazione con le linee delle frecce per completare le istruzioni.
- Definisci le variabili dipendenti da analizzare, seleziona i profili di analisi e specifica le variabili di interesse (focus su Corpo sotto variabili dipendenti).
NOTA: Se i componenti sono nascosti, fare clic sul simbolo dell'occhio nell'angolo in alto a destra per visualizzarli.- Fare doppio clic sull'angolo del corpo. Selezionare la piega assoluta. Vai attraverso le impostazioni di prova e seleziona il massimo, quindi fai clic su Aggiungi.
- Fare doppio clic sullo stato dell'angolo del corpo. Impostare l'intervallo di media su 5 campioni. Impostare la soglia dell'angolo di piegatura. Per calcolare le statistiche per bent, passa attraverso le statistiche di prova e seleziona la latenza per la prima > aggiungere. Ripetere i passaggi fino a ottenere soglie variabili (è stato utilizzato tra 20 e 80°) e assegnare un nome di conseguenza.
- Generazione di statistiche e grafici.
- Scegli l'analisi > i risultati > statistiche e grafici, quindi fai clic su Calcola.
- Assicurati che i profili di dati e analisi siano impostati sul modello corretto poiché è possibile creare diversi modelli in ogni sezione.
- Esporta le statistiche di prova e di gruppo come file di fogli di calcolo per l'elaborazione e l'analisi.
- Per selezionare le prove da analizzare, scegliere Profili dati e definire le tracce in base alla variabile indipendente di interesse.
6. Analisi dei dati
- Apri il foglio di calcolo contenente le statistiche della prova.
- Selezionare le colonne Angolo del corpo, Grado massimo, Latenza piegata (delle varie soglie dell'angolo del corpo).
- Considerare ogni cambiamento nell'angolo del corpo ≥ 30° entro una latenza di cut-off di 50 ms dopo l'inizio dello stimolo come una risposta C-start positiva (cioè un responder); Quelli con < angolo del corpo di 30° non rispondono.
- In modo binario, assegna 1 a una larva che risponde e 0 a larve che non rispondono per ogni piatto.
- Contare il numero totale di larve responder e non-responder per ogni piastra. Calcolare i responder (%) in ogni caso calcolati come (numero di larve che rispondono/numero totale di larve) × 100. Escludere dall'analisi le larve che rispondono meno del 30% allo stimolo di sorpresa16.
NOTA: Qualsiasi intensità di stimolo in grado di suscitare una risposta C-start pari o superiore al 70% delle larve è considerata uno stimolo di sorpresa adatto16.
- Contare il numero totale di larve responder e non-responder per ogni piastra. Calcolare i responder (%) in ogni caso calcolati come (numero di larve che rispondono/numero totale di larve) × 100. Escludere dall'analisi le larve che rispondono meno del 30% allo stimolo di sorpresa16.
- Calcolare %PPI come 100 × (percentuale che risponde allo stimolo di spavento - percentuale che risponde al preimpulso + sequenza di spavento)/ (percentuale che risponde allo stimolo di spavento)16.
7. Analisi statistica
- Presentare i dati come media ± deviazione standard, S.D. (vedere la Tabella dei materiali per il software statistico).
- Determinare gli effetti della variazione delle intensità del preimpulso sulla risposta larvale utilizzando l'ANOVA unidirezionale seguita da un test post-hoc di Tukey.
- Utilizzare l'ANOVA a due vie seguita dal test post-hoc di Holm-Sidak per determinare gli effetti del trattamento farmacologico sulla risposta % PPI con intensità pre-impulso variabili.
Risultati
Sono stati eseguiti tre esperimenti per convalidare il protocollo di combinazione di più sistemi per analizzare l'inibizione pre-impulso della risposta acustica allo spavento nel pesce zebra larvale. In primo luogo, è stata testata la capacità di fornire con precisione stimoli acustici e di catturare la risposta delle larve allo stimolo di spavento. Successivamente, è stata la convalida della capacità di attenuare la risposta di sorpresa quando viene presentato uno stimolo pre-pulsazione. Infine, è stata stabilita la capacità di rilevare la modulazione farmacologica dell'inibizione prepulsata della risposta di startle da parte dei farmaci apomorfina, aloperidolo e ketamina.
Risposta larvale del pesce zebra agli stimoli acustici di spavento
Lavori precedenti hanno dimostrato che le larve di pesce zebra mostrano un caratteristico C-start quando vengono presentate con uno stimolo acustico sorprendente16. È stata testata la capacità di incitare e catturare il comportamento delle larve agli stimoli di spavento. È stato osservato che le larve registrate mostravano la risposta C-start (Figura 2). Uno stimolo di 70 dB re (100 ms, 660 Hz, Figura supplementare 1A) è stato abbastanza forte da suscitare una risposta nel ≥70% delle larve (Figura 3A). Quando è stato presentato ripetutamente 30 volte a un intervallo tra le prove di 30 s, lo stimolo di 70 dB non ha provocato assuefazione larvale (N = 3 repliche; 16 larve/replica), come mostrato nella Figura 3B.
Il prepulse riduce la risposta di spavento delle larve di pesce zebra agli stimoli acustici
Una pletora di prove mostra che gli stimoli pre-impulso modulano la risposta larvale a uno stimolo di spavento 15,21,22,26. È stato utilizzato un paradigma a due impulsi, in cui uno stimolo debole chiamato preimpulso precedeva lo stimolo che induce lo spavento chiamato impulso. Gli stimoli pre-impulso utilizzati erano 20, 17 o 14 dB in meno rispetto allo stimolo a impulsi impostato a 70 dB re. Il preimpulso (5 ms, 440 Hz) è stato sempre presentato 100 ms prima dell'inizio dell'impulso (Figura supplementare 1B). Ogni stimolo pre-impulso testato ha ridotto significativamente la risposta larvale al polso. Nella Figura 4 la risposta larvale (in %) agli stimoli acustici di sorpresa è mostrata per 6 dpf TL in terreno E3, N = 6 (16 larve/gruppo). La percentuale di larve che hanno risposto allo stimolo di spavento (polso) è stata di 79,86 ± 9,772. Prevedibilmente, quando lo stimolo di spavento è stato preceduto da un preimpulso di 50, 53 o 56 dB, la risposta larvale è diminuita rispettivamente al 40,87% ± 11,30%, 39,58% ± 7,345% e 29,17% ± 9,350%. L'analisi Anova a una via ha rivelato una differenza statistica nell'effetto dello stimolo sulle larve (F (3, 48) = 57,23, P < 0,0001) con il test di confronto multiplo di Tukey che ha rivelato una significatività statistica tra i gruppi a un intervallo di confidenza del 95%.
Modulazione farmacologica dell'inibizione del preimpulso
Studi precedenti hanno dimostrato che i farmaci dopaminergici, apomorfina e aloperidolo, così come il farmaco glutammatergico, la ketamina, modulano significativamente l'inibizione del preimpulso nelle larve proprio come nei loro equivalenti mammiferi e roditori16. Sulla base di questi studi sono state selezionate le concentrazioni per la convalida del set-up. L'intervallo interstimolo (ISI) per tutti gli esperimenti farmacologici è stato di 100 ms.
Effetto dell'apomorfina sull'inibizione del preimpulso
Nella Figura 5, le larve pretrattate con 10 mg/mL di apomorfina per 10 minuti hanno mostrato una riduzione complessiva della % PPI rispetto alle larve di controllo E3 (ANOVA a due vie, non RM (fattori: trattamento e intensità pre-polso; trattamento: F (1, 34) = 16,21, p = 0,0003; intensità pre-polso: F (2, 34) = 8,674, P = 0,0009, questo ha mostrato un'interazione non significativa: F (2, 34) = 2,514, p = 0,0959). Per indagare le differenze in modo più dettagliato, il test post-hoc di Holm-Sidak ha rivelato differenze significative nella risposta allo spavento tra il controllo E3 e le larve trattate con apomorfina alle intensità pre-impulso 53 (p = 0,0126) e 56 (p = 0,0044) ma non a 50 dB (p = 0,5813).
Effetto dell'aloperidolo sull'inibizione del preimpulso
La Figura 6 mostra un aumento complessivo della %PPI nelle larve pretrattate per 20 minuti con aloperidolo 20 μM rispetto a quelle nel terreno E3 (ANOVA a due vie, non RM (fattori: trattamento e intensità pre-polso; trattamento: F (1, 32) = 20,75, p < 0,0001; intensità pre-impulso: F (2, 32) = 3,147, p = 0,0565, senza interazione significativa: F (2, 32) = 0,7455, p = 0,4826). Utilizzando il test post-hoc di Holm-Sidak, la presenza di significatività statistica è stata osservata solo alle intensità pre-impulso 53 (p = 0,00489 e 56 (p = 0,0348) ma non a 50 dB (p = 0,067).
Effetto della ketamina sull'inibizione del preimpulso
La Figura 7 mostra che a diverse intensità di stimolo pre-impulso, c'erano differenze nella risposta di trasalimento tra le larve di controllo E3 e quelle pretrattate per 10 minuti in ketamina 1,0 mM (ANOVA a due vie, non RM (fattori: trattamento e intensità pre-polso; trattamento: F (1, 35) = 25,46, p < 0,0001; intensità pre-impulso: F (2, 35) = 6,018, p = 0,0057, senza interazione significativa: F (2, 35) = 0,8450, p = 0,4381). Il test post-hoc di Holm-Sidak ha mostrato significatività solo a intensità pre-impulso di 50 (p = 0,0039) e 53 (p = 0,0027), ma non a 56 dB (p = 0,0802).
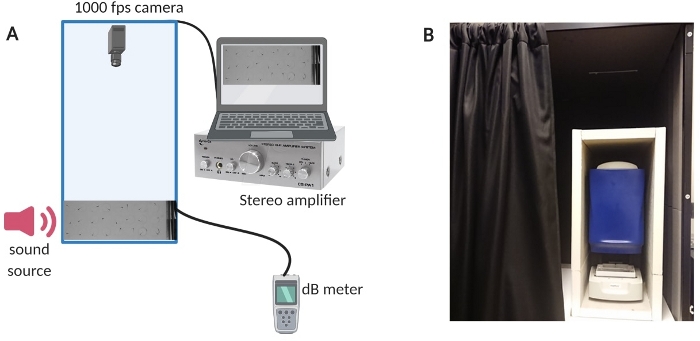
Figura 1: Apparecchiatura di prova. (A) Panoramica della configurazione dell'attrezzatura. (B) Isolamento interno dell'apparecchiatura di configurazione per ridurre al minimo il rumore di fondo durante gli esperimenti. Clicca qui per visualizzare una versione più grande di questa figura.
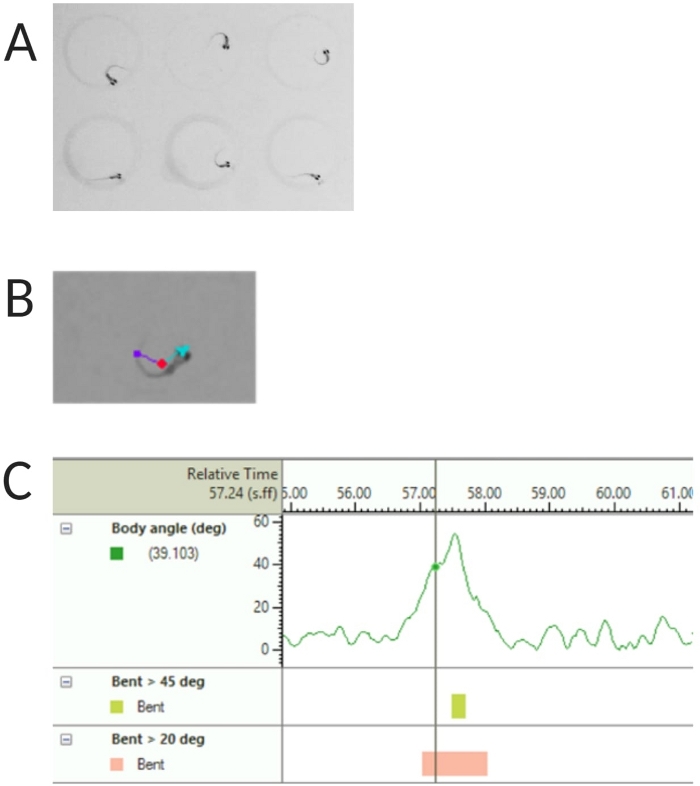
Figura 2: Analisi della risposta acustica allo spavento delle larve di pesce zebra. (A) Caratteristico C-start mostrato da 6 larve di pesce zebra a 6 dpf. (B) Immagine rappresentativa delle tre caratteristiche tracciate sovrapposte a una larva di 6 dpf: punto centrale (rosso), punto di naso (ciano) e base di coda (viola). (C) Immagine rappresentativa dell'angolo di curvatura assoluto mostrato da una larva di tipo selvatico TL da 6 dpf. Clicca qui per visualizzare una versione più grande di questa figura.
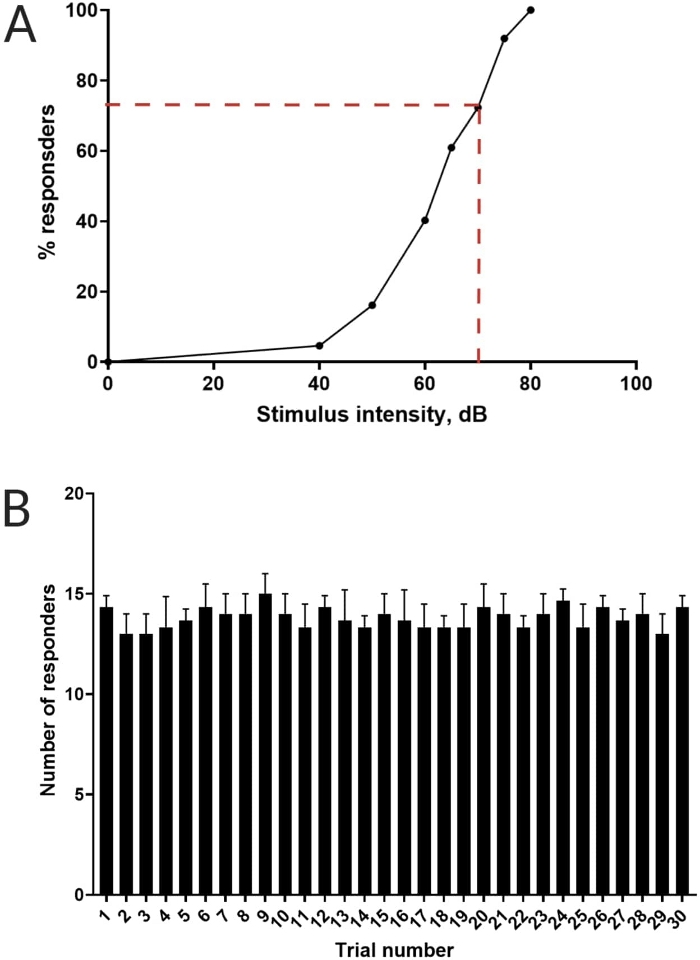
Figura 3: Determinazione della soglia di spavento acustico. (A) Un'intensità di stimolo di 70 dB (rappresentata da linee tratteggiate rosse) è in grado di suscitare una risposta C-start nel >70% delle larve (N = 33; 6 dpf TL). (B) Le larve non si abituano a 70 dB di stimolo re-diagnostico presentato 30 volte (prove) a un intervallo tra le prove di 30 s (N = 3 repliche; 16 larve/replica). I dati sono presentati come media ± S.D. Fare clic qui per visualizzare una versione più grande di questa figura.
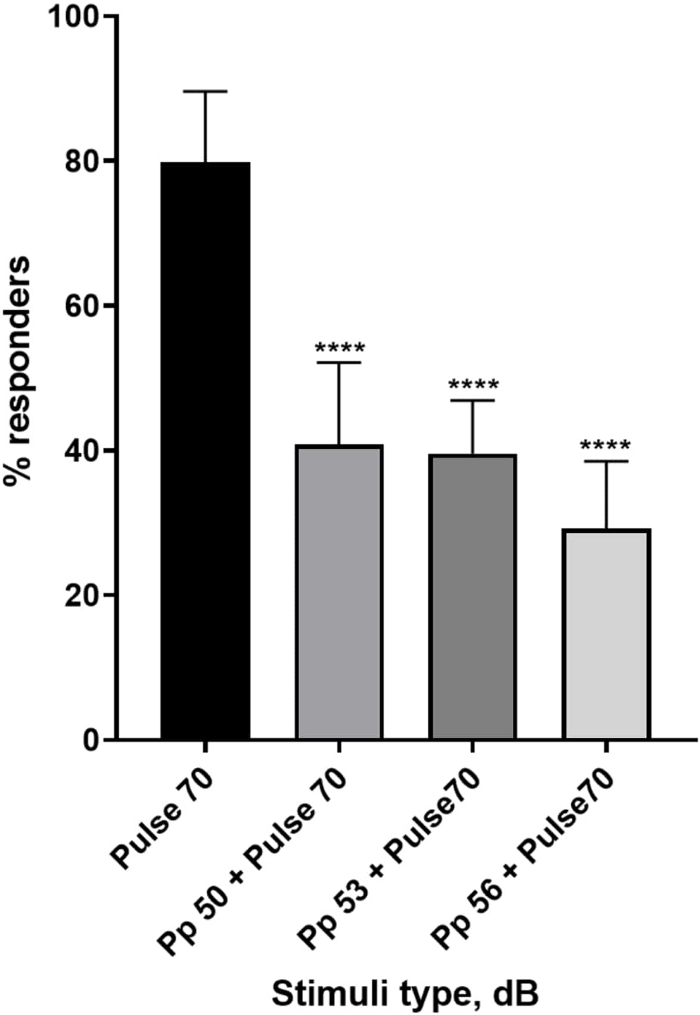
Figura 4: Diminuzione della risposta larvale pre-indotta dall'impulso (%). Gli stimoli pre-impulso a 20, 17 e 14 dB inferiori allo stimolo di 70 dB causano una riduzione del numero di larve di TL wild type C-start responder. Tutti i dati rappresentati come media ± S.D., N = 5 (16 larve/gruppo), ****p < 0,0001, significativamente diverso dallo stimolo di sorpresa del test post-hoc di Tukey dopo ANOVA a una via. Clicca qui per visualizzare una versione più grande di questa figura.
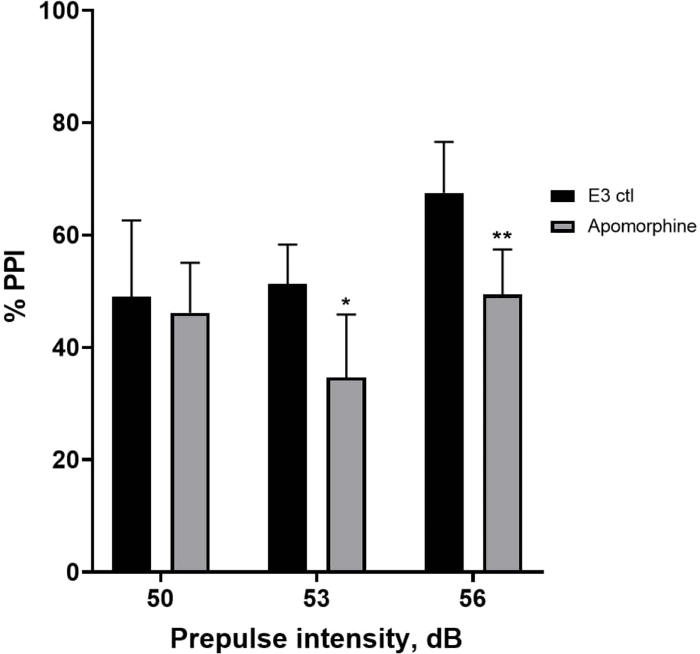
Figura 5: Deficit indotti dall'apomorfina in % PPI. Tutti i dati sono presentati come media ± S.D., N = 4\u20125 (16 larve/gruppo), differenza statisticamente significativa dal test post-hoc di Holm-Sidak dopo ANOVA a due vie. *p = 0,0126, gruppo trattato con E3 ctl/apomorfina a 53 dB; **p = 0,0044, gruppo trattato con E3 ctl/apomorfina a 56 dB. Clicca qui per visualizzare una versione più grande di questa figura.
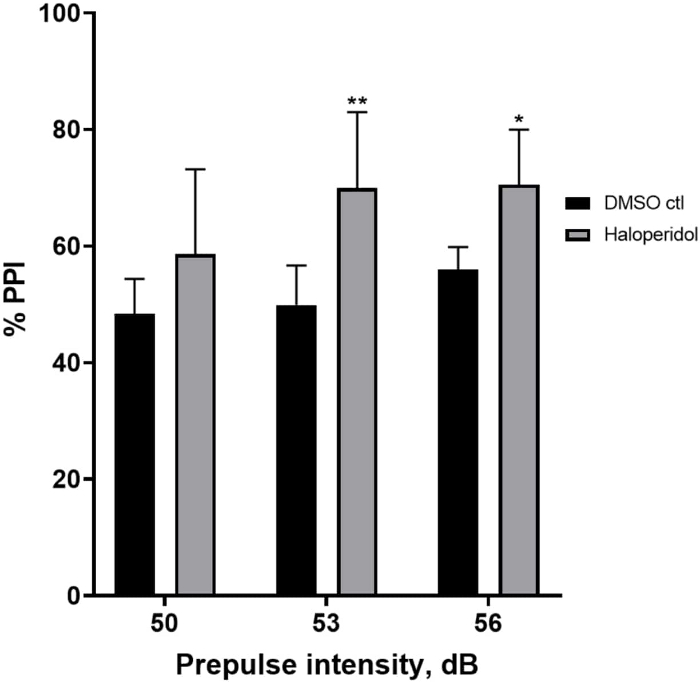
Figura 6: Potenziamento indotto dall'aloperidolo in %PPI. Tutti i dati sono presentati come media ± S.D., N = 4\u20125 (16 larve/gruppo), differenza statisticamente significativa dal test post-hoc di Holm-Sidak dopo Anova a due vie. **p = 0,0048, gruppo trattato con DMSO ctl/apomorfina a 53 dB; *p = 0,0348, gruppo trattato con DMSO ctl/apomorfina a 56 dB. Clicca qui per visualizzare una versione più grande di questa figura.
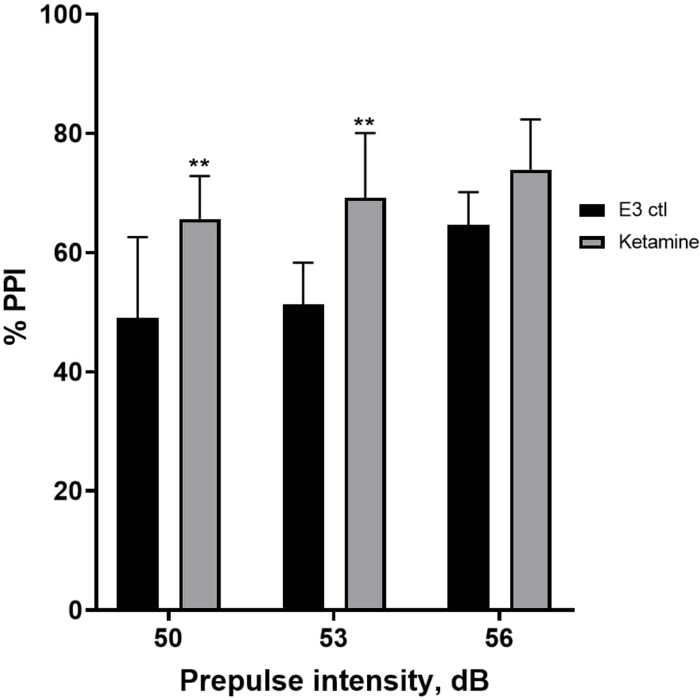
Figura 7: Aumento indotto dalla ketamina in %PPI. Tutti i dati rappresentati come media ± S.D, N = 4\u20125 (16 larve/gruppo), differenza statisticamente significativa dal test post-hoc di Holm-Sidak dopo Anova a due vie **p = 0,0039, gruppo trattato con E3 ctl/apomorfina a 50 dB, **p = 0,0027, gruppo trattato con E3 ctl/apomorfina a 53 dB. Clicca qui per visualizzare una versione più grande di questa figura.
Video supplementare 1: Video rappresentativo di larve che mostrano un C-start in risposta a uno stimolo acustico di spavento di 70 dB. Clicca qui per scaricare questo video.
Figura supplementare 1: Esempi rappresentativi di condizioni di stimolo generate utilizzando il generatore PPI. (A) prova di solo stimolo, (B) prova di inibizione pre-impulso (pre-impulso + impulso), (C) prova senza stimolo per misurare l'angolo di curvatura della linea di base di soglia di larve non stimolate. Clicca qui per scaricare questa figura.
Discussione
È essenziale convalidare qualsiasi nuovo sistema di test comportamentali con l'obiettivo di migliorare e perfezionare i protocolli per la ricerca neurocomportamentale. Nell'ambito dell'attuale indagine, è stata valutata la capacità di due sistemi e software disponibili in commercio di indurre una risposta acustica di sorpresa nelle larve di zebrafish e di rilevare e quantificare la modulazione farmacologica precedentemente descritta di tali comportamenti.
Sono state eseguite una serie di modifiche e risoluzione dei problemi per ottimizzare la configurazione. Il software predefinito per l'analisi delle risposte C-start era tale che l'analisi procedeva automaticamente dopo l'acquisizione dei dati per ogni esperimento (22 prove/piastra costituivano un esperimento). Ciò ha ridotto il numero di lastre che potevano essere utilizzate al giorno, riducendo così la produttività (5 lastre al giorno). Per evitare questa limitazione, è stato necessario disaccoppiare il software di analisi dal processo di raccolta dei dati, aumentando così la produttività a una media di 10 piastre al giorno. Pertanto, la decisione di rivolgersi a un software di analisi indipendente per l'analisi non in tempo reale si è rivelata vincente e più efficiente. Per evitare interferenze da ombre o altri detriti che introducono rumore nei dati, si consiglia di riempire completamente i pozzetti con il terreno, rimuovere tutte le bolle ed evitare particelle di cibo o simili che possono essere scambiate per larve, generando così rumore nei dati. Dopo la calibrazione degli stimoli sonori, l'intensità massima raggiungibile dal sistema amplificatore catturata dal dB meter era di 85 dB re, mentre il rumore di fondo iniziale nella camera di prova era di 60 dB re. Ciò ha comportato una finestra di dB ristretta in cui operare. Pertanto, era fondamentale mantenere il rumore di fondo il più minimo possibile. Per raggiungere questo obiettivo, è stato utilizzato il materiale parafon acoustics (vedi Tabella dei materiali) per costruire uno strato aggiuntivo di isolamento attorno alla camera di prova e uno strato extra di isolamento utilizzando un fascio di cabine vocali (vedi Tabella dei materiali). Con questi strati di isolamento, il rumore di fondo all'interno della camera di prova è stato ridotto con successo dai 60 dB iniziali a 45 dB re.
Attualmente, un vantaggio di questa configurazione è che tutti i componenti sono disponibili in commercio e, come tali, non limitati a pochi laboratori. Le persone con una conoscenza limitata del linguaggio di programmazione possono utilizzarlo, poiché il protocollo è piuttosto facile da capire e seguire. Ad esempio, utilizzando il sistema PPI, è stato possibile erogare impulsi e pre-impulsi a intervalli variabili tra stimoli e tra le prove, nonché catturare le risposte larvali a tali stimoli. Una volta che questi comportamenti sono stati acquisiti, è stato possibile classificarli utilizzando il software di analisi in risponditori e non risponditori. Il gruppo di risposta è stato classificato come larve che mostravano un C-start di 30° o più a una latenza di <50 ms. Inoltre, la risposta PPI è modulata da farmaci che hanno come bersaglio la segnalazione dopaminergica e glutammatergica (esaminata da Geyer e colleghi27). Coerentemente con studi precedenti, l'apomorfina, un agonista non selettivo del recettore della dopamina, ha ridotto l'inibizione pre-impulso della risposta di spavento nelle larve di zebrafish, mentre l'aloperidolo, un antagonista della dopamina, ha migliorato la risposta. Nelle larve di zebrafish, è stato dimostrato che la ketamina modula il PPI in modo differenziale in base alla durata dell'ISI16. Nello studio sopra citato, il PPI larvale è stato potenziato a 30 ms ma soppresso a 500 ms ISI quando pre-trattato con ketamina. Sebbene questo studio non abbia utilizzato l'ISI variabile, l'osservazione che la ketamina ha aumentato il PPI a un ISI di 100 ms, lo rende confrontabile con i dati dello studio precedente quando è stato utilizzato un ISI di 30 ms. Lo studio ha dimostrato che, combinando questi sistemi disponibili in commercio, è possibile eseguire il test PPI e rilevare in modo affidabile i cambiamenti farmacologicamente indotti nella risposta PPI larvale del pesce zebra. Una limitazione del sistema è che la caratteristica del punto del naso tracciata dal software di analisi cade sempre su uno degli occhi delle larve, creando così un angolo di base. Per ovviare a ciò, è necessario determinare sempre l'angolo di curvatura della linea di base delle larve non stimolate, che è risultato essere di ~30° per le larve utilizzate in questo studio. Quindi, formando la base per la scelta di 30° come soglia di quella che è stata considerata una risposta positiva di C-start nelle larve spaventate. Se si tiene conto di questi punti, dovrebbe essere possibile eseguire il test PPI in qualsiasi laboratorio con accesso all'attrezzatura di configurazione. Questo articolo non si è concentrato sulla categorizzazione della cinematica della risposta di sorpresa in latenza breve e latenza lunga come riportato in precedenza16, a causa della portata della variabilità della latenza. Pertanto, sono state utilizzate solo le risposte C-start <50 ms dopo l'insorgenza dello stimolo15.
È stato riportato che le differenze di ceppo influenzano il comportamento del pesce zebra in diversi saggi 28,29,30,31 e influenzano la sensibilità uditiva32. Pertanto, è essenziale determinare l'angolo di curvatura di base di ciascuna deformazione testata. Poiché anche le sensibilità uditive possono essere diverse, è fondamentale determinare le risposte di spavento di base, l'intensità del suono più adatta come stimolo di preimpulso o di spavento per ogni sforzo e la durata in cui lo stimolo viene presentato. L'ISI è un altro parametro che dovrebbe essere considerato attentamente perché alcuni farmaci possono aumentare o ridurre il PPI in base all'intervallo tra il preimpulso e l'insorgenza dello stimolo di sorpresa16. L'aspettativa è che i laboratori interessati allo studio della funzione cognitiva, dei disturbi neuropsichiatrici e dell'udito (funzione uditiva) trovino questo set-up e protocollo PPI utile nello screening dei loro modelli farmacologici e/o genetici. Questo protocollo fornisce anche una base per lo screening ad alto rendimento di librerie di composti.
Divulgazioni
Gli autori dichiarano di non avere interessi finanziari concorrenti.
Riconoscimenti
Ringraziamo Ana Tavara e João Paulo R. P. Santana per l'eccellente cura dei pesci e l'inestimabile aiuto con i test e l'allestimento delle cabine insonorizzate, e il Dr. Wietske van der Ent per il supporto iniziale nella configurazione del software EthoVision. Questo studio è stato finanziato dal Research Council of Norway (ISP, BIOTEK2021/ DigiBrain).
Materiali
| Name | Company | Catalog Number | Comments |
| Apomorphine | Sigma Aldrich | A4393 | Dopamine agonist |
| dB meter | PCE instruments | PCE-MSM 4 | For measuring stimulus intensity |
| DMSO | Sigma Aldrich | D8418 | For dissolving organic solutes |
| Dynavox Amplifier | Dynavox | CS-PA1 MK | For delivering acoustic stimuli |
| EthoVision XT | Noldus, Netherlands | EthoVision XT, version 14 | Automated tracking software |
| GraphPad Prism | GraphPad Software | Version 8 | Statistical analysis software |
| Haloperidol | Sigma Aldrich | H1512 | Dopamine antagonist |
| Ketamine | Sigma Aldrich | Y0000450 | NMDA receptor antagonist |
| parofon acoustics materials | Paroc | 8528308 | Helps reduce background noise in the test cabinet |
| t.akustik Vocal Booth Bundle | Thormann, Germany | 458543 | Helps reduce background noise in the test cabinet |
| ZebraBox Revo with PPI add-ons | ViewPoint, France | ZebraBox Revo with PPI add-ons | Includes hardware and software |
Riferimenti
- Gawel, K., Banono, N. S., Michalak, A., Esguerra, C. V. A critical review of zebrafish schizophrenia models: Time for validation. Neuroscience & Biobehavioral Reviews. 107, 6-22 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Kalueff, A. V., Stewart, A. M., Gerlai, R. Zebrafish as an emerging model for studying complex brain disorders. Trends in Pharmacological Sciences. 35 (2), 63-75 (2014).
- Panula, P., et al. The comparative neuroanatomy and neurochemistry of zebrafish CNS systems of relevance to human neuropsychiatric diseases. Neurobiology of Disease. 40 (1), 46-57 (2010).
- Kokel, D., Peterson, R. T. Chemobehavioural phenomics and behaviour-based psychiatric drug discovery in the zebrafish. Briefings in Functional Genomics and Proteomics. 7 (6), 483-490 (2008).
- Basnet, R. M., Zizioli, D., Taweedet, S., Finazzi, D., Memo, M. Zebrafish Larvae as a Behavioral Model in Neuropharmacology. Biomedicines. 7 (1), 23(2019).
- Henry, J., Wlodkowic, D. Towards High-Throughput Chemobehavioural Phenomics in Neuropsychiatric Drug Discovery. Marine Drugs. 17 (6), (2019).
- Behavioural measurement system | Laval zebrafish | Drosophila | Daphnia | insects | Products | Zantiks. , Available from: https://zantiks.com/products/zantiks-mwp (2020).
- Product List - ViewPoint. , Available from: http://www.viewpoint.fr/en/products (2020).
- Observation chamber for zebrafish research - DanioVision. , Available from: https://www.noldus.com/daniovision/observation-chamber (2020).
- EthoVision XT - Video tracking software | Noldus. , Available from: https://www.noldus.com/ethovision-xt (2020).
- Gould, T. D., Gottesman, I. I. Psychiatric endophenotypes and the development of valid animal models. Genes, Brain and Behavior. 5 (2), 113-119 (2006).
- van den Buuse, M. Modeling the Positive Symptoms of Schizophrenia in Genetically Modified Mice: Pharmacology and Methodology Aspects. Schizophrenia Bulletin. 36 (2), 246-270 (2010).
- Acoustic startle modification as a tool for evaluating auditory function of the mouse: Progress, pitfalls, and potential. Abstract - Europe PMC. , Available from: https://europepnc.org/article/PMC/5446932 (2020).
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. Journal of Experimental Biology. 216 (18), 3504-3513 (2013).
- Burgess, H. A., Granato, M. Sensorimotor Gating in Larval Zebrafish. Journal of Neuroscience. 27 (18), 4984-4994 (2007).
- Eaton, R. C., Farley, R. D., Kimmel, C. B., Schabtach, E. Functional development in the mauthner cell system of embryos and larvae of the zebra fish. Journal of Neurobiology. 8 (2), 151-172 (1977).
- SR-LAB - San Diego Instruments Startle Response. San Diego Instruments. , Available from: https://sandiegoinstruments.com/product/sr-lab-startle-response/ (2020).
- Startle packages - Med Associates Inc. Med Associates Inc. , Available from: https://www.med-associates.com/product-category/acoustic-startle-reflex-packages/ (2020).
- Startle response & Pre-pulse inhibition test. O'HARA & CO.,LTD. , Available from: https://ohara-time.co.jp/products/startle-response-pre-pulse-inhibition-test/ (2020).
- Thyme, S. B., et al. Phenotypic Landscape of Schizophrenia-Associated Genes Defines Candidates and Their Shared Functions. Cell. 177 (2), 478-491 (2019).
- Privat, M., et al. Sensorimotor Transformations in the Zebrafish Auditory System. Current Biology. 29 (23), 4010-4023 (2019).
- Gerlai, R. Reproducibility and replicability in zebrafish behavioral neuroscience research. Pharmacology Biochemistry and Behavior. 178, 30-38 (2019).
- Add-on - Fast camera 1000 FPS - ViewPoint. , Available from: http://www.viewpoint.fr/app.php/en/p/equipment/add-on-fast-camera (2020).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. , (2019).
- Bhandiwad, A. A., Sisneros, J. A. Revisiting Psychoacoustic Methods for the Assessment of Fish Hearing. Fish Hearing and Bioacoustics: An Anthology in Honor of Arthur N. Popper and Richard R. Fay. , 157-184 (2016).
- Geyer, M. A., Krebs-Thomson, K., Braff, D. L., Swerdlow, N. R. Pharmacological studies of prepulse inhibition models of sensorimotor gating deficits in schizophrenia: a decade in review. Psychopharmacology. 156 (2-3), 117-154 (2001).
- Lange, M., et al. Inter-Individual and Inter-Strain Variations in Zebrafish Locomotor Ontogeny. PLOS ONE. 8 (8), 70172(2013).
- Liu, X., et al. Strain-dependent differential behavioral responses of zebrafish larvae to acute MK-801 treatment. Pharmacology Biochemistry and Behavior. 127, 82-89 (2014).
- Loucks, E., Carvan, M. J. Strain-dependent effects of developmental ethanol exposure in zebrafish. Neurotoxicology and Teratology. 26 (6), 745-755 (2004).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLOS ONE. 12 (4), 0175420(2017).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hearing research. 341, 220-231 (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon