Method Article
Фармакологическая валидация преимпульсного ингибирования реакции испуга у личинок данио-рерио с использованием коммерческой автоматизированной системы и программного обеспечения
В этой статье
Резюме
В данной статье мы опишем протокол, в котором используются коммерчески доступные автоматизированные системы для фармакологической валидации анализа преимпульсного ингибирования (ИПП) у личинок рыбок данио.
Аннотация
Несмотря на то, что существует множество коммерческих и стандартизированных автоматизированных систем и программного обеспечения для проведения анализа предимпульсного ингибирования (ИПП) у грызунов, насколько нам известно, все анализы ИПП, выполненные у рыбок данио, до сих пор проводились с использованием специально разработанных систем, которые были доступны только отдельным группам. Таким образом, возникают проблемы, особенно в отношении вопросов воспроизводимости и стандартизации данных. В настоящей работе мы создали протокол, в котором используются коммерчески доступные автоматизированные системы для фармакологической валидации анализа ИПП у личинок рыбок данио. В соответствии с опубликованными результатами, мы смогли воспроизвести результаты применения апоморфина, галоперидола и кетамина в отношении реакции на ИПП личинок данио-рерио через 6 дней после оплодотворения.
Введение
Личинка данио-рерио (Danio rerio) является подходящим кандидатом для моделирования психических заболеваний, таких как шизофрения (рассмотрено Gawel et al.1), из-за многочисленных преимуществ, которыми она обладает. К ним относятся полностью секвенированный геном с гомологией 70% последовательности с человеческими ортологами2, существование прямых и обратных генетических инструментов для манипулирования геномом и определения вклада данного гена в развитие или заболевание3, а также наличие основных нейротрансмиттеров человека/грызуна в мозге рыбок данио. У рыбок данио существует несколько нейрофенотипических доменов, таких как тревожность, обучениеи память. Оптическая прозрачность и чувствительность к основным классам нейротропных препаратов делает его идеальным кандидатом для фармакологических манипуляций и фенотипического скрининга лекарственных препаратов 5,6.
Для проведения высокопроизводительного скрининга лекарственных средств очень важны автоматизация и наличие надежного эндофенотипа7. Например, для измерения поведения личинок данио-рерио были разработаны различные методы автоматической записи, такие как тигмотаксис, реакция испуга, оптокинетическая реакция, оптомоторная реакция, привыкание, захват добычи, поведение во время сна/бодрствования, локомоторное поведение инекоторые другие. В то время как некоторые лаборатории разрабатывают специализированные системы для автоматизированных измерений и анализа некоторых из этих поведений, существуют коммерчески доступные системы визуализации и программного обеспечения 8,9,10,11. Преимпульсное торможение (ИПП), форма сенсомоторного гейтирования, при которой реакция испуга снижается, когда слабый непугающий стимул предъявляется кратковременно перед испугающим стимулом, была использована в качестве эндофенотипа для изучения шизофрении на животных моделях (обзор12,13). Кроме того, акустическая реакция на испуг (ASR) и ИПП сыграли полезную роль в изучении слуха и слуховых функций у животных моделей, включая рыбок данио. Личинки данио-рерио демонстрируют характерный С-старт в ответ на неожиданный поразительный стимул, который ослабляется более слабым стимулом, называемым предимпульсом. С-старт долгое время описывался как поведение бегства, контролируемое различными популяциями нервных клеток, и был тщательно описан у личинок данио-рерио 15,16,17.
Существует обилие коммерческих и стандартизированных автоматизированных систем и программного обеспечения для проведения анализа ИПП у грызунов 18,19,20. Однако, насколько нам известно, все анализы ИПП, проведенные у рыбок данио-рерио до сих пор, проводились с использованием специально разработанных систем, которые доступны только для отдельных групп 15,16,21,22. Это создает проблемы для достижения воспроизводимости и воспроизводимости данных в отношении стандартизации23.
Недавно известный поставщик в сообществе рыбок данио разработал установку со встроенной быстрой камерой и дополнительными генераторами PPI для проведения анализа PPI у личинокданио-рерио 24. Камера записывает со скоростью 1000 кадров в секунду, что позволяет записывать быстро реагирующие действия, такие как C-start, в то время как генератор PPI позволяет управлять пользователем подачей различных акустических стимулов, вызывающих реакцию испуга. В данном случае мы объединяем вышеупомянутую систему с коммерчески доступным комплексным программным пакетом, предназначенным для автоматизированного анализа сложных поведенческих свойств11, для создания протокола для проведения анализов реакции на ИПП у личинок рыбок данио. Мы фармакологически валидируем ответ на ИПП с использованием: 1) апоморфина, агониста дофамина, который, как известно, вызывает дефицит ИПП; 2) галоперидол, антагонист дофамина и антипсихотик, который, как известно, усиливает ИПП, и 3) кетамин, антагонист NMDA-рецепторов, который, как известно, модулирует ИПП.
протокол
Все эксперименты на животных были одобрены системой надзора и применения Норвежского управления по безопасности пищевых продуктов (FOTS-18/106800-1).
1. Разведение рыбок данио рерио
- Установление спаривания взрослых самцов и самок данио-рерио дикого типа (Danio rerio), содержащихся в стандартных условиях25 накануне вечером. Здесь используется штамм Тупфеля с длинными плавниками (TL).
- На следующее утро уберите барьеры и дайте возможность спариваться во время естественного нереста.
- Соберите яйца из брачных емкостей.
- Неоплодотворенные яйца и другой мусор удаляют, затем переносят яйца в чашки Петри (n = 60) и выращивают в инкубаторе при температуре 28 °C в эмбриональной среде: 1,5 мМ HEPES, pH 7,6, 17,4 мМ NaCl, 0,21 мМ KCl, 0,12 мМ MgSO4 и 0,18 мМ Ca(NO3)2.
- Обновляйте половину зародышевой среды и удаляйте мертвых личинок ежедневно до 6 дпф.
ПРИМЕЧАНИЕ: Все эксперименты проводились на отдельных личинках через 6 дней после оплодотворения (dpf).
2. Фармакологические средства и предварительная обработка личинок
- Растворите апоморфин и кетамин в среде Е3 с получением 500 мкМ и 10 мМ исходных растворов соответственно.
- Растворите галоперидол в 100% диметилсульфоксиде (ДМСО) до получения 10 мМ исходного раствора. Конечная концентрация используемого ДМСО составила 0,1%.
- Используйте 0,1% ДМСО и среду E3 в качестве органов управления транспортным средством.
- Используют следующие конечные концентрации лекарственных средств: 10 мг/мл апоморфина, 1 мМ кетамина и 20 мкМ галоперидола16.
- Предварительно подвергнуть воздействию личинок группы апоморфина и кетамина на 10 мин, а контрольные группы галоперидола и ДМСО - на 20 мин16.
3. Настройка перед тестом поведения
- В день эксперимента перенесите личинок и все необходимые материалы в комнату для эксперимента. Установите в комнате для экспериментов температуру 27 ± 1 °C.
- Убедитесь, что фоновый шум в испытательной камере как можно ниже, желательно не более 45 дБ уровня звукового давления (SPL).
- Установите микрофон сонометра измерителя децибел (дБ) в испытательную камеру (отверстие для установки уже расточено производителем).
- Чтобы уменьшить фоновый шум в помещении, изолируйте испытательную камеру с помощью специально изготовленной звуковой кабины (см. Рисунок 1B для обзора конфигурации).
- Подготовьте 96-луночный планшет для теста на преимпульсное торможение.
ПРИМЕЧАНИЕ: Видеокамера имеет разрешение 2048 × 500 пикселей, что означает, что одновременно можно получить изображение не более чем 3 полосы движения (33 лунки).- Используйте изготовленную на заказ акриловую пластину формата 96 лунок, чтобы уменьшить помехи от теней.
ПРИМЕЧАНИЕ: Размеры для специальной пластины можно найти на следующем веб-сайте: https://zenodo.org/record/3739378#.XooyLW5uKas
- Используйте изготовленную на заказ акриловую пластину формата 96 лунок, чтобы уменьшить помехи от теней.
- С помощью передаточной пипетки перенесите 310 мкл раствора/среды воздействия с одной личинкой в каждую лунку.
- Откалибруйте и измерьте интенсивность стимула с помощью ручки громкости стереоусилителя и децибелметра соответственно.
- Зарегистрируйте максимальную интенсивность звука в разделе «Эталонный уровень».
4. Параметры стимула и захват видео
- Включите компьютер, усилительную систему и измеритель дБ (обзор настройки см. на рисунке 1A ).
- Используйте ручку громкости, повернув ее на минимум или максимум, чтобы отрегулировать интенсивность звука.
- Проверяйте уровень звука с помощью измерителя дБ каждый раз, ручка громкости регулируется. Это важно для определения максимальной и минимальной интенсивности звука, которая может быть получена с помощью установки.
ПРИМЕЧАНИЕ: Измеритель дБ вычисляет среднеквадратичное значение выходного сигнала дБ для стимула. Система генерирует звук внутри твердых компонентов испытательной камеры, сохраняя устойчивость пластины и создавая вибрацию в горизонтальной плоскости всей опоры пластины.- Отрегулируйте ручку громкости на максимум, измерьте интенсивность звука с помощью измерителя дБ и используйте это значение.
- Проверяйте уровень звука с помощью измерителя дБ каждый раз, ручка громкости регулируется. Это важно для определения максимальной и минимальной интенсивности звука, которая может быть получена с помощью установки.
- В интерфейсе генератора PPI определите параметры: интервал между стимулами, представленный в виде Delay; межсудебный интервал в виде дельта-времени Acquisition; длительность предварительного импульса и т.д.
- Для испытаний только с предварительным импульсом убедитесь, что значение параметра «Амплитуда» или «Длительность стимула » для параметров испуга равно нулю, и наоборот для испытаний только с испугом.
- Чтобы создать список пробных версий, нажмите кнопку Добавить > присвойте пробной версии имя. Например, "Prepulse 50 dB alone".
ПРИМЕЧАНИЕ: Можно создать столько пробных версий, сколько нужно, но будьте осторожны с длиной списка, так как это может привести к сбою программы.- Чередуйте предимпульсные испытания с испытаниями только пульса во всех экспериментах с ИПП с использованием псевдослучайного порядка. Если в эксперименте представлено несколько стимулов, используется межпробный интервал (ITI) в 30 с.
ПРИМЕЧАНИЕ: В данном исследовании использовался 100 мс стимул испуга (импульс) с частотой 660 Гц и предимпульсный стимул 5 мс с частотой 440 Гц. Для экспериментов с ИПП интервал между стимулами (ISI) составлял 100 мс.
- Чередуйте предимпульсные испытания с испытаниями только пульса во всех экспериментах с ИПП с использованием псевдослучайного порядка. Если в эксперименте представлено несколько стимулов, используется межпробный интервал (ITI) в 30 с.
- Чтобы сохранить протокол, выберите Файл > Сохранить как.
- Отрегулируйте условия освещения в испытательной камере следующим образом.
- Запустите расчет измерений через USB, выберите аналоговый выход , затем перейдите в раздел D/A OUT O (P13), чтобы внести изменения в освещение. Нулевое значение означает отсутствие света, при этом увеличивая значение D/A OUT O, увеличивается интенсивность света в коробке. Для всех экспериментов использовалась интенсивность света 100.
- Настройка камеры
- Запустите программное обеспечение и дождитесь загрузки камеры.
- Выберите «Корректировки» (находится справа) и установите частоту кадров захвата на 1 000, затем нажмите «Применить», чтобы внести изменения.
- Акклиматизируйте личинок к 100% освещенной светом тестовой камере за 5 мин до начала экспериментов.
- Чтобы начать эксперимент, выберите меню Эксперимент в генераторе PPI, нажмите Запустить и выберите формат скважины (например, 33 скважины).
- Перед началом эксперимента всегда убедитесь, что программное обеспечение камеры запущено с правильными настройками.
- Приобретайте видео продолжительностью 2 секунды для каждой пробной версии.
- Убедитесь, что частота кадров при захвате установлена на уровне 1 000.
5. Автоматизированное отслеживание и анализ акустической реакции на испуг и PPI
- Настройка протокола.
- Запустите программное обеспечение для анализа (см. Таблицу материалов). Выберите « Создать из шаблона » > «Применить готовый шаблон», а затем перейдите в другие меню (подробности ниже).
- Выберите «Из видеофайла » в разделе «Источник видео».
- Просмотрите видеофайл. Задайте тему как рыбу > личинки данио-рерио > шаблоне зоны (без шаблона). Укажите Количество арен в разделе Арены.
- Укажите Количество объектов на арене (установите значение 1) в разделе Темы.
- Выберите Обнаружение центральной точки, носовой точки и хвостового основания в разделе Отслеживаемые объекты (см. рис. 2A, B).
ПРИМЕЧАНИЕ: Это важно для расчета угла наклона тела для отклика C-start (см. Рисунок 2C). - Нажмите Имя > сохранить как. Используемые единицы измерения: мм, с, градус для расстояния, времени и вращения соответственно.
ПРИМЕЧАНИЕ: Не забывайте использовать одно и то же устройство для калибровки весов.
- Выберите «Настройка арены».
- Нажмите Захватить фоновое изображение.
- Выполните шаги в меню справа (если сомневаетесь, воспользуйтесь меню «Помощь »).
- Выберите инструмент рисования круга, чтобы нарисовать арены.
- Выберите Настройки пробного контроля > создать новое имя >.
- Выберите «Настройки обнаружения», выполните шаги в меню справа.
- Установите частоту дискретизации на 25. Выберите расширенные настройки обнаружения. В разделе «Метод» выберите «Динамическое вычитание», «Продвинутая модель/взрослая рыба», затем установите «Цвет объекта по сравнению с фоном» значение «Темнее» и переместите ползунок, чтобы определить контраст личинки.
- В разделе Контур объекта выберите сначала эрозию, затем расширяйте и увеличивайте значения эрозии и расширения контура до тех пор, пока животное не будет полностью обнаружено.
- Сохраните протокол и используйте его для последующего анализа полученных видео PPI.
- Запустите программное обеспечение для анализа (см. Таблицу материалов). Выберите « Создать из шаблона » > «Применить готовый шаблон», а затем перейдите в другие меню (подробности ниже).
- Настройка пробного списка.
- Выберите список испытаний, определите независимые переменные, такие как ID личинки, лечение, тип стимула и т.д. Выберите путь к видео и определите список пробных версий для пакетного приобретения.
- Настройка комплектации данных.
ПРИМЕЧАНИЕ: Если был сгенерирован пробный список, можно выполнить пакетный сбор видео.- Если некоторые треки потеряны, используйте редактор треков для настройки отслеживаемых объектов.
- Исключите из анализа ошибки трекинга, которые остались нерешенными после использования редактора треков.
- Установите профиль сглаживания дорожки на 1 мм, чтобы уменьшить шум от данных. Это можно скорректировать, исходя из фоновой активности личинок.
- Настройка анализа.
- Чтобы выбрать испытания для анализа, выберите «Профили данных » и определите треки на основе независимой переменной, представляющей интерес.
ПРИМЕЧАНИЕ: Если компоненты скрыты, нажмите на символ глаза в правом верхнем углу для отображения.- Фильтруйте части анализируемых испытаний (например, на основе лечения или типа группы стимулов).
- Выбор части трасс для анализа (вложенность). Для этого исследования были вложены данные об отслеживании между началом стимула и 100 мс после его появления.
- Не забудьте соединить все фильтры и гнездовые ящики линиями со стрелками, чтобы выполнить инструкцию.
- Определите зависимые переменные для анализа, выберите «Профили анализа» и укажите интересующие переменные (в разделе «Зависимые переменные» обратите внимание на «Тело»).
ПРИМЕЧАНИЕ: Если компоненты скрыты, нажмите на символ глаза в правом верхнем углу для отображения.- Дважды щелкните Угол корпуса. Выберите абсолютный изгиб. Перейдите в настройки пробной версии и выберите максимум, затем нажмите « Добавить».
- Двойной щелчок по состоянию угла корпуса. Установите интервал усреднения равным 5 выборкам. Установите порог угла изгиба. Чтобы рассчитать статистику по бенту, перейдите в раздел Статистика пробных версий и выберите задержку для первого > добавления. Повторяйте шаги до тех пор, пока не будут получены различные пороговые значения (в диапазоне от 20 до 80°) и назовите их соответственно.
- Генерация статистики и графиков.
- Выберите результаты анализа > > статистике и диаграммах, затем нажмите « Рассчитать».
- Убедитесь, что профили данных и анализа настроены на правильный шаблон, так как для каждого раздела можно создать несколько шаблонов.
- Экспортируйте статистику испытаний и групп в виде файлов электронных таблиц для обработки и анализа.
- Чтобы выбрать испытания для анализа, выберите «Профили данных » и определите треки на основе независимой переменной, представляющей интерес.
6. Анализ данных
- Откройте файл таблицы, содержащий статистику испытаний.
- Выберите столбцы Угол тела, Максимальный градус, Задержка изгиба (из различных пороговых значений угла тела).
- Рассматривайте каждое изменение угла наклона тела ≥ 30° в пределах отсечки в 50 мс после появления стимула как положительную реакцию C-start (т.е. ответчика); Те, у кого угол наклона тела < 30°, не реагируют.
- В бинарном режиме назначьте 1 отвечающей личинке и 0 нереагирующим личинкам для каждой пластины.
- Подсчитайте общее количество реагирующих и не отвечающих личинок для каждой пластины. Рассчитайте ответчиков (%) в каждом случае, рассчитанных как (число реагирующих личинок/общее число личинок) × 100. Исключить из анализа личинок, которые реагируют менее чем на 30% на стимул испуга16.
Примечание: Любая интенсивность стимула, способная вызвать реакцию С-старт у 70% или более 70% личинок, считается подходящим стимулом дляиспуга.
- Подсчитайте общее количество реагирующих и не отвечающих личинок для каждой пластины. Рассчитайте ответчиков (%) в каждом случае, рассчитанных как (число реагирующих личинок/общее число личинок) × 100. Исключить из анализа личинок, которые реагируют менее чем на 30% на стимул испуга16.
- Рассчитайте %PPI как 100 × (процент реагирующих на стимул испуга − процент реагирующих на предимпульс + последовательность испуга)/ (процент реагирующих на стимул испуга)16.
7. Статистический анализ
- Представьте данные в виде среднего значения ± стандартного отклонения, S.D. (см. Таблицу материалов для статистического программного обеспечения).
- Определите влияние различной интенсивности преимпульса на реакцию личинок с помощью одностороннего ANOVA с последующим апостериорным тестом Тьюки.
- Используйте двусторонний ANOVA с последующим тестом Holm-Sidak post-hoc для определения влияния медикаментозного лечения на % ответа на ИПП с различной интенсивностью преимпульса.
Результаты
Были проведены три эксперимента для валидации протокола объединения нескольких систем для анализа предимпульсного ингибирования акустической реакции испуга у личинок данио-рерио. Во-первых, была проверена способность точно доставлять акустические стимулы и улавливать реакцию личинок на стимул испуга. Далее была проверка способности ослаблять реакцию испуга при предъявлении предимпульсного стимула. Наконец, установлена возможность обнаружения фармакологической модуляции преимпульсного ингибирования реакции испуга препаратами апоморфином, галоперидолом и кетамином.
Реакция личинок данио рерио на акустические раздражители испуга
Предыдущая работа показала, что личинки данио-рерио демонстрируют характерный С-старт при предъявлении поразительного акустического стимула16. Была проверена способность подстрекать и улавливать поведение личинок к раздражителям испуга. Было замечено, что зарегистрированные личинки проявляют реакцию C-start (рис. 2). Стимул в 70 дБ относительно (100 мс, 660 Гц, дополнительный рисунок 1A) был достаточно сильным, чтобы вызвать ответ у ≥70% личинок (рисунок 3A). При многократном предъявлении 30 раз с интервалом между испытаниями в 30 с, рестимуляция 70 дБ не приводило к привыканию личинок (N = 3 репликации; 16 личинок/репликация), как показано на рисунке 3B.
Преимпульс снижает реакцию испуга личинок данио-рерио на акустические раздражители
Множество доказательств показывает, что предимпульсные стимулы модулируют реакцию личинок на раздражитель испуга 15,21,22,26. Была использована двухимпульсная парадигма, в которой слабый стимул, называемый предимпульсом, предшествовал стимулу, вызывающему испуг, называемому пульсом. Используемые предимпульсные стимулы были на 20, 17 или 14 дБ меньше, чем импульсный стимул, установленный на уровне 70 дБ. Предимпульс (5 мс, 440 Гц) всегда подавался за 100 мс до начала импульса (дополнительный рисунок 1B). Каждый испытуемый предимпульсный стимул значительно снижал личиночную реакцию на импульс. На рисунке 4 показана реакция личинки (в %) на акустические стимулы испуга для 6 dpf TL в среде E3, N = 6 (16 личинок/группа). Процент личинок, реагирующих на раздражитель испуга (пульс), составил 79,86 ± 9,772. Ожидаемо, когда стимулу испуга предшествовал предимпульс 50, 53 или 56 дБ, реакция личинки снижалась до 40,87% ± 11,30%, 39,58% ± 7,345% и 29,17% ± 9,350% соответственно. Односторонний анализ Anova выявил статистическую разницу в эффекте стимула на личинок (F (3, 48) = 57,23, P < 0,0001), а тест множественных сравнений Тьюки выявил статистическую значимость по группам в 95% доверительном интервале.
Фармакологическая модуляция преимпульсного торможения
Более ранние исследования показали, что дофаминергические препараты апоморфин и галоперидол, а также глутаматергический препарат кетамамин значительно модулируют преимпульсное ингибирование у личинок так же, как и у ихэквивалентов у млекопитающих и грызунов. На основе этих исследований были выбраны концентрации для валидации установки. Межстимульный интервал (ISI) для всех фармакологических экспериментов составлял 100 мс.
Влияние апоморфина на препульсовое торможение
На рисунке 5 личинки, предварительно обработанные апоморфином в дозе 10 мг/мл в течение 10 мин, показали общее снижение % ИПП по сравнению с личинками контроля Е3 (двусторонний ANOVA, без RM (факторы: интенсивность лечения и предимпульсной терапии; обработка: F (1, 34) = 16,21, p = 0,0003; предимпульсная интенсивность: F (2, 34) = 8,674, P = 0,0009, это показало незначительное взаимодействие: F (2, 34) = 2,514, p = 0,0959). Чтобы исследовать различия более подробно, апостериорный тест Холма-Сидака выявил значительные различия в реакции на испуг между контролем Е3 и личинками, обработанными апоморфином, при интенсивностях 53 (p = 0,0126) и 56 (p = 0,0044), но не при 50 дБ (p = 0,5813).
Влияние галоперидола на препульсное торможение
На рисунке 6 показано общее увеличение %ИПП у личинок, предварительно обработанных в течение 20 мин галоперидолом 20 мкМ, по сравнению с таковыми в среде Е3 (двусторонний ANOVA, без RM (факторы: интенсивность лечения и предимпульсной терапии; обработка: F (1, 32) = 20,75, p < 0,0001; предимпульсная интенсивность: F (2, 32) = 3,147, p = 0,0565, без значимого взаимодействия: F (2, 32) = 0,7455, p = 0,4826). С помощью апостериорного теста Холма-Сидака наличие статистической значимости наблюдалось только при предимпульсных интенсивностях 53 (p = 0,00489 и 56 (p = 0,0348), но не при 50 дБ (p = 0,067).
Влияние кетамина на препульсное торможение
На рисунке 7 показано, что при различных интенсивностях предимпульсного стимула наблюдались различия в реакции испуга между контрольными личинками Е3 и личинками, предварительно обработанными в течение 10 мин в 1,0 мМ кетамина (двусторонний ANOVA, без RM (факторы: лечение и интенсивность до импульса; лечение: F (1, 35) = 25,46, p < 0,0001; интенсивность перед импульсом: F (2, 35) = 6,018, p = 0,0057, без значимого взаимодействия: F (2, 35) = 0,8450, p = 0,4381). Апостериорный тест Холма-Сидака показал значимость только при предимпульсных интенсивностях 50 (p = 0,0039) и 53 (p = 0,0027), но не при 56 дБ (p = 0,0802).
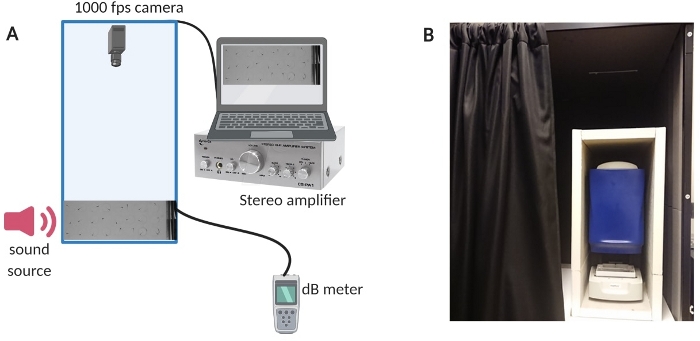
Рисунок 1: Испытательная аппаратура. (A) Обзор конфигурации оборудования. (B) Внутренняя изоляция настроенного оборудования для минимизации фонового шума во время экспериментов. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
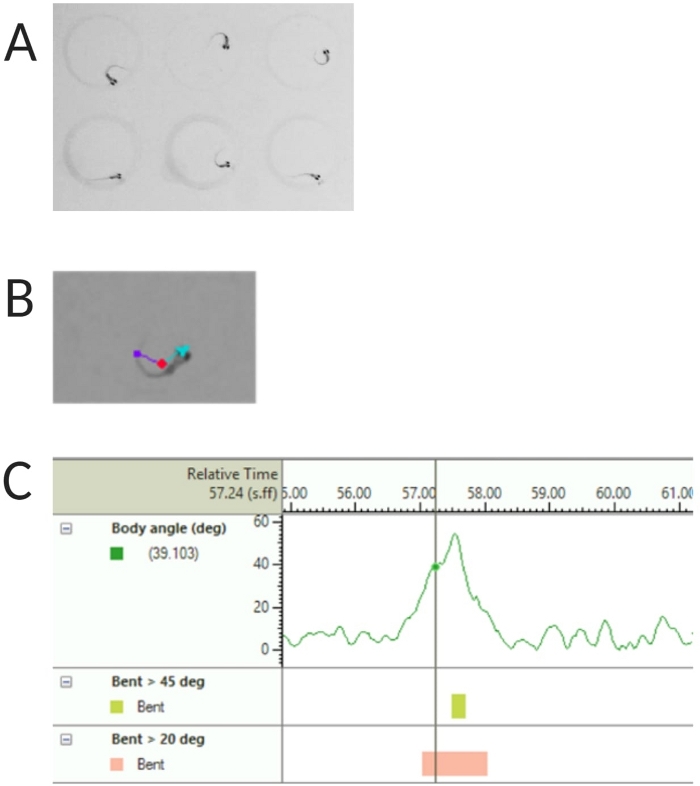
Рисунок 2: Анализ акустической реакции на испуг личинок данио-рерио. (A) Характерный C-старт у 6 личинок данио-рерио при 6 dpf. (B) Репрезентативное изображение трех отслеживаемых особенностей, наложенных на личинку размером 6 dpf: центральная точка (красная), точка носа (голубой) и основание хвоста (фиолетовый). (C) Репрезентативное изображение абсолютного угла изгиба, отображаемое личинками дикого типа TL 6-dpf. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
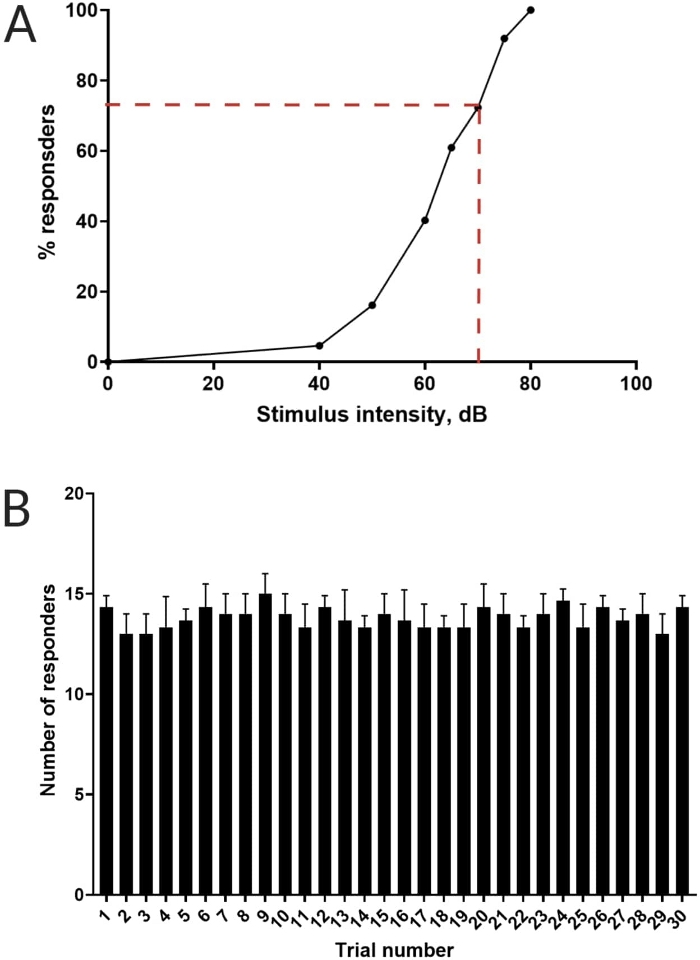
Рисунок 3: Определение порога акустического испуга. (A) Интенсивность стимула в 70 дБ (обозначенная красными пунктирными линиями) способна вызвать реакцию C-start у >70% личинок (N = 33; 6 dpf TL). (В) Личинки не привыкают к 70 дБ рестимуляции, предъявляемой 30 раз (испытания) с интервалом между испытаниями 30 с (N = 3 репликации; 16 личинок/репликация). Данные представлены в виде среднего ± S.D. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
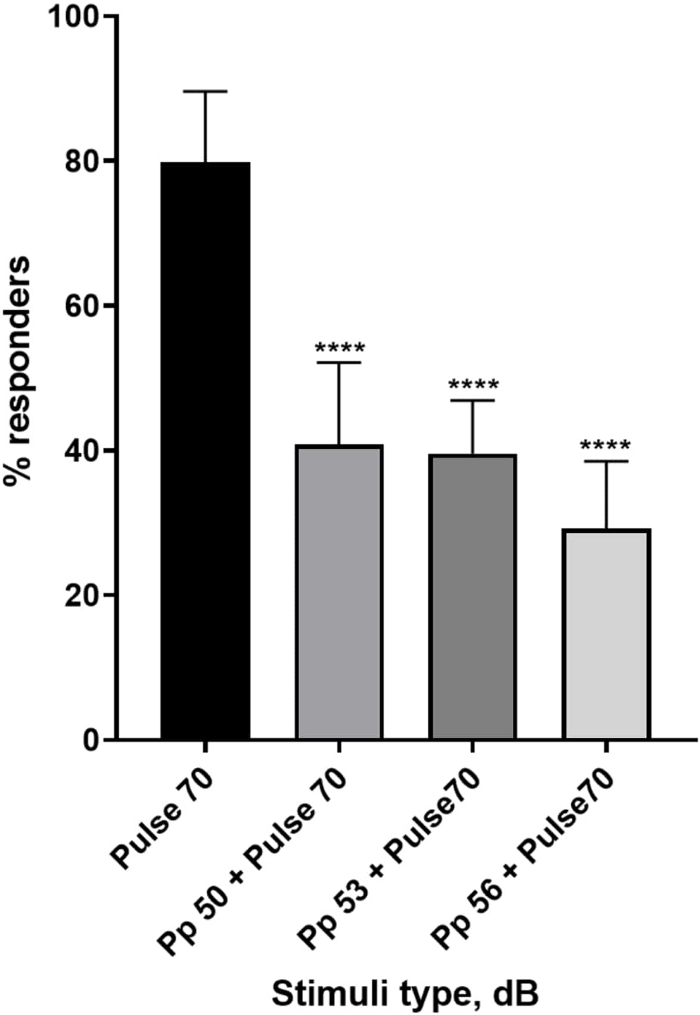
Рисунок 4: Индуцированное до импульса снижение личиночного ответа (%). Предимпульсные стимулы на 20, 17 и 14 дБ ниже, чем 70 дБ репугающего стимула, вызывают уменьшение количества реагирующих на C-старт личинок дикого типа TL. Все данные представлены в виде среднего значения ± S.D., N = 5 (16 личинок на группу), ****p < 0,0001, что значительно отличается от стимула испуга по апостериорному тесту Тьюки после одностороннего ANOVA. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
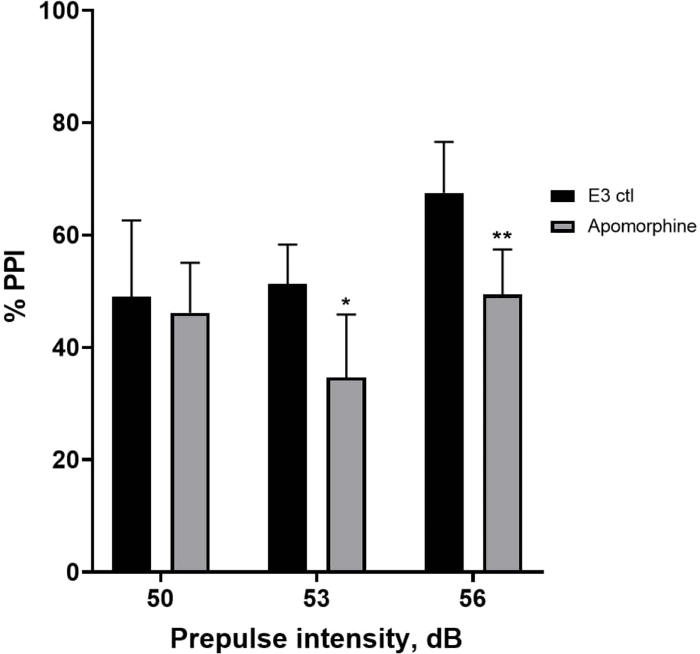
Рисунок 5: Дефицит %PPI, вызванный апоморфином. Все данные представлены в виде среднего значения ± S.D., N = 4\u20125 (16 личинок/группа), статистически значимая разница по апостериорному тесту Холма-Сидака после двустороннего ANOVA. *p = 0,0126, группа, обработанная E3 ctl/апоморфином при 53 дБ; **p = 0,0044, группа, обработанная E3 ctl/апоморфином при 56 дБ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
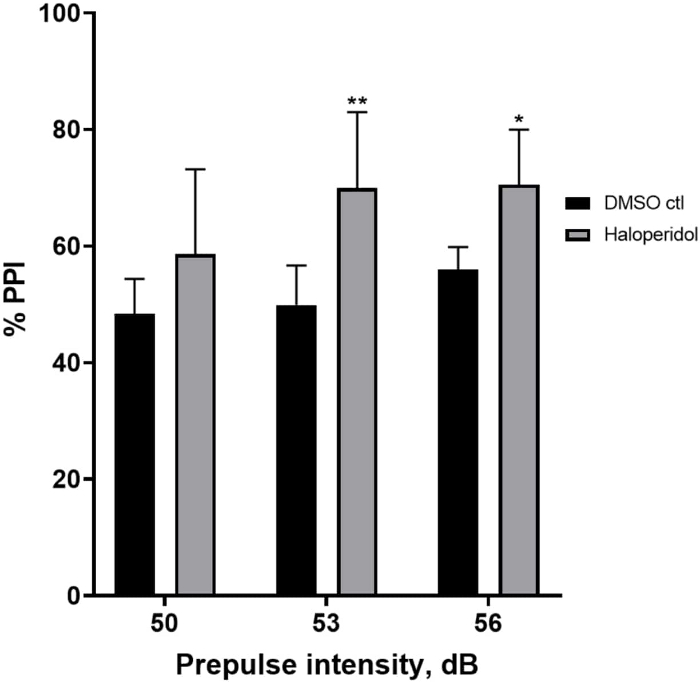
Рисунок 6: Галоперидол индуцировал повышение %PPI. Все данные представлены в виде среднего значения ± S.D., N = 4\u20125 (16 личинок/группа), статистически значимая разница по апостериорному тесту Холма-Сидака после двусторонней ановы. **p = 0,0048, группа, обработанная ДМСО ctl/апоморфином, при 53 дБ; *p = 0,0348, группа, обработанная ДМСО ctl/апоморфином при 56 дБ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
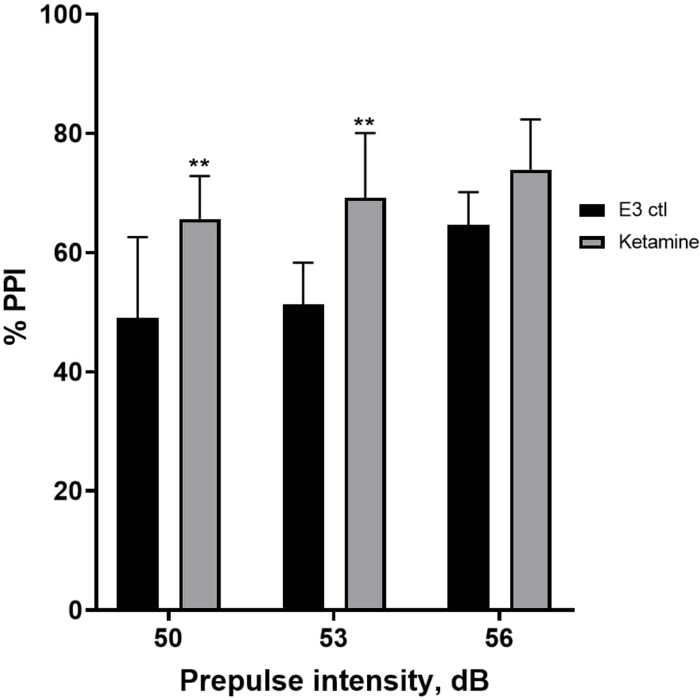
Рисунок 7: Кетамин индуцировал повышение %PPI. Все данные представлены в виде среднего значения ± S.D, N = 4\u20125 (16 личинок/группа), статистически значимая разница по результатам апостериорного теста Holm-Sidak после двустороннего введения Anova **p = 0,0039, группа, получавшая E3 ctl/апоморфин в дозе 50 дБ, **p = 0,0027, группа, получавшая E3 ctl/апоморфин, в дозе 53 дБ. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этой цифры.
Дополнительное видео 1: Репрезентативное видео личинок, демонстрирующих С-старт в ответ на акустический стимул испуга 70 дБ. Пожалуйста, нажмите здесь, чтобы скачать это видео.
Дополнительный рисунок 1: Репрезентативные примеры сгенерированных стимулирующих условий с использованием генератора PPI. (А) испытание только стимулом, (В) испытание до импульсного торможения (предимпульс + импульс), (В) испытание без стимула для измерения порогового базового угла изгиба нестимулированных личинок. Пожалуйста, нажмите здесь, чтобы скачать эту цифру.
Обсуждение
Крайне важно валидировать любую новую систему поведенческого анализа с целью улучшения и уточнения протоколов нейроповеденческих исследований. В настоящем исследовании была оценена способность двух коммерчески доступных систем и программного обеспечения вызывать акустическую реакцию испуга у личинок данио-рерио, а также обнаруживать и количественно определять ранее описанную фармакологическую модуляцию такого поведения.
Для оптимизации настройки был выполнен ряд модификаций и устранения неполадок. Стандартное программное обеспечение для анализа ответов C-start было таким, что анализ автоматически продолжался после получения данных для каждого эксперимента (22 испытания на планшет составляли эксперимент). Это уменьшило количество пластин, которые можно было запустить в день, тем самым снизив производительность (5 пластин в день). Чтобы избежать этого ограничения, необходимо было отделить аналитическое программное обеспечение от процесса сбора данных, что увеличило производительность в среднем до 10 пластин в день. Таким образом, решение обратиться к независимому аналитическому программному обеспечению для нереального анализа оказалось успешным и более эффективным. Чтобы избежать помех от теней или другого мусора, который вносит шум в данные, рекомендуется полностью заполнить колодцы средой, удалить все пузырьки и избегать частиц пищи или чего-то подобного, которые могут быть приняты за личинки, тем самым создавая шум в данных. После калибровки звуковых стимулов максимальная интенсивность, достижимая усилительной системой, зарегистрированной измерителем дБ, составила 85 дБ относительно, в то время как начальный фоновый шум в испытательной камере составил 60 дБ относительно. Это привело к узкому окну дБ, в котором можно было работать. Следовательно, было крайне важно свести к минимуму фоновый шум. Для достижения этой цели был использован материал парафонной акустики (см. Таблицу материалов) для создания дополнительного слоя изоляции вокруг испытательной камеры и дополнительного слоя изоляции с помощью пучка вокальной кабины (см. Таблицу материалов). С помощью этих слоев изоляции фоновый шум внутри испытательной камеры был успешно снижен с начальных 60 дБ до 45 дБ относительно.
В настоящее время одним из преимуществ такой конфигурации является то, что все компоненты коммерчески доступны и поэтому не ограничиваются только несколькими лабораториями. Люди с ограниченными знаниями языка программирования могут использовать его, так как протокол довольно прост для понимания и соблюдения. Например, с помощью системы ИПП можно было подавать импульсы и предимпульсы с различными интервалами между стимулами и межпробными интервалами, а также захватывать реакции личинок на такие стимулы. После того, как эти модели поведения были зафиксированы, их можно было классифицировать с помощью аналитического программного обеспечения на реагирующих и не реагирующих. Группа ответчиков была классифицирована как личинки, которые демонстрировали C-старт 30° или более при задержке <50 мс. Кроме того, реакция ИПП модулируется препаратами, которые нацелены на дофаминергическую и глутаматергическую передачу сигналов (обзор Гейера и коллег27). В соответствии с предыдущими исследованиями, апоморфин, неселективный агонист дофаминовых рецепторов, уменьшал предимпульсное ингибирование реакции испуга у личинок данио-рерио, в то время как галоперидол, антагонист дофамина, усиливал ответ. Было показано, что у личинок рыбок данио кетамин дифференциально модулирует ИПП в зависимости от продолжительности ISI16. В вышеупомянутом исследовании личиночный ИПП был повышен через 30 мс, но подавлен через 500 мс ИПП при предварительной обработке кетамином. Хотя в этом исследовании не использовали вариабельный ISI, наблюдение о том, что кетамин усиливает PPI при ISI 100 мс, делает его сопоставимым с данными предыдущего исследования при использовании ISI 30 мс. Исследование показало, что, комбинируя эти коммерчески доступные системы, можно провести анализ ИПП и надежно обнаружить фармакологически индуцированные изменения в ответе личинок данио-рерио на ИПП. Ограничением системы является то, что признак точки носа, отслеживаемый аналитическим программным обеспечением, всегда попадает на один из глаз личинок, тем самым создавая базовый угол. Чтобы преодолеть это, необходимо всегда определять исходный угол изгиба нестимулированных личинок, который оказался ~30° для личинок, использованных в данном исследовании. Таким образом, это послужило основанием для выбора 30° в качестве порога того, что считалось положительной реакцией C-start у испуганных личинок. Если эти моменты учтены, то должна быть возможность провести анализ ИПП в любой лаборатории, имеющей доступ к настроенному оборудованию. В данной статье не было сосредоточено на классификации кинематики реакции на испуг на короткую латентность и длинную латентность, как сообщалось ранее16, из-за масштаба изменчивости латентности. Следовательно, использовались только ответы C-start через <50 мс после начала стимула.
Сообщалось, что различия в штаммах влияют на поведение рыбок данио в нескольких анализах 28,29,30,31, а также влияют на чувствительность слуха32. Следовательно, важно определить базовый угол изгиба каждой испытуемой деформации. Поскольку чувствительность слуха также может быть различной, крайне важно определить исходную реакцию испуга, интенсивность звука, наиболее подходящую в качестве предимпульсного или испуганного стимула для каждого штамма, и продолжительность предъявления стимула. ISI является еще одним параметром, который следует тщательно учитывать, потому что некоторые препараты могут либо повышать, либо уменьшать PPI в зависимости от интервала между предимпульсом и началом испуга16. Ожидается, что лаборатории, заинтересованные в изучении когнитивных функций, нервно-психических расстройств и слуха (слуховой функции), сочтут эту систему и протокол ИПП полезными для скрининга своих фармакологических и/или генетических моделей. Этот протокол также обеспечивает основу для высокопроизводительного скрининга составных библиотек.
Раскрытие информации
Авторы заявляют об отсутствии конкурирующих финансовых интересов.
Благодарности
Мы благодарим Ану Тавару и Жуана Паулу Р.. Сантану за отличный уход за рыбами и неоценимую помощь в тестировании и настройке звукоизоляционных кабин, а также доктора Витске ван дер Ента за первоначальную поддержку в настройке программного обеспечения EthoVision. Это исследование было профинансировано Исследовательским советом Норвегии (ISP, BIOTEK2021/ DigiBrain).
Материалы
| Name | Company | Catalog Number | Comments |
| Apomorphine | Sigma Aldrich | A4393 | Dopamine agonist |
| dB meter | PCE instruments | PCE-MSM 4 | For measuring stimulus intensity |
| DMSO | Sigma Aldrich | D8418 | For dissolving organic solutes |
| Dynavox Amplifier | Dynavox | CS-PA1 MK | For delivering acoustic stimuli |
| EthoVision XT | Noldus, Netherlands | EthoVision XT, version 14 | Automated tracking software |
| GraphPad Prism | GraphPad Software | Version 8 | Statistical analysis software |
| Haloperidol | Sigma Aldrich | H1512 | Dopamine antagonist |
| Ketamine | Sigma Aldrich | Y0000450 | NMDA receptor antagonist |
| parofon acoustics materials | Paroc | 8528308 | Helps reduce background noise in the test cabinet |
| t.akustik Vocal Booth Bundle | Thormann, Germany | 458543 | Helps reduce background noise in the test cabinet |
| ZebraBox Revo with PPI add-ons | ViewPoint, France | ZebraBox Revo with PPI add-ons | Includes hardware and software |
Ссылки
- Gawel, K., Banono, N. S., Michalak, A., Esguerra, C. V. A critical review of zebrafish schizophrenia models: Time for validation. Neuroscience & Biobehavioral Reviews. 107, 6-22 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Kalueff, A. V., Stewart, A. M., Gerlai, R. Zebrafish as an emerging model for studying complex brain disorders. Trends in Pharmacological Sciences. 35 (2), 63-75 (2014).
- Panula, P., et al. The comparative neuroanatomy and neurochemistry of zebrafish CNS systems of relevance to human neuropsychiatric diseases. Neurobiology of Disease. 40 (1), 46-57 (2010).
- Kokel, D., Peterson, R. T. Chemobehavioural phenomics and behaviour-based psychiatric drug discovery in the zebrafish. Briefings in Functional Genomics and Proteomics. 7 (6), 483-490 (2008).
- Basnet, R. M., Zizioli, D., Taweedet, S., Finazzi, D., Memo, M. Zebrafish Larvae as a Behavioral Model in Neuropharmacology. Biomedicines. 7 (1), 23(2019).
- Henry, J., Wlodkowic, D. Towards High-Throughput Chemobehavioural Phenomics in Neuropsychiatric Drug Discovery. Marine Drugs. 17 (6), (2019).
- Behavioural measurement system | Laval zebrafish | Drosophila | Daphnia | insects | Products | Zantiks. , Available from: https://zantiks.com/products/zantiks-mwp (2020).
- Product List - ViewPoint. , Available from: http://www.viewpoint.fr/en/products (2020).
- Observation chamber for zebrafish research - DanioVision. , Available from: https://www.noldus.com/daniovision/observation-chamber (2020).
- EthoVision XT - Video tracking software | Noldus. , Available from: https://www.noldus.com/ethovision-xt (2020).
- Gould, T. D., Gottesman, I. I. Psychiatric endophenotypes and the development of valid animal models. Genes, Brain and Behavior. 5 (2), 113-119 (2006).
- van den Buuse, M. Modeling the Positive Symptoms of Schizophrenia in Genetically Modified Mice: Pharmacology and Methodology Aspects. Schizophrenia Bulletin. 36 (2), 246-270 (2010).
- Acoustic startle modification as a tool for evaluating auditory function of the mouse: Progress, pitfalls, and potential. Abstract - Europe PMC. , Available from: https://europepnc.org/article/PMC/5446932 (2020).
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. Journal of Experimental Biology. 216 (18), 3504-3513 (2013).
- Burgess, H. A., Granato, M. Sensorimotor Gating in Larval Zebrafish. Journal of Neuroscience. 27 (18), 4984-4994 (2007).
- Eaton, R. C., Farley, R. D., Kimmel, C. B., Schabtach, E. Functional development in the mauthner cell system of embryos and larvae of the zebra fish. Journal of Neurobiology. 8 (2), 151-172 (1977).
- SR-LAB - San Diego Instruments Startle Response. San Diego Instruments. , Available from: https://sandiegoinstruments.com/product/sr-lab-startle-response/ (2020).
- Startle packages - Med Associates Inc. Med Associates Inc. , Available from: https://www.med-associates.com/product-category/acoustic-startle-reflex-packages/ (2020).
- Startle response & Pre-pulse inhibition test. O'HARA & CO.,LTD. , Available from: https://ohara-time.co.jp/products/startle-response-pre-pulse-inhibition-test/ (2020).
- Thyme, S. B., et al. Phenotypic Landscape of Schizophrenia-Associated Genes Defines Candidates and Their Shared Functions. Cell. 177 (2), 478-491 (2019).
- Privat, M., et al. Sensorimotor Transformations in the Zebrafish Auditory System. Current Biology. 29 (23), 4010-4023 (2019).
- Gerlai, R. Reproducibility and replicability in zebrafish behavioral neuroscience research. Pharmacology Biochemistry and Behavior. 178, 30-38 (2019).
- Add-on - Fast camera 1000 FPS - ViewPoint. , Available from: http://www.viewpoint.fr/app.php/en/p/equipment/add-on-fast-camera (2020).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. , (2019).
- Bhandiwad, A. A., Sisneros, J. A. Revisiting Psychoacoustic Methods for the Assessment of Fish Hearing. Fish Hearing and Bioacoustics: An Anthology in Honor of Arthur N. Popper and Richard R. Fay. , 157-184 (2016).
- Geyer, M. A., Krebs-Thomson, K., Braff, D. L., Swerdlow, N. R. Pharmacological studies of prepulse inhibition models of sensorimotor gating deficits in schizophrenia: a decade in review. Psychopharmacology. 156 (2-3), 117-154 (2001).
- Lange, M., et al. Inter-Individual and Inter-Strain Variations in Zebrafish Locomotor Ontogeny. PLOS ONE. 8 (8), 70172(2013).
- Liu, X., et al. Strain-dependent differential behavioral responses of zebrafish larvae to acute MK-801 treatment. Pharmacology Biochemistry and Behavior. 127, 82-89 (2014).
- Loucks, E., Carvan, M. J. Strain-dependent effects of developmental ethanol exposure in zebrafish. Neurotoxicology and Teratology. 26 (6), 745-755 (2004).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLOS ONE. 12 (4), 0175420(2017).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hearing research. 341, 220-231 (2016).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены