Method Article
אימות פרמקולוגי של עיכוב קדם-דחף של תגובת בהלה בדגי זברה זחלים באמצעות מערכת ותוכנה אוטומטית מסחרית
In This Article
Summary
כאן אנו מתארים פרוטוקול המשתמש במערכות אוטומטיות זמינות מסחרית כדי לאמת פרמקולוגית את בדיקת עיכוב הדחף (PPI) בדג זברה זחל.
Abstract
אמנם יש שפע של מערכות ותוכנות אוטומטיות מסחריות וסטנדרטיות לביצוע בדיקת עיכוב דחף (PPI) במכרסמים, למיטב ידיעתנו, כל בדיקות ה-PPI שבוצעו בדג הזברה נעשו עד כה באמצעות מערכות מותאמות אישית שהיו זמינות רק לקבוצות בודדות. בכך הציב הדבר אתגרים, במיוחד בכל הנוגע לסוגיות של שחזור נתונים וסטנדרטיזציה. בעבודה הנוכחית, יצרנו פרוטוקול המשתמש במערכות אוטומטיות זמינות מסחרית כדי לאמת פרמקולוגית את בדיקת ה-PPI בדגי זברה זחלים. בהתאם לממצאים שפורסמו, הצלחנו לשכפל את התוצאות של אפומורפין, הלופרידול וקטמין על תגובת ה-PPI של זחלי דג הזברה 6 ימים לאחר ההפריה.
Introduction
זחל דג הזברה (Danio rerio) הוא מועמד מתאים למידול מחלות פסיכיאטריות כמו סכיזופרניה (נבדק על ידי Gawel et al.1) בגלל היתרונות הרבים שיש לו. אלה כוללים גנום מרוצף במלואו עם הומולוגיה של 70% רצף לאורתולוגים אנושיים2, קיומם של כלים גנטיים קדימה ואחורה למניפולציה של הגנום ולזיהוי התרומה של גן נתון להתפתחות או למחלה3, ונוכחות של נוירוטרנסמיטורים אנושיים/מכרסמים עיקריים במוח דג הזברה4. יש זמינות של מספר תחומים נוירו-פנוטיפיים בדג הזברה, כגון חרדה, למידה וזיכרון3. שקיפות אופטית ורגישות למחלקות העיקריות של תרופות נוירוטרופיות הופכות אותו למועמד אידיאלי לבחירה עבור מניפולציות פרמקולוגיות וסינון תרופות פנוטיפיות 5,6.
כדי לבצע סינון תרופות בתפוקה גבוהה, אוטומציה ונוכחות של אנדופנוטיפ חזק חשובים ביותר7. לדוגמה, פותחו מגוון טכניקות הקלטה אוטומטיות למדידת התנהגות דג הזברה של הזחלים כגון תיגמוטקסיס, תגובת בהלה, תגובה אופטוקינטית, תגובה אופטומוטורית, התרגלות, לכידת טרף, התנהגות שינה/ערות, התנהגות תנועהועוד כמה 6. בעוד שחלק מהמעבדות מפתחות מערכות מותאמות אישית למדידות אוטומטיות וניתוח של חלק מההתנהגויות הללו, ישנן מערכות הדמיה ותוכנה זמינות מסחרית 8,9,10,11. עיכוב קדם-דחף (PPI), צורה של שער תחושתי-מוטורי שבו תגובת ההבהלה מופחתת כאשר גירוי חלש שאינו מבהיל מוצג לזמן קצר לפני הגירוי המבהיל, שימש כאנדופנוטיפ לחקר סכיזופרניה במודלים של בעלי חיים (נסקר על ידי12,13). בנוסף, תגובת בהלה אקוסטית (ASR) ו-PPI מילאו תפקידים שימושיים בחקר תפקוד השמיעה והשמיעה במודלים של בעלי חיים כולל דג הזברה14,15. דג הזברה הזחל מציג התחלת C אופיינית בתגובה לגירוי מבהיל בלתי צפוי שמצטמצם על ידי גירוי חלש יותר הנקרא קדם-דופק. ה-C-start תוארה זה מכבר כהתנהגות בריחה הנשלטת על ידי אוכלוסיות תאים עצביים מובהקות ואופיינה ביסודיות בדג הזברה הזחלי 15,16,17.
יש שפע של מערכות ותוכנות אוטומטיות מסחריות וסטנדרטיות לביצוע בדיקת PPI במכרסמים 18,19,20. עם זאת, למיטב ידיעתנו, כל בדיקות ה-PPI שבוצעו בדג הזברה עד כה נעשו באמצעות מערכות מותאמות אישית הזמינות רק לקבוצות הבודדות 15,16,21,22. זה מציב אתגרים להשגת שחזור ושכפול נתונים ביחס לסטנדרטיזציה23.
לאחרונה, ספק ידוע בקהילת דגי הזברה פיתח מערך משובץ עם מצלמה מהירה ותוספות מחולל PPI לביצוע בדיקת PPI בזחל דג זברה24. המצלמה מקליטה במהירות של 1000 פריימים לשנייה המאפשרת הקלטה של התנהגויות מהירות כגון C-start, בעוד שמחולל ה-PPI מאפשר אספקה מבוקרת על ידי המשתמש של גירויים אקוסטיים שונים כדי לעורר תגובת בהלה24. כאן, אנו משלבים את המערכת הנ"ל עם חבילת תוכנה מקיפה זמינה מסחרית המיועדת לניתוח אוטומטי של התנהגויות מורכבות11, כדי ליצור פרוטוקול לביצוע מבחני תגובת PPI בדגי זברה זחלים. אנו מאמתים פרמקולוגית את תגובת ה-PPI באמצעות 1) אפומורפין, אגוניסט דופמין הידוע כגורם לליקויים ב-PPI; 2) הלופרידול, אנטגוניסט דופמין ואנטי פסיכוטי הידוע כמשפר PPI ו-3) קטמין, אנטגוניסט לקולטן NMDA הידוע כמווסת PPI.
Protocol
כל הניסויים בבעלי חיים אושרו על ידי מערכת הפיקוח והיישום של הרשות הנורבגית לבטיחות מזון (FOTS-18/106800-1).
1. גידול דג זברה
- הקימו הזדווגות של זכרים ונקבות של דגי זברה בוגרים מסוג בר (Danio rerio), שנשמרו בתנאים סטנדרטיים25 בערב הקודם. כאן נעשה שימוש בזן טופל ארוך סנפיר (TL).
- הסר מחסומים למחרת בבוקר ואפשר להזדווג באמצעות השרצה טבעית.
- אוספים ביצים ממיכלי ההזדווגות.
- הסר ביצים לא מופרות ופסולת אחרת, ולאחר מכן העביר ביצים לצלחות פטרי (n = 60) וגדל באינקובטור בטמפרטורה של 28 מעלות צלזיוס במדיום עוברי: 1.5 מ"מ HEPES, pH 7.6, 17.4 מ"מ NaCl, 0.21 מ"מ KCl, 0.12 מ"מ MgSO4 ו-0.18 מ"מ Ca(NO3)2.
- חדש מחצית ממדיום העובר והסר זחלים מתים מדי יום עד 6 dpf.
הערה: כל הניסויים בוצעו על זחלים בודדים 6 ימים לאחר ההפריה (dpf).
2. תרופות וטיפול מקדים בזחלים
- ממיסים אפומורפין וקטמין במדיום E3 כדי ליצור תמיסות מלאי של 500 מיקרומטר ו-10 מ"מ בהתאמה.
- ממיסים הלופרידול ב-100% דימתיל סולפוקסיד (DMSO) ליצירת תמיסת מלאי של 10 מ"מ. הריכוז הסופי של DMSO בשימוש היה 0.1%.
- השתמש ב-0.1% DMSO ו-E3 בינוני כבקרות רכב.
- השתמש בריכוזים הסופיים הבאים של תרופות: 10 מ"ג/מ"ל אפומורפין, 1 מ"מ קטמין ו-20 מיקרומטר הלופרידול16.
- חשיפה מוקדמת של זחלי קבוצות האפומורפין והקטמין למשך 10 דקות וקבוצות הביקורת של כלי ההלופרידול וה-DMSO למשך 20 דקות16.
3. הגדרה לפני מבחן ההתנהגות
- ביום הניסוי העבירו זחלים וכל החומרים הרלוונטיים לחדר הניסוי. הגדר את חדר הניסוי לטמפרטורה של 27 ± 1 מעלות צלזיוס.
- ודא שרעשי הרקע בתא הבדיקה נמוכים ככל האפשר, רצוי לא יותר מ-45 dB רמת לחץ קול (SPL).
- התקן את מיקרופון הסונומטר של מד הדציבלים (dB) בתא הבדיקה (הפתח להתקנה כבר משועמם על ידי היצרן).
- כדי להפחית את רעשי הרקע בחדר, בודד את תא הבדיקה עם תא סאונד שנבנה בהתאמה אישית (ראה איור 1B למעלview של ההגדרה).
- הכן צלחת של 96 בארות לבדיקת עיכוב קדם דופק.
הערה: למצלמת הווידאו יש רזולוציה של 2048 × 500 פיקסלים, כלומר ניתן לצלם רק 3 נתיבים לכל היותר (33 בארות) בכל פעם.- השתמש בצלחת אקרילית בהתאמה אישית בפורמט 96 בארות כדי להפחית הפרעות מצללים.
הערה: את המידות עבור הצלחת המותאמת אישית ניתן למצוא בכתובת הבאה webאתר: https://zenodo.org/record/3739378#.XooyLW5uKas
- השתמש בצלחת אקרילית בהתאמה אישית בפורמט 96 בארות כדי להפחית הפרעות מצללים.
- בעזרת פיפטת העברה, העבירו 310 מיקרוליטר של תמיסה/מדיום חשיפה עם זחל אחד לכל באר.
- כיול ומדידה של עוצמת הגירוי באמצעות כפתור עוצמת הקול של מגבר הסטריאו ומד דציבלים בהתאמה.
- רשום את עוצמת הצליל המקסימלית בסעיף "התייחסות לרמה".
4. פרמטרים של גירוי ורכישת וידאו
- הפעל את המחשב, את מערכת המגבר ואת מד ה-dB (ראה איור 1A לסקירה כללית של ההגדרה).
- השתמש בכפתור עוצמת הקול על ידי סיבובו למינימום או מקסימום כדי לכוונן את עוצמת הצליל.
- בדוק את רמת הקול עם מד ה-dB בכל פעם, כפתור עוצמת הקול מותאם. זה חשוב במציאת עוצמת הצליל המקסימלית והמינימלית שניתן להפיק על ידי ההגדרה.
הערה: מד ה-dB מחשב את פלט ה-RMS dB עבור הגירוי. המערכת מייצרת את הצליל בתוך הרכיבים המוצקים של תא הבדיקה, ושומרת על הצלחת יציבה תוך יצירת רטט במישור האופקי של כל תומך הצלחת.- כוונן את כפתור עוצמת הקול למקסימום, מדוד את עוצמת הקול עם מד ה-dB והשתמש בערך זה.
- בדוק את רמת הקול עם מד ה-dB בכל פעם, כפתור עוצמת הקול מותאם. זה חשוב במציאת עוצמת הצליל המקסימלית והמינימלית שניתן להפיק על ידי ההגדרה.
- בממשק של מחולל ה-PPI, הגדר את הפרמטרים: מרווח בין גירויים המיוצג כעיכוב; מרווח בין ניסויים מיוצג כזמן דלתא רכישה; משך הקדם-דופק וכו'.
- עבור ניסויי קדם-פולס בלבד, ודא ש"משרעת" או משך הגירוי עבור פרמטרי הבהלה מוגדרים לאפס ולהיפך עבור ניסויי הבהלה בלבד.
- כדי ליצור רשימת ניסיון, בחר הוסף > תן שם לגירסת הניסיון. לדוגמה, "Prepulse 50 dB בלבד".
הערה: אפשר ליצור כמה ניסויים שרוצים, אבל היזהר מאורך הרשימה מכיוון שזה יכול לקרוס את התוכנית.- ניסויי אינטרליז קדם-פולסים עם דופק בלבד בכל ניסויי ה-PPI תוך שימוש בסדר פסאודו-אקראי. כאשר מוצגים גירויים מרובים בניסוי, נעשה שימוש במרווח בין ניסויים (ITI) של 30 שניות.
הערה: במחקר זה נעשה שימוש בגירוי בהלה (דופק) של 100 אלפיות השנייה של 660 הרץ, וגירוי קדם-פולס של 5 אלפיות השנייה של 440 הרץ. עבור ניסויי PPI, מרווח בין גירויים (ISI) היה 100 אלפיות השנייה.
- ניסויי אינטרליז קדם-פולסים עם דופק בלבד בכל ניסויי ה-PPI תוך שימוש בסדר פסאודו-אקראי. כאשר מוצגים גירויים מרובים בניסוי, נעשה שימוש במרווח בין ניסויים (ITI) של 30 שניות.
- כדי לשמור את הפרוטוקול, בחר קובץ > שמירה בשם.
- התאם את תנאי התאורה בתא הבדיקה באופן הבא.
- הפעל מחשוב מדידת USB, בחר יציאה אנלוגית ולאחר מכן עבור אל D/A OUT O (P13) כדי לבצע שינויים בתאורה. ערך של אפס פירושו שאין אור תוך הגדלת ערך ה-D/A OUT O, מגביר את עוצמת האור בקופסה. עוצמת אור של 100 שימשה לכל הניסויים.
- הגדר את המצלמה
- הפעל את התוכנה והמתן לטעינת המצלמה.
- בחר התאמות (נמצא בצד ימין) והגדר את קצב הפריימים של הרכישה ל-1,000 ולאחר מכן לחץ על החל כדי לבצע את השינוי.
- התאקלמו זחלים לתא בדיקה מואר ב-100% אור למשך 5 דקות לפני תחילת הניסויים.
- כדי להתחיל ניסוי, בחר בתפריט הניסוי במחולל PPI, לחץ על הפעל ועל פורמט בחירת הבאר (למשל, 33 בארות).
- ודא תמיד שתוכנת המצלמה מופעלת עם ההגדרות הנכונות לפני הפעלת ניסוי.
- רכוש סרטון של 2 שניות לכל ניסיון.
- ודא שקצב הפריימים של הרכישה מוגדר ל-1,000.
5. מעקב וניתוח אוטומטי של תגובת בהלה אקוסטית ו-PPI
- הגדרת פרוטוקול.
- הפעל את תוכנת הניתוח (ראה טבלת החומרים). בחר חדש מתבנית > החל תבנית מוגדרת מראש ולאחר מכן עבור בין תפריטים אחרים (פרטים להלן).
- בחר מתוך קובץ וידאו תחת מקור וידאו.
- עיין בקובץ הווידאו. הגדר את הנושא כדג > זחלי דג זברה תבנית אזור > (ללא תבנית). ציין את מספר הזירות תחת זירות.
- ציין את מספר הנושאים בכל זירה (מוגדר כ-1) תחת נושאים.
- בחר זיהוי נקודת מרכז, נקודת אף ובסיס זנב תחת תכונות מעקב (ראה איור 2A,B).
הערה: זה חשוב כדי לחשב את זווית הגוף של תגובת C-start (ראה איור 2C). - לחץ על שם > שמור בשם. היחידות המשמשות הן מ"מ, s, deg למרחק, זמן וסיבוב בהתאמה.
הערה: זכור להשתמש באותה יחידה לכיול המשקל.
- בחר הגדרת זירה.
- לחץ על תפוס תמונת רקע.
- בצע את השלבים בתפריט הימני (אם יש לך ספק, השתמש בתפריט עזרה ).
- בחר בכלי ציור המעגל כדי לצייר את הזירות.
- בחר הגדרות בקרת ניסיון > ליצור שם > חדש.
- בחר הגדרות זיהוי, עבור על השלבים בתפריט הימני.
- הגדר את קצב הדגימה ל-25. בחר הגדרות זיהוי מתקדמות. תחת שיטה, בחר חיסור דינמי, דגם מתקדם/דג בוגר, ולאחר מכן הגדר את צבע הנושא בהשוואה לרקע ככהה יותר והזז את המחוון כדי להגדיר את הניגודיות של הזחל.
- תחת קווי המתאר של הנושא, בחר תחילה שחיקה, ולאחר מכן הרחב והגדל את ערכי השחיקה וההרחבה של קווי המתאר עד שהחיה מזוהה לחלוטין.
- שמור את הפרוטוקול והשתמש בו לניתוחים הבאים של סרטוני PPI שנרכשו.
- הפעל את תוכנת הניתוח (ראה טבלת החומרים). בחר חדש מתבנית > החל תבנית מוגדרת מראש ולאחר מכן עבור בין תפריטים אחרים (פרטים להלן).
- הגדרת רשימת ניסיון.
- בחר רשימת ניסויים, הגדר משתנים בלתי תלויים כגון מזהה זחל, טיפול, סוג גירוי וכו'. בחר את נתיב הסרטונים והגדר רשימה של ניסויים לרכישת אצווה.
- מערך רכישה.
הערה: אם נוצרה רשימת ניסיון, ניתן לבצע רכישה אצווה של הסרטונים.- אם חלק מהרצועות אבדו, השתמש בעורך הרצועות כדי להתאים את תכונות המעקב.
- אל תכלול בניתוח את שגיאות המעקב שנותרות לא פתורות לאחר השימוש בעורך הרצועות.
- הגדר את פרופיל החלקת הרצועות ל-1 מ"מ כדי להפחית את הרעש מהנתונים. ניתן להתאים זאת על סמך פעילות הרקע של הזחלים.
- הגדרת ניתוח.
- כדי לבחור ניסויים לניתוח, בחר פרופילי נתונים והגדר מסלולים על סמך המשתנה הבלתי תלוי המעניין.
הערה: אם הרכיבים מוסתרים, לחץ על סמל העין בפינה הימנית העליונה כדי להציג.- לסנן חלקים מהניסויים שיש לנתח (למשל, על סמך טיפול או סוג קבוצת הגירוי).
- בחר חלק מהרצועות לניתוח (קינון). עבור מחקר זה, הנתונים היו מקוננים עבור מסלולים בין תחילת הגירוי ל-100 אלפיות השנייה לאחר תחילת הגירוי.
- זכור לחבר את כל המסננים ותיבות הקינון עם קווי חצים כדי להשלים את ההוראה.
- הגדר משתנים תלויים לניתוח, בחר פרופילי ניתוח וציין את המשתנים המעניינים (התמקד בגוף תחת משתנים תלויים).
הערה: אם הרכיבים מוסתרים, לחץ על סמל העין בפינה הימנית העליונה כדי להציג.- לחץ פעמיים על זווית הגוף. בחר כיפוף מוחלט. עברו על הגדרות ניסיון ובחרו מקסימום, ולאחר מכן לחצו על הוסף.
- לחץ פעמיים על מצב זווית הגוף. הגדר מרווח ממוצע ל-5 דגימות. הגדר את סף זווית הכיפוף. כדי לחשב סטטיסטיקה עבור כפוף, עבור על סטטיסטיקת גירסת ניסיון ובחר השהיה להוספה > תחילה. חזור על השלבים עד לקבלת ספים משתנים (נעשה שימוש בין 20-80 מעלות) ושם בהתאם.
- יצירת סטטיסטיקות ותרשימים.
- בחר/י ניתוח > תוצאות > סטטיסטיקה ותרשימים ולאחר מכן לחץ/י על ״חשב״.
- ודא שפרופילי הנתונים והניתוח מוגדרים לתבנית הנכונה מכיוון שניתן ליצור מספר תבניות תחת כל סעיף.
- ייצא סטטיסטיקות ניסיון וסטטיסטיקות קבוצתיות כקבצי גיליון אלקטרוני לעיבוד וניתוח.
- כדי לבחור ניסויים לניתוח, בחר פרופילי נתונים והגדר מסלולים על סמך המשתנה הבלתי תלוי המעניין.
6. ניתוח נתונים
- פתח את קובץ הגיליון האלקטרוני המכיל את הנתונים הסטטיסטיים של הניסוי.
- בחר את העמודות: זווית גוף, סגר מקסימלי, השהיה כפופה (של ערכי הסף השונים של זווית הגוף).
- קחו בחשבון כל שינוי בזווית הגוף ≥-30 מעלות בתוך חביון חתך של 50 אלפיות השנייה לאחר תחילת הגירוי כתגובת C-start חיובית (כלומר, מגיב); אלה עם זווית גוף < של 30 מעלות אינם מגיבים.
- באופן בינארי, הקצה 1 לזחל מגיב ו-0 לזחלים שאינם מגיבים עבור כל צלחת.
- ספרו את המספר הכולל של המגיבים והזחלים שאינם מגיבים עבור כל צלחת. חשב את המגיבים (%) בכל מקרה מחושב כ (מספר הזחלים המגיבים/מספר הזחלים הכולל) × 100. לא לכלול זחלים המגיבים פחות מ-30% לגירוי ההבהלה מהניתוח16.
הערה: כל עוצמת גירוי המסוגלת לעורר תגובת C-start בשווה או יותר מ-70% מהזחלים נחשבת לגירוי בהלה מתאים16.
- ספרו את המספר הכולל של המגיבים והזחלים שאינם מגיבים עבור כל צלחת. חשב את המגיבים (%) בכל מקרה מחושב כ (מספר הזחלים המגיבים/מספר הזחלים הכולל) × 100. לא לכלול זחלים המגיבים פחות מ-30% לגירוי ההבהלה מהניתוח16.
- חשב %PPI כ-100 × (אחוז התגובה לגירוי בהלה - אחוז התגובה לגירוי הבהלה + רצף הבהלה)/ (אחוז המגיב לגירוי הבהלה)16.
7. ניתוח סטטיסטי
- הצג נתונים כממוצע ± סטיית תקן, S.D. (ראה טבלת החומרים לתוכנה סטטיסטית).
- קבע את ההשפעות של עוצמות קדם-דחף משתנות על תגובת הזחל באמצעות ANOVA חד כיווני ואחריו מבחן פוסט-הוק של Tukey.
- השתמש ב-ANOVA דו-כיווני ואחריו מבחן פוסט-הוק של הולם-סידק כדי לקבוע את ההשפעות של טיפול תרופתי על % תגובת PPI בעוצמות קדם-דופק משתנות.
תוצאות
שלושה ניסויים בוצעו כדי לאמת את הפרוטוקול של שילוב מערכות מרובות לניתוח עיכוב קדם-דחף של תגובת בהלה אקוסטית בדג הזברה הזחל. ראשית, נבדקה היכולת לספק גירויים אקוסטיים במדויק וללכוד את תגובת הזחלים לגירוי הבהלה. לאחר מכן, היה אימות היכולת להחליש את תגובת הבהלה כאשר מוצג גירוי קדם-דופק. לבסוף, נקבעה היכולת לזהות את האפנון הפרמקולוגי של עיכוב קדם-דופק של תגובת ההבהלה על ידי התרופות אפומורפין, הלופרידול וקטמין.
תגובת דג הזברה של הזחל לגירויים אקוסטיים
עבודות קודמות הראו כי דג הזברה של הזחל מציג התחלת C אופיינית כאשר הוא מוצג עם גירוי אקוסטימבהיל 16. נבדקה היכולת לעורר וללכוד את התנהגות הזחלים לגירוי הבהלה. זחלים מתועדים נצפו מציגים את תגובת C-start (איור 2). גירוי של 70 dB re (100 אלפיות השנייה, 660 הרץ, איור משלים 1A) היה חזק מספיק כדי לעורר תגובה ב-≥70% מהזחלים (איור 3A). כאשר הוצג שוב ושוב 30 פעמים במרווח בין ניסויים של 30 שניות, הגירוי מחדש של 70 dB לא הביא להתרגלות הזחלים (N = 3 חזרות; 16 זחלים/שכפולים), כפי שמוצג באיור 3B.
קדם-דחף מפחית את תגובת הבהלה של דג הזברה לגירויים אקוסטיים
שפע של ראיות מראות כי גירויים קדם-פולסים מווסתים את תגובת הזחל לגירוי בהלה 15,21,22,26. נעשה שימוש בפרדיגמה של שני פולסים, כאשר גירוי חלש שנקרא קדם-פולס קדם לגירוי מעורר הבהלה שנקרא דופק. גירויי הקדם-דחף ששימשו היו 20, 17 או 14 דציבלים פחות מגירוי הדופק שנקבע ל-70 דציבלים מחדש. הקדם-פולס (5 אלפיות השנייה, 440 הרץ) הוצג תמיד 100 אלפיות השנייה לפני תחילת הדופק (איור משלים 1B). כל גירוי קדם-דופק שנבדק הפחית משמעותית את תגובת הזחל לדופק. באיור 4 תגובת הזחל (באחוזים) לגירויים אקוסטיים מוצגת עבור 6 dpf TL בתווך E3, N = 6 (16 זחלים/קבוצה). אחוז הזחלים שהגיבו לגירוי ההבהלה (דופק) היה 79.86 ±-9.772. כצפוי, כאשר קדם לגירוי ההבהלה דחף של 50, 53 או 56 דציבלים, תגובת הזחל ירדה ל-40.87% ±-11.30%, 39.58% ±-7.345% ו-29.17% ±-9.350% בהתאמה. ניתוח Anova חד כיווני חשף הבדל סטטיסטי בהשפעת הגירוי על זחלים (F (3, 48) = 57.23, P < 0.0001) כאשר מבחן ההשוואות המרובות של Tukey חשף מובהקות סטטיסטית בין קבוצות ברווח בר-סמך של 95%.
אפנון פרמקולוגי של עיכוב קדם-דופק
מחקרים קודמים הראו כי התרופות הדופמינרגיות, אפומורפין והאלופרידול, כמו גם התרופה הגלוטמטרגית, קטמין, מווסתות באופן משמעותי את עיכוב הקדם-דופק בזחלים בדיוק כמו ביונקים ומכרסמים16. ריכוזים לאימות ההגדרה נבחרו על סמך מחקרים אלה. המרווח הבין-גירוי (ISI) עבור כל הניסויים התרופתיים היה 100 אלפיות השנייה.
השפעת אפומורפין על עיכוב קדם-דופק
באיור 5, זחלים שטופלו מראש ב-10 מ"ג/מ"ל אפומורפין במשך 10 דקות הראו ירידה כללית ב-% PPI בהשוואה לזחלי ביקורת E3 (ANOVA דו-כיווני, לא RM (גורמים: טיפול ועוצמות קדם-דופק; טיפול: F (1, 34) = 16.21, p = 0.0003; עוצמת קדם-דופק: F (2, 34) = 8.674, P = 0.0009, זה הראה אינטראקציה לא משמעותית: F (2, 34) = 2.514, p = 0.0959). כדי לחקור את ההבדלים ביתר פירוט, מבחן הפוסט-הוק של הולם-סידק חשף הבדלים משמעותיים בתגובת ההבהלה בין בקרת E3 לזחלים שטופלו באפומורפין בעוצמות קדם-דופק 53 (p = 0.0126) ו-56 (p = 0.0044) אך לא ב-50 dB (p = 0.5813).
השפעת הלופרידול על עיכוב קדם-דופק
איור 6 מראה עלייה כללית ב-%PPI בזחלים שטופלו מראש במשך 20 דקות עם 20 מיקרומטר הלופרידול בהשוואה לאלו במדיום E3 (ANOVA דו-כיווני, לא RM (גורמים: טיפול ועוצמות קדם-דופק; טיפול: F (1, 32) = 20.75, p < 0.0001; עוצמת קדם-דופק: F (2, 32) = 3.147, p = 0.0565, ללא אינטראקציה משמעותית: F (2, 32) = 0.7455, p = 0.4826). באמצעות מבחן הפוסט-הוק של הולם-סידק, נוכחות של מובהקות סטטיסטית נצפתה רק בעוצמות קדם-פולס 53 (p = 0.00489 ו-56 (p = 0.0348) אך לא ב-50 dB (p = 0.067).
השפעת קטמין על עיכוב קדם דופק
איור 7 מראה כי בעוצמות שונות של גירוי קדם-דופק, היו הבדלים בתגובת ההבהלה בין זחלי ביקורת E3 לאלה שטופלו במשך 10 דקות בקטמין של 1.0 מ"מ (ANOVA דו-כיווני, לא RM (גורמים: טיפול ועוצמות קדם-דופק; טיפול: F (1, 35) = 25.46, p < 0.0001; עוצמת קדם-דופק: F (2, 35) = 6.018, p = 0.0057, ללא אינטראקציה משמעותית: F (2, 35) = 0.8450, p = 0.4381). מבחן הפוסט-הוק של הולם-סידק, הראה מובהקות רק בעוצמות קדם-פולס של 50 (p = 0.0039) ו-53 (p = 0.0027), אך לא ב-56 dB (p = 0.0802).
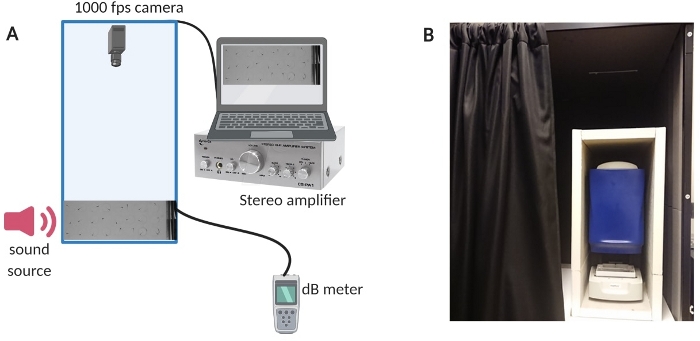
איור 1: מכשיר בדיקה. (א) סקירה כללית של מערך הציוד. (B) בידוד פנימי של ציוד ההתקנה כדי למזער רעשי רקע במהלך ניסויים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
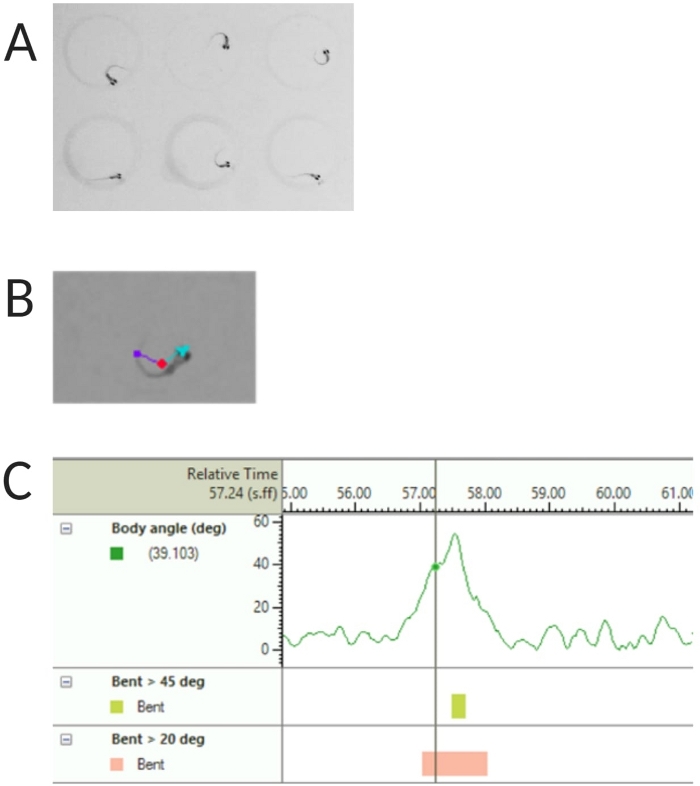
איור 2: ניתוח תגובת ההבהלה האקוסטית של דג הזברה הזחל. (A) התחלת C אופיינית שמוצגת על ידי 6 זחלי דג זברה ב-6 dpf. (B) תמונה מייצגת של שלושת המאפיינים המסומנים על גבי זחל של 6 dpf: נקודת מרכז (אדום), נקודת אף (ציאן) ובסיס זנב (סגול). (C) תמונה מייצגת של זווית הכיפוף המוחלטת שמוצגת על ידי זחלי בר מסוג TL 6-dpf. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
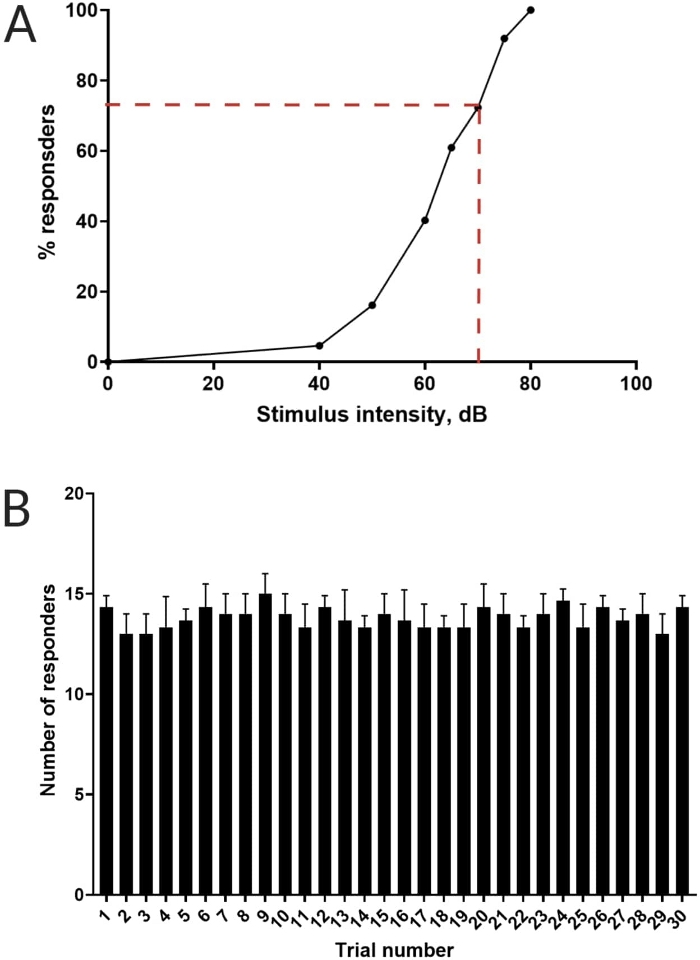
איור 3: קביעת סף הבהלה אקוסטית. (A) עוצמת גירוי של 70 dB (מיוצגת על ידי קווי מקף אדומים) מסוגלת לעורר תגובת C-start ב->70% מהזחלים (N = 33; 6 dpf TL). (B) הזחלים אינם מתרגלים לגירוי חוזר של 70 דציבל שהוצג 30 פעמים (ניסויים) במרווח בין ניסויים של 30 שניות (N = 3 משתכפל; 16 זחלים/משכפלים). הנתונים מוצגים כממוצע ± S.D. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
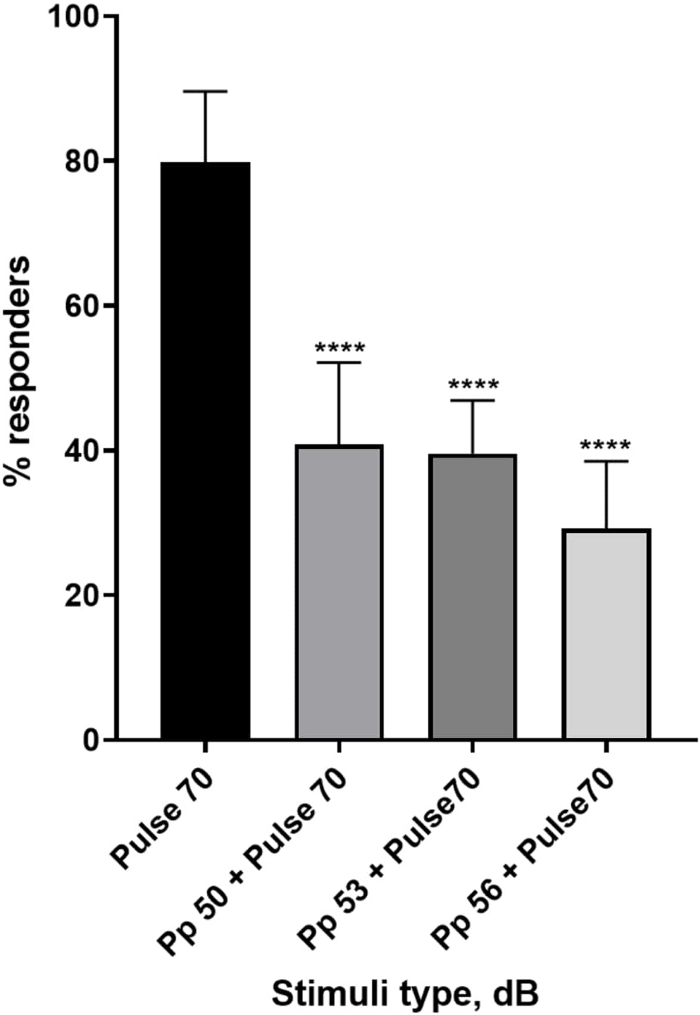
איור 4: ירידה בתגובת הזחל (%) הנגרמת לפני הדופק. גירויים לפני הדופק ב-20, 17 ו-14 דציבלים נמוכים מהגירוי המבהיל של 70 דציבלים גורמים להפחתה במספר המגיבים להתחלת C של זחלי TL מסוג בר. כל הנתונים מיוצגים כממוצע ± S.D., N = 5 (16 זחלים/קבוצה), ****p <-0.0001, שונה באופן משמעותי מגירוי הבהלה על ידי מבחן הפוסט-הוק של טוקי לאחר ANOVA חד-כיווני. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
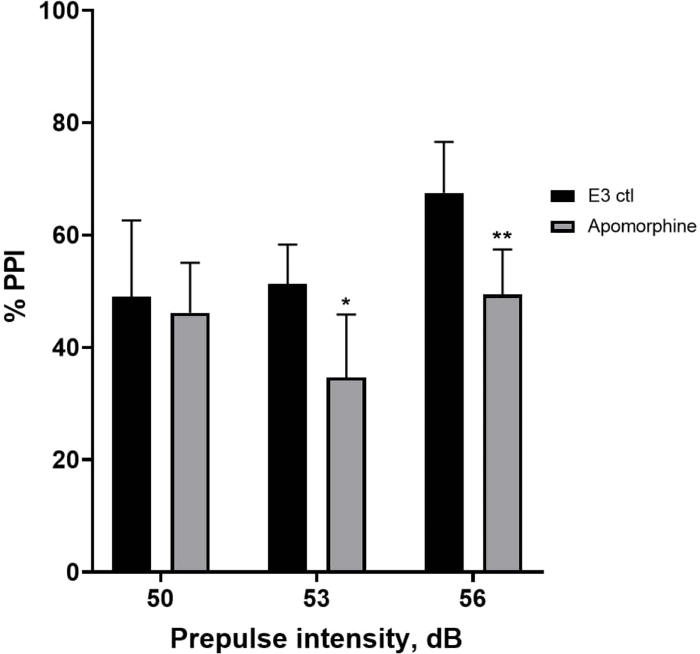
איור 5: גירעונות שנגרמו על ידי אפומורפין ב-%PPI. כל הנתונים מוצגים כממוצע ± S.D., N = 4-u20125 (16 זחלים לקבוצה), הבדל מובהק סטטיסטית על ידי מבחן הפוסט-הוק של הולם-סידק לאחר ANOVA דו-כיווני. *p = 0.0126, הקבוצה שטופלה ב-E3 ctl/אפומורפין ב-53 dB; **p = 0.0044, הקבוצה שטופלה ב-E3 ctl/אפומורפין ב-56 dB. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
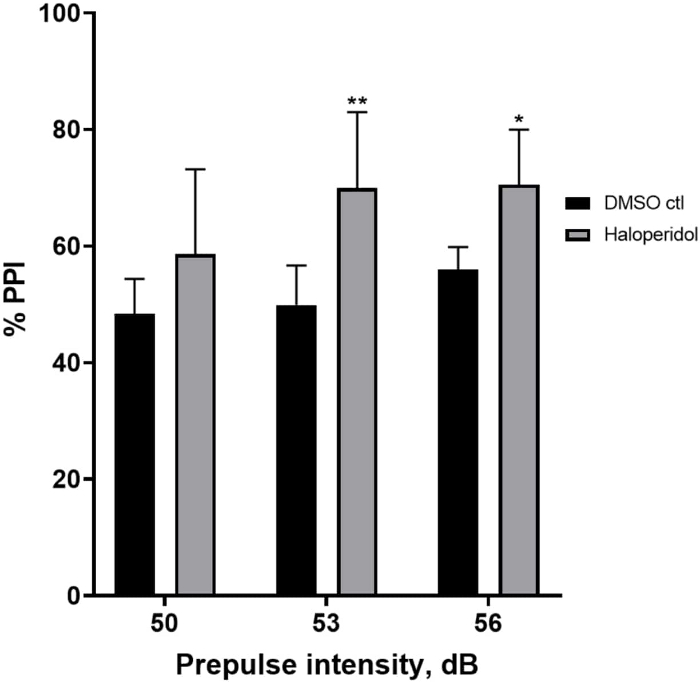
איור 6: שיפור המושרה על ידי הלופרידול ב-% PPI. כל הנתונים מוצגים כממוצע ± S.D., N = 4-u20125 (16 זחלים/קבוצה), הבדל מובהק סטטיסטית על ידי מבחן הפוסט-הוק של הולם-סידק לאחר אנובה דו-כיוונית. **p = 0.0048, קבוצה שטופלה ב-DMSO ctl/אפומורפין ב-53 dB; *p = 0.0348, קבוצה שטופלה ב-DMSO ctl/אפומורפין ב-56 dB. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
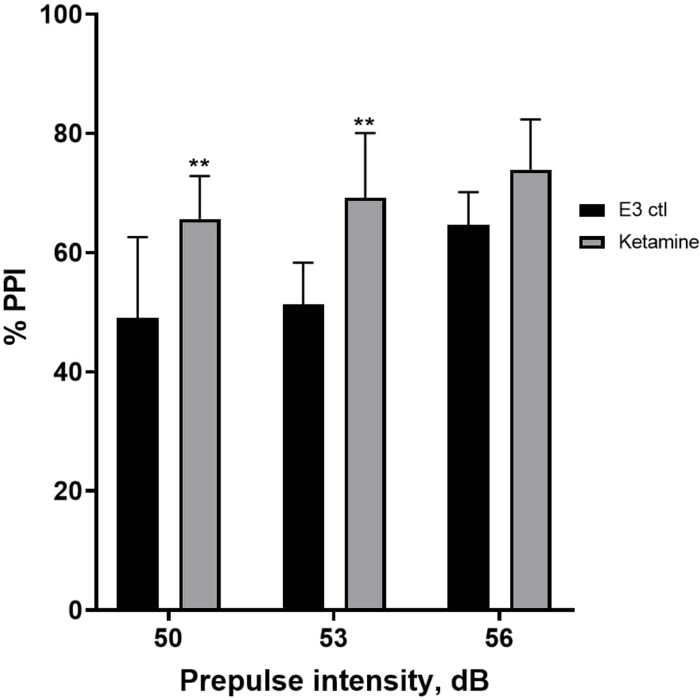
איור 7: שיפור המושרה על ידי קטמין ב-%PPI. כל הנתונים מיוצגים כממוצע ± S.D, N = 4-u20125 (16 זחלים/קבוצה), הבדל מובהק סטטיסטית על ידי מבחן הפוסט-הוק של הולם-סידק לאחר Anova דו-כיווני **p = 0.0039, E3 ctl/אפומורפין ב-50 dB, **p = 0.0027, E3 ctl/אפומורפין ב-53 dB. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
סרטון משלים 1: סרטון מייצג של זחלים המציגים התחלת C בתגובה לגירוי בהלה אקוסטי של 70 dB. אנא לחץ כאן להורדת סרטון זה.
איור משלים 1: דוגמאות מייצגות של תנאי גירוי שנוצרו באמצעות מחולל PPI. (א) ניסוי גירוי בלבד, (ב) ניסוי עיכוב טרום דופק (טרום דופק + דופק), (ג) ניסוי ללא גירוי למדידת זווית כיפוף סף בסיסית של זחלים לא מגורים. אנא לחץ כאן להורדת איור זה.
Discussion
חיוני לתקף כל מערכת בדיקה התנהגותית חדשה במטרה לשפר ולחדד פרוטוקולים למחקר נוירו-התנהגותי. במחקר הנוכחי, הוערכה היכולת של שתי מערכות ותוכנות זמינות מסחרית לגרום לתגובת בהלה אקוסטית בזחלי דג הזברה ולזהות ולכמת אפנון פרמקולוגי שתוארו בעבר של התנהגויות כאלה.
בוצעו מספר שינויים ופתרון בעיות כדי לייעל את ההגדרה. תוכנת ברירת המחדל לניתוח תגובות C-start הייתה כזו שהניתוח המשיך אוטומטית לאחר רכישת הנתונים עבור כל ניסוי (22 ניסויים / צלחת היוו ניסוי). זה הפחית את מספר הלוחות שניתן להפעיל ביום, ובכך הפחית את התפוקה (5 צלחות ליום). כדי להימנע ממגבלה זו, היה צורך לנתק את תוכנת הניתוח מתהליך איסוף הנתונים, מה שהגדיל את התפוקה לממוצע של 10 לוחות ליום. לפיכך, ההחלטה לפנות לתוכנת ניתוח עצמאית לניתוח לא חי הוכיחה את עצמה כמוצלחת ויעילה יותר. כדי למנוע הפרעות מצללים או פסולת אחרת המכניסים רעש לנתונים, מומלץ למלא בארות לחלוטין במדיום, להסיר את כל הבועות ולהימנע מחלקיקי מזון או דומים שעלולים להיחשב בטעות לזחלים, ובכך ליצור רעש בנתונים. לאחר כיול גירויי הקול, העוצמה המקסימלית שניתן להגיע אליה על ידי מערכת המגבר כפי שנלכדה על ידי מד ה-dB הייתה 85 dB re, בעוד שרעש הרקע הראשוני בתא הבדיקה היה 60 dB re. זה הביא לחלון dB צר לפעולה. לפיכך, היה קריטי לשמור על רעשי רקע מינימליים ככל האפשר. כדי להשיג זאת, נעשה שימוש בחומר אקוסטי של פרפון (ראה טבלת חומרים) לבניית שכבת בידוד נוספת סביב תא הבדיקה ושכבת בידוד נוספת באמצעות צרור תא קולי (ראה טבלת חומרים). עם שכבות בידוד אלה, רעשי הרקע בתוך תא הבדיקה הופחתו בהצלחה מ-60 dB הראשוניים ל-45 dB re.
נכון לעכשיו, יתרון אחד של מערך זה הוא שכל הרכיבים זמינים מסחרית וככאלה, אינם מוגבלים רק לכמה מעבדות. אנשים עם ידע מוגבל בשפת קידוד יכולים להשתמש בו, מכיוון שהפרוטוקול די קל להבנה ולביצוע. לדוגמה, על ידי שימוש במערכת PPI, ניתן היה להעביר פולסים ופולסים מקדימים במרווחי זמן משתנים בין גירויים ובין ניסויים, כמו גם ללכוד תגובות זחלים לגירויים כאלה. לאחר שנלכדו התנהגויות אלה, ניתן היה לסווג אותן באמצעות תוכנת הניתוח למגיבים ולא מגיבים. קבוצת המגיבים סווגה כזחלים שהראו התחלה C של 30 מעלות או יותר בהשהיה של <50 אלפיות השנייה. בנוסף, תגובת ה-PPI מווסתת על ידי תרופות המכוונות לאיתות דופמינרגי וגלוטמטרגי (נבדק על ידי גייר ועמיתיו27). בהתאם למחקרים קודמים, אפומורפין, אגוניסט קולטן דופמין לא סלקטיבי, הפחית את העיכוב לפני הדופק של תגובת הבהלה בדגי זברה זחלים, בעוד שהאלופרידול אנטגוניסט דופמין שיפר את התגובה. בדג זברה זחל, הוכח כי קטמין מווסת PPI באופן דיפרנציאלי בהתבסס על משך ה-ISI16. במחקר הנ"ל, PPI הזחל השתפר ב-30 אלפיות השנייה אך דוכא ב-500 אלפיות השנייה ISI כאשר טופל מראש בקטמין. למרות שמחקר זה לא השתמש ב-ISI משתנה, התצפית כי קטמין שיפר PPI ב-ISI של 100 אלפיות השנייה, הופכת אותו לדומה לנתוני המחקר הקודם כאשר נעשה שימוש ב-ISI של 30 אלפיות השנייה. המחקר הראה כי על ידי שילוב מערכות זמינות מסחריות אלה, ניתן לבצע את בדיקת ה-PPI ולזהות באופן אמין שינויים המושרים פרמקולוגית בתגובת ה-PPI של זחל דג הזברה. מגבלה של המערכת היא שתכונת נקודת האף שעוקבת אחריה תוכנת הניתוח נופלת תמיד על אחת מעיני הזחלים, ובכך יוצרת זווית בסיסית. כדי להתגבר על זה, יש צורך לקבוע תמיד את זווית הכיפוף הבסיסית של זחלים לא מגורים, שנמצאה כ~30 מעלות עבור זחלים ששימשו במחקר זה. לפיכך, מהווה את הבסיס לבחירה ב-30 מעלות כסף למה שנחשב לתגובת C חיובית בזחלים מבוהלים. אם נקודות אלה נלקחות בחשבון, אמור להיות אפשרי לבצע את בדיקת ה-PPI בכל מעבדה עם גישה לציוד ההגדרה. מאמר זה לא התמקד בסיווג הקינמטיקה של תגובת הבהלה לחביון קצר וחביון ארוך כפי שדווח קודם לכן16, בשל היקף השונות של השהיה. לפיכך, נעשה שימוש רק בתגובות C-start <50 אלפיות השנייה לאחר תחילת הגירוי15.
דווח על הבדלי זנים המשפיעים על התנהגות דג הזברה במספר בדיקות 28,29,30,31 וכן משפיעים על רגישות השמיעה 32. לפיכך, חיוני לקבוע את זווית הכיפוף הבסיסית של כל זן שנבדק. מכיוון שרגישויות השמיעה עשויות להיות שונות גם כן, חיוני לקבוע את תגובות ההבהלה הבסיסיות, את עוצמת הצליל המתאימה ביותר כגירוי קדם-דחף או בהלה עבור כל מאמץ ובאיזה משך מוצג הגירוי. ה-ISI הוא פרמטר נוסף שיש לשקול בזהירות מכיוון שתרופות מסוימות יכולות לשפר או להפחית PPI בהתבסס על המרווח בין הדחף להופעת גירוי ההבהלה16. הציפייה היא שמעבדות המעוניינות לחקור תפקוד קוגניטיבי, הפרעות נוירו-פסיכיאטריות ושמיעה (תפקוד שמיעתי) ימצאו את מערך ה-PPI והפרוטוקול הזה שימושי בסינון המודלים הפרמקולוגיים ו/או הגנטיים שלהן. פרוטוקול זה מספק גם בסיס לסינון תפוקה גבוהה של ספריות מורכבות.
Disclosures
המחברים מצהירים שאין אינטרסים פיננסיים מתחרים.
Acknowledgements
אנו מודים לאנה טווארה וז'ואאו פאולו ר.פ. סנטנה על טיפול מעולה בדגים ועזרה שלא תסולא בפז בבדיקה ובהקמה של התאים האטומים לרעש, ולד"ר ויצקה ואן דר אנט על התמיכה הראשונית בהגדרת תוכנת EthoVision. מחקר זה מומן על ידי מועצת המחקר של נורבגיה (ISP, BIOTEK2021/ DigiBrain).
Materials
| Name | Company | Catalog Number | Comments |
| Apomorphine | Sigma Aldrich | A4393 | Dopamine agonist |
| dB meter | PCE instruments | PCE-MSM 4 | For measuring stimulus intensity |
| DMSO | Sigma Aldrich | D8418 | For dissolving organic solutes |
| Dynavox Amplifier | Dynavox | CS-PA1 MK | For delivering acoustic stimuli |
| EthoVision XT | Noldus, Netherlands | EthoVision XT, version 14 | Automated tracking software |
| GraphPad Prism | GraphPad Software | Version 8 | Statistical analysis software |
| Haloperidol | Sigma Aldrich | H1512 | Dopamine antagonist |
| Ketamine | Sigma Aldrich | Y0000450 | NMDA receptor antagonist |
| parofon acoustics materials | Paroc | 8528308 | Helps reduce background noise in the test cabinet |
| t.akustik Vocal Booth Bundle | Thormann, Germany | 458543 | Helps reduce background noise in the test cabinet |
| ZebraBox Revo with PPI add-ons | ViewPoint, France | ZebraBox Revo with PPI add-ons | Includes hardware and software |
References
- Gawel, K., Banono, N. S., Michalak, A., Esguerra, C. V. A critical review of zebrafish schizophrenia models: Time for validation. Neuroscience & Biobehavioral Reviews. 107, 6-22 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Kalueff, A. V., Stewart, A. M., Gerlai, R. Zebrafish as an emerging model for studying complex brain disorders. Trends in Pharmacological Sciences. 35 (2), 63-75 (2014).
- Panula, P., et al. The comparative neuroanatomy and neurochemistry of zebrafish CNS systems of relevance to human neuropsychiatric diseases. Neurobiology of Disease. 40 (1), 46-57 (2010).
- Kokel, D., Peterson, R. T. Chemobehavioural phenomics and behaviour-based psychiatric drug discovery in the zebrafish. Briefings in Functional Genomics and Proteomics. 7 (6), 483-490 (2008).
- Basnet, R. M., Zizioli, D., Taweedet, S., Finazzi, D., Memo, M. Zebrafish Larvae as a Behavioral Model in Neuropharmacology. Biomedicines. 7 (1), 23(2019).
- Henry, J., Wlodkowic, D. Towards High-Throughput Chemobehavioural Phenomics in Neuropsychiatric Drug Discovery. Marine Drugs. 17 (6), (2019).
- Behavioural measurement system | Laval zebrafish | Drosophila | Daphnia | insects | Products | Zantiks. , Available from: https://zantiks.com/products/zantiks-mwp (2020).
- Product List - ViewPoint. , Available from: http://www.viewpoint.fr/en/products (2020).
- Observation chamber for zebrafish research - DanioVision. , Available from: https://www.noldus.com/daniovision/observation-chamber (2020).
- EthoVision XT - Video tracking software | Noldus. , Available from: https://www.noldus.com/ethovision-xt (2020).
- Gould, T. D., Gottesman, I. I. Psychiatric endophenotypes and the development of valid animal models. Genes, Brain and Behavior. 5 (2), 113-119 (2006).
- van den Buuse, M. Modeling the Positive Symptoms of Schizophrenia in Genetically Modified Mice: Pharmacology and Methodology Aspects. Schizophrenia Bulletin. 36 (2), 246-270 (2010).
- Acoustic startle modification as a tool for evaluating auditory function of the mouse: Progress, pitfalls, and potential. Abstract - Europe PMC. , Available from: https://europepnc.org/article/PMC/5446932 (2020).
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. Journal of Experimental Biology. 216 (18), 3504-3513 (2013).
- Burgess, H. A., Granato, M. Sensorimotor Gating in Larval Zebrafish. Journal of Neuroscience. 27 (18), 4984-4994 (2007).
- Eaton, R. C., Farley, R. D., Kimmel, C. B., Schabtach, E. Functional development in the mauthner cell system of embryos and larvae of the zebra fish. Journal of Neurobiology. 8 (2), 151-172 (1977).
- SR-LAB - San Diego Instruments Startle Response. San Diego Instruments. , Available from: https://sandiegoinstruments.com/product/sr-lab-startle-response/ (2020).
- Startle packages - Med Associates Inc. Med Associates Inc. , Available from: https://www.med-associates.com/product-category/acoustic-startle-reflex-packages/ (2020).
- Startle response & Pre-pulse inhibition test. O'HARA & CO.,LTD. , Available from: https://ohara-time.co.jp/products/startle-response-pre-pulse-inhibition-test/ (2020).
- Thyme, S. B., et al. Phenotypic Landscape of Schizophrenia-Associated Genes Defines Candidates and Their Shared Functions. Cell. 177 (2), 478-491 (2019).
- Privat, M., et al. Sensorimotor Transformations in the Zebrafish Auditory System. Current Biology. 29 (23), 4010-4023 (2019).
- Gerlai, R. Reproducibility and replicability in zebrafish behavioral neuroscience research. Pharmacology Biochemistry and Behavior. 178, 30-38 (2019).
- Add-on - Fast camera 1000 FPS - ViewPoint. , Available from: http://www.viewpoint.fr/app.php/en/p/equipment/add-on-fast-camera (2020).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. , (2019).
- Bhandiwad, A. A., Sisneros, J. A. Revisiting Psychoacoustic Methods for the Assessment of Fish Hearing. Fish Hearing and Bioacoustics: An Anthology in Honor of Arthur N. Popper and Richard R. Fay. , 157-184 (2016).
- Geyer, M. A., Krebs-Thomson, K., Braff, D. L., Swerdlow, N. R. Pharmacological studies of prepulse inhibition models of sensorimotor gating deficits in schizophrenia: a decade in review. Psychopharmacology. 156 (2-3), 117-154 (2001).
- Lange, M., et al. Inter-Individual and Inter-Strain Variations in Zebrafish Locomotor Ontogeny. PLOS ONE. 8 (8), 70172(2013).
- Liu, X., et al. Strain-dependent differential behavioral responses of zebrafish larvae to acute MK-801 treatment. Pharmacology Biochemistry and Behavior. 127, 82-89 (2014).
- Loucks, E., Carvan, M. J. Strain-dependent effects of developmental ethanol exposure in zebrafish. Neurotoxicology and Teratology. 26 (6), 745-755 (2004).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLOS ONE. 12 (4), 0175420(2017).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hearing research. 341, 220-231 (2016).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved