Method Article
Validación farmacológica de la inhibición prepulsada de la respuesta de sobresalto en larvas de pez cebra utilizando un sistema y software automatizados comerciales
En este artículo
Resumen
Aquí describimos un protocolo que utiliza sistemas automatizados disponibles comercialmente para validar farmacológicamente el ensayo de inhibición prepulso (PPI) en larvas de pez cebra.
Resumen
Si bien existe una gran cantidad de sistemas y software automatizados comerciales y estandarizados para realizar el ensayo de inhibición previa al pulso (PPI) en roedores, hasta donde sabemos, todos los ensayos de PPI realizados en el pez cebra se han realizado, hasta ahora, utilizando sistemas personalizados que solo estaban disponibles para grupos individuales. Por lo tanto, esto ha planteado desafíos, en particular con respecto a las cuestiones de reproducibilidad y normalización de los datos. En el presente trabajo, generamos un protocolo que utiliza sistemas automatizados disponibles comercialmente para validar farmacológicamente el ensayo PPI en larvas de pez cebra. De acuerdo con los hallazgos publicados, pudimos replicar los resultados de apomorfina, haloperidol y ketamina en la respuesta PPI de las larvas de pez cebra después de la fertilización de 6 días.
Introducción
La larva de pez cebra (Danio rerio) es una candidata adecuada para modelar enfermedades psiquiátricas como la esquizofrenia (revisada por Gawel et al.1) debido a las numerosas ventajas que posee. Estos incluyen un genoma completamente secuenciado con un 70% de homología de secuencia con los ortólogos humanos2, la existencia de herramientas genéticas directas e inversas para manipular el genoma e identificar la contribución de un gen dado al desarrollo o la enfermedad3, y la presencia de los principales neurotransmisores humanos/roedores en el cerebro del pez cebra4. Existe la disponibilidad de varios dominios neurofenotípicos en el pez cebra, como la ansiedad, el aprendizaje y la memoria3. La transparencia óptica y la sensibilidad a las principales clases de fármacos neurotrópicos lo convierten en un candidato ideal de elección para las manipulaciones farmacológicas y el cribado fenotípico de fármacos 5,6.
Para realizar el cribado de fármacos de alto rendimiento, es muy importante la automatización y la presencia de un endofenotipo robusto7. Por ejemplo, se han desarrollado una variedad de técnicas de registro automático para medir el comportamiento de las larvas de pez cebra, como la tigmotaxis, la respuesta de sobresalto, la respuesta optocinética, la respuesta optomotora, la habituación, la captura de presas, el comportamiento de sueño/vigilia, el comportamiento locomotor y varias otras6. Si bien algunos laboratorios desarrollan sistemas personalizados para mediciones y análisis automatizados de algunos de estos comportamientos, existen sistemas de imágenes y software disponibles comercialmente 8,9,10,11. La inhibición prepulsal (PPI), una forma de activación sensoriomotora en la que la respuesta de sobresalto se reduce cuando un estímulo débil no sobresaltante se presenta brevemente antes del estímulo sobresaltante, se ha utilizado como endofenotipo para estudiar la esquizofrenia en modelos animales (revisado por12,13). Además, la respuesta acústica de sobresalto (ASR) y los IBP han desempeñado un papel útil en el estudio de la audición y la función auditiva en modelos animales, incluido el pez cebra14,15. Las larvas de pez cebra muestran un inicio C característico en respuesta a un estímulo inesperado y sorprendente que se ve disminuido por un estímulo más débil llamado prepulso. El C-start ha sido descrito durante mucho tiempo como un comportamiento de escape controlado por distintas poblaciones de células neuronales y ha sido ampliamente caracterizado en las larvas de pez cebra 15,16,17.
Existe una gran cantidad de sistemas y software automatizados comerciales y estandarizados para realizar el ensayo PPI en roedores 18,19,20. Sin embargo, hasta donde sabemos, todos los ensayos de IBP realizados en el pez cebra hasta ahora se han realizado utilizando sistemas hechos a medida que solo están disponibles para los grupos individuales 15,16,21,22. Esto plantea desafíos para lograr la reproducibilidad y replicabilidad de los datos con respecto a la normalización23.
Recientemente, un proveedor conocido en la comunidad del pez cebra desarrolló una configuración integrada con una cámara rápida y complementos de generador de PPI para llevar a cabo el ensayo PPI en larvas de pez cebra24. La cámara graba a 1000 fotogramas por segundo, lo que permite la grabación de comportamientos de acción rápida, como el C-start, mientras que el generador PPI permite la entrega controlada por el usuario de varios estímulos acústicos para evocar una respuesta de sobresalto24. Aquí, combinamos el sistema antes mencionado con un paquete de software integral disponible comercialmente diseñado para el análisis automatizado de comportamientos complejos11, para generar un protocolo para realizar ensayos de respuesta a PPI en larvas de pez cebra. Validamos farmacológicamente la respuesta al IBP utilizando 1) apomorfina, un agonista de la dopamina conocido por causar déficits en el IBP; 2) haloperidol, un antagonista de la dopamina y antipsicótico conocido por mejorar los IBP y 3) ketamina, un antagonista del receptor NMDA conocido por modular los IBP.
Protocolo
Todos los experimentos con animales fueron aprobados por el sistema de supervisión y aplicación de la Administración de Animales Experimentales de la Autoridad Noruega de Seguridad Alimentaria (FOTS-18/106800-1).
1. Cría de pez cebra
- Establecer apareamientos de poblaciones de peces cebra (Danio rerio) adultos machos y hembras de tipo salvaje, mantenidos en condiciones estándar25 la noche anterior. En este caso, se utiliza la cepa Tupfel de aleta larga (TL).
- Retire las barreras a la mañana siguiente y permita aparearse a través del desove natural.
- Recoge los huevos de los tanques de apareamiento.
- Retire los huevos no fertilizados y otros desechos, luego transfiera los huevos a placas de Petri (n = 60) y créelos en una incubadora a 28 °C en medio embrionario: 1,5 mM HEPES, pH 7,6, 17,4 mM NaCl, 0,21 mM KCl, 0,12 mM MgSO4 y 0,18 mM Ca(NO3)2.
- Renueve la mitad del medio embrionario y retire las larvas muertas diariamente hasta 6 dpf.
NOTA: Todos los experimentos se realizaron en larvas individuales a los 6 días después de la fertilización (dpf).
2. Agentes farmacológicos y pretratamiento de larvas
- Disuelva la apomorfina y la ketamina en el medio E3 para hacer soluciones madre de 500 μM y 10 mM respectivamente.
- Disuelva el haloperidol en dimetilsulfóxido (DMSO) al 100% para hacer una solución madre de 10 mM. La concentración final de DMSO utilizada fue de 0,1%.
- Utilice 0.1% DMSO y E3 medio como controles del vehículo.
- Utilice las siguientes concentraciones finales de fármacos: 10 mg/mL de apomorfina, 1 mM de ketamina y 20 μM de haloperidol16.
- Preexponer las larvas de los grupos de apomorfina y ketamina durante 10 min y los grupos de control de vehículos de haloperidol y DMSO durante 20 min16.
3. Configuración previa a la prueba de comportamiento
- El día del experimento, transfiera las larvas y todos los materiales relevantes a la sala de experimentos. Ajuste la sala de experimentos a una temperatura de 27 ± 1 °C.
- Asegúrese de que el ruido de fondo en la cámara de prueba sea lo más bajo posible, preferiblemente no más de 45 dB de nivel de presión sonora (SPL).
- Instale el micrófono del sonómetro del medidor de decibelios (dB) en la cámara de prueba (la apertura para la instalación ya está perforada por el fabricante).
- Para reducir el ruido de fondo en la habitación, aísle la cámara de prueba con una cabina de sonido hecha a medida (consulte la Figura 1B para obtener una descripción general de la configuración).
- Prepare una placa de 96 pocillos para la prueba de inhibición previa al pulso.
NOTA: La cámara de video tiene una resolución de 2048 × 500 píxeles, lo que significa que solo se pueden obtener imágenes de un máximo de 3 carriles (33 pocillos) a la vez.- Utilice una placa acrílica hecha a medida en formato de 96 pocillos para reducir la interferencia de las sombras.
NOTA: Las medidas de la placa personalizada se pueden encontrar en el siguiente sitio web: https://zenodo.org/record/3739378#.XooyLW5uKas
- Utilice una placa acrílica hecha a medida en formato de 96 pocillos para reducir la interferencia de las sombras.
- Con la ayuda de una pipeta de transferencia, transfiera 310 μL de solución/medio de exposición con una larva a cada pocillo.
- Calibra y mide la intensidad del estímulo usando la perilla de volumen del amplificador estéreo y un medidor de decibelios respectivamente.
- Registre la intensidad sonora máxima en la sección "referencia de nivel".
4. Parámetros de estímulo y adquisición de vídeo
- Encienda la computadora, el sistema amplificador y el medidor de dB (consulte la Figura 1A para obtener una descripción general de la configuración).
- Use la perilla de volumen girándola al mínimo o al máximo para ajustar la intensidad del sonido.
- Verifique el nivel de sonido con el medidor de dB cada vez, se ajusta la perilla de volumen. Esto es importante para encontrar la intensidad sonora máxima y mínima que puede producir la configuración.
NOTA: El medidor de dB calcula la salida RMS dB para el estímulo. El sistema genera el sonido dentro de los componentes sólidos de la cámara de pruebas, manteniendo la placa firme mientras produce una vibración en el plano horizontal de todo el soporte de la placa.- Ajuste la perilla de volumen al máximo, mida la intensidad del sonido con el medidor de dB y use este valor.
- Verifique el nivel de sonido con el medidor de dB cada vez, se ajusta la perilla de volumen. Esto es importante para encontrar la intensidad sonora máxima y mínima que puede producir la configuración.
- En la interfaz del generador de PPI, defina los parámetros: intervalo entre estímulos representado como Delay; intervalo entre ensayos representado como tiempo delta de adquisición; duración del prepulso, etc.
- Para los ensayos de prepulso solo, asegúrese de que la "Amplitud" o la Duración del estímulo para los parámetros de sobresalto estén establecidos en cero y viceversa para los ensayos de sobresalto solo.
- Para generar una lista de pruebas, seleccione Agregar > asigne un nombre a la versión de prueba. Por ejemplo, "Prepulso 50 dB solo".
NOTA: Se pueden generar tantas pruebas como se desee, pero tenga cuidado con la longitud de la lista, ya que esto puede colapsar el programa.- Intercalar ensayos de prepulso con ensayos de pulso solo en todos los experimentos de PPI utilizando un orden pseudoaleatorio. Cuando se presentan múltiples estímulos en un experimento, se utiliza un intervalo entre ensayos (ITI) de 30 s.
NOTA: En este estudio, se utilizaron un estímulo de sobresalto de 100 ms (pulso) de 660 Hz, y estímulos de prepulso de 5 ms de 440 Hz. Para los experimentos de PPI, el intervalo entre estímulos (ISI) fue de 100 ms.
- Intercalar ensayos de prepulso con ensayos de pulso solo en todos los experimentos de PPI utilizando un orden pseudoaleatorio. Cuando se presentan múltiples estímulos en un experimento, se utiliza un intervalo entre ensayos (ITI) de 30 s.
- Para guardar el protocolo, seleccione Archivo > Guardar como.
- Ajuste las condiciones de iluminación en la cámara de prueba de la siguiente manera.
- Inicie la computación de medición USB, seleccione salida analógica y luego vaya a D/A OUT O (P13) para realizar cambios en la iluminación. Un valor de cero significa que no hay luz, mientras que al aumentar el valor D/A Out O, aumenta la intensidad de la luz en la caja. Se utilizó una intensidad de luz de 100 para todos los experimentos.
- Configurar la cámara
- Inicie el software y espere a que se cargue la cámara.
- Seleccione Ajustes (que se encuentra en el lado derecho) y establezca la velocidad de fotogramas de adquisición en 1,000, luego haga clic en aplicar para efectuar el cambio.
- Aclimatar las larvas a una cámara de prueba iluminada al 100% con luz durante 5 minutos antes de comenzar los experimentos.
- Para comenzar un experimento, seleccione el menú Experimento en el generador de PPI, haga clic en Ejecutar y seleccione el formato de pozo (por ejemplo, 33 pocillos).
- Asegúrese siempre de que el software de la cámara se inicie con la configuración correcta antes de realizar un experimento.
- Adquiera un video de 2 s para cada prueba.
- Asegúrese de que la velocidad de fotogramas de adquisición esté establecida en 1.000.
5. Seguimiento y análisis automatizados de la respuesta de sobresalto acústico y PPI
- Configuración del protocolo.
- Inicie el software de análisis (consulte la Tabla de materiales). Elija Nuevo de plantilla > Aplicar una plantilla predefinida y, a continuación, vaya a otros menús (detalles a continuación).
- Elija un archivo de video en Fuente de video.
- Examinar archivo de vídeo. Establezca el sujeto como plantilla de zona de > de larvas de pez > cebra (sin plantilla). Especifique Número de arenas en Arenas.
- Especifique el número de sujetos por arena (establecido como 1) en Asuntos.
- Seleccione Detección de punto central, punto de nariz y base de cola en Entidades rastreadas (consulte la Figura 2A,B).
NOTA: Esto es importante para calcular el ángulo del cuerpo de la respuesta de arranque en C (consulte la Figura 2C). - Haga clic en Nombre > guardar como. Las unidades utilizadas son mm, s, grados para distancia, tiempo y rotación respectivamente.
NOTA: Recuerde utilizar la misma unidad para calibrar la báscula.
- Elija la configuración de la Arena.
- Haz clic en Capturar imagen de fondo.
- Siga los pasos en el menú de la derecha (en caso de duda, use el menú Ayuda ).
- Elige la herramienta de dibujo circular para dibujar las arenas.
- Elija Configuración de control de prueba > crear un nuevo nombre de >.
- Elija Configuración de detección, siga los pasos en el menú de la derecha.
- Establezca la frecuencia de muestreo en 25. Elija la configuración de detección avanzada. En Método, seleccione sustracción dinámica, modelo avanzado/pez adulto y, a continuación, establezca el color del sujeto en comparación con el fondo como Más oscuro y mueva el control deslizante para definir el contraste de la larva.
- En el contorno del sujeto, seleccione primero la erosión, luego dilate y aumente los valores de erosión y dilatación del contorno hasta que el animal se detecte por completo.
- Guarde el protocolo y utilícelo para análisis posteriores de los vídeos PPI adquiridos.
- Inicie el software de análisis (consulte la Tabla de materiales). Elija Nuevo de plantilla > Aplicar una plantilla predefinida y, a continuación, vaya a otros menús (detalles a continuación).
- Configuración de la lista de pruebas.
- Elija la lista de ensayos, defina variables independientes como la identificación de la larva, el tratamiento, el tipo de estímulo, etc. Seleccione la ruta de los vídeos y defina una lista de pruebas para la adquisición por lotes.
- Configuración de adquisición.
NOTA: Si se ha generado una lista de prueba, se puede realizar una adquisición por lotes de los videos.- Si se pierden algunas pistas, utilice el editor de pistas para ajustar las características de las pistas.
- Excluya del análisis los errores de seguimiento que permanezcan sin resolver después de utilizar el editor de seguimiento.
- Establezca el perfil de suavizado de pista en 1 mm para disminuir el ruido de los datos. Esto se puede ajustar en función de la actividad de fondo de las larvas.
- Configuración del análisis.
- Para seleccionar los ensayos que se van a analizar, elija Perfiles de datos y defina los recorridos en función de la variable independiente de interés.
NOTA: Si los componentes están ocultos, haga clic en el símbolo del ojo en la esquina superior derecha para mostrarlo.- Filtre las partes de los ensayos que se van a analizar (por ejemplo, según el tratamiento o el tipo de grupo de estímulo).
- Seleccionar parte de las pistas a analizar (anidamiento). Para este estudio, los datos se anidaron para las pistas entre el inicio del estímulo y 100 ms después del inicio del estímulo.
- Recuerde conectar todos los filtros y cajas anidantes con líneas de flecha para completar la instrucción.
- Defina las variables dependientes que se van a analizar, seleccione Perfiles de análisis y especifique las variables de interés (concéntrese en Cuerpo en Variables dependientes).
NOTA: Si los componentes están ocultos, haga clic en el símbolo del ojo en la esquina superior derecha para mostrarlo.- Doble clic Ángulo del cuerpo. Seleccione la curva absoluta. Vaya a Configuración de prueba y seleccione máximo, luego haga clic en agregar.
- Haga doble clic en el estado del ángulo del cuerpo. Establezca el intervalo de promedio en 5 muestras. Establezca el umbral del ángulo de curvatura. Para calcular las estadísticas de Bend, vaya a Estadísticas de prueba y seleccione Latencia para > primer agregar. Repita los pasos hasta obtener umbrales variables (se utilizó entre 20 y 80°) y asigne un nombre en consecuencia.
- Generación de estadísticas y gráficos.
- Selecciona análisis > resultados > estadísticas y gráficos y, a continuación, haz clic en calcular.
- Asegúrese de que los perfiles de datos y análisis estén configurados en la plantilla correcta, ya que se pueden crear varias plantillas en cada sección.
- Exporte estadísticas de prueba y grupo como archivos de hoja de cálculo para su procesamiento y análisis.
- Para seleccionar los ensayos que se van a analizar, elija Perfiles de datos y defina los recorridos en función de la variable independiente de interés.
6. Análisis de datos
- Abra el archivo de hoja de cálculo que contiene las estadísticas del ensayo.
- Seleccione las columnas Ángulo del cuerpo Grados máximos, Latencia de flexión (de los distintos umbrales de ángulo del cuerpo).
- Considere cada cambio en el ángulo del cuerpo ≥ 30° dentro de una latencia de corte de 50 ms después del inicio del estímulo como una respuesta positiva de inicio C (es decir, un respondedor); Aquellos con < ángulo corporal de 30° no responden.
- De forma binaria, asigne 1 a una larva que responda y 0 a las larvas que no respondan para cada placa.
- Cuente el número total de larvas respondedoras y no respondedoras para cada placa. Calcule los respondedores (%) en cada caso calculado como (número de larvas que responden/número total de larvas) × 100. Excluir del análisis las larvas que respondan menos del 30% al estímulo de sobresalto16.
NOTA: Cualquier intensidad de estímulo capaz de provocar una respuesta de inicio C igual o superior al 70% de las larvas se considera un estímulo de sobresalto adecuado16.
- Cuente el número total de larvas respondedoras y no respondedoras para cada placa. Calcule los respondedores (%) en cada caso calculado como (número de larvas que responden/número total de larvas) × 100. Excluir del análisis las larvas que respondan menos del 30% al estímulo de sobresalto16.
- Calcule el %PPI como 100 × (porcentaje que responde al estímulo de sobresalto − porcentaje que responde al prepulso + secuencia de sobresalto)/ (porcentaje que responde al estímulo de sobresalto)16.
7. Análisis estadístico
- Presente los datos como la media ± la desviación estándar, S.D. (consulte la Tabla de materiales para software estadístico).
- Determinar los efectos de las intensidades variables de prepulso en la respuesta de las larvas utilizando ANOVA de un factor seguido de una prueba post-hoc de Tukey.
- Utilice el ANOVA de dos factores seguido de la prueba post-hoc de Holm-Sidak para determinar los efectos del tratamiento farmacológico sobre la respuesta del % de IBP con diferentes intensidades de prepulso.
Resultados
Se realizaron tres experimentos para validar el protocolo de combinación de múltiples sistemas para analizar la inhibición prepulso de la respuesta de sobresalto acústico en las larvas de pez cebra. En primer lugar, se probó la capacidad de transmitir con precisión estímulos acústicos y de capturar la respuesta de las larvas al estímulo de sobresalto. A continuación, se validó la capacidad de atenuar la respuesta de sobresalto cuando se presenta un estímulo previo al pulso. Finalmente, se estableció la capacidad de detectar la modulación farmacológica de la inhibición prepulso de la respuesta de sobresalto por los fármacos apomorfina, haloperidol y ketamina.
Respuesta de las larvas de pez cebra a los estímulos acústicos de sobresalto
Trabajos anteriores han demostrado que las larvas de pez cebra muestran un inicio C característico cuando se les presenta un estímulo acústico sorprendente16. Se probó la capacidad de incitar y capturar el comportamiento de las larvas a los estímulos de sobresalto. Se observó que las larvas registradas mostraban la respuesta C-start (Figura 2). Un estímulo de 70 dB re (100 ms, 660 Hz, Figura suplementaria 1A) fue lo suficientemente fuerte como para provocar una respuesta en el ≥70% de las larvas (Figura 3A). Cuando se presentó repetidamente 30 veces en un intervalo entre ensayos de 30 s, el re estímulo de 70 dB no resultó en habituación larvaria (N = 3 repeticiones; 16 larvas/replicación), como se muestra en la Figura 3B.
El prepulso disminuye la respuesta de sobresalto de las larvas de pez cebra a los estímulos acústicos
Una plétora de evidencias muestra que los estímulos previos al pulso modulan la respuesta de las larvas a un estímulo de sobresalto 15,21,22,26. Se utilizó un paradigma de dos pulsos, donde un estímulo débil llamado prepulso precedió al estímulo inductor de sobresalto llamado pulso. Los estímulos de prepulso utilizados fueron 20, 17 o 14 dB menos que el estímulo de pulso que se estableció en 70 dB re. El prepulso (5 ms, 440 Hz) siempre se presentó 100 ms antes del inicio del pulso (Figura suplementaria 1B). Cada estímulo previo al pulso probado redujo significativamente la respuesta de las larvas al pulso. En la Figura 4 se muestra la respuesta larvaria (en %) a los estímulos acústicos de sobresalto para 6 dpf TL en medio E3, N = 6 (16 larvas/grupo). El porcentaje de larvas que respondieron al estímulo de sobresalto (pulso) fue de 79,86 ± 9,772. Como era de esperar, cuando el estímulo de sobresalto fue precedido por un prepulso de 50, 53 o 56 dB, la respuesta larvaria disminuyó a 40,87% ± 11,30%, 39,58% ± 7,345% y 29,17% ± 9,350% respectivamente. El análisis de Anova de un factor reveló una diferencia estadística en el efecto del estímulo en las larvas (F (3, 48) = 57,23, P < 0,0001) con la prueba de comparaciones múltiples de Tukey que reveló significación estadística entre los grupos con un intervalo de confianza del 95%.
Modulación farmacológica de la inhibición prepulso
Estudios previos mostraron que los fármacos dopaminérgicos, apomorfina y haloperidol, así como el fármaco glutamatérgico, ketamina, modulaban significativamente la inhibición prepulso enlarvas, al igual que en sus equivalentes de mamíferos y roedores. Las concentraciones para la validación de la configuración se seleccionaron con base en estos estudios. El intervalo interestímulo (ISI) para todos los experimentos farmacológicos fue de 100 ms.
Efecto de la apomorfina en la inhibición prepulso
En la Figura 5, las larvas pretratadas con 10 mg/mL de apomorfina durante 10 min mostraron una reducción general en el % de PPI en comparación con las larvas control E3 (ANOVA de dos vías, no RM (factores: tratamiento e intensidades de prepulso; tratamiento: F (1, 34) = 16.21, p = 0.0003; intensidad de prepulso: F (2, 34) = 8.674, P = 0.0009, esto mostró una interacción no significativa: F (2, 34) = 2.514, p = 0,0959). Para investigar las diferencias con más detalle, la prueba post-hoc de Holm-Sidak reveló diferencias significativas en la respuesta de sobresalto entre el control E3 y las larvas tratadas con apomorfina a las intensidades prepulso 53 (p = 0,0126) y 56 (p = 0,0044) pero no a 50 dB (p = 0,5813).
Efecto del haloperidol sobre la inhibición prepulso
La Figura 6 muestra un aumento general en el % de PPI en las larvas pretratadas durante 20 min con haloperidol de 20 μM en comparación con las del medio E3 (ANOVA de dos vías, no RM (factores: intensidades de tratamiento y prepulso; tratamiento: F (1, 32) = 20,75, p < 0,0001; intensidad de prepulso: F (2, 32) = 3,147, p = 0,0565, sin interacción significativa: F (2, 32) = 0,7455, p = 0,4826). Utilizando la prueba post-hoc de Holm-Sidak, se observó presencia de significación estadística solo a las intensidades prepulso 53 (p = 0,00489 y 56 (p = 0,0348) pero no a 50 dB (p = 0,067).
Efecto de la ketamina en la inhibición previa al pulso
La Figura 7 muestra que a diferentes intensidades de estímulo previo al pulso, hubo diferencias en la respuesta de sobresalto entre las larvas de control E3 y las pretratadas durante 10 min en ketamina 1.0 mM (ANOVA de dos vías, no RM (factores: tratamiento e intensidades de prepulso; tratamiento: F (1, 35) = 25.46, p < 0.0001; intensidad de prepulso: F (2, 35) = 6.018, p = 0.0057, sin interacción significativa: F (2, 35) = 0,8450, p = 0,4381). La prueba post-hoc de Holm-Sidak mostró significación solo a intensidades prepulso de 50 (p = 0,0039) y 53 (p = 0,0027), pero no a 56 dB (p = 0,0802).
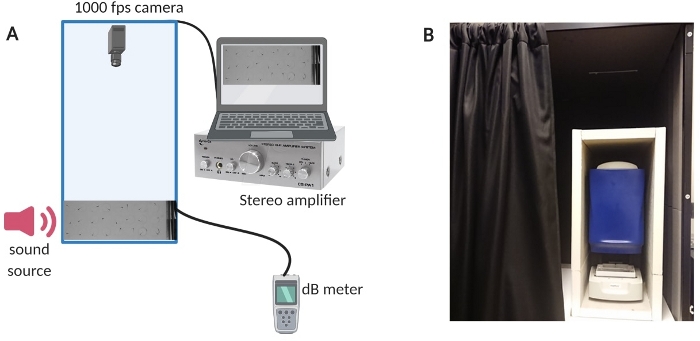
Figura 1: Aparato de prueba. (A) Visión general de la configuración del equipo. (B) Aislamiento interno del equipo de configuración para minimizar el ruido de fondo durante los experimentos. Haga clic aquí para ver una versión más grande de esta figura.
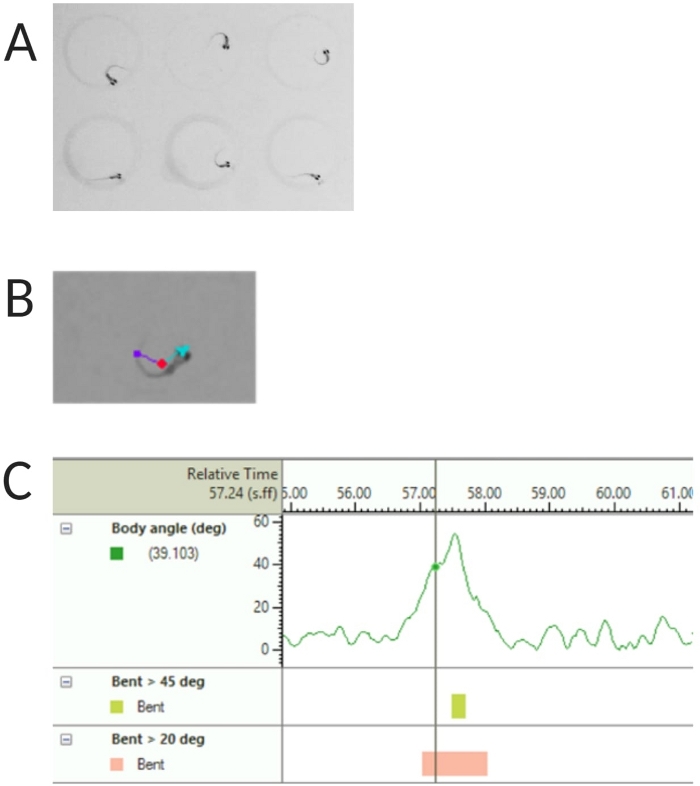
Figura 2: Análisis de la respuesta acústica de sobresalto de las larvas de pez cebra. (A) Característica C-start mostrada por 6 larvas de pez cebra a 6 dpf. (B) Imagen representativa de las tres características rastreadas superpuestas a una larva de 6 dpf: punto central (rojo), punta de la nariz (cian) y base de la cola (púrpura). (C) Imagen representativa del ángulo de curvatura absoluto mostrado por una larva de tipo salvaje TL de 6 dpf. Haga clic aquí para ver una versión más grande de esta figura.
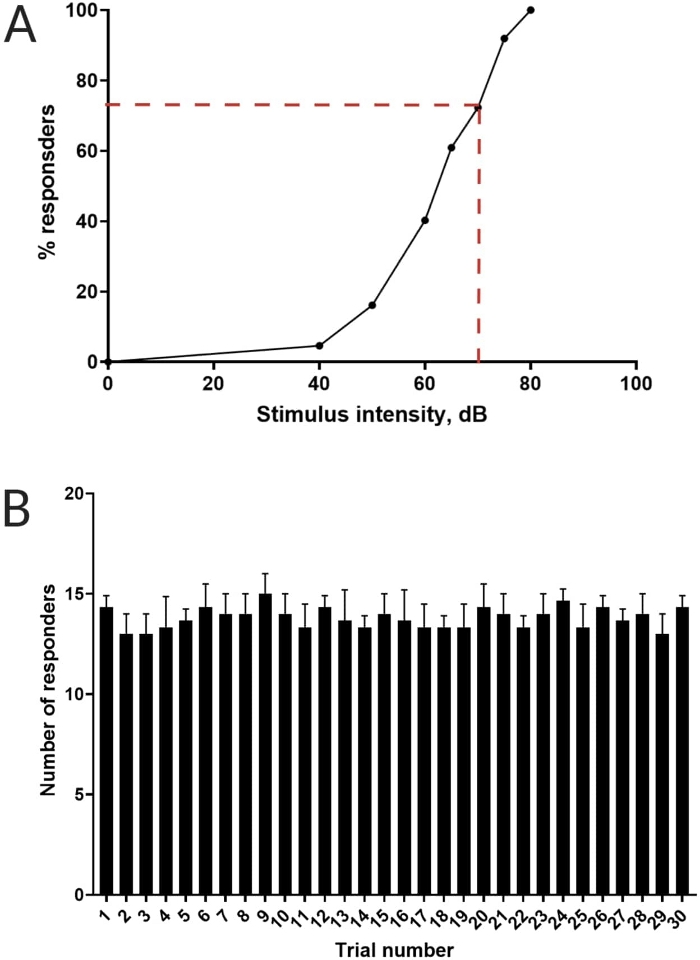
Figura 3: Determinación del umbral de sobresalto acústico. (A) Una intensidad de estímulo de 70 dB (representada por líneas discontinuas rojas) es capaz de provocar una respuesta de inicio C en el >70% de las larvas (N = 33; 6 dpf TL). (B) Las larvas no se habitúan a un estímulo de 70 dB presentado 30 veces (ensayos) en un intervalo entre ensayos de 30 s (N = 3 repeticiones; 16 larvas/replicación). Los datos se presentan como media ± S.D. Haga clic aquí para ver una versión más grande de esta figura.
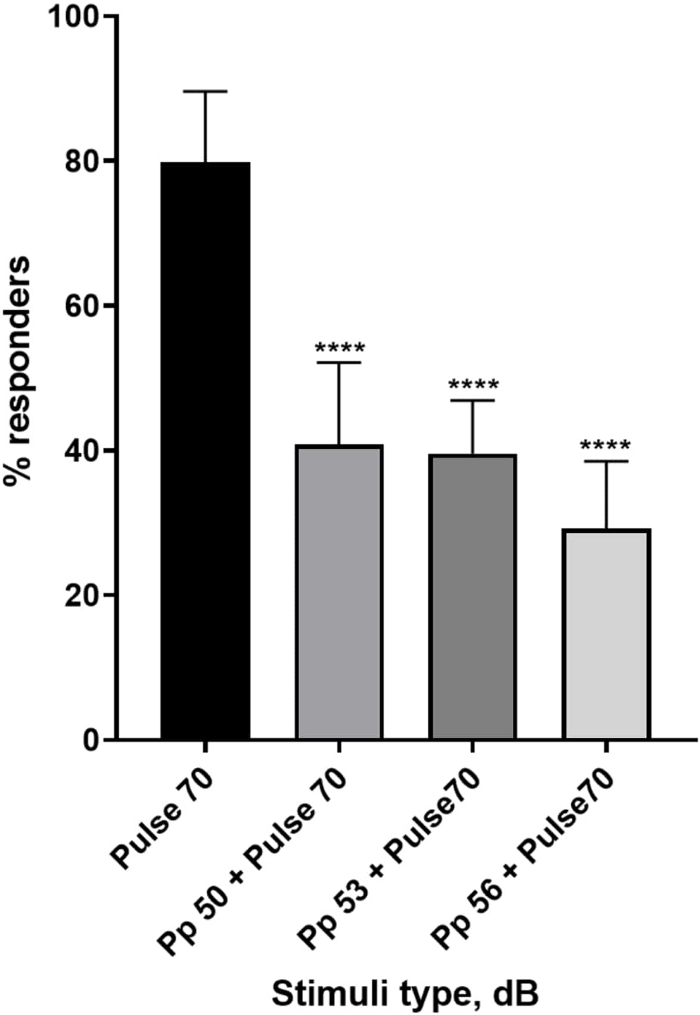
Figura 4: Disminución de la respuesta larvaria inducida por el prepulso (%). Los estímulos previos al pulso a 20, 17 y 14 dB por debajo del estímulo de sobresalto de 70 dB causan una reducción en el número de pacientes que responden a las larvas de TL de tipo salvaje. Todos los datos se representan como media ± S.D., N = 5 (16 larvas/grupo), ****p < 0,0001, significativamente diferente del estímulo de sobresalto por la prueba post-hoc de Tukey después del ANOVA de un factor. Haga clic aquí para ver una versión más grande de esta figura.
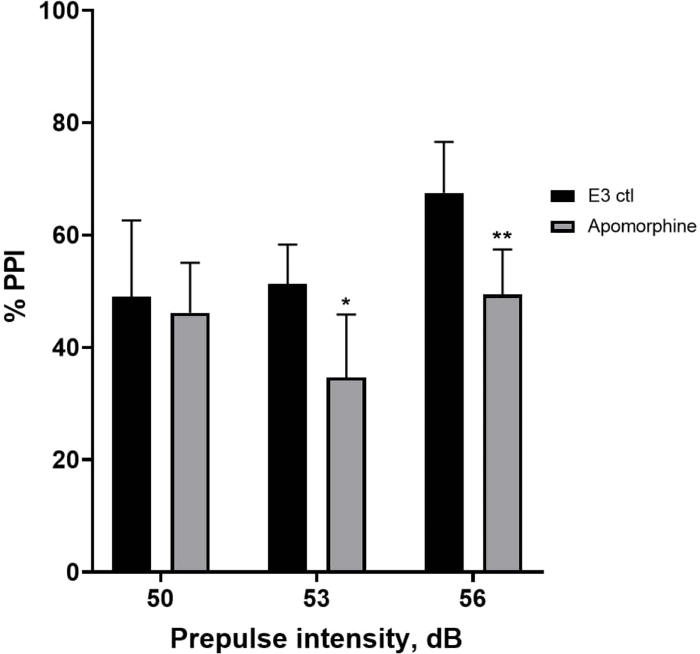
Figura 5: Déficits inducidos por apomorfina en %PPI. Todos los datos se presentan como media ± S.D., N = 4\u20125 (16 larvas/grupo), diferencia estadísticamente significativa por la prueba post-hoc de Holm-Sidak después del ANOVA de dos vías. *p = 0,0126, grupo E3 ctl/tratado con apomorfina a 53 dB; **p = 0,0044, grupo E3 ctl/tratado con apomorfina a 56 dB. Haga clic aquí para ver una versión más grande de esta figura.
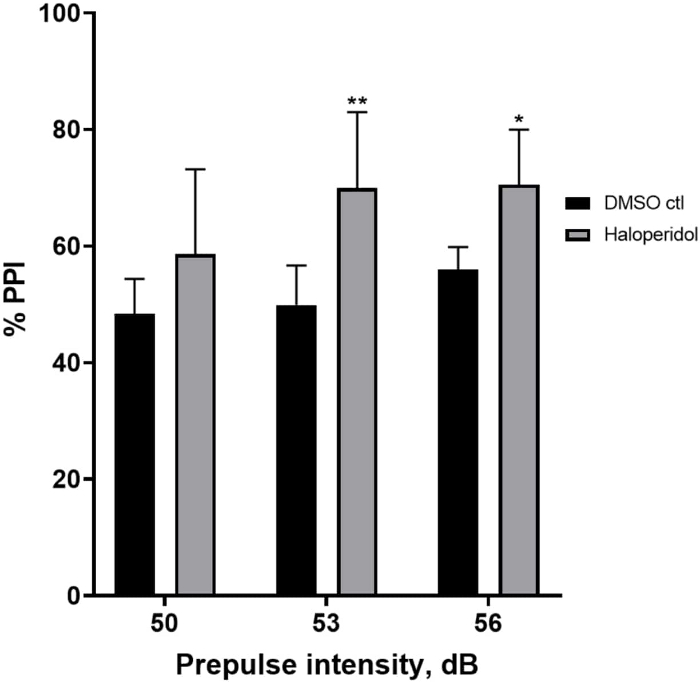
Figura 6: Haloperidol indujo un aumento en %PPI. Todos los datos se presentan como media ± S.D., N = 4\u20125 (16 larvas/grupo), diferencia estadísticamente significativa según la prueba post-hoc de Holm-Sidak después de Anova de dos vías. **p = 0,0048, grupo tratado con DMSO ctl/apomorfina a 53 dB; *p = 0,0348, grupo tratado con DMSO ctl/apomorfina a 56 dB. Haga clic aquí para ver una versión más grande de esta figura.
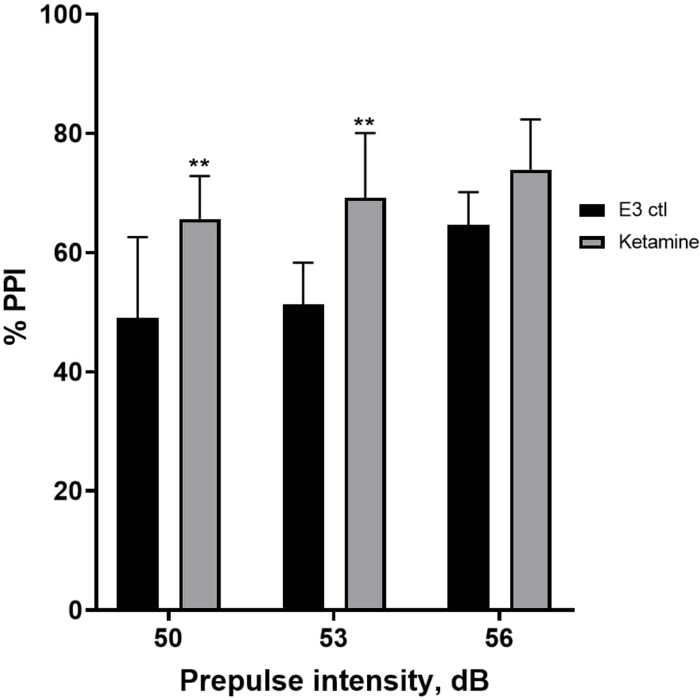
Figura 7: Mejora inducida por ketamina en %PPI. Todos los datos se representan como media ± S.D, N = 4\u20125 (16 larvas/grupo), diferencia estadísticamente significativa por la prueba post-hoc de Holm-Sidak después de Anova de dos vías **p = 0,0039, grupo E3 ctl/tratado con apomorfina a 50 dB, **p = 0,0027, grupo E3 ctl/tratado con apomorfina a 53 dB. Haga clic aquí para ver una versión más grande de esta figura.
Video complementario 1: Vídeo representativo de larvas que muestran un inicio en C en respuesta a un estímulo de sobresalto acústico de 70 dB. Haga clic aquí para descargar este video.
Figura complementaria 1: Ejemplos representativos de condiciones de estímulo generadas utilizando el generador de PPI. (A) ensayo de estímulo solo, (B) ensayo de inhibición previo al pulso (pre-pulso + pulso), (C) ensayo sin estímulo para medir el ángulo de flexión basal umbral de las larvas no estimuladas. Haga clic aquí para descargar esta figura.
Discusión
Es esencial validar cualquier nuevo sistema de ensayo conductual con el objetivo de mejorar y refinar los protocolos para la investigación neuroconductual. En la investigación actual, se evaluó la capacidad de dos sistemas y software disponibles comercialmente para inducir una respuesta acústica de sobresalto en larvas de pez cebra y para detectar y cuantificar la modulación farmacológica previamente descrita de dichos comportamientos.
Se realizaron una serie de modificaciones y solución de problemas para optimizar la configuración. El software predeterminado para el análisis de las respuestas de C-start era tal que el análisis procedía automáticamente después de que se adquirían los datos de cada experimento (22 ensayos/placa constituían un experimento). Esto redujo el número de placas que se podían ejecutar por día, lo que redujo el rendimiento (5 placas por día). Para evitar esta limitación, fue necesario desacoplar el software de análisis del proceso de recopilación de datos, lo que aumentó el rendimiento a un promedio de 10 placas por día. Por lo tanto, la decisión de recurrir a un software de análisis independiente para el análisis no en vivo resultó exitosa y más eficiente. Para evitar interferencias de sombras u otros residuos que introduzcan ruido en los datos, se recomienda llenar los pozos completamente con medio, eliminar todas las burbujas y evitar partículas de comida o similares que puedan confundirse con larvas, generando así ruido en los datos. Después de la calibración de los estímulos sonoros, la intensidad máxima alcanzable por el sistema amplificador capturada por el medidor de dB fue de 85 dB re, mientras que el ruido de fondo inicial en la cámara de prueba fue de 60 dB re. Esto dio lugar a una ventana de dB estrecha en la que operar. Por lo tanto, era fundamental mantener el ruido de fondo lo más mínimo posible. Para lograr esto, se utilizó material acústico de parafón (ver Tabla de Materiales) para construir una capa adicional de aislamiento alrededor de la cámara de prueba y una capa adicional de aislamiento usando un haz de cabina vocal (ver Tabla de Materiales). Con estas capas de aislamiento, el ruido de fondo dentro de la cámara de pruebas se redujo con éxito de los 60 dB iniciales a 45 dB re.
Actualmente, una ventaja de esta configuración es que todos los componentes están disponibles comercialmente y, como tales, no se limitan a unos pocos laboratorios. Las personas con conocimientos limitados en lenguaje de codificación pueden usarlo, ya que el protocolo es bastante fácil de entender y seguir. Por ejemplo, mediante el uso del sistema PPI, fue posible administrar pulsos y prepulsos a intervalos variables entre estímulos y ensayos, así como capturar las respuestas de las larvas a dichos estímulos. Una vez capturados estos comportamientos, se pudieron clasificar utilizando el software de análisis en respondedores y no respondedores. El grupo de respondedores se clasificó como larvas que mostraron un inicio de C de 30° o más con una latencia de <50 ms. Además, la respuesta del IBP está modulada por fármacos que se dirigen a la señalización dopaminérgica y glutamatérgica (revisado por Geyer y colaboradores27). De acuerdo con estudios previos, la apomorfina, un agonista no selectivo del receptor de dopamina, redujo la inhibición previa al pulso de la respuesta de sobresalto en larvas de pez cebra, mientras que el haloperidol, un antagonista de la dopamina, mejoró la respuesta. En las larvas de pez cebra, se ha demostrado que la ketamina modula el IBP de manera diferencial en función de la duración del ISI16. En el estudio antes mencionado, los IBP larvales mejoraron a los 30 ms, pero se suprimieron a los 500 ms de ISI cuando se trataron previamente con ketamina. Aunque este estudio no utilizó la variable ISI, la observación de que la ketamina mejoró el IBP a un ISI de 100 ms, lo hace comparable con los datos del estudio anterior cuando se utilizó un ISI de 30 ms. El estudio demostró que, mediante la combinación de estos sistemas disponibles en el mercado, es posible realizar el ensayo PPI y detectar de forma fiable los cambios inducidos farmacológicamente en la respuesta de las larvas de pez cebra en el PPI. Una limitación del sistema es que la característica del punto de la nariz rastreada por el software de análisis siempre cae en uno de los ojos de las larvas, creando así un ángulo de referencia. Para superar esto, es necesario determinar siempre el ángulo de curvatura de referencia de las larvas no estimuladas, que resultó ser de ~30° para las larvas utilizadas en este estudio. Por lo tanto, constituyendo la base para la elección de 30° como umbral de lo que se consideró una respuesta C-start positiva en larvas asustadas. Si se tienen en cuenta estos puntos, debería ser posible realizar el ensayo PPI en cualquier laboratorio con acceso al equipo de configuración. Este artículo no se centró en categorizar la cinemática de la respuesta de sobresalto en latencia corta y latencia larga como se informó anteriormente16, debido al alcance de la variabilidad de la latencia. Por lo tanto, solo se utilizaron las respuestas de inicio C <50 ms después del inicio del estímulo15.
Se ha reportado que las diferencias de cepa influyen en el comportamiento del pez cebra en varios ensayos 28,29,30,31, así como en la sensibilidad auditiva 32. Por lo tanto, es esencial determinar el ángulo de flexión de referencia de cada deformación probada. Dado que las sensibilidades auditivas también pueden ser diferentes, es crucial determinar las respuestas de sobresalto basales, la intensidad del sonido más adecuada como estímulo previo al pulso o al sobresalto para cada cepa y a qué duración se presenta el estímulo. El ISI es otro parámetro que debe ser considerado cuidadosamente porque algunos fármacos pueden mejorar o reducir el IBP en función del intervalo entre el inicio del estímulo previo al pulso y el sobresalto16. Se espera que los laboratorios interesados en estudiar la función cognitiva, los trastornos neuropsiquiátricos y la audición (función auditiva) encuentren útil esta configuración y protocolo de PPI para evaluar sus modelos farmacológicos y/o genéticos. Este protocolo también proporciona una base para el cribado de alto rendimiento de bibliotecas de compuestos.
Divulgaciones
Los autores declaran no tener intereses financieros contrapuestos.
Agradecimientos
Agradecemos a Ana Tavara y João Paulo R. P. Santana por su excelente cuidado de los peces y su inestimable ayuda con las pruebas y la instalación de las cabinas insonorizadas, y al Dr. Wietske van der Ent por su apoyo inicial en la configuración del software EthoVision. Este estudio fue financiado por el Consejo de Investigación de Noruega (ISP, BIOTEK2021/ DigiBrain).
Materiales
| Name | Company | Catalog Number | Comments |
| Apomorphine | Sigma Aldrich | A4393 | Dopamine agonist |
| dB meter | PCE instruments | PCE-MSM 4 | For measuring stimulus intensity |
| DMSO | Sigma Aldrich | D8418 | For dissolving organic solutes |
| Dynavox Amplifier | Dynavox | CS-PA1 MK | For delivering acoustic stimuli |
| EthoVision XT | Noldus, Netherlands | EthoVision XT, version 14 | Automated tracking software |
| GraphPad Prism | GraphPad Software | Version 8 | Statistical analysis software |
| Haloperidol | Sigma Aldrich | H1512 | Dopamine antagonist |
| Ketamine | Sigma Aldrich | Y0000450 | NMDA receptor antagonist |
| parofon acoustics materials | Paroc | 8528308 | Helps reduce background noise in the test cabinet |
| t.akustik Vocal Booth Bundle | Thormann, Germany | 458543 | Helps reduce background noise in the test cabinet |
| ZebraBox Revo with PPI add-ons | ViewPoint, France | ZebraBox Revo with PPI add-ons | Includes hardware and software |
Referencias
- Gawel, K., Banono, N. S., Michalak, A., Esguerra, C. V. A critical review of zebrafish schizophrenia models: Time for validation. Neuroscience & Biobehavioral Reviews. 107, 6-22 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Kalueff, A. V., Stewart, A. M., Gerlai, R. Zebrafish as an emerging model for studying complex brain disorders. Trends in Pharmacological Sciences. 35 (2), 63-75 (2014).
- Panula, P., et al. The comparative neuroanatomy and neurochemistry of zebrafish CNS systems of relevance to human neuropsychiatric diseases. Neurobiology of Disease. 40 (1), 46-57 (2010).
- Kokel, D., Peterson, R. T. Chemobehavioural phenomics and behaviour-based psychiatric drug discovery in the zebrafish. Briefings in Functional Genomics and Proteomics. 7 (6), 483-490 (2008).
- Basnet, R. M., Zizioli, D., Taweedet, S., Finazzi, D., Memo, M. Zebrafish Larvae as a Behavioral Model in Neuropharmacology. Biomedicines. 7 (1), 23(2019).
- Henry, J., Wlodkowic, D. Towards High-Throughput Chemobehavioural Phenomics in Neuropsychiatric Drug Discovery. Marine Drugs. 17 (6), (2019).
- Behavioural measurement system | Laval zebrafish | Drosophila | Daphnia | insects | Products | Zantiks. , Available from: https://zantiks.com/products/zantiks-mwp (2020).
- Product List - ViewPoint. , Available from: http://www.viewpoint.fr/en/products (2020).
- Observation chamber for zebrafish research - DanioVision. , Available from: https://www.noldus.com/daniovision/observation-chamber (2020).
- EthoVision XT - Video tracking software | Noldus. , Available from: https://www.noldus.com/ethovision-xt (2020).
- Gould, T. D., Gottesman, I. I. Psychiatric endophenotypes and the development of valid animal models. Genes, Brain and Behavior. 5 (2), 113-119 (2006).
- van den Buuse, M. Modeling the Positive Symptoms of Schizophrenia in Genetically Modified Mice: Pharmacology and Methodology Aspects. Schizophrenia Bulletin. 36 (2), 246-270 (2010).
- Acoustic startle modification as a tool for evaluating auditory function of the mouse: Progress, pitfalls, and potential. Abstract - Europe PMC. , Available from: https://europepnc.org/article/PMC/5446932 (2020).
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. Journal of Experimental Biology. 216 (18), 3504-3513 (2013).
- Burgess, H. A., Granato, M. Sensorimotor Gating in Larval Zebrafish. Journal of Neuroscience. 27 (18), 4984-4994 (2007).
- Eaton, R. C., Farley, R. D., Kimmel, C. B., Schabtach, E. Functional development in the mauthner cell system of embryos and larvae of the zebra fish. Journal of Neurobiology. 8 (2), 151-172 (1977).
- SR-LAB - San Diego Instruments Startle Response. San Diego Instruments. , Available from: https://sandiegoinstruments.com/product/sr-lab-startle-response/ (2020).
- Startle packages - Med Associates Inc. Med Associates Inc. , Available from: https://www.med-associates.com/product-category/acoustic-startle-reflex-packages/ (2020).
- Startle response & Pre-pulse inhibition test. O'HARA & CO.,LTD. , Available from: https://ohara-time.co.jp/products/startle-response-pre-pulse-inhibition-test/ (2020).
- Thyme, S. B., et al. Phenotypic Landscape of Schizophrenia-Associated Genes Defines Candidates and Their Shared Functions. Cell. 177 (2), 478-491 (2019).
- Privat, M., et al. Sensorimotor Transformations in the Zebrafish Auditory System. Current Biology. 29 (23), 4010-4023 (2019).
- Gerlai, R. Reproducibility and replicability in zebrafish behavioral neuroscience research. Pharmacology Biochemistry and Behavior. 178, 30-38 (2019).
- Add-on - Fast camera 1000 FPS - ViewPoint. , Available from: http://www.viewpoint.fr/app.php/en/p/equipment/add-on-fast-camera (2020).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. , (2019).
- Bhandiwad, A. A., Sisneros, J. A. Revisiting Psychoacoustic Methods for the Assessment of Fish Hearing. Fish Hearing and Bioacoustics: An Anthology in Honor of Arthur N. Popper and Richard R. Fay. , 157-184 (2016).
- Geyer, M. A., Krebs-Thomson, K., Braff, D. L., Swerdlow, N. R. Pharmacological studies of prepulse inhibition models of sensorimotor gating deficits in schizophrenia: a decade in review. Psychopharmacology. 156 (2-3), 117-154 (2001).
- Lange, M., et al. Inter-Individual and Inter-Strain Variations in Zebrafish Locomotor Ontogeny. PLOS ONE. 8 (8), 70172(2013).
- Liu, X., et al. Strain-dependent differential behavioral responses of zebrafish larvae to acute MK-801 treatment. Pharmacology Biochemistry and Behavior. 127, 82-89 (2014).
- Loucks, E., Carvan, M. J. Strain-dependent effects of developmental ethanol exposure in zebrafish. Neurotoxicology and Teratology. 26 (6), 745-755 (2004).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLOS ONE. 12 (4), 0175420(2017).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hearing research. 341, 220-231 (2016).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados