Method Article
Validation pharmacologique de l’inhibition pré-impulsionnelle de la réponse de sursaut chez les larves de poisson-zèbre à l’aide d’un système automatisé commercial et d’un logiciel
Dans cet article
Résumé
Nous décrivons ici un protocole qui utilise des systèmes automatisés disponibles dans le commerce pour valider pharmacologiquement le test d’inhibition pré-impulsionnelle (IPP) chez les larves de poisson-zèbre.
Résumé
Bien qu’il existe une abondance de systèmes automatisés et de logiciels commerciaux et normalisés pour effectuer le test d’inhibition pré-impulsionnelle (IPP) chez les rongeurs, à notre connaissance, tous les tests PPI effectués chez le poisson-zèbre ont, jusqu’à présent, été effectués à l’aide de systèmes sur mesure qui n’étaient disponibles que pour des groupes individuels. Cela a donc posé des défis, notamment en ce qui concerne les questions de reproductibilité et de normalisation des données. Dans le présent travail, nous avons généré un protocole qui utilise des systèmes automatisés disponibles dans le commerce pour valider pharmacologiquement le dosage des IPP chez les larves de poisson-zèbre. Conformément aux résultats publiés, nous avons été en mesure de reproduire les résultats de l’apomorphine, de l’halopéridol et de la kétamine sur la réponse des IPP de 6 jours après la fécondation des larves de poisson-zèbre.
Introduction
La larve du poisson-zèbre (Danio rerio) est un candidat approprié pour la modélisation de maladies psychiatriques telles que la schizophrénie (revue par Gawel et al.1) en raison des nombreux avantages qu’elle possède. Il s’agit notamment d’un génome entièrement séquencé avec une homologie de séquence de 70 % avec les orthologues humains2, de l’existence d’outils génétiques directs et inverses pour manipuler le génome et identifier la contribution d’un gène donné au développement ou à la maladie3, et de la présence de neurotransmetteurs humains/rongeurs majeurs dans le cerveau du poisson zèbre4. Il existe une disponibilité de plusieurs domaines neuro-phénotypiques chez le poisson zèbre, tels que l’anxiété, l’apprentissage et la mémoire3. La transparence optique et la sensibilité aux principales classes de médicaments neurotropes en font un candidat idéal pour les manipulations pharmacologiques et le criblage phénotypique de médicaments 5,6.
Pour effectuer le criblage de médicaments à haut débit, l’automatisation et la présence d’un endophénotype robuste sont très importantes7. Par exemple, une variété de techniques d’enregistrement automatique ont été développées pour mesurer le comportement des larves de poisson-zèbre, telles que la thigmotaxie, la réponse de sursaut, la réponse optocinétique, la réponse optomotrice, l’habituation, la capture de proies, le comportement de sommeil/éveil, le comportement locomoteur et plusieurs autres6. Bien que certains laboratoires développent des systèmes sur mesure pour des mesures et des analyses automatisées de certains de ces comportements, il existe des systèmes d’imagerie et des logiciels disponibles dans le commerce 8,9,10,11. L’inhibition pré-impulsionnelle (IPP), une forme de déclenchement sensorimoteur dans laquelle la réponse de sursaut est réduite lorsqu’un stimulus faible non surprenant est présenté brièvement avant le stimulus surprenant, a été utilisée comme endophénotype pour étudier la schizophrénie dans des modèles animaux (examiné par12,13). De plus, la réponse de sursaut acoustique (ASR) et l’IPP ont joué un rôle utile dans l’étude de l’audition et de la fonction auditive dans des modèles animaux, y compris le poisson-zèbre14,15. La larve de poisson-zèbre présente un C-start caractéristique en réponse à un stimulus surprenant inattendu qui est atténué par un stimulus plus faible appelé prépulsion. Le C-start a longtemps été décrit comme un comportement d’évasion contrôlé par des populations de cellules neurales distinctes et a été soigneusement caractérisé chez les larves de poisson-zèbre 15,16,17.
Il existe une abondance de systèmes automatisés et de logiciels commerciaux et standardisés pour effectuer le dosage de l’IPP chez les rongeurs 18,19,20. Cependant, à notre connaissance, tous les tests d’IPP effectués jusqu’à présent chez le poisson-zèbre ont été réalisés à l’aide de systèmes sur mesure qui ne sont disponibles que pour les groupes individuels 15,16,21,22. Cela pose des défis pour la reproductibilité et la reproductibilité des données en ce qui concerne la normalisation23.
Récemment, un fournisseur connu dans la communauté du poisson-zèbre a développé une configuration intégrée avec une caméra rapide et des add-ons de générateur d’IPP pour effectuer le test PPI dans les larves de poisson-zèbre24. La caméra enregistre à 1000 images par seconde, ce qui permet d’enregistrer des comportements à action rapide tels que le C-start, tandis que le générateur PPI permet la livraison contrôlée par l’utilisateur de divers stimuli acoustiques pour évoquer une réponse de sursaut24. Ici, nous combinons le système susmentionné avec un progiciel complet disponible dans le commerce conçu pour l’analyse automatisée de comportements complexes11, afin de générer un protocole pour effectuer des tests de réponse à l’IPP chez les larves de poisson-zèbre. Nous validons pharmacologiquement la réponse aux IPP en utilisant 1) l’apomorphine, un agoniste de la dopamine connu pour provoquer des déficits en IPP ; 2) l’halopéridol, un antagoniste de la dopamine et un antipsychotique connu pour améliorer l’IPP et 3) la kétamine, un antagoniste des récepteurs NMDA connu pour moduler l’IPP.
Protocole
Toutes les expériences sur les animaux ont été approuvées par le système de supervision et d’application de l’administration norvégienne des animaux d’expérimentation (FOTS-18/106800-1).
1. Élevage de poissons-zèbres
- Mettre en place des accouplements de poissons zèbres adultes mâles et femelles de type sauvage, maintenus dans des conditions standard25 la veille au soir. Ici, la souche Tupfel à longues nageoires (TL) est utilisée.
- Retirez les barrières le lendemain matin et laissez s’accoupler par ponte naturelle.
- Récupérez les œufs dans les bassins d’accouplement.
- Retirer les œufs non fécondés et autres débris, puis les transférer dans des boîtes de Pétri (n = 60) et les élever dans un incubateur à 28 °C dans un milieu embryonnaire : 1,5 mM HEPES, pH 7,6, 17,4 mM NaCl, 0,21 mM KCl, 0,12 mM MgSO4 et 0,18 mM Ca(NO3)2.
- Renouveler la moitié du milieu embryonnaire et retirer les larves mortes tous les jours jusqu’à 6 dpf.
REMARQUE : Toutes les expériences ont été réalisées sur des larves individuelles 6 jours après la fécondation.
2. Agents pharmacologiques et prétraitement des larves
- Dissoudre l’apomorphine et la kétamine dans le milieu E3 pour obtenir des solutions mères de 500 μM et 10 mM respectivement.
- Dissoudre l’halopéridol dans du sulfoxyde de diméthyle à 100 % (DMSO) pour obtenir une solution mère de 10 mM. La concentration finale de DMSO utilisée était de 0,1 %.
- Utilisez 0,1 % de DMSO et de milieu E3 comme commandes du véhicule.
- Utilisez les concentrations finales suivantes de médicaments : 10 mg/mL d’apomorphine, 1 mM de kétamine et 20 μM d’halopéridol16.
- Pré-exposer les larves des groupes apomorphine et kétamine pendant 10 min et les groupes témoins des véhicules halopéridol et DMSO pendant 20 min16.
3. Configuration avant le test de comportement
- Le jour de l’expérience, transférez les larves et tout le matériel pertinent dans la salle d’expérience. Réglez la salle d’expérience à une température de 27 ± 1 °C.
- Veillez à ce que le bruit de fond dans la chambre d’essai soit aussi faible que possible, de préférence pas supérieur à 45 dB à un niveau de pression acoustique (SPL).
- Installez le microphone du sonomètre du décibel-mètre (dB) dans la chambre d’essai (l’ouverture pour l’installation est déjà percée par le fabricant).
- Pour réduire le bruit de fond dans la pièce, isolez la chambre d’essai à l’aide d’une cabine de son sur mesure (voir la figure 1B pour une vue d’ensemble de l’installation).
- Préparez une plaque à 96 puits pour l’essai d’inhibition pré-impulsionnelle.
REMARQUE : La caméra vidéo a une résolution de 2048 × 500 pixels, ce qui signifie que seulement un maximum de 3 voies (33 puits) peuvent être imagés à la fois.- Utilisez une plaque acrylique sur mesure au format 96 puits pour réduire les interférences des ombres.
REMARQUE : Les mesures de la plaque personnalisée peuvent être trouvées sur le site Web suivant : https://zenodo.org/record/3739378#.XooyLW5uKas
- Utilisez une plaque acrylique sur mesure au format 96 puits pour réduire les interférences des ombres.
- À l’aide d’une pipette de transfert, transvaser 310 μL de solution d’exposition/milieu avec une larve dans chaque puits.
- Calibrez et mesurez l’intensité du stimulus à l’aide du bouton de volume de l’amplificateur stéréo et d’un décibelmètre, respectivement.
- Enregistrez l’intensité sonore maximale dans la section « référence de niveau ».
4. Paramètres de stimulus et acquisition vidéo
- Mettez l’ordinateur, le système d’amplification et le dB-mètre (voir la Figure 1A pour une vue d’ensemble de la configuration).
- Utilisez le bouton de volume en le tournant au minimum ou au maximum pour régler l’intensité sonore.
- Vérifiez le niveau sonore avec le dBmètre à chaque fois, le bouton de volume est réglé. Ceci est important pour trouver l’intensité sonore maximale et minimale qui peut être produite par l’installation.
REMARQUE : Le dBmètre calcule la sortie RMS dB pour le stimulus. Le système génère le son à l’intérieur des composants solides de la chambre d’essai, maintenant la plaque ferme tout en produisant une vibration dans le plan horizontal de l’ensemble du support de la plaque.- Réglez le bouton de volume au maximum, mesurez l’intensité sonore avec le dB-mètre et utilisez cette valeur.
- Vérifiez le niveau sonore avec le dBmètre à chaque fois, le bouton de volume est réglé. Ceci est important pour trouver l’intensité sonore maximale et minimale qui peut être produite par l’installation.
- Sur l’interface du générateur PPI, définissez les paramètres : intervalle inter-stimulus représenté par Delay ; intervalle inter-essais représenté par le temps delta d’acquisition ; durée de la préimpulsion, etc.
- Pour les essais pré-impulsionnels seuls, assurez-vous que l’amplitude ou la durée du stimulus pour les paramètres Startle sont réglés à zéro et vice versa pour les essais Jumple seul.
- Pour générer une liste d’essais, sélectionnez Ajouter > donner un nom à l’essai. Par exemple, « Pré-impulsion 50 dB seul ».
REMARQUE : On peut générer autant d’essais que l’on le souhaite, mais faites attention à la longueur de la liste car cela peut faire planter le programme.- Intercaler les essais pré-impulsionnels avec les essais pulsés seuls dans toutes les expériences IPP utilisant un ordre pseudo-aléatoire. Lorsque plusieurs stimuli sont présentés dans une expérience, un intervalle inter-essais (ITI) de 30 s est utilisé.
REMARQUE : Dans cette étude, un stimulus de sursaut (impulsion) de 100 ms à 660 Hz et des stimuli pré-impulsionnels de 5 ms à 440 Hz ont été utilisés. Pour les expériences IPP, l’intervalle inter-stimulus (ISI) était de 100 ms.
- Intercaler les essais pré-impulsionnels avec les essais pulsés seuls dans toutes les expériences IPP utilisant un ordre pseudo-aléatoire. Lorsque plusieurs stimuli sont présentés dans une expérience, un intervalle inter-essais (ITI) de 30 s est utilisé.
- Pour enregistrer le protocole, sélectionnez Fichier > Enregistrer sous.
- Ajustez les conditions d’éclairage dans la chambre d’essai comme suit.
- Lancez l’informatique de mesure USB, sélectionnez sortie analogique puis allez dans D/A OUT O (P13) pour apporter des modifications à l’éclairage. Une valeur de zéro signifie qu’il n’y a pas de lumière, tandis que l’augmentation de la valeur D/A OUT O augmente l’intensité de la lumière dans la boîte. Une intensité lumineuse de 100 a été utilisée pour toutes les expériences.
- Configurer l’appareil photo
- Lancez le logiciel et attendez que l’appareil photo se charge.
- Sélectionnez Ajustements (sur le côté droit) et réglez la fréquence d’images d’acquisition sur 1 000, puis cliquez sur Appliquer pour effectuer la modification.
- Acclimatez les larves à une chambre d’essai éclairée à 100 % par la lumière pendant 5 minutes avant le début des expériences.
- Pour commencer une expérience, sélectionnez le menu Expérience du générateur PPI, cliquez sur Exécuter et sélectionnez le format de puits (par exemple, 33 puits).
- Assurez-vous toujours que le logiciel de l’appareil photo est lancé avec les bons paramètres avant d’exécuter une expérience.
- Acquérez une vidéo de 2 s pour chaque essai.
- Assurez-vous que la fréquence d’images d’acquisition est définie sur 1 000.
5. Suivi et analyse automatisés de la réponse de sursaut acoustique et de l’IPP
- Configuration du protocole.
- Lancez le logiciel d’analyse (voir la Table des matériaux). Choisissez Nouveau dans le modèle > Appliquez un modèle prédéfini , puis parcourez les autres menus (détails ci-dessous).
- Choisissez dans le fichier vidéo sous Source vidéo.
- Parcourir le fichier vidéo. Définir le sujet comme modèle de zone de > de larves de poisson > de poisson-zèbre (pas de modèle). Spécifiez le nombre d’arènes sous Arènes.
- Spécifiez le nombre de sujets par arène (défini sur 1) sous Sujets.
- Sélectionnez Détection du point central, du point de nez et de la base arrière sous Fonctions suivies (voir Figure 2A,B).
REMARQUE : Ceci est important pour calculer l’angle du corps de la réponse C-start (voir Figure 2C). - Cliquez sur Nom > enregistrer sous. Les unités utilisées sont respectivement mm, s, deg pour la distance, le temps et la rotation.
REMARQUE : N’oubliez pas d’utiliser la même unité pour calibrer la balance.
- Choisissez le paramètre Arène.
- Cliquez sur Saisir l’image d’arrière-plan.
- Suivez les étapes du menu de droite (en cas de doute, utilisez le menu Aide ).
- Choisissez l’outil de dessin de cercle pour dessiner les arènes.
- Choisissez Paramètres de contrôle d’essai > créez un nouveau nom >.
- Choisissez Paramètres de détection, suivez les étapes du menu de droite.
- Réglez la fréquence d’échantillonnage sur 25. Choisissez les paramètres de détection avancés. Sous Méthode, sélectionnez soustraction dynamique, modèle avancé/poisson adulte, puis définissez la couleur du sujet par rapport à l’arrière-plan sur Plus foncé et déplacez le curseur pour définir le contraste de la larve.
- Sous le contour du sujet, sélectionnez d’abord éroder, puis dilater et augmenter les valeurs d’érosion et de dilatation du contour jusqu’à ce que l’animal soit complètement détecté.
- Enregistrez le protocole et utilisez-le pour les analyses ultérieures des vidéos PPI acquises.
- Lancez le logiciel d’analyse (voir la Table des matériaux). Choisissez Nouveau dans le modèle > Appliquez un modèle prédéfini , puis parcourez les autres menus (détails ci-dessous).
- Configuration de la liste d’essai.
- Choisissez la liste d’essais, définissez des variables indépendantes telles que l’identification des larves, le traitement, le type de stimulus, etc. Sélectionnez le chemin d’accès des vidéos et définissez une liste d’essais pour l’acquisition par lots.
- Configuration de l’acquisition.
REMARQUE : Si une liste d’essai a été générée, il est possible d’effectuer une acquisition par lots des vidéos.- Si certaines pistes sont perdues, utilisez l’éditeur de pistes pour ajuster les fonctions de piste.
- Excluez de l’analyse les erreurs de suivi qui restent non résolues après l’utilisation de l’éditeur de pistes.
- Réglez le profil de lissage de la piste sur 1 mm pour réduire le bruit des données. Cela peut être ajusté en fonction de l’activité de fond des larves.
- Paramétrage de l’analyse.
- Pour sélectionner les essais à analyser, choisissez Profils de données et définissez les traces en fonction de la variable indépendante d’intérêt.
REMARQUE : Si les composants sont cachés, cliquez sur le symbole de l’œil dans le coin supérieur droit pour afficher.- Filtrez les parties des essais à analyser (p. ex., en fonction du traitement ou du type de groupe de stimulus).
- Sélectionnez une partie des traces à analyser (imbrication). Pour cette étude, les données ont été imbriquées pour les traces entre le début du stimulus et 100 ms après le début du stimulus.
- N’oubliez pas de connecter tous les filtres et nichoirs avec des lignes fléchées pour terminer l’instruction.
- Définissez les variables dépendantes à analyser, sélectionnez Profils d’analyse et spécifiez les variables d’intérêt (focus sur Corps sous Variables dépendantes).
REMARQUE : Si les composants sont cachés, cliquez sur le symbole de l’œil dans le coin supérieur droit pour afficher.- Double-cliquez sur Angle du corps. Sélectionnez Pli absolu. Passez par les paramètres d’essai et sélectionnez maximum, puis cliquez sur ajouter.
- Double-cliquez sur l’état de l’angle du corps. Réglez l’intervalle de calcul de la moyenne sur 5 échantillons. Définissez le seuil d’angle de pliage. Pour calculer les statistiques de bent, parcourez les statistiques d’essai et sélectionnez la latence à ajouter en premier , > ajouter. Répétez les étapes jusqu’à ce que des seuils variables soient obtenus (entre 20 et 80° ont été utilisés) et nommez en conséquence.
- Génération de statistiques et de graphiques.
- Choisissez Analyse > résultats > statistiques et graphiques, puis cliquez sur Calculer.
- Assurez-vous que les profils de données et d’analyse sont définis sur le bon modèle, car plusieurs modèles peuvent être créés sous chaque section.
- Exportez les statistiques d’essai et de groupe sous forme de tableur pour le traitement et l’analyse.
- Pour sélectionner les essais à analyser, choisissez Profils de données et définissez les traces en fonction de la variable indépendante d’intérêt.
6. Analyse des données
- Ouvrez le fichier tableur contenant les statistiques de l’essai.
- Sélectionnez les colonnes Angle du corps Degré maximum, Latence courbée (des différents seuils d’angle du corps).
- Considérer chaque changement d’angle corporel ≥ 30° dans une latence de coupure de 50 ms après le début du stimulus comme une réponse positive au début du stimulus (c’est-à-dire un répondeur) ; Ceux qui ont < angle de corps de 30° ne répondent pas.
- De manière binaire, attribuez 1 à une larve répondante et 0 à une larve non répondante pour chaque plaque.
- Comptez le nombre total de larves répondeuses et non répondantes pour chaque plaque. Calculez les répondeurs ( %) dans chaque cas calculés comme suit (nombre de larves répondantes/nombre total de larves) × 100. Exclure de l’analyse les larves qui répondent à moins de 30 % au stimulus de sursaut16.
REMARQUE : Toute intensité de stimulus capable de provoquer une réponse C-start chez égale ou supérieure à 70 % des larves est considérée comme un stimulus de sursautapproprié 16.
- Comptez le nombre total de larves répondeuses et non répondantes pour chaque plaque. Calculez les répondeurs ( %) dans chaque cas calculés comme suit (nombre de larves répondantes/nombre total de larves) × 100. Exclure de l’analyse les larves qui répondent à moins de 30 % au stimulus de sursaut16.
- Calculez le %PPI comme suit : 100 × (pourcentage de réponse au stimulus de sursaut − pourcentage de réponse à la séquence de pré-impulsion + sursaut)/ (pourcentage de réponse au stimulus de sursaut)16.
7. Analyse statistique
- Présenter les données sous forme de moyenne ± d’écart-type, S.D. (voir la Table des matériaux pour les logiciels statistiques).
- Déterminez les effets de différentes intensités de préimpulsion sur la réponse larvaire à l’aide d’une ANOVA à un facteur suivie d’un test post-hoc de Tukey.
- Utiliser l’ANOVA à deux facteurs suivie du test post-hoc de Holm-Sidak pour déterminer les effets du traitement médicamenteux sur le % de réponse aux IPP avec des intensités de pré-impulsion variables.
Résultats
Trois expériences ont été réalisées pour valider le protocole de combinaison de plusieurs systèmes pour analyser l’inhibition pré-impulsionnelle de la réponse de sursaut acoustique chez les larves de poisson-zèbre. Tout d’abord, la capacité à délivrer avec précision des stimuli acoustiques et à capturer la réponse des larves au stimulus de sursaut a été testée. Ensuite, il s’agissait de valider la capacité d’atténuer la réponse de sursaut lorsqu’un stimulus pré-impulsionnel est présenté. Enfin, la capacité de détecter la modulation pharmacologique de l’inhibition pré-impulsionnelle de la réponse de sursaut par les médicaments apomorphine, halopéridol et kétamine a été établie.
Réponse des larves de poisson-zèbre aux stimuli de sursaut acoustique
Des travaux antérieurs ont démontré que les larves de poisson-zèbre présentent un C-start caractéristique lorsqu’elles sont présentées avec un stimulus acoustique surprenant16. La capacité d’inciter et de capturer le comportement des larves aux stimuli de sursaut a été testée. On a observé que les larves observées présentaient la réponse C-start (figure 2). Un stimulus de 70 dB re (100 ms, 660 Hz, figure supplémentaire 1A) était suffisamment fort pour susciter une réponse chez ≥70 % des larves (figure 3A). Lorsqu’il a été présenté à plusieurs reprises 30 fois à un intervalle de 30 s entre les essais, le stimulus re de 70 dB n’a pas entraîné d’accoutumance larvaire (N = 3 répétitions ; 16 larves/répétition), comme le montre la figure 3B.
La préimpulsion diminue la réponse de sursaut des larves de poisson-zèbre aux stimuli acoustiques
Une pléthore de preuves montre que les stimuli pré-impulsionnels modulent la réponse larvaire à un stimulus de sursaut 15,21,22,26. Un paradigme à deux impulsions a été utilisé, où un stimulus faible appelé pré-impulsion précédait le stimulus provoquant le sursaut appelé impulsion. Les stimuli pré-impulsionnels utilisés étaient inférieurs de 20, 17 ou 14 dB au stimulus pulsé fixé à 70 dB re. La préimpulsion (5 ms, 440 Hz) était toujours présentée 100 ms avant le début de l’impulsion (figure supplémentaire 1B). Chaque stimulus pré-impulsionnel testé réduisait considérablement la réponse larvaire au pouls. La figure 4 montre la réponse larvaire (en %) aux stimuli de sursaut acoustique pour 6 dpf TL dans le milieu E3, N = 6 (16 larves/groupe). Le pourcentage de larves répondant au stimulus de sursaut (pouls) était de 79,86 ± 9,772. Comme on pouvait s’y attendre, lorsque le stimulus de sursaut était précédé d’une prépulsion de 50, 53 ou 56 dB, la réponse larvaire diminuait à 40,87 % ± 11,30 %, 39,58 % ± 7,345 % et 29,17 % ± 9,350 % respectivement. L’analyse de l’anova à un facteur a révélé une différence statistique dans l’effet du stimulus sur les larves (F (3, 48) = 57,23, P < 0,0001) avec le test de comparaisons multiples de Tukey révélant une signification statistique entre les groupes à un intervalle de confiance de 95 %.
Modulation pharmacologique de l’inhibition pré-impulsionnelle
Des études antérieures ont montré que les médicaments dopaminergiques, l’apomorphine et l’halopéridol, ainsi que le médicament glutamatergique, la kétamine, modulaient de manière significative l’inhibition pré-impulsionnelle chez les larves tout comme chez leurs équivalents mammifères et rongeurs16. Les concentrations pour la validation de l’installation ont été sélectionnées sur la base de ces études. L’intervalle inter-stimulus (ISI) pour toutes les expériences pharmacologiques était de 100 ms.
Effet de l’apomorphine sur l’inhibition de la préimpulsion
Dans la figure 5, les larves prétraitées avec 10 mg/mL d’apomorphine pendant 10 min ont montré une réduction globale du % d’IPP par rapport aux larves témoins E3 (ANOVA à deux facteurs, non RM (facteurs : intensité du traitement et de la préimpulsion ; traitement : F (1, 34) = 16,21, p = 0,0003 ; intensité de la préimpulsion : F (2, 34) = 8,674, P = 0,0009, cela a montré une interaction non significative : F (2, 34) = 2,514, p = 0,0959). Pour étudier les différences plus en détail, le test post-hoc de Holm-Sidak a révélé des différences significatives dans la réponse de sursaut entre le témoin E3 et les larves traitées à l’apomorphine à des intensités pré-impulsionnelles de 53 (p = 0,0126) et 56 (p = 0,0044) mais pas à 50 dB (p = 0,5813).
Effet de l’halopéridol sur l’inhibition de la préimpulsion
La figure 6 montre une augmentation globale du % d’IPP chez les larves prétraitées pendant 20 min avec de l’halopéridol de 20 μM par rapport à celles dans le milieu E3 (ANOVA à deux facteurs, non RM (facteurs : intensité du traitement et pré-impulsion ; traitement : F (1, 32) = 20,75, p < 0,0001 ; intensité pré-impulsion : F (2, 32) = 3,147, p = 0,0565, sans interaction significative : F (2, 32) = 0,7455, p = 0,4826). À l’aide du test post-hoc de Holm-Sidak, la présence d’une signification statistique n’a été observée qu’aux intensités pré-impulsionnelles 53 (p = 0,00489) et 56 (p = 0,0348), mais pas à 50 dB (p = 0,067).
Effet de la kétamine sur l’inhibition pré-impulsionnelle
La figure 7 montre qu’à différentes intensités de stimulus pré-impulsionnel, il y avait des différences dans la réponse de sursaut entre les larves témoins E3 et celles prétraitées pendant 10 min dans 1,0 mM de kétamine (ANOVA à deux facteurs, non RM (facteurs : intensités de traitement et de pré-impulsion ; traitement : F (1, 35) = 25,46, p < 0,0001 ; intensité pré-impulsion : F (2, 35) = 6,018, p = 0,0057, sans interaction significative : F (2, 35) = 0,8450, p = 0,4381). Le test post-hoc de Holm-Sidak n’a montré de signification qu’à des intensités de pré-impulsion de 50 (p = 0,0039) et 53 (p = 0,0027), mais pas à 56 dB (p = 0,0802).
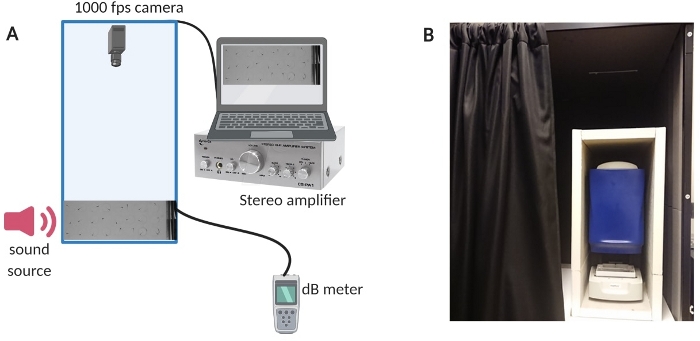
Figure 1 : Appareil d’essai. (A) Vue d’ensemble de la configuration de l’équipement. (B) Isolation interne de l’équipement de configuration pour minimiser le bruit de fond pendant les expériences. Veuillez cliquer ici pour voir une version agrandie de cette figure.
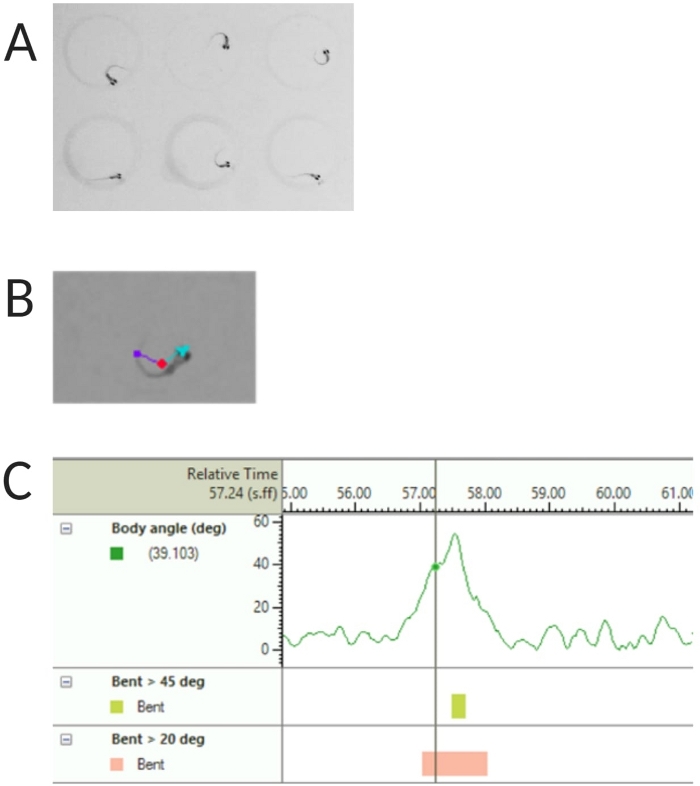
Figure 2 : Analyse de la réponse acoustique des larves de poisson-zèbre. (A) Début C caractéristique présenté par 6 larves de poisson-zèbre à 6 dpf. (B) Image représentative des trois caractéristiques suivies superposées à une larve de 6 dpf : point central (rouge), point nasal (cyan) et base de la queue (violet). (C) Image représentative de l’angle de courbure absolu présenté par une larve de type sauvage TL de 6 dpf. Veuillez cliquer ici pour voir une version agrandie de cette figure.
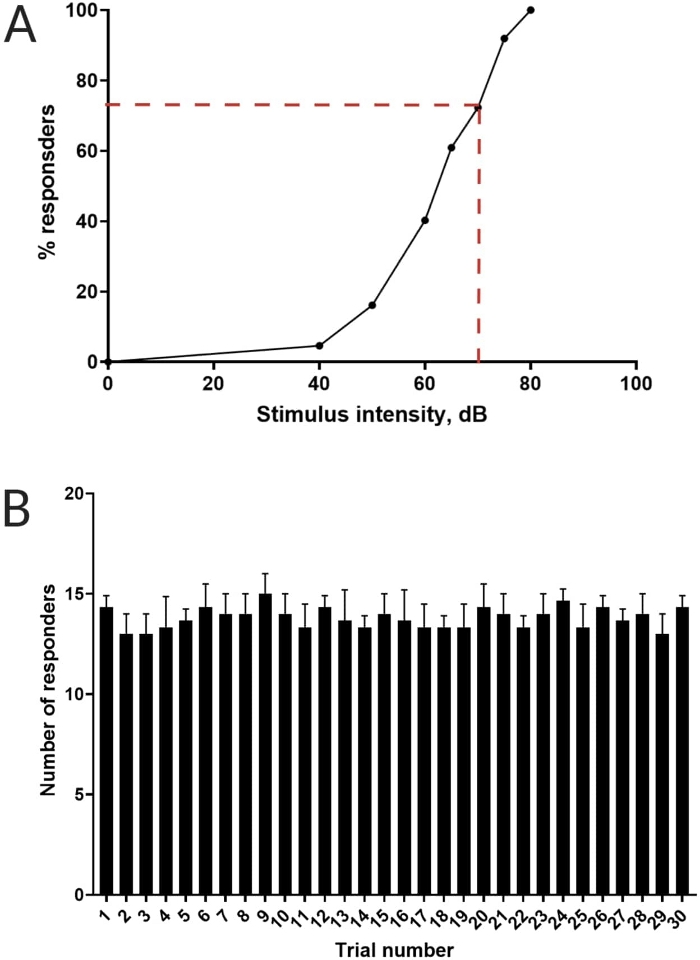
Figure 3 : Détermination du seuil de sursaut acoustique. (A) Une intensité de stimulus de 70 dB (représentée par des lignes pointillées rouges) est capable de provoquer une réponse C-start chez >70 % des larves (N = 33 ; 6 dpf TL). (B) Les larves ne s’habituent pas à un stimulus de 70 dB présenté 30 fois (essais) à un intervalle de 30 s entre les essais (N = 3 répétitions ; 16 larves/répétition). Les données sont présentées en moyenne ± écart-type. Veuillez cliquer ici pour voir une version agrandie de ce chiffre.
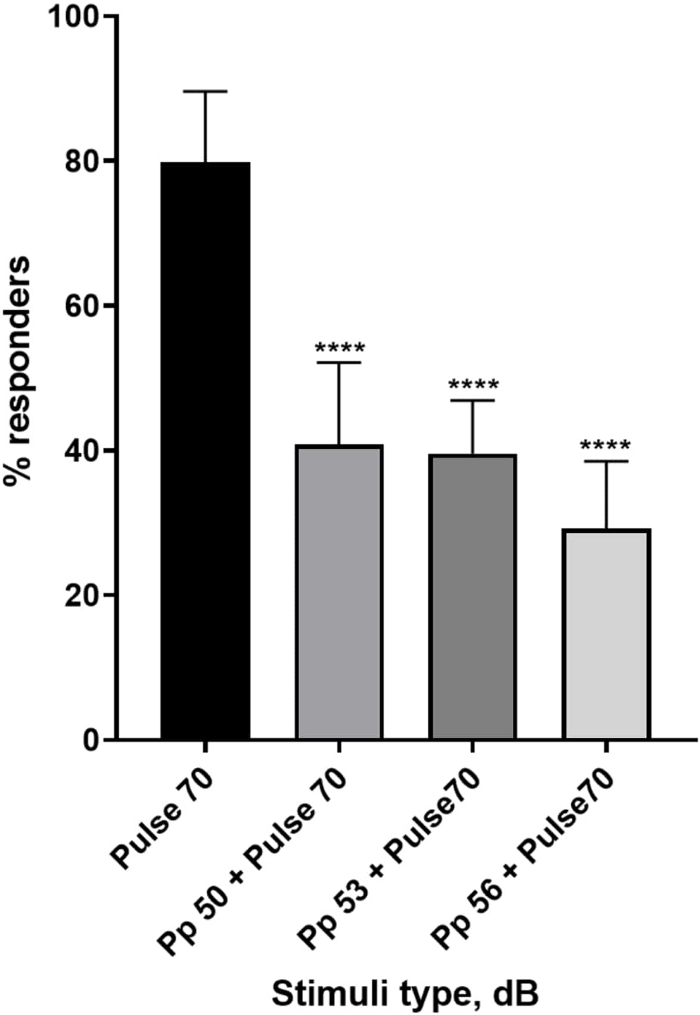
Figure 4 : Diminution de la réponse larvaire induite par le pré-pouls ( %). Des stimuli pré-impulsionnels à 20, 17 et 14 dB inférieurs au stimulus surprenant de 70 dB provoquent une réduction du nombre de larves de type sauvage TL répondant au début du C. Toutes les données sont représentées par une moyenne ± écart-type, N = 5 (16 larves/groupe), ****p < 0,0001, significativement différente du stimulus de sursaut par le test post-hoc de Tukey après ANOVA à un facteur. Veuillez cliquer ici pour voir une version agrandie de cette figure.
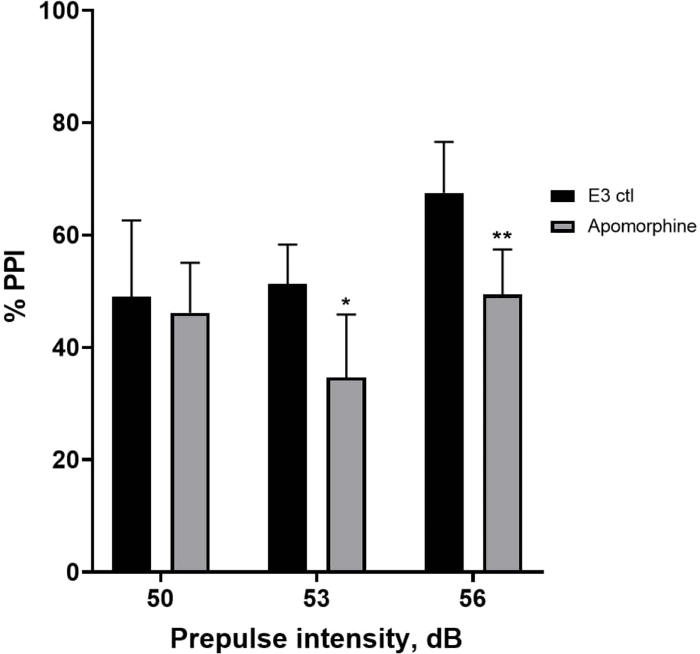
Figure 5 : Déficits induits par l’apomorphine en % IPP. Toutes les données sont présentées sous forme de différence moyenne ± écart-type, N = 4 à 4 (16 larves/groupe), différence statistiquement significative selon l’essai post-hoc de Holm-Sidak après l’ANOVA à deux facteurs. *p = 0,0126, groupe traité par E3 ctl/apomorphine à 53 dB ; **p = 0,0044, groupe traité par E3 ctl/apomorphine à 56 dB. Veuillez cliquer ici pour voir une version agrandie de cette figure.
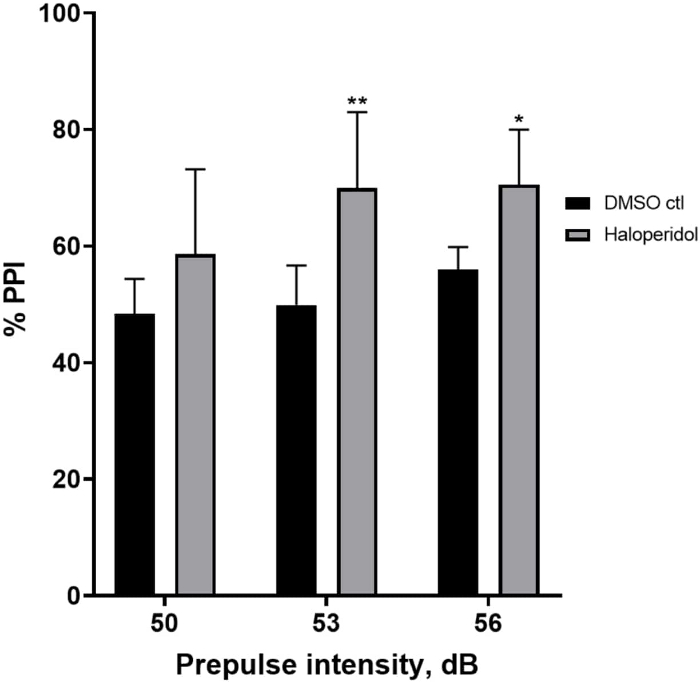
Figure 6 : Augmentation induite par l’halopéridol en % IPP. Toutes les données sont présentées sous forme de moyenne ± écart-type, N = 4 à 4 (16 larves/groupe), différence statistiquement significative selon le test post-hoc de Holm-Sidak après l’analyse de synthèse par anonova à deux facteurs. **p = 0,0048, groupe traité par DMSO ctl/apomorphine à 53 dB ; *p = 0,0348, groupe traité par DMSO ctl/apomorphine à 56 dB. Veuillez cliquer ici pour voir une version agrandie de cette figure.
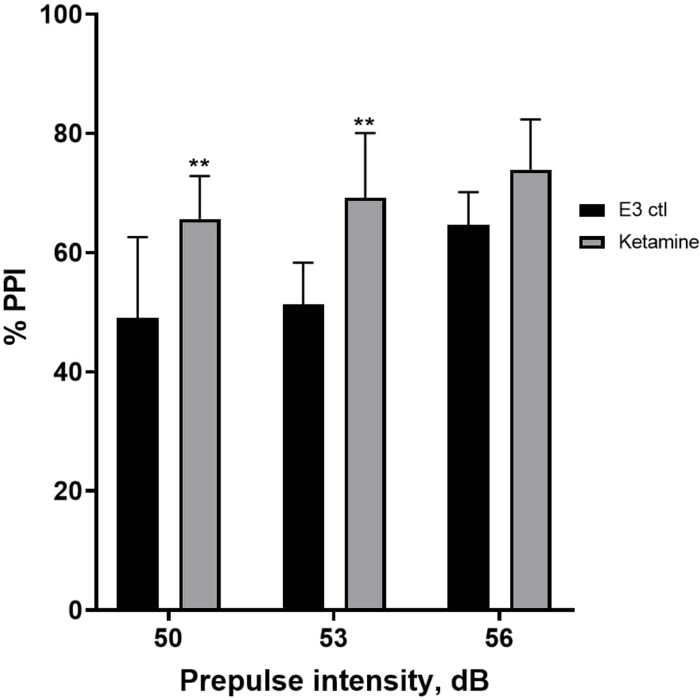
Figure 7 : Augmentation induite par la kétamine en % IPP. Toutes les données sont représentées sous forme de moyenne ± Écart-type, N = 4-4-5 (16 larves/groupe), différence statistiquement significative par le test post-hoc de Holm-Sidak après une anova à deux facteurs **p = 0,0039, groupe traité à l’E3 ctl/apomorphine à 50 dB, **p = 0,0027, groupe traité à l’E3 ctl/apomorphine à 53 dB. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Vidéo supplémentaire 1 : Vidéo représentative de larves présentant un C-start en réponse à un stimulus de sursaut acoustique de 70 dB. Veuillez cliquer ici pour télécharger cette vidéo.
Figure supplémentaire 1 : Exemples représentatifs de conditions de stimulus générées à l’aide du générateur IPP. (A) essai de stimulus seul, (B) essai d’inhibition pré-impulsion (pré-impulsion + impulsion), (C) essai sans stimulus pour mesurer l’angle de courbure de base seuil des larves non stimulées. Veuillez cliquer ici pour télécharger cette figure.
Discussion
Il est essentiel de valider tout nouveau système de test comportemental dans le but d’améliorer et d’affiner les protocoles de recherche neurocomportementale. Dans la présente étude, la capacité de deux systèmes et logiciels disponibles dans le commerce à induire une réponse de sursaut acoustique chez les larves de poisson-zèbre et à détecter et quantifier la modulation pharmacologique précédemment décrite de ces comportements a été évaluée.
Un certain nombre de modifications et de dépannages ont été effectués afin d’optimiser la configuration. Le logiciel par défaut pour l’analyse des réponses C-start était tel que l’analyse se poursuivait automatiquement après l’acquisition des données de chaque expérience (22 essais/plaque constituaient une expérience). Cela réduisait le nombre de plaques pouvant être traitées par jour, réduisant ainsi le débit (5 plaques par jour). Pour éviter cette limitation, il était nécessaire de découpler le logiciel d’analyse du processus de collecte de données, ce qui a permis d’augmenter le débit à une moyenne de 10 plaques par jour. Ainsi, la décision de se tourner vers un logiciel d’analyse indépendant pour l’analyse en non-direct s’est avérée fructueuse et plus efficace. Pour éviter les interférences d’ombres ou d’autres débris qui introduisent du bruit dans les données, il est recommandé de remplir complètement les puits avec du fluide, d’éliminer toutes les bulles et d’éviter les particules de nourriture ou similaires qui peuvent être confondues avec des larves, générant ainsi du bruit dans les données. Après étalonnage des stimuli sonores, l’intensité maximale pouvant être atteinte par le système d’amplification, telle que capturée par le dB-mètre, était de 85 dB re, tandis que le bruit de fond initial dans la chambre d’essai était de 60 dB re. Il en résultait une fenêtre de dB étroite dans laquelle opérer. Par conséquent, il était essentiel de garder le bruit de fond aussi minimal que possible. Pour y parvenir, un matériau acoustique parafon (voir Tableau des matériaux) a été utilisé pour construire une couche supplémentaire d’isolation autour de la chambre d’essai et une couche supplémentaire d’isolation à l’aide d’un faisceau de cabine vocale (voir Tableau des matériaux). Grâce à ces couches d’isolation, le bruit de fond à l’intérieur de la chambre d’essai a été réduit avec succès de 60 dB à 45 dB re.
À l’heure actuelle, l’un des avantages de cette configuration est que tous les composants sont disponibles dans le commerce et, en tant que tels, ne se limitent pas à quelques laboratoires. Les personnes ayant une connaissance limitée du langage de codage peuvent l’utiliser, car le protocole est plutôt facile à comprendre et à suivre. Par exemple, en utilisant le système IPP, il a été possible d’émettre des impulsions et des pré-impulsions à divers intervalles entre les stimuli et entre les essais, ainsi que de capturer les réponses larvaires à ces stimuli. Une fois ces comportements capturés, ils ont pu être classifiés à l’aide du logiciel d’analyse en répondants et non-répondeurs. Le groupe des répondeurs a été classé comme étant des larves présentant un C-start de 30° ou plus à une latence de <50 ms. De plus, la réponse aux IPP est modulée par des médicaments qui ciblent la signalisation dopaminergique et glutamatergique (examiné par Geyer et ses collègues27). Conformément aux études précédentes, l’apomorphine, un agoniste non sélectif des récepteurs de la dopamine, a réduit l’inhibition pré-impulsion de la réponse de sursaut chez les larves de poisson-zèbre, tandis que l’halopéridol, un antagoniste de la dopamine, a amélioré la réponse. Chez les larves de poisson-zèbre, il a été démontré que la kétamine module l’IPP différemment en fonction de la durée de l’ISI16. Dans l’étude susmentionnée, l’IPP larvaire a été augmenté à 30 ms mais supprimé à 500 ms ISI lorsqu’il a été prétraité avec de la kétamine. Bien que cette étude n’ait pas utilisé l’ISI variable, l’observation selon laquelle la kétamine a augmenté l’IPP à un ISI de 100 ms le rend comparable aux données de l’étude précédente lorsqu’un ISI de 30 ms a été utilisé. L’étude a démontré qu’en combinant ces systèmes disponibles dans le commerce, il est possible d’effectuer le dosage des IPP et de détecter de manière fiable les changements pharmacologiquement induits dans la réponse des larves de poisson-zèbre. Une limite du système est que la caractéristique du point de nez suivie par le logiciel d’analyse tombe toujours sur l’un des yeux des larves, créant ainsi un angle de base. Pour surmonter cela, il est nécessaire de toujours déterminer l’angle de courbure de base des larves non stimulées, qui s’est avéré être de ~30° pour les larves utilisées dans cette étude. C’est ainsi que l’on a choisi 30° comme seuil de ce qui a été considéré comme une réponse positive C-start chez les larves effrayées. Si ces points sont pris en compte, il devrait être possible d’effectuer le dosage de l’IPP dans n’importe quel laboratoire ayant accès à l’équipement de configuration. Cet article ne s’est pas concentré sur la catégorisation de la cinématique de la réponse de sursaut en latence courte et latence longue, comme indiqué précédemment16, en raison de l’étendue de la variabilité de la latence. Par conséquent, seules les réponses C-start <50 ms après le début du stimulus ont été utilisées15.
Il a été rapporté que les différences de souche influencent le comportement du poisson-zèbre dans plusieurs essais 28,29,30,31 ainsi que la sensibilité auditive 32. Par conséquent, il est essentiel de déterminer l’angle de courbure de base de chaque déformation testée. Étant donné que les sensibilités auditives peuvent également être différentes, il est crucial de déterminer les réponses de sursaut de base, l’intensité sonore la plus adaptée comme stimulus pré-impulsionnel ou de sursaut pour chaque souche et à quelle durée le stimulus est présenté. L’ISI est un autre paramètre qui doit être soigneusement pris en compte, car certains médicaments peuvent augmenter ou réduire l’IPP en fonction de l’intervalle entre le début du stimulus pré-impulsionnel et le début du stimulus de sursaut16. On s’attend à ce que les laboratoires intéressés par l’étude de la fonction cognitive, des troubles neuropsychiatriques et de l’audition (fonction auditive) trouvent cette configuration et ce protocole d’IPP utiles pour le criblage de leurs modèles pharmacologiques et/ou génétiques. Ce protocole fournit également une base pour le criblage à haut débit de banques de composés.
Déclarations de divulgation
Les auteurs ne déclarent aucun intérêt financier concurrent.
Remerciements
Nous remercions Ana Tavara et João Paulo R. P. Santana pour l’excellent soin des poissons et l’aide précieuse pour les tests et la mise en place des cabines d’insonorisation, ainsi que le Dr Wietske van der Ent pour son soutien initial dans la configuration du logiciel EthoVision. Cette étude a été financée par le Conseil norvégien de la recherche (ISP, BIOTEK2021/ DigiBrain).
matériels
| Name | Company | Catalog Number | Comments |
| Apomorphine | Sigma Aldrich | A4393 | Dopamine agonist |
| dB meter | PCE instruments | PCE-MSM 4 | For measuring stimulus intensity |
| DMSO | Sigma Aldrich | D8418 | For dissolving organic solutes |
| Dynavox Amplifier | Dynavox | CS-PA1 MK | For delivering acoustic stimuli |
| EthoVision XT | Noldus, Netherlands | EthoVision XT, version 14 | Automated tracking software |
| GraphPad Prism | GraphPad Software | Version 8 | Statistical analysis software |
| Haloperidol | Sigma Aldrich | H1512 | Dopamine antagonist |
| Ketamine | Sigma Aldrich | Y0000450 | NMDA receptor antagonist |
| parofon acoustics materials | Paroc | 8528308 | Helps reduce background noise in the test cabinet |
| t.akustik Vocal Booth Bundle | Thormann, Germany | 458543 | Helps reduce background noise in the test cabinet |
| ZebraBox Revo with PPI add-ons | ViewPoint, France | ZebraBox Revo with PPI add-ons | Includes hardware and software |
Références
- Gawel, K., Banono, N. S., Michalak, A., Esguerra, C. V. A critical review of zebrafish schizophrenia models: Time for validation. Neuroscience & Biobehavioral Reviews. 107, 6-22 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Kalueff, A. V., Stewart, A. M., Gerlai, R. Zebrafish as an emerging model for studying complex brain disorders. Trends in Pharmacological Sciences. 35 (2), 63-75 (2014).
- Panula, P., et al. The comparative neuroanatomy and neurochemistry of zebrafish CNS systems of relevance to human neuropsychiatric diseases. Neurobiology of Disease. 40 (1), 46-57 (2010).
- Kokel, D., Peterson, R. T. Chemobehavioural phenomics and behaviour-based psychiatric drug discovery in the zebrafish. Briefings in Functional Genomics and Proteomics. 7 (6), 483-490 (2008).
- Basnet, R. M., Zizioli, D., Taweedet, S., Finazzi, D., Memo, M. Zebrafish Larvae as a Behavioral Model in Neuropharmacology. Biomedicines. 7 (1), 23 (2019).
- Henry, J., Wlodkowic, D. Towards High-Throughput Chemobehavioural Phenomics in Neuropsychiatric Drug Discovery. Marine Drugs. 17 (6), (2019).
- . Behavioural measurement system | Laval zebrafish | Drosophila | Daphnia | insects | Products | Zantiks Available from: https://zantiks.com/products/zantiks-mwp (2020)
- . Observation chamber for zebrafish research - DanioVision Available from: https://www.noldus.com/daniovision/observation-chamber (2020)
- . EthoVision XT - Video tracking software | Noldus Available from: https://www.noldus.com/ethovision-xt (2020)
- Gould, T. D., Gottesman, I. I. Psychiatric endophenotypes and the development of valid animal models. Genes, Brain and Behavior. 5 (2), 113-119 (2006).
- van den Buuse, M. Modeling the Positive Symptoms of Schizophrenia in Genetically Modified Mice: Pharmacology and Methodology Aspects. Schizophrenia Bulletin. 36 (2), 246-270 (2010).
- . Acoustic startle modification as a tool for evaluating auditory function of the mouse: Progress, pitfalls, and potential. Abstract - Europe PMC Available from: https://europepnc.org/article/PMC/5446932 (2020)
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. Journal of Experimental Biology. 216 (18), 3504-3513 (2013).
- Burgess, H. A., Granato, M. Sensorimotor Gating in Larval Zebrafish. Journal of Neuroscience. 27 (18), 4984-4994 (2007).
- Eaton, R. C., Farley, R. D., Kimmel, C. B., Schabtach, E. Functional development in the mauthner cell system of embryos and larvae of the zebra fish. Journal of Neurobiology. 8 (2), 151-172 (1977).
- SR-LAB - San Diego Instruments Startle Response. San Diego Instruments Available from: https://sandiegoinstruments.com/product/sr-lab-startle-response/ (2020)
- Startle packages - Med Associates Inc. Med Associates Inc Available from: https://www.med-associates.com/product-category/acoustic-startle-reflex-packages/ (2020)
- Startle response & Pre-pulse inhibition test. O'HARA & CO.,LTD Available from: https://ohara-time.co.jp/products/startle-response-pre-pulse-inhibition-test/ (2020)
- Thyme, S. B., et al. Phenotypic Landscape of Schizophrenia-Associated Genes Defines Candidates and Their Shared Functions. Cell. 177 (2), 478-491 (2019).
- Privat, M., et al. Sensorimotor Transformations in the Zebrafish Auditory System. Current Biology. 29 (23), 4010-4023 (2019).
- Gerlai, R. Reproducibility and replicability in zebrafish behavioral neuroscience research. Pharmacology Biochemistry and Behavior. 178, 30-38 (2019).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. , (2019).
- Bhandiwad, A. A., Sisneros, J. A. Revisiting Psychoacoustic Methods for the Assessment of Fish Hearing. Fish Hearing and Bioacoustics: An Anthology in Honor of Arthur N. Popper and Richard R. Fay. , 157-184 (2016).
- Geyer, M. A., Krebs-Thomson, K., Braff, D. L., Swerdlow, N. R. Pharmacological studies of prepulse inhibition models of sensorimotor gating deficits in schizophrenia: a decade in review. Psychopharmacology. 156 (2-3), 117-154 (2001).
- Lange, M., et al. Inter-Individual and Inter-Strain Variations in Zebrafish Locomotor Ontogeny. PLOS ONE. 8 (8), 70172 (2013).
- Liu, X., et al. Strain-dependent differential behavioral responses of zebrafish larvae to acute MK-801 treatment. Pharmacology Biochemistry and Behavior. 127, 82-89 (2014).
- Loucks, E., Carvan, M. J. Strain-dependent effects of developmental ethanol exposure in zebrafish. Neurotoxicology and Teratology. 26 (6), 745-755 (2004).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLOS ONE. 12 (4), 0175420 (2017).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hearing research. 341, 220-231 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon