Method Article
Pharmakologische Validierung der Präpulshemmung der Schreckreaktion bei Zebrafischlarven mit einem kommerziellen automatisierten System und Software
In diesem Artikel
Zusammenfassung
Hier beschreiben wir ein Protokoll, das kommerziell erhältliche automatisierte Systeme verwendet, um den Prepuls-Inhibitions-Assay (PPI) in Zebrafischlarven pharmakologisch zu validieren.
Zusammenfassung
Es gibt zwar eine Fülle von kommerziellen und standardisierten automatisierten Systemen und Software für die Durchführung des Prepuls-Inhibitions-Assays (PPI) bei Nagetieren, aber nach unserem besten Wissen wurden bisher alle PPI-Assays, die am Zebrafisch durchgeführt wurden, mit maßgeschneiderten Systemen durchgeführt, die nur einzelnen Gruppen zur Verfügung standen. Dies hat Herausforderungen mit sich gebracht, insbesondere im Hinblick auf Fragen der Reproduzierbarkeit und Standardisierung von Daten. In der vorliegenden Arbeit haben wir ein Protokoll entwickelt, das kommerziell erhältliche automatisierte Systeme zur pharmakologischen Validierung des PPI-Assays in Zebrafischlarven verwendet. In Übereinstimmung mit den veröffentlichten Ergebnissen konnten wir die Ergebnisse von Apomorphin, Haloperidol und Ketamin auf die PPI-Reaktion von Zebrafischlarven 6 Tage nach der Befruchtung replizieren.
Einleitung
Die Larve des Zebrafisches (Danio rerio) ist aufgrund ihrer zahlreichen Vorteile ein geeigneter Kandidat für die Modellierung psychiatrischer Erkrankungen wie Schizophrenie (rezensiert von Gawel et al.1). Dazu gehören ein vollständig sequenziertes Genom mit einer Sequenzhomologie von 70 % zu menschlichen Orthologen2, das Vorhandensein von Vorwärts- und Rückwärtsgenetischen Werkzeugen zur Manipulation des Genoms und zur Identifizierung des Beitrags eines bestimmten Gens zur Entwicklung oder Krankheit3 sowie das Vorhandensein wichtiger Neurotransmitter von Menschen und Nagetieren im Zebrafischgehirn4. Im Zebrafisch gibt es mehrere neurophänotypische Domänen wie Angst, Lernen und Gedächtnis3. Optische Transparenz und Empfindlichkeit gegenüber den Hauptklassen neurotroper Arzneimittel machen es zu einem idealen Kandidaten der Wahl für pharmakologische Manipulationen und phänotypisches Wirkstoffscreening 5,6.
Für die Durchführung eines Hochdurchsatz-Wirkstoffscreenings ist die Automatisierung und das Vorhandensein eines robusten Endophänotyps von großer Bedeutung7. Zum Beispiel wurde eine Vielzahl von automatischen Aufzeichnungstechniken entwickelt, um das Verhalten von Zebrafischlarven zu messen, wie z. B. Thigmotaxis, Schreckreaktion, optokinetische Reaktion, optomotorische Reaktion, Gewöhnung, Beutefang, Schlaf-Wach-Verhalten, Bewegungsverhalten und einige andere6. Während einige Laboratorien maßgeschneiderte Systeme für die automatisierte Messung und Analyse einiger dieser Verhaltensweisen entwickeln, gibt es kommerziell erhältliche Bildgebungs- und Softwaresysteme 8,9,10,11. Die Präpulshemmung (PPI), eine Form des sensomotorischen Gatings, bei der die Schreckreaktion reduziert wird, wenn kurz vor dem überraschenden Reiz ein schwacher, nicht erschreckender Reiz präsentiert wird, wurde als Endophänotyp für die Untersuchung von Schizophrenie in Tiermodellen verwendet (überprüft von12,13). Darüber hinaus haben die akustische Schreckreaktion (ASR) und PPI eine nützliche Rolle bei der Untersuchung des Hörens und der Hörfunktion in Tiermodellen wie dem Zebrafisch gespielt14,15. Die Zebrafischlarve zeigt einen charakteristischen C-Start als Reaktion auf einen unerwarteten erschreckenden Reiz, der durch einen schwächeren Reiz, den sogenannten Vorpuls, abgeschwächt wird. Der C-Start wurde lange Zeit als Fluchtverhalten beschrieben, das von unterschiedlichen neuronalen Zellpopulationen gesteuert wird, und wurde bei der Zebrafischlarve gründlich charakterisiert 15,16,17.
Es gibt eine Fülle von kommerziellen und standardisierten automatisierten Systemen und Software für die Durchführung des PPI-Assays bei Nagetieren 18,19,20. Nach bestem Wissen und Gewissen wurden jedoch alle PPI-Assays, die bisher am Zebrafisch durchgeführt wurden, mit maßgeschneiderten Systemen durchgeführt, die nur für die einzelnen Gruppen 15,16,21,22 verfügbar sind. Dies stellt Herausforderungen für die Reproduzierbarkeit und Reproduzierbarkeit von Daten im Hinblick auf die Standardisierungdar 23.
Kürzlich hat ein bekannter Anbieter in der Zebrafisch-Community ein Setup entwickelt, das mit einer schnellen Kamera und PPI-Generator-Add-ons ausgestattet ist, um den PPI-Assay bei Zebrafischlarvendurchzuführen 24. Die Kamera zeichnet mit 1000 Bildern pro Sekunde auf, was die Aufzeichnung von schnell wirkenden Verhaltensweisen wie dem C-Start ermöglicht, während der PPI-Generator eine benutzergesteuerte Abgabe verschiedener akustischer Reize ermöglicht, um eine Schreckreaktion hervorzurufen24. Hier kombinieren wir das oben genannte System mit einem kommerziell erhältlichen umfassenden Softwarepaket, das für die automatisierte Analyse komplexer Verhaltensweisen11 entwickelt wurde, um ein Protokoll für die Durchführung von PPI-Response-Assays bei Zebrafischlarven zu generieren. Wir validieren die PPI-Reaktion pharmakologisch mit 1) Apomorphin, einem Dopaminagonisten, von dem bekannt ist, dass er Defizite im PPI verursacht; 2) Haloperidol, ein Dopaminantagonist und Antipsychotikum, von dem bekannt ist, dass er PPI erhöht, und 3) Ketamin, ein NMDA-Rezeptor-Antagonist, von dem bekannt ist, dass er PPI moduliert.
Protokoll
Alle Tierversuche wurden vom Überwachungs- und Antragssystem der norwegischen Behörde für Lebensmittelsicherheit (FOTS-18/106800-1) genehmigt.
1. Haltung von Zebrafischen
- Verpaarungen von adulten männlichen und weiblichen Wildtyp-Zebrafischbeständen (Danio rerio), die am Vorabend unter Standardbedingungengehalten werden 25 . Hier wird der Tupfel-Stamm der Langflosse (TL) verwendet.
- Entfernen Sie die Barrieren am nächsten Morgen und lassen Sie sie durch natürliches Laichen paaren.
- Sammle Eier aus den Belegbecken.
- Entfernen Sie unbefruchtete Eier und andere Ablagerungen, geben Sie die Eier in Petrischalen (n = 60) und ziehen Sie sie in einem Inkubator bei 28 °C im Embryomedium auf: 1,5 mM HEPES, pH 7,6, 17,4 mM NaCl, 0,21 mM KCl, 0,12 mM MgSO4 und 0,18 mM Ca(NO3)2.
- Erneuern Sie die Hälfte des Embryomediums und entfernen Sie abgestorbene Larven täglich bis 6 dpf.
HINWEIS: Alle Versuche wurden an einzelnen Larven 6 Tage nach der Befruchtung (dpf) durchgeführt.
2. Pharmakologische Wirkstoffe und Vorbehandlung der Larven
- Apomorphin und Ketamin in E3-Medium auflösen, um 500 μM bzw. 10 mM Stammlösungen herzustellen.
- Lösen Sie Haloperidol in 100 % Dimethylsulfoxid (DMSO) auf, um eine 10 mM Stammlösung herzustellen. Die Endkonzentration des verwendeten DMSO betrug 0,1 %.
- Verwenden Sie 0,1 % DMSO und E3-Medium als Fahrzeugsteuerung.
- Verwenden Sie die folgenden Endkonzentrationen von Arzneimitteln: 10 mg/ml Apomorphin, 1 mM Ketamin und 20 μM Haloperidol16.
- Die Larven der Apomorphin- und Ketamingruppen werden 10 Minuten lang und die Kontrollgruppen mit Haloperidol und DMSO-Vehikel 20 Minuten lang belichtet16.
3. Einrichtung vor dem Verhaltenstest
- Am Tag des Experiments werden die Larven und alle relevanten Materialien in den Versuchsraum gebracht. Stellen Sie den Experimentierraum auf eine Temperatur von 27 ± 1 °C ein.
- Stellen Sie sicher, dass die Hintergrundgeräusche in der Prüfkammer so gering wie möglich sind, vorzugsweise nicht mehr als 45 dB Schalldruckpegel (SPL).
- Installieren Sie das Sonometermikrofon des Dezibel (dB) Messgeräts in der Prüfkammer (die Öffnung für den Einbau ist vom Hersteller bereits gebohrt).
- Um die Geräuschkulisse im Raum zu reduzieren, isolieren Sie die Prüfkammer mit einer speziell angefertigten Schallkabine (siehe Abbildung 1B für einen Überblick über den Aufbau).
- Bereiten Sie eine 96-Well-Platte für den Prepuls-Inhibitionstest vor.
HINWEIS: Die Videokamera hat eine Auflösung von 2048 × 500 Pixeln, was bedeutet, dass nur maximal 3 Spuren (33 Wells) gleichzeitig abgebildet werden können.- Verwenden Sie eine speziell angefertigte Acrylplatte im 96-Well-Format, um Interferenzen durch Schatten zu reduzieren.
HINWEIS: Die Maße für die benutzerdefinierte Platte finden Sie auf der folgenden Website: https://zenodo.org/record/3739378#.XooyLW5uKas
- Verwenden Sie eine speziell angefertigte Acrylplatte im 96-Well-Format, um Interferenzen durch Schatten zu reduzieren.
- Mit Hilfe einer Transferpipette werden 310 μl Expositionslösung/-medium mit einer Larve in jede Vertiefung überführt.
- Kalibrieren und messen Sie die Stimulusintensität mit dem Lautstärkeregler des Stereoverstärkers bzw. einem Dezibelmeter.
- Registrieren Sie die maximale Schallintensität im Abschnitt "Pegelreferenz".
4. Stimulusparameter und Videoaufnahme
- Schalten Sie den Computer, das Verstärkersystem und das dB-Meter ein (siehe Abbildung 1A für einen Überblick über die Einrichtung).
- Verwenden Sie den Lautstärkeregler, indem Sie ihn auf Minimum oder Maximum drehen, um die Klangintensität einzustellen.
- Überprüfen Sie den Schallpegel jedes Mal mit dem dB-Meter, der Lautstärkeregler wird eingestellt. Dies ist wichtig, um die maximale und minimale Schallintensität zu ermitteln, die durch das Setup erzeugt werden kann.
HINWEIS: Das dB-Messgerät berechnet den Effektivwert-dB-Ausgang für den Stimulus. Das System erzeugt den Schall in den festen Komponenten der Prüfkammer, hält die Platte fest und erzeugt gleichzeitig eine Vibration in der horizontalen Ebene der gesamten Plattenstütze.- Stellen Sie den Lautstärkeregler auf Maximum, messen Sie die Schallintensität mit dem dB-Meter und verwenden Sie diesen Wert.
- Überprüfen Sie den Schallpegel jedes Mal mit dem dB-Meter, der Lautstärkeregler wird eingestellt. Dies ist wichtig, um die maximale und minimale Schallintensität zu ermitteln, die durch das Setup erzeugt werden kann.
- Definieren Sie auf der Benutzeroberfläche des PPI-Generators die Parameter: Inter-Stimulus-Intervall, dargestellt als Verzögerung; Intervall zwischen den Versuchen, dargestellt als Akquisitionsdelta-Zeit; Dauer des Vorimpulses etc.
- Stellen Sie bei Versuchen mit reinem Prepuls sicher, dass die Parameter "Amplitude" oder "Dauer des Stimulus " für Startle auf Null gesetzt sind und umgekehrt für Versuche mit Nur-Startle.
- Um eine Testliste zu erstellen, wählen Sie Hinzufügen aus > geben Sie der Testversion einen Namen. Zum Beispiel: "Vorpuls allein 50 dB".
HINWEIS: Man kann so viele Versuche generieren, wie man möchte, aber seien Sie vorsichtig, wie lang die Liste ist, da dies das Programm zum Absturz bringen kann.- Verschachteln Sie Prepuls-Versuche mit Puls-Nur-Puls-Versuchen in allen PPI-Experimenten in einer pseudozufälligen Reihenfolge. Wenn in einem Experiment mehrere Stimuli präsentiert werden, wird ein Inter-Trial-Intervall (ITI) von 30 s verwendet.
HINWEIS: In dieser Studie wurden ein 100 ms Start-Stimulus (Puls) von 660 Hz und 5 ms Vorpuls-Stimuli von 440 Hz verwendet. Für PPI-Experimente betrug das Interstimulus-Intervall (ISI) 100 ms.
- Verschachteln Sie Prepuls-Versuche mit Puls-Nur-Puls-Versuchen in allen PPI-Experimenten in einer pseudozufälligen Reihenfolge. Wenn in einem Experiment mehrere Stimuli präsentiert werden, wird ein Inter-Trial-Intervall (ITI) von 30 s verwendet.
- Um das Protokoll zu speichern, wählen Sie Datei > Speichern unter.
- Die Lichtverhältnisse in der Prüfkammer sind wie folgt einzustellen.
- Starten Sie den USB-Messrechner, wählen Sie Analogausgang und gehen Sie dann zu D/A OUT O (P13), um Änderungen an der Beleuchtung vorzunehmen. Ein Wert von Null bedeutet, dass kein Licht vorhanden ist, während eine Erhöhung des D/A-OUT-O-Werts die Lichtintensität in der Box erhöht. Für alle Experimente wurde eine Lichtstärke von 100 verwendet.
- Richten Sie die Kamera ein
- Starten Sie die Software und warten Sie, bis die Kamera geladen ist.
- Wählen Sie Anpassungen (auf der rechten Seite) und stellen Sie die Bildrate auf 1.000 ein. Klicken Sie dann auf Anwenden, um die Änderung vorzunehmen.
- Akklimatisieren Sie die Larven 5 min lang in einer 100% lichtbeleuchteten Testkammer, bevor die Versuche gestartet werden.
- Um ein Experiment zu starten, wählen Sie im PPI-Generator das Menü "Experiment" aus, klicken Sie auf "Ausführen" und wählen Sie das Well-Format aus (z. B. 33 Wells).
- Stellen Sie immer sicher, dass die Kamerasoftware mit den richtigen Einstellungen gestartet wird, bevor Sie ein Experiment durchführen.
- Erwerben Sie für jeden Versuch ein 2-Sekunden-Video.
- Stellen Sie sicher, dass die Bildrate der Erfassung auf 1.000 eingestellt ist.
5. Automatisierte Verfolgung und Analyse des akustischen Schreckverhaltens und der PPI
- Einrichtung des Protokolls.
- Starten Sie die Analysesoftware (siehe Materialtabelle). Wählen Sie Neu aus Vorlage > Vordefinierte Vorlage anwenden und durchlaufen Sie dann die anderen Menüs (Details unten).
- Wählen Sie unter Videoquelle aus der Videodatei aus.
- Videodatei durchsuchen. Legen Sie das Motiv als Fisch- > Zebrafischlarven > Zonenvorlage fest (keine Vorlage). Geben Sie unter Arenen die Anzahl der Arenen an.
- Geben Sie unter Fächer die Anzahl der Themen pro Arena an (auf 1 festgelegt).
- Wählen Sie Erkennung von Mittelpunkt, Nasenpunkt und Heckbasis unter Verfolgte Merkmale (siehe Abbildung 2A,B).
HINWEIS: Dies ist wichtig, um den Körperwinkel des C-Start-Ansprechverhaltens zu berechnen (siehe Abbildung 2C). - Klicken Sie auf Name > Speichern unter. Die verwendeten Einheiten sind mm, s, deg für Entfernung, Zeit bzw. Drehung.
HINWEIS: Denken Sie daran, die gleiche Einheit für die Kalibrierung der Waage zu verwenden.
- Wählen Sie die Arena-Einstellung.
- Klicken Sie auf Hintergrundbild erfassen.
- Führen Sie die Schritte im Menü auf der rechten Seite aus (im Zweifelsfall verwenden Sie das Hilfemenü).
- Wählen Sie das Kreiszeichenwerkzeug, um die Arenen zu zeichnen.
- Wählen Sie Einstellungen für die Teststeuerung aus > erstellen Sie einen neuen >Namen.
- Wählen Sie Erkennungseinstellungen und führen Sie die Schritte im Menü auf der rechten Seite aus.
- Stellen Sie die Samplerate auf 25 ein. Wählen Sie erweiterte Erkennungseinstellungen aus. Wählen Sie unter Methode die Option Dynamische Subtraktion, Erweitertes Modell/adulter Fisch aus, stellen Sie dann die Motivfarbe im Vergleich zum Hintergrund auf Dunkler ein und verschieben Sie den Schieberegler, um den Kontrast der Larve zu definieren.
- Wählen Sie unter Motivkontur die Option Zuerst erodieren, dann erweitern und die Werte für Konturerosion und -erweiterung erhöhen, bis das Tier vollständig erkannt wird.
- Speichern Sie das Protokoll und verwenden Sie es für nachfolgende Analysen der erfassten PPI-Videos.
- Starten Sie die Analysesoftware (siehe Materialtabelle). Wählen Sie Neu aus Vorlage > Vordefinierte Vorlage anwenden und durchlaufen Sie dann die anderen Menüs (Details unten).
- Einrichtung der Testliste.
- Wählen Sie eine Versuchsliste, definieren Sie unabhängige Variablen wie Larven-ID, Behandlung, Stimulustyp usw. Wählen Sie den Pfad der Videos aus und definieren Sie eine Liste von Testversionen für die Batch-Erfassung.
- Einrichtung der Akquise.
HINWEIS: Wenn eine Testliste erstellt wurde, kann eine Batch-Erfassung der Videos durchgeführt werden.- Wenn einige Tracks verloren gehen, verwenden Sie den Track-Editor, um die getrackten Features anzupassen.
- Schließen Sie die Tracking-Fehler von der Analyse aus, die nach der Verwendung des Track-Editors nicht behoben wurden.
- Stellen Sie das Spurglättungsprofil auf 1 mm ein, um das Rauschen der Daten zu verringern. Dies kann anhand der Hintergrundaktivität der Larven angepasst werden.
- Aufbau der Analyse.
- Um die zu analysierenden Versuche auszuwählen, wählen Sie Datenprofile und definieren Sie Tracks basierend auf der unabhängigen Variablen von Interesse.
HINWEIS: Wenn Komponenten ausgeblendet sind, klicken Sie auf das Augensymbol in der oberen rechten Ecke, um sie anzuzeigen.- Filtern Sie Teile von Studien, die analysiert werden sollen (z. B. basierend auf der Behandlung oder der Art der Stimulusgruppe).
- Wählen Sie einen Teil der zu analysierenden Spuren aus (Nesting). Für diese Studie wurden die Daten für Spuren zwischen dem Einsetzen des Stimulus und 100 ms nach dem Einsetzen des Stimulus verschachtelt.
- Denken Sie daran, alle Filter und Nistkästen mit Pfeillinien zu verbinden, um die Anleitung zu vervollständigen.
- Definieren Sie die zu analysierenden abhängigen Variablen, wählen Sie Analyseprofile aus und geben Sie die gewünschten Variablen an (Fokus auf Körper unter abhängige Variablen).
HINWEIS: Wenn Komponenten ausgeblendet sind, klicken Sie auf das Augensymbol in der oberen rechten Ecke, um sie anzuzeigen.- Doppelklicken Sie auf Körperwinkel. Wählen Sie "Absolute Biegung" aus. Gehen Sie durch die Testeinstellungen , wählen Sie Maximum und klicken Sie dann auf Hinzufügen.
- Doppelklicken Sie auf den Status des Körperwinkels. Stellen Sie das Mittelungsintervall auf 5 Samples ein. Legen Sie den Schwellenwert für den Biegewinkel fest. Um Statistiken für bent zu berechnen, gehen Sie durch Teststatistiken , und wählen Sie Latenz aus, die zuerst hinzugefügt werden soll, > hinzufügen. Wiederholen Sie die Schritte, bis unterschiedliche Schwellenwerte erreicht sind (es wurde ein Schwellenwert zwischen 20 und 80° verwendet) und benennen Sie entsprechend.
- Generierung von Statistiken und Diagrammen.
- Wählen Sie Analyse > Ergebnisse > Statistiken und Diagramme aus und klicken Sie dann auf Berechnen.
- Stellen Sie sicher, dass die Daten- und Analyseprofile auf die richtige Vorlage eingestellt sind, da unter jedem Abschnitt mehrere Vorlagen erstellt werden können.
- Exportieren Sie Versuchs- und Gruppenstatistiken als Tabellenkalkulationsdateien zur Verarbeitung und Analyse.
- Um die zu analysierenden Versuche auszuwählen, wählen Sie Datenprofile und definieren Sie Tracks basierend auf der unabhängigen Variablen von Interesse.
6. Datenanalyse
- Öffnen Sie die Tabellenkalkulation mit den Teststatistiken.
- Wählen Sie die Spalten Körperwinkel, Maximale Grad, gebogene Latenz (der verschiedenen Körperwinkelschwellenwerte) aus.
- Betrachten Sie jede Änderung des Körperwinkels ≥ 30° innerhalb einer Cut-off-Latenz von 50 ms nach Stimulusbeginn als positive C-Start-Reaktion (d. h. als Responder); Diejenigen mit < Körperwinkel von 30° sind Non-Responder.
- Weisen Sie auf binäre Weise einer reagierenden Larve 1 und jeder nicht reagierenden Larve 0 für jede Platte zu.
- Zählen Sie die Gesamtzahl der Responder und Non-Responder-Larven für jede Platte. Berechnen Sie die Responder (%), jeweils berechnet als (Anzahl der antwortenden Larven/Gesamtzahl der Larven) × 100. Larven, die weniger als 30 % auf den Schreckreiz reagieren, sind aus der Analyse auszuschließen16.
ANMERKUNG: Jede Reizintensität, die in der Lage ist, bei mindestens 70 % der Larven eine C-Start-Reaktion hervorzurufen, gilt als geeigneter Schreckreiz16.
- Zählen Sie die Gesamtzahl der Responder und Non-Responder-Larven für jede Platte. Berechnen Sie die Responder (%), jeweils berechnet als (Anzahl der antwortenden Larven/Gesamtzahl der Larven) × 100. Larven, die weniger als 30 % auf den Schreckreiz reagieren, sind aus der Analyse auszuschließen16.
- Berechnen Sie %PPI als 100 × (Prozentsatz, der auf Schreckreiz reagiert − Prozentsatz, der auf Vorimpuls + Schrecksequenz reagiert)/ (Prozentsatz, der auf Schreckimpuls reagiert)16.
7. Statistische Auswertung
- Präsentieren Sie die Daten als Mittelwert ± Standardabweichung, S.D. (siehe Materialtabelle für statistische Software).
- Bestimmen Sie die Auswirkungen unterschiedlicher Präpulsintensitäten auf die Larvenreaktion mit Hilfe einer unidirektionalen ANOVA, gefolgt von einem Tukey-Post-hoc-Test .
- Verwenden Sie eine bidirektionale ANOVA, gefolgt von einem Post-hoc-Test von Holm-Sidak, um die Auswirkungen einer medikamentösen Behandlung auf das PPI-Ansprechen in % bei unterschiedlichen Prepulsintensitäten zu bestimmen.
Ergebnisse
Drei Experimente wurden durchgeführt, um das Protokoll der Kombination mehrerer Systeme zu validieren, um die Hemmung der akustischen Schreckreaktion vor dem Impuls bei der Zebrafischlarve zu analysieren. Zunächst wurde die Fähigkeit getestet, akustische Reize genau abzugeben und die Reaktion der Larven auf den Schreckreiz zu erfassen. Als nächstes wurde die Fähigkeit validiert, die Schreckreaktion zu dämpfen, wenn ein Prepuls-Stimulus präsentiert wird. Schließlich wurde die Fähigkeit nachgewiesen, die pharmakologische Modulation der Präpulshemmung der Schreckreaktion durch die Medikamente Apomorphin, Haloperidol und Ketamin zu detektieren.
Reaktion von Zebrafischlarven auf akustische Schreckreize
Frühere Arbeiten haben gezeigt, dass Zebrafischlarven einen charakteristischen C-Start aufweisen, wenn sie mit erschreckenden akustischen Reizen konfrontiert werden16. Es wurde die Fähigkeit getestet, das Verhalten der Larven zu den Schreckreizen anzuregen und zu erfassen. Es wurde beobachtet, dass die registrierten Larven die C-Start-Reaktion zeigten (Abbildung 2). Ein Stimulus von 70 dB re (100 ms, 660 Hz, Ergänzende Abbildung 1A) war stark genug, um bei ≥70% der Larven eine Reaktion auszulösen (Abbildung 3A). Bei 30-maliger Wiederholung in einem Intervall von 30 s zwischen den Versuchen führte der 70 dB Re-Stimulus nicht zu einer Larvengewöhnung (N = 3 Replikate; 16 Larven/Replikat), wie in Abbildung 3B gezeigt.
Prepulse verringert die Schreckreaktion von Zebrafischlarven auf akustische Reize
Eine Fülle von Beweisen zeigt, dass Prepuls-Stimuli die Reaktion der Larven auf einen Schreckreiz modulieren 15,21,22,26. Es wurde ein Zwei-Puls-Paradigma verwendet, bei dem ein schwacher Stimulus, der als Vorpuls bezeichnet wird, dem erschreckenden Reiz namens Puls vorausging. Die verwendeten Vorpulsstimuli waren entweder 20, 17 oder 14 dB geringer als der Impulsstimulus, der auf 70 dB re eingestellt war. Der Vorpuls (5 ms, 440 Hz) wurde immer 100 ms vor dem Pulsbeginn präsentiert (Ergänzende Abbildung 1B). Jeder getestete Prepuls-Stimulus reduzierte die Reaktion der Larven auf den Puls signifikant. In Abbildung 4 ist die Reaktion der Larven (in %) auf akustische Schreckreize für 6 dpf TL im E3-Medium, N = 6 (16 Larven/Gruppe) dargestellt. Der Prozentsatz der Larven, die auf den Schreckreiz (Puls) reagierten, betrug 79,86 ± 9,772. Erwartungsgemäß verringerte sich die Larvenreaktion, wenn dem Schreckreiz entweder ein Vorpuls von 50, 53 oder 56 dB vorausging, auf 40,87 % ± 11,30 %, 39,58 % ± 7,345 % bzw. 29,17 % ± 9,350 %. Die einseitige Anova-Analyse ergab einen statistischen Unterschied in der Stimuluswirkung auf Larven (F (3, 48) = 57,23, P < 0,0001), wobei Tukeys Mehrfachvergleichstest eine statistische Signifikanz zwischen den Gruppen bei einem Konfidenzintervall von 95 % zeigte.
Pharmakologische Modulation der Präpulshemmung
Frühere Studien zeigten, dass die dopaminergen Medikamente Apomorphin und Haloperidol sowie das glutamaterge Medikament Ketamin die Prepulshemmung bei Larven ebenso wie bei ihren Säugetier- und Nagetieräquivalenten signifikant modulierten16. Auf der Grundlage dieser Studien wurden Konzentrationen für die Validierung des Aufbaus ausgewählt. Das Inter-Stimulus-Intervall (ISI) betrug für alle pharmakologischen Experimente 100 ms.
Wirkung von Apomorphin auf die Hemmung des Präpulses
In Abbildung 5 zeigten Larven, die 10 min lang mit 10 mg/ml Apomorphin vorbehandelt wurden, eine Gesamtreduktion des % PPI im Vergleich zu E3-Kontrolllarven (bidirektionale ANOVA, non RM (Faktoren: Behandlungs- und Präpulsintensitäten; Behandlung: F (1, 34) = 16,21, p = 0,0003; Präpulsintensität: F (2, 34) = 8,674, P = 0,0009, dies zeigte eine nicht signifikante Interaktion: F (2, 34) = 2,514, p = 0,0959). Um die Unterschiede genauer zu untersuchen, zeigte der Post-hoc-Test von Holm-Sidak signifikante Unterschiede in der Schreckreaktion zwischen E3-Kontrolllarven und Apomorphin-behandelten Larven bei den Präpulsintensitäten 53 (p = 0,0126) und 56 (p = 0,0044), jedoch nicht bei 50 dB (p = 0,5813).
Wirkung von Haloperidol auf die Hemmung des Präpulses
Abbildung 6 zeigt einen Gesamtanstieg des %PPI bei Larven, die 20 min lang mit 20 μM Haloperidol vorbehandelt wurden, im Vergleich zu denen in E3-Medium (bidirektionale ANOVA, non RM (Faktoren: Behandlungs- und Präpulsintensitäten; Behandlung: F (1, 32) = 20,75, p < 0,0001; Präpulsintensität: F (2, 32) = 3,147, p = 0,0565, ohne signifikante Wechselwirkung: F (2, 32) = 0,7455, p = 0,4826). Mit dem Holm-Sidak-Post-hoc-Test wurde das Vorhandensein statistischer Signifikanz nur bei den Präpulsintensitäten 53 (p = 0,00489 und 56 (p = 0,0348), nicht aber bei 50 dB (p = 0,067) beobachtet.
Wirkung von Ketamin auf die Hemmung des Vorpulses
Abbildung 7 zeigt, dass es bei unterschiedlichen Präpuls-Stimulusintensitäten Unterschiede in der Schreckreaktion zwischen E3-Kontrolllarven und denjenigen gab, die 10 min lang in 1,0 mM Ketamin vorbehandelt wurden (bidirektionale ANOVA, non RM (Faktoren: Behandlungs- und Präpulsintensitäten; Behandlung: F (1, 35) = 25,46, p < 0,0001; Präpulsintensität: F (2, 35) = 6,018, p = 0,0057, ohne signifikante Wechselwirkung: F (2, 35) = 0,8450, p = 0,4381). Der Post-hoc-Test von Holm-Sidak zeigte Signifikanz nur bei Präpulsintensitäten von 50 (p = 0,0039) und 53 (p = 0,0027), nicht aber bei 56 dB (p = 0,0802).
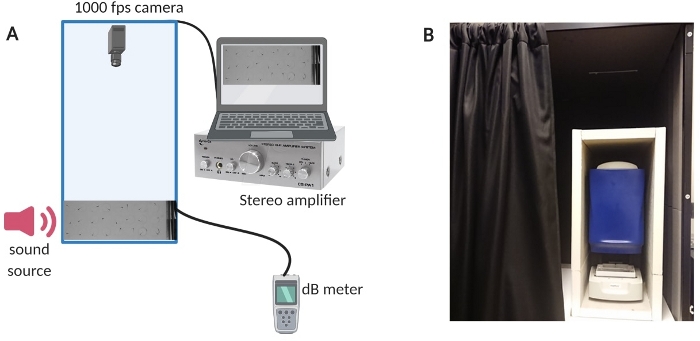
Abbildung 1: Prüfgerät. (A) Überblick über die Einrichtung der Ausrüstung. (B) Hauseigene Isolierung der Aufbauausrüstung zur Minimierung von Hintergrundgeräuschen während der Experimente. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
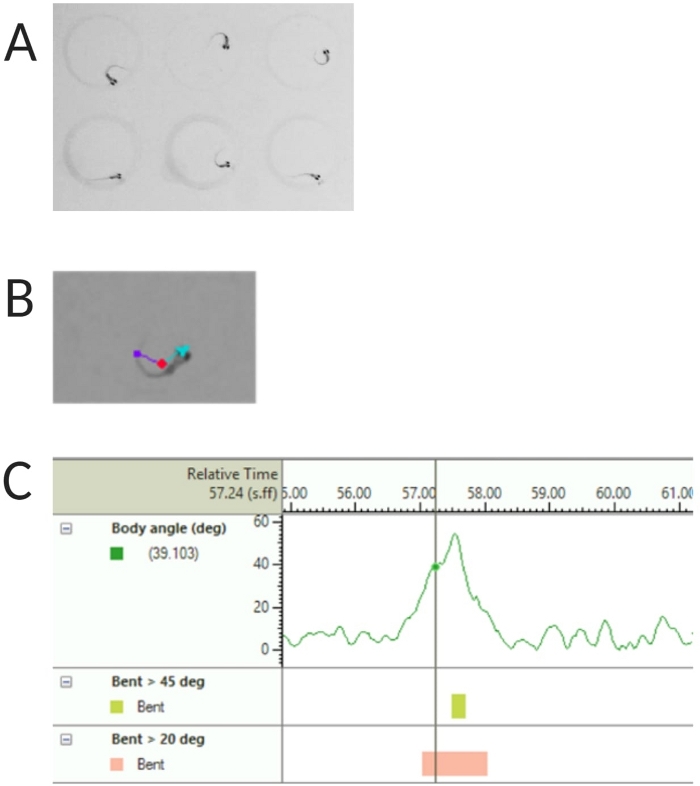
Abbildung 2: Analyse der akustischen Schreckreaktion von Zebrafischlarven. (A) Charakteristischer C-Start, der von 6 Zebrafischlarven bei 6 dpf gezeigt wird. (B) Repräsentatives Bild der drei verfolgten Merkmale, die auf einer Larve mit 6 dpf überlagert sind: Mittelpunkt (rot), Nasenpunkt (cyan) und Schwanzansatz (violett). (C) Repräsentatives Bild des absoluten Biegewinkels, der von einer 6-dpf TL-Wildtyp-Larve angezeigt wird. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
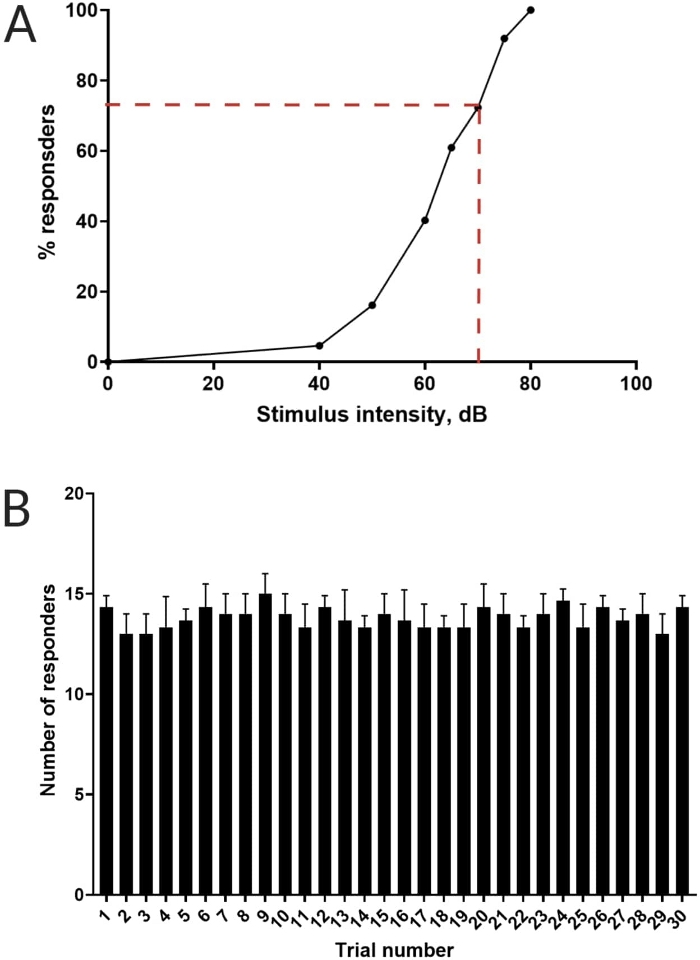
Abbildung 3: Bestimmung der akustischen Schreckschwelle. (A) Eine Reizintensität von 70 dB (dargestellt durch rote Strichlinien) ist in der Lage, bei >70% der Larven (N = 33; 6 dpf TL) eine C-Start-Reaktion auszulösen. (B) Die Larven gewöhnen sich nicht an einen Restimulus von 70 dB, der 30 Mal (Versuche) in einem Intervall von 30 s zwischen den Versuchen präsentiert wird (N = 3 Wiederholungen; 16 Larven/Wiederholung). Die Daten sind als mittlere ± S.D. dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
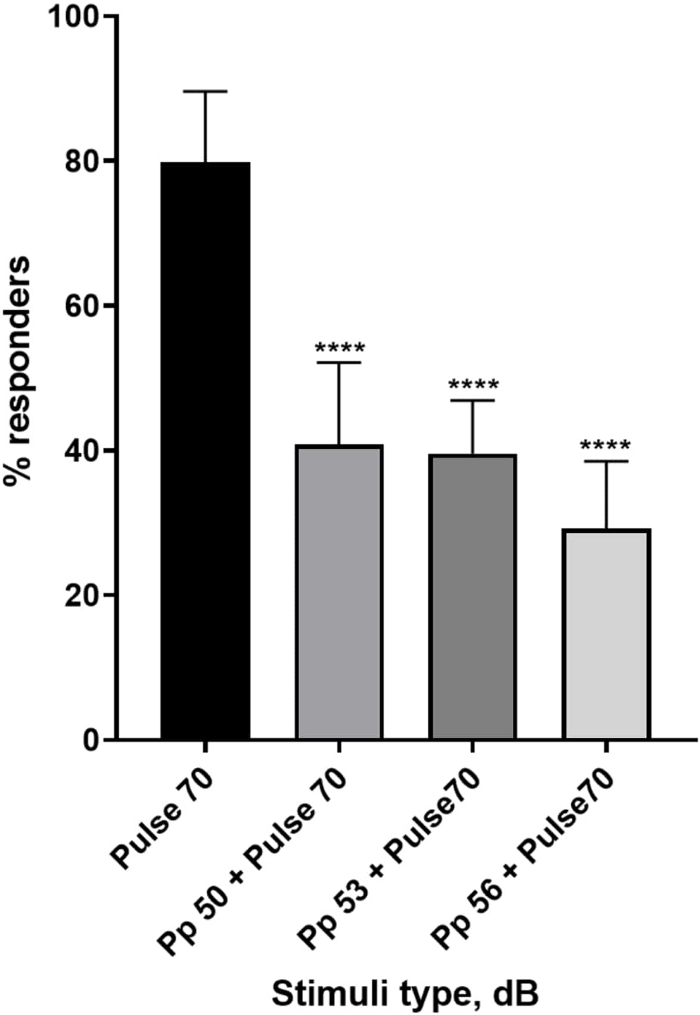
Abbildung 4: Präpulsinduzierte Abnahme der Larvenreaktion (%). Pre-Pulse-Stimuli bei 20, 17 und 14 dB, die niedriger als der 70 dB Wiederholungsreiz sind, führen zu einer Verringerung der Anzahl der C-Start-Responder von Wildtyp-TL-Larven. Alle Daten werden als Mittelwert ± S.D., N = 5 (16 Larven/Gruppe), ****p < 0,0001 dargestellt, signifikant anders als der Schreckstimulus durch Tukeys Post-hoc-Test nach Einweg-ANOVA. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
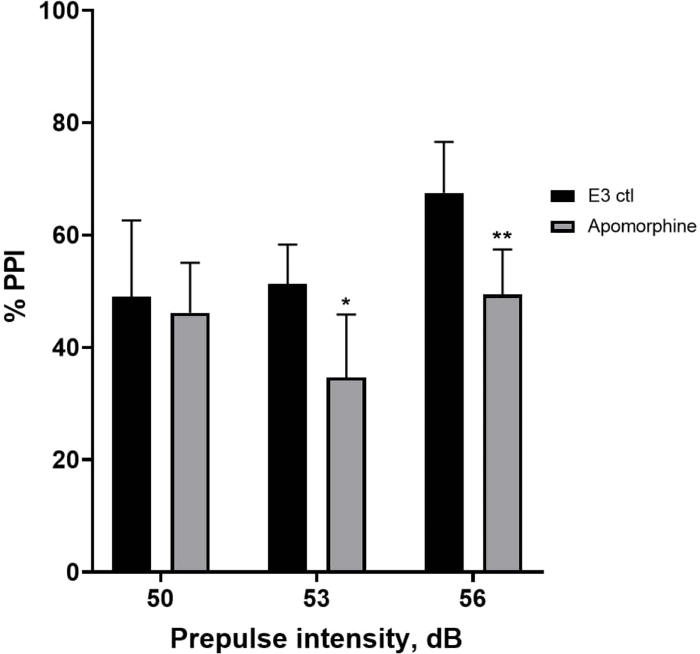
Abbildung 5: Apomorphin-induzierte Defizite in %PPI. Alle Daten werden als Mittelwert ± S.D., N = 4\u20125 (16 Larven/Gruppe) dargestellt, statistisch signifikante Differenz durch den Post-hoc-Test von Holm-Sidak nach bidirektionaler ANOVA. *p = 0,0126, mit E3 ctl/Apomorphin behandelte Gruppe bei 53 dB; **p = 0,0044, mit E3 ctl/Apomorphin behandelte Gruppe bei 56 dB. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
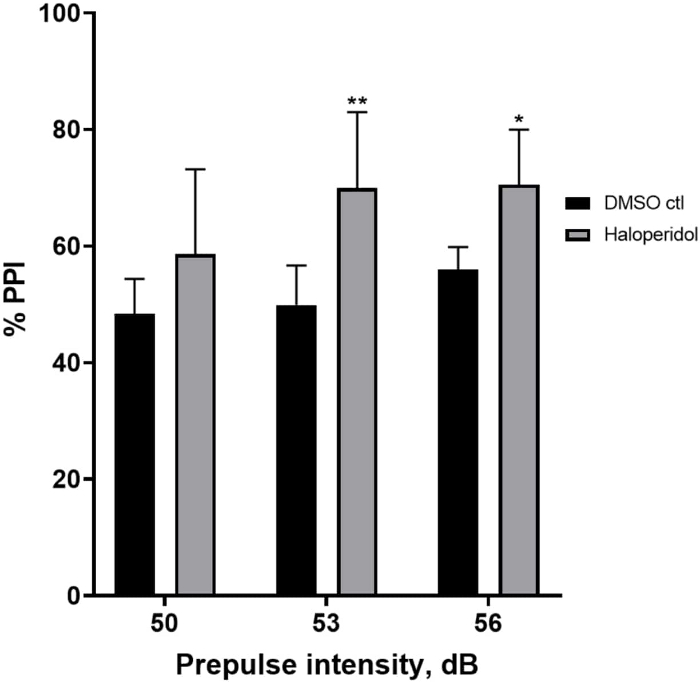
Abbildung 6: Haloperidol-induzierte Erhöhung des %PPI. Alle Daten werden als Mittelwert ± S.D., N = 4\u20125 (16 Larven/Gruppe) dargestellt, statistisch signifikante Differenz durch den Holm-Sidak-Post-hoc-Test nach bidirektionaler Anova. **p = 0,0048, mit DMSO ctl/Apomorphin behandelte Gruppe bei 53 dB; *p = 0,0348, mit DMSO ctl/Apomorphin behandelte Gruppe bei 56 dB. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
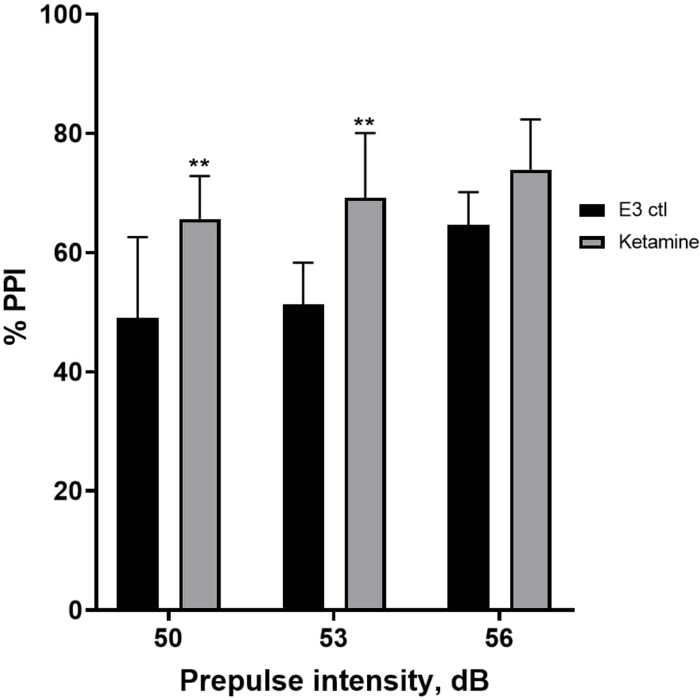
Abbildung 7: Ketamin-induzierte Erhöhung des %PPI. Alle Daten werden als Mittelwert ± S.D, N = 4\u20125 (16 Larven/Gruppe) dargestellt, statistisch signifikante Differenz durch den Holm-Sidak-Post-hoc-Test nach Zwei-Wege-Anova **p = 0,0039, E3 ctl/Apomorphin-behandelte Gruppe bei 50 dB, **p = 0,0027, E3 ctl/Apomorphin-behandelte Gruppe bei 53 dB. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzendes Video 1: Repräsentatives Video von Larven, die als Reaktion auf einen akustischen Schreckreiz von 70 dB einen C-Start zeigen. Bitte klicken Sie hier, um dieses Video herunterzuladen.
Ergänzende Abbildung 1: Repräsentative Beispiele für generierte Stimulusbedingungen mit dem PPI-Generator. (A) Versuch mit reinem Stimulus, (B) Versuch mit Prä-Puls-Hemmung (vor dem Puls + Puls), (C) kein Stimulusversuch zur Messung des Schwellen-Ausgangsbiegewinkels von nicht stimulierten Larven. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Diskussion
Es ist wichtig, jedes neue Verhaltensassay-System zu validieren, mit dem Ziel, die Protokolle für die neurobehaviorale Forschung zu verbessern und zu verfeinern. In der vorliegenden Untersuchung wurde die Fähigkeit von zwei kommerziell erhältlichen Systemen und Software untersucht, eine akustische Schreckreaktion bei Zebrafischlarven zu induzieren und die zuvor beschriebene pharmakologische Modulation solcher Verhaltensweisen zu detektieren und zu quantifizieren.
Es wurden eine Reihe von Modifikationen und Fehlerbehebungen durchgeführt, um das Setup zu optimieren. Die Standardsoftware für die Analyse der C-Start-Antworten war so, dass die Analyse automatisch fortgesetzt wurde, nachdem die Daten für jedes Experiment erfasst worden waren (22 Versuche/Platte stellten ein Experiment dar). Dadurch wurde die Anzahl der Platten, die pro Tag gefahren werden konnten, reduziert, wodurch der Durchsatz (5 Platten pro Tag) reduziert wurde. Um diese Einschränkung zu vermeiden, war es notwendig, die Analysesoftware vom Datenerfassungsprozess zu entkoppeln, was den Durchsatz auf durchschnittlich 10 Platten pro Tag erhöhte. So erwies sich die Entscheidung, auf eine unabhängige Analysesoftware für die Non-Live-Analyse zurückzugreifen, als erfolgreich und effizienter. Um Störungen durch Schatten oder andere Ablagerungen zu vermeiden, die zu Rauschen in die Daten führen, wird empfohlen, die Vertiefungen vollständig mit Medium zu füllen, alle Blasen zu entfernen und Speisereste oder Ähnliches zu vermeiden, die mit Larven verwechselt werden können und dadurch Rauschen in den Daten erzeugen. Nach Kalibrierung der Schallreize betrug die vom Verstärkersystem maximal erreichbare Intensität, wie sie vom dB-Meter erfasst wurde, 85 dB re, während das anfängliche Hintergrundrauschen in der Prüfkammer 60 dB re betrug. Dies führte zu einem engen dB-Fenster, in dem gearbeitet werden konnte. Daher war es wichtig, die Hintergrundgeräusche so gering wie möglich zu halten. Um dies zu erreichen, wurde parafon acoustics Material (siehe Materialtabelle) verwendet, um eine zusätzliche Isolationsschicht um die Prüfkammer und eine zusätzliche Isolationsschicht mit einem Gesangskabinenbündel aufzubauen (siehe Materialtabelle). Mit diesen Isolationsschichten gelang es, die Geräuschkulisse im Prüfraum von anfänglich 60 dB auf 45 dB re zu reduzieren.
Derzeit besteht ein Vorteil dieses Aufbaus darin, dass alle Komponenten kommerziell verfügbar sind und somit nicht nur auf wenige Labore beschränkt sind. Personen mit begrenzten Kenntnissen in der Programmiersprache können es verwenden, da das Protokoll recht einfach zu verstehen und zu befolgen ist. Zum Beispiel war es durch die Verwendung des PPI-Systems möglich, Impulse und Vorimpulse in unterschiedlichen Intervallen zwischen Reizen und Versuchen abzugeben sowie die Reaktionen der Larven auf solche Reize zu erfassen. Sobald diese Verhaltensweisen erfasst waren, konnten sie mit der Analysesoftware in Responder und Non-Responder klassifiziert werden. Die Responder-Gruppe wurde als Larven kategorisiert, die einen C-Start von 30° oder mehr bei einer Latenz von <50 ms aufwiesen. Darüber hinaus wird die PPI-Antwort durch Medikamente moduliert, die auf dopaminerge und glutamaterge Signalwege abzielen (überprüft von Geyer und Kollegen27). In Übereinstimmung mit früheren Studien reduzierte Apomorphin, ein nicht-selektiver Dopaminrezeptoragonist, die Hemmung der Schreckreaktion vor dem Impuls bei Zebrafischlarven, während Haloperidol, ein Dopaminantagonist, die Reaktion verstärkte. Bei Zebrafischlarven wurde gezeigt, dass Ketamin den PPI basierend auf der Dauer des ISI16 unterschiedlich moduliert. In der oben genannten Studie war die PPI der Larven bei 30 ms erhöht, aber bei 500 ms ISI unterdrückt, wenn sie mit Ketamin vorbehandelt wurde. Obwohl in dieser Studie kein variabler ISI verwendet wurde, ist die Beobachtung, dass Ketamin den PPI bei einem ISI von 100 ms erhöhte, vergleichbar mit den Daten der vorherigen Studie, wenn ein ISI von 30 ms verwendet wurde. Die Studie zeigte, dass es durch die Kombination dieser kommerziell erhältlichen Systeme möglich ist, den PPI-Assay durchzuführen und pharmakologisch induzierte Veränderungen in der PPI-Antwort der Zebrafischlarven zuverlässig zu detektieren. Eine Einschränkung des Systems besteht darin, dass das von der Analysesoftware verfolgte Nasenpunktmerkmal immer auf eines der Augen der Larven fällt, wodurch ein Basislinienwinkel entsteht. Um dies zu überwinden, ist es notwendig, immer den Ausgangsbiegewinkel von unstimulierten Larven zu bestimmen, der bei den in dieser Studie verwendeten Larven ~30° betrug. Dies bildete die Grundlage für die Wahl von 30° als Schwelle für das, was als positive C-Start-Reaktion bei erschrockenen Larven angesehen wurde. Wenn diese Punkte berücksichtigt werden, sollte es möglich sein, den PPI-Assay in jedem Labor durchzuführen, das Zugang zu den Setup-Geräten hat. Diese Arbeit konzentrierte sich nicht auf die Kategorisierung der Kinematik der Schreckreaktion in kurze und lange Latenz, wie zuvorberichtet 16, aufgrund des Umfangs der Variabilität der Latenz. Daher wurden nur C-Start-Antworten <50 ms nach Stimulusbeginn verwendet15.
Es wurde berichtet, dass Stammunterschiede das Verhalten von Zebrafischen in mehreren Assaysbeeinflussen 28,29,30,31 sowie die Hörempfindlichkeitbeeinflussen 32. Daher ist es wichtig, den Basisbiegewinkel jeder getesteten Dehnung zu bestimmen. Da auch die Hörempfindlichkeit unterschiedlich sein kann, ist es entscheidend, die Schreckreaktion zu bestimmen, die Schallintensität, die sich am besten als Vorimpuls- oder Schreckreiz für jede Belastung eignet und mit welcher Dauer der Reiz präsentiert wird. Der ISI ist ein weiterer Parameter, der sorgfältig abgewogen werden sollte, da einige Medikamente den PPI basierend auf dem Intervall zwischen dem Prepuls und dem Einsetzen des Schreckreizes entweder erhöhen oder reduzieren können16. Es wird erwartet, dass Laboratorien, die an der Untersuchung kognitiver Funktionen, neuropsychiatrischer Störungen und des Hörens (Hörfunktion) interessiert sind, dieses PPI-Setup und -Protokoll beim Screening ihrer pharmakologischen und/oder genetischen Modelle nützlich finden werden. Dieses Protokoll bietet auch eine Grundlage für das Hochdurchsatz-Screening von Substanzbibliotheken.
Offenlegungen
Die Autoren erklären, dass keine konkurrierenden finanziellen Interessen bestehen.
Danksagungen
Wir danken Ana Tavara und João Paulo R. P. Santana für die hervorragende Fischpflege und unschätzbare Hilfe beim Testen und Einrichten der Schallschutzkabinen sowie Dr. Wietske van der Ent für die anfängliche Unterstützung bei der Einrichtung der EthoVision-Software. Diese Studie wurde vom norwegischen Forschungsrat (ISP, BIOTEK2021/ DigiBrain) finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Apomorphine | Sigma Aldrich | A4393 | Dopamine agonist |
| dB meter | PCE instruments | PCE-MSM 4 | For measuring stimulus intensity |
| DMSO | Sigma Aldrich | D8418 | For dissolving organic solutes |
| Dynavox Amplifier | Dynavox | CS-PA1 MK | For delivering acoustic stimuli |
| EthoVision XT | Noldus, Netherlands | EthoVision XT, version 14 | Automated tracking software |
| GraphPad Prism | GraphPad Software | Version 8 | Statistical analysis software |
| Haloperidol | Sigma Aldrich | H1512 | Dopamine antagonist |
| Ketamine | Sigma Aldrich | Y0000450 | NMDA receptor antagonist |
| parofon acoustics materials | Paroc | 8528308 | Helps reduce background noise in the test cabinet |
| t.akustik Vocal Booth Bundle | Thormann, Germany | 458543 | Helps reduce background noise in the test cabinet |
| ZebraBox Revo with PPI add-ons | ViewPoint, France | ZebraBox Revo with PPI add-ons | Includes hardware and software |
Referenzen
- Gawel, K., Banono, N. S., Michalak, A., Esguerra, C. V. A critical review of zebrafish schizophrenia models: Time for validation. Neuroscience & Biobehavioral Reviews. 107, 6-22 (2019).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 496 (7446), 498-503 (2013).
- Kalueff, A. V., Stewart, A. M., Gerlai, R. Zebrafish as an emerging model for studying complex brain disorders. Trends in Pharmacological Sciences. 35 (2), 63-75 (2014).
- Panula, P., et al. The comparative neuroanatomy and neurochemistry of zebrafish CNS systems of relevance to human neuropsychiatric diseases. Neurobiology of Disease. 40 (1), 46-57 (2010).
- Kokel, D., Peterson, R. T. Chemobehavioural phenomics and behaviour-based psychiatric drug discovery in the zebrafish. Briefings in Functional Genomics and Proteomics. 7 (6), 483-490 (2008).
- Basnet, R. M., Zizioli, D., Taweedet, S., Finazzi, D., Memo, M. Zebrafish Larvae as a Behavioral Model in Neuropharmacology. Biomedicines. 7 (1), 23(2019).
- Henry, J., Wlodkowic, D. Towards High-Throughput Chemobehavioural Phenomics in Neuropsychiatric Drug Discovery. Marine Drugs. 17 (6), (2019).
- Behavioural measurement system | Laval zebrafish | Drosophila | Daphnia | insects | Products | Zantiks. , Available from: https://zantiks.com/products/zantiks-mwp (2020).
- Product List - ViewPoint. , Available from: http://www.viewpoint.fr/en/products (2020).
- Observation chamber for zebrafish research - DanioVision. , Available from: https://www.noldus.com/daniovision/observation-chamber (2020).
- EthoVision XT - Video tracking software | Noldus. , Available from: https://www.noldus.com/ethovision-xt (2020).
- Gould, T. D., Gottesman, I. I. Psychiatric endophenotypes and the development of valid animal models. Genes, Brain and Behavior. 5 (2), 113-119 (2006).
- van den Buuse, M. Modeling the Positive Symptoms of Schizophrenia in Genetically Modified Mice: Pharmacology and Methodology Aspects. Schizophrenia Bulletin. 36 (2), 246-270 (2010).
- Acoustic startle modification as a tool for evaluating auditory function of the mouse: Progress, pitfalls, and potential. Abstract - Europe PMC. , Available from: https://europepnc.org/article/PMC/5446932 (2020).
- Bhandiwad, A. A., Zeddies, D. G., Raible, D. W., Rubel, E. W., Sisneros, J. A. Auditory sensitivity of larval zebrafish (Danio rerio) measured using a behavioral prepulse inhibition assay. Journal of Experimental Biology. 216 (18), 3504-3513 (2013).
- Burgess, H. A., Granato, M. Sensorimotor Gating in Larval Zebrafish. Journal of Neuroscience. 27 (18), 4984-4994 (2007).
- Eaton, R. C., Farley, R. D., Kimmel, C. B., Schabtach, E. Functional development in the mauthner cell system of embryos and larvae of the zebra fish. Journal of Neurobiology. 8 (2), 151-172 (1977).
- SR-LAB - San Diego Instruments Startle Response. San Diego Instruments. , Available from: https://sandiegoinstruments.com/product/sr-lab-startle-response/ (2020).
- Startle packages - Med Associates Inc. Med Associates Inc. , Available from: https://www.med-associates.com/product-category/acoustic-startle-reflex-packages/ (2020).
- Startle response & Pre-pulse inhibition test. O'HARA & CO.,LTD. , Available from: https://ohara-time.co.jp/products/startle-response-pre-pulse-inhibition-test/ (2020).
- Thyme, S. B., et al. Phenotypic Landscape of Schizophrenia-Associated Genes Defines Candidates and Their Shared Functions. Cell. 177 (2), 478-491 (2019).
- Privat, M., et al. Sensorimotor Transformations in the Zebrafish Auditory System. Current Biology. 29 (23), 4010-4023 (2019).
- Gerlai, R. Reproducibility and replicability in zebrafish behavioral neuroscience research. Pharmacology Biochemistry and Behavior. 178, 30-38 (2019).
- Add-on - Fast camera 1000 FPS - ViewPoint. , Available from: http://www.viewpoint.fr/app.php/en/p/equipment/add-on-fast-camera (2020).
- Aleström, P., et al. Zebrafish: Housing and husbandry recommendations. Laboratory Animals. , (2019).
- Bhandiwad, A. A., Sisneros, J. A. Revisiting Psychoacoustic Methods for the Assessment of Fish Hearing. Fish Hearing and Bioacoustics: An Anthology in Honor of Arthur N. Popper and Richard R. Fay. , 157-184 (2016).
- Geyer, M. A., Krebs-Thomson, K., Braff, D. L., Swerdlow, N. R. Pharmacological studies of prepulse inhibition models of sensorimotor gating deficits in schizophrenia: a decade in review. Psychopharmacology. 156 (2-3), 117-154 (2001).
- Lange, M., et al. Inter-Individual and Inter-Strain Variations in Zebrafish Locomotor Ontogeny. PLOS ONE. 8 (8), 70172(2013).
- Liu, X., et al. Strain-dependent differential behavioral responses of zebrafish larvae to acute MK-801 treatment. Pharmacology Biochemistry and Behavior. 127, 82-89 (2014).
- Loucks, E., Carvan, M. J. Strain-dependent effects of developmental ethanol exposure in zebrafish. Neurotoxicology and Teratology. 26 (6), 745-755 (2004).
- van den Bos, R., et al. Further characterisation of differences between TL and AB zebrafish (Danio rerio): Gene expression, physiology and behaviour at day 5 of the larval stage. PLOS ONE. 12 (4), 0175420(2017).
- Monroe, J. D., et al. Hearing sensitivity differs between zebrafish lines used in auditory research. Hearing research. 341, 220-231 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten