需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
分离近端液研究胰腺腺癌肿瘤微环境
* 这些作者具有相同的贡献
摘要
胰液是人类胰腺癌生物标志物的宝贵来源。我们在这里描述一种术中收集程序的方法。为了克服在小鼠模型中采用该程序的挑战,我们建议使用替代样品,肿瘤组织液,并在此处描述其分离的两种方案。
摘要
胰腺腺癌(PDAC)是癌症相关死亡的第四大原因,很快就会成为第二大原因。迫切需要与特定胰腺病变相关的变量,以帮助术前鉴别诊断和患者分析。胰液是一种相对未开发的体液,由于其靠近肿瘤部位,它反映了周围组织的变化。在这里,我们详细描述了术中收集程序。不幸的是,将胰液收集转化为PDAC的小鼠模型以进行机理研究在技术上非常具有挑战性。肿瘤间质液(TIF)是血液和血浆外的细胞外液,用于沐浴肿瘤和基质细胞。与胰液类似,由于其收集和浓缩在血浆中稀释的分子的特性,TIF可以用作微环境改变的指标和疾病相关生物标志物的宝贵来源。由于TIF不易获得,因此提出了各种技术来隔离TIF。我们在这里描述了两种简单且技术要求不高的分离方法:组织离心和组织洗脱。
引言
胰腺导管腺癌(PDAC)是最具侵袭性的肿瘤之一,很快就会成为第二大死因1,2,3。它以其免疫抑制微环境和对免疫治疗方案无反应而闻名4。目前,手术切除仍然是PDAC的唯一治愈选择,但早期复发和术后并发症的频率很高。直到晚期才有特定症状,无法进行早期诊断,从而导致疾病的最后期限。此外,PDAC与其他良性胰腺病变之间的症状重叠会阻碍使用当前的诊断策略实现及时可靠的诊断。识别与特定胰腺病变相关的变量可以促进手术决策过程并改善患者分析。
使用易于获取的体液(例如血液5,6,7,尿液8,唾液9和胰液10,11,12)在生物标志物发现方面取得了有希望的结果。许多研究利用全面的"组学"方法,如基因组学、蛋白质组学和代谢组学技术,来识别可以区分PDAC和其他良性胰腺疾病的候选分子或特征。我们最近证明,胰液是一种相对未开发的体液,可用于识别具有不同临床特征的患者的代谢特征12。胰液是一种富含蛋白质的液体,它积累胰腺导管细胞的分泌组并流向主胰管,然后流向主胆总管。由于它靠近胰腺,它可能受到肿瘤肿块引起的微环境扰动的强烈影响(图1),因此比血液或尿液或基于组织的分析更具信息性。一些研究已经探索了胰液使用各种方法鉴定疾病新型生物标志物的潜力,包括细胞学分析13,质谱分析14,15,评估遗传和表观遗传标志物,如K-ras和p53突变16,17,DNA甲基化改变18和miRNA19.从技术上讲,胰液可以通过术中或微创手术收集,例如内窥镜超声、逆行胰胆管造影或通过内镜收集十二指肠液分泌物20。目前尚不清楚所使用的收集技术在多大程度上影响胰液组成。我们在这里描述了术中收集程序,并表明胰液可以代表PDAC生物标志物的宝贵来源。
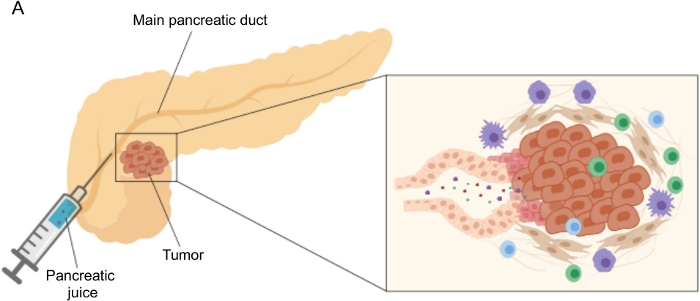
图1:胰液收集的示意图。 (A)描述胰液分泌到胰管中的示意图,并在手术过程中收集胰液。插图显示了肿瘤微环境的特写:胰液收集胰管中肿瘤和基质细胞释放的分子。 请点击此处查看此图的大图。
在PDAC的遗传和原位小鼠模型中收集胰液将受到赞赏,以便在临床前机制研究中利用这种生物流体;然而,这种手术在技术上可能非常具有挑战性,对于皮下肿瘤等更简单的模型是不可行的。出于这个原因,我们将肿瘤间质液(TIF)确定为胰液的替代来源,因为它具有作为周围扰动指标的相似特征。间质液(IF)是在血液和淋巴管外发现的细胞外液体,可沐浴组织细胞21。IF组成受器官血液循环和局部分泌的影响;事实上,周围细胞在IF21中积极产生和分泌蛋白质。间质反映了周围组织的微环境变化,因此可以代表在几种病理环境中发现生物标志物的宝贵来源,例如肿瘤。TIF中高浓度的局部分泌蛋白可用于鉴定要作为血浆22,23,24中的预后或诊断生物标志物进行测试的候选分子。一些研究已经证明TIF是高通量蛋白质组学方法的合适样品,例如质谱技术23,24,25,多重ELISA方法26和microRNA分析27。
已经提出了几种用于分离肿瘤中IF的方法,其大致可分为体内(毛细管超滤28,29,30,31和微透析32,33,34,35)和离体方法(组织离心22,36,37,38和组织洗脱39,40,41,42)。这些技术已经进行了广泛的详细审查43,44。适当方法的选择应考虑下游分析和应用以及回收量等问题。我们最近使用这种方法作为原理证明,以证明来自两种小鼠胰腺腺癌细胞系的肿瘤的不同代谢活性12。基于文献24,38,我们选择使用低速离心方法,以避免细胞破裂和细胞内内容物稀释。TIF中葡萄糖和乳酸的含量都反映了两种不同细胞系的不同糖酵解特性。在这里,我们详细描述了两种最常用的TIF分离方法的方案:组织离心和组织洗脱(图2)。
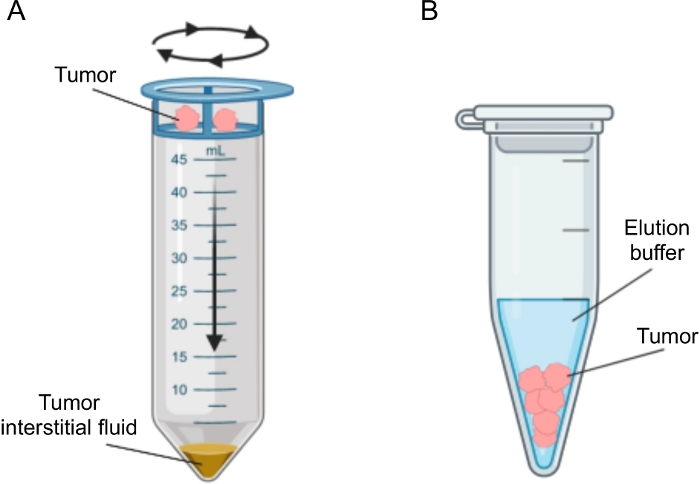
图2:肿瘤间质液分离方法的示意图。 方案中详细描述的技术的示意图,即组织离心(A)和组织洗脱(B)。 请点击此处查看此图的大图。
研究方案
对于所有入组的患者,在手术时根据该机构伦理委员会批准的方案收集外周血和胰液。所有患者均在签署知情同意书后纳入研究,包括收集生物标本和临床数据。该研究已获得该机构伦理委员会的批准(协议号ICH-595,批准于2009年5月发布)。涉及小鼠及其护理的程序符合欧盟和机构指南(协议ID 121 / 2016-PR)。
1.胰液分离
注意:胰液的抽取是在胰腺切除术的开放手术(例如,胰十二指肠切除术,全胰腺切除术,胰腺远端切除术)的背景下由胰腺专家外科医生的设备进行的。
- 患者选择
- 考虑任何计划进行开放性胰腺切除术的患者。
- 如果认为主胰管大小足以进行胰液提取,则确认纳入。在增强 CT 成像中,主胰管直径的最小限制为 2 mm。
- 增强CT成像下胰管术前研究,帮助胰液回收计划
- 在胰颈水平处三维定位腺体内的主胰管:在横截面载玻片上测量主胰管与前缘、上胰缘和下胰腺缘的距离,以及冠状面和矢状面效果图。进入手术室后,使用这些测量值来估算穿刺胰腺以插管Wirsung导管并取回胰液的正确位置。
- 材料准备
- 无菌材料:打开一根 25 G 针头和一个 3 mL 注射器的无菌信封,并在擦洗护士的合作下将它们放置在无菌区域。
- 未消毒材料:在手术室中准备好 3 mL K2EDTA 真空试管,用于储存液体。
- 患者的准备
- 将患者放在手术室病床上。使用瑞芬太尼、塞沃兰和罗库溴铵诱导混合全身麻醉,然后插管并开始为患者通气。将患者仰卧位,右臂与身体相连,左臂外展 90°,固定在扶板上。
- 在切口部位对腹部皮肤进行消毒。在覆盖患者的腹部创建并保持无菌区域。
- 手术
- 进行肋下切口并进入腹腔。放置罗查德腹部回缩以进行器官暴露。
- 通过Kocher操作暴露和调动胰腺,打开胃结肠韧带,沿着胰腺上缘和下缘切开腹膜后组织,在胰颈和位于后方的肠系膜上静脉之间形成解剖平面。
- 一旦胰腺被动员并暴露,在胰颈切片之前进行胰液戒断。
- 胰管的识别和定位
- 使用成像时进行的测量估计胰管的位置,然后触诊胰腺的前表面以确定其精确位置。
- 收集胰液
- 从下方握住胰头和十二指肠,用左手抬高,用第一个手指标记胰管的位置。
- 用装有 25 G 针头的 3 mL 注射器的右手握住。
- 用右手将针头插入左手拇指远端的胰腺中。根据术前测量和对穿透导管壁的感知来确定刺入深度和针头倾斜程度。
- 用注射器取出果汁。如果无法取回果汁,请将针头重新定位在四个方向,尝试插管胰管。
- 取出胰液后,将其移出无菌区并将其转移到 3 mL K2EDTA 真空试管中。保持在4°C,直到样品转移到实验室,并尽早进行进一步处理。
注意:通过此程序可以回收的胰液体积差异很大,根据我们的经验,大约从 0.2 mL 到 3 mL 不等。取汁量高度取决于患者:Wirsung导管的尺寸和胰腺的功能状态(功能与萎缩腺)。根据我们的经验,没有权宜之计可以用来增加回收的胰液量。
2. 胰液的加工
- 在4°C下以400× g 离心胰液10分钟以除去任何细胞或碎片。
注意:胰液在离心前应透明。手术过程中有时会发生血液污染,使样本看起来更浑浊和更红。考虑从进一步分析中排除此类样本。 - 回收上清液,等分试样并储存在-80°C直至进一步分析。
3.诱导皮下肿瘤
注意:小鼠Panc02和DT6606细胞系分别从Lorenzo Piemonti教授(意大利米兰圣拉斐尔糖尿病研究所)和Francesco Novelli教授(意大利都灵实验研究和医学研究中心)获得,如前所述12。
- 肿瘤细胞的生长
- 罗斯威尔公园纪念研究所(RPMI)1640培养基中的培养Panc02和DT6606细胞含有10%胎牛血清(FBS),2mM L-谷氨酰胺和1%青霉素 - 链霉素抗生素。
- 在肿瘤注射前1-2周解冻冷冻细胞,根据细胞系的生长速度。
- 在无菌条件下在37°C,5%CO2 和95%湿度下培养细胞。
- 用0.025%胰蛋白酶/ EDTA溶液分离细胞在37°C下5分钟,当它们达到80%汇合时,并通过离心消除胰蛋白酶。
注意:DT6606是原代细胞,非永生化细胞,来源于LSL-KrasG12D-Pdx1-Cre小鼠,在 体内 注射前不应传代超过3次,以保持其原始特性。建议在注射前7-10天解冻DT6606细胞。
- 体内注射肿瘤细胞
- 胰蛋白酶消化细胞(见步骤3.1.4)并用磷酸盐缓冲盐水(PBS)洗涤一次。通过离心消除PBS,并在计数前将细胞重悬于新鲜PBS中。
- 计数细胞并将其重悬于PBS中,浓度为0.5-1 x 107 个细胞/ mL,以使终浓度为0.5-1 x 106 个细胞/ 100μL以注入每只小鼠。准备多余的细胞。将细胞保持在4°C或冰上,直到程序结束。
- 根据不同的细胞系或处理将动物(8周龄雌性C57BL / 6J小鼠)分组在不同的笼子中。
- 手动约束动物并使用氯胺酮(80mg / kg)和甲苯噻嗪(10mg / kg)的混合物或根据当地批准的程序麻醉它们。
- 用电动剃须刀剃除注射部位,通常是腿上方的侧腹,并用酒精仔细清洁注射部位。
- 用 1 mL 注射器上下移液细胞悬液,通过上下移动活塞去除任何气泡。将25G针头连接到注射器上,并向上推动活塞,直到细胞悬液到达针头开口。
- 用平头镊子捏住侧腹的皮肤,并小心地将针头插入镊子之间的皮肤褶皱底部,不要刺穿腹膜腔或肌肉组织。要验证针头的正确位置,请轻轻尝试将针尖侧向移动到皮肤下。针头应自由移动。
- 缓慢注入100μL细胞悬液(含有0.5-1 x 106 个细胞),轻轻夹住注射部位几秒钟,然后缓慢抽出针头,没有任何侧向运动。
- 将鼠标放回笼子并监测麻醉恢复情况。
- 使用卡尺检查肿瘤生长3-4周。当肿瘤达到约 0.5-1 cm3 时,使用 CO2 或根据当地批准的程序对动物实施安乐死。
4. 肿瘤间质液(TIF)的分离
- 皮下肿瘤切除
- 用纸胶带堵住动物的四肢,并用酒精清洁皮肤。切开腹部的皮肤,将其与腹膜分开并一直到四肢。在剪刀,夹子和最终手术刀的帮助下切除在侧腹皮肤下生长的肿瘤。
- 称量肿瘤并将其保存在冰上的干净管中,直到分离TIF为止。
- 通过离心分离TIF
- 将肿瘤切成两半,用PBS快速冲洗两部分,并在滤纸上轻轻吸干以去除多余的PBS。尽快执行这些步骤,以避免肿瘤蒸发。
- 立即将肿瘤转移到固定在50mL锥形管上的20μm尼龙细胞过滤器中。
- 在4°C下以400× g 离心管10分钟。
注意:这种低速离心可保持细胞完整性,避免细胞内隔室污染TIF。细胞内内容物泄漏可以在下游应用中进行测试,例如通过评估细胞内管家蛋白(例如核糖体蛋白)的存在25。 - 从管底部回收TIF,最终将其等分并立即将其冷冻在干冰上并储存在-80°C直至进一步分析。
可选:根据要执行的下游蛋白质组学分析,用蛋白酶抑制剂混合物在PBS中稀释样品,以避免特定分子的降解。
注意:根据肿瘤的组成,在某些情况下,非常小的肿瘤不会产生任何液体。
- 通过洗脱分离TIF的
- 用剪刀或手术刀将肿瘤切成小块(≈1-3毫米3),并用冷PBS仔细冲洗。
注意:在此步骤中,快速工作并执行最少的操作以避免细胞损坏非常重要。 - 将肿瘤碎片转移到 1.5 mL 管中,并加入 500 μL PBS 和蛋白酶抑制剂混合物,以避免分析物降解。在37°C和5%CO2下孵育1小时。
- 回收上清液并将其转移到新的 1.5 mL 管中。在4°C下以1,000× g 离心5分钟,以从样品中除去任何细胞。
- 将上清液转移到新管中,并在4°C下再次以2,000× g 离心8分钟。
- 将上清液转移到新管中,并在4°C下以20,000× g 再次离心30分钟以除去任何碎屑。回收上清液。立即将TIF样品分装并在干冰上冷冻,并储存在-80°C直至进一步分析。
- 用剪刀或手术刀将肿瘤切成小块(≈1-3毫米3),并用冷PBS仔细冲洗。
结果
我们按照上述程序从PDAC(n = 31)和其他良性胰腺疾病(非PDAC,n = 9)患者那里获取胰液,包括胰腺炎(n = 2),状壶腹肿瘤(n = 4),神经内分泌肿瘤(n = 2),导管内状粘液瘤变(IPMN; n = 1)12。然后使用核磁共振(1H-NMR)对胰液样品进行代谢组学分析12。通过过滤大分子(例如脂蛋白、脂质等)的广核磁共振信号,我们能够详细了解小分子量...
讨论
在这项研究中,我们描述了术中收集胰液的技术,这是一种在很大程度上未开发的液体活检。我们最近表明,胰液可以用作疾病12代谢标志物的来源。对其他液体活检(如血液5、6、7、尿液8 和唾液9)的代谢组学分析在区分 PDAC 与健康受试者或胰腺炎方面显示出有希望的结?...
披露声明
作者没有什么可透露的。
致谢
我们感谢罗伯塔·米廖雷的技术援助。导致这些结果的研究已获得意大利人协会(AIRC)在IG2016-ID.18443项目下的资助 - P.I. Marchesi Federica。资助者在研究设计、数据收集和分析、发表决定或手稿准备方面没有任何作用。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
参考文献
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O'Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Cancer Research. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors - a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。