Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Pankreatik adenokarsinomun tümör mikroçevresini araştırmak için proksimal sıvıların izolasyonu
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Pankreas suyu, insan pankreas kanseri için değerli bir biyobelirteç kaynağıdır. Burada intraoperatif toplama prosedürü için bir yöntem tarif ediyoruz. Bu prosedürü murin modellerinde benimseme zorluğunun üstesinden gelmek için, alternatif bir örnek, tümör interstisyel sıvısı öneriyoruz ve burada izolasyonu için iki protokol açıklıyoruz.
Özet
Pankreatik adenokarsinom (PDAC), kansere bağlı ölümlerin dördüncü önde gelen nedenidir ve yakında ikinci olacaktır. Preoperatif ayırıcı tanıya ve hasta profillemesine yardımcı olmak için spesifik pankreas patolojileriyle ilişkili değişkenlere acil ihtiyaç vardır. Pankreas suyu, tümör bölgesine yakınlığı nedeniyle çevredeki dokudaki değişiklikleri yansıtan nispeten keşfedilmemiş bir vücut sıvısıdır. Burada intraoperatif toplama prosedürünü ayrıntılı olarak açıklıyoruz. Ne yazık ki, mekanik çalışmalar yapmak için pankreas suyu koleksiyonunu PDAC'nin murin modellerine çevirmek teknik olarak çok zordur. Tümör interstisyel sıvısı (TIF), tümör ve stromal hücreleri yıkayan kan ve plazma dışındaki hücre dışı sıvıdır. Pankreas suyuna benzer şekilde, plazmada seyreltilmiş olarak bulunan molekülleri toplama ve konsantre etme özelliği nedeniyle, TIF, mikro çevresel değişikliklerin bir göstergesi ve hastalıkla ilişkili biyobelirteçlerin değerli bir kaynağı olarak kullanılabilir. TIF'ye kolayca erişilemediğinden, izolasyonu için çeşitli teknikler önerilmiştir. Burada izolasyonu için iki basit ve teknik olarak iddiasız yöntem açıklıyoruz: doku santrifüjleme ve doku elüsyonu.
Giriş
Pankreatik duktal adenokarsinom (PDAC) en agresif tümörlerden biridir ve kısa sürede ikinci önde gelen ölüm nedeni haline gelecektir 1,2,3. İmmünsüpresif mikro çevresi ve immünoterapi protokollerine yanıt vermemesi ile bilinir4. Günümüzde cerrahi rezeksiyon PDAC için hala tek küratif seçenektir, ancak erken nüks ve cerrahi sonrası komplikasyonların yüksek sıklığı vardır. İleri bir aşamaya kadar spesifik semptomların olmaması, erken tanıya izin vermez ve hastalığın son tarihlerine katkıda bulunur. Ayrıca, PDAC ve diğer benign pankreas patolojileri arasındaki semptomların örtüşmesi, mevcut tanı stratejileri ile hızlı ve güvenilir bir tanı konmasını engelleyebilir. Spesifik pankreas patolojileri ile ilişkili değişkenlerin tanımlanması, cerrahi karar verme sürecini kolaylaştırabilir ve hasta profillemesini iyileştirebilir.
Biyobelirteç keşfinde umut verici sonuçlar, kan5,6,7, idrar8, tükürük9 ve pankreas suyu10,11,12 gibi kolay erişilebilir vücut sıvıları kullanılarak elde edilmiştir. Birçok çalışma, PDAC ve diğer iyi huylu pankreas rahatsızlıkları arasında ayrım yapabilecek aday molekülleri veya imzaları tanımlamak için genomik, proteomik ve metabolomik teknikler gibi kapsamlı "omik" yaklaşımlardan yararlanmıştır. Son zamanlarda, nispeten keşfedilmemiş bir vücut sıvısı olan pankreas suyunun, farklı klinik profillere sahip hastaların metabolik imzalarını tanımlamak için kullanılabileceğini gösterdik12. Pankreas suyu, pankreas duktal hücrelerinin sekretomunu biriktiren ve ana pankreas kanalına ve daha sonra ana ortak safra kanalına akan protein bakımından zengin bir sıvıdır. Pankreasa yakınlığı nedeniyle, tümör kütlesinin neden olduğu mikro çevresel pertürbasyonlardan güçlü bir şekilde etkilenebilir (Şekil 1) ve bu nedenle kan veya idrardan veya doku bazlı profillemeden daha bilgilendiricidir. Birçok çalışma, sitolojik analiz 13, kütle-spektrometri14,15 tarafından gerçekleştirilen proteomik analiz, K-ras ve p53 mutasyonları gibi genetik ve epigenetik belirteçlerin değerlendirilmesi 16,17, DNA metilasyonundaki değişiklikler 18 ve miRNA'lar 19 dahil olmak üzere çeşitli yaklaşımlar kullanarak pankreas suyunun hastalığın yeni biyobelirteçlerini tanımlama potansiyelini araştırmıştır. . Teknik olarak, pankreas suyu intraoperatif olarak veya endoskopik ultrason, retrograd kolanjiyo-pankreatografi gibi minimal invaziv prosedürlerle veya duodenal meyve suyu sekresyonu20'nin endoskopik toplanmasıyla toplanabilir. Kullanılan toplama tekniğinden pankreas suyu bileşiminin ne ölçüde etkilendiği henüz belli değildir. Burada intraoperatif toplama prosedürünü açıklıyoruz ve pankreas suyunun PDAC biyobelirteçleri için değerli bir kaynak olabileceğini gösteriyoruz.
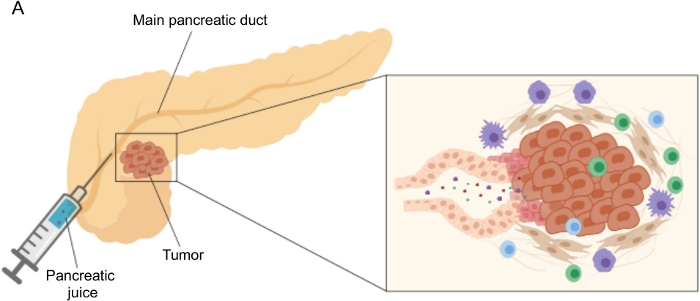
Şekil 1: Pankreas suyu koleksiyonunun şematik gösterimi. (A) Pankreas suyunun pankreas kanalına salgılanmasını ve ameliyat sırasında toplanmasını gösteren şematik gösterim. İç kısım, tümör mikro ortamının yakın çekimini gösterir: pankreas suyu, pankreas kanallarındaki tümör ve stromal hücreler tarafından salınan molekülleri toplar. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
PDAC'nin genetik ve ortotopik fare modellerinde pankreas suyunun toplanması, bu biyoakışkanın klinik öncesi mekanik çalışmalarda kullanılması perspektifinde takdir edilecektir; Bununla birlikte, bu prosedür teknik olarak çok zor olabilir ve deri altı tümörler gibi daha basit modeller için uygun değildir. Bu nedenle, tümör interstisyel sıvısını (TIF), çevredeki pertürbasyonların bir göstergesi olarak hareket etme özelliğine benzer özelliği nedeniyle, pankreas suyuna alternatif bir kaynak olarak tanımladık. İnterstisyel sıvı (IF), kan ve lenfatik damarların dışında bulunan, doku hücrelerini yıkayan hücre dışı sıvıdır21. IF bileşimi hem organa kan dolaşımından hem de lokal sekresyondan etkilenirse; Aslında, çevreleyen hücreler aktif olarak IF21'de protein üretir ve salgılar. İnterstisyum, çevredeki dokuların mikro çevresel değişikliklerini yansıtır ve bu nedenle tümörler gibi çeşitli patolojik bağlamlarda biyobelirteç keşfi için değerli bir kaynak olabilir. TIF'deki lokal olarak salgılanan proteinlerin yüksek konsantrasyonu, plazmada prognostik veya tanısal biyobelirteçler olarak test edilecek aday molekülleri tanımlamak için kullanılabilir22,23,24. Birçok çalışma, TIF'nin kütle spektrometri teknikleri23,24,25, multipleks ELISA yaklaşımları 26 ve mikroRNA profilleme27 gibi yüksek verimli proteomik yaklaşımlar için uygun bir örnek olduğunu kanıtlamıştır.
Tümörlerde IF'nin izolasyonu için, in vivo (kılcal ultrafiltrasyon 28,29,30,31 ve mikrodiyaliz 32,33,34,35) ve ex vivo yöntemler (doku santrifüjleme22,36,37,38 ve doku elüsyonu 39,40,41,42). Bu teknikler ayrıntılı olarak gözden geçirilmiştir43,44. Uygun yöntemin seçimi, aşağı akış analizleri ve uygulamaları ve kurtarılan hacim gibi konuları dikkate almalıdır. Son zamanlarda bu yaklaşımı, iki murin pankreatik adenokarsinom hücre hattından tümörlerin farklı metabolik aktivitesini göstermek için bir ilke kanıtı olarak kullandık12. Literatür 24,38'e dayanarak, hücre kırılmasını ve hücre içi içerikten seyreltmeyi önlemek için düşük hızlı santrifüjleme yöntemini kullanmayı seçtik. TIF'deki hem glikoz hem de laktat miktarı, iki farklı hücre hattının farklı glikolitik özelliklerini yansıtıyordu. Burada, TIF'nin izolasyonu için en sık kullanılan iki yöntemin protokolünü ayrıntılı olarak açıklıyoruz: doku santrifüjleme ve doku elüsyonu (Şekil 2).
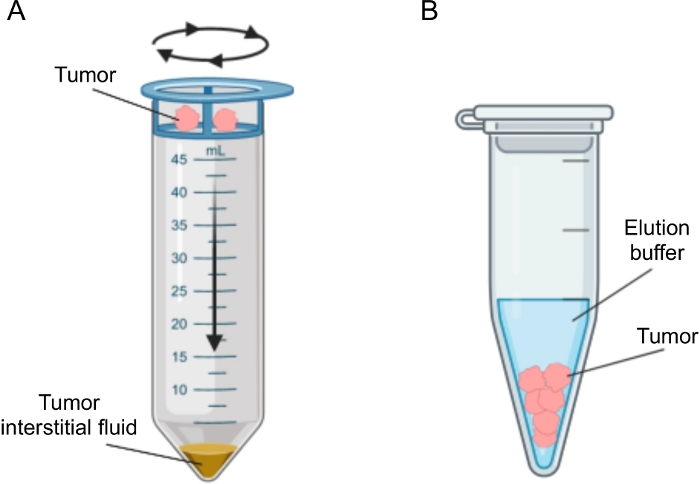
Şekil 2: Tümör interstisyel sıvı izolasyon yöntemlerinin şematik gösterimi. Protokolde ayrıntılı olarak açıklanan tekniklerin, yani doku santrifüjleme (A) ve doku elüsyonu (B) tekniklerinin şematik gösterimi. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
Protokol
Kayıt yaptıran tüm hastalar için periferik kan ve pankreas suyu, Kurum Etik Kurulu tarafından onaylanan protokollere göre ameliyat sırasında toplanmıştır. Tüm hastalar, biyolojik örneklerin ve klinik verilerin toplanması da dahil olmak üzere bilgilendirilmiş onam imzalandıktan sonra çalışmaya dahil edildi. Çalışma Kurum Etik Kurulu tarafından onaylanmıştır (protokol numarası ICH-595, Mayıs 2009'da verilen onay). Fareleri ve bakımlarını içeren prosedürler AB ve Kurumsal Kılavuzlara (protokol ID 121/2016-PR) uygundur.
1. Pankreas suyunun izolasyonu
NOT: Pankreas suyunun geri çekilmesi, açık bir pankreas rezeksiyonu prosedürü (örneğin, pankreatikoduodenektomi, total pankreatektomi, distal pankreatektomi) bağlamında, uzman pankreas cerrahlarının bir donanımı tarafından gerçekleştirilir.
- Hasta seçimi
- Açık pankreas rezeksiyonu için planlanan herhangi bir hastayı prosedür için düşünün.
- Ana pankreas kanalı boyutunun pankreas suyu alımına izin vermek için yeterli olduğu düşünülürse dahil etmeyi onaylayın. Ana pankreas kanalının çapındaki minimum sınır, kontrastlı BT görüntülemede 2 mm olarak kabul edilir.
- Pankreas suyu alımının planlanmasına yardımcı olmak için kontrastlı BT görüntülemede pankreas kanalının ameliyat öncesi incelenmesi
- Bez içindeki ana pankreas kanalını pankreas boynu seviyesinde üç boyutlu olarak lokalize edin: ana pankreas kanalının enine kesitsel slaytlarda anterior, superior ve inferior pankreas marjından uzaklığını ve koronal ve sagital görüntülemeleri ölçün. Ameliyathaneye girdikten sonra, Wirsung kanalını kanüle etmek ve pankreas suyunu almak için pankreasın delineceği doğru yere yaklaşmak için bu ölçümleri kullanın.
- Malzemenin hazırlanması
- Steril malzeme: Bir adet 25 G iğne ve bir adet 3 mL şırınganın steril zarfını açın ve kese hemşiresinin işbirliği ile steril alana yerleştirin.
- Steril olmayan malzeme: Sıvının depolanması için ameliyathanede 3 mL'lik bir K2EDTA vakum test tüpünü elinizin altında bulundurun.
- Hastanın hazırlanması
- Hastayı ameliyathane yatağına yerleştirin. Remifentanil, Sevorane ve Rocuronium kullanarak karışık genel anesteziyi indükleyin, ardından entübe edin ve hastayı ventilasyona başlayın. Hastayı, sağ kolu vücuda sıkışmış ve sol kolu kaçırılmış bir kol tahtasına sabitlenmiş 90 ° 'ye kadar kaçırılmış olarak sırtüstü dekübitus içine yerleştirin.
- Karın derisini kesi bölgesinde dezenfekte edin. Hastayı örten karın üzerinde steril bir alan oluşturun ve koruyun.
- Cerrahi prosedür
- Subkostal bir kesi yapın ve karın boşluğuna erişin. Organ maruziyeti için bir Rochard abdominal retraksiyonu konumlandırın.
- Kocher manevrası ile pankreasın açığa çıkarılması ve mobilize edilmesi, gastrokolik ligamentin açılması, retroperitoneal dokunun pankreasın superior ve inferior sınırı boyunca kesilmesi, pankreas boynu ile posteriorda yer alan superior mezenterik ven arasında diseksiyon düzlemi oluşturulması.
- Pankreas mobilize edildikten ve maruz kaldıktan sonra, pankreas boynunun kesilmesinden önce pankreas suyunun çekilmesine devam edin.
- Pankreas kanalının tanımlanması ve lokalizasyonu
- Görüntülemede alınan ölçümü kullanarak pankreas kanalının yerini tahmin edin ve ardından kesin yerini belirlemek için pankreasın ön yüzeyini palpe edin.
- Pankreas suyunun toplanması
- Pankreas başını ve duodenumu alttan tutun ve pankreas kanalının yerini ilk basamakla işaretleyerek sol elinizle yükseltin.
- 25 G iğne takılı 3 mL şırınganın sağ eliyle tutun.
- İğneyi pankreasa sokmak için sağ elinizi kullanın, sadece sol başparmağın distalinde. Preoperatif ölçümlere ve kanal duvarına nüfuz etmiş olma algısına dayanarak iğnenin penetrasyon derinliğine ve eğim derecesine karar verin.
- Şırınga ile suyu çekin. Meyve suyunu almak mümkün değilse, pankreas kanalını kanüle etmeye çalışırken iğneyi dört yönde yeniden konumlandırın.
- Pankreas suyu alındıktan sonra, steril alanın dışına taşıyın ve 3 mL K2EDTA vakum test tüpüne aktarın. Numune laboratuvara aktarılana kadar 4 °C'de tutun ve mümkün olduğunca erken bir zamanda daha fazla işleme devam edin.
NOT: Bu prosedürle geri kazanılabilecek pankreas suyunun hacmi, deneyimlerimize göre yaklaşık 0,2 mL ila 3 mL arasında değişen büyük ölçüde değişmektedir. Alınan meyve suyu miktarı büyük ölçüde hastaya bağlıdır: Wirsung kanalının boyutu ve pankreasın fonksiyonel durumu (atrofik beze karşı işlevsel). Deneyimlerimize göre, alınan pankreas suyu miktarını artırmak için kullanılabilecek bir yol yoktur.
2. Pankreas suyunun işlenmesi
- Herhangi bir hücreyi veya döküntüyü çıkarmak için pankreas suyunu 400 x g'de 4 ° C'de 10 dakika boyunca santrifüj yapın.
NOT: Pankreas suyu, santrifüjlemeden önce berrak ve şeffaf renkte olmalıdır. Ameliyat sırasında kan kontaminasyonu bazen ortaya çıkabilir ve numunenin daha bulanık ve kırmızı renkte görünmesine neden olabilir. Bu tür numuneleri daha sonraki analizlerden hariç tutmayı düşünün. - Supernatant, aliquot'u geri kazanın ve daha sonraki analizlere kadar -80 ° C'de saklayın.
3. Subkutan tümörlerin indüksiyonu
NOT: Murin Panc02 ve DT6606 hücre hatları, daha önce açıklandığı gibi sırasıyla Prof. Lorenzo Piemonti (San Raffaele Diyabet Enstitüsü, Milano, İtalya) ve Prof. Francesco Novelli'den (Deneysel Araştırma ve Tıbbi Çalışmalar Merkezi, Torino, İtalya) elde edilmiştir12.
- Tümör hücrelerinin büyümesi
- Roswell Park Memorial Institute (RPMI) 1640 ortamındaki Kültür Panc02 ve DT6606 hücreleri% 10 fetal sığır serumu (FBS), 2mM L-Glutamin ve% 1 penisilin-streptomisin antibiyotik içerir.
- Dondurulmuş hücreleri, tümör enjeksiyonundan 1-2 hafta önce, hücre hattının büyüme hızına göre çözün.
- Steril koşullarda %5 CO2 ve %95 nem ile 37 °C'de hücreleri büyütün.
- Hücreleri% 80 akıcılığa ulaştıklarında 37 ° C'de 5 dakika boyunca% 0.025 Tripsin / EDTA çözeltisi ile ayırın ve santrifüjleme yoluyla tripsini ortadan kaldırın.
NOT: DT6606, LSL-KrasG12D-Pdx1-Cre fareden türetilen birincil hücrelerdir, ölümsüzleştirilmemiştir ve orijinal özelliklerini korumak için enjeksiyondan önce 3 defadan fazla geçirilmemelidir. DT6606 hücrelerinin enjeksiyondan 7-10 gün önce çözülmesi önerilir.
- Tümör hücrelerinin in vivo enjeksiyonu
- Hücreleri tripsinize edin (bkz. adım 3.1.4) ve bunları bir kez Fosfat Tamponlu Salin (PBS) ile yıkayın. Santrifüjleme yoluyla PBS'yi ortadan kaldırın ve saymadan önce taze PBS'deki hücreleri yeniden askıya alın.
- Hücreleri sayın ve her fareye enjekte edilecek 0.5-1 x 106 hücre / 100 μL'lik bir son konsantrasyona sahip olmak için PBS'de 0.5-1 x 107 hücre / mL konsantrasyonda yeniden askıya alın. Hücreleri fazla hazırlayın. İşlemin sonuna kadar hücreleri 4 ° C'de veya buz üzerinde tutun.
- Hayvanları (8 haftalık dişi C57BL/6J fareler) farklı hücre hatlarına veya tedavilere göre farklı kafeslerde gruplandırın.
- Hayvanları manuel olarak kısıtlayın ve Ketamin (80 mg / kg) ve Ksilazin (10 mg / kg) karışımı kullanarak veya yerel olarak onaylanmış prosedürlere göre anestezi yapın.
- Enjeksiyon bölgesini, genellikle bir bacağın üzerindeki bir kanadı, elektrikli tıraş makinesiyle tıraş edin ve enjeksiyon bölgesini alkolle dikkatlice temizleyin.
- 1 mL'lik bir şırınga ile hücre süspansiyonunu yukarı ve aşağı pipetle temizleyin, pistonu yukarı ve aşağı hareket ettirerek hava kabarcıklarını giderin. Şırıngaya 25 G'lik bir iğne takın ve hücre süspansiyonu iğne açıklığına ulaşana kadar pistonu yukarı doğru itin.
- Kanadın derisini düz uçlu forseps ile sıkıştırın ve iğneyi, periton boşluğunu veya kas sistemini delmeden forseps arasındaki cilt kıvrımının tabanına dikkatlice yerleştirin. İğnenin doğru pozisyonunu doğrulamak için, iğnenin ucunu cildin altında yavaşça yana doğru hareket ettirmeye çalışın. İğne serbestçe hareket etmelidir.
- Yavaşça 100 μL hücre süspansiyonu enjekte edin (0.5-1 x 106 hücre içerir), enjeksiyon bölgesini birkaç saniye hafifçe sıkıştırın ve iğneyi herhangi bir yana doğru hareket etmeden yavaşça geri çekin.
- Fareyi kafesine geri döndürün ve anesteziden iyileşmeyi izleyin.
- 3-4 hafta boyunca bir kumpas kullanarak tümör büyümesini kontrol edin. Tümörler CO2 kullanılarak veya lokal olarak onaylanmış prosedürlere göre yaklaşık 0.5-1cm3'e ulaştığında hayvanları ötenazileştirin.
4. Tümör interstisyel sıvısının (TIF) izolasyonu
- Subkutan tümörlerin eksizyonu
- Hayvanların uzuvlarını kağıt bantla bloke edin ve cildi alkolle temizleyin. Peritondan ayırmak ve uzuvlara kadar devam etmek için cildi karın üzerinde açın. Kanadın derisi altında yetişen tümörü makas, kelepçe ve sonunda bir neşter yardımıyla tüketin.
- Tümörü tartın ve TIF'nin izolasyonunu takip edene kadar buz üzerinde temiz bir tüpte tutun.
- Santrifüjleme ile TIF'nin izolasyonu
- Tümörü ikiye bölün, iki parçayı PBS'de hızlı bir şekilde durulayın ve PBS fazlalığını gidermek için filtre kağıdına hafifçe lekeleyin. Tümörden buharlaşmayı önlemek için bu adımları mümkün olduğunca hızlı uygulayın.
- Tümörü derhal 50 mL'lik bir konik tüpün üzerine yapıştırılmış 20 μm naylon hücre süzgecine aktarın.
- Tüpü 4 ° C'de 10 dakika boyunca 400 x g'de santrifüj yapın.
NOT: Bu düşük hızlı santrifüjleme, hücre bütünlüğünü korur ve TIF'nin hücre içi bölme tarafından kontaminasyonunu önler. Hücre içi içerik sızıntısı, örneğin ribozomal proteinler25 gibi hücre içi temizlik proteinlerinin varlığını değerlendirerek aşağı akış uygulamalarında test edilebilir. - TIF'yi tüpün dibinden geri kazanın, sonunda aliquot edin ve hemen kuru buz üzerinde dondurun ve daha fazla analize kadar -80 ° C'de saklayın.
İsteğe bağlı: Yapılacak aşağı akış proteomik analizine dayanarak, spesifik moleküllerin bozulmasını önlemek için numuneyi PBS'de bir proteaz inhibitörü kokteyli ile seyreltin.
NOT: Tümörün bileşimine bağlı olarak, bazı durumlarda çok küçük tümörler herhangi bir sıvı vermez.
- TIF'nin elüsyon ile izolasyonu
- Tümörü makas veya neşterle küçük parçalara (≈1-3 mm3) kesin ve soğuk PBS ile dikkatlice durulayın.
NOT: Bu adımda, hücre hasarını önlemek için hızlı çalışmak ve minimum manipülasyon yapmak çok önemlidir. - Tümör parçalarını 1.5 mL'lik bir tüpe aktarın ve analitlerin bozulmasını önlemek için bir proteaz inhibitörü kokteyli ile 500 μL PBS ekleyin. 37 °C'de 1 saat inkübe edin ve% 5 CO2.
- Süpernatantı geri kazanın ve yeni bir 1,5 mL tüpe aktarın. Numuneden herhangi bir hücreyi çıkarmak için 4 ° C'de 5 dakika boyunca 1.000 x g'de santrifüj yapın.
- Süpernatantı yeni bir tüpe aktarın ve 4 ° C'de 8 dakika boyunca 2.000 x g'de tekrar santrifüj yapın.
- Süpernatantı yeni bir tüpe aktarın ve herhangi bir döküntüyü gidermek için 4 ° C'de 30 dakika boyunca 20.000 x g'de tekrar santrifüj yapın. Süper natantı kurtarın. TIF numunesini derhal aliquot ve kuru buz üzerinde dondurun ve daha fazla analize kadar -80 ° C'de saklayın.
- Tümörü makas veya neşterle küçük parçalara (≈1-3 mm3) kesin ve soğuk PBS ile dikkatlice durulayın.
Sonuçlar
Yukarıda tarif edilen prosedürü takip ederek PDAC (n=31) ve pankreatit (n=2), papiller-ampulla tümörleri (n=4), nöroendokrin tümörler (n=2), intraduktal papiller müsinöz neoplazi (IPMN; n=1)12 dahil olmak üzere diğer benign pankreas rahatsızlıkları (PDAC olmayan, n=9) olan hastalardan pankreas suyu elde etmek için izlendi. Pankreas suyu örnekleri daha sonra nükleer manyetik rezonans (1H-NMR) kullanılarak metabolomik analize tabi tutuldu1...
Tartışmalar
Bu çalışmada, büyük ölçüde keşfedilmemiş bir sıvı biyopsisi olan pankreas suyunu intraoperatif olarak toplama tekniğini tanımladık. Son zamanlarda pankreas suyunun hastalığın metabolik belirteçlerinin bir kaynağı olarak kullanılabileceğini gösterdik12. Kan 5,6,7, idrar8 ve tükürük9 gibi diğer sıvı biyopsiler üzerinde yapılan metabolomik analizler, P...
Açıklamalar
Yazarların açıklayacak hiçbir şeyleri yoktur.
Teşekkürler
Teknik yardım için Roberta Migliore'ye teşekkür ederiz. Bu sonuçlara yol açan araştırma, IG2016-ID.18443 projesi - P.I. Marchesi Federica kapsamında Associazione Italiana per la ricerca sul cancro'dan (AIRC) fon aldı. Fon verenlerin çalışma tasarımı, veri toplama ve analizi, yayınlama kararı veya makalenin hazırlanmasında hiçbir rolü yoktu.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
Referanslar
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O'Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Cancer Research. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors - a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır