Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Isolement de liquides proximaux pour étudier le microenvironnement tumoral de l’adénocarcinome pancréatique
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Le suc pancréatique est une source précieuse de biomarqueurs du cancer du pancréas humain. Nous décrivons ici une méthode de procédure de collecte peropératoire. Pour surmonter le défi de l’adoption de cette procédure dans des modèles murins, nous suggérons un échantillon alternatif, le liquide interstitiel tumoral, et décrivons ici deux protocoles pour son isolement.
Résumé
L’adénocarcinome pancréatique (PDAC) est la quatrième cause de décès lié au cancer, et deviendra bientôt la deuxième. Il existe un besoin urgent de variables associées à des pathologies pancréatiques spécifiques pour faciliter le diagnostic différentiel préopératoire et le profilage des patients. Le suc pancréatique est un fluide corporel relativement inexploré qui, en raison de sa proximité avec le site tumoral, reflète les changements dans les tissus environnants. Nous décrivons ici en détail la procédure de collecte peropératoire. Malheureusement, la traduction de la collecte de sucs pancréatiques en modèles murins de PDAC, pour effectuer des études mécanistes, est techniquement très difficile. Le liquide interstitiel tumoral (TIF) est le liquide extracellulaire, à l’extérieur du sang et du plasma, qui baigne les cellules tumorales et stromales. Tout comme le suc pancréatique, pour sa propriété de collecter et de concentrer les molécules qui se trouvent diluées dans le plasma, le TIF peut être exploité comme indicateur d’altérations microenvironnementales et comme source précieuse de biomarqueurs associés à la maladie. Le FIT n’étant pas facilement accessible, diverses techniques ont été proposées pour son isolement. Nous décrivons ici deux méthodes simples et techniquement peu exigeantes pour son isolement: la centrifugation tissulaire et l’élution tissulaire.
Introduction
L’adénocarcinome canalaire pancréatique (PDAC) est l’une des tumeurs les plus agressives et deviendra bientôt la deuxième cause de décès 1,2,3. Il est bien connu pour son microenvironnement immunosuppresseur et pour son manque de réponse aux protocoles d’immunothérapie4. Actuellement, la résection chirurgicale est toujours la seule option curative pour PDAC, mais il existe une fréquence élevée de rechutes précoces et de complications postopératoires. L’absence de symptômes spécifiques jusqu’à un stade avancé ne permet pas un diagnostic précoce, contribuant ainsi aux délais de la maladie. En outre, le chevauchement des symptômes entre PDAC et d’autres pathologies pancréatiques bénignes peut entraver la réalisation d’un diagnostic rapide et fiable avec les stratégies de diagnostic actuelles. L’identification de variables associées à des pathologies pancréatiques spécifiques pourrait faciliter le processus de prise de décision chirurgicale et améliorer le profilage des patients.
Des résultats prometteurs dans la découverte de biomarqueurs ont été obtenus en utilisant des fluides corporels facilement accessibles, tels que le sang 5,6,7, l’urine 8, la salive9 et le suc pancréatique 10,11,12. De nombreuses études ont exploité des approches « omiques » globales, telles que des techniques génomiques, protéomiques et métabolomiques, pour identifier des molécules candidates ou des signatures qui pourraient faire la distinction entre l’ACPE et d’autres affections pancréatiques bénignes. Nous avons récemment démontré que le suc pancréatique, un fluide corporel relativement inexploré, peut être utilisé pour identifier les signatures métaboliques de patients ayant des profils cliniques distincts12. Le suc pancréatique est un liquide riche en protéines, qui accumule le sécrétome des cellules canalaires pancréatiques et s’écoule vers le canal pancréatique principal, puis vers le canal cholédoque principal. En raison de sa proximité avec le pancréas, il pourrait être fortement affecté par les perturbations microenvironnementales induites par la masse tumorale (Figure 1), et donc plus informatif que le sang ou l’urine, ou le profilage tissulaire. Plusieurs études ont exploré le potentiel du suc pancréatique pour identifier de nouveaux biomarqueurs de la maladie en utilisant diverses approches, y compris l’analyse cytologique 13, l’analyse protéomique effectuée par spectrométrie de masse 14,15, l’évaluation de marqueurs génétiques et épigénétiques tels que les mutations K-ras et p53 16,17, les altérations de la méthylation de l’ADN18 et les miARN 19 . Techniquement, le suc pancréatique peut être collecté en peropératoire ou avec des procédures mini-invasives, telles que l’échographie endoscopique, la cholangio-pancréatographie rétrograde ou par collecte endoscopique de la sécrétion de suc duodénal20. On ne sait pas encore dans quelle mesure la composition du suc pancréatique est affectée par la technique de collecte utilisée. Nous décrivons ici la procédure de prélèvement peropératoire et montrons que le suc pancréatique peut représenter une source précieuse pour les biomarqueurs PDAC.
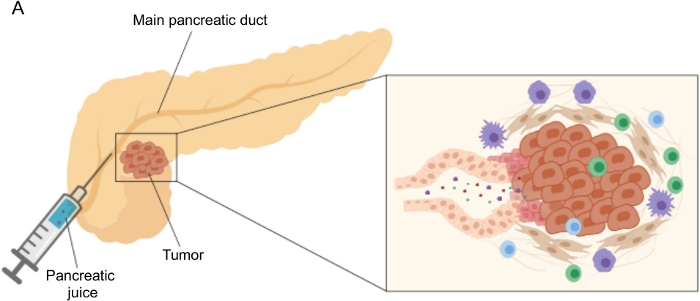
Figure 1 : Représentation schématique de la collection de sucs pancréatiques. (A) Représentation schématique représentant la sécrétion de suc pancréatique dans le canal pancréatique et sa collecte pendant la chirurgie. L’encart montre un gros plan du microenvironnement tumoral: le suc pancréatique recueille les molécules libérées par les cellules tumorales et stromales dans les canaux pancréatiques. Veuillez cliquer ici pour voir une version agrandie de cette figure.
La collecte de suc pancréatique dans des modèles murins génétiques et orthotopiques de PDAC serait appréciée dans la perspective d’exploiter ce biofluide dans des études mécanistiques précliniques ; Cependant, cette procédure peut être techniquement très difficile et n’est pas réalisable pour des modèles plus simples tels que les tumeurs sous-cutanées. Pour cette raison, nous avons identifié le liquide interstitiel tumoral (TIF) comme une source alternative au suc pancréatique, pour sa caractéristique similaire d’agir comme un indicateur des perturbations environnantes. Le liquide interstitiel (SI) est le liquide extracellulaire, trouvé à l’extérieur des vaisseaux sanguins et lymphatiques, qui baigne les cellules tissulaires21. La composition de la FI est affectée à la fois par la circulation sanguine vers l’organe et par la sécrétion locale; en fait, les cellules environnantes produisent et sécrètent activement des protéines dans l’IF21. L’interstitium reflète les changements microenvironnementaux des tissus environnants et pourrait donc représenter une source précieuse pour la découverte de biomarqueurs dans plusieurs contextes pathologiques, tels que les tumeurs. La forte concentration de protéines sécrétées localement dans le TIF peut être utilisée pour identifier les molécules candidates à tester comme biomarqueurs pronostiques ou diagnostiques dans le plasma22,23,24. Plusieurs études ont prouvé que le TIF est un échantillon approprié pour les approches protéomiques à haut débit, telles que les techniques de spectrométrie de masse 23,24,25, ainsi que les approches ELISA multiplex 26 et le profilage des microARN 27.
Plusieurs approches ont été proposées pour l’isolement de la FI dans les tumeurs, qui peuvent être largement classées comme in vivo (ultrafiltration capillaire 28,29,30,31 et microdialyse 32,33,34,35) et ex vivo (centrifugation tissulaire 22,36,37,38 et élution tissulaire 39,40,41,42). Ces techniques ont été examinées en détail43,44. Le choix de la méthode appropriée devrait tenir compte de questions telles que les analyses et les applications en aval et le volume récupéré. Nous avons récemment utilisé cette approche comme preuve de principe pour démontrer l’activité métabolique différente des tumeurs de deux lignées cellulaires d’adénocarcinome pancréatique murin12. Sur la base de la littérature24,38, nous avons choisi d’utiliser la méthode de centrifugation à basse vitesse pour éviter la rupture cellulaire et la dilution du contenu intracellulaire. La quantité de glucose et de lactate dans le TIF reflétait les différentes caractéristiques glycolytiques des deux lignées cellulaires différentes. Nous décrivons ici en détail le protocole des deux méthodes les plus couramment utilisées pour l’isolement du FIT : la centrifugation tissulaire et l’élution tissulaire (Figure 2).
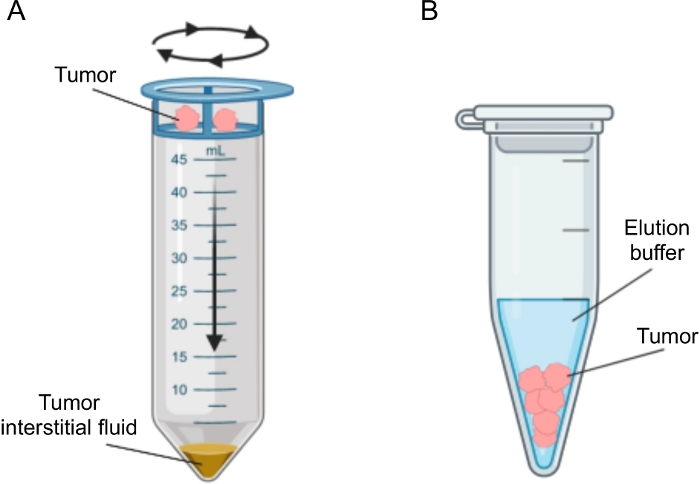
Figure 2 : Représentation schématique des méthodes d’isolement du liquide interstitiel tumoral. Illustration schématique des techniques décrites en détail dans le protocole, à savoir la centrifugation tissulaire (A) et l’élution tissulaire (B). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Protocole
Pour tous les patients recrutés, le sang périphérique et le suc pancréatique ont été prélevés au moment de la chirurgie selon les protocoles approuvés par le comité d’éthique de l’établissement. Tous les patients ont été recrutés dans l’étude après avoir signé un consentement éclairé, y compris la collecte d’échantillons biologiques et de données cliniques. L’étude a été approuvée par le Comité d’éthique de l’institution (protocole numéro ICH-595, approbation délivrée en mai 2009). Les procédures impliquant des souris et leurs soins ont été conformes aux directives européennes et institutionnelles (protocole ID 121/2016-PR).
1. Isolement du suc pancréatique
REMARQUE : Le retrait du suc pancréatique est effectué dans le cadre d’une procédure ouverte de résection pancréatique (p. ex. pancréaticoduodénectomie, pancréatectomie totale, pancréatectomie distale) par une équipe de chirurgiens pancréatiques experts.
- Sélection des patients
- Considérez pour la procédure tout patient prévu pour une résection pancréatique ouverte.
- Confirmer l’inclusion si la taille du canal pancréatique principal est jugée suffisante pour permettre le prélèvement du suc pancréatique. La limite minimale de diamètre du canal pancréatique principal est considérée comme de 2 mm à l’imagerie CT avec contraste amélioré.
- Étude préopératoire du canal pancréatique à l’imagerie CT améliorée par contraste pour aider à la planification de la récupération du suc pancréatique
- Localiser tridimensionnellement le canal pancréatique principal dans la glande au niveau du col pancréatique : mesurer la distance du canal pancréatique principal par rapport à la marge pancréatique antérieure, supérieure et inférieure sur les diapositives transversales et les rendus coronaux et sagittaux. Une fois dans la salle d’opération, utilisez ces mesures pour approximer le bon endroit où percer le pancréas pour canuler le canal Wirsung et récupérer le suc pancréatique.
- Préparation du matériel
- Matériel stérile : Ouvrez l’enveloppe stérile d’une aiguille de 25 G et d’une seringue de 3 mL et placez-les dans le champ stérile avec la collaboration de l’infirmière de récurage.
- Matériel non stérile : Gardez un tube à essai sous vide K2EDTA de 3 ml à portée de main dans la salle d’opération pour le stockage du liquide.
- Préparation du patient
- Placez le patient sur le lit de la salle d’opération. Induire une anesthésie générale mixte, en utilisant Remifentanil, Sevorane et Rocuronium, puis intuber et commencer à ventiler le patient. Placez le patient dans un décubitus dorsal avec le bras droit replié contre le corps et le bras gauche enlevé à 90° fixé sur un bras.
- Désinfectez la peau de l’abdomen au site de l’incision. Créer et maintenir un champ stérile sur l’abdomen draguant le patient.
- Intervention chirurgicale
- Effectuez une incision sous-costale et accédez à la cavité abdominale. Positionner une rétraction abdominale de Rochard pour l’exposition des organes.
- Exposer et mobiliser le pancréas par la manœuvre de Kocher, l’ouverture du ligament gastrocolique, l’incision du tissu rétropéritonéal le long du bord supérieur et inférieur du pancréas créant un plan de dissection entre le col pancréatique et la veine mésentérique supérieure située postérieurement.
- Une fois le pancréas mobilisé et exposé, procéder au retrait du suc pancréatique avant la section du col pancréatique.
- Identification et localisation du canal pancréatique
- Estimer l’emplacement du canal pancréatique à l’aide de la mesure prise à l’imagerie, puis palper la surface antérieure du pancréas pour identifier son emplacement précis.
- Collection de suc pancréatique
- Tenez la tête pancréatique et le duodénum par le dessous et élevez-le avec la main gauche, en marquant l’emplacement du canal pancréatique avec le premier chiffre.
- Tenez avec la main droite de la seringue de 3 ml avec l’aiguille de 25 G montée.
- Utilisez la main droite pour insérer l’aiguille dans le pancréas juste distale au pouce gauche. Décider de la profondeur de pénétration et du degré d’inclinaison de l’aiguille en fonction des mesures préopératoires et de la perception d’avoir pénétré la paroi du conduit.
- Retirer le jus avec la seringue. S’il n’est pas possible de récupérer le jus, déplacez l’aiguille dans les quatre directions en essayant de canuler le canal pancréatique.
- Une fois le suc pancréatique récupéré, déplacez-le à l’extérieur du champ stérile et transférez-le dans le tube à essai sous vide K2EDTA de 3 mL. Conserver à 4 °C jusqu’à ce que l’échantillon soit transféré au laboratoire et procéder à un traitement ultérieur le plus tôt possible.
REMARQUE: Le volume de suc pancréatique qui peut être récupéré avec cette procédure varie considérablement, allant d’environ 0,2 mL à 3 mL selon notre expérience. La quantité de jus prélevée dépend fortement du patient : la dimension du canal Wirsung et l’état fonctionnel du pancréas (fonctionnement versus glande atrophique). D’après notre expérience, il n’y a pas d’expédient qui puisse être utilisé pour augmenter la quantité de suc pancréatique récupérée.
2. Traitement du suc pancréatique
- Centrifuger le suc pancréatique à 400 x g pendant 10 min à 4 °C pour éliminer les cellules ou les débris.
REMARQUE: Le suc pancréatique doit être de couleur claire et transparente avant la centrifugation. Une contamination du sang pendant la chirurgie peut parfois se produire, rendant l’échantillon plus trouble et de couleur plus rouge. Envisager d’exclure ces échantillons des analyses ultérieures. - Récupérer l’aliquote surnageant et conserver à -80 °C jusqu’à de nouvelles analyses.
3. Induction de tumeurs sous-cutanées
NOTE: Les lignées cellulaires murines Panc02 et DT6606 ont été obtenues respectivement auprès du Prof. Lorenzo Piemonti (San Raffaele Diabetes Institute, Milan, Italie) et du Prof. Francesco Novelli (Center for Experimental Research and Medical Studies, Turin, Italie), comme décrit précédemment12.
- Croissance des cellules tumorales
- Culture de cellules Panc02 et DT6606 dans un milieu 1640 du Roswell Park Memorial Institute (RPMI) contenant 10% de sérum bovin fœtal (FBS), 2mM de L-Glutamine et 1% d’antibiotique pénicilline-streptomycine.
- Décongeler les cellules congelées 1-2 semaines avant l’injection de la tumeur, selon le taux de croissance de la lignée cellulaire.
- Cultiver des cellules à 37 °C avec 5% de CO2 et 95% d’humidité dans des conditions stériles.
- Détacher les cellules avec une solution de trypsine/EDTA à 0,025 % pendant 5 min à 37 °C lorsqu’elles atteignent 80 % de confluence et éliminer la trypsine par centrifugation.
REMARQUE: Les DT6606 sont des cellules primaires, non immortalisées, dérivées de la souris LSL-KrasG12D-Pdx1-Cre, et ne doivent pas être passées plus de 3 fois avant injection in vivo afin de maintenir leurs caractéristiques d’origine. Il est recommandé de décongeler les cellules DT6606 7 à 10 jours avant l’injection.
- Injection de cellules tumorales in vivo
- Trypsiniser les cellules (voir étape 3.1.4) et les laver une fois avec une solution saline tamponnée au phosphate (PBS). Éliminer le PBS par centrifugation et remettre en suspension les cellules dans du PBS frais avant de compter.
- Compter les cellules et les remettre en suspension dans du PBS à une concentration de 0,5-1 x 107 cellules/mL afin d’avoir une concentration finale de 0,5-1 x 106 cellules/100 μL à injecter dans chaque souris. Préparez les cellules en excès. Gardez les cellules à 4 °C ou sur de la glace jusqu’à la fin de la procédure.
- Regroupez les animaux (souris C57BL/6J femelles âgées de 8 semaines) dans différentes cages en fonction de différentes lignées cellulaires ou traitements.
- Maîtriser les animaux manuellement et les anesthésier en utilisant un mélange de kétamine (80 mg/kg) et de xylazine (10 mg/kg) ou selon des procédures approuvées localement.
- Rasez le site d’injection, généralement un flanc au-dessus d’une jambe, avec un rasoir électrique et nettoyez soigneusement le site d’injection avec de l’alcool.
- Pipeter de haut en bas la suspension cellulaire avec une seringue de 1 mL, en éliminant les bulles d’air en déplaçant le piston de haut en bas. Fixez une aiguille de 25 G à la seringue et poussez le piston vers le haut jusqu’à ce que la suspension de la cellule atteigne l’ouverture de l’aiguille.
- Pincez la peau du flanc avec une pince à pointe plate et insérez délicatement l’aiguille à la base du pli cutané entre les pinces sans perforer la cavité péritonéale ou la musculature. Pour vérifier la position correcte de l’aiguille, essayez doucement de déplacer la pointe de l’aiguille latéralement sous la peau. L’aiguille doit bouger librement.
- Injectez lentement 100 μL de suspension cellulaire (contenant 0,5-1 x 106 cellules ), serrez doucement le site d’injection pendant quelques secondes et retirez lentement l’aiguille sans aucun mouvement latéral.
- Remettez la souris dans sa cage et surveillez la récupération de l’anesthésie.
- Vérifiez la croissance tumorale à l’aide d’un pied à coulisse pendant 3-4 semaines. Euthanasier les animaux lorsque les tumeurs atteignent environ 0,5-1cm3 en utilisant du CO2 ou selon des procédures approuvées localement.
4. Isolement du liquide interstitiel tumoral (TIF)
- Excision des tumeurs sous-cutanées
- Bloquez les membres des animaux avec du ruban adhésif et nettoyez la peau avec de l’alcool. Coupez la peau ouverte sur l’abdomen afin de la séparer du péritoine et continuez jusqu’aux membres. Excise la tumeur cultivée sous la peau du flanc à l’aide de ciseaux, de pinces et éventuellement d’un scalpel.
- Pesez la tumeur et conservez-la dans un tube propre sur de la glace jusqu’à l’isolement du TIF.
- Isolement du FIT par centrifugation
- Coupez la tumeur en deux, rincez rapidement les deux parties dans du PBS et épongez-les doucement sur du papier filtre pour éliminer l’excès de PBS. Effectuez ces étapes le plus rapidement possible pour éviter l’évaporation de la tumeur.
- Transférer immédiatement la tumeur dans une crépine à cellules en nylon de 20 μm fixée au sommet d’un tube conique de 50 mL.
- Centrifuger le tube à 400 x g pendant 10 min à 4 °C.
REMARQUE: Cette centrifugation à basse vitesse préserve l’intégrité cellulaire en évitant la contamination du TIF par le compartiment intracellulaire. La fuite de contenu intracellulaire peut être testée dans des applications en aval, par exemple en évaluant la présence de protéines internes intracellulaires, telles que les protéines ribosomales25. - Récupérez le TIF au fond du tube, éventuellement aliquote-le et congelez-le immédiatement sur de la glace sèche et conservez-le à -80 °C jusqu’à une analyse plus approfondie.
Facultatif : Sur la base de l’analyse protéomique en aval à effectuer, diluer l’échantillon dans du PBS avec un cocktail d’inhibiteurs de protéase pour éviter la dégradation de molécules spécifiques.
REMARQUE: Selon la composition de la tumeur, dans certains cas, les très petites tumeurs ne produisent pas de liquide.
- Isolement du FIT par élution
- Couper la tumeur en petits morceaux (≈1-3 mm3) avec des ciseaux ou un scalpel et rincer soigneusement avec du PBS froid.
REMARQUE: Dans cette étape, il est très important de travailler rapidement et d’effectuer un minimum de manipulation pour éviter d’endommager les cellules. - Transférer les morceaux tumoraux dans un tube de 1,5 mL et ajouter 500 μL de PBS avec un cocktail d’inhibiteurs de protéase pour éviter la dégradation des analytes. Incuber pendant 1 heure à 37 °C et 5% de CO2.
- Récupérez le surnageant et transférez-le dans un nouveau tube de 1,5 mL. Centrifuger à 1 000 x g pendant 5 min à 4 °C pour éliminer les cellules de l’échantillon.
- Transférer le surnageant dans un nouveau tube et centrifuger à nouveau à 2 000 x g pendant 8 min à 4 °C.
- Transférer le surnageant dans un nouveau tube et centrifuger à nouveau à 20 000 x g pendant 30 min à 4 °C pour éliminer les débris. Récupérez le surnageant. Immédiatement aliquote et congeler l’échantillon de FIT sur de la glace sèche et conserver à -80 °C jusqu’à une analyse plus approfondie.
- Couper la tumeur en petits morceaux (≈1-3 mm3) avec des ciseaux ou un scalpel et rincer soigneusement avec du PBS froid.
Résultats
Nous avons suivi la procédure décrite ci-dessus pour obtenir le suc pancréatique de patients atteints de PDAC (n = 31) et d’autres affections pancréatiques bénignes (non-PDAC, n = 9), y compris la pancréatite (n = 2), les tumeurs papillaires de l’ampoule (n = 4), les tumeurs neuroendocrines (n = 2), la néoplasie mucineuse papillaire intracanalaire (IPMN; n = 1) 12. Les échantillons de suc pancréatique ont ensuite été soumis à une analyse métabolomique par résonance magnétique nu...
Discussion
Dans cette étude, nous avons décrit la technique de collecte peropératoire du suc pancréatique, une biopsie liquidienne largement inexplorée. Nous avons récemment montré que le suc pancréatique peut être exploité comme source de marqueurs métaboliques de la maladie12. L’analyse métabolomique sur d’autres biopsies liquides, telles que le sang 5,6,7, l’urine8 et la salive9
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Roberta Migliore pour son assistance technique. La recherche menant à ces résultats a reçu un financement de l’Associazione Italiana per la ricerca sul cancro (AIRC) dans le cadre du projet IG2016-ID.18443 – P.I. Marchesi Federica. Les bailleurs de fonds n’ont joué aucun rôle dans la conception de l’étude, la collecte et l’analyse des données, la décision de publier ou la préparation du manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD Biosciences | 309659 | |
| 1.5 mL Eppendorf tube | Greiner BioOne | GR616201 | |
| 20 µm nylon cell strainer | pluriSelect | 43-50020-03 | |
| 25G needle | BD Biosciences | 305122 | |
| 3 mL K2EDTA vacutainer | BD Biosciences | 366473 | |
| 3 mL syringe | BD Biosciences | 309656 | |
| 50 mL Falcon tube | Corning | 352098 | |
| Clamps | Medicon | 06.20.12 | |
| Disposable scalpel | Medicom | 9000-10 | |
| Fetal bovine serum | Microtech | MG10432 | |
| Flat-tipped forceps | Medicon | 06.00.10 | |
| Penicillin-Streptomycin | Lonza | ECB3001D | |
| Phosphate-Buffered Saline (PBS) | Sigma-Aldrich | D8537 | |
| Protease inhibitor cocktail | Roche | 34044100 | |
| RPMI medium | Euroclone | ECB9006L | |
| Scissors | Medicon | 02.04.09 | |
| Trypsin/EDTA 1x | Lonza | BE17-161F | |
| Ultraglutamine 100x | Lonza | BE17-605E/U1 |
Références
- Costello, E., Greenhalf, W., Neoptolemos, J. P. New biomarkers and targets in pancreatic cancer and their application to treatment. Nature Reviews Gastroenterology & Hepatology. 9 (8), 435-444 (2012).
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2020. CA: A Cancer Journal for Clinicians. 70 (1), 7-30 (2020).
- Neoptolemos, J. P., et al. Therapeutic developments in pancreatic cancer: current and future perspectives. Nature Reviews Gastroenterology & Hepatology. 15 (6), 333-348 (2018).
- Sahin, I. H., Askan, G., Hu, Z. I., O'Reilly, E. M. Immunotherapy in pancreatic ductal adenocarcinoma: an emerging entity. Annals of Oncology. 28 (12), 2950-2961 (2017).
- Mayerle, J., et al. Metabolic biomarker signature to differentiate pancreatic ductal adenocarcinoma from chronic pancreatitis. Gut. 67 (1), 128-137 (2018).
- Bathe, O. F., et al. Feasibility of identifying pancreatic cancer based on serum metabolomics. Cancer Epidemiology, Biomarkers & Prevention. 20 (1), 140-147 (2011).
- Mayers, J. R., et al. Elevation of circulating branched-chain amino acids is an early event in human pancreatic adenocarcinoma development. Nature Medicine. 20 (10), 1193-1198 (2014).
- Napoli, C., et al. Urine metabolic signature of pancreatic ductal adenocarcinoma by (1)h nuclear magnetic resonance: identification, mapping, and evolution. Journal of Proteome Research. 11 (1), 1274-1283 (2012).
- Sugimoto, M., Wong, D. T., Hirayama, A., Soga, T., Tomita, M. Capillary electrophoresis mass spectrometry-based saliva metabolomics identified oral, breast and pancreatic cancer-specific profiles. Metabolomics. 6 (1), 78-95 (2010).
- Chen, R., et al. Comparison of pancreas juice proteins from cancer versus pancreatitis using quantitative proteomic analysis. Pancreas. 34 (1), 70-79 (2007).
- Mori, Y., et al. A minimally invasive and simple screening test for detection of pancreatic ductal adenocarcinoma using biomarkers in duodenal juice. Pancreas. 42 (2), 187-192 (2013).
- Cortese, N., et al. Metabolome of Pancreatic Juice Delineates Distinct Clinical Profiles of Pancreatic Cancer and Reveals a Link between Glucose Metabolism and PD-1+ Cells. Cancer Immunology Research. , (2020).
- Tanaka, M., et al. Cytologic Analysis of Pancreatic Juice Increases Specificity of Detection of Malignant IPMN-A Systematic Review. Clinical Gastroenterology and Hepatology. 17 (11), 2199-2211 (2019).
- Chen, K. T., et al. Potential prognostic biomarkers of pancreatic cancer. Pancreas. 43 (1), 22-27 (2014).
- Tian, M., et al. Proteomic analysis identifies MMP-9, DJ-1 and A1BG as overexpressed proteins in pancreatic juice from pancreatic ductal adenocarcinoma patients. BMC Cancer. 8, 241 (2008).
- Shi, C., et al. Sensitive and quantitative detection of KRAS2 gene mutations in pancreatic duct juice differentiates patients with pancreatic cancer from chronic pancreatitis, potential for early detection. Cancer Biology & Therapy. 7 (3), 353-360 (2008).
- Rogers, C. D., et al. Differentiating pancreatic lesions by microarray and QPCR analysis of pancreatic juice RNAs. Cancer Biology & Therapy. 5 (10), 1383-1389 (2006).
- Matsubayashi, H., et al. DNA methylation alterations in the pancreatic juice of patients with suspected pancreatic disease. Cancer Research. 66 (2), 1208-1217 (2006).
- Cote, G. A., et al. A pilot study to develop a diagnostic test for pancreatic ductal adenocarcinoma based on differential expression of select miRNA in plasma and bile. The American Journal of Gastroenterology. 109 (12), 1942-1952 (2014).
- Yu, J., et al. Digital next-generation sequencing identifies low-abundance mutations in pancreatic juice samples collected from the duodenum of patients with pancreatic cancer and intraductal papillary mucinous neoplasms. Gut. , (2016).
- Wiig, H., Swartz, M. A. Interstitial fluid and lymph formation and transport: physiological regulation and roles in inflammation and cancer. Physiological Reviews. 92 (3), 1005-1060 (2012).
- Haslene-Hox, H., et al. A new method for isolation of interstitial fluid from human solid tumors applied to proteomic analysis of ovarian carcinoma tissue. PLoS One. 6 (4), 19217 (2011).
- Zhang, J., et al. In-depth proteomic analysis of tissue interstitial fluid for hepatocellular carcinoma serum biomarker discovery. British Journal of Cancer. 117 (11), 1676-1684 (2017).
- Sullivan, M. R., et al. Quantification of microenvironmental metabolites in murine cancers reveals determinants of tumor nutrient availability. Elife. 8, (2019).
- Matas-Nadal, C., et al. Evaluation of Tumor Interstitial Fluid-Extraction Methods for Proteome Analysis: Comparison of Biopsy Elution versus Centrifugation. Journal of Proteome Research. 19 (7), 2598-2605 (2020).
- Espinoza, J. A., et al. Cytokine profiling of tumor interstitial fluid of the breast and its relationship with lymphocyte infiltration and clinicopathological characteristics. Oncoimmunology. 5 (12), 1248015 (2016).
- Halvorsen, A. R., et al. Profiling of microRNAs in tumor interstitial fluid of breast tumors - a novel resource to identify biomarkers for prognostic classification and detection of cancer. Molecular Oncology. 11 (2), 220-234 (2017).
- Yang, S., Huang, C. M. Recent advances in protein profiling of tissues and tissue fluids. Expert Review of Proteomics. 4, 515-529 (2007).
- Huang, C. M., et al. Mass spectrometric proteomics profiles of in vivo tumor secretomes: capillary ultrafiltration sampling of regressive tumor masses. Proteomics. 6 (22), 6107-6116 (2006).
- Leegsma-Vogt, G., Janle, E., Ash, S. R., Venema, K., Korf, J. Utilization of in vivo ultrafiltration in biomedical research and clinical applications. Life Sciences. 73 (16), 2005-2018 (2003).
- Schneiderheinze, J. M., Hogan, B. L. Selective in vivo and in vitro sampling of proteins using miniature ultrafiltration sampling probes. Analytical Chemistry. 68 (21), 3758-3762 (1996).
- Hardt, M., Lam, D. K., Dolan, J. C., Schmidt, B. L. Surveying proteolytic processes in human cancer microenvironments by microdialysis and activity-based mass spectrometry. Proteomics Clinical Applications. 5 (11-12), 636-643 (2011).
- Xu, B. J., et al. Microdialysis combined with proteomics for protein identification in breast tumor microenvironment in vivo. Cancer Microenvironment. 4 (1), 61-71 (2010).
- Bendrik, C., Dabrosin, C. Estradiol increases IL-8 secretion of normal human breast tissue and breast cancer in vivo. The Journal of Immunology. 182 (1), 371-378 (2009).
- Ao, X., Stenken, J. A. Microdialysis sampling of cytokines. Methods. 38 (4), 331-341 (2006).
- Ho, P. C., et al. Phosphoenolpyruvate Is a Metabolic Checkpoint of Anti-tumor T Cell Responses. Cell. 162 (6), 1217-1228 (2015).
- Choi, J., et al. Intraperitoneal immunotherapy for metastatic ovarian carcinoma: Resistance of intratumoral collagen to antibody penetration. Clinical Cancer Research. 12 (6), 1906-1912 (2006).
- Wiig, H., Aukland, K., Tenstad, O. Isolation of interstitial fluid from rat mammary tumors by a centrifugation method. The American Journal of Physiology-Heart and Circulatory Physiology. 284 (1), 416-424 (2003).
- Li, S., Wang, R., Zhang, M., Wang, L., Cheng, S. Proteomic analysis of non-small cell lung cancer tissue interstitial fluids. World Journal of Surgical Oncology. 11, 173 (2013).
- Fijneman, R. J., et al. Proximal fluid proteome profiling of mouse colon tumors reveals biomarkers for early diagnosis of human colorectal cancer. Clinical Cancer Research. 18 (9), 2613-2624 (2012).
- Teng, P. N., Hood, B. L., Sun, M., Dhir, R., Conrads, T. P. Differential proteomic analysis of renal cell carcinoma tissue interstitial fluid. Journal of Proteome Research. 10 (3), 1333-1342 (2011).
- Turtoi, A., et al. Novel comprehensive approach for accessible biomarker identification and absolute quantification from precious human tissues. Journal of Proteome Research. 10 (7), 3160-3182 (2011).
- Wagner, M., Wiig, H. Tumor Interstitial Fluid Formation, Characterization, and Clinical Implications. Frontiers in Oncology. 5, 115 (2015).
- Haslene-Hox, H., Tenstad, O., Wiig, H. Interstitial fluid-a reflection of the tumor cell microenvironment and secretome. Biochimica Biophysica Acta. 1834 (11), 2336-2346 (2013).
- Hsieh, S. Y., et al. Secreted ERBB3 isoforms are serum markers for early hepatoma in patients with chronic hepatitis and cirrhosis. Journal of Proteome Research. 10, 4715-4724 (2011).
- Sun, W., et al. Characterization of the liver tissue interstitial fluid (TIF) proteome indicates potential for application in liver disease biomarker discovery. Journal of Proteome Research. 9 (2), 1020-1031 (2010).
- Haslene-Hox, H., et al. Increased WD-repeat containing protein 1 in interstitial fluid from ovarian carcinomas shown by comparative proteomic analysis of malignant and healthy gynecological tissue. Biochimica Biophysica Acta. 1834 (11), 2347-2359 (2013).
- Wang, T. H., et al. Stress-induced phosphoprotein 1 as a secreted biomarker for human ovarian cancer promotes cancer cell proliferation. Molecular & Cellular Proteomics. 9, 1873-1884 (2010).
- Gromov, P., et al. Up-regulated proteins in the fluid bathing the tumour cell microenvironment as potential serological markers for early detection of cancer of the breast. Molecular Oncology. 4 (1), 65-89 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon