Method Article
低温样品加载到魔法角度旋转核磁共振光谱仪中,可保持细胞生存能力
摘要
这里介绍了冷冻样品低温传输到动态核极化 (DNP) 神奇角度旋转 (MAS) 核磁共振 (NMR) 探测器的协议。该协议包括实验前转子存储方向和实验前后可行性测量方向。
摘要
动态核极化 (DNP) 可显著提高神奇角度旋转 (MAS) 核磁共振 (NMR) 光谱的灵敏度。这些灵敏度随着温度的降低而增加,并且足够大,能够在大多数商用 DNP 配备的 NMR 光谱仪的运行温度 (+100 K) 下对浓度非常低的分子进行研究。这导致细胞内结构生物学的可能性,冷冻保存的细胞大分子在其内源水平在其本地环境中。但是,在 DNP MAS NMR 的典型样品处理过程中,细胞低温保存所需的冻结率超过,这导致细胞完整性和生存能力的丧失。本文描述了将哺乳动物细胞冷冻样本制备和低温转移到MAS NMR光谱仪的详细方案。
引言
引入动态核极化用于神奇角度旋转核磁共振光谱,可将MAS NMR的灵敏度提高几个数量级。这使得生物分子在生理浓度或接近其生理浓度时能够检测。DNP可以而且确实提供在复杂生物环境中内源性(+1 μM)浓度下检测同位素标记蛋白所需的灵敏度。由于有成熟的协议,将同位素标记分子引入未标记的哺乳动物细胞,而不影响其生存能力,这为研究同位素丰富的生物分子在其原生环境中的内生水平开辟了可能性。此外,由于DNP增强在2、3、4的低温下效率更高,DNP MAS NMR的实验温度与长期储存可存活哺乳动物细胞5所需的温度完全一致。然而,将样品转移到DNP MAS NMR光谱仪的传统方法使其受制于破坏哺乳动物细胞的温度波动率。
MAS NMR实验要求样品以等于或大于同向相互作用的幅度的频率旋转,使其平均为零,通常至少为4千赫,通常高得多的6,7,8,9。因此,样品被包装成转子,其中有一个鳍尖,用于通过气体流驱动转子的旋转,并在另一端有一个标记,以便旋转频率可以通过转速计进行监控。大多数 MAS NMR 仪器的样品传输是通过将仪器外部的转子注入 NMR 探头末端的支架,并注入干燥空气或氮气流来完成的。转子到达以神奇角度容纳转子的天体后,样品旋转由空气涡轮机制推动。单独的气体支持流,推动和控制转子的温度。将转子插入 NMR 光谱仪并实现稳定的 MAS 旋转需要精细加工的驱动尖端和严格控制单独气体流的温度和压力。尽管有这些技术要求,但用于室温应用的商业 MAS NMR 探头的插入和实现稳定的 MAS 基本上实现了自动化。
然而,对于低温应用来说,情况更为复杂。用于低温应用的样品通常在室温下插入光谱仪,并冻结在天线器中。在第一分钟,样品温度迅速下降(> ±100 °C/分钟),系统温度需要几分钟才能平衡。由于温度和压力的相互作用,所需 MAS 的插入和接近通常用于低温应用手动处理。尽管需要人工干预,但冻结仪器内部的转子是有益的,因为它最大限度地减少了水和冷凝到探针中,这对成功旋转至关重要。环境湿气产生的凝结和结冰不仅能阻断转子本身的气体线、凝结或霜冻,还能机械地防止 MAS。因此,低温 MAS NMR 样品通常以超过 -100 °C/分钟的速率冻结在仪器内部。
如果冷却速度慢于5、10、11、12,则哺乳动物细胞可以通过冻结-解冻周期保持完整性,速率等于或慢于 1°C/分钟。或者,如果冷却速率超快13、14、15,则电池也会保持其完整性,冷却速率高于 104 °C/分钟。率中间到这两个极端破裂和杀死哺乳动物细胞由于冰晶形成内外的细胞,即使在低温保护剂16的存在。预冷却探针内室温转子的样品冷却速率在这两个极端之间下降,因此,为了研究低温保存完好的哺乳动物细胞,样品必须在转移到仪器之前冷冻并转移到仪器中,而不会出现温度波动,从而损害转子上的样品或霜冻积累,从而阻止转子旋转。该协议描述了一种无霜、预冷转子插入低温MAS NMR系统的方法,用于研究低温保存完好的存活哺乳动物细胞样本。此处描述的低温样本转移是为活体完整细胞的 NMR 特征而开发的。但是,它适用于温度波动可能损害样品完整性的任何系统。这包括任何复杂的系统,如冷冻淬火反应的化学和结构特征的被困反应中间体17,18,酶19,20或蛋白质折叠21,22。
研究方案
1. 哺乳动物细胞的培养和低温保护
- 培养和收获哺乳动物细胞
- 解冻冷冻人类胚胎肾细胞(HEK 293)的一个无名小包。
- 培养 HEK 293 细胞在生长介质 (例如, DMEM 与 10% 胎儿牛血清和 1% 笔链球菌) 在 37 °C 与 5% CO2 在 100 毫米板 2 至三段 (7-10 天).
- 将细胞和培养在150毫米的盘子中分裂,直到细胞达到90-95%的汇流。
注:150 mm 板在 > 90% 的汇流将足以填充两个直径为 3.2 mm 的蓝宝石转子。 - 使用 4 mL 的试金石(见材料表)和 10 mL 的介质收集细胞。将悬架以 673 x g(1000 rpm)将悬架转移到无菌的 15 mL 圆锥形离心机中,在室温下 5 分钟。取出超高超。
- 用磷酸盐缓冲盐水(PBS)(pH 7.4,+CaCl 2,+MgCl 2)清洗细胞颗粒。
- 细胞的冷冻保护
- 在微中心管中收集 50 μL 细胞颗粒。在单独的管子中准备 50 μL 的 PBS 和 18 μL 甘油的混合物。
- 将甘油-PBS混合物加入颗粒顶部,轻轻敲击管侧,直到没有团块,将50微升细胞颗粒与68微升甘油-PBS混合物轻轻混合,并重新吸收颗粒。
注意:轻柔的管道也可以用来重新使用细胞,但是,确保细胞完整性不受影响。
2. 在NMR转子中保存哺乳动物细胞
- 将细胞转移到 3.2 毫米蓝宝石转子中。
- 要制作漏斗,切开一个 200 μL 移液器尖端,并将切口移液器尖端的窄端插入 3.2 mm 转子中。
- 将细胞转移到位于转子上的漏斗中。将转子与漏斗一起放入微中心管中,在室温下以 673 x g 离心将细胞颗粒到转子底部 2-3 分钟。
- 从转子中取出超高音和任何多余的样品。重复这两个步骤,直到转子完全充满细胞。
注:可选,在冻结前确定样品的细胞生存能力。在 100 μL 的无 FBS DMEM 中重复 10 μL 的多余细胞颗粒。将悬架的 10 μL 与 0.4% 试穿蓝色解决方案混合,并立即使用自动电池计数器评估可行性。仅使用 FBS 自由介质稀释细胞,因为血清会干扰尝试蓝色染色。 - 使用市售包装工具用硅塞密封转子。
- 通过垂直向下按压转子,用陶瓷驱动尖端关闭转子。避免触摸驱动器尖端侧面的细腻鳍。
- 用银色永久标记标记蓝宝石转子底部边缘的一半,用黑色永久标记标记转子底部边缘的另一半,以便准确监控光谱仪内部转子的旋转。
注:转子标记不完善会妨碍对旋转频率的准确计数,导致无法实现稳定的旋转。因为标记不会写在冻结转子上,转子加热会损害样品的完整性,因此在冻结前标记转子是关键步骤。
- 在 3.2 毫米蓝宝石转子内冷冻保存细胞。
- 将一块纸巾或纸巾制成的垫子放在盖子下,放在低温小瓶的底部(见 材料表)。
注:纸巾保护转子标记免受低温小瓶两侧碰撞造成的损坏。 - 将 3.2 毫米蓝宝石转子放入用纸巾填充的低温小瓶中,其显著端面向低温小瓶底部。
- 将低温小瓶放入控制速率(-1 °C/min)冷却容器中,并将容器放入 -80 °C 的冰柜中,至少 3 小时,从而缓慢冻结转子。
- 将含有冷冻转子的低温小瓶转移到液氮储存处。
- 将一块纸巾或纸巾制成的垫子放在盖子下,放在低温小瓶的底部(见 材料表)。
3. 冷冻样品低温转移到NMR光谱仪中
- 将冷冻样品运送到 NMR 设施。
- 将含有冷冻转子的低温小瓶转移到充满液氮的小排华中,以便输送到 NMR 设施。
- 将冷冻转子转移到液氮浴中。
- 用 500 mL - 1 L 液氮填充干燥、隔热的宽嘴泡沫脱瓦尔。
- 将转子从低温小瓶转移到充满液氮的宽口泡沫脱瓦尔中。
- 将低温小瓶从手的转移去瓦尔,并举行它正上方的液氮,以保护它免受大气。
- 一边拿着低温小瓶,嘴稍微向下指向,一边拧开盖子,让转子滑入液氮浴池。
注:一旦盖开,转子必须从低温小瓶迅速落入液氮浴(1秒以下),以防止冷凝物收集在转子上。液氮的蒸发在宽口泡沫中形成"氮云",防止转子凝结,然后再浸入液氮中。转子对空气的长时间暴露会导致转子壁上的水分凝结,从而重新凝结成冰。
- 转子低温转移至 NMR 样品捕手。
- 将 1.5 mL 微中心管浸入液氮浴中,预切一个 1.5 mL 微中心管。不要关闭管子。
注:在转移到微中心管之前检查转子。使用钳子,将转子放在液氮表面正下方,检查转子标记是否完好无损,其墙壁上是否形成冰层,驱动尖端是否完好无损。转子壁上的冰晶沉积物显示为白色粉末。小心始终按其身体而不是驱动器尖端按住转子。不要用钳子尖划掉转子上的标记。 - 在液氮浴的表面下,使用钳子将转子转移到微中心管中,驱动尖端朝向微中心管的底部,标记朝向管的开口。
注意:在浸入液氮或接触转子之前,请始终干燥钳子。 - 使用钳子,将含有转子的管子按住颈部的液氮。
- 手里拿着第二对钳子,准备将NMR样品捕手浸入液氮浴中,并抓住它,使其与微中心管的尖锐角度倾斜。
注意:尽量减少样品捕手与液氮接触的时间,以避免冻结 O 环。如果 O 环冻结,将很难将捕手插入光谱仪。
- 将 1.5 mL 微中心管浸入液氮浴中,预切一个 1.5 mL 微中心管。不要关闭管子。
- 低温转子从 NMR 样品捕获器传输到 NMR 光谱仪
注:这一步骤需要两个人,一个操作冷冻卡比尼,一个将样品从液氮转移到探针中。- 将冷冻卡比内特按在柜子上,使冷冻卡比内特处于弹出模式。
注:喷射模式清除从探针到大气的高压下干冷氮气流,以防止大气水分进入。 - 将转子转移到 NMR 样品捕手。
- 将 NMR 样品捕手的开端插入微中心管中,同时仍处于液氮表面之下。
- 抬起微中心管和 NMR 样品捕手,让转子落入样品捕手。摇动 NMR 样品捕手和微中心管,以防转子卡在样品捕手的边缘。
- 将空微中心管放在 NMR 样品捕手顶部,以保护转子不受空气影响。
- 从探头中取出另一个空的 NMR 样品捕手,并将其放在地板上。
- 将装有转子的 NMR 样品捕手转移到您的手上,取出微中心管并立即将其插入探针中。
注意:如果 O 环冻结,将很难收紧样品捕手。继续使用武力,直到它滑入原位。 - 将操作冷冻卡比内特的人信号到"停止弹出"和"插入"。
注:插入模式将取样器中的转子引导到探针中。 - 通过调整低温卡比内特控制的轴承和驱动流压力,将样品旋转到所需的旋转速率(例如 12 kHz)。(例如,立即将轴承气体增加到 ±200 mBar,将驱动气体增加到 10 mBar。样品旋转后,将轴承气体增加到 1000 mBar,将气体驱动到 200 mBar。旋转稳定时,将轴承增加到 2400 mBar,然后在几分钟内将驱动气体从 200 mBar 增加到 1700 mBar。VT 冷却气体恒定在 ±1070 L/h.
注:将微中心管和NMR样品捕手从液氮浴中取出时,请确保微中心管内有足够的液氮来包围转子。最大限度地缩短将转子转移到 NMR 样品捕手和将 NMR 样品捕手插入光谱仪之间的时间。3.4 中的所有步骤应在 30s 内完成。
- 将冷冻卡比内特按在柜子上,使冷冻卡比内特处于弹出模式。
4. 从 NMR 光谱仪中低温去除样品
- 液氮浴和低温小瓶的准备
- 将 500 mL - 1 L 液氮倒入宽口泡沫脱瓦尔,并将浴缸置于光谱仪下。
- 预冷低温小瓶。将含有一块纸巾的空低温小瓶浸入液氮浴中。
- 转子从探针到低温小瓶的低温转移
- 通过降低驱动和轴承气体流,并通过切换到弹射模式弹出转子,将旋转速率降低到 0 kHz。
- 保持弹出模式,从探针中取出样品捕手,将转子直接滴入含有液氮的宽口泡沫脱瓦尔中。
- 使用预冷钳子,将转子转移到液氮表面下的预冷低温小瓶中。
- 盖上低温小瓶。将低温小瓶盖浸入液氮中,以预切低温小瓶盖。从浴缸中取出含有转子和液氮的低温小瓶,用预切盖盖盖管。不要拧紧盖,以便可以安全地释放蒸发氮。
- 将低温小瓶重新浸入液氮中。样品可以转移到较长期的液氮储存或立即拆开包装作进一步分析。
5. 拆包转子和可行性测量
- 拆开转子和测量可行性
- 预热血清免费介质 (DMEM) 或 PBS 至 37 °C。
- 从液氮中取出转子。拆下驱动尖端和硅塞。
注:蓝宝石是一种优秀的热导体。避免用手指触摸转子,因为传热会导致局部冻结-解冻事件,损害细胞生存能力。
- 测量可行性
- 在转子中的冷冻细胞颗粒中加入 20 μL 的加热介质并重新悬回细胞。用移液器取下悬架,将悬架与 100 μL 介质混合。
- 去除 10 μL 的电池悬架,并与等量的 0.4% 试用蓝色溶液(v/v)混合。在室温下孵育30秒至1分钟。
- 使用自动电池计数器测量可行性。
结果
将哺乳动物细胞的冷冻前样本低温插入NMR光谱仪,支持整个NMR实验的可行性。 图1显示冷冻样品低温转移到预冷却的NMR探头的原理图。细胞的生存能力和完整性可以使用各种方法进行评估。在这里,我们使用了标准染料为基础的膜完整性测量,这与其他方法23非常一致。精密细胞不透水,可尝试蓝色,而膜完整性受损的细胞则可渗透。可使用自动电池计数器快速评估可尝试蓝渗透和不透水细胞的数量。使用此处描述的协议,MAS NMR(即点 5.2.3)之后哺乳动物细胞的锥蓝渗透性类似于哺乳动物细胞在任何温度变化之前的尝试蓝渗透性(即点 2.1.3)。但是,如果细胞被缓慢冻结,然后在插入前加热到室温(即在将转子加热到室温之前,再将转子加热到室温,然后插入冰冷探头),则通过 trypan Blue 评估的细胞生存能力将降低到细胞的 10% 以下(图 2)。因此,光谱仪内的冷冻细胞会导致细胞膜完整性丧失,而哺乳动物细胞冷冻样本的低温插入则支持细胞在整个NMR实验中的生存能力。

图1:冷冻样品低温转移成预冷却NMR探针的示意图。(A) 接近液氮表面,拧开低温小瓶的顶部。(B) 将转子滑入液氮浴中。(C) 使用钳子将微中心管浸泡在原位,直到完全冷却。(D) 将转子插入微中心,驱动尖端朝向管底。用钳子推,而不是抓住。(E) 将微中心管握在液氮浴表面正下方,直观地检查转子,以确保转子无霜且标记良好。(F) 以高于表面的角度将样品捕手抱住。(G) 一旦样品捕手在微中心管内,立即将样品捕手和管子从液氮中取出。(H) 如果转子被夹在边缘上,摇动样品捕手。(I) 从探头中取出空样品捕手,放在地上。(J) 将微中心管从样品捕手中取出,内侧转子,插入、拧紧探针中的样品捕手,并在控制控制台上按"插入"。 请单击此处查看此图的较大版本。
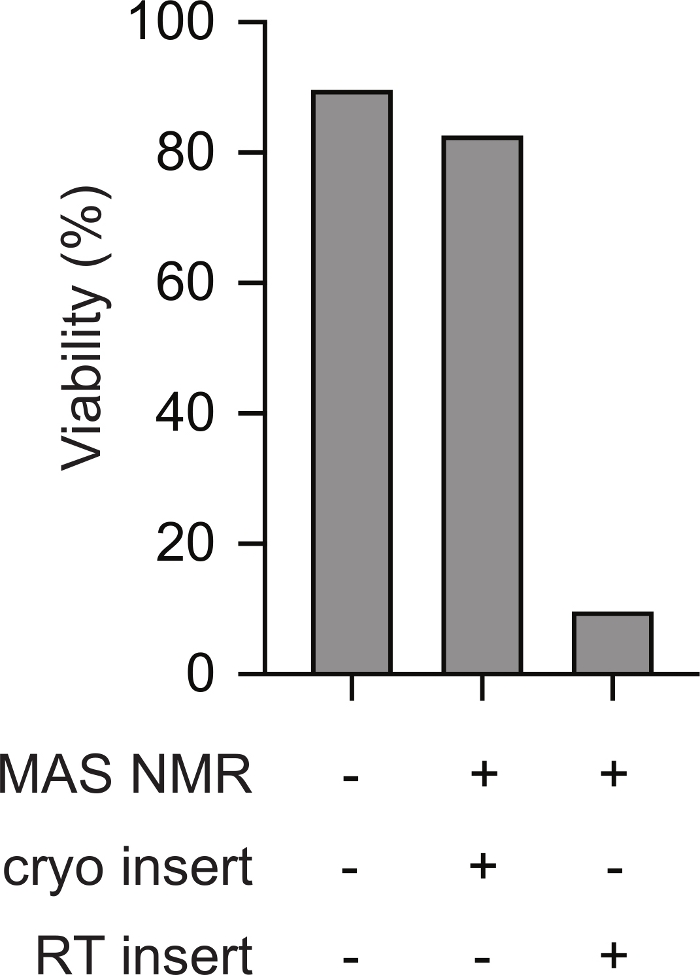
图2:对哺乳动物细胞预冷冻样本的低温插入,可以测量细胞完整性,类似于从未冷冻过的哺乳动物细胞样本。从未冷冻过的样品(例如第 2.1.3 步)的试穿蓝色不透水细胞的百分比与 MAS NMR 之后的样本细胞(例如第 5.2.3 步,12 kHz MAS)相似。在插入预先冷却到 100 K 的 NMR 仪器之前,加热到室温的慢速冷冻细胞(例如第 3 步)在 MAS NMR 与 12 kHz MAS 之后的完整细胞百分比要低得多。 请单击此处查看此图的较大版本。
讨论
冷冻样品低温转移到NMR光谱仪中,通过NMR数据采集成功地保持了冷冻哺乳动物细胞的生存能力。该方法的成功表现在 MAS NMR 生存能力测量的前期和后期。这种方法是成功的,可概括到任何温度波动可能损害样品完整性的系统。当前提交的协议是与 HEK 293 电池线一起执行的。由于许多哺乳动物细胞系的低温保存条件非常相似,因此这里报告的条件很可能可以翻译成其他细胞系统:然而,它们可能需要进一步优化低温保护剂、样本量和冷冻率才能达到相同的结果。
这种方法可以通过在NMR实验后更快地拆开转子来改进。此步骤目前处于次优状态,其执行会影响细胞的生存能力。在将电池重新悬用于介质之前,必须从转子中取出驱动尖端和硅塞。当转子在拆卸驱动尖端时保持不均匀解冻,硅塞因此缩短转子处理时间会导致更高的振动。转子支架或其他工具的开发,以促进均匀解冻和快速去除驱动尖端和硅塞将有助于使NMR后可行性评估更准确。
本文中描述的低温样品加载方法仅限于支持在 NMR 磁体孔中放置探头的样品插入和弹出的 NMR 探头。虽然外部样品插入和弹出是商业 DNP 系统的标准配置,但自定义探头并不总是有此选项。此外,这种低温样品加载方法可能需要对构建与不同尺寸转子兼容的 NMR 探头进行一些修改。此协议已优化为 3.2 mm 转子,如果样品捕手的外径超过微中心管的内径(例如第 3.4.2 步),则可能需要修改。
随着DNP在MAS NMR中的应用,现在有可能在内源生理浓度24、25、26中检测蛋白质和其他生物分子。这为研究其原生环境中的生物分子开辟了可能性。在整个实验过程中保持细胞完整性和生存能力对于将光谱学的实验结果与生物现象联系起来可能至关重要。含有纯化蛋白或细胞解剖剂的样品不受控制冻结通常不会损害样品质量7,27,虽然有迹象表明,即使在纯化系统28中,冷冻率也可能是一个重要变量。然而,如果保持细胞完整性和生存能力对于解释很重要,哺乳动物细胞的样本需要以受控的速度冷冻。在这里,我们提出了一个协议,冻结和转移哺乳动物细胞的冷冻样本到预冷却的DNP MAS NMR仪器,以避免潜在的破坏性温度波动,并支持对可行的细胞的测量。
披露声明
作者没有什么可透露的。
致谢
这项工作得到了德克萨斯州癌症研究预防研究所[RR150076]、国家科学基金会[1751174]的资助;国家卫生研究院 [NS-111236], 韦尔奇基金会 [1-1923-20170325];卢佩·默奇森基金会、泰德·纳什长寿基金会和金氏基金会(西尔学者计划)
材料
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue stain | Invitrogen | T10282 | |
| 100 mm cell culture dish | Thomas Scientific | 430167 | |
| 150 mm cell culture dish | Nunc | 157150 | |
| 3.2 mm sapphire rotor | Bruker | ||
| 45 ° angled forceps | Hampton Research | HR4-859 | |
| AMUPol | Cortecnet | C010P005 | |
| Black and Silver marker | Sharpie | ||
| Cap removal tool | Bruker | HZ16913 | |
| Cell culture grade water | HyClone | SH30529.03 | |
| Ceramic cap | Cortecnet | HZ12372 | |
| CoolCell | Corning/ Biocision | UX-04392-00 (Corning) / BCS-405 (Bioscion) | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10288 | |
| Countess II automated cell counter | Invitrogen | AMQAF1000 | |
| Cryogen tubes | Nalgene | 03-337-7Y | |
| d8-glycerol | Aldrich | 447498 | |
| Deuterium oxide, 99.8 % atom D | Aldrich | 756822-1 | |
| DMEM | Gibco | 10569-010 | |
| DNP NMR system with frequency-matched gyrotron | Bruker | ||
| Foam dewar | Spearlab | FD-800 | |
| Kimwipes | Kimwipes | ||
| Packing tool | Bruker | ||
| Pen-Strep | Gibco | 15140-122 | |
| Powdered PBS | VWR | VWRRV0780 | |
| Protonated PBS | Gibco | 10010-023 | |
| Silicon plug | Bruker | B7089 | |
| Standard Vessel forceps | |||
| Tryp-L | Gibco | 12605010 |
参考文献
- Costello, W. N., Xiao, Y., Frederick, K. K. DNP-Assisted NMR Investigation of Proteins at Endogenous Levels in Cellular Milieu. Methods Enzymology. 615 (1), 373-406 (2019).
- Hall, D. A., et al. Polarization-Enhanced NMR Spectroscopy of Biomolecules in Frozen Solution. Science. 276 (5314), 930-932 (1997).
- Akbey, Ü, Oschkinat, H. Structural biology applications of solid state MAS DNP NMR. Journal of Magnetic Resonance. 269 (1), 213-224 (2016).
- Matsuki, Y., et al. Helium-cooling and -spinning dynamic nuclear polarization for sensitivity-enhanced solid-state NMR at 14T and 30K. Journal of Magnetic Resonance. 225 (1), 1-9 (2012).
- Miyamoto, Y., Ikeuchi, M., Noguchi, H., Hayashi, S. Long-term Cryopreservation of Human and other Mammalian Cells at -80 °C for 8 Years. Cell Medicine. 10 (1), 1-7 (2018).
- Lopez del Amo, J. M., Schneider, D., Loquet, A., Lange, A., Reif, B. Cryogenic solid state NMR studies of fibrils of the Alzheimer's disease amyloid-β peptide: perspectives for DNP. Journal of Biomolecular NMR. 56 (4), 359-363 (2013).
- Gupta, R., et al. Dynamic nuclear polarization enhanced MAS NMR spectroscopy for structural analysis of HIV-1 protein assemblies. The Journal of Physical Chemistry B. 120 (2), 329-339 (2016).
- Lim, B. J., Ackermann, B. E., Debelouchina, G. T. Targetable Tetrazine-Based Dynamic Nuclear Polarization Agents for Biological Systems. ChemBioChem. 21 (9), 1315-1319 (2020).
- Jaudzems, K., et al. Dynamic nuclear polarization-enhanced biomolecular NMR spectroscopy at high magnetic field with fast magic-angle spinning. Angewandte Chemie International Edition. 57 (25), 7458-7462 (2018).
- Chaytor, J. L., et al. Inhibiting ice recrystallization and optimization of cell viability after cryopreservation. Glycobiology. 22 (1), 123-133 (2012).
- Mazur, P. Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing. The Journal of General Physiology. 47 (2), 347-369 (1963).
- Lovelock, J. E., Bishop, M. W. H. Prevention of Freezing Damage to Living Cells by Dimethyl Sulphoxide. Nature. 183 (4672), 1394-1395 (1959).
- Bald, W. B. The relative merits of various cooling methods. Journal of Microscopy. 140 (1), 17-40 (1985).
- Akiyama, Y., Shinose, M., Watanabe, H., Yamada, S., Kanda, Y. Cryoprotectant-free cryopreservation of mammalian cells by superflash freezing. Proceedings of the National Academy of Sciences. 116 (16), 7738-7743 (2019).
- Shi, M., et al. High-throughput non-contact vitrification of cell-laden droplets based on cell printing. Scientific Reports. 5 (1), 17928(2015).
- Pegg, D. E. Principles of cryopreservation. Methods in Molecular Biology. 1257, 3-19 (2015).
- Ramilo, C., et al. Detection of the covalent intermediate of UDP-N-acetylglucosamine enolpyruvyl transferase by solution-state and time-resolved solid-state NMR spectroscopy. Biochemistry. 33 (50), 15071-15079 (1994).
- Jeon, J., Thurber, K. R., Ghirlando, R., Yau, W. M., Tycko, R. Application of millisecond time-resolved solid state NMR to the kinetics and mechanism of melittin self-assembly. Proceedings of the National Academy of Sciences. 116 (34), 16717(2019).
- Pievo, R., et al. A rapid freeze-quench setup for multi-frequency EPR spectroscopy of enzymatic reactions. Chemphyschem. 14 (18), 4094-4101 (2013).
- Cherepanov, A. V., de Vries, S. Microsecond freeze-hyperquenching: development of a new ultrafast micro-mixing and sampling technology and application to enzyme catalysis. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1656 (1), 1-31 (2004).
- Hu, K. N., Tycko, R. What can solid state NMR contribute to our understanding of protein folding. Biophysical Chemistry. 151 (1), 10-21 (2010).
- Hu, K. N., Yau, W. M., Tycko, R. Detection of a transient intermediate in a rapid protein folding process by solid-state nuclear magnetic resonance. Journal of the American Chemical Society. 132 (1), 24-25 (2010).
- Johnson, S., Nguyen, V., Coder, D. Assessment of cell viability. Current Protocols in Cytometry. 64 (1), 1-26 (2013).
- Frederick, K. K., et al. Sensitivity-enhanced NMR reveals alterations in protein structure by cellular milieus. Cell. 163 (3), 620-628 (2015).
- Van Der Cruijsen, E. A. W., et al. Biomolecular DNP-supported NMR spectroscopy using Site-directed spin labeling. Chemistry. 21 (37), 12971-12977 (2015).
- Schlagnitweit, J., et al. Observing an antisense drug complex in intact human cells by in-cell NMR spectroscopy. ChemBioChem. 20 (19), 2474-2478 (2019).
- Debelouchina, G. T., et al. Dynamic nuclear polarization-enhanced solid-state NMR spectroscopy of GNNQQNY nanocrystals and amyloid fibrils. Physical Chemistry Chemical Physics : PCCP. 12 (22), 5911-5919 (2010).
- Schmidt, T., et al. Submillisecond freezing permits cryoprotectant-free EPR doubled electron-electron resonance spectroscopy. ChemPhysChem. 21, 1224-1229 (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。