Method Article
דגימה קריוגנית נטענת לתוך זווית קסם ספינינג ספקטרומטר תהודה מגנטית גרעינית המשמרת את הכדאיות התאית
In This Article
Summary
מוצג כאן פרוטוקול להעברה קריוגנית של דגימות קפואות לזווית הקסם הדינמית של הקיטוב הגרעיני (DNP) המסתובב (MAS) גשושית תהודה מגנטית גרעינית (NMR). הפרוטוקול כולל הוראות לאחסון רוטור לפני הניסוי וכיוונים למדידות כדאיות לפני ואחרי הניסוי.
Abstract
קיטוב גרעיני דינמי (DNP) יכול להגביר באופן דרמטי את הרגישות של ספקטרוסקופיית תהודה מגנטית גרעינית (MAS) של זווית הקסם (MAS). רווחי רגישות אלה עולים ככל שהטמפרטורות יורדות וגדולות מספיק כדי לאפשר את חקר המולקולות בריכוזים נמוכים מאוד בטמפרטורות ההפעלה (~ 100 K) של רוב ספקטרומטרי NMR המסחריים המצוידים ב- DNP. זה מוביל לאפשרות של ביולוגיה מבנית בתא על תאים cryopreserved עבור macromolecules ברמות אנדוגני שלהם בסביבות המקומיות שלהם. עם זאת, שיעורי ההקפאה הנדרשים עבור cryopreservation הסלולר הם חריגה במהלך טיפול מדגם טיפוסי עבור DNP MAS NMR וזה גורם לאובדן שלמות התא ואת הכדאיות. מאמר זה מתאר פרוטוקול מפורט להכנת והעברה קריוגנית של מדגם קפוא של תאי יונקים לספקטרומטר NMR MAS.
Introduction
כניסתו של קיטוב גרעיני דינמי עבור זווית קסם ספינינג ספקטרוסקופיית תהודה מגנטית גרעינית יכול להגביר את הרגישות של MAS NMR על ידי מספר סדרי גודל. זה איפשר זיהוי של ביומולקולים בריכוזים הפיזיולוגיים שלהם או בסמוך להם. DNP יכול ומספק את הרגישות הנדרשת כדי לזהות חלבון שכותרתו איזוטופית בריכוזים אנדוגניים (~ 1 μM) בסביבה ביולוגית מורכבת1. מכיוון שישנם פרוטוקולים מבוססים היטב להכניס מולקולות בעלות תווית איזוטופית לתאי יונקים ללא תווית מבלי להשפיע על הכדאיות שלהם, זה פותח את האפשרות לחקור ביומולקולות מועשרות איזוטופית ברמות האנדוגניות שלהם בסביבה הטבעית שלהם. יתר על כן, כי שיפורי DNP יעילים יותר בטמפרטורות נמוכות יותר2,3,4, הטמפרטורות הניסיוניות עבור DNP MAS NMR ליישר בצורה מסודרת עם אלה הנדרשים לאחסון לטווח ארוך של תאים יונקים קיימא5. עם זאת, השיטה הקונבנציונלית של העברת מדגם לתוך ספקטרומטר DNP MAS NMR נושאת אותו לשיעורי תנודות טמפרטורה כי לקרוע תאים יונקים.
ניסויי MAS NMR דורשים כי המדגם יסתובב על זווית הקסם בתדרים השווים או גדולים יותר מגודל האינטראקציה האניסוטרופית כדי שהיא תהיה ממוצעת לאפס, בדרך כלל לפחות 4 kHz ולעתים קרובות הרבה יותר גבוה6,7,8,9. דגימות, אם כן, ארוזות לתוך רוטורים שיש להם קצה פין המשמש להנעת הסיבוב של הרוטור על ידי זרם של גז ויש להם סימן בקצה השני, כך שתדר הסיבוב יכול להיות במעקב על ידי טכומטר. העברת מדגם עבור רוב מכשירי ה- MAS NMR מתבצעת על ידי הזרקת הרוטור מבחוץ של המכשיר לתוך הסטטור בסוף הבדיקה NMR עם זרם של אוויר יבש או גז חנקן. לאחר שהרוטור מגיע לסטטור, שמחזיק את הרוטור בזווית הקסם, סיבוב הדגימה מונע על ידי מנגנון טורבינת אוויר. נחלים נפרדים של תמיכה בגז, להניע ולשלוט בטמפרטורה של הרוטור. החדרת רוטור לספקטרומטר NMR והשגת ספינינג MAS יציב דורשת קצות כונן במכונה דק ושליטה הדוקה בטמפרטורה ובלחץ של זרמי הגז הנפרדים. למרות דרישות טכניות אלה, החדרה והשגת MAS יציבה הם אוטומטיים במידה רבה עבור בדיקות מס NMR מסחרי עבור יישומי טמפרטורת החדר.
עם זאת, המצב מסובך יותר עבור יישומי טמפרטורה נמוכה. דגימות עבור יישומי טמפרטורה נמוכה מוכנסות בדרך כלל לספקטרומטר בטמפרטורת החדר ומוקפאות בסטטור. בדקה הראשונה, טמפרטורת המדגם יורדת במהירות (> −100 °C /min) וטמפרטורת המערכת דורשת מספר דקות כדי שישוות. בגלל יחסי הגומלין של טמפרטורה ולחץ, החדרה והתקרבות של MAS הרצוי מטופלים לעתים קרובות באופן ידני עבור יישומים בטמפרטורה נמוכה. למרות הדרישה להתערבות ידנית, הקפאת הרוטור בתוך המכשיר מועילה מכיוון שהיא ממזערת את כניסת המים והעיבוי לתוך הגשושית, שהיא קריטית לספינינג מוצלח. לא רק עיבוי והצטברות קרח מהסביבה לחות לחסום קווי גז, עיבוי, או כפור על הרוטור עצמו יכול למנוע באופן מכני MAS. לכן, דגימות עבור טמפרטורה נמוכה MAS NMR קפואים בדרך כלל בתוך המכשיר בשיעורים העולים על -100 °C /min.
תאי יונקים יכולים לשמור על שלמותם באמצעות מחזור הפשרת קיפאון אם הקירור איטי5,10,11,12, בקצב שווה או איטי יותר מ 1 °C /min. לחלופין, תאים גם שומרים על שלמותם אם קצב הקירור הוא אולטרה מהיר13,14,15, בקצב מהיר יותר מ 10 °C(4 °F/ min). המחירים ביניים לשני קיצוניים אלה לקרוע ולהרוג תאים יונקים עקב היווצרות גבישי קרח הן בתוך ומחוץ לתאים, אפילו בנוכחות סוכנים קריוגננים16. שיעורי הקירור לדוגמה עבור רוטור טמפרטורת החדר בתוך בדיקה מקוררת מראש נופלים בין שני הקצוות האלה, ובכך לחקור תאי יונקים בריוגניים שהשתמרו באופן קריוגניים, יש להקפיא דגימות לפני המעבר למכשיר ולהעביר אותן למכשיר ללא תנודות טמפרטורה שעלולות לפגוע במדגם או הצטברות של כפור על הרוטור שיכולים למנוע מהרוטור להסתובב. הפרוטוקול מתאר שיטה להכנסת רוטור ללא כפור מקורר מראש למערכת MAS NMR קריוגנית לחקר דגימות תאי יונקים שלמים שהשתמרו באופן קריוגני. העברת הדגימה הקריוגנית המתוארת כאן פותחה לאפיון NMR של תאים שלמים קיימא. עם זאת, הוא חל על כל מערכת שבה תנודות טמפרטורה עלולות לסכן את שלמות המדגם. זה כולל כל מגוון של מערכות מורכבות, כגון הקפאת תגובות מרווה לאפיון כימי ומבני של תגובה לכודה ביניים17,18, אנזימולוגיה19,20 או חלבון מתקפל21,22.
Protocol
1. תרבות והקפאה של תאי יונקים
- תרבות וקצירת תאי יונקים
- להפשיר aliquot של תאי כליה עוברית אנושית קפואה (HEK 293).
- תרבית HEK 293 תאים במדיה צמיחה (למשל, DMEM עם 10% סרום בקר עוברי ו 1% Pen-סטרפטוקוף) ב 37 °C עם 5% CO2 ב 100 מ"מ לוחות לשניים עד שלושה מעברים (7-10 ימים).
- לפצל את התאים ואת התרבות בצלחת 150 מ"מ עד התאים להשיג 90-95% השפעה.
הערה: צלחת 150 מ"מ במפגש > 90% תספיק למילוי שני רוטורים ספיר בקוטר של 3.2 מ"מ. - קציר תאים באמצעות 4 מ"ל של טריפסין (ראה טבלת חומרים) ו 10 מ"ל של מדיה. מעבירים את המתלים לחרוט סטרילי של 15 מ"ל וצנטריפוגה ב-673 x גרם (1000 סל"ד) למשך 5 דקות בטמפרטורת החדר. הסר את סופר-טבעי.
- לשטוף את גלולה התא עם תמיסת מלח חוצץ פוספט (PBS) (pH 7.4, −CaCl2, −MgCl2).
- קריוהגנה על תאים
- לאסוף גלולה תא 50 μL בצינור microcentrifuge. הכן תערובת של 50 μL של PBS ו 18 μL של גלילצל בצינור נפרד.
- מערבבים בעדינות את גלולה 50 μL תא עם 68 μL של תערובת גלצל-PBS על ידי הוספת תערובת גליצל-PBS לחלק העליון של הכדור ו שימוש חוזר את הכדור על ידי הקשה עדינה על הצד של הצינור עד שלא נותרו גושים.
הערה: צנרת עדינה יכולה לשמש גם כדי resuspend התא, עם זאת, לוודא כי שלמות הסלולר אינו נפגע.
2. שימור קריופרציה של תאי יונקים ברוטור NMR
- העברת תאים לרוטור ספיר 3.2 מ"מ.
- כדי להפוך משפך, לחתוך קצה פיפטה 200 μL ולהכניס את הקצה הצר של קצה פיפטה לחתוך לתוך רוטור 3.2 מ"מ.
- מעבירים את התאים למשפך היושב על הרוטור. מניחים את הרוטור יחד עם המשפך בצינור microcentrifuge וכדור את התאים לתוך החלק התחתון של הרוטור על ידי צנטריפוגה ב 673 x g במשך 2-3 דקות בטמפרטורת החדר.
- הסר את supernatant וכל דגימה עודפת מן הרוטור. חזור על שני שלבים אלה עד שהרוטור יהיה מלא בתאים.
הערה: לחלופה, לקבוע את הכדאיות התאית של המדגם לפני הקפאה. Resuspend 10 μL של גלולה תא עודף ב 100 μL של DMEM ללא FBS. ערבבו 10 μL של המתלה עם פתרון כחול טריפן 0.4% ולהעריך מיד את הכדאיות באמצעות מונה תאים אוטומטי. השתמש רק במדיה ללא FBS כדי לדלל תאים כאשר סרום מפריע להכתמת כחול טריפן. - אטמו את הרוטור באמצעות תקע סיליקון באמצעות כלי אריזה זמין מסחרית.
- סגור את הרוטור עם קצה כונן קרמי על ידי לחיצה אנכית כלפי מטה. הימנעו מלגעת בסנפירים העדינים בצד קצה הכונן.
- סמן חצי מהקצה התחתון של רוטור הספיר עם סמן קבוע כסוף ואת החצי השני של הקצה התחתון של הרוטור עם סמן קבוע שחור כדי לאפשר ניטור מדויק של ספינינג של הרוטור בתוך הספקטרומטר.
הערה: פגמים בסימון הרוטור ימנעו ספירה מדויקת של תדר הסיבוב, וכתוצאה מכך הכישלון להשיג ספינינג יציב. מכיוון שסמנים לא יכתבו על רוטור קפוא והתחממות הרוטור פוגעת בשלמות המדגם, סימון הרוטור לפני ההקפאה הוא צעד קריטי.
- הקפאה של תאים בתוך רוטור ספיר 3.2 מ"מ.
- מניחים כרית המיוצרת על ידי פיסת טישו או מגבת נייר מתחת למכסה ובתחתית הקרבון הקריוגני (ראו שולחן חומרים).
הערה: נייר הטישו מגן על סימון הרוטור מפני נזק שנגרם על ידי נתקל בצדדים של בקבוקונים קריוגניים. - מניחים את רוטור הספיר 3.2 מ"מ לתוך הנקניקייה הקריוגנית מרופדת בנייר הטישו עם קצה מסומן הפונה לתחתית הנקניקייה הקריוגנית.
- להקפיא את הרוטור על ידי הצבת את הנקניקייה cryogenic לתוך קצב מבוקר (-1 °C/min) מיכל קירור ומניחים את המיכל במקפיא -80 °C למשך מינימום של 3 שעות.
- מעבירים את ההקמה הקריוגנית המכילה את הרוטור הקפוא לאחסון חנקן נוזלי.
- מניחים כרית המיוצרת על ידי פיסת טישו או מגבת נייר מתחת למכסה ובתחתית הקרבון הקריוגני (ראו שולחן חומרים).
3. העברה קריוגנית של דגימה קפואה לספקטרומטר NMR
- להעביר את הדגימה הקפואה למתקן NMR.
- מעבירים את ההמולה הקריוגנית המכילה את הרוטור הקפוא לערוע קטן מלא בחנקן נוזלי להובלה למתקן NMR.
- מעבירים רוטור קפוא לאמבט החנקן הנוזלי.
- מלאו קצף פה רחב יבש ומבודד תרמית עם 500 מ"ל – 1 ליטר של חנקן נוזלי.
- מעבירים את הרוטור מהביחון הקריוגני לקצף הפה הרחב מלא בחנקן נוזלי.
- קח את הגעיף הקריוגני מן dewar ההעברה ביד להחזיק אותו ממש מעל פני השטח של החנקן הנוזלי כדי להגן עליו מפני האטמוספירה.
- תוך כדי החזקת הגבעול הקריוגני כשהפה מצביע מעט כלפי מטה, פתחו את המכסה ותנו לרוטור להחליק לתוך אמבט החנקן הנוזלי.
הערה: לאחר המכסה הוא פתח, הרוטור חייב ליפול מן הגבעול cryogenic לתוך אמבט חנקן נוזלי במהירות (מתחת 1 שנייה) כדי למנוע עיבוי מאיסוף על הרוטור. אידוי של חנקן נוזלי יוצר "ענן חנקן" בקצף הפה הרחב dewar ומונע עיבוי על הרוטור לפני שהוא שקוע לתוך החנקן הנוזלי. חשיפה ארוכה יותר של הרוטור לאוויר עלולה להוביל לעיבוי הלחות על קירות הרוטור אשר יתעבה מחדש לקרח.
- העברה קריוגנית של רוטור ללוכד מדגם NMR.
- Prechill צינור microcentrifuge 1.5 מ"ל על ידי טביעתו באמבט חנקן נוזלי. אל תסגור את הצינור.
הערה: בדוק את הרוטור לפני ההעברה לתוך צינור microcentrifuge. באמצעות פינצטה, להחזיק את הרוטור ממש מתחת לפני השטח של החנקן הנוזלי ולבדוק כי סימוני הרוטור הם שלמים, כי אין מרבצי קרח נוצרו על קירותיו וכי קצה הכונן הוא שלם. מרבצי קריסטל קרח על קירות הרוטור מופיעים כאבקה לבנה. היזהר תמיד להחזיק את הרוטור על ידי גופו ולא על ידי קצה הכונן. אין לגרד את הסימון את הרוטור עם טיפים פינצטה. - מתחת לפני השטח של אמבט החנקן הנוזלי, השתמש בפינצטה כדי להעביר את הרוטור לצינור microcentrifuge עם קצה הכונן הפונה לתחתית צינור microcentrifuge ואת הסימנים מול פתיחת הצינור.
הערה: תמיד יבש פינצטה לפני שקוע בחנקן נוזלי או לגעת רוטור. - באמצעות פינצטה, להחזיק את הצינור המכיל את הרוטור תחת חנקן נוזלי על ידי הצוואר שלה.
- עם זוג נוסף של פינצטה ביד, להיות מוכן להטביע את לוכד מדגם NMR באמבט חנקן נוזלי להחזיק אותו, כך שהוא נוטה בזווית חריפה ביחס צינור microcentrifuge.
הערה: מזער את הזמן שבו לוכד הדגימה נמצא במגע עם החנקן הנוזלי כדי למנוע הקפאת טבעת ה- O. אם טבעת ה-O תקפא, יהיה קשה מאוד להכניס את התופס לספקטרומטר.
- Prechill צינור microcentrifuge 1.5 מ"ל על ידי טביעתו באמבט חנקן נוזלי. אל תסגור את הצינור.
- העברת רוטור קריוגנית מתופס מדגם NMR לספקטרומטר NMR
הערה: שלב זה דורש שני אנשים, אחד להפעיל את cryocabinet ואחד להעביר את המדגם מן החנקן הנוזלי לתוך הבדיקה.- מקם את הקריוקאבינט במצב פליטה על-ידי לחיצה על 'EJECT' בארון.
הערה: מצב הפליטה מטהר את זרימת גז החנקן היבש והקר בלחץ גבוה מהגשוש לאטמוספירה כדי למנוע כניסה של לחות אטמוספרית. - העבר את הרוטור לתוך לוכד מדגם NMR.
- הכנס את הקצה הפתוח של לוכד מדגם NMR לתוך צינור microcentrifuge בעוד עדיין מתחת לפני השטח של החנקן הנוזלי.
- הרם הן את צינור microcentrifuge והן את לוכד מדגם NMR כדי לאפשר לרוטור ליפול לתוך לוכד הדגימה. לנער את לוכד מדגם NMR וצינור microcentrifuge במקרה הרוטור תקוע על שפתו של לוכד המדגם.
- השאירו את צינור microcentrifuge הריק על גבי לוכד מדגם NMR כדי להגן על הרוטור מהאוויר.
- הסר את לוכד מדגם NMR הריק האחר מהגשוש והנח אותו על הרצפה.
- העבר את לוכד מדגם NMR המכיל את הרוטור ליד החופשית שלך, להסיר את צינור microcentrifuge ולהכניס אותו מיד לתוך הבדיקה.
הערה: אם טבעת O קופאת, יהיה קשה להדק את לוכד הדגימה. תמשיך להפעיל כוח עד שהוא יחליק למקומו. - אותת לאדם המפעיל את הקריוקאבינט ל- 'STOP EJECT' ו- 'INSERT'.
הערה: מצב ההוספה מנחה את הרוטור מהתופס לדוגמה אל הגשוש. - סובב את המדגם לקצב הסיבוב הרצוי (לדוגמה, 12 קילו-הרץ) על-ידי התאמת לחץ הזרימה והמסב ונשנה הנשלט על-ידי הקריוקאבינט. (למשל, הגדל באופן מיידי את הגז הנושא ל- ~ 200 mBar ואת גז הכונן ל 10 mBar. ברגע המדגם מסתובב, להגדיל את גז הנושא ל 1000 מ"ר ולהניע גז ל 200 mBar. כמו ספינינג מתייצב, להגדיל את המסבים ל 2400 mBar ולאחר מכן להגדיל את גז הכונן מ 200 mBar ל 1700 mBar על פני מספר דקות. VT גז קירור קבוע ב ~ 1070 L / h.)
הערה: בעת הרמת צינור microcentrifuge ותופס מדגם NMR מתוך אמבט חנקן נוזלי, ודא כי צינור microcentrifuge יש מספיק חנקן נוזלי בתוכו כדי להקיף את הרוטור. מזער את הזמן בין העברת הרוטור לתוך לוכד מדגם NMR והכנסת לוכד מדגם NMR לתוך הספקטרומטר. כל השלבים ב-3.4 צריכים להסתיים בתוך 30.
- מקם את הקריוקאבינט במצב פליטה על-ידי לחיצה על 'EJECT' בארון.
4. הסרה קריוגנית של המדגם מספקטרומטר NMR
- הכנת אמבט החנקן הנוזלי והבינה הקריוגנית
- יוצקים 500 מ"ל - 1 ליטר של חנקן נוזלי לתוך קצף הפה הרחב dewar ומניחים את האמבטיה מתחת ספקטרומטר.
- תרגיע את הנקניקון הקריוגני. תטביעו את הנקניקייה הקריוגנית הריקה המכילה פיסת נייר טישו באמבט החנקן הנוזלי.
- העברה קריוגנית של רוטור מבדיקה לחקירה קריוגנית
- הפחת את קצב הסיבוב ל- 0 kHz על-ידי הרחבת זרימת הגז בנהיגה ונושאת ופלט את הרוטור על-ידי מעבר למצב הפליטה.
- שמור על מצב הפליטה על, להסיר את לוכד המדגם מן הבדיקה, טיפת רוטור ישירות לתוך dewar קצף הפה הרחב המכיל חנקן נוזלי.
- בעזרת פינצטה מצוננת מראש, מעבירים את הרוטור לחקירה קריוגנית מצוננת מראש מתחת לפני השטח של החנקן הנוזלי.
- תכובע את הנקניקון הקריוגני. הקדימו את מכסה הנקניקיון הקריוגני על ידי טבילתו בחנקן נוזלי. הסר את הקוקייה cryogenic המכיל את הרוטור וחנקן נוזלי מן האמבטיה ואת מכסה את הצינור עם כובע prechilled. אין להדק את המכסה כך שניתן יהיה לשחרר בבטחה חנקן מתאדה.
- תטביע מחדש את המכיין הקריוגני בחנקן נוזלי. המדגם יכול להיות מועבר לאחסון חנקן נוזלי לטווח ארוך יותר או לפרוק מיד לניתוח נוסף.
5. פרקת מדידות רוטור ותכשירות
- פרק רוטור ומדידת הכדאיות
- מדיה חופשית בסרום חם מראש (DMEM) או PBS ל 37 °C (7 °F).
- מוציאים רוטור מחנקן נוזלי. הסר קצה כונן ותקע סיליקון.
הערה: ספיר הוא מוליך חום מעולה. הימנעו מלגעת ברוטור באצבעות מכיוון שהעברת חום עלולה לגרום לאירועי הפשרת הקפאה מקומיים שפוגעים ביכולות התאית.
- מדידת הכדאיות
- הוסף 20 μL של מדיה חמה לכדור התא הקפוא ברוטור ותאים resuspend. הסר מתלה עם pipette ולערבב את המתלים עם 100 μL של מדיה.
- הסר 10 μL של השעיית תא ולערבב עם נפח שווה של 0.4% פתרון כחול טריפן (v / v). דגירה בטמפרטורת החדר במשך 30 s עד 1 דקות.
- מדוד את הכדאיות באמצעות מונה תאים אוטומטי.
תוצאות
החדרה קריוגנית של דגימות קפואות מראש של תאי יונקים לספקטרומטר NMR תומכת בכדאיות לאורך הניסוי ב- NMR. שרטוטים של העברה קריוגנית של דגימה קפואה לתוך בדיקה NMR מקורר מראש מוצג איור 1. ניתן להעריך את הכדאיות התאית ואת השלמות במגוון שיטות. כאן השתמשנו מידה סטנדרטית המבוססת על צבע של שלמות הממברנה, אשר מיישר היטב עם שיטות אחרות23. תאים שלמים הם בלתי חדירים כדי trypan כחול בעוד תאים עם שלמות ממברנה נפגעת הם חדישים. ניתן להעריך במהירות את מספר התאים הכחולים החדירים והבלתי חבויים באמצעות מונה תאים אוטומטי. באמצעות הפרוטוקול המתואר כאן, החדרות הכחולה של תאי היונקים לאחר MAS NMR (כלומר, בנקודה 5.2.3) דומה לחדירה הכחולה של תאי היונקים לפני כל שינוי בטמפרטורה (כלומר, נקודה 2.1.3). עם זאת, אם התאים קפואים באיטיות, ואז מתחממים לטמפרטורת החדר לפני הכניסה (כלומר בעקבות הפרוטוקול לנקודה 3 לפני חימום הרוטור לטמפרטורת החדר לפני הכניסה לגשוש הצונן), הכדאיות התאית כפי שהוערכה על ידי כחול טריפן יורדת לפחות מ -10% מהתאים(איור 2). לפיכך, הקפאת תאים בתוך הספקטרומטר גורמת לאובדן שלמות הממברנה התאית בעוד החדרה קריוגנית של דגימות קפואות של תאי יונקים תומכת בכדאיות התא לאורך הניסוי ב- NMR.

איור 1: סכמטי של העברה קריוגנית של דגימה קפואה לתוך בדיקה NMR מקורר מראש. (A)התקרב לפני השטח של החנקן הנוזלי ו פתח את החלק העליון של ההקמה הקריוגנית. (B)החלק את הרוטור לתוך אמבט החנקן הנוזלי. (C)שקוע צינור microcentrifuge באמצעות פינצטה ולהחזיק אותו במקום עד שהוא מתקרר לחלוטין. (D)הכנס את הרוטור למיקרוצנטריפוגה עם קצה הכונן הפונה לתחתית הצינור. לדחוף, במקום לתפוס, עם פינצטה. (E)החזק את צינור microcentrifuge ממש מתחת לפני השטח של אמבט החנקן הנוזלי ובדוק חזותית את הרוטור כדי להבטיח שהוא נטול כפור ומסומן היטב. (ו)החזק את לוכד הדגימה בזווית מעל פני השטח. (G)הרם את לוכד הדגימה ואת הצינור מתוך החנקן הנוזלי ברגע לוכד הדגימה הוא בתוך צינור microcentrifuge. (H)לנער את לוכד הדגימה אם הרוטור נתפס על שפת. (אני)הסר את לוכד הדגימה הריק מהגשוש והנח אותו על הקרקע. (J)הסר את צינור microcentrifuge מן התופס מדגם עם הרוטור בפנים, להוסיף, להדק את לוכד המדגם בגשוש ולחץ על "INSERT" על מסוף הבקרה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
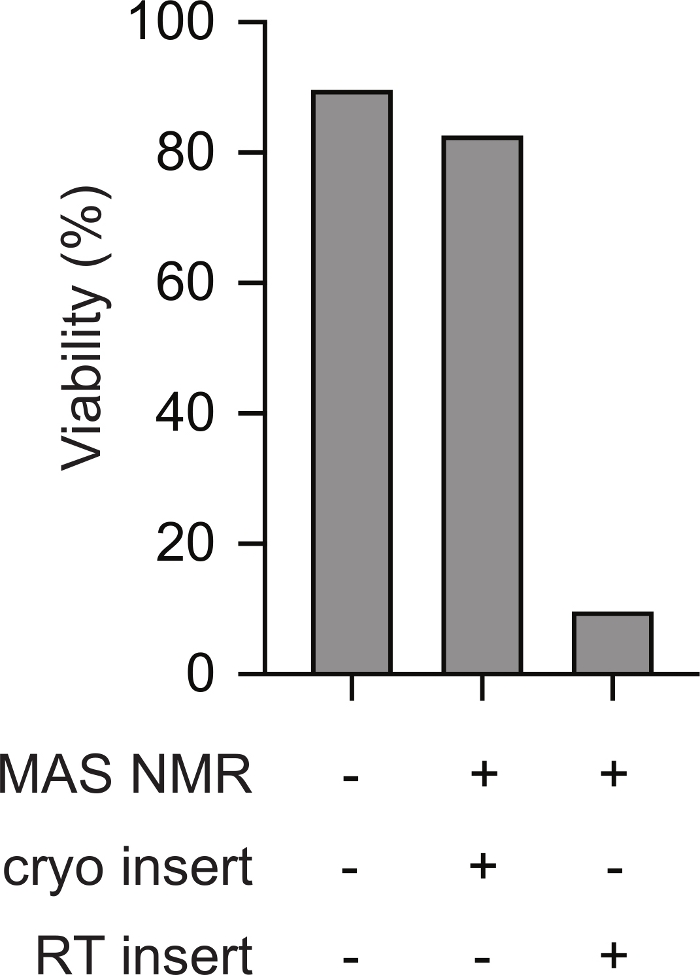
איור 2: החדרה קריוגנית של דגימה קפואה מראש של תאי יונקים גורמת למדידות של שלמות תאית הדומות לדגימות של תאי יונקים שמעולם לא הוקפאו. אחוז התאים הכחולים של טריפן עבור דגימות שמעולם לא הוקפאו (לדוגמה שלב 2.1.3) דומה לזה של תאים עבור דגימות לאחר MAS NMR (למשל שלב 5.2.3 עם 12 kHz MAS). תאים קפואים איטיים (למשל שלב 3) שחוממו לטמפרטורת החדר לפני הכניסה למכשיר NMR שהתקרר מראש ל-100 K היו אחוזים נמוכים בהרבה של תאים שלמים לאחר MAS NMR עם 12 kHz MAS. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
ההעברה הקריוגנית של דגימות קפואות לספקטרומטר NMR מצליחה לשמר את הכדאיות של תאי יונקים קפואים באמצעות רכישת נתוני NMR. ההצלחה של מתודולוגיה זו מודגמת במדידות הכדאיות של לפני ולאחר MAS NMR. גישה זו היא מוצלחת וכליל לכל מערכת שבה תנודות טמפרטורה עלולות לסכן את שלמות המדגם. הפרוטוקול המוצג כעת מבוצע עם קו התא HEK 293. מכיוון שתנאי ההקפאה של קווי תאים רבים של יונקים דומים מאוד, סביר להניח כי התנאים המדווחים כאן ניתנים לתרגום למערכות תאיות אחרות; עם זאת, הם עשויים לדרוש אופטימיזציה נוספת של קריו-הגנה, נפחי דגימה ושיעורי הקפאה כדי להשיג את אותן תוצאות.
מתודולוגיה זו ניתן לשפר על ידי פירוק הרוטור מהר יותר לאחר ניסוי NMR. שלב זה הוא כעת תת אופטימלי וביצועו משפיע על הכדאיות של התאים. לפני שניתן יהיה לחבר מחדש את התאים במדיה, יש להסיר את קצה הכונן ואת תקע הסיליקון מהרוטור. המדגם מפשיר באופן לא אחיד כאשר הרוטור מוחזק במהלך הסרת קצה הכונן ותקע הסיליקון כך זמני טיפול רוטור קצרים כל כך לגרום viabilitiesות גבוהות יותר. פיתוח מחזיקי רוטור או כלים אחרים כדי להקל על הפשרה אחידה והסרה מהירה של קצה הכונן ותקע הסיליקון יסייעו להפוך את הערכת הכדאיות שלאחר NMR למדויקת יותר.
הגישה לטעינת דגימה קריוגנית המתוארת במאמר זה מוגבלת לבדיקות NMR התומכות בהחדרת דגימה ופלטה עם הגשוש במקום בשעמום של מגנט NMR. בעוד הכנסה ופלטה של מדגם חיצוניות סטנדרטיות עבור מערכות DNP מסחריות, בדיקות מותאמות אישית לא תמיד יש אפשרות זו. כמו כן, גישה זו לטעינת מדגם קריוגני עשויה לדרוש שינוי מסוים עבור בדיקות NMR שנבנו כדי להיות תואמות לרוטורים בגודל שונה. פרוטוקול זה עבר אופטימיזציה לרוטורים 3.2 מ"מ ועשוי לדרוש שינוי אם הקוטר החיצוני של לוכד הדגימה עולה על הקוטר הפנימי של צינור microcentrifuge (למשל, שלב 3.4.2).
עם היישום של DNP ל- MAS NMR, כעת ניתן לזהות חלבונים וביומולקולים אחרים בריכוזים פיזיולוגיים אנדוגניים24,25,26. זה פותח את האפשרות של לימוד biomolecules בתוך הסביבות המקומיות שלהם. שמירה על שלמות התאים והקיימות לאורך כל הניסוי צפויה להיות קריטית בחיבור התוצאות הניסיוניות של הספקטרוסקופיה לתופעות ביולוגיות. הקפאה בלתי מבוקרת של דגימות המכילות חלבונים מטוהרים או ליסאטים תאיים אינה פוגעת בדרך כלל באיכות המדגם7,27, אם כי יש כמה אינדיקציות לכך שקצב ההקפאה עשוי להיות משתנה חשוב אפילו במערכות מטוהרות28. עם זאת, דגימות של תאי יונקים צריכות להיות קפואות בקצב מבוקר אם שמירה על שלמות התאים ואת הכדאיות חשובה לפרשנות. כאן אנו מציגים פרוטוקול להקפאה והעברת דגימות קפואות של תאי יונקים למכשיר DNP MAS NMR מקורר מראש, המונע תנודות טמפרטורה שעלולות להזיק ותומך במדידה על תאים בת קיימא.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
עבודה זו נתמכה על ידי מענקים מהמכון לחקר הסרטן בטקסס [RR150076], הקרן הלאומית למדע [1751174]; המכונים הלאומיים לבריאות [NS-111236], קרן וולש [1-1923-20170325]; קרן לופה מרצ'יסון, קרן טד נאש לחיים ארוכים וקרן הקרבה (תוכנית חוקרי סירל) ל- K.K.F.
Materials
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue stain | Invitrogen | T10282 | |
| 100 mm cell culture dish | Thomas Scientific | 430167 | |
| 150 mm cell culture dish | Nunc | 157150 | |
| 3.2 mm sapphire rotor | Bruker | ||
| 45 ° angled forceps | Hampton Research | HR4-859 | |
| AMUPol | Cortecnet | C010P005 | |
| Black and Silver marker | Sharpie | ||
| Cap removal tool | Bruker | HZ16913 | |
| Cell culture grade water | HyClone | SH30529.03 | |
| Ceramic cap | Cortecnet | HZ12372 | |
| CoolCell | Corning/ Biocision | UX-04392-00 (Corning) / BCS-405 (Bioscion) | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10288 | |
| Countess II automated cell counter | Invitrogen | AMQAF1000 | |
| Cryogen tubes | Nalgene | 03-337-7Y | |
| d8-glycerol | Aldrich | 447498 | |
| Deuterium oxide, 99.8 % atom D | Aldrich | 756822-1 | |
| DMEM | Gibco | 10569-010 | |
| DNP NMR system with frequency-matched gyrotron | Bruker | ||
| Foam dewar | Spearlab | FD-800 | |
| Kimwipes | Kimwipes | ||
| Packing tool | Bruker | ||
| Pen-Strep | Gibco | 15140-122 | |
| Powdered PBS | VWR | VWRRV0780 | |
| Protonated PBS | Gibco | 10010-023 | |
| Silicon plug | Bruker | B7089 | |
| Standard Vessel forceps | |||
| Tryp-L | Gibco | 12605010 |
References
- Costello, W. N., Xiao, Y., Frederick, K. K. DNP-Assisted NMR Investigation of Proteins at Endogenous Levels in Cellular Milieu. Methods Enzymology. 615 (1), 373-406 (2019).
- Hall, D. A., et al. Polarization-Enhanced NMR Spectroscopy of Biomolecules in Frozen Solution. Science. 276 (5314), 930-932 (1997).
- Akbey, &. #. 2. 2. 0. ;., Oschkinat, H. Structural biology applications of solid state MAS DNP NMR. Journal of Magnetic Resonance. 269 (1), 213-224 (2016).
- Matsuki, Y., et al. Helium-cooling and -spinning dynamic nuclear polarization for sensitivity-enhanced solid-state NMR at 14T and 30K. Journal of Magnetic Resonance. 225 (1), 1-9 (2012).
- Miyamoto, Y., Ikeuchi, M., Noguchi, H., Hayashi, S. Long-term Cryopreservation of Human and other Mammalian Cells at -80 °C for 8 Years. Cell Medicine. 10 (1), 1-7 (2018).
- Lopez del Amo, J. M., Schneider, D., Loquet, A., Lange, A., Reif, B. Cryogenic solid state NMR studies of fibrils of the Alzheimer's disease amyloid-β peptide: perspectives for DNP. Journal of Biomolecular NMR. 56 (4), 359-363 (2013).
- Gupta, R., et al. Dynamic nuclear polarization enhanced MAS NMR spectroscopy for structural analysis of HIV-1 protein assemblies. The Journal of Physical Chemistry B. 120 (2), 329-339 (2016).
- Lim, B. J., Ackermann, B. E., Debelouchina, G. T. Targetable Tetrazine-Based Dynamic Nuclear Polarization Agents for Biological Systems. ChemBioChem. 21 (9), 1315-1319 (2020).
- Jaudzems, K., et al. Dynamic nuclear polarization-enhanced biomolecular NMR spectroscopy at high magnetic field with fast magic-angle spinning. Angewandte Chemie International Edition. 57 (25), 7458-7462 (2018).
- Chaytor, J. L., et al. Inhibiting ice recrystallization and optimization of cell viability after cryopreservation. Glycobiology. 22 (1), 123-133 (2012).
- Mazur, P. Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing. The Journal of General Physiology. 47 (2), 347-369 (1963).
- Lovelock, J. E., Bishop, M. W. H. Prevention of Freezing Damage to Living Cells by Dimethyl Sulphoxide. Nature. 183 (4672), 1394-1395 (1959).
- Bald, W. B. The relative merits of various cooling methods. Journal of Microscopy. 140 (1), 17-40 (1985).
- Akiyama, Y., Shinose, M., Watanabe, H., Yamada, S., Kanda, Y. Cryoprotectant-free cryopreservation of mammalian cells by superflash freezing. Proceedings of the National Academy of Sciences. 116 (16), 7738-7743 (2019).
- Shi, M., et al. High-throughput non-contact vitrification of cell-laden droplets based on cell printing. Scientific Reports. 5 (1), 17928 (2015).
- Pegg, D. E. Principles of cryopreservation. Methods in Molecular Biology. 1257, 3-19 (2015).
- Ramilo, C., et al. Detection of the covalent intermediate of UDP-N-acetylglucosamine enolpyruvyl transferase by solution-state and time-resolved solid-state NMR spectroscopy. Biochemistry. 33 (50), 15071-15079 (1994).
- Jeon, J., Thurber, K. R., Ghirlando, R., Yau, W. M., Tycko, R. Application of millisecond time-resolved solid state NMR to the kinetics and mechanism of melittin self-assembly. Proceedings of the National Academy of Sciences. 116 (34), 16717 (2019).
- Pievo, R., et al. A rapid freeze-quench setup for multi-frequency EPR spectroscopy of enzymatic reactions. Chemphyschem. 14 (18), 4094-4101 (2013).
- Cherepanov, A. V., de Vries, S. Microsecond freeze-hyperquenching: development of a new ultrafast micro-mixing and sampling technology and application to enzyme catalysis. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1656 (1), 1-31 (2004).
- Hu, K. N., Tycko, R. What can solid state NMR contribute to our understanding of protein folding. Biophysical Chemistry. 151 (1), 10-21 (2010).
- Hu, K. N., Yau, W. M., Tycko, R. Detection of a transient intermediate in a rapid protein folding process by solid-state nuclear magnetic resonance. Journal of the American Chemical Society. 132 (1), 24-25 (2010).
- Johnson, S., Nguyen, V., Coder, D. Assessment of cell viability. Current Protocols in Cytometry. 64 (1), 1-26 (2013).
- Frederick, K. K., et al. Sensitivity-enhanced NMR reveals alterations in protein structure by cellular milieus. Cell. 163 (3), 620-628 (2015).
- Van Der Cruijsen, E. A. W., et al. Biomolecular DNP-supported NMR spectroscopy using Site-directed spin labeling. Chemistry. 21 (37), 12971-12977 (2015).
- Schlagnitweit, J., et al. Observing an antisense drug complex in intact human cells by in-cell NMR spectroscopy. ChemBioChem. 20 (19), 2474-2478 (2019).
- Debelouchina, G. T., et al. Dynamic nuclear polarization-enhanced solid-state NMR spectroscopy of GNNQQNY nanocrystals and amyloid fibrils. Physical Chemistry Chemical Physics : PCCP. 12 (22), 5911-5919 (2010).
- Schmidt, T., et al. Submillisecond freezing permits cryoprotectant-free EPR doubled electron-electron resonance spectroscopy. ChemPhysChem. 21, 1224-1229 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved