Method Article
Chargement d’échantillons cryogéniques dans un spectromètre à résonance magnétique nucléaire à angle magique qui préserve la viabilité cellulaire
Dans cet article
Résumé
Présenté ici est un protocole pour le transfert cryogénique d’échantillons congelés dans la sonde de polarisation nucléaire dynamique (DNP) à rotation d’angle magique (MAS) de résonance magnétique nucléaire (RMN). Le protocole comprend des instructions pour le stockage du rotor avant l’expérience et des instructions pour les mesures de viabilité avant et après l’expérience.
Résumé
La polarisation nucléaire dynamique (DNP) peut augmenter considérablement la sensibilité de la spectroscopie par résonance magnétique nucléaire (RMN) à rotation d’angle magique (MAS). Ces gains de sensibilité augmentent à mesure que les températures diminuent et sont suffisamment importants pour permettre l’étude de molécules à de très faibles concentrations aux températures de fonctionnement (~ 100 K) de la plupart des spectromètres RMN commerciaux équipés de DNP. Cela conduit à la possibilité d’une biologie structurale cellulaire sur des cellules cryoconservées pour les macromolécules à leurs niveaux endogènes dans leur environnement natif. Cependant, les taux de congélation requis pour la cryoconservation cellulaire sont dépassés lors de la manipulation typique d’échantillons pour la RMN DNP MAS, ce qui entraîne une perte d’intégrité et de viabilité cellulaires. Cet article décrit un protocole détaillé pour la préparation et le transfert cryogénique d’un échantillon congelé de cellules de mammifères dans un spectromètre RMN MAS.
Introduction
L’introduction de la polarisation nucléaire dynamique pour la spectroscopie par résonance magnétique nucléaire à angle magique peut augmenter la sensibilité de la RMN MAS de plusieurs ordres de grandeur. Cela a permis de détecter des biomolécules à leurs concentrations physiologiques ou à proximité. Le DNP peut fournir et fournit la sensibilité nécessaire pour détecter une protéine isotopiquement étiquetée à des concentrations endogènes (~1 μM) dans un environnement biologique complexe1. Parce qu’il existe des protocoles bien établis pour introduire des molécules étiquetées isotopiquement dans les cellules de mammifères non étiquetées sans affecter leur viabilité, cela ouvre la possibilité d’étudier des biomolécules enrichies isotopiquement à leurs niveaux endogènes dans leur environnement natif. De plus, parce que les améliorations DNP sont plus efficaces à des températures plus basses2,3,4, les températures expérimentales pour DNP MAS RMN s’alignent parfaitement sur celles requises pour le stockage à long terme de cellules de mammifères viables5. Cependant, la méthode conventionnelle de transfert d’un échantillon dans un spectromètre RMN DNP MAS le soumet à des taux de fluctuation de température qui rompent les cellules de mammifères.
Les expériences de RMN MAS exigent que l’échantillon soit tourné autour de l’angle magique à des fréquences égales ou supérieures à l’amplitude de l’interaction anisotrope pour qu’il soit moyenné à zéro, généralement au moins 4 kHz et souvent beaucoup plus élevé6,7,8,9. Les échantillons sont donc emballés dans des rotors qui ont une pointe à ailettes qui est utilisée pour entraîner la rotation du rotor par un flux de gaz et ont une marque à l’autre extrémité afin que la fréquence de rotation puisse être surveillée par un tachymètre. Le transfert d’échantillon pour la plupart des instruments RMN MAS est effectué en injectant le rotor de l’extérieur de l’instrument dans le stator à l’extrémité de la sonde RMN avec un flux d’air sec ou d’azote gazeux. Une fois que le rotor a atteint le stator, qui maintient le rotor à l’angle magique, la rotation de l’échantillon est propulsée par un mécanisme de turbine à air. Séparer les flux de gaz supportent, propulsent et contrôlent la température du rotor. L’insertion d’un rotor dans le spectromètre RMN et la stabilité de la rotation MAS nécessitent des pointes d’entraînement finement usinées et un contrôle strict de la température et de la pression des flux de gaz séparés. Malgré ces exigences techniques, l’insertion et la réalisation de MAS stables sont largement automatisées pour les sondes RMN MAS commerciales pour les applications à température ambiante.
Cependant, la situation est plus compliquée pour les applications à basse température. Les échantillons pour les applications à basse température sont généralement insérés dans le spectromètre à température ambiante et congelés dans le stator. Dans la première minute, la température de l’échantillon diminue rapidement (> −100 °C/min) et la température du système nécessite plusieurs minutes pour s’équilibrer. En raison de l’interaction de la température et de la pression, l’insertion et l’approche du MAS souhaité sont souvent gérées manuellement pour les applications à basse température. Malgré la nécessité d’une intervention manuelle, la congélation du rotor à l’intérieur de l’instrument est bénéfique car elle minimise l’introduction d’eau et de condensation dans la sonde, ce qui est essentiel pour une filature réussie. Non seulement la condensation et l’accumulation de glace provenant de l’humidité ambiante peuvent bloquer les conduites de gaz, la condensation ou le gel sur le rotor lui-même peuvent empêcher mécaniquement le MAS. Ainsi, les échantillons de RMN MAS à basse température sont généralement congelés à l’intérieur de l’instrument à des taux supérieurs à -100 °C/min.
Les cellules de mammifères peuvent conserver leur intégrité tout au long d’un cycle de gel-dégel si le refroidissement est lent5,10,11,12, à un taux égal ou inférieur à 1 ° C / min. Alternativement, les cellules conservent également leur intégrité si la vitesse de refroidissement est ultra-rapide13,14,15, à une vitesse supérieure à 104 ° C / min. Les taux intermédiaires à ces deux extrêmes rompent et tuent les cellules de mammifères en raison de la formation de cristaux de glace à l’intérieur et à l’extérieur des cellules, même en présence d’agents cryoprotecteurs16. Les taux de refroidissement de l’échantillon pour un rotor à température ambiante à l’intérieur d’une sonde pré-refroidie se situent entre ces deux extrêmes, donc pour étudier cryogéniquement les cellules de mammifères viables intactes conservées cryogéniquement, les échantillons doivent être congelés avant d’être transférés dans l’instrument et transférés dans l’instrument sans fluctuations de température qui pourraient endommager l’échantillon ou l’accumulation de givre sur le rotor qui pourrait empêcher le rotor de tourner. Le protocole décrit une méthode d’insertion de rotor pré-refroidie sans gel dans un système de RMN MAS cryogénique pour l’étude d’échantillons de cellules de mammifères viables intacts cryogéniquement préservés. Le transfert d’échantillon cryogénique décrit ici a été développé pour la caractérisation RMN de cellules intactes viables. Cependant, elle s’applique à tout système où les fluctuations de température peuvent compromettre l’intégrité de l’échantillon. Cela inclut toute variété de systèmes complexes, tels que les réactions trempées par congélation pour la caractérisation chimique et structurelle des intermédiaires de réaction piégés17,18, l’enzymologie19,20 ou le repliement des protéines21,22.
Protocole
1. Culture et cryoprotection des cellules de mammifères
- Culture et récolte de cellules de mammifères
- Décongeler une aliquote de cellules rénales embryonnaires humaines congelées (HEK 293).
- Culture de cellules HEK 293 dans des milieux de croissance (p. ex. DMEM avec 10 % de sérum bovin fœtal et 1 % de streptocoque) à 37 °C avec 5 % de CO2 dans des plaques de 100 mm pendant deux à trois passages (7-10 jours).
- Divisez les cellules et les culturez dans une plaque de 150 mm jusqu’à ce que les cellules atteignent une confluence de 90 à 95%.
REMARQUE: Une plaque de 150 mm à > 90% de confluence sera suffisante pour remplir deux rotors en saphir d’un diamètre de 3,2 mm. - Récolter des cellules en utilisant 4 mL de trypsine (voir Tableau des matériaux)et 10 mL de milieu. Transférer la suspension dans un conique stérile de 15 mL et centrifuger à 673 x g (1000 tr/min) pendant 5 min à température ambiante. Retirez le surnageant.
- Laver la pastille cellulaire avec une solution saline tamponnée au phosphate (PBS) (pH 7,4, −CaCl2, −MgCl2).
- Cryoprotection des cellules
- Recueillir une pastille de cellule de 50 μL dans un tube de microcentrifugation. Préparer un mélange de 50 μL de PBS et de 18 μL de glycérol dans un tube séparé.
- Mélanger doucement la pastille cellulaire de 50 μL avec 68 μL de mélange glycérol-PBS en ajoutant le mélange glycérol-PBS au sommet de la pastille et en repoussant la pastille en tapotant doucement le côté du tube jusqu’à ce qu’il ne reste plus d’amas.
REMARQUE: Le pipetage doux peut également être utilisé pour ressuspend la cellule, mais assurez-vous que l’intégrité cellulaire n’est pas compromise.
2. Cryoconservation de cellules de mammifères dans un rotor RMN
- Transfert des cellules dans un rotor en saphir de 3,2 mm.
- Pour fabriquer un entonnoir, coupez une pointe de pipette de 200 μL et insérez l’extrémité étroite de la pointe de la pipette coupée dans le rotor de 3,2 mm.
- Transférez les cellules dans l’entonnoir assis sur le rotor. Placez le rotor avec l’entonnoir dans un tube de microcentrifugation et enrobez les cellules dans le fond du rotor par centrifugation à 673 x g pendant 2-3 min à température ambiante.
- Retirez le surnageant et tout excès d’échantillon du rotor. Répétez ces deux étapes jusqu’à ce que le rotor soit complètement rempli de cellules.
REMARQUE: Éventuellement, déterminez la viabilité cellulaire de l’échantillon avant la congélation. Resuspendez 10 μL de la pastille cellulaire excédentaire dans 100 μL de DMEM sans FBS. Mélanger 10 μL de la suspension avec une solution de bleu de trypan à 0,4 % et évaluer immédiatement la viabilité à l’aide d’un compteur de cellules automatisé. Utilisez uniquement des milieux libres fbs pour diluer les cellules car le sérum interfère avec la coloration du bleu trypan. - Scellez le rotor avec un bouchon en silicium à l’aide d’un outil d’emballage disponible dans le commerce.
- Fermez le rotor avec une pointe d’entraînement en céramique en appuyant verticalement vers le bas. Évitez de toucher les ailettes délicates sur le côté de la pointe du lecteur.
- Marquez la moitié du bord inférieur du rotor en saphir avec un marqueur permanent en argent et l’autre moitié du bord inférieur du rotor avec un marqueur permanent noir pour permettre une surveillance précise de la rotation du rotor à l’intérieur du spectromètre.
REMARQUE: Des imperfections dans le marquage du rotor empêcheront un comptage précis de la fréquence de rotation, ce qui entraînera l’échec de la rotation stable. Étant donné que les marqueurs n’écrivent pas sur un rotor gelé et que le réchauffement du rotor compromet l’intégrité de l’échantillon, le marquage du rotor avant la congélation est une étape critique.
- Cryoconservation de cellules à l’intérieur d’un rotor en saphir de 3,2 mm.
- Placez un coussin fait d’un morceau de mouchoir ou d’une serviette en papier sous le couvercle et au fond du flacon cryogénique (voir Tableau des matériaux).
REMARQUE: Le papier de soie protège le marquage du rotor contre les dommages subis par le choc contre les côtés des flacons cryogéniques. - Placez le rotor en saphir de 3,2 mm dans le flacon cryogénique rembourré avec le papier de soie avec une extrémité marquée face au fond du flacon cryogénique.
- Congelez lentement le rotor en plaçant le flacon cryogénique dans le récipient de refroidissement à débit contrôlé (-1 °C/min) et placez le récipient dans un congélateur à -80 °C pendant au moins 3 h.
- Transférer le flacon cryogénique contenant le rotor congelé dans un stockage d’azote liquide.
- Placez un coussin fait d’un morceau de mouchoir ou d’une serviette en papier sous le couvercle et au fond du flacon cryogénique (voir Tableau des matériaux).
3. Transfert cryogénique d’un échantillon congelé dans le spectromètre RMN
- Transporter l’échantillon congelé jusqu’à l’installation rmneuse.
- Transférer le flacon cryogénique contenant le rotor congelé dans un petit dewar rempli d’azote liquide pour le transport vers l’installation de RMN.
- Transfert du rotor congelé dans le bain d’azote liquide.
- Remplissez un dewar en mousse à large bouche sèche et isolée thermiquement avec 500 mL – 1 L d’azote liquide.
- Transférer le rotor du flacon cryogénique dans la mousse à large bouche remplie d’azote liquide.
- Prenez le flacon cryogénique du dewar de transfert dans la main et tenez-le juste au-dessus de la surface de l’azote liquide pour le protéger de l’atmosphère.
- Tout en tenant le flacon cryogénique avec la bouche pointant légèrement vers le bas, dévissez le capuchon et laissez le rotor glisser dans le bain d’azote liquide.
REMARQUE: Une fois le bouchon dévissé, le rotor doit tomber rapidement du flacon cryogénique dans le bain d’azote liquide (moins de 1 seconde) pour empêcher la condensation de s’accumuler sur le rotor. L’évaporation de l’azote liquide forme un « nuage d’azote » dans la large bouche mousse dewar et empêche la condensation sur le rotor avant qu’il ne soit immergé dans l’azote liquide. Une exposition plus longue du rotor à l’air peut entraîner une condensation de l’humidité sur les parois du rotor qui se condensera à nouveau en glace.
- Transfert cryogénique du rotor vers le capteur d’échantillons RMN.
- Préchillez un tube de microcentrifugation de 1,5 mL en l’immergeant dans le bain d’azote liquide. Ne fermez pas le tube.
REMARQUE: Inspectez le rotor avant de le transférer dans le tube de microcentrifugation. À l’aide d’une pince à épilez, maintenez le rotor juste sous la surface de l’azote liquide et vérifiez que les marques du rotor sont intactes, qu’aucun dépôt de glace ne s’est formé sur ses parois et que la pointe de l’entraînement est intacte. Les dépôts de cristaux de glace sur les parois du rotor apparaissent sous forme de poudre blanche. Veillez à toujours tenir le rotor par son corps et non par la pointe de l’entraînement. Ne grattez pas le marquage du rotor avec les embouts de la pince. - Sous la surface du bain d’azote liquide, utilisez une pince à épiler pour transférer le rotor dans le tube de microcentrifugation avec la pointe d’entraînement orientée vers le bas du tube de microcentrifugation et les marques faisant face à l’ouverture du tube.
REMARQUE: Toujours sécher les pinces avant de s’immerger dans de l’azote liquide ou de toucher le rotor. - À l’aide d’une pince à épilez, maintenez le tube contenant le rotor sous azote liquide par son col.
- Avec une deuxième paire de pinces à épiler à la main, préparez-vous à immerger le capteur d’échantillon RMN dans le bain d’azote liquide et à le maintenir de manière à ce qu’il soit incliné à un angle aigu par rapport au tube de microcentrifugation.
REMARQUE : Réduisez au minimum le temps pendant lequel le capteur d’échantillons est en contact avec l’azote liquide pour éviter de congeler le joint torique. Si le joint torique gèle, il sera très difficile d’insérer le capteur dans le spectromètre.
- Préchillez un tube de microcentrifugation de 1,5 mL en l’immergeant dans le bain d’azote liquide. Ne fermez pas le tube.
- Transfert cryogénique du rotor du capteur d’échantillons RMN au spectromètre RMN
REMARQUE: Cette étape nécessite deux personnes, l’une pour faire fonctionner le cryocabinet et l’autre pour transférer l’échantillon de l’azote liquide dans la sonde.- Placez la cryocabinette en mode éjection en appuyant sur 'EJECT' sur l’armoire.
REMARQUE: Le mode d’éjection purge le flux d’azote gazeux sec et froid à haute pression de la sonde à l’atmosphère afin d’empêcher l’entrée de l’humidité atmosphérique. - Transférez le rotor dans le capteur d’échantillons RMN.
- Insérez l’extrémité ouverte du capteur d’échantillon RMN dans le tube de microcentrifugation tout en restant sous la surface de l’azote liquide.
- Soulevez à la fois le tube de microcentrifugation et le capteur d’échantillons RMN pour permettre au rotor de tomber dans le capteur d’échantillons. Secouez le capteur d’échantillons RMN et le tube de microcentrifugation au cas où le rotor serait coincé sur le bord du capteur d’échantillons.
- Laissez le tube de microcentrifugation vide sur le dessus du capteur d’échantillons RMN pour protéger le rotor de l’air.
- Retirez l’autre capteur d’échantillons RMN vide de la sonde et posez-le sur le sol.
- Transférez le capteur d’échantillons RMN contenant le rotor à votre main libre, retirez le tube de microcentrifugeuse et insérez-le immédiatement dans la sonde.
REMARQUE: Si le joint torique gèle, il sera difficile de serrer le capteur d’échantillon. Continuez à appliquer de la force jusqu’à ce qu’elle glisse en place. - Signalez à la personne qui exploite la cryocabinet d’arrêter d’éjecter et d’insérer.
REMARQUE: Le mode d’insertion guide le rotor du capteur d’échantillons dans la sonde. - Faites tourner l’échantillon à la vitesse de rotation souhaitée (par exemple, 12 kHz) en ajustant le roulement et la pression de débit d’englage contrôlée par la cryocabinet. (par exemple, augmentez immédiatement le gaz de roulement à ~200 mBar et le gaz d’entraînement à 10 mBar. Une fois l’échantillon file, augmentez le gaz du roulement à 1000 mBar et entraînez le gaz à 200 mBar. Au fur et à mesure que la rotation se stabilise, augmentez le roulement à 2400 mBar, puis augmentez le gaz d’entraînement de 200 mBar à 1700 mBar pendant plusieurs minutes. Le gaz de refroidissement VT est constant à ~1070 L/h.)
REMARQUE: Lorsque vous soulevez le tube de microcentrifugation et le capteur d’échantillons RMN hors du bain d’azote liquide, assurez-vous que le tube de microcentrifugation contient suffisamment d’azote liquide pour entourer le rotor. Réduisez le temps entre le transfert du rotor dans le capteur d’échantillons RMN et l’insertion du capteur d’échantillons RMN dans le spectromètre. Toutes les étapes de la section 3.4 devraient être terminées dans les 30 s.
- Placez la cryocabinette en mode éjection en appuyant sur 'EJECT' sur l’armoire.
4. Retrait cryogénique de l’échantillon du spectromètre RMN
- Préparation du bain d’azote liquide et du flacon cryogénique
- Versez 500 mL - 1 L d’azote liquide dans la mousse à large bouche et placez le bain sous le spectromètre.
- Pré-refroidir le flacon cryogénique. Immergez le flacon cryogénique vide contenant un morceau de papier de soie dans le bain d’azote liquide.
- Transfert cryogénique du rotor de la sonde au flacon cryogénique
- Réduisez la vitesse de rotation à 0 kHz en réduisant le débit de gaz d’éjection et de roulement et éjectez le rotor en passant en mode d’éjection.
- Maintenez le mode d’éjection activé, retirez le capteur d’échantillons de la sonde, déposez le rotor directement dans le dewar en mousse à large bouche contenant de l’azote liquide.
- À l’aide d’une pince à épileuse pré-réfrigérée, transférer le rotor dans un flacon cryogénique pré-réfrigéré sous la surface de l’azote liquide.
- Coiuchez le flacon cryogénique. Précédez le bouchon du flacon cryogénique en le trempant dans de l’azote liquide. Retirez le flacon cryogénique contenant le rotor et l’azote liquide du bain et coiffez le tube avec un bouchon précédité. Ne serrez pas le bouchon de sorte que l’azote vaporisant puisse être libéré en toute sécurité.
- Ré-immergez le flacon cryogénique dans de l’azote liquide. L’échantillon peut être transféré dans un stockage d’azote liquide à plus long terme ou déballé immédiatement pour une analyse plus approfondie.
5. Déballage du rotor et mesures de viabilité
- Déballage du rotor et mesure de la viabilité
- Milieu préchauffant sans sérum (DMEM) ou PBS à 37 °C.
- Retirer le rotor de l’azote liquide. Retirez l’embout du lecteur et la fiche en silicium.
REMARQUE: Le saphir est un excellent conducteur de chaleur. Évitez de toucher le rotor avec vos doigts, car le transfert de chaleur peut provoquer des événements de gel-dégel locaux qui compromettent la viabilité cellulaire.
- Mesurer la viabilité
- Ajouter 20 μL de milieu chaud à la pastille de cellule congelée dans le rotor et resuspender les cellules. Retirer la suspension avec une pipette et mélanger la suspension avec 100 μL de média.
- Retirer 10 μL de suspension cellulaire et mélanger avec un volume égal de solution de bleu de trypan à 0,4 % (v/v). Incuber à température ambiante pendant 30 s à 1 min.
- Mesurez la viabilité à l’aide d’un compteur de cellules automatisé.
Résultats
L’insertion cryogénique d’échantillons prégelés de cellules de mammifères dans le spectromètre RMN favorise la viabilité tout au long de l’expérience RMN. Les schémas du transfert cryogénique d’un échantillon congelé dans une sonde RMN pré-refroidie sont illustrés à la figure 1. La viabilité et l’intégrité cellulaires peuvent être évaluées à l’aide de diverses méthodes. Ici, nous avons utilisé une mesure standard de l’intégrité de la membrane à base de colorant, qui s’aligne bien avec d’autres méthodes23. Les cellules intactes sont imperméables au bleu trypan tandis que les cellules dont l’intégrité membranaire est compromise sont perméables. Le nombre de cellules perméables et imperméables au bleu trypan peut être rapidement évalué à l’aide d’un compteur de cellules automatisé. Selon le protocole décrit ici, la perméabilité au bleu trypan des cellules de mammifères après rmN MAS (c.-à-d. au point 5.2.3) est similaire à la perméabilité au bleu trypan des cellules de mammifères avant tout changement de température (c.-à-d. point 2.1.3). Cependant, si les cellules sont lentement congelées, puis réchauffées à la température ambiante avant l’insertion (c’est-à-dire en suivant le protocole au point 3 avant de réchauffer le rotor à la température ambiante avant de l’insérer dans la sonde réfrigérée), la viabilité cellulaire évaluée par le bleu de trypan diminue à moins de 10% des cellules(Figure 2). Ainsi, la congélation des cellules à l’intérieur du spectromètre entraîne la perte de l’intégrité de la membrane cellulaire tandis que l’insertion cryogénique d’échantillons congelés de cellules de mammifères soutient la viabilité cellulaire tout au long de l’expérience rmneuse.

Figure 1 : Schéma du transfert cryogénique d’un échantillon congelé dans une sonde RMN pré-refroidie. (A) Approchez la surface de l’azote liquide et dévissez le sommet du flacon cryogénique. (B) Faire glisser le rotor dans le bain d’azote liquide. (C) Immergez un tube de microcentrifugation à l’aide d’une pince à épiler et maintenez-le en place jusqu’à ce qu’il refroidisse complètement. (D) Insérez le rotor dans la microcentrifugeuse avec la pointe d’entraînement orientée vers le bas du tube. Poussez, plutôt que d’attraper, avec la pince à épiler. (E) Tenez le tube de microcentrifugation juste sous la surface du bain d’azote liquide et inspectez visuellement le rotor pour vous assurer qu’il est exempt de gel et bien marqué. (F) Maintenez le capteur d’échantillons à un angle au-dessus de la surface. (G) Soulevez le capteur d’échantillons et le tube hors de l’azote liquide dès que le capteur d’échantillons est à l’intérieur du tube de microcentrifugation. (H) Secouez le capteur d’échantillons si le rotor est coincé sur la jante. (I) Retirez le capteur d’échantillons vide de la sonde et posez-le sur le sol. (J) Retirez le tube de microcentrifugeuse du capteur d’échantillons avec le rotor à l’intérieur, insérez, serrez le capteur d’échantillons dans la sonde et appuyez sur « INSERT » sur la console de commande. Veuillez cliquer ici pour voir une version agrandie de cette figure.
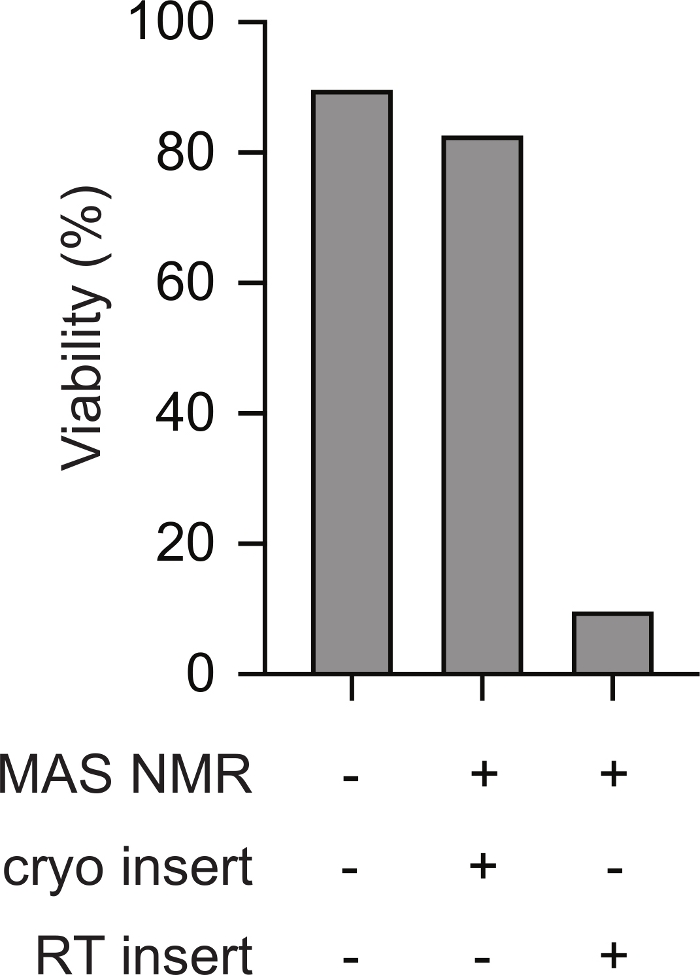
Figure 2 : L’insertion cryogénique d’un échantillon prégelé de cellules de mammifères permet de mesurer l’intégrité cellulaire de la même manière que les échantillons de cellules de mammifères qui n’ont jamais été congelés. Le pourcentage de cellules imperméables au bleu de trypan pour les échantillons qui n’ont jamais été congelés (p. ex. étape 2.1.3) est semblable à celui des cellules pour les échantillons après RMN MAS (p. ex. étape 5.2.3 avec MAS 12 kHz). Les cellules à congélation lente (p. ex. étape 3) qui ont été chauffées à la température ambiante avant d’être insérées dans l’instrument rmnographe qui avait été pré-refroidi à 100 K avaient des pourcentages beaucoup plus faibles de cellules intactes après rmN MAS avec MAS 12 kHz. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le transfert cryogénique d’échantillons congelés dans un spectromètre RMN réussit à préserver la viabilité des cellules de mammifères congelées grâce à l’acquisition de données RMN. Le succès de cette méthodologie est démontré dans les mesures de viabilité RMN avant et après MAS. Cette approche est efficace et généralisable à tout système où les fluctuations de température peuvent compromettre l’intégrité de l’échantillon. Le protocole actuellement présenté est réalisé avec la lignée cellulaire HEK 293. Étant donné que les conditions de cryoconservation pour de nombreuses lignées cellulaires de mammifères sont très similaires, il est probable que les conditions rapportées ici sont traduisibles à d’autres systèmes cellulaires; cependant, ils peuvent nécessiter une optimisation supplémentaire des cryoprotecteurs, des volumes d’échantillons et des taux de congélation pour obtenir les mêmes résultats.
Cette méthodologie peut être améliorée en déballant le rotor plus rapidement après l’expérience RMN. Cette étape est actuellement sous-optimale et son exécution affecte la viabilité des cellules. Avant que les cellules puissent être ressuspendées dans un support, la pointe d’entraînement et la fiche en silicium doivent être retirées du rotor. L’échantillon dégèle de manière inégale lorsque le rotor est maintenu pendant le retrait de la pointe d’entraînement et du bouchon en silicium, de sorte que des temps de manipulation du rotor plus courts entraînent des viabilités plus élevées. Le développement de supports de rotor ou d’autres outils pour faciliter une décongélation uniforme et le retrait rapide de la pointe d’entraînement et du bouchon en silicium contribuerait à rendre l’évaluation post-RMN de la viabilité plus précise.
L’approche de la charge cryogénique des échantillons décrite dans cet article est limitée aux sondes RMN qui prennent en charge l’insertion et l’éjection de l’échantillon avec la sonde en place dans l’alésage de l’aimant RMN. Bien que l’insertion et l’éjection d’échantillons externes soit standard pour les systèmes DNP commerciaux, les sondes personnalisées n’ont pas toujours cette option. En outre, cette approche de la charge cryogénique des échantillons peut nécessiter certaines modifications pour que les sondes RMN construites soient compatibles avec des rotors de différentes tailles. Ce protocole a été optimisé pour les rotors de 3,2 mm et peut nécessiter une modification si le diamètre extérieur du capteur d’échantillon dépasse le diamètre intérieur d’un tube de microcentrifugation (p. ex., étape 3.4.2).
Avec l’application du DNP à la RMN MAS, il est maintenant possible de détecter des protéines et d’autres biomolécules à des concentrations physiologiques endogènes24,25,26. Cela ouvre la possibilité d’étudier les biomolécules dans leur environnement natif. Le maintien de l’intégrité et de la viabilité cellulaires tout au long de l’expérience est susceptible d’être essentiel pour relier les résultats expérimentaux de la spectroscopie aux phénomènes biologiques. La congélation incontrôlée d’échantillons contenant des protéines purifiées ou des lysates cellulaires ne compromet généralement pas la qualité des échantillons7,27, bien qu’il y ait certaines indications que le taux de congélation puisse être une variable importante même dans les systèmes purifiés28. Cependant, les échantillons de cellules de mammifères doivent être congelés à un rythme contrôlé si la préservation de l’intégrité et de la viabilité cellulaires est importante pour l’interprétation. Nous présentons ici un protocole pour la congélation et le transfert d’échantillons congelés de cellules de mammifères dans un instrument de RMN DNP MAS pré-refroidi qui évite les fluctuations de température potentiellement dommageables et prend en charge la mesure sur des cellules viables.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été soutenu par des subventions du Cancer Research Prevention & Research Institute of Texas [RR150076], de la National Science Foundation [1751174]; les National Institutes of Health [NS-111236], la Welch Foundation [1-1923-20170325]; la Lupe Murchison Foundation, la Ted Nash Long Life Foundation et la Kinship Foundation (Searle Scholars Program) à K.K.F.
matériels
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue stain | Invitrogen | T10282 | |
| 100 mm cell culture dish | Thomas Scientific | 430167 | |
| 150 mm cell culture dish | Nunc | 157150 | |
| 3.2 mm sapphire rotor | Bruker | ||
| 45 ° angled forceps | Hampton Research | HR4-859 | |
| AMUPol | Cortecnet | C010P005 | |
| Black and Silver marker | Sharpie | ||
| Cap removal tool | Bruker | HZ16913 | |
| Cell culture grade water | HyClone | SH30529.03 | |
| Ceramic cap | Cortecnet | HZ12372 | |
| CoolCell | Corning/ Biocision | UX-04392-00 (Corning) / BCS-405 (Bioscion) | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10288 | |
| Countess II automated cell counter | Invitrogen | AMQAF1000 | |
| Cryogen tubes | Nalgene | 03-337-7Y | |
| d8-glycerol | Aldrich | 447498 | |
| Deuterium oxide, 99.8 % atom D | Aldrich | 756822-1 | |
| DMEM | Gibco | 10569-010 | |
| DNP NMR system with frequency-matched gyrotron | Bruker | ||
| Foam dewar | Spearlab | FD-800 | |
| Kimwipes | Kimwipes | ||
| Packing tool | Bruker | ||
| Pen-Strep | Gibco | 15140-122 | |
| Powdered PBS | VWR | VWRRV0780 | |
| Protonated PBS | Gibco | 10010-023 | |
| Silicon plug | Bruker | B7089 | |
| Standard Vessel forceps | |||
| Tryp-L | Gibco | 12605010 |
Références
- Costello, W. N., Xiao, Y., Frederick, K. K. DNP-Assisted NMR Investigation of Proteins at Endogenous Levels in Cellular Milieu. Methods Enzymology. 615 (1), 373-406 (2019).
- Hall, D. A., et al. Polarization-Enhanced NMR Spectroscopy of Biomolecules in Frozen Solution. Science. 276 (5314), 930-932 (1997).
- Akbey, Ü, Oschkinat, H. Structural biology applications of solid state MAS DNP NMR. Journal of Magnetic Resonance. 269 (1), 213-224 (2016).
- Matsuki, Y., et al. Helium-cooling and -spinning dynamic nuclear polarization for sensitivity-enhanced solid-state NMR at 14T and 30K. Journal of Magnetic Resonance. 225 (1), 1-9 (2012).
- Miyamoto, Y., Ikeuchi, M., Noguchi, H., Hayashi, S. Long-term Cryopreservation of Human and other Mammalian Cells at -80 °C for 8 Years. Cell Medicine. 10 (1), 1-7 (2018).
- Lopez del Amo, J. M., Schneider, D., Loquet, A., Lange, A., Reif, B. Cryogenic solid state NMR studies of fibrils of the Alzheimer's disease amyloid-β peptide: perspectives for DNP. Journal of Biomolecular NMR. 56 (4), 359-363 (2013).
- Gupta, R., et al. Dynamic nuclear polarization enhanced MAS NMR spectroscopy for structural analysis of HIV-1 protein assemblies. The Journal of Physical Chemistry B. 120 (2), 329-339 (2016).
- Lim, B. J., Ackermann, B. E., Debelouchina, G. T. Targetable Tetrazine-Based Dynamic Nuclear Polarization Agents for Biological Systems. ChemBioChem. 21 (9), 1315-1319 (2020).
- Jaudzems, K., et al. Dynamic nuclear polarization-enhanced biomolecular NMR spectroscopy at high magnetic field with fast magic-angle spinning. Angewandte Chemie International Edition. 57 (25), 7458-7462 (2018).
- Chaytor, J. L., et al. Inhibiting ice recrystallization and optimization of cell viability after cryopreservation. Glycobiology. 22 (1), 123-133 (2012).
- Mazur, P. Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing. The Journal of General Physiology. 47 (2), 347-369 (1963).
- Lovelock, J. E., Bishop, M. W. H. Prevention of Freezing Damage to Living Cells by Dimethyl Sulphoxide. Nature. 183 (4672), 1394-1395 (1959).
- Bald, W. B. The relative merits of various cooling methods. Journal of Microscopy. 140 (1), 17-40 (1985).
- Akiyama, Y., Shinose, M., Watanabe, H., Yamada, S., Kanda, Y. Cryoprotectant-free cryopreservation of mammalian cells by superflash freezing. Proceedings of the National Academy of Sciences. 116 (16), 7738-7743 (2019).
- Shi, M., et al. High-throughput non-contact vitrification of cell-laden droplets based on cell printing. Scientific Reports. 5 (1), 17928(2015).
- Pegg, D. E. Principles of cryopreservation. Methods in Molecular Biology. 1257, 3-19 (2015).
- Ramilo, C., et al. Detection of the covalent intermediate of UDP-N-acetylglucosamine enolpyruvyl transferase by solution-state and time-resolved solid-state NMR spectroscopy. Biochemistry. 33 (50), 15071-15079 (1994).
- Jeon, J., Thurber, K. R., Ghirlando, R., Yau, W. M., Tycko, R. Application of millisecond time-resolved solid state NMR to the kinetics and mechanism of melittin self-assembly. Proceedings of the National Academy of Sciences. 116 (34), 16717(2019).
- Pievo, R., et al. A rapid freeze-quench setup for multi-frequency EPR spectroscopy of enzymatic reactions. Chemphyschem. 14 (18), 4094-4101 (2013).
- Cherepanov, A. V., de Vries, S. Microsecond freeze-hyperquenching: development of a new ultrafast micro-mixing and sampling technology and application to enzyme catalysis. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1656 (1), 1-31 (2004).
- Hu, K. N., Tycko, R. What can solid state NMR contribute to our understanding of protein folding. Biophysical Chemistry. 151 (1), 10-21 (2010).
- Hu, K. N., Yau, W. M., Tycko, R. Detection of a transient intermediate in a rapid protein folding process by solid-state nuclear magnetic resonance. Journal of the American Chemical Society. 132 (1), 24-25 (2010).
- Johnson, S., Nguyen, V., Coder, D. Assessment of cell viability. Current Protocols in Cytometry. 64 (1), 1-26 (2013).
- Frederick, K. K., et al. Sensitivity-enhanced NMR reveals alterations in protein structure by cellular milieus. Cell. 163 (3), 620-628 (2015).
- Van Der Cruijsen, E. A. W., et al. Biomolecular DNP-supported NMR spectroscopy using Site-directed spin labeling. Chemistry. 21 (37), 12971-12977 (2015).
- Schlagnitweit, J., et al. Observing an antisense drug complex in intact human cells by in-cell NMR spectroscopy. ChemBioChem. 20 (19), 2474-2478 (2019).
- Debelouchina, G. T., et al. Dynamic nuclear polarization-enhanced solid-state NMR spectroscopy of GNNQQNY nanocrystals and amyloid fibrils. Physical Chemistry Chemical Physics : PCCP. 12 (22), 5911-5919 (2010).
- Schmidt, T., et al. Submillisecond freezing permits cryoprotectant-free EPR doubled electron-electron resonance spectroscopy. ChemPhysChem. 21, 1224-1229 (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon