Method Article
Caricamento criogenico del campione in uno spettrometro a risonanza magnetica nucleare ad angolo magico che preserva la vitalità cellulare
In questo articolo
Riepilogo
Qui viene presentato un protocollo per il trasferimento criogenico di campioni congelati nella sonda di risonanza magnetica nucleare (NMR) a polarizzazione nucleare dinamica (DNP) ma anche ad angolo di rotazione (MAS). Il protocollo include le indicazioni per lo stoccaggio del rotore prima dell'esperimento e le indicazioni per le misurazioni di fattibilità prima e dopo l'esperimento.
Abstract
La polarizzazione nucleare dinamica (DNP) può aumentare notevolmente la sensibilità della spettroscopia di risonanza magnetica nucleare (NMR) MAS (Magic Angle Spinning). Questi guadagni di sensibilità aumentano con la diminuzione delle temperature e sono abbastanza grandi da consentire lo studio di molecole a concentrazioni molto basse alle temperature operative (~ 100 K) della maggior parte degli spettrometri NMR dotati di DNP commerciali. Ciò porta alla possibilità di biologia strutturale in-cell su cellule crioconservate per macromolecole ai loro livelli endogeni nei loro ambienti nativi. Tuttavia, i tassi di congelamento richiesti per la crioconservazione cellulare vengono superati durante la tipica manipolazione del campione per DNP MAS NMR e ciò si traduce in perdita di integrità e vitalità cellulare. Questo articolo descrive un protocollo dettagliato per la preparazione e il trasferimento criogenico di un campione congelato di cellule di mammifero in uno spettrometro MAS NMR.
Introduzione
L'introduzione della polarizzazione nucleare dinamica per la spettroscopia di risonanza magnetica nucleare ad angolo magico può aumentare la sensibilità della NMR MAS di diversi ordini di grandezza. Ciò ha permesso il rilevamento di biomolecole in prossimità delle loro concentrazioni fisiologiche. DNP può e fornisce la sensibilità necessaria per rilevare una proteina etichettata isotopicamente a concentrazioni endogene (~1 μM) in ambiente biologico complesso1. Poiché esistono protocolli consolidati per introdurre molecole etichettate isotopicamente in cellule di mammifero non etichettate senza influire sulla loro vitalità, questo apre la possibilità di studiare biomolecole arricchite isotopicamente ai loro livelli endogeni nel loro ambiente nativo. Inoltre, poiché i miglioramenti DNP sono più efficienti a temperature più basse2,3,4,le temperature sperimentali per DNP MAS NMR si allineano perfettamente con quelle richieste per la conservazione a lungo termine di cellule di mammifero vitali5. Tuttavia, il metodo convenzionale di trasferimento di un campione in uno spettrometro NMR DNP MAS lo sottopone a tassi di fluttuazione della temperatura che rompono le cellule di mammifero.
Gli esperimenti MAS NMR richiedono che il campione sia ruotato attorno all'angolo magico a frequenze uguali o superiori alla grandezza dell'interazione anisotropica per essere mediato a zero, in genere almeno 4 kHz e spesso molto più alto6,7,8,9. I campioni sono, quindi, imballati in rotori che hanno una punta alettata che viene utilizzata per guidare la rotazione del rotore da un flusso di gas e hanno un segno all'altra estremità in modo che la frequenza di rotazione possa essere monitorata da un tachimetro. Il trasferimento del campione per la maggior parte degli strumenti MAS NMR viene effettuato iniettando il rotore dall'esterno dello strumento nello statore all'estremità della sonda NMR con un flusso di aria secca o azoto gassoso. Dopo che il rotore raggiunge lo statore, che tiene il rotore all'angolo magico, la rotazione del campione viene spinta da un meccanismo a turbina ad aria. Flussi separati di gas supportano, spingono e controllano la temperatura del rotore. L'inserimento di un rotore nello spettrometro NMR e il raggiungimento di una rotazione MAS stabile richiedono punte di azionamento finemente lavorate e uno stretto controllo della temperatura e della pressione dei flussi separati di gas. Nonostante queste esigenze tecniche, l'inserimento e il raggiungimento di MAS stabili sono in gran parte automatizzati per le sonde NMR MAS commerciali per applicazioni a temperatura ambiente.
Tuttavia, la situazione è più complicata per le applicazioni a bassa temperatura. I campioni per applicazioni a bassa temperatura vengono in genere inseriti nello spettrometro a temperatura ambiente e congelati nello statore. Nel primo minuto, la temperatura del campione diminuisce rapidamente (> −100 °C/min) e la temperatura del sistema richiede diversi minuti per equilibrarsi. A causa dell'interazione tra temperatura e pressione, l'inserimento e l'avvicinamento del MAS desiderato vengono spesso gestiti manualmente per applicazioni a bassa temperatura. Nonostante la necessità di un intervento manuale, il congelamento del rotore all'interno dello strumento è vantaggioso perché riduce al minimo l'introduzione di acqua e condensa nella sonda, che è fondamentale per una rotazione di successo. Non solo la condensa e l'accumulo di ghiaccio dall'umidità ambientale bloccano le linee del gas, la condensa o il gelo sul rotore stesso possono impedire meccanicamente il MAS. Pertanto, i campioni per MAS NMR a bassa temperatura sono tipicamente congelati all'interno dello strumento a velocità superiori a -100 °C/min.
Le cellule di mammifero possono mantenere la loro integrità attraverso un ciclo di congelamento-disgelo se il raffreddamento è lento5,10,11, 12,ad una velocità uguale o più lenta di 1 °C/min. In alternativa le celle mantengono la loro integrità anche se la velocità di raffreddamento è ultraveloca13,14,15,ad una velocità superiore a 104 °C/min. Tassi intermedi a questi due estremi rompono e uccidono le cellule di mammifero a causa della formazione di cristalli di ghiaccio sia all'interno che all'esterno delle cellule, anche in presenza di agenti crioprotettivi16. Le frequenze di raffreddamento del campione per un rotore a temperatura ambiente all'interno di una sonda pre-raffreddata rientrano tra questi due estremi, quindi per studiare le cellule di mammifero vitali conservate criogenicamente intatte, i campioni devono essere congelati prima del trasferimento nello strumento e trasferiti nello strumento senza fluttuazioni di temperatura che potrebbero danneggiare il campione o l'accumulo di brina sul rotore che potrebbe impedire al rotore di girare. Il protocollo descrive un metodo per l'inserimento del rotore pre-raffreddato senza gelo in un sistema NMR MAS criogenico per lo studio di campioni di cellule di mammifero vitali conservate criogenicamente intatte. Il trasferimento di campioni criogenici qui descritto è stato sviluppato per la caratterizzazione NMR di cellule intatte vitali. Tuttavia, è applicabile a qualsiasi sistema in cui le fluttuazioni di temperatura possono compromettere l'integrità del campione. Ciò include qualsiasi varietà di sistemi complessi, come le reazioni di congelamento per la caratterizzazione chimica e strutturale degli intermedi di reazione intrappolati17,18, enzimologia19,20 o il ripiegamento proteico21,22.
Protocollo
1. Coltura e crioprotezione delle cellule di mammifero
- Coltura e raccolta di cellule di mammifero
- Scongelare un'aliquota di cellule renali embrionali umane congelate (HEK 293).
- Coltura di cellule HEK 293 in mezzi di crescita (ad esempio, DMEM con 10% di siero bovino fetale e 1% Pen-Strep) a 37 °C con 5% di CO2 in piastre da 100 mm per due o tre passaggi (7-10 giorni).
- Dividere le cellule e la coltura in una piastra di 150 mm fino a quando le cellule raggiungono il 90-95% di confluenza.
NOTA: Una piastra da 150 mm a > confluenza del 90% sarà sufficiente per riempire due rotori in zaffiro con un diametro di 3,2 mm. - Raccogliere le cellule utilizzando 4 mL di tripsina (vedi Tabella dei materiali)e 10 mL di media. Trasferire la sospensione in una conica sterile da 15 mL e centrifuga a 673 x g (1000 rpm) per 5 min a temperatura ambiente. Rimuovere il surnatante.
- Lavare il pellet cellulare con soluzione salina tamponata con fosfato (PBS) (pH 7,4, −CaCl2, −MgCl2).
- Crioprotezione delle cellule
- Raccogliere un pellet di cella da 50 μL in un tubo di microcentrifuga. Preparare una miscela di 50 μL di PBS e 18 μL di glicerolo in un tubo separato.
- Mescolare delicatamente il pellet cellulare da 50 μL con 68 μL di miscela glicerolo-PBS aggiungendo la miscela glicerolo-PBS nella parte superiore del pellet e riconsospendo il pellet picchiettando delicatamente il lato del tubo fino a quando non rimangono grumi.
NOTA: il pipettaggio delicato può anche essere utilizzato per risospendare la cellula, tuttavia, assicurarsi che l'integrità cellulare non sia compromessa.
2. Crioconservazione delle cellule di mammifero in un rotore NMR
- Trasferimento delle celle in un rotore in zaffiro da 3,2 mm.
- Per creare un imbuto, tagliare una punta della pipetta da 200 μL e inserire l'estremità stretta della punta della pipetta tagliata nel rotore da 3,2 mm.
- Trasferire le celle nell'imbuto seduto sul rotore. Posizionare il rotore insieme all'imbuto in un tubo microcentrifuga e pellet le celle nella parte inferiore del rotore mediante centrifugazione a 673 x g per 2-3 minuti a temperatura ambiente.
- Rimuovere il surnatante e l'eventuale campione in eccesso dal rotore. Ripetere questi due passaggi fino a quando il rotore non è completamente imballato con le celle.
NOTA: Facoltativamente, determinare la vitalità cellulare del campione prima del congelamento. Spese 10 μL del pellet cellulare in eccesso in 100 μL di DMEM senza FBS. Mescolare 10 μL della sospensione con soluzione blu di tripano allo 0,4% e valutare immediatamente la vitalità utilizzando un contatore cellulare automatizzato. Utilizzare solo supporti privi di FBS per diluire le cellule poiché il siero interferisce con la colorazione blu di tripano. - Sigillare il rotore con un tappo di silicio utilizzando uno strumento di imballaggio disponibile in commercio.
- Chiudere il rotore con una punta di azionamento in ceramica premendolo verticalmente verso il basso. Evitare di toccare le alette delicate sul lato della punta dell'unità.
- Contrassegnare metà del bordo inferiore del rotore in zaffiro con un marcatore permanente in argento e l'altra metà del bordo inferiore del rotore con un marcatore permanente nero per consentire un monitoraggio accurato della rotazione del rotore all'interno dello spettrometro.
NOTA: le imperfezioni nella marcatura del rotore impediranno un conteggio accurato della frequenza di rotazione, con conseguente mancato raggiungimento di una rotazione stabile. Poiché i marcatori non scrivono su un rotore congelato e il riscaldamento del rotore compromette l'integrità del campione, contrassegnare il rotore prima del congelamento è un passaggio critico.
- Crioconservazione delle cellule all'interno di un rotore in zaffiro da 3,2 mm.
- Posizionare un cuscino fatto da un pezzo di carta velina o tovagliolo sotto il coperchio e sul fondo della fiala criogenica (vedere Tabella dei materiali).
NOTA: La carta velina protegge la marcatura del rotore dai danni subiti urtando contro i lati delle fiale criogeniche. - Posizionare il rotore in zaffiro da 3,2 mm nel flaconcino criogenico imbottito con carta velina con estremità marcata rivolta verso il fondo del flaconcino criogenico.
- Congelare lentamente il rotore inserendo il flaconcino criogenico nel contenitore di raffreddamento a velocità controllata (-1 °C/min) e posizionare il contenitore in un congelatore a -80 °C per un minimo di 3 ore.
- Trasferire il flaconcino criogenico contenente il rotore congelato in azoto liquido.
- Posizionare un cuscino fatto da un pezzo di carta velina o tovagliolo sotto il coperchio e sul fondo della fiala criogenica (vedere Tabella dei materiali).
3. Trasferimento criogenico di un campione congelato nello spettrometro NMR
- Trasportare il campione congelato all'impianto NMR.
- Trasferire il flaconcino criogenico contenente il rotore congelato in un piccolo dewar riempito con azoto liquido per il trasporto all'impianto NMR.
- Trasferimento del rotore congelato al bagno di azoto liquido.
- Riempire un dewar in schiuma a bocca larga asciutto e isolato termicamente con 500 ml – 1 L di azoto liquido.
- Trasferire il rotore dal flaconcino criogenico nella schiuma a bocca larga dewar riempita con azoto liquido.
- Prendi la fiala criogenica dal dewar di trasferimento nella mano e tienila appena sopra la superficie dell'azoto liquido per proteggerla dall'atmosfera.
- Tenendo la fiala criogenica con la bocca leggermente rivolta verso il basso, svitare il cappuccio e lasciare che il rotore scivoli nel bagno di azoto liquido.
NOTA: Una volta svitato il cappuccio, il rotore deve cadere rapidamente dal flaconcino criogenico nel bagno di azoto liquido (meno di 1 secondo) per evitare che la condensa si raccolga sul rotore. L'evaporazione dell'azoto liquido forma una "nuvola di azoto" nel dewar di schiuma a bocca larga e impedisce la condensa sul rotore prima che venga immerso nell'azoto liquido. Un'esposizione più lunga del rotore all'aria può portare alla condensazione dell'umidità sulle pareti del rotore che si ricondenderà in ghiaccio.
- Trasferimento criogenico del rotore al raccoglitore di campioni NMR.
- Prechill un tubo di microcentrifuga da 1,5 ml immergendolo nel bagno di azoto liquido. Non chiudere il tubo.
NOTA: ispezionare il rotore prima del trasferimento nel tubo microcentrifuga. Usando una pinzetta, tenere il rotore appena sotto la superficie dell'azoto liquido e controllare che i segni del rotore siano intatti, che non si siano formati depositi di ghiaccio sulle sue pareti e che la punta dell'azionamento sia intatta. I depositi di cristalli di ghiaccio sulle pareti del rotore appaiono come polvere bianca. Fare attenzione a tenere sempre il rotore per il suo corpo e non per la punta dell'azionamento. Non graffiare la marcatura del rotore con le punte delle pinzette. - Sotto la superficie del bagno di azoto liquido, utilizzare una pinzetta per trasferire il rotore nel tubo microcentrifuga con la punta dell'azionamento rivolta verso il fondo del tubo microcentrifuga e i segni rivolti verso l'apertura del tubo.
NOTA: Asciugare sempre le pinzette prima di immergersi in azoto liquido o toccare il rotore. - Usando una pinzetta, tenere il tubo contenente il rotore sotto azoto liquido per il collo.
- Con una seconda coppia di pinzette in mano, preparatevi a immergere il raccoglitore di campioni NMR nel bagno di azoto liquido e tenerlo in modo che sia inclinato ad angolo acuto rispetto al tubo della microcentrifuga.
NOTA: ridurre al minimo il tempo in cui il raccoglitore del campione è a contatto con l'azoto liquido per evitare il congelamento dell'O-ring. Se l'O-ring si blocca, sarà molto difficile inserire il catcher nello spettrometro.
- Prechill un tubo di microcentrifuga da 1,5 ml immergendolo nel bagno di azoto liquido. Non chiudere il tubo.
- Trasferimento del rotore criogenico dal raccoglitore di campioni NMR allo spettrometro NMR
NOTA: questo passaggio richiede due persone, una per azionare il criocabineto e una per trasferire il campione dall'azoto liquido alla sonda.- Posizionare il criocabineto in modalità di espulsione premendo 'EJECT' sull'armadio.
NOTA: La modalità di espulsione spurga il flusso di gas di azoto secco e freddo ad alta pressione dalla sonda all'atmosfera al fine di impedire l'ingresso di umidità atmosferica. - Trasferire il rotore nel raccoglitore di campioni NMR.
- Inserire l'estremità aperta del raccoglitore di campioni NMR nel tubo microcentrifuga mentre è ancora sotto la superficie dell'azoto liquido.
- Sollevare sia il tubo microcentrifuga che il raccoglitore di campioni NMR per consentire al rotore di cadere nel raccoglitore di campioni. Agitare il raccoglitore di campioni NMR e il tubo di microcentrifuga nel caso in cui il rotore sia bloccato sul bordo del raccoglitore di campioni.
- Lasciare il tubo microcentrifuga vuoto sulla parte superiore del raccoglitore di campioni NMR per proteggere il rotore dall'aria.
- Rimuovere l'altro raccoglitore di campioni NMR vuoto dalla sonda e posarlo sul pavimento.
- Trasferire il raccoglitore di campioni NMR contenente il rotore a mano libera, rimuovere il tubo microcentrifuga e inserirlo immediatamente nella sonda.
NOTA: se l'O-ring si blocca, sarà difficile stringere il raccoglitore del campione. Continua ad applicare forza fino a quando non scivola in posizione. - Segnalare alla persona che aziona il criocabineto 'STOP EJECT' e 'INSERT'.
NOTA: la modalità di inserimento guida il rotore dal raccoglitore di campioni alla sonda. - Ruotare il campione alla velocità di rotazione desiderata (ad esempio, 12 kHz) regolando il cuscinetto e la pressione del flusso di guida controllata dal criocabineto. (ad esempio, aumentare immediatamente il gas del cuscinetto a ~ 200 mBar e il gas di azionamento a 10 mBar. Una volta che il campione gira, aumentare il gas del cuscinetto a 1000 mBar e guidare il gas a 200 mBar. Man mano che la rotazione si stabilizza, aumentare il cuscinetto a 2400 mBar e quindi aumentare il gas di azionamento da 200 mBar a 1700 mBar per diversi minuti. Il gas di raffreddamento VT è costante a ~1070 L/h.)
NOTA: quando si solleva il tubo di microcentrifuga e il raccoglitore di campioni NMR fuori dal bagno di azoto liquido, assicurarsi che il tubo di microcentrifuga abbia abbastanza azoto liquido al suo interno per circondare il rotore. Ridurre al minimo il tempo che tra il trasferimento del rotore nel raccoglitore di campioni NMR e l'inserimento del raccoglitore di campioni NMR nello spettrometro. Tutti i passaggi in 3.4 dovrebbero essere completati entro 30 s.
- Posizionare il criocabineto in modalità di espulsione premendo 'EJECT' sull'armadio.
4. Rimozione criogenica del campione dallo spettrometro NMR
- Preparazione del bagno di azoto liquido e del flaconcino criogenico
- Versare 500 ml - 1 L di azoto liquido nella schiuma a bocca larga dewar e posizionare il bagno sotto lo spettrometro.
- Pre-raffreddare il flaconcino criogenico. Immergere il flaconcino criogenico vuoto contenente un pezzo di carta velina nel bagno di azoto liquido.
- Trasferimento criogenico del rotore dalla sonda alla fiala criogenica
- Ridurre la velocità di rotazione a 0 kHz riducendo il flusso di gas di guida e cuscinetto ed espellendo il rotore passando alla modalità di espulsione.
- Mantenere attiva la modalità di espulsione, rimuovere il raccoglitore di campioni dalla sonda, far cadere il rotore direttamente nella schiuma a bocca larga dewar contenente azoto liquido.
- Utilizzando pinzette pre-refrigerate, trasferire il rotore in un flaconcino criogenico pre-refrigerato sotto la superficie dell'azoto liquido.
- Tappare il flaconcino criogenico. Prechill il tappo del flaconcino criogenico immergendolo in azoto liquido. Rimuovere il flaconcino criogenico contenente il rotore e l'azoto liquido dal bagno e tappare il tubo con cappuccio prechilled. Non stringere il tappo in modo che l'azoto vaporizzante possa essere rilasciato in modo sicuro.
- Ri-immergere il flaconcino criogenico in azoto liquido. Il campione può essere trasferito allo stoccaggio di azoto liquido a lungo termine o disimballato immediatamente per ulteriori analisi.
5. Misurazioni del rotore e della vitalità disimballaggio
- Disimballaggio del rotore e misurazione della redditività
- Media senza siero preriscaldante (DMEM) o PBS a 37 °C.
- Rimuovere il rotore dall'azoto liquido. Rimuovere la punta dell'unità e la spina in silicone.
NOTA: Lo zaffiro è un eccellente conduttore di calore. Evitare di toccare il rotore con le dita perché il trasferimento di calore può causare eventi locali di congelamento-scongelamento che compromettono la vitalità cellulare.
- Misurare la redditività
- Aggiungere 20 μL di mezzo caldo al pellet di cella congelato nel rotore e riaspendare le celle. Rimuovere la sospensione con una pipetta e mescolare la sospensione con 100 μL di supporto.
- Rimuovere 10 μL di sospensione cellulare e mescolare con uguale volume di soluzione blu di tripano allo 0,4% (v/v). Incubare a temperatura ambiente per 30 s a 1 min.
- Misurare la redditività utilizzando il contatore automatico delle celle.
Risultati
L'inserimento criogenico di campioni pre-congelati di cellule di mammifero nello spettrometro NMR supporta la vitalità durante l'esperimento NMR. Gli schemi di trasferimento criogenico di un campione congelato in una sonda NMR pre-raffreddata sono mostrati nella Figura 1. La vitalità cellulare e l'integrità possono essere valutate utilizzando una varietà di metodi. Qui abbiamo usato una misura standard basata sul colorante dell'integrità della membrana, che si allinea bene con altri metodi23. Le cellule intatte sono impermeabili al tripano blu mentre le cellule con integrità della membrana compromessa sono permeabili. Il numero di celle permeabili e impermeabili blu tripano può essere rapidamente valutato utilizzando un contatore di celle automatizzato. Utilizzando il protocollo qui descritto, la permeabilità al tripano blu delle cellule di mammifero dopo MAS NMR (cioè al punto 5.2.3) è simile alla permeabilità al tripano blu delle cellule di mammifero prima di qualsiasi variazione di temperatura (cioè punto 2.1.3). Tuttavia, se le cellule vengono congelate lentamente, quindi riscaldate a temperatura ambiente prima dell'inserimento (cioè seguendo il protocollo al punto 3 prima di riscaldare il rotore a temperatura ambiente prima di inserirle nella sonda refrigerata), la vitalità cellulare valutata dal tripano blu diminuisce a meno del 10% delle cellule (Figura 2). Pertanto, il congelamento delle cellule all'interno dello spettrometro provoca la perdita dell'integrità della membrana cellulare mentre l'inserimento criogenico di campioni congelati di cellule di mammifero supporta la vitalità cellulare durante l'esperimento NMR.

Figura 1: Schema del trasferimento criogenico di un campione congelato in una sonda NMR pre-raffreddata. (A) Avvicinarsi alla superficie dell'azoto liquido e svitare la parte superiore del flaconcino criogenico. B)Far scorrere il rotore nel bagno di azoto liquido. (C) Immergere un tubo di microcentrifuga usando una pinzetta e tenerlo in posizione fino a quando non si raffredda completamente. (D) Inserire il rotore nella microcentrifuga con la punta dell'azionamento rivolta verso il fondo del tubo. Spingere, piuttosto che afferrare, con le pinzette. (E) Tenere il tubo di microcentrifuga appena sotto la superficie del bagno di azoto liquido e ispezionare visivamente il rotore per assicurarsi che sia privo di brina e ben marcato. (F) Tenere il raccoglitore di campioni ad un angolo sopra la superficie. (G) Sollevare il raccoglitore e il tubo del campione dall'azoto liquido non appena il raccoglitore del campione si trova all'interno del tubo del microcentrifuga. (H) Agitare il raccoglitore di campioni se il rotore è catturato sul bordo. (I) Rimuovere il raccoglitore di campioni vuoto dalla sonda e posarlo a terra. (J) Rimuovere il tubo microcentrifuga dal raccoglitore di campioni con il rotore all'interno, inserire, stringere il raccoglitore di campioni nella sonda e premere "INSERT" sulla console di controllo. Fare clic qui per visualizzare una versione più grande di questa figura.
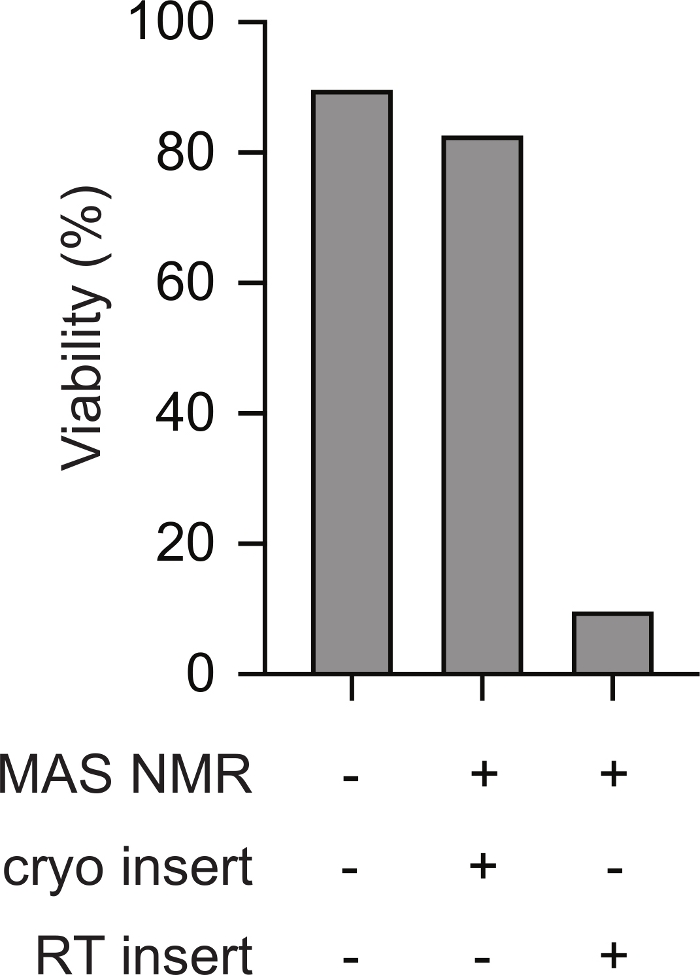
Figura 2: L'inserimento criogenico di un campione pre-congelato di cellule di mammifero si traduce in misurazioni dell'integrità cellulare simili a campioni di cellule di mammifero che non sono mai stati congelati. La percentuale di cellule impermeabili blu di tripano per campioni che non sono mai stati congelati (ad esempio il passaggio 2.1.3) è simile a quella delle cellule per i campioni dopo MAS NMR (ad esempio il passaggio 5.2.3 con MAS a 12 kHz). Le celle congelate lente (ad esempio la fase 3) che sono state riscaldate a temperatura ambiente prima dell'inserimento nello strumento NMR che era stato pre-raffreddato a 100 K avevano percentuali molto più basse di cellule intatte dopo MAS NMR con MAS 12 kHz MAS. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il trasferimento criogenico di campioni congelati in uno spettrometro NMR ha successo nel preservare la vitalità delle cellule di mammifero congelate attraverso l'acquisizione dei dati NMR. Il successo di questa metodologia è dimostrato nelle misurazioni di fattibilità NMR pre e post MAS. Questo approccio è efficace e generalizzabile a qualsiasi sistema in cui le fluttuazioni di temperatura possono compromettere l'integrità del campione. Il protocollo attualmente presentato viene eseguito con la linea cellulare HEK 293. Poiché le condizioni di crioconservazione per molte linee cellulari di mammiferi sono molto simili, è probabile che le condizioni qui riportate siano traducibili in altri sistemi cellulari; tuttavia, possono richiedere un'ulteriore ottimizzazione dei crioprotezionanti, dei volumi dei campioni e dei tassi di congelamento per ottenere gli stessi risultati.
Questa metodologia può essere migliorata disimballando il rotore più velocemente dopo l'esperimento NMR. Questo passaggio è attualmente sub ottimale e la sua esecuzione influisce sulla vitalità delle cellule. Prima che le celle possano essere riconsepense nel supporto, la punta dell'unità e la spina di silicio devono essere rimosse dal rotore. Il campione si scongela in modo non uniforme quando il rotore viene tenuto durante la rimozione della punta dell'azionamento e della spina di silicio, quindi tempi di gestione del rotore più brevi si traducono in maggiori viabilità. Lo sviluppo di supporti del rotore o altri strumenti per facilitare lo scongelamento uniforme e la rimozione rapida della punta dell'azionamento e della spina di silicio aiuterebbe a rendere più accurata la valutazione post-NMR della fattibilità.
L'approccio al carico criogenico del campione descritto in questo articolo è limitato alle sonde NMR che supportano l'inserimento e l'espulsione del campione con la sonda in posizione nel foro del magnete NMR. Mentre l'inserimento e l'espulsione di campioni esterni sono standard per i sistemi DNP commerciali, le sonde personalizzate non hanno sempre questa opzione. Inoltre, questo approccio al carico criogenico del campione può richiedere alcune modifiche per le sonde NMR costruite per essere compatibili con rotori di dimensioni diverse. Questo protocollo è stato ottimizzato per rotori da 3,2 mm e può richiedere modifiche se il diametro esterno del raccoglitore di campioni supera il diametro interno di un tubo di microcentrifuga (ad esempio, punto 3.4.2).
Con l'applicazione di DNP a MAS NMR, è ora possibile rilevare proteine e altre biomolecole a concentrazioni fisiologiche endogene24,25,26. Questo apre la possibilità di studiare biomolecole all'interno dei loro ambienti nativi. Il mantenimento dell'integrità e della vitalità cellulare durante l'esperimento è probabilmente fondamentale per collegare i risultati sperimentali della spettroscopia ai fenomeni biologici. Il congelamento incontrollato di campioni contenenti proteine purificate o lisati cellulari in genere non compromette la qualità del campione7,27,anche se ci sono alcune indicazioni che la velocità di congelamento può essere una variabile importante anche nei sistemi purificati28. Tuttavia, i campioni di cellule di mammifero devono essere congelati a velocità controllata se preservare l'integrità e la vitalità cellulare è importante per l'interpretazione. Qui presentiamo un protocollo per il congelamento e il trasferimento di campioni congelati di cellule di mammifero in uno strumento NMR DNP MAS pre-raffreddato che evita fluttuazioni di temperatura potenzialmente dannose e supporta la misurazione su cellule vitali.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da sovvenzioni del Cancer Research Prevention & Research Institute of Texas [RR150076], della National Science Foundation [1751174]; il National Institutes of Health [NS-111236], la Welch Foundation [1-1923-20170325]; la Lupe Murchison Foundation, la Ted Nash Long Life Foundation e la Kinship Foundation (Searle Scholars Program) a K.K.F.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue stain | Invitrogen | T10282 | |
| 100 mm cell culture dish | Thomas Scientific | 430167 | |
| 150 mm cell culture dish | Nunc | 157150 | |
| 3.2 mm sapphire rotor | Bruker | ||
| 45 ° angled forceps | Hampton Research | HR4-859 | |
| AMUPol | Cortecnet | C010P005 | |
| Black and Silver marker | Sharpie | ||
| Cap removal tool | Bruker | HZ16913 | |
| Cell culture grade water | HyClone | SH30529.03 | |
| Ceramic cap | Cortecnet | HZ12372 | |
| CoolCell | Corning/ Biocision | UX-04392-00 (Corning) / BCS-405 (Bioscion) | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10288 | |
| Countess II automated cell counter | Invitrogen | AMQAF1000 | |
| Cryogen tubes | Nalgene | 03-337-7Y | |
| d8-glycerol | Aldrich | 447498 | |
| Deuterium oxide, 99.8 % atom D | Aldrich | 756822-1 | |
| DMEM | Gibco | 10569-010 | |
| DNP NMR system with frequency-matched gyrotron | Bruker | ||
| Foam dewar | Spearlab | FD-800 | |
| Kimwipes | Kimwipes | ||
| Packing tool | Bruker | ||
| Pen-Strep | Gibco | 15140-122 | |
| Powdered PBS | VWR | VWRRV0780 | |
| Protonated PBS | Gibco | 10010-023 | |
| Silicon plug | Bruker | B7089 | |
| Standard Vessel forceps | |||
| Tryp-L | Gibco | 12605010 |
Riferimenti
- Costello, W. N., Xiao, Y., Frederick, K. K. DNP-Assisted NMR Investigation of Proteins at Endogenous Levels in Cellular Milieu. Methods Enzymology. 615 (1), 373-406 (2019).
- Hall, D. A., et al. Polarization-Enhanced NMR Spectroscopy of Biomolecules in Frozen Solution. Science. 276 (5314), 930-932 (1997).
- Akbey, &. #. 2. 2. 0. ;., Oschkinat, H. Structural biology applications of solid state MAS DNP NMR. Journal of Magnetic Resonance. 269 (1), 213-224 (2016).
- Matsuki, Y., et al. Helium-cooling and -spinning dynamic nuclear polarization for sensitivity-enhanced solid-state NMR at 14T and 30K. Journal of Magnetic Resonance. 225 (1), 1-9 (2012).
- Miyamoto, Y., Ikeuchi, M., Noguchi, H., Hayashi, S. Long-term Cryopreservation of Human and other Mammalian Cells at -80 °C for 8 Years. Cell Medicine. 10 (1), 1-7 (2018).
- Lopez del Amo, J. M., Schneider, D., Loquet, A., Lange, A., Reif, B. Cryogenic solid state NMR studies of fibrils of the Alzheimer's disease amyloid-β peptide: perspectives for DNP. Journal of Biomolecular NMR. 56 (4), 359-363 (2013).
- Gupta, R., et al. Dynamic nuclear polarization enhanced MAS NMR spectroscopy for structural analysis of HIV-1 protein assemblies. The Journal of Physical Chemistry B. 120 (2), 329-339 (2016).
- Lim, B. J., Ackermann, B. E., Debelouchina, G. T. Targetable Tetrazine-Based Dynamic Nuclear Polarization Agents for Biological Systems. ChemBioChem. 21 (9), 1315-1319 (2020).
- Jaudzems, K., et al. Dynamic nuclear polarization-enhanced biomolecular NMR spectroscopy at high magnetic field with fast magic-angle spinning. Angewandte Chemie International Edition. 57 (25), 7458-7462 (2018).
- Chaytor, J. L., et al. Inhibiting ice recrystallization and optimization of cell viability after cryopreservation. Glycobiology. 22 (1), 123-133 (2012).
- Mazur, P. Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing. The Journal of General Physiology. 47 (2), 347-369 (1963).
- Lovelock, J. E., Bishop, M. W. H. Prevention of Freezing Damage to Living Cells by Dimethyl Sulphoxide. Nature. 183 (4672), 1394-1395 (1959).
- Bald, W. B. The relative merits of various cooling methods. Journal of Microscopy. 140 (1), 17-40 (1985).
- Akiyama, Y., Shinose, M., Watanabe, H., Yamada, S., Kanda, Y. Cryoprotectant-free cryopreservation of mammalian cells by superflash freezing. Proceedings of the National Academy of Sciences. 116 (16), 7738-7743 (2019).
- Shi, M., et al. High-throughput non-contact vitrification of cell-laden droplets based on cell printing. Scientific Reports. 5 (1), 17928 (2015).
- Pegg, D. E. Principles of cryopreservation. Methods in Molecular Biology. 1257, 3-19 (2015).
- Ramilo, C., et al. Detection of the covalent intermediate of UDP-N-acetylglucosamine enolpyruvyl transferase by solution-state and time-resolved solid-state NMR spectroscopy. Biochemistry. 33 (50), 15071-15079 (1994).
- Jeon, J., Thurber, K. R., Ghirlando, R., Yau, W. M., Tycko, R. Application of millisecond time-resolved solid state NMR to the kinetics and mechanism of melittin self-assembly. Proceedings of the National Academy of Sciences. 116 (34), 16717 (2019).
- Pievo, R., et al. A rapid freeze-quench setup for multi-frequency EPR spectroscopy of enzymatic reactions. Chemphyschem. 14 (18), 4094-4101 (2013).
- Cherepanov, A. V., de Vries, S. Microsecond freeze-hyperquenching: development of a new ultrafast micro-mixing and sampling technology and application to enzyme catalysis. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1656 (1), 1-31 (2004).
- Hu, K. N., Tycko, R. What can solid state NMR contribute to our understanding of protein folding. Biophysical Chemistry. 151 (1), 10-21 (2010).
- Hu, K. N., Yau, W. M., Tycko, R. Detection of a transient intermediate in a rapid protein folding process by solid-state nuclear magnetic resonance. Journal of the American Chemical Society. 132 (1), 24-25 (2010).
- Johnson, S., Nguyen, V., Coder, D. Assessment of cell viability. Current Protocols in Cytometry. 64 (1), 1-26 (2013).
- Frederick, K. K., et al. Sensitivity-enhanced NMR reveals alterations in protein structure by cellular milieus. Cell. 163 (3), 620-628 (2015).
- Van Der Cruijsen, E. A. W., et al. Biomolecular DNP-supported NMR spectroscopy using Site-directed spin labeling. Chemistry. 21 (37), 12971-12977 (2015).
- Schlagnitweit, J., et al. Observing an antisense drug complex in intact human cells by in-cell NMR spectroscopy. ChemBioChem. 20 (19), 2474-2478 (2019).
- Debelouchina, G. T., et al. Dynamic nuclear polarization-enhanced solid-state NMR spectroscopy of GNNQQNY nanocrystals and amyloid fibrils. Physical Chemistry Chemical Physics : PCCP. 12 (22), 5911-5919 (2010).
- Schmidt, T., et al. Submillisecond freezing permits cryoprotectant-free EPR doubled electron-electron resonance spectroscopy. ChemPhysChem. 21, 1224-1229 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon