Method Article
細胞生存率を維持するマジックアングル回転核磁気共鳴分光計への低温サンプルローディング
要約
ここでは、核磁気共鳴(NMR)プローブを回転させる動的核分極(DNP)マジックアングル(DNP)に凍結したサンプルを極低温で伝達するためのプロトコルを紹介します。このプロトコルには、実験前のローター保管の方向と、実験前後の生存率測定の方向が含まれます。
要約
動的核分極(DNP)は、マジックアングルスピニング(MAS)核磁気共鳴(NMR)分光法の感度を劇的に高めることができます。これらの感度は温度が低下するにつれて増加し、ほとんどの商用DNP搭載NMR分光計の動作温度(約100K)で非常に低い濃度で分子の研究を可能にするのに十分な大きさです。これは、母国の環境で内因性レベルでの高分子の凍結保存細胞の細胞内構造生物学の可能性につながります。しかし、細胞凍結保存に必要な凍結率は、DNP MAS NMRの典型的なサンプル処理中に超え、細胞の完全性と生存率が失われる。本稿では、MAS NMR分光計への哺乳動物細胞の凍結サンプルの調製および極低温移動のための詳細なプロトコルについて説明する。
概要
核磁気共鳴分光法を紡ぐマジックアングルの動的核分極化の導入により、MAS NMRの感度を数桁高めることができます。これにより、生体分子の生理学的濃度またはその近くで生体分子の検出が可能になりました。DNPは、複雑な生物学的環境1において内在性(〜1μM)濃度で同位体標識タンパク質を検出するのに必要な感度を提供し、提供することができる。同位体標識分子を生存可能性に影響を与えずに非標識哺乳類細胞に導入するプロトコルが確立されているため、同位体に富んだ生体分子を母国の環境で内在性レベルで研究する可能性が開かれます。また、DNP増強は、より低い温度2、3、4でより効率的であるため、DNP MAS NMRの実験温度は、生存可能な哺乳動物細胞5の長期保存に必要なものときちんと一致する。しかし、サンプルをDNP MAS NMR分光計に移す従来の方法は、哺乳類細胞を破裂させる温度変動率に被験者を与える。
MAS NMR実験では、異方性相互作用の大きさをゼロ(通常は少なくとも4kHz、通常は6、7、8、9)に平均する周波数で、マジックアングルを中心に試料を回転させる必要があります。したがって、サンプルは、ガスの流れによってローターの回転を駆動するために使用されるフィン付き先端を有するローターに詰め込まれ、回転周波数をタコメータで監視できるようにもう一方の端にマークを付ける。ほとんどのMAS NMR機器のサンプル転送は、乾燥空気または窒素ガスの流れでNMRプローブの端にあるステータに器具の外側からロータを注入することによって達成されます。ロータが回転子を魔法の角度で保持するステータに到達すると、サンプルの回転は空気タービン機構によって推進される。ガスのサポートの別々の流れは、推進し、ローターの温度を制御する。ローターをNMR分光計に挿入し、安定したMAS回転を実現するには、細かく機械加工された駆動チップと、ガスの別々の流れの温度と圧力を厳しく制御する必要があります。これらの技術的な要求にもかかわらず、挿入および安定したMASを達成することは、主に室温の適用のための商業MAS NMRの調査のために自動化される。
しかし、低温用途では状況がより複雑になります。低温用途のサンプルは、通常、室温で分光計に挿入され、固定子で凍結されます。最初の1分間で、サンプル温度が急速に低下し (>-100 °C/min)、システム温度は平衡化するのに数分を必要とします。温度と圧力の相互作用のために、望ましいMASの挿入および接近は、多くの場合、低温用途のために手動で処理される。手動介入の要件にもかかわらず、装置の中のローターを凍結することは、水の導入とプローブへの凝縮を最小限に抑え、回転を成功させるために重要であるため、有益です。周囲の水分ブロックガスラインからの凝縮や氷の蓄積だけでなく、ローター自体の凝縮、または霜は機械的にMASを防ぐことができます。したがって、低温MAS NMRのサンプルは、通常、-100 °C/minを超える速度で器具の内部で凍結されます。
哺乳類細胞は、冷却が遅い5、10、11、12の速度で1°C/min以上の速度で凍結融解サイクルを経て完全性を保持することができます。また、冷却速度が超高速13、14、15の場合、セルは104°C/minよりも速い速度で整合性を保ちます。これら2つの極端に中間的な率は、細胞の内側と外側の両方の氷の結晶形成による哺乳類細胞を破裂して殺す、凍結保護剤16の存在下でも。事前冷却されたプローブ内の室温ローターの冷却速度は、これら2つの極端な間に落ち、したがって極低温保存された無傷の生き哺乳類細胞を研究するために、サンプルを器具に移す前に凍結し、ローターのサンプルまたはローターの霜の蓄積を損なう可能性のある温度変動なしに器具に移す必要があります。プロトコルは、極低温保存無傷の生き生き哺乳類細胞サンプルの研究のための極低温MAS NMRシステムへの霜のない、予冷ローター挿入のための方法を記述する。ここで説明した極低温サンプル転写は、生存可能な無傷細胞のNMR特性評価のために開発された。ただし、温度変動がサンプルの完全性を損なう可能性があるシステムには適用可能です。これには、閉じ込められた反応中間体17、18、酵素学19、20、またはタンパク質フォールディング21、22の化学的および構造的特徴付けに対する凍結クエンチ反応のようなあらゆる様々な複雑な系が含まれる。
プロトコル
哺乳類細胞の培養と凍結保護
- 哺乳類細胞の培養と収穫
- 凍結されたヒト胚性腎臓細胞のアリコートを解凍する(HEK 293)。
- 培養HEK 293細胞は、成長培地中で(例えば、10%のウシ血清と1%のペンストレップを有するDMEM)37°Cで、100mmプレートで5%CO2を2〜3回(7〜10日間)で培養した。
- 細胞と培養物を150mmのプレートに分割し、90~95%の合流まで培養します。
注:>90%の合流度で150 mmの版は3.2 mmの直径の2つのサファイアローターを満たすのに十分である。 - 4 mLのトリプシン(材料表を参照)と10 mLの培地を使用して細胞を収穫します。懸濁液を673 x g(1000 rpm)で無菌15 mL円錐形および遠心分離機に室温で5分間移動します。上清を取り除く。
- リン酸緩衝生理食塩水(PBS)で細胞ペレットを洗浄します(pH 7.4、 -CaCl2、- MgCl2)。
- 細胞の凍結保護
- マイクロ遠心チューブに50μLの細胞ペレットを取り付けます。PBS 50 μL とグリセロール 18 μL の混合物を別のチューブに用意します。
- グリセロール-PBS混合物をペレットの上部に加え、塊が残らなくなるまでチューブの側面を軽くタップしてペレットを再懸濁させることで、グリセロール-PBS混合物の68 μLと50 μLの細胞ペレットを穏やかに混合します。
注:穏やかなピペットは、細胞を再中断するために使用することができますが、細胞の完全性が損なわれないようにしてください。
2. NMRローターにおける哺乳類細胞の凍結保存
- セルを3.2 mmサファイアローターに移す。
- 漏斗を作るために、200 μLピペットの先端を切り、切ったピペットの先端の狭い端を3.2 mmローターに挿入します。
- ローターに座っている漏斗に細胞を移す。マイクロ遠心チューブにじょうごと一緒にローターを置き、セルをローターの底にペレットに入れ、673 x g で室温で2〜3分間遠心します。
- 上清と余分なサンプルをローターから取り除きます。ローターがセルを完全に詰め込むまで、この2つの手順を繰り返します。
注: 必要に応じて、凍結する前にサンプルの細胞の生存率を決定します。FBSフリーDMEMの100 μLに過剰な細胞ペレットの10 μLを再懸濁します。懸濁液の10 μLを0.4%のトリパンブルー溶液と混合し、自動化されたセルカウンターを使用してすぐに生存率を評価します。細胞を希釈するには、FBSフリーの培地のみを使用して、細胞を希釈し、トリパンブルー染色を妨げます。 - 市販の梱包ツールを使用して、シリコンプラグでローターを密封します。
- ローターを垂直に下に押して、セラミックドライブチップで閉じます。ドライブ先端の側面にある繊細なフィンに触れないようにしてください。
- 銀の永久マーカーを持つサファイアローターの下端の半分をマークし、分光計の内側のロータの回転を正確に監視できるように、ロータの下端の残りの半分を黒の永久マーカーでマークします。
注:ロータのマーキングに欠陥がある場合、回転周波数の正確なカウントが防止され、安定した回転を実現できません。マーカーは凍結ローターに書き込まず、ローターの温暖化はサンプルの完全性を損なうので、凍結前にローターをマーキングすることは重要なステップです。
- 3.2mmサファイアローター内の細胞の凍結保存。
- ティッシュまたはペーパータオルで作られたクッションを蓋の下と極低温バイアルの底に置いてください( 材料表を参照)。
メモ:ティッシュペーパーは、ロータマーキングを極低温バイアルの側面にぶつかった場合の損傷から保護します。 - 3.2 mm サファイアローターを、極低温バイアルの底面に目印の端が付いたティッシュペーパーで埋め込まれた極低温バイアルに入れます。
- 低温バイアルを制御速度(-1 °C/min)冷却容器に入れ、最低3時間で-80°Cの冷凍庫に入れ、ローターをゆっくり凍結します。
- 凍結ローターを含む極低温バイアルを液体窒素貯蔵に移します。
- ティッシュまたはペーパータオルで作られたクッションを蓋の下と極低温バイアルの底に置いてください( 材料表を参照)。
3. NMR分光計への凍結試料の低温転写
- 凍結したサンプルをNMR施設に輸送します。
- 凍結ローターを含む極低温バイアルを、液体窒素を充填した小さなデュワーに移し、NMR施設に輸送します。
- 液体窒素浴場への凍結ローターの移動。
- 乾燥した、熱断熱された広口泡のデュワーを500 mL – 1 Lの液体窒素で満たします。
- ローターを極低温バイアルから液体窒素で満たされた広口泡デュワーに移します。
- 手に移り変えるデュワーから極低温バイアルを取り、液体窒素の表面のすぐ上に保持して大気から保護します。
- 口を少し下向きにして極低温バイアルを保持しながら、キャップを緩め、ローターを液体窒素浴中にスライドさせます。
注:キャップが緩めなくなると、ロータはロータに結露が集まらないように、極低温バイアルから液体窒素浴に素早く(1秒以下)落下する必要があります。液体窒素の蒸発は、広口発泡のデュワーに「窒素雲」を形成し、液体窒素に沈める前にローター上の結露を防ぎます。ローターを空気に長時間曝すと、ローターの壁に水分が凝縮し、氷に再凝縮する可能性があります。
- ローターをNMRサンプルキャッチャーに極低温で移動。
- 液体窒素浴中に1.5mLマイクロ遠心分離チューブを浸してプレチルします。チューブを閉じないでください。
メモ:マイクロ遠心チューブに移す前にローターを点検してください。ピンセットを使用して、ローターを液体窒素の表面のすぐ下に保持し、ローターのマーキングがそのままであり、壁に氷の堆積物が形成されていないこと、およびドライブ先端がそのままであることを確認します。ローター壁の氷の結晶堆積物は白い粉として現れます。ローターは、ドライブチップではなく、常にボディで保持するように注意してください。トゥイザーチップでローターのマーキングを引っ掻かないでください。 - 液体窒素浴の表面の下で、ピンセットを使用して、マイクロ遠心チューブの底に面したドライブチップとチューブの開口部に面したマーキングで、ローターをマイクロ遠心チューブに移します。
注:液体窒素に浸かるか、ローターに触れる前に、必ずピンセットを乾燥してください。 - ピンセットを使用して、ローターを含むチューブを液体窒素の下に首で保持します。
- 2つ目のピンセットを手にして、NMRサンプルキャッチャーを液体窒素浴中に沈め、マイクロ遠心チューブに対して鋭角に傾斜するように保持する準備をしてください。
メモ:Oリングの凍結を避けるために、サンプルキャッチャーが液体窒素と接触する時間を最小限に抑えます。Oリングがフリーズすると、捕手を分光器に挿入することは非常に困難になります。
- 液体窒素浴中に1.5mLマイクロ遠心分離チューブを浸してプレチルします。チューブを閉じないでください。
- NMRサンプルキャッチャーからNMR分光器への極低温ローター転写
注:このステップでは、クライオキャビネットを操作し、1人が液体窒素からプローブにサンプルを移す2人が必要です。- キャビネットの「EJECT」を押して、凍結キャビネットをイジェクションモードにします。
注:吐出モードは大気の湿気の入り口を防ぐために、プローブから大気への高圧で乾燥した窒素ガスの流れをパージします。 - ローターをNMRサンプルキャッチャーに移します。
- 液体窒素の表面の下にNMRサンプルキャッチャーの開いた端をマイクロ遠心分離管に挿入します。
- マイクロ遠心チューブとNMRサンプルキャッチャーの両方を持ち上げて、ローターがサンプルキャッチャーに落ちるようにします。ローターがサンプルキャッチャーの縁に刺さった場合に備えて、NMRサンプルキャッチャーとマイクロ遠心チューブを振ります。
- 空のマイクロ遠心チューブをNMRサンプルキャッチャーの上に置いて、ローターを空気から保護します。
- 他の空のNMRサンプルキャッチャーをプローブから取り出し、床に置きます。
- ローターを含むNMRサンプルキャッチャーをフリーハンドに移し、マイクロ遠心チューブを取り外し、すぐにプローブに挿入します。
メモ:Oリングがフリーズすると、サンプルキャッチャーを締めるのが難しくなります。それが所定の位置にスライドするまで力を適用し続けます。 - クライオキャビネットを操作している人に「EJECTを停止」と「INSERT」と合図します。
メモ:挿入モードは、ロータをサンプルキャッチャーからプローブに導きます。 - クライオキャビネットで制御される軸受と駆動流圧を調整して、目的の回転速度(例えば12kHz)までサンプルを回転させます。(例えば、軸受ガスを~200mBarに直ちに増やし、駆動ガスを10mBarに増やします。サンプルが回転したら、ベアリングガスを1000 mBarに上げ、ガスを200 mBarに駆動します。回転が安定すると、ベアリングを2400 mBarに増やし、数分間で駆動ガスを200 mBarから1700 mBarに増やします。VT冷却ガスは、約1070 L/hで一定です。
注:マイクロ遠心チューブとNMRサンプルキャッチャーを液体窒素バスから持ち上げる場合は、マイクロ遠心チューブの中にローターを取り囲むのに十分な液体窒素があることを確認してください。ローターをNMRサンプルキャッチャーに移してから、NMRサンプルキャッチャーを分光器に挿入する時間を最小限に抑えます。3.4のすべての手順は30 s以内で完了する必要があります。
- キャビネットの「EJECT」を押して、凍結キャビネットをイジェクションモードにします。
4. NMR分光器からの試料の極低温除去
- 液体窒素浴と極低温バイアルの調製
- 広い口の泡のデュワーに液体窒素の500 mL - 1 Lを注ぎ、分光器の下にバスを置きます。
- 極低温バイアルを事前に冷却します。液体窒素浴中にティッシュペーパーを含む空の極低温バイアルを水没させる。
- ローターのプローブから低温バイアルへの極低温移動
- 駆動ガスとベアリングガスの流れを下げて回転速度を0 kHzに下げ、射出モードに切り替えてロータを排出します。
- 放出モードをオンにしたまま、サンプルキャッチャーをプローブから取り出し、ローターを液体窒素を含む広口泡デュワーに直接ドロップします。
- 事前に冷やしたピンセットを使用して、ローターを液体窒素の表面の下で冷やされた極低温バイアルに移します。
- 極低温バイアルをキャップします。極低温バイアルキャップを液体窒素に浸してプレチルします。ローターと液体窒素を含む極低温バイアルを浴槽から取り出し、チューブにプレチルキャップをキャップします。気化窒素を安全に放出できるようにキャップを締めないでください。
- 極低温バイアルを液体窒素に再び浸す。サンプルは、より長期間の液体窒素貯蔵に移されるか、または更なる分析のためにすぐに開梱することができる。
5. ロータと生存率の測定を開梱する
- ローターの開梱と実行可能性の測定
- プレウォーム血清フリー培地(DMEM)またはPBS〜37°C。
- 液体窒素からローターを取り除きます。ドライブチップとシリコンプラグを取り外します。
注:サファイアは優れた熱伝導体です。熱伝達は細胞の生存率を損なう局所的な凍結融解イベントを引き起こす可能性があるため、指でローターに触れないようにしてください。
- 生存率の測定
- ローターの凍結した細胞ペレットに20μLの温かい培地を加え、細胞を再懸濁させます。ピペットでサスペンションを取り外し、100 μLのメディアで撹拌します。
- 10 μLのセル懸濁液を取り除き、0.4%のトリパンブルー溶液(v/v)の等体積で混ぜます。室温で30~1分間インキュベートします。
- 自動化されたセルカウンターを使用して生存率を測定します。
結果
NMR分光計への哺乳類細胞の凍結前サンプルの低温挿入は、NMR実験全体で生存率をサポートします。凍結した試料を事前冷却されたNMRプローブに極低温移動する回路図を 図1に示す。細胞の生存率および無傷性は、種々の方法を用いて評価することができる。ここでは、膜完全性の標準的な染料ベースの尺度を使用しました, これは、他の方法とよく一致します23.無傷の細胞は、損傷した膜の完全性を有する細胞が透過性である間、青色を試してみるために不透過性である。トリパンブルー透過性および不透過性細胞の数は、自動化されたセルカウンターを使用して迅速に評価することができます。ここで説明するプロトコルを用いて、MAS NMR後の哺乳類細胞のトリパンブルー透過性(すなわち、点5.2.3)は、温度変化前の哺乳動物細胞のトリパンブルー透過性(すなわち、ポイント2.1.3)と類似している。しかし、細胞がゆっくり凍結した場合、挿入前に室温まで温める(すなわち、チルドプローブに挿入する前にロータを室温に温める前に3をポイントするプロトコルに従う)、トリパンブルーで評価した細胞生存率は細胞の10%未満に低下する(図2)。したがって、分光計内の細胞を凍結すると細胞膜の完全性が失われ、哺乳動物細胞の凍結サンプルの極低温挿入はNMR実験全体で細胞の生存率をサポートする。

図1:凍結した試料を事前冷却したNMRプローブに極低温移動する模式図。(A)液体窒素の表面に近づき、極低温バイアルの上部を緩めます。(B)ローターを液体窒素浴中にスライドさせます。(C)ピンセットを使用してマイクロ遠心チューブを水没させ、完全に冷却するまで所定の位置に保持します。(D) マイクロ遠心部にローターを挿入し、ドライブ先端をチューブの底面に向けます。ピンセットでつかむのではなく、押します。(E)マイクロ遠心チューブを液体窒素浴の表面のすぐ下に持ち、ローターを目視で点検して、霜がないことを確認し、十分にマークを付けます。(F)サンプルキャッチャーをサーフェスの上の角度で保持します。(G)サンプルキャッチャーとチューブを液体窒素から持ち上げ、サンプルキャッチャーがマイクロ遠心チューブの中に入ったらすぐに持ち上げます。(H)ローターがリムに引っかかった場合は、サンプルキャッチャーを振ります。(I) 空のサンプルキャッチャーをプローブから取り出し、地面に置きます。(J)サンプルキャッチャーからマイクロ遠心チューブをローターの内側に取り出し、挿入してプローブのサンプルキャッチャーを締め、コントロールコンソールで「INSERT」を押します。この図の大きなバージョンを表示するには、ここをクリックしてください。
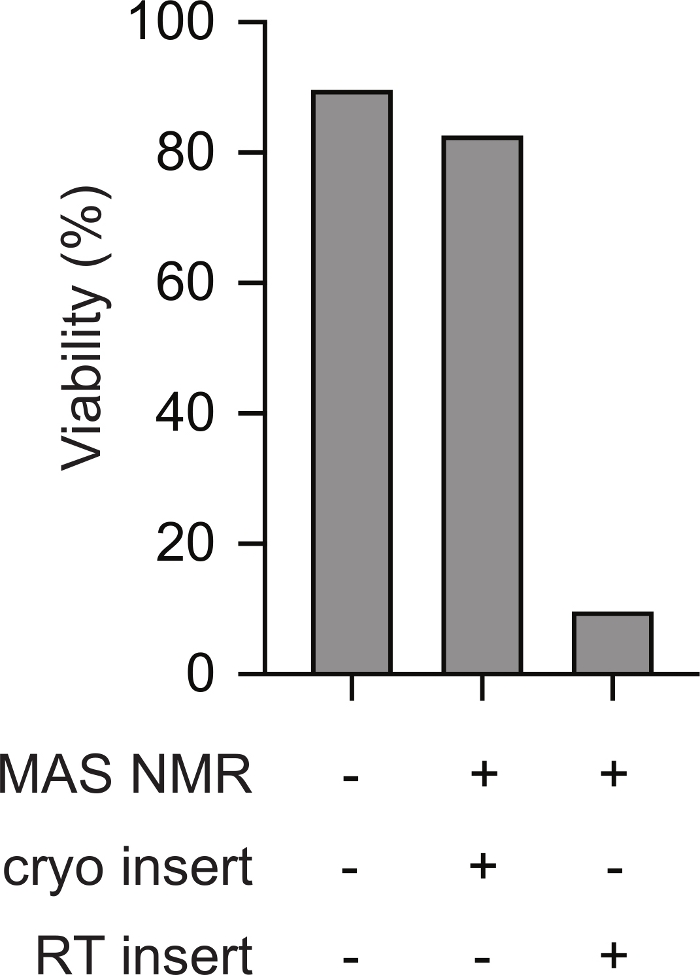
図2:哺乳動物細胞の凍結前のサンプルを極低温挿入すると、凍結したことがない哺乳類細胞サンプルに類似した細胞無傷の測定が行われる。凍結されたことがないサンプルのトリパンブルー不透過性細胞の割合(例えばステップ2.1.3)は、MAS NMR後のサンプルの細胞の割合と似ています(例えば、ステップ5.2.3 12 kHz MAS)。100Kに予冷したNMR器具に挿入する前に室温まで温めた遅い凍結細胞(例えばステップ3)は、12kHz MASでMAS NMRの後に無傷の細胞の割合がはるかに低かった。 この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
NMR分光器への凍結サンプルの極低温移動は、NMRデータ取得を通じて凍結された哺乳動物細胞の生存率を維持することに成功した。この方法論の成功は、MAS NMRの生存率測定の前と後で実証されています。このアプローチは、温度変動がサンプルの完全性を損なう可能性があるあらゆるシステムに対して成功し、一般化できます。現在提示されているプロトコルはHEK 293細胞株で行われる。多くの哺乳類細胞株の凍結保存条件は非常に類似しているため、ここで報告された条件は他の細胞系に翻訳可能である可能性が高い。しかし、同じ結果を得るためには、凍結保護剤、サンプル量、および凍結率をさらに最適化する必要があります。
この方法論は、ローターをNMR後の実験より速く開梱することによって改善することができる。このステップは現在最適ではなく、その実行は細胞の生存率に影響を与えます。セルをメディアに再懸濁させる前に、ドライブチップとシリコンプラグをローターから取り外す必要があります。ローターがドライブチップの取り外し中に保持されると、ロータが不均一に解凍され、シリコンプラグのロータ処理時間が短くなるほど、高い生存率が得られます。ローターホルダーやその他のツールを開発することで、均一な解凍やドライブチップとシリコンプラグの迅速な取り外しを容易に行い、NMR後の生存率評価をより正確に行うことができます。
この記事で説明した極低温サンプルローディングのアプローチは、NMR磁石のボア内のプローブでサンプルの挿入と放出をサポートするNMRプローブに限定されています。外部サンプルの挿入と取り出しは商用の DNP システムでは標準ですが、カスタムプローブには必ずしもこのオプションが用意されているわけではありません。また、この極低温サンプルローディングのアプローチでは、異なるサイズのローターと互換性を持つNMRプローブに何らかの変更が必要になることがあります。このプロトコルは3.2 mmローター用に最適化されており、サンプルキャッチャーの外径がマイクロ遠心チューブの内径を超える場合(例えば、ステップ3.4.2)の修正が必要な場合があります。
MAS NMRへのDNPの適用により、内因性生理学的濃度24、25、26でタンパク質および他の生体分子を検出することが可能になった。これは、彼らのネイティブ環境内で生体分子を研究する可能性を開きます.実験全体を通して細胞の完全性と生存性の維持は、分光法の実験結果を生物現象に結びつける上で重要である可能性が高い。精製されたタンパク質または細胞ライセートを含むサンプルの非制御凍結は、通常、サンプル品質7,27を損なわないが、凍結速度が精製系28においても重要な可変となる可能性があるといういくつかの徴候がある。しかし、細胞の無傷性や生存率を維持することが解釈にとって重要である場合、哺乳類細胞のサンプルは制御された速度で凍結する必要があります。ここでは、哺乳類細胞の凍結サンプルを凍結し、予め冷却されたDNP MAS NMR機器に移し、潜在的に有害な温度変動を回避し、生存細胞の測定をサポートするプロトコルを提示します。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、テキサス州癌研究予防研究所[RR150076]、国立科学財団[1751174]からの助成金によって支えられました。国立衛生研究所[NS-111236]、ウェルチ財団[1-1923-20170325];ルペ・マーチソン財団、テッド・ナッシュ・ロングライフ財団、親族財団(サール・スカラーズ・プログラム)をK.K.F.
資料
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue stain | Invitrogen | T10282 | |
| 100 mm cell culture dish | Thomas Scientific | 430167 | |
| 150 mm cell culture dish | Nunc | 157150 | |
| 3.2 mm sapphire rotor | Bruker | ||
| 45 ° angled forceps | Hampton Research | HR4-859 | |
| AMUPol | Cortecnet | C010P005 | |
| Black and Silver marker | Sharpie | ||
| Cap removal tool | Bruker | HZ16913 | |
| Cell culture grade water | HyClone | SH30529.03 | |
| Ceramic cap | Cortecnet | HZ12372 | |
| CoolCell | Corning/ Biocision | UX-04392-00 (Corning) / BCS-405 (Bioscion) | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10288 | |
| Countess II automated cell counter | Invitrogen | AMQAF1000 | |
| Cryogen tubes | Nalgene | 03-337-7Y | |
| d8-glycerol | Aldrich | 447498 | |
| Deuterium oxide, 99.8 % atom D | Aldrich | 756822-1 | |
| DMEM | Gibco | 10569-010 | |
| DNP NMR system with frequency-matched gyrotron | Bruker | ||
| Foam dewar | Spearlab | FD-800 | |
| Kimwipes | Kimwipes | ||
| Packing tool | Bruker | ||
| Pen-Strep | Gibco | 15140-122 | |
| Powdered PBS | VWR | VWRRV0780 | |
| Protonated PBS | Gibco | 10010-023 | |
| Silicon plug | Bruker | B7089 | |
| Standard Vessel forceps | |||
| Tryp-L | Gibco | 12605010 |
参考文献
- Costello, W. N., Xiao, Y., Frederick, K. K. DNP-Assisted NMR Investigation of Proteins at Endogenous Levels in Cellular Milieu. Methods Enzymology. 615 (1), 373-406 (2019).
- Hall, D. A., et al. Polarization-Enhanced NMR Spectroscopy of Biomolecules in Frozen Solution. Science. 276 (5314), 930-932 (1997).
- Akbey, Ü, Oschkinat, H. Structural biology applications of solid state MAS DNP NMR. Journal of Magnetic Resonance. 269 (1), 213-224 (2016).
- Matsuki, Y., et al. Helium-cooling and -spinning dynamic nuclear polarization for sensitivity-enhanced solid-state NMR at 14T and 30K. Journal of Magnetic Resonance. 225 (1), 1-9 (2012).
- Miyamoto, Y., Ikeuchi, M., Noguchi, H., Hayashi, S. Long-term Cryopreservation of Human and other Mammalian Cells at -80 °C for 8 Years. Cell Medicine. 10 (1), 1-7 (2018).
- Lopez del Amo, J. M., Schneider, D., Loquet, A., Lange, A., Reif, B. Cryogenic solid state NMR studies of fibrils of the Alzheimer's disease amyloid-β peptide: perspectives for DNP. Journal of Biomolecular NMR. 56 (4), 359-363 (2013).
- Gupta, R., et al. Dynamic nuclear polarization enhanced MAS NMR spectroscopy for structural analysis of HIV-1 protein assemblies. The Journal of Physical Chemistry B. 120 (2), 329-339 (2016).
- Lim, B. J., Ackermann, B. E., Debelouchina, G. T. Targetable Tetrazine-Based Dynamic Nuclear Polarization Agents for Biological Systems. ChemBioChem. 21 (9), 1315-1319 (2020).
- Jaudzems, K., et al. Dynamic nuclear polarization-enhanced biomolecular NMR spectroscopy at high magnetic field with fast magic-angle spinning. Angewandte Chemie International Edition. 57 (25), 7458-7462 (2018).
- Chaytor, J. L., et al. Inhibiting ice recrystallization and optimization of cell viability after cryopreservation. Glycobiology. 22 (1), 123-133 (2012).
- Mazur, P. Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing. The Journal of General Physiology. 47 (2), 347-369 (1963).
- Lovelock, J. E., Bishop, M. W. H. Prevention of Freezing Damage to Living Cells by Dimethyl Sulphoxide. Nature. 183 (4672), 1394-1395 (1959).
- Bald, W. B. The relative merits of various cooling methods. Journal of Microscopy. 140 (1), 17-40 (1985).
- Akiyama, Y., Shinose, M., Watanabe, H., Yamada, S., Kanda, Y. Cryoprotectant-free cryopreservation of mammalian cells by superflash freezing. Proceedings of the National Academy of Sciences. 116 (16), 7738-7743 (2019).
- Shi, M., et al. High-throughput non-contact vitrification of cell-laden droplets based on cell printing. Scientific Reports. 5 (1), 17928(2015).
- Pegg, D. E. Principles of cryopreservation. Methods in Molecular Biology. 1257, 3-19 (2015).
- Ramilo, C., et al. Detection of the covalent intermediate of UDP-N-acetylglucosamine enolpyruvyl transferase by solution-state and time-resolved solid-state NMR spectroscopy. Biochemistry. 33 (50), 15071-15079 (1994).
- Jeon, J., Thurber, K. R., Ghirlando, R., Yau, W. M., Tycko, R. Application of millisecond time-resolved solid state NMR to the kinetics and mechanism of melittin self-assembly. Proceedings of the National Academy of Sciences. 116 (34), 16717(2019).
- Pievo, R., et al. A rapid freeze-quench setup for multi-frequency EPR spectroscopy of enzymatic reactions. Chemphyschem. 14 (18), 4094-4101 (2013).
- Cherepanov, A. V., de Vries, S. Microsecond freeze-hyperquenching: development of a new ultrafast micro-mixing and sampling technology and application to enzyme catalysis. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1656 (1), 1-31 (2004).
- Hu, K. N., Tycko, R. What can solid state NMR contribute to our understanding of protein folding. Biophysical Chemistry. 151 (1), 10-21 (2010).
- Hu, K. N., Yau, W. M., Tycko, R. Detection of a transient intermediate in a rapid protein folding process by solid-state nuclear magnetic resonance. Journal of the American Chemical Society. 132 (1), 24-25 (2010).
- Johnson, S., Nguyen, V., Coder, D. Assessment of cell viability. Current Protocols in Cytometry. 64 (1), 1-26 (2013).
- Frederick, K. K., et al. Sensitivity-enhanced NMR reveals alterations in protein structure by cellular milieus. Cell. 163 (3), 620-628 (2015).
- Van Der Cruijsen, E. A. W., et al. Biomolecular DNP-supported NMR spectroscopy using Site-directed spin labeling. Chemistry. 21 (37), 12971-12977 (2015).
- Schlagnitweit, J., et al. Observing an antisense drug complex in intact human cells by in-cell NMR spectroscopy. ChemBioChem. 20 (19), 2474-2478 (2019).
- Debelouchina, G. T., et al. Dynamic nuclear polarization-enhanced solid-state NMR spectroscopy of GNNQQNY nanocrystals and amyloid fibrils. Physical Chemistry Chemical Physics : PCCP. 12 (22), 5911-5919 (2010).
- Schmidt, T., et al. Submillisecond freezing permits cryoprotectant-free EPR doubled electron-electron resonance spectroscopy. ChemPhysChem. 21, 1224-1229 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved