Method Article
셀룰러 생존력을 보존하는 마법의 각도 회전 핵 자기 공명 분광기에 극저온 샘플 로딩
요약
여기에 제시된 것은 동결된 시료를 동적 핵 편광(DNP) 매직 앵글 방적(MAS) 핵자기 공명(NMR) 프로브로 전송하기 위한 프로토콜이다. 이 프로토콜에는 실험 전의 로터 저장 방향과 실험 전후의 생존 가능성 측정을 위한 방향이 포함됩니다.
초록
동적 핵 편광(DNP)은 MAS(핵자기 공명)의 감도를 크게 증가시킬 수 있다. 이러한 감도 상승 온도 감소 하 고 대부분의 상용 DNP 장착 NMR 분광기의 작동 온도 (~100 K)에서 매우 낮은 농도에서 분자의 연구를 가능하게 할 만큼 충분히 큽니다. 이것은 그들의 네이티브 환경에 있는 그들의 내인성 수준에 있는 거대 분자를 위한 냉동 보존된 세포에 세포 내 구조 생물학의 가능성으로 이끌어 냅니다. 그러나, 세포 극저온 보존에 필요한 동결 율은 DNP MAS NMR에 대한 일반적인 샘플 처리 중에 초과되며 이로 인해 세포 무결성 및 생존능력이 저하됩니다. 이 문서에서는 포유류 세포의 냉동 시료를 MAS NMR 분광계로 준비 및 극저온 전달을 위한 상세한 프로토콜을 설명합니다.
서문
핵 자기 공명 분광기를 회전하는 매직 앵글을 위한 동적 핵 편광의 도입은 MAS NMR의 민감도를 여러 수 주까지 증가시킬 수 있다. 이것은 그들의 생리적인 사격량에 또는 그 근처에 생체 분자의 검출을 가능하게 했습니다. DNP는 복잡한 생물학적 환경에서 내인성(~1 μM) 농도에서 동위원소 표지단백질을 검출하는 데 필요한 감도를 제공할 수 있고1. 그들의 생존가능성에 영향을 미치지 않고 표기되지 않는 포유류 세포로 동위원소 표지된 분자를 소개하는 잘 확립된 프로토콜이 있기 때문에, 이것은 그들의 토착 환경에 있는 그들의 내인성 수준에서 동위원소 풍부한 생체 분자를 공부의 가능성을 열어줍니다. 더욱이, DNP 개선은 낮은 온도2,3,4에서더 효율적이기 때문에, DNP MAS NMR에 대한 실험 온도는 실행 가능한 포유류 세포의 장기 저장에 필요한 것과 깔끔하게정렬5. 그러나, 기존의 방법은 샘플을 DNP MAS NMR 분광계 피험자로 이송하여 포유류 세포를 파열시키는 온도 변동률로 이시가지한다.
MAS NMR 실험은 시료가 이상 4kHz, 그리고 종종 훨씬 더 높은6,7,8,9에평균될 수 있도록 애니소트로피 상호작용의 크기와 같거나 큰 주파수에서 마술 각도에 대해 회전할 것을요구한다. 따라서 샘플은 가스 스트림에 의해 로터회전을 구동하고 타코스터에 의해 회전 주파수를 모니터링할 수 있도록 다른 쪽 끝에 마크가 있는 핀 팁이 있는 로터에 포장됩니다. 대부분의 MAS NMR 기기에 대한 샘플 전송은 건조 공기 또는 질소 가스의 스트림과 NMR 프로브의 끝에 있는 stator에 악기의 외부에서 로터를 주입하여 달성된다. 로터가 회전기를 마술 각도로 고정하는 스테이터에 도달하면 공기 터빈 메커니즘에 의해 샘플 회전이 추진됩니다. 가스 지지체의 별도의 스트림, 추진 및 로터의 온도를 제어할 수 있습니다. NMR 분광계에 로터를 삽입하고 안정적인 MAS 회전을 달성하려면 미세하게 가공된 드라이브 팁과 별도의 가스 스트림의 온도 및 압력을 엄격하게 제어해야 합니다. 이러한 기술적 요구에도 불구하고, 안정적인 MAS를 삽입하고 달성하는 것은 주로 실온 애플리케이션을 위한 상용 MAS NMR 프로브에 자동화됩니다.
그러나 저온 응용 분야에서는 상황이 더 복잡합니다. 저온 어플리케이션을 위한 샘플은 일반적으로 실온에서 분광계에 삽입되고 스테이터에서 동결됩니다. 첫 번째 분에서, 샘플 온도는 빠르게 감소 (> -100 ° C / 분) 시스템 온도는 평형하는 데 몇 분이 필요합니다. 온도와 압력의 상호 작용으로 인해 원하는 MAS의 삽입 및 접근은 종종 저온 응용 제품에 대해 수동으로 처리됩니다. 수동 개입의 요구에도 불구하고, 장비 내부의 로터를 동결하는 것은 성공적인 회전에 중요한 프로브에 물과 응축의 도입을 최소화하기 때문에 유용합니다. 주변 수분 블록 가스 라인, 응축 또는 로터 자체의 서리로 인한 응축 및 얼음 축적은 기계적으로 MAS를 방지할 수 있습니다. 따라서, 저온 MAS NMR에 대한 샘플은 일반적으로 -100 °C /min을 초과하는 속도로 기기 내부로 동결된다.
포유류 세포는 냉각이 느린 경우 동결 해동 주기를통해 무결성을 유지할 수 있습니다5,10,11,12,1 °C/ 분보다 동일하거나 느린 속도로. 또는 셀은 냉각 속도가 10 4°C/min보다 빠른 속도로 초고속13,14,15인경우 무결성을 유지합니다. 이 두 극단에 중간 속도 파열 및 극저온 보호 제(16)의존재에도, 세포 내부와 외부 모두 얼음 결정 형성으로 인해 포유류 세포를 죽일. 미리 냉각된 프로브 내부의 실온 로터에 대한 샘플 냉각 속도는 이 두 극단 사이에 떨어지므로 극저온보존 가능한 포유류 세포를 연구하기 위해서는, 시료를 계측기로 옮기기 전에 동결되어야 하며, 로터의 시료 나 서리 축적을 손상시킬 수 있는 온도 변동 없이 계측기로 옮겨야 한다. 이 프로토콜은 극저온 보존 된 생존 가능한 포유류 세포 샘플의 연구를 위한 극저온 MAS NMR 시스템에 서리가 없는 사전 냉각 로터 삽입방법을 설명합니다. 여기에 설명된 극저온 샘플 전송은 실행 가능한 그대로 세포의 NMR 특성화를 위해 개발되었다. 그러나 온도 변동이 샘플 무결성을 손상시킬 수 있는 모든 시스템에 적용됩니다. 여기에는 갇힌 반응 중급제의 화학적 및 구조적 특성화를 위한 동결 담금질 반응과 같은 모든 복합 시스템이포함되며,17,18,효소학19,20 또는 단백질 접이식21,22.
프로토콜
1. 포유류 세포의 배양 및 극저온 보호
- 포유류 세포의 배양 및 수확
- 동결 된 인간 배아 신장 세포의 알리쿼트 (HEK 293)를 해동.
- 성장 매체에서 HEK 293 세포(예를 들어, DMEM, 10% 태아 소 혈청 및 1% 펜-스트렙)에서 37°C에서 5%CO2에서 100mm 플레이트에서 2~3개의 통로(7-10일).
- 세포가 90-95%의 합류에 도달할 때까지 세포와 배양을 150mm 플레이트로 분할합니다.
참고: > 90%의 150mm 플레이트는 직경 3.2mm의 사파이어 로터 2개를 채우기에 충분합니다. - 트립신 4mL(재료표 참조) 및 10mL의 미디어를 사용하여 셀을 수확합니다. 서스펜션을 실온에서 5분 동안 673 x g(1000 rpm)에서 멸균 15mL 원심분리기로 옮긴다. 상부체를 제거합니다.
- 인산완충식염(PBS)(PH 7.4, -CaCl 2 , -MgCl2)으로셀 펠릿을 세척한다.
- 세포의 냉동 보호
- 마이크로센심분리기 튜브에 50 μL 세포 펠릿을 수집합니다. 별도의 튜브에 PBS 50 μL 및 글리세롤 18 μL의 혼합물을 준비합니다.
- 50 μL 세포 펠릿과 글리세롤-PBS 혼합물 68μL을 펠릿 상단에 추가하고 덩어리가 남아있을 때까지 튜브의 측면을 부드럽게 눌러 펠릿을 다시 분리하여 펠릿을 재연합니다.
참고: 부드러운 파이펫팅을 사용하여 셀을 다시 일시 중단할 수도 있지만 셀 무결성이 손상되지 않았는지 확인합니다.
2. NMR 로터에서 포유류 세포의 냉동 보존
- 3.2mm 사파이어 로터로 세포를 옮기.
- 깔때기를 만들려면 200 μL 파이펫 팁을 자르고 절단 파이펫 팁의 좁은 끝을 3.2mm 로터에 삽입합니다.
- 로터에 앉아 깔때기로 세포를 전송합니다. 로터를 마이크로센심심분리기 튜브에 깔때기와 함께 놓고 실온에서 2-3분 동안 673 x g의 원심분리로 세포를 로터 바닥으로 배치합니다.
- 원형 및 로터에서 과잉 샘플을 제거합니다. 로터가 셀로 완전히 포장될 때까지 이 두 단계를 반복합니다.
참고: 선택적으로 동결 하기 전에 샘플의 셀룰러 생존 가능성을 결정 합니다. FBS 가 없는 DMEM의 100 μL에서 초과 셀 펠릿의 10 μL을 다시 중단합니다. 서스펜션의 10 μL을 0.4% 트라이팬 블루 솔루션과 혼합하고 자동화된 셀 카운터를 사용하여 생존 가능성을 즉시 평가합니다. 세럼이 트라이판 블루 스테인링을 방해하기 때문에 FBS 프리 미디어만 사용하여 세포를 희석시하십시오. - 상용 포장 도구를 사용하여 실리콘 플러그로 로터를 밀봉하십시오.
- 세라믹 드라이브 팁으로 로터를 세로로 아래로 누른 다. 드라이브 팁 의 측면에 섬세한 지느러미를 만지지 마십시오.
- 사파이어 로터의 아래쪽 가장자리의 절반을 은 영구 마커로 표시하고 검정 영구 마커로 로터의 하단 가장자리의 나머지 절반을 표시하여 분광기 내부의 로터 회전을 정확하게 모니터링할 수 있습니다.
참고: 로터 마킹의 불완전함은 회전 주파수의 정확한 계수를 방지하여 안정적인 회전을 달성하지 못할 것입니다. 마커가 냉동 로터에 쓰지 않고 로터 온난화가 샘플 무결성을 손상시키므로 동결 전에 로터를 표시하는 것이 중요한 단계입니다.
- 3.2mm 사파이어 로터 내부의 셀 보존.
- 티슈 나 종이 타월조각으로 만든 쿠션을 뚜껑 아래와 극저온 병병 의 바닥에 놓습니다 (재료 표참조).
참고: 티슈 페이퍼는 극저온 바이알의 측면에 부딪쳐 발생하는 손상으로부터 로터 표시를 보호합니다. - 3.2mm 사파이어 로터를 극저온 바이알 패딩에 넣고 극저온 바이알 바닥을 향한 표시된 끝이 있는 티슈 페이퍼를 넣습니다.
- 극저온 유리알을 제어속도(-1°C/min)에 넣고 최소 3시간 동안 -80°C 냉동고에 배치하여 로터를 천천히 동결한다.
- 냉동 로터를 함유한 극저온 바이알을 액체 질소 저장으로 옮춘다.
- 티슈 나 종이 타월조각으로 만든 쿠션을 뚜껑 아래와 극저온 병병 의 바닥에 놓습니다 (재료 표참조).
3. 냉동 시료를 NMR 분광계로 극저온 전달
- 냉동 샘플을 NMR 시설로 전송합니다.
- 냉동 로터가 함유된 극저온 바이알을 NMR 시설로 수송하기 위해 액체 질소로 채워진 작은 분해로 옮기.
- 냉동 로터의 액체 질소 목욕으로 옮기.
- 500mL - 액체 질소 1L로 건조하고 열절연 된 넓은 입 거품 dewar를 채웁니다.
- 극저온 바이알에서 액체 질소로 채워진 넓은 입 폼 데워로 로터를 옮기.
- 손에 전이 탈전쟁에서 극저온 바이알을 가지고 대기로부터 보호하기 위해 액체 질소의 표면 바로 위에 고정.
- 입을 약간 아래쪽으로 가리키는 극저온 바이알을 들고 있는 동안 캡을 풀고 로터가 액체 질소 욕조로 미끄러지게 합니다.
참고: 캡이 나사로 풀려나면 로터는 극저온 바이알에서 액체 질소 목욕(1초 미만)으로 떨어져 응축이 로터에서 수집되는 것을 방지해야 합니다. 액체 질소의 증발은 넓은 입 거품 탈파에서 "질소 구름"을 형성하고 액체 질소에 침수되기 전에 로터의 응축을 방지합니다. 로터가 공기에 더 오래 노출되면 로터 벽에 수분이 응축되어 얼음으로 다시 응축될 수 있습니다.
- NMR 샘플 포수로 로터의 극저온 전송.
- 액체 질소 목욕에 침수하여 1.5 mL 미세 원심 분리기 튜브를 미리 식힙니다. 튜브를 닫지 마십시오.
참고: 마이크로센심분리기 튜브로 이송하기 전에 로터를 검사합니다. 핀셋을 사용하여 액체 질소 표면 바로 아래에 로터를 잡고 로터 표시가 손상되지 않고 벽에 얼음 침전물이 형성되지 않았으며 드라이브 팁이 손상되지 않은지 확인하십시오. 로터 벽의 얼음 결정 침전물은 흰색 분말로 나타납니다. 드라이브 팁이 아닌 항상 로터를 본체로 고정하십시오. 트위저 팁으로 로터에서 마킹을 긁지 마십시오. - 액체 질소 목욕의 표면 에서, 마이크로 원심 분리기 튜브의 바닥을 향한 드라이브 팁과 튜브의 개구부를 향한 표시와 마이크로 원심 분리기 튜브로 로터를 전송하는 핀셋을 사용합니다.
참고: 액체 질소에 잠기거나 로터를 만지기 전에 항상 말린 핀셋. - 핀셋을 사용하여, 목에 의해 액체 질소 아래에 로터를 포함하는 튜브를 개최.
- 두 번째 핀셋을 손에 들고, 액체 질소 욕조에 NMR 샘플 포수를 침수하고 마이크로 센심 분리튜브에 대하여 급성 각도로 기울어지도록 보관할 준비를 하십시오.
참고: 샘플 포수가 액체 질소와 접촉하는 시간을 최소화하여 O-링이 동결되지 않도록 합니다. O 링이 정지하면 포수를 분광계에 삽입하기가 매우 어려울 것입니다.
- 액체 질소 목욕에 침수하여 1.5 mL 미세 원심 분리기 튜브를 미리 식힙니다. 튜브를 닫지 마십시오.
- NMR 샘플 포수에서 NMR 분광계로 극저온 로터 전송
참고: 이 단계는 극저온 캐비닛을 작동시키고 하나는 액체 질소에서 프로브로 샘플을 전송하는 두 사람이 필요합니다.- 캐비닛에 'EJECT'를 눌러 극저온 캐비닛을 배출 모드로 배치합니다.
참고: 배출 모드는 대기 수분의 입구를 방지하기 위해 프로브에서 대기로 고압으로 건조 및 냉류 질소 가스 흐름을 제거합니다. - 로터를 NMR 샘플 포수로 옮기습니다.
- 액체 질소의 표면 아래에 있는 동안 NMR 샘플 포수의 열린 끝을 마이크로 원심 분리기 튜브에 삽입합니다.
- 마이크로원심분리기 튜브와 NMR 샘플 캐처를 모두 들어 올려 로터가 샘플 포수에 빠질 수 있도록 합니다. 로터가 샘플 포수의 림에 붙어 있는 경우에 NMR 샘플 포수 및 미세 원심 분리관을 흔들어 주세요.
- NMR 샘플 포수 위에 빈 미세원심분리기 튜브를 두어 로터를 공기로부터 보호합니다.
- 프로브에서 다른 빈 NMR 샘플 캐처를 제거하고 바닥에 놓습니다.
- 로터를 포함하는 NMR 샘플 포수를 자유 손에 옮기고, 마이크로센심분리기 튜브를 제거하고 프로브에 즉시 삽입합니다.
참고: O 링이 정지하면 샘플 포수를 조이기가 어려울 것입니다. 제자리에 미끄러낼 때까지 힘을 계속 가십시오. - 저온 캐비닛을 운영하는 사람에게 '정지 EJECT'와 'INSERT'로 신호를 보라고 합니다.
참고: 삽입 모드는 샘플 포수에서 프로브로 로터를 안내합니다. - 저온 캐비닛에 의해 제어되는 베어링 및 구동 유압을 조정하여 원하는 회전 속도(예: 12kHz)로 샘플을 회전시. (예를 들어, 베어링 가스를 ~200mBar로 즉시 늘리고 구동 가스를 10mBar로 늘립니다. 샘플이 회전하면 베어링 가스를 1000mBar로 늘리고 가스를 200mBar로 구동합니다. 회전이 안정화됨에 따라 베어링을 2,400mBar로 늘인 다음 드라이브 가스를 200mBar에서 1,700mBar로 몇 분 동안 증가시면 됩니다. VT 냉각 가스는 ~1070 L/h에서 일정합니다.)
참고: 액체 질소 배스에서 마이크로센트 심분리기 튜브와 NMR 샘플 캐처를 들어 올릴 때 마이크로 센트심분리기 튜브내부에 로터를 둘러싸기에 충분한 액체 질소가 있는지 확인하십시오. NMR 샘플 포수로 로터를 옮기고 NMR 샘플 캐처를 분광계에 삽입하는 시간을 최소화합니다. 3.4의 모든 단계는 30s 이내에 완료되어야 합니다.
- 캐비닛에 'EJECT'를 눌러 극저온 캐비닛을 배출 모드로 배치합니다.
4. NMR 분광계에서 샘플을 극저온 제거
- 액체 질소 목욕 및 극저온 병병의 준비
- 500mL - 액체 질소 1L을 넓은 입 거품 탈와에 붓고 분광기 아래에 목욕을 놓습니다.
- 극저온 바이알을 미리 식힙니다. 액체 질소 목욕에 티슈 페이퍼를 포함하는 빈 극저온 병병을 잠급한다.
- 프로브에서 극저온 바이알로 로터의 극저온 전달
- 주행 및 베어링 가스 흐름을 래핑하여 회전 속도를 0kHz로 줄이고 배출 모드로 전환하여 로터를 배출합니다.
- 배출 모드를 유지하여 프로브에서 샘플 포수를 제거하고, 액체 질소를 함유한 넓은 구강 폼 데워에 직접 로터를 놓습니다.
- 미리 차가운 핀셋을 사용하여 로터를 액체 질소 표면 아래의 미리 차가운 극저온 바이알로 옮춥니다.
- 극저온 바이알을 캡. 극저온 바이알 캡을 액체 질소에 담그어 미리 식힙니다. 목욕에서 로터와 액체 질소를 포함하는 극저온 바이알을 제거하고 미리 차가운 캡으로 튜브를 캡. 질소를 기화하는 것이 안전하게 방출될 수 있도록 캡을 조이지 마십시오.
- 액체 질소에 극저온 바이알을 다시 침수합니다. 샘플은 장기간 액체 질소 저장으로 전송되거나 추가 분석을 위해 즉시 압축을 풀 수 있습니다.
5. 로터 및 생존 가능성 측정 을 풀기
- 로터 풀기 및 측정 실행 가능성
- 37°C까지 사전 웜 혈청 프리 미디어(DMEM) 또는 PBS.
- 액체 질소에서 로터를 제거합니다. 드라이브 팁과 실리콘 플러그를 제거합니다.
참고 : 사파이어는 우수한 열 도체입니다. 열 전달은 세포 생존가능성을 손상시키는 현지 동결 해동 이벤트를 일으킬 수 있으므로 손가락으로 로터를 만지지 마십시오.
- 실행 가능성 측정
- 로터의 냉동 셀 펠릿에 따뜻한 매체 20 μL을 추가하고 세포를 다시 중단합니다. 파이펫으로 서스펜션을 제거하고 서스펜션을 100 μL의 미디어와 혼합합니다.
- 셀 서스펜션 10μL을 제거하고 동일한 부피0.4% 트라이팬 블루 용액(v/v)으로 섞는다. 실온에서 30초에서 1분 동안 배양합니다.
- 자동화된 셀 카운터를 사용하여 생존 가능성을 측정합니다.
결과
NMR 분광계에 포유류 세포의 미리 냉동 된 샘플의 극저온 삽입은 NMR 실험 전반에 걸쳐 생존력을 지원합니다. 냉동 시료를 미리 냉각된 NMR 프로브로 전송하는 회로도 1도에도시된다. 세포 생존력과 손상성은 다양한 방법을 사용하여 평가될 수 있다. 여기서 우리는 다른 방법(23)과잘 일치하는 멤브레인 무결성의 표준 염료 기반 측정값을 사용했습니다. 손상된 세포는 손상된 막 무결성을 가진 세포가 투과성이 있는 동안 시험청에 불투과성입니다. 트라이팬 블루 투과성 및 불투과성 셀의 수는 자동화된 셀 카운터를 사용하여 빠르게 평가될 수 있다. 여기에 기재된 프로토콜을 사용하여, MAS NMR(즉, 점 5.2.3) 후 포유류 세포의 트리판 블루 투과성은 온도 변화 전에 포유류 세포의 트리판 블루 투과성(즉, 점 2.1.3)과 유사하다. 그러나, 세포가 느려지면 삽입 전 실온으로 따뜻하게 한 다음(즉, 냉각 프로브에 삽입하기 전에 로터를 실온으로 데우기 전에 3점을 가리키는 프로토콜에 따라), trypan blue에 의해 평가된 세포 생존 가능성은 셀의 10% 미만으로 감소한다(그림2). 따라서, 분광계 내부의 세포를 동결하면 세포막 무결성이 저하되는 반면 포유류 세포의 냉동 시료의 극저온 삽입은 NMR 실험 전반에 걸쳐 세포 생존가능성을 지원합니다.

그림 1: 냉동 시료를 미리 냉각된 NMR 프로브로 옮기는 극저온 전달의 회로도. (A)액체 질소의 표면에 접근하여 극저온 바이알의 상부를 풀어냅니다. (B)로터를 액체 질소 목욕으로 밀어 넣습니다. (C)핀셋을 사용하여 마이크로 센트심분리기 튜브를 침수하고 완전히 식을 때까지 제자리에 고정합니다. (D)튜브의 바닥을 향한 드라이브 팁과 함께 마이크로 센심 분리기에 로터를 삽입합니다. 핀셋으로 잡아두기보다는 밀어 넣으세요. (E)액체 질소 배스의 표면 바로 아래에 미세 원심 분리기 튜브를 잡고 육안으로 로터를 검사하여 서리가 없고 잘 표시되어 있는지 확인합니다. (F)샘플 포수를 표면 위의 각도로 잡습니다. (G)샘플 포수가 마이크로센트리슈어지 튜브 내부에 있는 즉시 액체 질소에서 샘플 포수와 튜브를 들어 올립니다. (H)로터가 림에 잡히면 샘플 포수를 흔들어 주세요. (I)프로브에서 빈 샘플 포수를 제거하고 땅에 놓습니다. (J)내부 로터와 샘플 포수에서 마이크로 원심 분리기를 제거하고, 삽입, 프로브에서 샘플 포수를 조이고 제어 콘솔에 "INSERT"를 누릅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
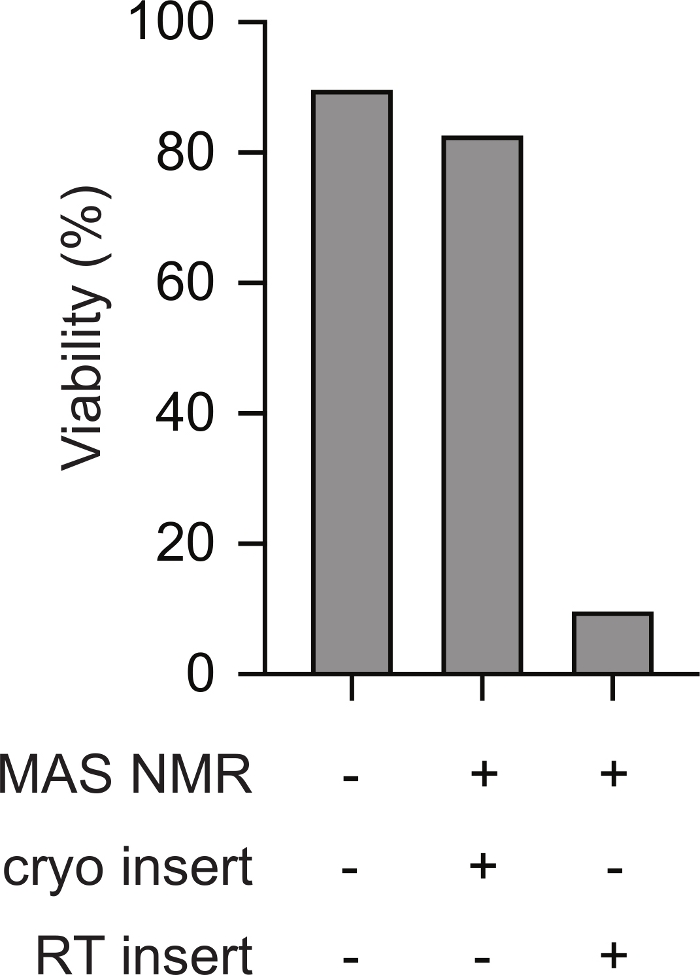
그림 2: 포유류 세포의 미리 냉동된 시료의 극저온 삽입은 결코 동결되지 않은 포유류 세포 샘플과 유사한 세포 손상의 측정을 초래한다. 결코 동결된 적이 없는 시료에 대한 트라이팬 블루 불투과성 세포의 백분율(예: 단계 2.1.3)은 MAS NMR(예: 12kHz MAS를 갖는 단계 5.2.3)이 시료에 대한 세포의 백분율과 유사하다. 100K로 미리 냉각된 NMR 기기에 삽입하기 전에 실온으로 따뜻해졌던 느린 냉동 셀(예: 3단계)은 12kHz MAS를 가진 MAS NMR 이후 의 전소 셀의 비율이 훨씬 낮았다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
냉동 시료를 NMR 분광계로 전송하는 것은 NMR 데이터 수집을 통해 냉동 포유류 세포의 생존가능성을 유지하는 데 성공적입니다. 이 방법론의 성공은 MAS NMR 생존 가능성 측정을 사전 및 게시하여 입증됩니다. 이 방법은 온도 변동이 샘플 무결성을 손상시킬 수 있는 모든 시스템에서 성공적이고 일반화할 수 있습니다. 현재 제시된 프로토콜은 HEK 293 세포주와 함께 수행된다. 많은 포유류 세포주를 위한 극저온 보존 조건은 매우 유사하기 때문에, 여기에서 보고된 조건은 그밖 세포 계통에 번역할 가능성이 높습니다; 그러나 동일한 결과를 얻기 위해서는 냉동 보호제, 샘플 볼륨 및 동결 속도의 추가 최적화가 필요할 수 있습니다.
이 방법론은 NMR 실험 후 로터를 더 빠르게 풀면 개선할 수 있습니다. 이 단계는 현재 최적이 지으며 실행은 셀의 생존 가능성에 영향을 미칩니다. 세포가 미디어에서 다시 중단되기 전에 드라이브 팁과 실리콘 플러그를 로터에서 제거해야 합니다. 드라이브 팁과 실리콘 플러그를 제거하는 동안 로터를 보유할 때 샘플이 고르지 않게 해지면 로터 처리 시간이 짧아 더 높은 비우음이 발생합니다. 로터 홀더 또는 기타 도구의 개발은 균일한 해동과 드라이브 팁과 실리콘 플러그의 빠른 제거를 용이하게하기 위해 생존 가능성의 포스트 NMR 평가를 보다 정확하게 만드는 데 도움이 될 것입니다.
본 문서에 기재된 극저온 시료 로딩에 대한 접근법은 NMR 자석의 보어에 프로브를 사용하여 시료 삽입 및 배출을 지원하는 NMR 프로브로 제한됩니다. 외부 샘플 삽입 및 배출은 상용 DNP 시스템에 표준이지만 사용자 지정 프로브에 항상 이 옵션이 있는 것은 아닙니다. 또한 극저온 시료 로딩에 대한 이러한 접근 방식은 다른 크기의 로터와 호환되기 위해 제작된 NMR 프로브에 대해 약간의 수정이 필요할 수 있습니다. 이 프로토콜은 3.2mm 로터에 최적화되었으며 샘플 포수의 외경이 미세 원심분리기 튜브의 내경을 초과하는 경우 변형이 필요할 수 있습니다(예: 단계 3.4.2).
MAS NMR에 DNP를 적용하면, 이제 내인성 생리 농도24,25,26에서단백질 및 기타 생체 분자를 검출할 수 있게 되었다. 이것은 그들의 토착 환경 내의 생체 분자를 공부의 가능성을 엽니다. 실험 전반에 걸친 세포 무결성 및 생존력 의 유지 는 분광법의 실험 결과를 생물학적 현상에 연결하는 데 중요할 것입니다. 정제된 단백질 또는 세포용액을 함유한 시료의 통제되지 않은 동결은 일반적으로 시료 품질7,27을손상시키지 않지만, 동결속도가 정제된시스템(28)에서도중요한 변수가 될 수 있다는 몇 가지 징후가 있지만. 그러나, 포유류 세포의 견본은 세포 손상및 생존성을 보존하는 것이 해석을 위해 중요하다면 통제된 비율로 동결될 필요가 있습니다. 여기서 우리는 포유류 세포의 냉동 샘플을 동결 및 전송하기 위한 프로토콜을 잠재적으로 손상시키는 온도 변동을 피하고 실행 가능한 세포에 대한 측정을 지원하는 미리 냉각된 DNP MAS NMR 계측기로 전달합니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
이 연구는 텍사스의 암 연구 예방 및 연구 연구소 [RR150076], 국립 과학 재단 [1751174]의 보조금에 의해 지원되었다; 국립 보건원 [NS-111236], 웰치 재단 [1-1923-20170325]; 루페 머치슨 재단, 테드 내쉬 롱 라이프 재단, 킨십 재단(Searle Scholars Program)
자료
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue stain | Invitrogen | T10282 | |
| 100 mm cell culture dish | Thomas Scientific | 430167 | |
| 150 mm cell culture dish | Nunc | 157150 | |
| 3.2 mm sapphire rotor | Bruker | ||
| 45 ° angled forceps | Hampton Research | HR4-859 | |
| AMUPol | Cortecnet | C010P005 | |
| Black and Silver marker | Sharpie | ||
| Cap removal tool | Bruker | HZ16913 | |
| Cell culture grade water | HyClone | SH30529.03 | |
| Ceramic cap | Cortecnet | HZ12372 | |
| CoolCell | Corning/ Biocision | UX-04392-00 (Corning) / BCS-405 (Bioscion) | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10288 | |
| Countess II automated cell counter | Invitrogen | AMQAF1000 | |
| Cryogen tubes | Nalgene | 03-337-7Y | |
| d8-glycerol | Aldrich | 447498 | |
| Deuterium oxide, 99.8 % atom D | Aldrich | 756822-1 | |
| DMEM | Gibco | 10569-010 | |
| DNP NMR system with frequency-matched gyrotron | Bruker | ||
| Foam dewar | Spearlab | FD-800 | |
| Kimwipes | Kimwipes | ||
| Packing tool | Bruker | ||
| Pen-Strep | Gibco | 15140-122 | |
| Powdered PBS | VWR | VWRRV0780 | |
| Protonated PBS | Gibco | 10010-023 | |
| Silicon plug | Bruker | B7089 | |
| Standard Vessel forceps | |||
| Tryp-L | Gibco | 12605010 |
참고문헌
- Costello, W. N., Xiao, Y., Frederick, K. K. DNP-Assisted NMR Investigation of Proteins at Endogenous Levels in Cellular Milieu. Methods Enzymology. 615 (1), 373-406 (2019).
- Hall, D. A., et al. Polarization-Enhanced NMR Spectroscopy of Biomolecules in Frozen Solution. Science. 276 (5314), 930-932 (1997).
- Akbey, Ü, Oschkinat, H. Structural biology applications of solid state MAS DNP NMR. Journal of Magnetic Resonance. 269 (1), 213-224 (2016).
- Matsuki, Y., et al. Helium-cooling and -spinning dynamic nuclear polarization for sensitivity-enhanced solid-state NMR at 14T and 30K. Journal of Magnetic Resonance. 225 (1), 1-9 (2012).
- Miyamoto, Y., Ikeuchi, M., Noguchi, H., Hayashi, S. Long-term Cryopreservation of Human and other Mammalian Cells at -80 °C for 8 Years. Cell Medicine. 10 (1), 1-7 (2018).
- Lopez del Amo, J. M., Schneider, D., Loquet, A., Lange, A., Reif, B. Cryogenic solid state NMR studies of fibrils of the Alzheimer's disease amyloid-β peptide: perspectives for DNP. Journal of Biomolecular NMR. 56 (4), 359-363 (2013).
- Gupta, R., et al. Dynamic nuclear polarization enhanced MAS NMR spectroscopy for structural analysis of HIV-1 protein assemblies. The Journal of Physical Chemistry B. 120 (2), 329-339 (2016).
- Lim, B. J., Ackermann, B. E., Debelouchina, G. T. Targetable Tetrazine-Based Dynamic Nuclear Polarization Agents for Biological Systems. ChemBioChem. 21 (9), 1315-1319 (2020).
- Jaudzems, K., et al. Dynamic nuclear polarization-enhanced biomolecular NMR spectroscopy at high magnetic field with fast magic-angle spinning. Angewandte Chemie International Edition. 57 (25), 7458-7462 (2018).
- Chaytor, J. L., et al. Inhibiting ice recrystallization and optimization of cell viability after cryopreservation. Glycobiology. 22 (1), 123-133 (2012).
- Mazur, P. Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing. The Journal of General Physiology. 47 (2), 347-369 (1963).
- Lovelock, J. E., Bishop, M. W. H. Prevention of Freezing Damage to Living Cells by Dimethyl Sulphoxide. Nature. 183 (4672), 1394-1395 (1959).
- Bald, W. B. The relative merits of various cooling methods. Journal of Microscopy. 140 (1), 17-40 (1985).
- Akiyama, Y., Shinose, M., Watanabe, H., Yamada, S., Kanda, Y. Cryoprotectant-free cryopreservation of mammalian cells by superflash freezing. Proceedings of the National Academy of Sciences. 116 (16), 7738-7743 (2019).
- Shi, M., et al. High-throughput non-contact vitrification of cell-laden droplets based on cell printing. Scientific Reports. 5 (1), 17928(2015).
- Pegg, D. E. Principles of cryopreservation. Methods in Molecular Biology. 1257, 3-19 (2015).
- Ramilo, C., et al. Detection of the covalent intermediate of UDP-N-acetylglucosamine enolpyruvyl transferase by solution-state and time-resolved solid-state NMR spectroscopy. Biochemistry. 33 (50), 15071-15079 (1994).
- Jeon, J., Thurber, K. R., Ghirlando, R., Yau, W. M., Tycko, R. Application of millisecond time-resolved solid state NMR to the kinetics and mechanism of melittin self-assembly. Proceedings of the National Academy of Sciences. 116 (34), 16717(2019).
- Pievo, R., et al. A rapid freeze-quench setup for multi-frequency EPR spectroscopy of enzymatic reactions. Chemphyschem. 14 (18), 4094-4101 (2013).
- Cherepanov, A. V., de Vries, S. Microsecond freeze-hyperquenching: development of a new ultrafast micro-mixing and sampling technology and application to enzyme catalysis. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1656 (1), 1-31 (2004).
- Hu, K. N., Tycko, R. What can solid state NMR contribute to our understanding of protein folding. Biophysical Chemistry. 151 (1), 10-21 (2010).
- Hu, K. N., Yau, W. M., Tycko, R. Detection of a transient intermediate in a rapid protein folding process by solid-state nuclear magnetic resonance. Journal of the American Chemical Society. 132 (1), 24-25 (2010).
- Johnson, S., Nguyen, V., Coder, D. Assessment of cell viability. Current Protocols in Cytometry. 64 (1), 1-26 (2013).
- Frederick, K. K., et al. Sensitivity-enhanced NMR reveals alterations in protein structure by cellular milieus. Cell. 163 (3), 620-628 (2015).
- Van Der Cruijsen, E. A. W., et al. Biomolecular DNP-supported NMR spectroscopy using Site-directed spin labeling. Chemistry. 21 (37), 12971-12977 (2015).
- Schlagnitweit, J., et al. Observing an antisense drug complex in intact human cells by in-cell NMR spectroscopy. ChemBioChem. 20 (19), 2474-2478 (2019).
- Debelouchina, G. T., et al. Dynamic nuclear polarization-enhanced solid-state NMR spectroscopy of GNNQQNY nanocrystals and amyloid fibrils. Physical Chemistry Chemical Physics : PCCP. 12 (22), 5911-5919 (2010).
- Schmidt, T., et al. Submillisecond freezing permits cryoprotectant-free EPR doubled electron-electron resonance spectroscopy. ChemPhysChem. 21, 1224-1229 (2020).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유