Method Article
Amostra criogênica carregando em um espectrômetro de ressonância magnética nuclear de ângulo mágico que preserva a viabilidade celular
Neste Artigo
Resumo
Apresentado aqui é um protocolo para transferência criogênica de amostras congeladas para a dinâmica polarização nuclear (DNP) sonda de ressonância magnética nuclear (MAS). O protocolo inclui instruções para armazenamento de rotores antes do experimento e direções para medições de viabilidade antes e depois do experimento.
Resumo
A polarização nuclear dinâmica (DNP) pode aumentar drasticamente a sensibilidade da espectroscopia de ressonância magnética nuclear (NMR) de ângulo mágico. Esses ganhos de sensibilidade aumentam à medida que as temperaturas diminuem e são grandes o suficiente para permitir o estudo de moléculas em concentrações muito baixas nas temperaturas operacionais (~100 K) da maioria dos espectrômetros NMR equipados com DNP comerciais. Isso leva à possibilidade de biologia estrutural em células em células criopreservadas para macromoléculas em seus níveis endógenos em seus ambientes nativos. No entanto, as taxas de congelamento exigidas para a criopreservação celular são excedidas durante o manuseio típico da amostra para DNP MAS NMR e isso resulta em perda de integridade celular e viabilidade. Este artigo descreve um protocolo detalhado para a preparação e transferência criogênica de uma amostra congelada de células mamíferas em um espectrômetro MAS NMR.
Introdução
A introdução da polarização nuclear dinâmica para espectroscopia de ressonância magnética nuclear de ângulo mágico pode aumentar a sensibilidade do MAS NMR por várias ordens de magnitude. Isso permitiu a detecção de biomoléculas em ou perto de suas concentrações fisiológicas. O DNP pode e fornece a sensibilidade necessária para detectar uma proteína isototicamente rotulada em concentrações endógenas (~1 μM) em ambiente biológico complexo1. Como existem protocolos bem estabelecidos para introduzir moléculas isototicamente rotuladas em células mamíferas sem afetar sua viabilidade, isso abre a possibilidade de estudar biomoléculas enriquecidas isototicamente em seus níveis endógenos em seu ambiente nativo. Além disso, como os aprimoramentos do DNP são mais eficientes a temperaturas mais baixas2,3,4, as temperaturas experimentais para DNP MAS NMR se alinham perfeitamente com as necessárias para o armazenamento a longo prazo de células de mamíferos viáveis5. No entanto, o método convencional de transferência de uma amostra para um espectrômetro DNP MAS NMR submete-a a taxas de flutuação de temperatura que rompem células de mamíferos.
Os experimentos de NMR mas exigem que a amostra seja girada sobre o ângulo mágico em frequências iguais ou maiores do que a magnitude da interação anisotrópica para que ela seja mediada a zero, tipicamente com pelo menos 4 kHz e muitas vezes muito maior6,7,8,9. As amostras são, portanto, embaladas em rotores que têm uma ponta afim que é usada para conduzir a rotação do rotor por um fluxo de gás e têm uma marca na outra extremidade para que a frequência de rotação possa ser monitorada por um tacômetro. A transferência de amostras para a maioria dos instrumentos MAS NMR é realizada injetando o rotor do exterior do instrumento no estator no final da sonda NMR com um fluxo de ar seco ou gás nitrogênio. Depois que o rotor atinge o estator, que segura o rotor no ângulo mágico, a rotação da amostra é impulsionada por um mecanismo de turbina de ar. Fluxos separados de suporte a gás, impulsionem e controlem a temperatura do rotor. Inserir um rotor no espectrômetro NMR e alcançar o giro MAS estável requer pontas de acionamento finamente usinadas e controle rigoroso da temperatura e pressão dos fluxos separados de gás. Apesar dessas demandas técnicas, a inserção e a obtenção de MAS estável são em grande parte automatizadas para testes comerciais de NMR MAS para aplicações de temperatura ambiente.
No entanto, a situação é mais complicada para aplicações de baixa temperatura. Amostras para aplicações de baixa temperatura são tipicamente inseridas no espectrômetro à temperatura ambiente e congeladas no estator. No primeiro minuto, a temperatura da amostra diminui rapidamente (> −100 °C/min) e a temperatura do sistema requer vários minutos para se equilibrar. Devido à interação entre temperatura e pressão, a inserção e a aproximação do MAS desejado são frequentemente manuseadas manualmente para aplicações de baixa temperatura. Apesar da exigência de intervenção manual, o congelamento do rotor dentro do instrumento é benéfico porque minimiza a introdução de água e condensação na sonda, o que é fundamental para o sucesso da fiação. Não só a condensação e o acúmulo de gelo das linhas de gás do bloco de umidade ambiente, condensação ou geada no próprio rotor podem evitar mecanicamente a MAS. Assim, as amostras para NMR mas de baixa temperatura são tipicamente congeladas dentro do instrumento a taxas que excedem -100 °C/min.
As células mamíferas podem manter sua integridade através de um ciclo de congelamento se o resfriamento for lento5,10,11,12, a uma taxa igual ou mais lenta do que 1 °C/min. Alternativamente, as células também mantêm sua integridade se a taxa de resfriamento for ultrarrápida13,14,15, a uma taxa mais rápida do que 104 °C/min. Taxas intermediárias a esses dois extremos rompem e matam células mamíferas devido à formação de cristais de gelo dentro e fora das células, mesmo na presença de agentes crioprotetores16. As taxas de resfriamento da amostra para um rotor de temperatura ambiente dentro de uma sonda pré-resfriada caem entre esses dois extremos, para estudar células de mamíferos intactas preservadas criogenicamente preservadas, as amostras devem ser congeladas antes de serem transferidas para o instrumento e transferidas para o instrumento sem flutuações de temperatura que possam danificar a amostra ou o acúmulo de geada no rotor que poderia impedir que o rotor girasse. O protocolo descreve um método de inserção de rotor pré-resfriado e sem geada em um sistema de NMR mas criogênico para o estudo de amostras de células mamárias intactas preservadas criogenicamente. A transferência de amostra criogênica descrita aqui foi desenvolvida para caracterização de RMN de células intactas viáveis. No entanto, é aplicável a qualquer sistema onde flutuações de temperatura possam comprometer a integridade da amostra. Isso inclui qualquer variedade de sistemas complexos, como o congelamento de reações saciadas para caracterização química e estrutural dos intermediários de reação preso17,18, enzima19,20 ou dobramento deproteínas 21,22.
Protocolo
1. Cultura e crioproteção de células mamíferas
- Cultura e colheita de células de mamíferos
- Descongele uma alíquota de células renais embrionárias humanas congeladas (HEK 293).
- Cultura HEK 293 células em mídia de crescimento (por exemplo, DMEM com soro bovino fetal de 10% e 1% Pen-Strep) a 37 °C com 5% de CO2 em placas de 100 mm para duas a três passagens (7-10 dias).
- Divida as células e a cultura em uma placa de 150 mm até que as células atinjam 90-95% de confluência.
NOTA: Uma placa de 150 mm a > confluência de 90% será suficiente para encher dois rotores de safira com diâmetro de 3,2 mm. - Células de colheita usando 4 mL de trippsina (ver Tabela de Materiais) e 10 mL de mídia. Transfira a suspensão para um concânico e centrífuga de 15 mL estéril a 673 x g (1000 rpm) por 5 min a temperatura ambiente. Remova o supernatante.
- Lave a pelota celular com soro fisiológico tamponado de fosfato (PBS) (pH 7.4, −CaCl2, −MgCl2).
- Crioproteção das células
- Colete uma pelota de célula de 50 μL em um tubo de microcentrifuuagem. Prepare uma mistura de 50 μL de PBS e 18 μL de glicerol em um tubo separado.
- Misture suavemente a pelota de célula de 50 μL com 68 μL de mistura glicerol-PBS adicionando a mistura glicerol-PBS ao topo da pelota e reutilizando a pelota batendo suavemente na lateral do tubo até que não restem aglomerados.
NOTA: A tubulação suave também pode ser usada para resususpensar a célula, no entanto, certifique-se de que a integridade celular não esteja comprometida.
2. Criopreservação de células mamíferas em um rotor de RMN
- Transferência de células para um rotor de safira de 3,2 mm.
- Para fazer um funil, corte uma ponta de pipeta de 200 μL e insira a extremidade estreita da ponta de pipeta cortada no rotor de 3,2 mm.
- Transfira as células para o funil sentado no rotor. Coloque o rotor junto com o funil em um tubo de microcentrifuuge e pelota as células na parte inferior do rotor por centrifugação a 673 x g para 2-3 min à temperatura ambiente.
- Remova o supernatante e qualquer amostra em excesso do rotor. Repita estes dois passos até que o rotor esteja totalmente embalado com as células.
NOTA: Opcionalmente, determine a viabilidade celular da amostra antes de congelar. Resuspend 10 μL da pelota de célula em excesso de pelotas em 100 μL de DMEM livre de FBS. Misture 10 μL da suspensão com solução azul trypan de 0,4% e avalie imediatamente a viabilidade usando um contador automático de células. Use apenas mídia livre FBS para diluir células à medida que o soro interfere com a coloração azul trypan. - Sele o rotor com um plugue de silício usando uma ferramenta de embalagem comercialmente disponível.
- Feche o rotor com uma ponta de acionamento de cerâmica pressionando-o verticalmente para baixo. Evite tocar nas delicadas aletas na lateral da ponta da unidade.
- Marque metade da borda inferior do rotor de safira com um marcador permanente prateado e a outra metade da borda inferior do rotor com um marcador permanente preto para permitir o monitoramento preciso da fiação do rotor dentro do espectrômetro.
NOTA: As imperfeições na marcação do rotor evitarão uma contagem precisa da frequência giratória, resultando na falha em alcançar uma fiação estável. Porque os marcadores não escreverão em um rotor congelado e o aquecimento do rotor compromete a integridade da amostra, marcar o rotor antes de congelar é um passo crítico.
- Criopreservação de células dentro de um rotor de safira de 3,2 mm.
- Coloque uma almofada feita por um pedaço de tecido ou toalha de papel sob a tampa e na parte inferior do frasco criogênico (ver Tabela de Materiais).
NOTA: O papel de tecido protege a marcação do rotor contra danos incorridos batendo contra os lados dos frascos criogênicos. - Coloque o rotor de safira de 3,2 mm no frasco criogênico acolchoado com o papel de tecido com extremidade marcada voltada para o fundo do frasco criogênico.
- Congele lentamente o rotor colocando o frasco criogênico no recipiente de resfriamento de taxa controlada (-1 °C/min) e coloque o recipiente no congelador de -80 °C por um mínimo de 3h.
- Transfira o frasco criogênico contendo o rotor congelado para o armazenamento líquido de nitrogênio.
- Coloque uma almofada feita por um pedaço de tecido ou toalha de papel sob a tampa e na parte inferior do frasco criogênico (ver Tabela de Materiais).
3. Transferência criogênica de uma amostra congelada para o espectrômetro NMR
- Transporte a amostra congelada para a instalação da RMN.
- Transfira o frasco criogênico contendo o rotor congelado para uma pequena de guerra cheia de nitrogênio líquido para transporte para a instalação da RMN.
- Transferência de rotor congelado para o banho de nitrogênio líquido.
- Encha uma espuma de boca larga seca e isolada termicamente com 500 mL – 1 L de nitrogênio líquido.
- Transfira o rotor do frasco criogênico para a espuma de espuma da boca larga recheada com nitrogênio líquido.
- Pegue o frasco criogênico da transferência de guerra na mão e segure-o logo acima da superfície do nitrogênio líquido para protegê-lo da atmosfera.
- Enquanto segura o frasco criogênico com a boca apontando ligeiramente para baixo, desaparafusar a tampa e deixar o rotor deslizar para o banho de nitrogênio líquido.
NOTA: Uma vez que a tampa esteja desparafusada, o rotor deve cair do frasco criogênico para o banho de nitrogênio líquido rapidamente (menos de 1 segundo) para evitar que a condensação seja coletado no rotor. A evaporação do nitrogênio líquido forma uma "nuvem de nitrogênio" na de guerra da espuma da boca larga e previne a condensação do rotor antes de ser submerso no nitrogênio líquido. A maior exposição do rotor ao ar pode levar à condensação da umidade nas paredes do rotor que se re condensarão no gelo.
- Transferência criogênica de rotor para receptor de amostras NMR.
- Prechill um tubo de microcentrifutura de 1,5 mL submergindo-o no banho de nitrogênio líquido. Não feche o tubo.
NOTA: Inspecione o rotor antes de transferir para o tubo de microcentrifuuagem. Usando pinças, segure o rotor logo abaixo da superfície do nitrogênio líquido e verifique se as marcas do rotor estão intactas, que nenhum depósito de gelo se formou em suas paredes e que a ponta da unidade está intacta. Depósitos de cristal de gelo nas paredes do rotor aparecem como pó branco. Tenha cuidado para sempre segurar o rotor pelo corpo e não pela ponta da unidade. Não arranhe a marcação do rotor com as pontas da pinça. - Sob a superfície do banho de nitrogênio líquido, use pinças para transferir o rotor para o tubo de microcentrifuuge com a ponta de acionamento voltada para a parte inferior do tubo de microcentrifuuge e as marcas voltadas para a abertura do tubo.
NOTA: Sempre seque pinças antes de submergir em nitrogênio líquido ou tocar no rotor. - Usando pinças, segure o tubo contendo o rotor sob nitrogênio líquido pelo pescoço.
- Com um segundo par de pinças na mão, prepare-se para submergir o apanhador de amostras de NMR no banho de nitrogênio líquido e segurá-lo para que ele esteja inclinado a um ângulo agudo em relação ao tubo de microcentrifuuge.
NOTA: Minimize o tempo em que o apanhador de amostras esteja em contato com o nitrogênio líquido para evitar o congelamento do anel O. Se o anel O congelar, será muito difícil inserir o apanhador no espectrômetro.
- Prechill um tubo de microcentrifutura de 1,5 mL submergindo-o no banho de nitrogênio líquido. Não feche o tubo.
- Transferência de rotor criogênico do apanhador de amostras NMR para espectrômetro NMR
NOTA: Esta etapa requer duas pessoas, uma para operar a criocabinet e outra para transferir a amostra do nitrogênio líquido para a sonda.- Coloque o criocabinet no modo de ejeção pressionando 'EJETAR' no gabinete.
NOTA: O modo de ejeção elimina o fluxo de gás nitrogênio seco e frio em alta pressão da sonda para a atmosfera, a fim de evitar a entrada de umidade atmosférica. - Transfira o rotor para o apanhador de amostras NMR.
- Insira a extremidade aberta do apanhador de amostras de NMR no tubo de microcentrifuuuagem enquanto ainda estiver sob a superfície do nitrogênio líquido.
- Levante o tubo de microcentrifuge e o apanhador de amostras de NMR para permitir que o rotor caia no receptor de amostras. Agite o apanhador de amostras de NMR e o tubo de microcentrifuuge no caso de o rotor ficar preso na borda do receptor de amostras.
- Deixe o tubo de microcentrifuuge vazio em cima do apanhador de amostras NMR para proteger o rotor do ar.
- Remova o outro apanhador de amostras NMR vazio da sonda e coloque-o no chão.
- Transfira o apanhador de amostras de NMR contendo o rotor para a mão livre, remova o tubo de microcentrifuuagem e insira-o imediatamente na sonda.
NOTA: Se o anel O congelar, será difícil apertar o apanhador de amostras. Continue aplicando força até que ele deslize no lugar. - Sinalize a pessoa que opera o cryocabinet para 'STOP EJECT' e 'INSERT'.
NOTA: O modo de inserção guia o rotor do receptor de amostra para dentro da sonda. - Gire a amostra para a taxa de fiação desejada (por exemplo, 12 kHz) ajustando a pressão de fluxo de rolamento e condução controlada pela criocabinet. (por exemplo, aumente imediatamente o gás de rolamento para ~200 mBar e o gás de acionamento para 10 mBar. Uma vez que a amostra gire, aumente o gás de rolamento para 1000 mBar e leve o gás para 200 mBar. À medida que a fiação se estabiliza, aumente o rolamento para 2400 mBar e, em seguida, aumente o gás de condução de 200 mBar para 1700 mBar ao longo de vários minutos. O gás de resfriamento VT é constante em ~1070 L/h.)
NOTA: Ao levantar o tubo de microcentrifuuge e o apanhador de amostras de NMR do banho de nitrogênio líquido, certifique-se de que o tubo de microcentrífuga tenha nitrogênio líquido suficiente dentro dele para cercar o rotor. Minimize o tempo entre transferir o rotor para o apanhador de amostras de RMN e inserir o apanhador de amostras de RMN no espectrômetro. Todas as etapas do 3.4 devem ser concluídas dentro dos 30 s.
- Coloque o criocabinet no modo de ejeção pressionando 'EJETAR' no gabinete.
4. Remoção criogênica da amostra do espectrômetro NMR
- Preparação do banho de nitrogênio líquido e do frasco criogênico
- Despeje 500 mL - 1 L de nitrogênio líquido na espuma de espuma da boca larga e coloque o banho sob o espectrômetro.
- Pré-esfrie o frasco criogênico. Submergir o frasco criogênico vazio contendo um pedaço de papel de tecido no banho de nitrogênio líquido.
- Transferência criogênica de rotor da sonda para o frasco criogênico
- Reduza a taxa de rotação para 0 kHz, reduzindo o fluxo de fluxo de vapor e rolamento do gás e ejete o rotor mudando para o modo de ejeção.
- Mantenha o modo de ejeção ligado, remova o apanhador de amostras da sonda, solte o rotor diretamente na dewar da espuma da boca larga contendo nitrogênio líquido.
- Usando pinças pré-refrigeradas, transfira o rotor para um frasco criogênico pré-refrigerado sob a superfície do nitrogênio líquido.
- Tampe o frasco criogênico. Prechill a tampa de frasco criogênico mergulhando-o em nitrogênio líquido. Remova o frasco criogênico contendo o rotor e nitrogênio líquido do banho e tampa o tubo com tampa pré-filhada. Não aperte a tampa para que o nitrogênio vaporizador possa ser liberado com segurança.
- Submergir o frasco criogênico em nitrogênio líquido. A amostra pode ser transferida para armazenamento de nitrogênio líquido a longo prazo ou desembalada imediatamente para análise suplementar.
5. Desempacotar as medidas do rotor e da viabilidade
- Desempacotamento do rotor e viabilidade de medição
- Mídia livre de soro pré-quente (DMEM) ou PBS a 37 °C.
- Remova o rotor do nitrogênio líquido. Remova a ponta da unidade e o plugue de silicone.
NOTA: Safira é um excelente condutor de calor. Evite tocar no rotor com os dedos, pois a transferência de calor pode causar eventos locais de congelamento que comprometem a viabilidade celular.
- Medindo a viabilidade
- Adicione 20 μL de mídia quente à pelota de célula congelada no rotor e células resusgasentas. Retire a suspensão com uma pipeta e misture a suspensão com 100 μL de mídia.
- Remova 10 μL de suspensão celular e misture com o mesmo volume de 0,4% de solução azul trypan (v/v). Incubar em temperatura ambiente por 30 a 1 min.
- Medir a viabilidade usando o contador automático de células.
Resultados
A inserção criogênica de amostras pré-congeladas de células mamíferas no espectrômetro NMR suporta viabilidade durante todo o experimento NMR. Esquemas de transferência criogênica de uma amostra congelada em uma sonda NMR pré-resfriada é mostrado na Figura 1. A viabilidade celular e a inintegridade podem ser avaliadas usando uma variedade de métodos. Aqui usamos uma medida padrão baseada em corante da integridade da membrana, que se alinha bem com outros métodos23. Células intactas são impermeáveis ao azul trypan enquanto células com integridade de membrana comprometida são permeáveis. O número de células permeáveis e impermeáveis do trypan azul pode ser rapidamente avaliado usando um contador automatizado de células. Usando o protocolo descrito aqui, a permeabilidade azul trippan das células mamíferas após o MAS NMR (ou seja, no ponto 5.2.3) é semelhante à permeabilidade azul tripupan das células mamíferas antes de qualquer mudança de temperatura (ou seja, ponto 2.1.3). No entanto, se as células são congeladas lentamente, então aquecidas à temperatura ambiente antes da inserção (ou seja, seguindo o protocolo para o ponto 3 antes de aquecer o rotor à temperatura ambiente antes de inserir na sonda refrigerada), a viabilidade celular avaliada pelo azul trypan diminui para menos de 10% das células(Figura 2). Assim, o congelamento de células dentro do espectrômetro resulta na perda da integridade da membrana celular, enquanto a inserção criogênica de amostras congeladas de células mamíferas suporta a viabilidade celular durante todo o experimento de RMN.

Figura 1: Esquema de transferência criogênica de uma amostra congelada em uma sonda NMR pré-resfriada. (A) Aproxime-se da superfície do nitrogênio líquido e desaparafusar o topo do frasco criogênico. (B) Deslize o rotor para o banho de nitrogênio líquido. (C) Submerse um tubo de microcentrífuga usando pinças e segure-o no lugar até esfriar completamente. (D) Insira o rotor no microcentrifuso com a ponta da unidade voltada para a parte inferior do tubo. Empurre, em vez de agarrar, com a pinça. (E) Segure o tubo de microcentrifuuge logo abaixo da superfície do banho de nitrogênio líquido e inspecione visualmente o rotor para garantir que ele esteja livre de geada e bem marcado. (F) Segure o apanhador de amostras em um ângulo acima da superfície. (G) Retire o apanhador de amostras e o tubo do nitrogênio líquido assim que o apanhador de amostras estiver dentro do tubo de microcentrifuuagem. (H) Agite o apanhador de amostras se o rotor estiver preso na borda. (I) Remova o apanhador de amostras vazio da sonda e coloque-o no chão. (J) Remova o tubo de microcentrifutura do receptor de amostras com o rotor dentro, insira, aperte o apanhador de amostras na sonda e pressione "INSERT" no console de controle. Clique aqui para ver uma versão maior desta figura.
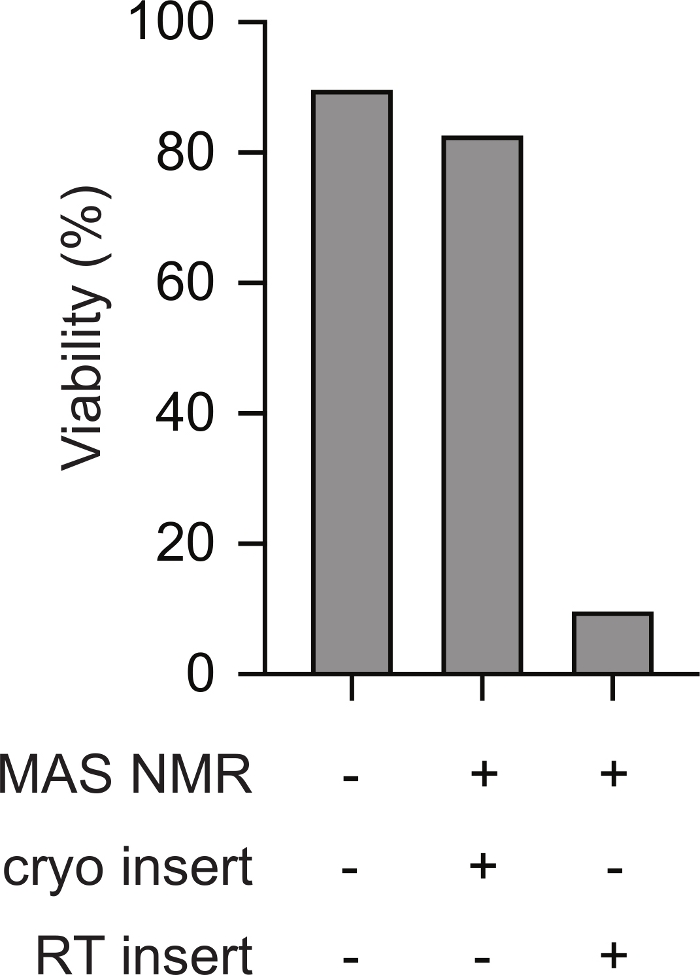
Figura 2: A inserção criogênica de uma amostra pré-congelada de células mamíferas resulta em medições de intactidade celular semelhantes às amostras de células mamíferas que nunca foram congeladas. A porcentagem de células impermeáveis azuis para amostras que nunca foram congeladas (por exemplo, passo 2.1.3) é semelhante à das células para amostras após MAS NMR (por exemplo, passo 5.2.3 com 12 kHz MAS). As células congeladas lentas (por exemplo, passo 3) que foram aquecidas à temperatura ambiente antes da inserção no instrumento NMR que havia sido pré-resfriado para 100 K tinham percentuais muito menores de células intactas após MAS NMR com MAS de 12 kHz. Clique aqui para ver uma versão maior desta figura.
Discussão
A transferência criogênica de amostras congeladas em um espectrômetro NMR é bem sucedida em preservar a viabilidade das células de mamíferos congelados através da aquisição de dados NMR. O sucesso dessa metodologia é demonstrado em medições de viabilidade pré e pós-MAS NMR. Esta abordagem é bem sucedida e generalizável para qualquer sistema onde flutuações de temperatura possam comprometer a integridade da amostra. O protocolo apresentado atualmente é realizado com a linha de células HEK 293. Como as condições de criopreservação para muitas linhas de células de mamíferos são muito semelhantes, é provável que as condições aqui relatadas sejam traduzíveis para outros sistemas celulares; no entanto, podem exigir maior otimização dos crioprotetores, volumes amostrais e taxas de congelamento para alcançar os mesmos resultados.
Essa metodologia pode ser melhorada desempacotando o rotor mais rápido pós-NMR. Esta etapa é atualmente sub ideal e sua execução afeta a viabilidade das células. Antes que as células possam ser resuspendidas em mídia, a ponta da unidade e o plugue de silício devem ser removidos do rotor. A amostra descongela de forma irregular quando o rotor é mantido durante a remoção da ponta da unidade e o plugue de silício de modo tão curto os tempos de manuseio do rotor resultam em maiores viabilidades. O desenvolvimento de suportes de rotor ou outras ferramentas para facilitar o descongelamento uniforme e a remoção rápida da ponta da unidade e o plugue de silício ajudaria a tornar a avaliação pós-NMR da viabilidade mais precisa.
A abordagem do carregamento de amostras criogênicas descrita neste artigo limita-se a sondas NMR que suportam a inserção e ejeção da amostra com a sonda no suporte do ímã NMR. Embora a inserção e a ejeção de amostras externas seja padrão para sistemas DNP comerciais, os testes personalizados nem sempre têm essa opção. Além disso, essa abordagem para o carregamento de amostras criogênicas pode exigir alguma modificação para sondas NMR construídas para serem compatíveis com rotores de tamanho diferente. Este protocolo foi otimizado para rotores de 3,2 mm e pode exigir modificação se o diâmetro externo do receptor de amostra exceder o diâmetro interno de um tubo de microcentrída (por exemplo, passo 3.4.2).
Com a aplicação de DNP ao MAS NMR, agora é possível detectar proteínas e outras biomoléculas em concentrações fisiológicas endógenas24,25,26. Isso abre a possibilidade de estudar biomoléculas em seus ambientes nativos. A manutenção da integridade celular e da viabilidade ao longo do experimento provavelmente será fundamental para conectar os resultados experimentais da espectroscopia a fenômenos biológicos. O congelamento descontrolado de amostras contendo proteínas purificadas ou lises celulares normalmente não compromete a qualidade da amostra7,27, embora existam algumas indicações de que a taxa de congelamento pode ser uma variável importante mesmo nos sistemas purificados28. No entanto, amostras de células mamíferas precisam ser congeladas a uma taxa controlada se preservar a intactidade e a viabilidade celular é importante para a interpretação. Aqui apresentamos um protocolo para congelar e transferir amostras congeladas de células mamíferas para um instrumento de NMR DNP MAS pré-resfriado que evita flutuações de temperatura potencialmente prejudiciais e suporta a medição em células viáveis.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho foi apoiado por doações do Cancer Research Prevention & Research Institute of Texas [RR150076], a National Science Foundation [1751174]; os Institutos Nacionais de Saúde [NS-111236], a Fundação Welch [1-1923-20170325]; a Fundação Lupe Murchison, a Fundação Ted Nash Long Life e a Kinship Foundation (Searle Scholars Program) para k.K.F.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.4% Trypan blue stain | Invitrogen | T10282 | |
| 100 mm cell culture dish | Thomas Scientific | 430167 | |
| 150 mm cell culture dish | Nunc | 157150 | |
| 3.2 mm sapphire rotor | Bruker | ||
| 45 ° angled forceps | Hampton Research | HR4-859 | |
| AMUPol | Cortecnet | C010P005 | |
| Black and Silver marker | Sharpie | ||
| Cap removal tool | Bruker | HZ16913 | |
| Cell culture grade water | HyClone | SH30529.03 | |
| Ceramic cap | Cortecnet | HZ12372 | |
| CoolCell | Corning/ Biocision | UX-04392-00 (Corning) / BCS-405 (Bioscion) | |
| Countess Cell Counting Chamber Slides | Invitrogen | C10288 | |
| Countess II automated cell counter | Invitrogen | AMQAF1000 | |
| Cryogen tubes | Nalgene | 03-337-7Y | |
| d8-glycerol | Aldrich | 447498 | |
| Deuterium oxide, 99.8 % atom D | Aldrich | 756822-1 | |
| DMEM | Gibco | 10569-010 | |
| DNP NMR system with frequency-matched gyrotron | Bruker | ||
| Foam dewar | Spearlab | FD-800 | |
| Kimwipes | Kimwipes | ||
| Packing tool | Bruker | ||
| Pen-Strep | Gibco | 15140-122 | |
| Powdered PBS | VWR | VWRRV0780 | |
| Protonated PBS | Gibco | 10010-023 | |
| Silicon plug | Bruker | B7089 | |
| Standard Vessel forceps | |||
| Tryp-L | Gibco | 12605010 |
Referências
- Costello, W. N., Xiao, Y., Frederick, K. K. DNP-Assisted NMR Investigation of Proteins at Endogenous Levels in Cellular Milieu. Methods Enzymology. 615 (1), 373-406 (2019).
- Hall, D. A., et al. Polarization-Enhanced NMR Spectroscopy of Biomolecules in Frozen Solution. Science. 276 (5314), 930-932 (1997).
- Akbey, Ü, Oschkinat, H. Structural biology applications of solid state MAS DNP NMR. Journal of Magnetic Resonance. 269 (1), 213-224 (2016).
- Matsuki, Y., et al. Helium-cooling and -spinning dynamic nuclear polarization for sensitivity-enhanced solid-state NMR at 14T and 30K. Journal of Magnetic Resonance. 225 (1), 1-9 (2012).
- Miyamoto, Y., Ikeuchi, M., Noguchi, H., Hayashi, S. Long-term Cryopreservation of Human and other Mammalian Cells at -80 °C for 8 Years. Cell Medicine. 10 (1), 1-7 (2018).
- Lopez del Amo, J. M., Schneider, D., Loquet, A., Lange, A., Reif, B. Cryogenic solid state NMR studies of fibrils of the Alzheimer's disease amyloid-β peptide: perspectives for DNP. Journal of Biomolecular NMR. 56 (4), 359-363 (2013).
- Gupta, R., et al. Dynamic nuclear polarization enhanced MAS NMR spectroscopy for structural analysis of HIV-1 protein assemblies. The Journal of Physical Chemistry B. 120 (2), 329-339 (2016).
- Lim, B. J., Ackermann, B. E., Debelouchina, G. T. Targetable Tetrazine-Based Dynamic Nuclear Polarization Agents for Biological Systems. ChemBioChem. 21 (9), 1315-1319 (2020).
- Jaudzems, K., et al. Dynamic nuclear polarization-enhanced biomolecular NMR spectroscopy at high magnetic field with fast magic-angle spinning. Angewandte Chemie International Edition. 57 (25), 7458-7462 (2018).
- Chaytor, J. L., et al. Inhibiting ice recrystallization and optimization of cell viability after cryopreservation. Glycobiology. 22 (1), 123-133 (2012).
- Mazur, P. Kinetics of water loss from cells at subzero temperatures and the likelihood of intracellular freezing. The Journal of General Physiology. 47 (2), 347-369 (1963).
- Lovelock, J. E., Bishop, M. W. H. Prevention of Freezing Damage to Living Cells by Dimethyl Sulphoxide. Nature. 183 (4672), 1394-1395 (1959).
- Bald, W. B. The relative merits of various cooling methods. Journal of Microscopy. 140 (1), 17-40 (1985).
- Akiyama, Y., Shinose, M., Watanabe, H., Yamada, S., Kanda, Y. Cryoprotectant-free cryopreservation of mammalian cells by superflash freezing. Proceedings of the National Academy of Sciences. 116 (16), 7738-7743 (2019).
- Shi, M., et al. High-throughput non-contact vitrification of cell-laden droplets based on cell printing. Scientific Reports. 5 (1), 17928(2015).
- Pegg, D. E. Principles of cryopreservation. Methods in Molecular Biology. 1257, 3-19 (2015).
- Ramilo, C., et al. Detection of the covalent intermediate of UDP-N-acetylglucosamine enolpyruvyl transferase by solution-state and time-resolved solid-state NMR spectroscopy. Biochemistry. 33 (50), 15071-15079 (1994).
- Jeon, J., Thurber, K. R., Ghirlando, R., Yau, W. M., Tycko, R. Application of millisecond time-resolved solid state NMR to the kinetics and mechanism of melittin self-assembly. Proceedings of the National Academy of Sciences. 116 (34), 16717(2019).
- Pievo, R., et al. A rapid freeze-quench setup for multi-frequency EPR spectroscopy of enzymatic reactions. Chemphyschem. 14 (18), 4094-4101 (2013).
- Cherepanov, A. V., de Vries, S. Microsecond freeze-hyperquenching: development of a new ultrafast micro-mixing and sampling technology and application to enzyme catalysis. Biochimica et Biophysica Acta (BBA) - Bioenergetics. 1656 (1), 1-31 (2004).
- Hu, K. N., Tycko, R. What can solid state NMR contribute to our understanding of protein folding. Biophysical Chemistry. 151 (1), 10-21 (2010).
- Hu, K. N., Yau, W. M., Tycko, R. Detection of a transient intermediate in a rapid protein folding process by solid-state nuclear magnetic resonance. Journal of the American Chemical Society. 132 (1), 24-25 (2010).
- Johnson, S., Nguyen, V., Coder, D. Assessment of cell viability. Current Protocols in Cytometry. 64 (1), 1-26 (2013).
- Frederick, K. K., et al. Sensitivity-enhanced NMR reveals alterations in protein structure by cellular milieus. Cell. 163 (3), 620-628 (2015).
- Van Der Cruijsen, E. A. W., et al. Biomolecular DNP-supported NMR spectroscopy using Site-directed spin labeling. Chemistry. 21 (37), 12971-12977 (2015).
- Schlagnitweit, J., et al. Observing an antisense drug complex in intact human cells by in-cell NMR spectroscopy. ChemBioChem. 20 (19), 2474-2478 (2019).
- Debelouchina, G. T., et al. Dynamic nuclear polarization-enhanced solid-state NMR spectroscopy of GNNQQNY nanocrystals and amyloid fibrils. Physical Chemistry Chemical Physics : PCCP. 12 (22), 5911-5919 (2010).
- Schmidt, T., et al. Submillisecond freezing permits cryoprotectant-free EPR doubled electron-electron resonance spectroscopy. ChemPhysChem. 21, 1224-1229 (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados