Method Article
使用过滤和超速离心分离和表征人脂肪细胞来源的细胞外囊泡
摘要
我们描述了使用过滤和超速离心从臀部和腹部脂肪组织中分离人脂肪细胞衍生的细胞外囊泡 (EV)。我们通过纳米颗粒追踪分析和蛋白质印迹确定分离的脂肪细胞衍生的 EV 的大小和浓度来表征分离的脂肪细胞衍生的 EV 是否存在 EV 蛋白肿瘤易感基因 101 (TSG101)。
摘要
细胞外囊泡 (EV) 是脂质封闭的包膜,携带生物活性物质,如蛋白质、RNA、代谢物和脂质。EV 可以在组织微环境中局部或通过释放到外周血中来调节其他细胞的细胞状态。脂肪细胞来源的 EV 在外周血中升高,并在代谢紊乱(包括肥胖和糖尿病)期间显示其货物(RNA 和蛋白质)发生变化。脂肪细胞来源的 EV 可以调节邻近血管细胞的细胞状态,例如内皮细胞和脂肪组织驻留巨噬细胞,以促进脂肪组织炎症。研究体内脂肪细胞来源的 EV 的改变很复杂,因为来自外周血的 EV 具有高度异质性,并且包含来自其他来源的 EV,即血小板、内皮细胞、红细胞和肌肉。因此,人脂肪细胞的培养为脂肪细胞来源的 EVs 的研究提供了一个模型系统。在这里,我们提供了使用过滤和超速离心从人臀部和腹部脂肪细胞的细胞培养基中提取总小 EV 的详细方案。我们进一步证明了纳米颗粒跟踪分析 (NTA) 用于定量 EV 大小和浓度,并显示臀部和腹部脂肪细胞衍生的 EV 中存在 EV 蛋白肿瘤易感基因 101 (TSG101)。从该方案中分离的 EV 可用于下游分析,包括透射电子显微镜、蛋白质组学、代谢组学、小 RNA 测序、微阵列,并可用于体外/体内功能性研究。
引言
细胞外囊泡 (EV) 是脂质封闭的包膜,携带生物活性物质,如蛋白质、microRNA、代谢物和脂质。术语 EV 表示各种亚群,包括外泌体、微泡(微粒/胞外体)和凋亡体1。EV 可能用作生物标志物,因为它们与病理信号有关并释放到生物流体中,包括血液和尿液。EV 可以在组织微环境中局部或通过释放到外周血中来调节其他细胞的细胞状态2。EV 具有其亲本细胞的特征,但每个亚群的分化主要基于 EV 大小和蛋白质含量,例如 EV 标志物,包括存在四跨膜蛋白(CD9、CD63 和 CD81)、肿瘤易感基因 101 (TSG101) 和 ALG-2 相互作用蛋白 X (ALIX)。这些蛋白质标志物代表外泌体的内体来源(CD9、CD63 和 CD81),外泌体在多泡体内产生,或代表与直接从微泡质膜出芽或起泡相关的蛋白质。然而,这些亚群之间存在显著重叠,并且很难区分血浆、血清或尿液等复杂生物流体中的单个亚群。
代谢紊乱,包括肥胖、胰岛素抵抗以及细胞外葡萄糖、氧气和炎症的扰动,可以改变 EV 及其货物的大小和浓度。脂肪细胞来源的 EV 携带 Perilipin A、脂联素,并在肥胖和糖尿病期间显示其蛋白质和 RNA 转运蛋白发生变化 3,4,5,6。脂肪细胞来源的 EV 调节邻近血管内皮细胞7 和脂肪组织驻留巨噬细胞的细胞状态,以促进脂肪组织炎症和胰岛素抵抗 8,9,10,11。研究体内脂肪细胞来源的 EV 的改变很复杂,因为来自复杂生物流体(如血浆、血清或尿液)的 EV 群体包含来自多种来源的 EV,例如血小板、内皮细胞、红细胞和肌肉,这些来源与代谢功能障碍和疾病的发病机制有关。
因此,人前脂肪细胞的培养和体外分化为脂肪细胞来源的 EV 的研究提供了一个模型系统。在这里,我们提供了使用注射器过滤和超速离心从人脂肪细胞的细胞培养基中提取总小 EV 的详细方案。超速离心仍然是 EV 的一种流行的分离方法,因为它很容易获得并且几乎不需要事先的专业知识。然而,其他方法(如沉淀、尺寸排阻色谱和使用 tetraspanins 的免疫亲和捕获)能够从一系列生物流体中分离 EV,包括血浆、血清、尿液和条件细胞培养基。每种方法(包括此处描述的超速离心方案)都会产生不同纯度的 EV 制剂,因为这些方法可以共分离可溶性蛋白质和脂蛋白,这些蛋白质和脂蛋白可能会掩盖为 EV。将这种超速离心方案与其他方法(如密度离心、尺寸排阻色谱和免疫亲和捕获)相结合,可显著提高分离的 EV 的纯度。但与超速离心类似,这些其他方法不允许从复杂样品(如血液、血浆和尿液)中捕获独立的 EV 亚群。因此,选定细胞群的培养仍然是产生高产量细胞特异性 EV 的最稳健方法之一。每种 EV 方法都有许多注意事项,方法的选择会影响分离的 EV 类型及其浓度,这可能会使下游对细胞和组织信号转导的机制研究以及 EV 货物的确定产生偏差,以进行诊断研究;EV 隔离的这些方法问题将在其他地方和 4,12 下面的限制部分中讨论。在这里,我们描述了使用过滤和超速离心分离人脂肪细胞来源的 EV。我们进一步证明了使用纳米颗粒示踪分析 (NTA) 来量化 EV 的大小和浓度,并显示了我们的人脂肪细胞衍生的 EV 中存在 EV 蛋白肿瘤易感基因 101 (TSG101)。从该方案中分离的 EV 可用于下游分析,包括透射电子显微镜、蛋白质组学、代谢组学、小 RNA 测序、微阵列,并可用于体外/体内功能性研究。
研究方案
所有方法均已获得牛津大学机构伦理审查委员会的批准。健康志愿者在局部麻醉下通过穿刺活检获得脂肪组织。
1. 细胞培养基和缓冲液的制备
- 通过将胶原酶 H (1 mg/mL) 溶解在 Hanks 平衡盐溶液 (HBSS)(不含氯化钙和氯化镁)中,并使用 0.2 μm 孔径注射器过滤器制备无菌过滤器。
- 使用前不超过 10 分钟准备胶原酶消化缓冲液。
- 如下制备生长培养基 (GM):Dulbecco 改良 Eagle 培养基/Ham's 营养混合物 F12 (DMEM/F12),补充有 10% 胎牛血清 (FBS)、100 单位/mL 青霉素、100 μg/mL 链霉素、2 mM L-谷氨酰胺和 0.5 ng/mL 成纤维细胞生长因子 (FGF)。
- 按如下方式制备碱性分化培养基(碱性 DM):补充有 100 单位/mL 青霉素、100 μg/mL 链霉素、2 mM L-谷氨酰胺、17 μM 泛酸钠、100 nM 人胰岛素、10 nM 三碘-L-甲状腺原氨酸、33 μM 生物素、10 μg/mL 转铁蛋白和 1 μM 地塞米松的 DMEM/F12。
- 通过在步骤 1.3 中的碱性 DM 中补充 0.25 mM 3-异丁基-1-甲基黄嘌呤和 4 μM 曲格列酮来制备完全分化培养基(完全 DM)。
- 制备 10 mM 脂肪酸储备溶液,与 10% 基本不含脂肪酸的牛血清白蛋白 (BSA) 复合,如下所示。
- 将 16 g BSA 溶解在 160 mL DMEM/F12 培养基中,并加热至 37 °C。 在三个独立的 50 mL 锥形管中,称取 150 mg 油酸钠、139 mg 棕榈酸钠和 151 mg 亚油酸钠。向每个试管中加入 50 mL 加热的 BSA 溶液,并通过反复涡旋充分混合。
- 将油酸盐和亚油酸盐管放回 37 °C 水浴中 15 分钟。涡旋混合直至完全溶解。
- 对于棕榈酸酯溶液,将试管置于 65 °C 水浴中 2-3 分钟。涡旋剧烈混合。
- 重复步骤 1.5.3 直到完全溶解 - 大约 30 分钟。
注意:一些小颗粒可能仍然可见。 - 使用 0.2 μm 孔径注射器过滤器对脂肪酸溶液进行无菌过滤。
- 使用适当的测定法确认每种储备液的非酯化脂肪酸浓度。
注:脂肪酸原液应为 10 mM (±10%),以使脂肪酸和 BSA 之间的摩尔比为 6:1。如果浓度超出此范围,则应重新配制储备液。储备溶液可以等分并储存在 -30 °C。
2. 人体脂肪组织活检的消化
- 通过连接到 50 mL 锥形管的 200 μm 无菌细胞过滤器缓慢过滤活检注射器的内容物,以便脂肪组织收集在过滤器中。
- 将过滤器转移到新的 50 mL 锥形管中,并用 10 mL HBSS 洗涤脂肪组织 3 次。
注:可能需要用手术剪刀去除血凝块和纤维组织,或重复 HBSS 洗涤以去除多余的红细胞。 - 称量洗过的纸巾。
注意:我们通常通过穿刺活检获得 400-800 mg 组织。 - 将胶原酶消化缓冲液放入无菌 50 mL 锥形管中,并加入洗涤过的组织。在此步骤中可以使用手术剪刀将组织切成大小相等的块。
注:每 0.5 g 组织使用 5 mL 缓冲液。对于较大的组织,样品可以在培养皿中切碎。 - 将试管放入 37 °C 振荡水浴中并孵育 35-40 分钟。
注意:成功消化后,溶液应呈乳白色。如果小块组织仍然可见,请用手再摇晃 10-20 秒。
3. 前脂肪细胞的分离
- 要沉淀前脂肪细胞组分,请以 1,000 x g 离心 5 分钟。
- 吸出并丢弃漂浮的脂肪细胞层和上清液,留下大约 1 mL 的 HBSS 覆盖细胞沉淀。
- 将沉淀重悬于 5 mL HBSS 中,并将细胞悬液通过 250 μm 孔径的网孔,然后通过 100 μm 网孔,以去除任何未消化的材料。将细胞悬液收集在 15 mL 锥形管中。
- 以 1,000 x g 离心 5 分钟。
注:在此步骤之后,如果红细胞污染是一个问题,可以用红细胞裂解液处理前脂肪细胞组分。 - 吸出并丢弃上清液。
- 将细胞沉淀重悬于 5 mL GM 中(步骤 1.2),并接种到 25 cm2 贴壁组织培养瓶中。将培养瓶置于细胞培养箱(5% CO 2,37 °C)中。
4. 维持前脂肪细胞培养物
- 在细胞增殖时每 2 天更换一次 GM
注:细胞增殖速率可能因供体而异。- 当细胞达到大约 80% 汇合时,将它们转移到 75 cm2 贴壁组织培养瓶中。去除 GM 并用磷酸盐缓冲盐水 (PBS) 洗涤细胞。
- 弃去 PBS 并加入 0.5 mL 高度纯化的细胞解离酶以解离附着的细胞。在 37 °C 孵育 5 分钟。
- 用力敲击培养瓶以释放细胞并加入 5 mL GM。将细胞悬液收集在 15 mL 锥形管中。
- 以 1,000 x g 离心 5 分钟。
- 吸出并丢弃上清液。将细胞沉淀重悬于 5 mL GM 中,并转移到 75 cm2 培养瓶中。将 GM 加满至最终体积为 12 mL,然后更换细胞培养箱中的培养瓶(5% CO 2,37 °C)。
注意:要维持细胞,请继续每 2-3 天更换一次 GM。当细胞达到 80% 汇合时,重复步骤 4.2-4.3 并将细胞 1:3 分装到新的 75 cm2 烧瓶中。可以重复多次传代,直到为实验设置生成足够数量的细胞。我们不建议超过 10 代,因为前脂肪细胞的增殖和分化能力会下降。
5. 接种前脂肪细胞以进行成脂分化
- 使用血细胞计数器计数细胞,并将 200,000 个细胞接种到 2 mL GM 中 6 孔板的多个孔中。或者,在 22 mL GM 培养基中每 175 cm2 培养瓶接种 350 万个细胞。
- 让细胞再增殖 2-4 天,直到它们完全汇合,从而在培养的第二天改变 GM。
- 要开始成脂分化,请去除 GM 并用完全 DM 替换 4 天(6 孔板每孔 2 mL 完全 DM 或 175 cm2 培养瓶每 22 mL)。
注意:第 2 天更换为新鲜的完全 DM。 - 第 4 天,去除完整的 DM 并替换为 2 mL 补充有 22.5 μM 油酸盐、15 μM 棕榈酸酯和 12.5 μM 亚油酸酯的碱性 DM,得到 6 孔板每孔 50 μM 的总脂肪酸浓度或 22 mL(175 cm2 烧瓶)。每 2 天更换一次介质,再持续 10 天。
注意:从第 7 天开始,脂质滴应在分化的前脂肪细胞中可见。 - 在培养第 14 天,从细胞中收集培养基以分离脂肪细胞来源的 EV。
6. 用于细胞外囊泡分离或储存和未来细胞外囊泡分离的细胞培养上清液的制备
- 从每个 6 孔板中取出细胞培养上清液并合并。加入 15 mL 试管中,或从 175 cm2 培养瓶中去除所有细胞培养上清液,然后加入 50 mL 试管中。
- 在 4 °C 下以 1000 x g 离心 10 分钟。
- 分别倾倒将上清液倒入新的干净的 15 mL 或 50 mL 试管中。
- 取出 10 mL 注射器的针筒,并连接 0.45 μm 注射器过滤器。
- 将上清液倒入注射器储液槽中,用拇指或手掌轻轻按压注射器桶开口,直到细胞培养上清液自由通过过滤器。
注:此过滤步骤的速度可能因针式过滤器的类型而异。 - 将滤液收集在干净的 50 mL 试管中。
注意:如果需要,此时可以将经过调节的过滤培养基在 -80 °C 下储存数周。需要时,将细胞培养上清液在4°C下解冻,并在4°C下以1000× g 离心10分钟。 在继续进行 EV 分离之前,将上清液倒入干净的试管中。
7. 细胞外囊泡的分离
- 通过在管底部画一个圆圈来标记 13 mL 超速离心管,预期 EV 颗粒将在其中形成,并在管颈周围标记一条线,以便在超速离心管转子中定位。用样品标识符标记试管。
- 将试管放入试管架中。
- 将 16 G 针头连接到 10 mL 注射器上,然后取出注射器针筒。
- 从针头上取下保护盖,将针头插入超速离心管的颈部。
- 将细胞培养上清液直接倒入注射器桶中,以填充超速离心管。
- 根据需要用 PBS 加满试管直至装满。
注意:如有必要,让管子略微溢出,确保超速离心管中没有空气空间,也没有气泡。 - 使用烙铁密封超速离心管,轻轻挤压管子,确保管子气密。
- 将超速离心管放入超速离心转子中;确保在管顶部标记的线和在管底部绘制的圆圈朝外,EV 颗粒将在这里形成。
- 在 4 °C 下以 120,000 x g 超速离心 2 小时。
- 小心地从超速离心机上取下转子。
- 从转子上取下超速离心管,并放入试管架中。
- 将 16 G 针头连接到 10 mL 注射器上。
- 刺穿超速离心管的顶部,将针头插入管顶部 2 cm,然后将上清液吸入注射器中。
- 将这种去除 EV 的上清液倒入 1.5 mL 试管中,并在 -80 °C 下冷冻。
- 将针头重新插入试管中,小心吸出剩余的上清液并丢弃。
- 用剪刀剪断管子的顶部。
- 快速倒出剩余的上清液。
- 让试管倒挂 1 分钟。
- 用纸巾拍干试管上形成的任何液体。
- 倒置试管并放入试管架中。
- 向试管中加入 100 μL PBS。
- 使用移液管的尖端,在步骤 7.1 中标记的区域内以圆周运动轻轻地将 EV 颗粒移出管底。
- 短暂(1-2 秒)涡旋两次。
- 通过在管底部画一个圆圈来标记新的 13 mL 超速离心管,预期 EV 颗粒将在其中形成,并在管颈周围标记一条线,以便在超速离心管转子中定位。用样品标识符标记试管。
- 将试管放入试管架中。
- 使用干净的注射器和针头将 12 mL PBS 添加到新的超速离心管中。
- 使用注射器和针头收集 100 μL EV 样品并添加到试管中。小心混合 EVS 和 PBS,轻轻收集 PBS 并吸入管中,冲洗注射器和针头。
注意:避免产生气泡。 - 使用烙铁密封超速离心管,轻轻挤压管子,确保管子气密。
- 将超速离心管放入超速离心转子中;确保在管顶部标记的线和在管底部绘制的圆朝外。
- 在 4 °C 下以 120,000 x g 超速离心 1 小时。
- 小心地从超速离心机上取下转子。
- 将 16 G 针头连接到 12 mL 注射器上。
- 刺穿超速离心管的顶部,将针头插入管顶部 2 cm;将上清液吸入注射器中并丢弃。
- 用剪刀剪断管子的顶部。
- 快速倒出剩余的上清液。
- 让试管倒挂 1 分钟。
- 拍干管边缘形成的任何液体。
- 将试管放入试管架中。
- 向试管中加入 100 μL PBS。
- 使用移液管的尖端,在步骤 7.24 中标记的区域内以圆周运动轻轻地将 EV 颗粒移出管底。
- 短暂(1-2 秒)涡旋两次。
- 将 100 μL PBS/EV 溶液移液到干净的 1.5 mL 试管中,并保持在湿冰上。
注:EV 可直接用于下游加工,可冷冻并储存在 -80 °C 下。
8. 使用纳米颗粒跟踪分析 (NTA) 测定 EV 大小和浓度
- 准备系统
注意:Mehdiani 等人报道了使用纳米粒子跟踪分析 (NTA) 测定 EV 大小和浓度的详细方法13。- 解冻样品并将其保持在 4 °C。
- 单击软件图标启动 NTA 软件。
- 软件将在 “cell check” 中打开,并提示用去离子水填充流通池。用去离子水填充 10 mL 注射器并推入机器,确保没有气泡进入加载室。
- 按照屏幕上的说明准备系统以进行质量检查 (QC)。该软件将执行细胞检查并给出细胞质量的测量。这应该是非常好到优秀。
- 准备由 100 纳米聚苯乙烯珠组成的质量控制。将 1 μL 标准品移液到 999 μL 去离子水(稀释储备液)中。随后,将 10 μL 稀释储备液添加到 2.5 mL 去离子水(QC 样品)中。通过轻轻涡旋 2-3 秒和移液来混合溶液。
注:质量控制样品应每天新鲜制备,但初始稀释的储备样品在 4 °C 下可稳定保存 1 周。 - 将 1 mL QC 样品填充到 1 mL 注射器中,并去除注射器中的所有气泡。
- 通过将注射器的尖端轻轻倾斜到进样室中,同时推动柱塞,在不引入气泡的情况下注入 NTA 样品加载室。将多达 950 μL 的 QC 样品注入腔室。
注意:请勿将气泡引入样品装载室。 - 等待软件执行自动对准(聚焦相机)并检查 Z 电位读数的电压 - 电压图应为平滑的 U 形曲线。
注意: 如果出现错误消息“voltage too low error”,则电池可能因清洁而湿润或不牢固,或者可能存在气泡。 - 自动对准/电压检查完成后,使用相机位置下拉菜单检查所有位置 (0.1-0.9) 是否有异常痕迹 - 这些痕迹的存在表明电解池可能需要冲洗和/或清洁。QC 后,系统将显示“准备测量”。
- 用 PBS 灌注流通池。打开 Pump/Temp 选项卡,然后在 Pump 下,单击 Run for pump 2 (PBS reservoir) 。这将使 PBS 通过细胞运行 1 分钟,然后自动停止。
注:腔室中可能存在颗粒,但可以通过将 10 mL PBS 推入加载端口来清除这些颗粒。 - 用 PBS 填充 10 mL 注射器,然后装入无气泡的腔室。
- 为设备创建一个要运行的协议,该协议将测量激光的多个位置并平均每帧的粒子数。
- 在继续之前,请检查颗粒计数是否小于 5(尽可能接近 0)- 如有必要,用更多的 PBS 冲洗。
- 稀释前,通过移液混合 EV 样品。
- 在 PBS 中以 1:1,000 的比例稀释样品,并通过移液混合。将样品填充到 1 mL 注射器中,然后装入无气泡的腔室中。
- 检查粒子计数是否在可接受的范围内(计数值上方的条形应位于绿色区域或接近绿色区域)。如果没有,请相应地调整样品稀释度。在样品和样品稀释之间,将 10 mL PBS 加载到机器前部以清理腔室,然后加载 1 mL 稀释的样品。
注:每个样品将根据样品的浓度进行独立稀释。设备的颗粒计数应在每帧 50-200 个颗粒之间,以便准确测量。 - 前往 测量 软件中的选项卡。
- 单击 Run video acquisition 按钮。
- 输入样本名称并选择目标文件夹以保存测量结果。
- 创建 EV 标准作程序 (SOP)。
- 创建 > 保存 > 加载 一个 EV SOP,该 SOP 将以 100 的快门速度和 80 的相机灵敏度测量颗粒数量和大小,11 个相机位置持续 2 个周期。
注:除非样品有特殊要求,否则无需更改这些设置。 - 输入样品的稀释度并添加您想要添加的任何其他注释。
- 点击 OK 软件将自动开始录制。完成后,软件将自动加载一个弹出表,显示每个相机位置的平均颗粒数量和大小。
注意: 在此期间,请勿触摸机器或附近的台面,因为振动会影响最终读数。 - 具有统计异常读数的相机位置将被自动排除 - 要手动排除任何相机位置(或出于任何原因重新包含排除的相机位置),请单击样品详细信息左侧的复选框。
- 单击 “继续 ”,软件将创建并打开样品的 PDF,其中包含大小和浓度结果。
- 创建 > 保存 > 加载 一个 EV SOP,该 SOP 将以 100 的快门速度和 80 的相机灵敏度测量颗粒数量和大小,11 个相机位置持续 2 个周期。
- 统计分析
- 通过单向或双向方差分析和事后 Tukey 校正分析 NTA 数据。将数据绘制为组均值±标准差。P 值为 <0.05 被认为是显着的。
结果
我们按照描述的方案确定了从人臀脂肪细胞中分离的 EV 的数量。我们使用 NTA 计算了脂肪细胞来源的 EV 的大小和浓度(图 1A、B)。我们使用了假培养基对照,它们是等体积的培养基,这些培养基未与细胞接触,但经过培养并接受上述分离程序。我们测量了初始分离后和在 PBS 中洗涤分离的脂肪细胞 EV 后的脂肪细胞衍生的 EV 浓度(图 1A、B),并绘制了组均值±标准差 (SD),通过带有事后 Tukey 校正的双向方差分析进行分析。
NTA 从第 1 次 分离中测定的脂肪细胞来源的 EV 的浓度范围为 6.10 x 106 至 2.70 x 107 ,中位数为 2.60 x 107 EVs/mL(图 1 A、B)。PBS 洗涤后,每个样品中的脂肪细胞衍生 EV 显着减少(图 1A、B)(P < 0.001),范围为 5.00 x 105 至 4.30 x 106 ,中位数为 2.70 x 106 EVs/mL。假培养基对照不包含 NTA 确定的 EV(图 1A、B)。第一次分离的 EV 的模态大小在 PBS 洗涤后为 125 nm 和 105 nm(图 1A、B)。所述方案进一步应用于来自较大 T175 cm2 烧瓶的腹部和臀源性脂肪细胞。这些来自 T175 cm2 培养瓶的臀部 EV 样品的浓度范围为 3.60 x 107 至 7.50 x 107/mL,中位数为 5.40 x 107 EVs/mL。来自 T175 cm2 烧瓶的腹部脂肪细胞来源的 EV 浓度范围为 6.30 x 107 至 8.60 x 107/mL,中位数为 7.60 x 107 EVs/mL(图 1C、D)。来自 T175 cm2 培养瓶的 EV 的模态大小为臀部 EV 为 115 nm,腹部 EVs 为 125 nm。我们通过免疫印迹肿瘤易感基因 101 (TSG101) 证实了臀部和腹部来源的 EV 中存在 EV 蛋白,并发现腹部和臀部脂肪细胞沉淀以及腹部和臀部脂肪细胞来源的 EV 对 TSG101 呈阳性,而作为未与细胞接触的假对照培养基呈阴性(图 1E)。
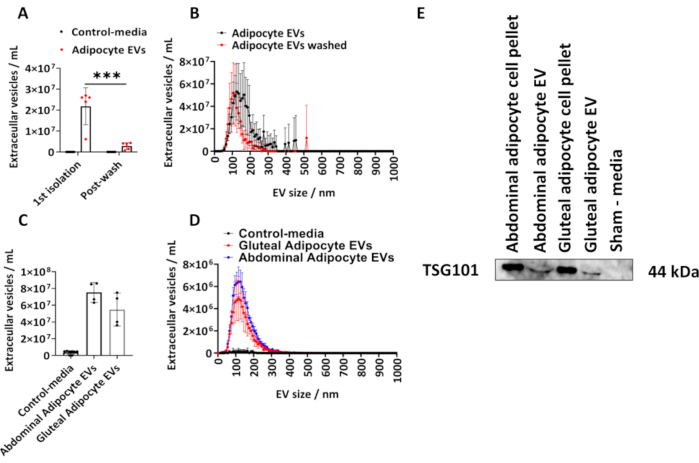
图 1:来自细胞培养基的脂肪细胞来源的 EV 的大小和分布曲线以及 EV 蛋白 TSG101 的测定。 通过纳米颗粒跟踪分析 (NTA) 从第 1 次 分离 (N = 5) 和用 PBS 洗涤 (N = 6) 后确定的总 EV 浓度、大小和浓度分布曲线。(C) NTA 确定的来自 T175cm2 烧瓶的腹部和臀部来源的 EV 的总浓度和 (D) 大小和浓度分布曲线(每组 N = 4)。(E) TSG101 的臀部和腹部来源的 EVs 的蛋白质印迹。细胞沉淀和假培养基分别用作阳性和阴性对照。数据是标准差 (SD) ±组均值。具有事后 Tukey 校正的单向或双向方差分析。P < 0.001。 请单击此处查看此图的较大版本。
讨论
我们展示了从细胞培养上清液中分离臀部和腹部脂肪细胞衍生的 EV 的方案,并通过 NTA 7,14,15 确定它们的大小和浓度。我们表明,培养的人脂肪细胞产生 EV 并将其释放到细胞培养基中,随后可以使用过滤和超速离心进行分离。我们确定了分离的脂肪细胞来源的 EV 的大小和浓度曲线,并表明超速离心可能从细胞培养基中共分离污染物,并且在 PBS 中洗涤分离的 EV 沉淀会显着降低它们在第二次 NTA 测量中的浓度。我们通过蛋白质印迹对 EV 标志物 TSG101 进一步确定了分离的臀部和腹部衍生的 EVs 的纯度。臀部和腹部来源的 EV 制剂对 TSG101 呈阳性,但重要的是,在未暴露于细胞的对照培养基中不存在。所提出的实验使用人脂肪细胞作为产生 EV 的母细胞,但所描述的方法适用于其他细胞类型,包括内皮细胞、血管平滑肌、骨骼肌、免疫细胞,以及从患者血小板贫血浆或血清中分离 EV。
脂肪细胞来源的 EV 在代谢性疾病中升高,确定体内脂肪细胞 EV 的大小和数量的改变是复杂的,因为血液等生物液含有来自许多细胞来源的 EV,这些细胞来源也与代谢疾病的发病机制有关,包括来自内皮细胞、骨骼肌、红细胞和免疫细胞的 EV。此处描述的方法允许测定人脂肪细胞 EV,这可能为调查导致脂肪细胞中 EV 生物发生的因素的机制研究提供有用的模型,目前尚不清楚。重要的是,确定脂肪细胞 EV 生物发生以及脂肪细胞 EV 中特定 RNA、蛋白质和代谢物的负载如何编排,可能揭示在代谢功能障碍中扰乱致病性脂肪细胞 EV 信号传导的新治疗机会。详细的研究将更好地了解 EV 的大小、数量、生物发生途径和 EV 货物(RNA、蛋白质和代谢物)如何响应疾病或刺激(如氧气、葡萄糖、脂质和胰岛素的扰动)而改变。有关环境因素对代谢疾病中脂肪细胞 EV 信号传导的作用以及脂肪细胞衍生的 EV 如何导致脂肪组织炎症的信息可能揭示代谢疾病中的新治疗靶点。
局限性
脂肪细胞来源的 EV 的体外生成
在体外使用人前脂肪细胞提供了一个模型系统,用于研究体外脂肪细胞分化后脂肪细胞衍生的 EVs 的释放和产生,但存在许多局限性。特别是,体外来源的脂肪细胞 EV 可能与从生物体液(如血浆14 )中回收的脂肪来源的 EV 在大小、浓度、EV 蛋白、-RNA、-代谢物和功能方面有所不同。这些 EV 差异可能受到体内驻留在脂肪组织中的其他非脂肪细胞的影响,例如脂肪组织来源的干细胞、内皮细胞和巨噬细胞,它们与脂肪组织生理学密切相关,并在脂肪组织病理学中发挥作用,包括脂肪组织炎症。
应该注意的是,此处描述的 2 周体外分化方案可能不足以产生与体内观察到的脂肪细胞相当的完全成熟脂肪细胞;以二维 (2D) 形式生长的体外分化脂肪细胞显示出与体内细胞不同的形态,并且不会产生单房脂滴。此外,该方案中描述的前脂肪细胞是从脂肪基质血管部分获得的,我们尚未评估其他细胞类型对 EV 池的贡献,这些细胞类型在细胞分离过程中未完全消除。
脂肪细胞与脂肪组织中其他非脂肪细胞的重要细胞间相互作用的缺失可能会影响脂肪细胞 EV 的产生、释放、脂肪细胞的 EV 蛋白和 EV-RNA 以及脂肪组织来源的干细胞16。然而,尚未详尽评估体外衍生的脂肪细胞 EV 与体内产生的脂肪细胞 EV 有何不同。
原代组织活检含有血液,因此衍生的细胞培养物可能含有红细胞和红细胞衍生的 EV,无论我们的方案中强调的多次洗涤和培养基变化如何。在分离基质血管组分后,可能需要额外的红细胞裂解步骤,以消除红细胞对脂肪细胞的影响。这很重要,因为红细胞来源的 EV 会影响其他细胞的细胞功能17,而红细胞来源的 EV 在氧化应激18 和代谢综合征患者中升高19,20。因此,代谢性疾病患者来源的脂肪组织可能含有高水平的红细胞衍生 EV,这可能会影响脂肪细胞的体外表型。
消除 FBS
所描述的方案在成脂分化过程中利用生长培养基中的 FBS,但随后脂肪细胞在最终培养基收集之前受到多种培养基变化,以分离脂肪细胞衍生的 EV。因此,我们假设 EV 制剂中 FBS 衍生的 EV 污染的总体风险较低,随后通过 TSG101 的蛋白质印迹证实细胞培养基中不存在残留的 EV。从需要 FBS 的细胞来源中分离细胞培养的 EV 必须使用耗尽 EV 的 FBS 或通过超速离心耗尽牛 EV,以防止牛 EV 混杂脂肪细胞 EV 浓度和脂肪细胞 EV 货物分析。已知脂肪细胞血清的耗竭会改变它们的细胞反应21 ,因此研究必须确保血清中的血清耗竭或 EV 耗竭使其脂肪细胞培养物真正代表脂肪细胞生物学。
使用过滤和超速离心分离 EV 的技术限制
我们描述了一种使用一次性塑料管进行超速离心的方法,该方法需要在超速离心之前进行密封以进行 EV 分离。我们承认这些一次性密封管对许多人来说可能不是一个经济的选择,并建议探索类似的管子,这些管子不需要密封且可重复使用。然而,研究人员必须确保可重复使用的试管清洗是充分的,并且不会导致蛋白质、脂质和 RNA 污染物随着时间的推移而逐渐积累,这可能会影响 EV 相关货物的下游研究或影响细胞功能研究。
此处描述的过滤和超速离心方案已经使用多年,多项研究强调了该方法的不足,包括污染细胞成分(如细胞线粒体)的非特异性分离、核片段的存在和细胞膜的成分。此外,此处描述的方法将共分离存在于 EV 耗尽的 FBS 中的脂蛋白。通过使用密度超速离心和体积排阻色谱 (SEC) 来消除污染的可溶性蛋白质和一些脂蛋白,可以进一步开发该方法。结合分离的 EV 和 SEC 的 PBS 洗涤,可以限制但不能完全消除共分离的污染物。因此,用户应确保包含适当的对照,包括未与细胞接触的假培养基,以解决培养基中的可溶性蛋白质和脂蛋白,以及 EV 耗尽的上清液对照,以证明从仍含有可溶性蛋白质和脂蛋白的条件培养基中成功分离 EV。
使用过滤和超速离心分离 EV 依赖于作员确保在细胞培养上清液通过过滤器孔或针头/注射器孔时不会对细胞培养上清液施加过大的压力。在所述方案的这一阶段施加不当的力可能会使 EV 破裂,影响最终的 EV 浓度并产生曾经包裹在 EV 中的游离 RNA、蛋白质和代谢物。我们在这里描述了一种方法,该方法不需要注射器针筒,因此当 EV 通过过滤器或针头进入其收集储液罐和超速离心管时,需要对调节介质中的 EV 施加力。尽管如此,在 PBS 中重悬 EV 沉淀时必须进一步小心。只需使用短暂的涡旋,因为剧烈的涡旋可能会破坏 EV 膜。
超速离心后,作员必须小心超速离心管,以免干扰 EV 颗粒。这可以通过小心处理试管并在超速离心转头和试管架之间缓慢移动来实现。在超速离心管顶部穿孔以吸出 EV 耗尽的上清液时,必须进一步小心。将针头插入管顶部并快速吸出上清液将在注射器桶中产生真空,这会猛烈地迫使上清液回到超速离心管中并破坏 EV 沉淀。切开超速离心管以倒出剩余的上清液后,必须小心,因为 EV 沉淀可能会变得松散,倾倒会丢弃 EV 沉淀。或者,可以使用注射器和针头缓慢去除剩余的上清液,而无需倒入或倒置试管。
用于分离 EV 的上清液过滤和超速离心是一种有用且有效的方法。但它容易受到脂蛋白和可溶性蛋白的共分离。这些可以通过用 PBS 清洗 EV 来缓解(如前所述),但这并不能消除所有污染物。可以使用 SEC 从 EV 组分中洗脱可溶性蛋白质,但是,该方法不区分脂蛋白和 EV。含有 EV 的 SEC 洗脱液可以与超速离心相结合,以沉淀 EV。过滤和差速超速离心是优于使用聚乙二醇的沉淀技术的 EV 分离方法,因为这些沉淀方法共分离细胞培养上清液和其他生物液体中的大量可溶性蛋白质和脂蛋白。对于许多人来说,超速离心可能仍然是最容易获得的 EV 分离形式,因为大多数实验室都配备了超速离心机,因此降低了初始启动成本。但对于许多人来说,用于 EV 分离的超速离心受到超速离心管体积和材料起始体积的阻碍。可能需要几百 mL 的培养上清液才能产生足够的 EV 量,用于下游蛋白质组学或 RNA 测序。然而,用于 EV 分离的超速离心技术很可能会伴随着其他技术,例如 SEC 和使用四跨膜蛋白 CD9、CD63 和 CD81 的免疫亲和捕获,以提高分离的 EV 的纯度。其他技术,如市售沉淀溶液和流式细胞术,可能在特定研究中有所用处。
EV 制剂的纯度
我们证实了通过 TSG101 的蛋白质印迹分离脂肪细胞来源的 EV,但这种单一的蛋白质印迹达不到国际细胞外囊泡学会 (ISEV) 发布的指南。使用四跨膜蛋白 CD9、CD63 和 CD81 进一步表征这些脂肪细胞来源的 EV 将是理想的,以识别外泌体和细胞污染标志物,例如组蛋白 H3、白蛋白和载脂蛋白 A1。
这里介绍的方案允许从包括脂肪细胞在内的一系列细胞来源的细胞培养上清液中分离 EV,用于通过蛋白质印迹测定 EV 大小、浓度、EV 标志物,以及在基于组学的技术(如蛋白质组学和 RNA 测序)中的实用性。
披露声明
作者没有什么可披露的。
致谢
N.A. 和 R.C. 感谢英国心脏基金会 (British Heart Foundation) 牛津卓越研究中心 (N.A. 和 R.C.;RE/13/1/30181 和 RE/18/3/34214)、英国心脏基金会项目资助(NA 和 RC;PG/18/53/33895)、三方免疫代谢联盟、诺和诺德基金会 (NNF15CC0018486)、美国国家卫生研究所 (NIHR)、牛津生物医学研究中心 (BRC)、纳菲尔德医学捐助组织和惠康机构战略支持基金 (ISSF)。所表达的观点是作者的观点,不一定是 NHS、NIHR 或卫生部的观点。
材料
| Name | Company | Catalog Number | Comments |
| 100 µm mesh | Sefar | 03-250/50 | |
| 15 mL Conical Tube | Sarstedt | 62.554.002 | |
| 250 µm mesh | Sefar | 03-100/44 | |
| 50 mL Conical Tube | Sarstedt | 62.547.004 | |
| Beckman Coulter, Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Bicinchoninic acid assay (BCA) | Thermo Scientific | 23225 | |
| Biotin | Sigma | B4639 | |
| BSA (essentially fatty acid free) | Sigma | A7030 | |
| Collagenase H | Sigma | 11074032001 | |
| Dexamethasone | Sigma | D2915 | |
| Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 | Sigma | D6421 | |
| Fetal bovine serum | Labtech | FCS-SA | |
| Fibroblast growth factor | Bio-Techne | 233-FB-025 | |
| Glutamine | ThermoFisher | 25030024 | |
| Hanks balanced salt solution | Sigma | H9394 | |
| Human insulin | ThermoFisher | 12585-014 | |
| Hypodermic needles, Microlance 16G | VWR | 613-3897 | |
| IBMX | Sigma | I7018 | |
| Nanoparticle Tracking Analysis, Zetaview | Particle Metrix | BASIC PMX-120 | |
| NEFA kit | Randox | FA115 | |
| Pantothenate | Sigma | P5710 | |
| Penicillin and Streptomycin | ThermoFisher | 15140122 | |
| Phosphate buffered saline | ThermoFisher Scientific | 10010056 | |
| PluriStrainer 200 µm | Cambridge Bioscience | 43-50200-03 | |
| Polyallomer Quick-Seal ultra-clear 16 mm × 76 mm tubes | Beckman Coulter | 342413 | |
| Single use syringes, 2-piece, Injekt Solo | VWR | 20-2520 | |
| Sodium linoleate | Sigma | L8134 | |
| Sodium oleate | Sigma | O7501 | |
| Sodium palmitate | Sigma | P9767 | |
| Soldering Iron | Zacro | 7.14954E+11 | |
| Syringe Filter 0.2 µm | Sarstedt | 83.1826.001 | |
| Syringe Filter 0.45 µm | ThermoFisher | 195-2545 | |
| T175 cm2 tissue culture flasks | Sarstedt | 83.3912.002 | |
| T25 cm2 tissue culture flasks | Sarstedt | 83.3910.002 | |
| T75 cm2 tissue culture flasks | Sarstedt | 83.3911.002 | |
| Transferrin | Sigma | T8158 | |
| Triiodo-L-thyronine | Sigma | T5516 | |
| Troglitazone | Sigma | T2573 | |
| TrypLE Express Enzyme | Fisher Scientific | 12604021 |
参考文献
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Akbar, N., et al. Endothelium-derived extracellular vesicles promote splenic monocyte mobilization in myocardial infarction. JCI Insight. 2 (17), (2017).
- Xiao, Y., et al. Extracellular vesicles in type 2 diabetes mellitus: key roles in pathogenesis, complications, and therapy. Journal of Extracellular Vesicles. 8, 1625677(2019).
- Akbar, N., Azzimato, V., Choudhury, R. P., Aouadi, M. Extracellular vesicles in metabolic disease. Diabetologia. 62 (12), 2179-2187 (2019).
- Kobayashi, Y., et al. Circulating extracellular vesicles are associated with lipid and insulin metabolism. The American Journal of Physiology-Endocrinology and Metabolism. 315 (4), 574-582 (2018).
- Eguchi, A., et al. Circulating adipocyte-derived extracellular vesicles are novel markers of metabolic stress. Journal of Molecular Medicine. 94 (11), Berlin, Germany. 1241-1253 (2016).
- Crewe, C., et al. An Endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 175 (3), 695-708 (2018).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363 (6430), 989-993 (2019).
- Deng, Z. B., et al. Adipose tissue exosome-like vesicles mediate activation of macrophage-induced insulin resistance. Diabetes. 58 (11), 2498-2505 (2009).
- Kranendonk, M. E., et al. Human adipocyte extracellular vesicles in reciprocal signaling between adipocytes and macrophages. Obesity. 22 (5), Silver Spring. 1296-1308 (2014).
- Song, M., et al. Adipocyte-derived exosomes carrying sonic hedgehog mediate M1 macrophage polarization-induced insulin resistance via Ptch and PI3K pathways. Cellular Physiology and Biochemistry. 48 (4), 1416-1432 (2018).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10 (3), 881-906 (2018).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments: JoVE. (95), e50974(2015).
- Connolly, K. D., et al. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 159 (9), 3259-3267 (2018).
- Camino, T., et al. Vesicles shed by pathological murine adipocytes spread pathology: characterization and functional role of insulin resistant/hypertrophied adiposomes. International Journal of Molecular Sciences. 21 (6), 2252(2020).
- Zhu, Y., et al. Extracellular vesicles derived from human adipose-derived stem cells promote the exogenous angiogenesis of fat grafts via the let-7/AGO1/VEGF signalling pathway. Scientific Reports. 10 (1), 5313(2020).
- Sadallah, S., Eken, C., Schifferli, J. A. Erythrocyte-derived ectosomes have immunosuppressive properties. Journal of Leukocyte Biology. 84 (5), 1316-1325 (2008).
- Sudnitsyna, J., et al. Microvesicle formation induced by oxidative stress in human erythrocytes. Antioxidants. 9 (10), Basel. (2020).
- Helal, O., et al. Increased levels of microparticles originating from endothelial cells, platelets and erythrocytes in subjects with metabolic syndrome: relationship with oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases. 21 (9), 665-671 (2011).
- Agouni, A., et al. Endothelial dysfunction caused by circulating microparticles from patients with metabolic syndrome. The American Journal of Pathology. 173 (4), 1210-1219 (2008).
- Park, J., Park, J., Nahm, S. -S., Choi, I., Kim, J. Identification of anti-adipogenic proteins in adult bovine serum suppressing 3T3-L1 preadipocyte differentiation. BMB Reports. 46 (12), 582-587 (2013).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。