Method Article
Isolement et caractérisation de vésicules extracellulaires dérivées d’adipocytes humains à l’aide de la filtration et de l’ultracentrifugation
Dans cet article
Résumé
Nous décrivons l’isolement de vésicules extracellulaires (VE) dérivées d’adipocytes humains à partir de tissus adipeux fessiers et abdominaux à l’aide de la filtration et de l’ultracentrifugation. Nous caractérisons les VE isolées dérivées d’adipocytes en déterminant leur taille et leur concentration par analyse de suivi des nanoparticules et par western blot pour la présence du gène de susceptibilité tumorale de la protéine EV 101 (TSG101).
Résumé
Les vésicules extracellulaires (VE) sont des enveloppes lipidiques qui transportent des matériaux biologiquement actifs tels que des protéines, de l’ARN, des métabolites et des lipides. Les VE peuvent moduler l’état cellulaire d’autres cellules localement dans les microenvironnements tissulaires ou par libération dans le sang périphérique. Les VE dérivées des adipocytes sont élevées dans le sang périphérique et présentent des altérations de leur cargaison (ARN et protéines) lors de perturbations métaboliques, notamment l’obésité et le diabète. Les VE dérivées des adipocytes peuvent réguler l’état cellulaire des cellules vasculaires voisines, telles que les cellules endothéliales et les macrophages résidents du tissu adipeux pour favoriser l’inflammation du tissu adipeux. L’étude des altérations des VE dérivées des adipocytes in vivo est complexe car les VE dérivées du sang périphérique sont très hétérogènes et contiennent des VE provenant d’autres sources, à savoir les plaquettes, les cellules endothéliales, les érythrocytes et les muscles. Par conséquent, la culture d’adipocytes humains fournit un système modèle pour l’étude des VE dérivées des adipocytes. Ici, nous fournissons un protocole détaillé pour l’extraction de petits VE totaux à partir de milieux de culture cellulaire d’adipocytes fessiers et abdominaux humains par filtration et ultracentrifugation. Nous démontrons en outre l’utilisation de l’analyse de suivi des nanoparticules (NTA) pour la quantification de la taille et de la concentration des EV et montrons la présence du gène de susceptibilité tumorale 101 (TSG101) dans les VE dérivées des adipocytes fessiers et abdominaux. Les VE isolés de ce protocole peuvent être utilisés pour l’analyse en aval, y compris la microscopie électronique à transmission, la protéomique, la métabolomique, le séquençage de petits ARN, les microréseaux et peuvent être utilisés dans des études fonctionnelles in vitro/in vivo.
Introduction
Les vésicules extracellulaires (VE) sont des enveloppes enfermées dans des lipides qui transportent des matériaux biologiquement actifs tels que des protéines, des microARN, des métabolites et des lipides. Le terme EV désigne diverses sous-populations, qui comprennent les exosomes, les microvésicules (microparticules/ectosomes) et les corps apoptotiques1. Les VE peuvent servir de biomarqueurs parce qu’ils sont impliqués dans la signalisation pathologique et libérés dans les biofluides, y compris le sang et l’urine. Les VE peuvent moduler l’état cellulaire d’autres cellules localement dans les microenvironnements tissulaires ou par libération dans le sang périphérique2. Les VE portent des caractéristiques de leur cellule parente, mais la différenciation de chaque sous-population est principalement basée sur la taille des VE et le contenu en protéines, tels que les marqueurs VE, y compris la présence de tétraspanines (CD9, CD63 et CD81), le gène de susceptibilité tumorale 101 (TSG101) et la protéine X interagissant avec ALG-2 (ALIX). Ces marqueurs protéiques sont représentatifs de l’origine endosomale (CD9, CD63 et CD81) des exosomes, qui sont générés à l’intérieur des corps multi-vésiculaires ou représentent des protéines associées au bourgeonnement ou au gonflement directement de la membrane plasmique pour les microvésicules. Cependant, il existe un chevauchement important entre ces sous-populations, et il est difficile de distinguer les sous-populations individuelles dans des biofluides complexes tels que le plasma, le sérum ou l’urine.
Les perturbations métaboliques, notamment l’obésité, la résistance à l’insuline et les perturbations du glucose extracellulaire, de l’oxygène et de l’inflammation, peuvent modifier la taille et la concentration des VE et de leur cargaison. Les VE dérivées d’adipocytes transportent la périlipine A, l’adiponectine et présentent des altérations de leur cargaison de protéines et d’ARN au cours de l’obésité et du diabète 3,4,5,6. Les VE dérivées des adipocytes régulent l’état cellulaire des cellules endothéliales vasculaires voisines7 et des macrophages résidents du tissu adipeux pour favoriser l’inflammation du tissu adipeux et la résistance à l’insuline 8,9,10,11. L’étude des altérations des VE dérivées des adipocytes in vivo est complexe, car les populations de VE dérivées de biofluides complexes tels que le plasma, le sérum ou l’urine contiennent des VE provenant de sources multiples, telles que les plaquettes, les cellules endothéliales, les érythrocytes et les muscles, qui sont impliquées dans la pathogenèse du dysfonctionnement métabolique et de la maladie.
La culture et la différenciation in vitro de préadipocytes humains fournissent donc un système modèle pour l’étude des VE dérivées d’adipocytes. Ici, nous fournissons un protocole détaillé pour l’extraction de petits VE totaux à partir de milieux de culture cellulaire d’adipocytes humains à l’aide de la filtration à la seringue et de l’ultracentrifugation. L’ultracentrifugation reste une méthode d’isolation populaire pour les véhicules électriques car elle est facilement accessible et nécessite peu de connaissances spécialisées préalables. Cependant, d’autres méthodes telles que la précipitation, la chromatographie d’exclusion stérique et la capture d’immunoaffinité à l’aide de tétraspanines permettent d’isoler les VE à partir d’une gamme de biofluides, y compris le plasma, le sérum, l’urine et les milieux de culture cellulaire conditionnés. Chaque méthode, y compris le protocole d’ultracentrifugation décrit ici, produit des préparations de VE de pureté variable, car les méthodes peuvent co-isoler des protéines solubles et des lipoprotéines, qui peuvent se masquer comme des VE. La combinaison de ce protocole d’ultra-centrifugation avec d’autres méthodes telles que la centrifugation de densité, la chromatographie d’exclusion stérique et la capture d’immunoaffinité augmente considérablement la pureté des VE isolés. Mais à l’instar de l’ultracentrifugation, ces autres méthodes ne permettent pas de capturer des sous-populations indépendantes de VE à partir d’échantillons complexes tels que le sang, le plasma et l’urine. Par conséquent, les cultures de populations cellulaires sélectionnées restent l’une des méthodes les plus robustes pour générer des rendements élevés de VE spécifiques aux cellules. Chaque méthode EV comporte un certain nombre de mises en garde et le choix de la méthode peut avoir une incidence sur les types de VE isolés et leurs concentrations, ce qui peut biaiser les investigations mécanistes en aval sur la signalisation cellulaire et tissulaire et la détermination de la cargaison EV pour les études diagnostiques ; ces problèmes méthodologiques de l’isolation des VE sont discutés ailleurs et dans les sections sur les limites ci-dessous 4,12. Ici, nous décrivons l’isolement des VE humaines dérivées d’adipocytes à l’aide de la filtration et de l’ultracentrifugation. Nous démontrons en outre l’utilisation de l’analyse de suivi des nanoparticules (NTA) pour la quantification de la taille et de la concentration des VE et montrons la présence du gène de susceptibilité tumorale 101 (TSG101) dans nos VE dérivées d’adipocytes humains. Les VE isolées de ce protocole peuvent être utilisées pour l’analyse en aval, y compris la microscopie électronique à transmission, la protéomique, la métabolomique, le séquençage de petits ARN, les microréseaux, et peuvent être utilisées dans des études fonctionnelles in vitro/in vivo.
Protocole
Toutes les méthodes ont été approuvées par le comité d’éthique de l’Université d’Oxford. Le tissu adipeux a été obtenu par biopsie à l’aiguille sous anesthésie locale sur des volontaires sains.
1. Préparation des milieux de culture cellulaire et des tampons
- Préparez un tampon de digestion de la collagénase en dissolvant la collagénase H (1 mg/mL) dans une solution saline équilibrée de Hanks (HBSS) (sans chlorure de calcium et sans chlorure de magnésium) et un filtre stérile à l’aide d’un filtre de seringue à pores de 0,2 μm.
- Préparez le tampon de digestion de la collagénase pas plus de 10 minutes avant utilisation.
- Préparez le milieu de croissance (GM) comme suit : le mélange nutritif Dulbecco’s Modified’s Eagle’s Medium/Ham F12 (DMEM/F12) complété par 10 % de sérum de bovin fœtal (FBS), 100 unités/mL de pénicilline, 100 μg/mL de streptomycine, 2 mM de L-glutamine et 0,5 ng/mL de facteur de croissance des fibroblastes (FGF).
- Préparez le milieu de différenciation de base (DM de base) comme suit : DMEM/F12 complété par 100 unités/ml de pénicilline, 100 μg/mL de streptomycine, 2 mM de L-glutamine, 17 μM de pantothénate, 100 nM d’insuline humaine, 10 nM de triiodo-L-thyronine, 33 μM de biotine, 10 μg/mL de transferrine et 1 μM de dexaméthasone.
- Préparez le milieu de différenciation complet (DM complet) en complétant le MS de base de l’étape 1.3 avec 0,25 mM de 3-isobutyl-1-méthylxanthine et 4 μM de troglitazone.
- Préparez 10 mM de solutions mères d’acides gras complexées à 10 % d’albumine sérique bovine (BSA) essentiellement exempte d’acides gras comme suit.
- Dissoudre 16 g de BSA dans 160 mL de milieu DMEM/F12 et chauffer à 37 °C. Dans trois tubes coniques distincts de 50 ml, pesez 150 mg d’oléate de sodium, 139 mg de palmitate de sodium et 151 mg de linoléate de sodium. Ajouter 50 mL de la solution BSA réchauffée dans chaque tube et bien mélanger par vortex répété.
- Remettez les tubes d’oléate et de linoléate dans le bain-marie à 37 °C pendant 15 min. Mélanger par vortex jusqu’à dissolution complète.
- Pour la solution de palmitate, placez le tube dans un bain-marie à 65 °C pendant 2-3 min. Mélanger vigoureusement par vortex.
- Répéter l’étape 1.5.3 jusqu’à dissolution complète, environ 30 min.
REMARQUE : Certaines petites particules peuvent encore être visibles. - Filtrer stérilement les solutions d’acides gras à l’aide d’un filtre à seringue à pores de 0,2 μm.
- Confirmer la concentration en acides gras non estérifiés de chaque solution mère à l’aide d’un dosage approprié.
REMARQUE : Les stocks d’acides gras doivent être de 10 mM (±10 %) pour obtenir un rapport molaire de 6:1 entre l’acide gras et la BSA. Si la concentration est en dehors de cette plage, la solution mère doit être refaite. Les solutions mères peuvent être aliquotes et stockées à -30 °C.
2. Digestion des biopsies du tissu adipeux humain
- Filtrez lentement le contenu de la seringue de biopsie à travers une passoire à cellules stériles de 200 μm fixée à un tube conique de 50 ml afin que le tissu adipeux soit recueilli dans la passoire.
- Transférez la passoire dans un nouveau tube conique de 50 ml et lavez le tissu adipeux trois fois avec 10 ml de HBSS.
REMARQUE : Il peut être nécessaire d’enlever les caillots sanguins et les tissus fibreux avec des ciseaux chirurgicaux ou de répéter le lavage HBSS pour éliminer l’excès de globules rouges. - Pesez le tissu lavé.
REMARQUE : Nous obtenons généralement 400 à 800 mg de tissu par biopsie à l’aiguille. - Mettez le tampon de digestion de la collagénase dans un tube conique stérile de 50 ml et ajoutez le tissu lavé. Des ciseaux chirurgicaux peuvent être utilisés à cette étape pour hacher le tissu en morceaux de taille égale.
REMARQUE : Utiliser 5 ml de tampon par mouchoir de 0,5 g. Pour les tissus plus gros, les échantillons peuvent être hachés dans une boîte de Pétri. - Placez le tube dans un bain-marie à 37 °C et incubez pendant 35 à 40 min.
REMARQUE : Après une digestion réussie, la solution devrait apparaître laiteuse. Si de petits morceaux de tissu sont encore visibles, agitez à la main pendant 10 à 20 secondes supplémentaires.
3. Isolement des préadipocytes
- Pour granuler la fraction préadipocytaire, centrifuger à 1 000 x g pendant 5 min.
- Aspirer et jeter la couche adipocytaire flottante et le surnageant, laissant environ 1 mL de HBSS recouvrir la pastille cellulaire.
- Remettez la pastille en suspension dans 5 mL de HBSS et faites passer la suspension cellulaire à travers un maillage de 250 μm de pore suivi d’un treillis de 100 μm pour éliminer tout matériau non digéré. Recueillir la suspension cellulaire dans un tube conique de 15 ml.
- Centrifugeuse à 1 000 x g pendant 5 min.
REMARQUE : Après cette étape, la fraction préadipocytaire peut être traitée avec une solution de lyse des globules rouges si la contamination des globules rouges est un problème. - Aspirez et jetez le surnageant.
- Remettre la pastille de cellule en suspension dans 5 mL de GM (étape 1.2) et l’ensemencer dans une fiole de culture tissulaire adhérente de 25 cm2 . Placer le ballon dans un incubateur de culture cellulaire (5 % de CO2, 37 °C).
4. Maintien des cultures de préadipocytes
- Remplacez le GM tous les 2 jours pendant que les cellules prolifèrent
REMARQUE : Les taux de prolifération cellulaire peuvent varier d’un donneur à l’autre.- Lorsque les cellules atteignent environ 80 % de confluence, transférez-les dans une fiole de culture tissulaire adhérente de 75cm2 . Retirez le GM et lavez les cellules avec une solution saline tamponnée au phosphate (PBS).
- Jetez le PBS et ajoutez 0,5 ml d’enzymes de dissociation cellulaire hautement purifiées pour dissocier les cellules attachées. Incuber à 37 °C pendant 5 min.
- Tapotez vivement le ballon pour libérer les cellules et ajoutez 5 ml de GM. Récupérez la suspension cellulaire dans un tube conique de 15 ml.
- Centrifugeuse à 1 000 x g pendant 5 min.
- Aspirez et jetez le surnageant. Remettre la pastille en suspension dans 5 mL de GM et transférer dans une fiole de75 cm 2 . Remplissez le GM jusqu’à ce qu’il atteigne un volume final de 12 mL et replacez le ballon dans l’incubateur de culture cellulaire (5 % de CO2, 37 °C).
REMARQUE : Pour entretenir les cellules, continuez à changer le GM tous les 2-3 jours. Lorsque les cellules atteignent 80 % de confluence, répétez les étapes 4.2-4.3 et divisez les cellules 1:3 en nouveaux flaconsde 75 cm 2 . Cela peut être répété pendant plusieurs passages jusqu’à ce qu’un nombre suffisant de cellules ait été généré pour la mise en place expérimentale. Nous ne recommandons pas plus de 10 passages car la capacité de prolifération et de différenciation des préadipocytes diminue.
5. Ensemencement des préadipocytes pour la différenciation adipogénique
- Comptez les cellules à l’aide d’un hémocytomètre et ensemencez 200 000 cellules dans plusieurs puits d’une plaque à 6 puits dans 2 mL de GM. Vous pouvez également ensemencer 3,5 millions de cellules par flacon de2 cm de 175 cm dans 22 mL de milieu GM.
- Laissez les cellules proliférer pendant 2 à 4 jours supplémentaires jusqu’à ce qu’elles atteignent leur pleine confluence, en changeant le GM le deuxième jour de la culture.
- Pour commencer la différenciation adipogénique, retirer le GM et le remplacer par du DM complet pendant 4 jours (2 mL de DM complet par puits d’une plaque à 6 puits ou 22 mL pour une fiole de175 cm à 2 puits).
REMARQUE : Remplacer par du DM complet frais le jour 2. - Le jour 4, retirer le DM complet et le remplacer par 2 mL de DM basique complété par 22,5 μM d’oléate, 15 μM de palmitate et 12,5 μM de linoléate pour obtenir une concentration totale en acides gras de 50 μM par puits d’une plaque à 6 puits ou de 22 ml pour une fiole de175 cm 2 . Remplacer par un support tous les 2 jours pendant 10 jours supplémentaires.
REMARQUE : À partir du 7e jour, les gouttelettes lipidiques devraient être visibles dans les préadipocytes différenciateurs. - Le 14e jour de culture, prélever le milieu des cellules pour isoler les VE dérivées des adipocytes.
6. Préparation du surnageant de culture cellulaire pour l’isolement ou le stockage des vésicules extracellulaires et l’isolement futur des vésicules extracellulaires
- Retirer les surnageants de culture cellulaire de chaque plaque à 6 puits et combiner. Ajoutez-les dans un tube de 15 mL ou retirez tous les surnageants de culture cellulaire d’une fiole de175 cm de 2 et ajoutez-les dans un tube de 50 mL.
- Centrifugeuse à 1000 x g pendant 10 min à 4 °C.
- Décanter le surnageant dans un nouveau tube propre de 15 mL ou 50 mL en versant, respectivement.
- Retirez le cylindre d’une seringue de 10 ml et fixez un filtre de seringue de 0,45 μm.
- Versez le surnageant dans le réservoir de la seringue et appliquez une légère pression sur l’ouverture du corps de la seringue avec le pouce ou la paume jusqu’à ce que le surnageant de culture cellulaire passe librement à travers le filtre.
REMARQUE : La vitesse de cette étape de filtration peut varier en fonction du type de filtre de seringue. - Prélever le filtrat dans un tube propre de 50 ml.
REMARQUE : Si nécessaire, le média filtré conditionné peut être stocké à ce point à -80 °C pendant plusieurs semaines. Si nécessaire, décongeler les surnageants de culture cellulaire à 4 °C et centrifuger à 1000 x g pendant 10 min à 4 °C. Décantez le surnageant dans un tube propre en le versant avant de poursuivre avec les isolations EV.
7. Isolement des vésicules extracellulaires
- Étiquetez un tube d’ultracentrifugation de 13 mL en traçant un cercle au bas du tube, à l’endroit où la pastille EV attendue se formera, et marquez une ligne autour du col du tube pour l’orientation dans le rotor du tube d’ultracentrifugation. Étiquetez le tube avec un identificateur d’échantillon.
- Placez le tube dans le support de tube.
- Fixez une aiguille de 16 g à une seringue de 10 ml et retirez le corps de la seringue.
- Retirez le couvercle de protection de l’aiguille et insérez l’aiguille dans le col du tube d’ultracentrifugation.
- Versez le surnageant de culture cellulaire directement dans le corps de la seringue pour remplir le tube d’ultracentrifugation.
- Remplissez le tube avec du PBS si nécessaire jusqu’à ce qu’il soit plein.
REMARQUE : Laissez le tube déborder légèrement si nécessaire, en vous assurant qu’il n’y a pas d’espaces d’air dans le tube d’ultracentrifugation et pas de bulles d’air. - Scellez le tube d’ultracentrifugation à l’aide d’un fer à souder, en vous assurant que le tube est étanche à l’air en pressant doucement le tube.
- Placez les tubes d’ultracentrifugation dans le rotor d’ultracentrifugation ; assurez-vous que la ligne marquée en haut du tube et le cercle tracé à la base du tube sont orientés vers l’extérieur, là où la pastille EV se formera.
- Ultracentrifugeuse à 120 000 x g pendant 2 h à 4 °C.
- Retirez délicatement le rotor de l’ultracentrifugeuse.
- Retirez les tubes d’ultracentrifugation du rotor et placez-les dans le support de tube.
- Fixez une aiguille de 16 g à une seringue de 10 ml.
- Percez le haut du tube d’ultracentrifugation et insérez l’aiguille à 2 cm dans le haut du tube et aspirez le surnageant dans la seringue.
- Décanter ce surnageant appauvri en VE dans un tube de 1,5 mL et congeler à -80 °C.
- Réinsérez l’aiguille dans le tube et aspirez soigneusement le surnageant restant et jetez-le.
- Coupez le haut du tube à l’aide d’une paire de ciseaux.
- Versez le surnageant restant en un seul geste rapide.
- Laissez le tube pendre à l’envers pendant 1 min.
- Séchez tout liquide qui se forme sur le tube avec une serviette en papier.
- Retournez le tube et placez-le dans le support de tube.
- Ajouter 100 μL de PBS dans le tube.
- À l’aide de la pointe d’une pipette, délogez doucement la pastille EV à la base du tube en effectuant un mouvement circulaire dans la zone indiquée à l’étape 7.1.
- Vortex brièvement (1 à 2 secondes), deux fois.
- Étiquetez un nouveau tube d’ultracentrifugation de 13 ml en traçant un cercle au bas du tube, à l’endroit où la pastille EV attendue se formera, et marquez une ligne autour du col du tube pour l’orientation dans le rotor du tube d’ultracentrifugation. Étiquetez le tube avec un identificateur d’échantillon.
- Placez le tube dans le support de tube.
- Ajouter 12 ml de PBS dans un nouveau tube d’ultracentrifugation à l’aide d’une seringue et d’une aiguille propres.
- À l’aide d’une seringue et d’une aiguille, prélever l’échantillon de 100 μL EV et l’ajouter dans le tube. Mélangez soigneusement les VE et le PBS et rincez la seringue et l’aiguille en recueillant doucement le PBS et en aspirant dans le tube.
REMARQUE : Évitez de créer des bulles. - Scellez le tube d’ultracentrifugation à l’aide d’un fer à souder, en vous assurant que le tube est étanche à l’air en pressant doucement le tube.
- Placez les tubes d’ultracentrifugation dans le rotor d’ultracentrifugation ; Assurez-vous que la ligne marquée en haut du tube et le cercle tracé à la base du tube sont orientés vers l’extérieur.
- Ultracentrifugeuse à 120 000 x g pendant 1 h à 4 °C.
- Retirez délicatement le rotor de l’ultracentrifugeuse.
- Fixez une aiguille de 16 g à une seringue de 12 ml.
- Percez le haut du tube d’ultracentrifugation et insérez l’aiguille jusqu’à 2 cm dans le haut du tube ; Aspirez le surnageant dans la seringue et jetez-le.
- Coupez le haut du tube à l’aide d’une paire de ciseaux.
- Versez le surnageant restant en un seul geste rapide.
- Laissez le tube pendre à l’envers pendant 1 min.
- Séchez tout liquide qui se forme sur le bord du tube.
- Placez le tube dans le support de tube.
- Ajouter 100 μL de PBS dans le tube.
- À l’aide de la pointe d’une pipette, délogez doucement la pastille EV à la base du tube en effectuant un mouvement circulaire dans la zone indiquée à l’étape 7.24.
- Vortex brièvement (1 à 2 secondes), deux fois.
- Pipeter 100 μL de solution PBS/EV dans un tube propre de 1,5 mL et conserver sur de la glace humide.
REMARQUE : Les EV sont prêts pour le traitement en aval et peuvent être congelés et stockés à -80 °C.
8. Détermination de la taille et de la concentration des VE à l’aide de l’analyse de suivi des nanoparticules (NTA)
- Préparation du système
REMARQUE : Mehdiani et coll.13 ont présenté une méthode détaillée pour l’utilisation de l’analyse de suivi des nanoparticules (NTA) pour déterminer la taille et la concentration des VE.- Décongelez les échantillons et conservez-les à 4 °C.
- Démarrez le logiciel NTA en cliquant sur l’icône du logiciel.
- Le logiciel s’ouvrira dans « cell check » et vous demandera de remplir la cellule d’écoulement avec de l’eau déminéralisée. Remplissez une seringue de 10 ml d’eau déminéralisée et poussez-la dans la machine, en veillant à ce qu’aucune bulle d’air ne passe dans la chambre de chargement.
- Suivez les instructions à l’écran pour préparer le système à travers un contrôle de qualité (QC). Le logiciel effectuera une vérification de la cellule et donnera une mesure de la qualité de la cellule. Cela devrait être très bon à excellent.
- Préparez le contrôle qualité composé d’un cordon de polystyrène de 100 nanomètres. Pipeter 1 μL de l’étalon dans 999 μL d’eau déminéralisée (pâte diluée). Par la suite, ajouter 10 μL de la substance diluée à 2,5 mL d’eau désionisée (échantillon QC). Mélangez la solution en tourbillonnant doucement pendant 2-3 s et en pipetant.
REMARQUE : Les échantillons de contrôle de la qualité doivent être préparés frais tous les jours, mais l’échantillon initial dilué est stable pendant 1 semaine à 4 °C. - Remplissez une seringue de 1 ml avec 1 ml de l’échantillon de contrôle qualité et retirez toutes les bulles d’air de la seringue.
- Injectez, sans introduire de bulles d’air, dans la chambre de chargement d’échantillon NTA en inclinant doucement l’extrémité de la seringue dans la chambre d’injection, tout en poussant simultanément le piston. Injectez jusqu’à 950 μL de l’échantillon de CQ dans la chambre.
REMARQUE : N’introduisez pas de bulles d’air dans la chambre de chargement de l’échantillon. - Attendez que le logiciel effectue un alignement automatique (pour faire la mise au point de la caméra) et vérifie la tension pour les lectures de potentiel Z - le graphique de tension doit être une courbe lisse en forme de U.
REMARQUE : S’il y a un message d’erreur « tension trop faible erreur », la cellule peut être mouillée par le nettoyage ou non sécurisée ou il peut y avoir une bulle d’air. - Une fois la vérification de l’alignement automatique/de la tension terminée, utilisez le menu déroulant de position de la caméra pour vérifier toutes les positions (0,1-0,9) à la recherche de marques inhabituelles - la présence de celles-ci indique que la cellule peut avoir besoin d’être rincée et/ou nettoyée. Après le contrôle qualité, le système affichera « prêt pour les mesures ».
- Amorcez la cellule d’écoulement avec du PBS. Ouvrez l’onglet Pompe/Température et sous Pompe, cliquez sur Exécuter pour la pompe 2 (réservoir PBS). Cela fera fonctionner PBS dans la cellule pendant 1 min, puis s’arrêtera automatiquement.
REMARQUE : Il peut y avoir des particules dans la chambre, mais celles-ci peuvent être éliminées en poussant 10 ml de PBS à travers l’orifice de chargement. - Remplissez une seringue de 10 ml de PBS et chargez-la dans la chambre sans bulles d’air.
- Créez un protocole pour le fonctionnement de l’appareil qui mesurera plusieurs positions du laser et fera la moyenne des particules par image.
- Vérifiez que le nombre de particules est inférieur à 5 (aussi proche que possible de 0) avant de continuer - rincez avec plus de PBS, si nécessaire.
- Avant la dilution, mélanger l’échantillon EV par pipetage.
- Diluer l’échantillon à l’échelle 1:1 000 dans du PBS et mélanger par pipetage. Remplissez une seringue de 1 mL avec l’échantillon et chargez-le dans la chambre sans bulles d’air.
- Vérifiez que le nombre de particules se situe dans la plage acceptable (la barre au-dessus de la valeur de comptage doit se trouver dans la zone verte ou à proximité de celle-ci). Si ce n’est pas le cas, ajustez la dilution de l’échantillon en conséquence. Entre les échantillons et les dilutions d’échantillons, chargez 10 ml de PBS à l’avant de la machine pour dégager la chambre, puis chargez 1 ml de l’échantillon dilué.
REMARQUE : Chaque échantillon aura une dilution indépendante en fonction de la concentration de l’échantillon. Le nombre de particules de l’appareil doit être compris entre 50 et 200 particules par image pour des mesures précises. - Allez dans l’onglet Mesure du logiciel.
- Cliquez sur le bouton Exécuter l’acquisition vidéo .
- Entrez un nom d’échantillon et sélectionnez un dossier de destination pour enregistrer la mesure.
- Créez une procédure d’utilisation standard (SOP) pour les VE.
- Créez > enregistrez > chargez une SOP EV qui mesurera le nombre et la taille des particules à une vitesse d’obturation de 100 et une sensibilité de l’appareil photo de 80, 11 positions de l’appareil photo pendant 2 cycles.
REMARQUE : À moins que l’échantillon n’ait des exigences particulières, il n’est pas nécessaire de modifier ces paramètres. - Entrez la dilution de l’échantillon et ajoutez les autres notes que vous souhaitez ajouter.
- Cliquez sur OK et le logiciel commencera automatiquement l’enregistrement. Une fois terminé, le logiciel chargera automatiquement une table contextuelle indiquant le nombre et la taille moyens des particules pour chaque position de la caméra.
REMARQUE : Ne touchez pas la machine ou les comptoirs à proximité pendant ce temps car les vibrations influenceront les lectures finales. - Les positions de caméra avec des lectures statistiquement inhabituelles seront automatiquement exclues - pour exclure manuellement toutes les positions de caméra (ou réinclure celles exclues pour une raison quelconque), cochez la case à gauche des détails de l’échantillon.
- Cliquez sur Continuer et le logiciel créera et ouvrira un PDF de l’échantillon avec les résultats de taille et de concentration.
- Créez > enregistrez > chargez une SOP EV qui mesurera le nombre et la taille des particules à une vitesse d’obturation de 100 et une sensibilité de l’appareil photo de 80, 11 positions de l’appareil photo pendant 2 cycles.
- Analyse statistique
- Analysez les données NTA par ANOVA unidirectionnelle ou bidirectionnelle avec correction de Tukey post-hoc. Tracez les données sous forme de moyennes de groupe ± d’écart-type. Une valeur P de <0,05 a été considérée comme significative.
Résultats
Nous avons déterminé la quantité de VE isolée des adipocytes fessiers humains en suivant le protocole décrit. Nous avons calculé la taille et la concentration des VE dérivées des adipocytes à l’aide du NTA (Figure 1A,B). Nous avons utilisé des témoins de milieux fictifs, c’est-à-dire des volumes égaux de milieux qui n’avaient pas été en contact avec des cellules, mais cultivés et soumis à la procédure d’isolement décrite ci-dessus. Nous avons mesuré la concentration de VE dérivée des adipocytes après l’isolement initial et après le lavage des VE adipocytaires isolés dans le PBS (Figure 1A,B) et tracé les moyennes de groupe ±écart-type (ET), qui a été analysé par une ANOVA à deux facteurs avec correction de Tukey post-hoc.
La concentration de VE dérivées d’adipocytes déterminée par NTA à partir du1er isolement variait de 6,10 x 106 à 2,70 x 107 avec une médiane de 2,60 x 107 VE/mL (figure 1 A, B). À la suite d’un lavage par PBS, il y avait significativement moins de VE dérivées des adipocytes par échantillon (figures 1A, B) (P < 0,001), qui variaient de 5,00 x 105 à 4,30 x 106 avec une médiane de 2,70 x 106 VE/mL. Les commandes du support fictif ne contenaient pas de VE, tel que déterminé par la NTA (figures 1A, B). La taille modale des VE à partir du premier isolement était de 125 nm et de 105 nm après un lavage PBS (figures 1A, B). Le protocole décrit a ensuite été appliqué aux adipocytes abdominaux et glutéaux dérivés de flacons T175 cm2 plus grands. La concentration de ces échantillons d’EV fessiers provenant de flacons T175 cm2 variait de 3,60 x 107 à 7,50 x 107/mL, avec une médiane de 5,40 x 107 EV/mL. La concentration des VE dérivées des adipocytes abdominaux provenant des flacons de T175 cm2 variait de 6,30 x 107 à 8,60 x 107/mL, avec une médiane de 7,60 x 107 EV/mL (figures 1C et D). La taille modale des VE dérivées des flacons T175 cm2 était de 115 nm pour les VE fessières et de 125 nm pour les VE abdominaux. Nous avons confirmé la présence de la protéine EV dans les VE dérivées des fessiers et des abdominaux par immunotransfert pour le gène de susceptibilité tumorale 101 (TSG101) et avons constaté que les cuillers de cellules adipocytaires abdominales et fessiers et les VE dérivées d’adipocytes abdominaux et fessiers étaient positifs pour TSG101, tandis que les milieux de contrôle fictifs, qui n’avaient pas été en contact avec les cellules, étaient négatifs (Figure 1E).
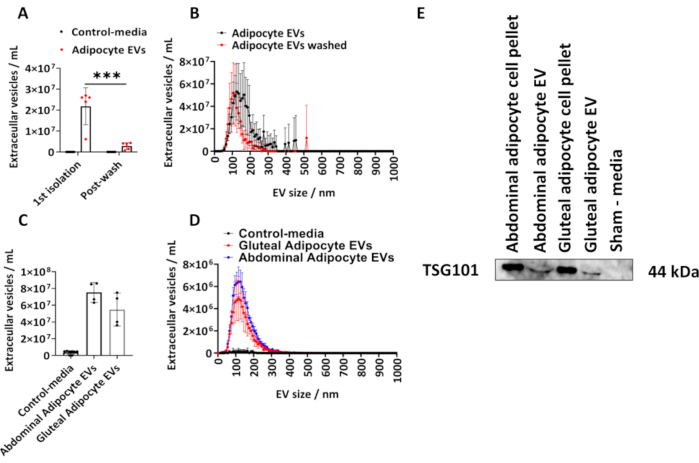
Figure 1 : Profil de taille et de distribution des VE dérivées d’adipocytes dans des milieux de culture cellulaire et détermination de la protéine TSG101. Concentrations totales de VE et profils de taille et de distribution des concentrations déterminés par l’analyse de suivi des nanoparticules (NTA) à partir de la 1èreisolation (N = 5) et après lavage au PBS (N = 6). (C) les concentrations totales et (D) les profils de distribution de taille et de concentration déterminés par NTA pour les VE dérivées de l’abdomen et du fessier à partir de flacons T175cm2 (N = 4 par groupe). (E) Western blot de VE dérivées de la sarcelle et de l’abdomen pour TSG101. Des pastilles cellulaires et des milices fictives ont été utilisées comme témoins positifs et négatifs, respectivement. Les données sont des moyennes de groupe ± de l’écart-type (ET). Une ANOVA unidirectionnelle ou bidirectionnelle avec correction de Tukey post-hoc. P < 0,001. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Nous démontrons un protocole pour l’isolement des VE dérivées des adipocytes fessiers et abdominaux à partir de surnageants de culture cellulaire et déterminons leur taille et leur concentration par NTA 7,14,15. Nous montrons que les adipocytes humains cultivés produisent et libèrent des VE dans le milieu de culture cellulaire, qui peuvent ensuite être isolés par filtration et ultracentrifugation. Nous avons déterminé la taille et le profil de concentration des VE isolés dérivés d’adipocytes et montré que l’ultracentrifugation a probablement co-isolé les contaminants des milieux de culture cellulaire et que le lavage des pastilles de VE isolées dans le PBS réduit considérablement leur concentration lors d’une deuxième mesure NTA. Nous avons ensuite déterminé la pureté des VE isolés dérivés des fessiers et des abdominaux par transfert western pour TSG101, un marqueur EV. Les préparations de VE, dérivées de la sarcelle et de l’abdomen, étaient positives pour TSG101, mais, surtout, cela était absent dans les milieux témoins qui n’étaient pas exposés aux cellules. Les expériences présentées ont utilisé des adipocytes humains comme cellule mère générant des VE, mais la méthode décrite convient à d’autres types de cellules, y compris les cellules endothéliales, les muscles lisses vasculaires, les muscles squelettiques, les cellules immunitaires, et pour l’isolement des VE à partir de plasma ou de sérum pauvre en plaquettes de patients.
Les VE dérivées des adipocytes sont élevées dans les maladies métaboliques et la détermination des modifications de la taille et du nombre de VE adipocytaires in vivo est complexe car les fluides biologiques tels que le sang contiennent des VE provenant d’un certain nombre de sources cellulaires qui sont également impliquées dans la pathogenèse des maladies métaboliques, y compris les VE des cellules endothéliales, des muscles squelettiques, des érythrocytes et des cellules immunitaires. La méthode décrite ici permet de déterminer les VE des adipocytes humains, ce qui peut fournir un modèle utile pour les études mécanistes sur les facteurs qui conduisent à la biogenèse des VE dans les adipocytes, ce qui est actuellement inconnu. Il est important de noter que la détermination de la biogenèse des VE adipocytaires et de la façon dont la charge d’ARN, de protéines et de métabolites particuliers est orchestrée dans les VE adipocytaires peut révéler de nouvelles opportunités thérapeutiques pour perturber la signalisation des VE adipocytaires pathogènes dans le dysfonctionnement métabolique. Des études détaillées permettront de mieux comprendre comment la taille, le nombre, la voie de biogenèse et la cargaison de VE (ARN, protéines et métabolites) sont modifiés en réponse à une maladie ou à des stimuli tels que des perturbations de l’oxygène, du glucose, des lipides et de l’insuline. Des informations sur le rôle des facteurs environnementaux dans la signalisation des VE adipocytaires dans les maladies métaboliques et sur la façon dont les VE dérivées des adipocytes contribuent à l’inflammation du tissu adipeux pourraient révéler de nouvelles cibles thérapeutiques dans les maladies métaboliques.
Limitations
Génération in vitro de VE dérivées d’adipocytes
L’utilisation de préadipocytes humains in vitro fournit un système modèle pour étudier la libération et la génération de VE dérivées des adipocytes après la différenciation des adipocytes in vitro, mais il existe un certain nombre de limites. En particulier, les VE adipocytaires dérivées in vitro sont susceptibles de différer des VE dérivées du tissu adipeux récupérées dans des fluides biologiques, tels que le plasma14 , en termes de taille, de concentration, de protéine, d’ARN, de métabolites et de fonction. Ces différences EV pourraient être influencées par d’autres cellules non adipocytaires qui résident dans le tissu adipeux in vivo, telles que les cellules souches dérivées du tissu adipeux, les cellules endothéliales et les macrophages, qui sont intimement liés à la physiologie du tissu adipeux et ont montré des rôles dans la pathologie du tissu adipeux, y compris l’inflammation du tissu adipeux.
Il est à noter que le protocole de différenciation in vitro de 2 semaines décrit ici peut ne pas être suffisant pour générer des adipocytes à pleine maturité équivalents à ceux observés in vivo ; Les adipocytes différenciés in vitro cultivés dans un format bidimensionnel (2D) présentent une morphologie différente de celle des cellules in vivo et ne développent pas de gouttelettes lipidiques uniloculaires. De plus, les préadipocytes décrits dans ce protocole sont obtenus à partir de la fraction stromo-vasculaire adipeuse et nous n’avons pas évalué la contribution à l’EV pool d’autres types de cellules qui n’ont pas été complètement éliminées lors de l’isolement cellulaire.
La perte d’interactions intercellulaires importantes des adipocytes avec d’autres non-adipocytes dans le tissu adipeux peut influencer la génération et la libération de la protéine EV et de l’ARN EV des adipocytes et des cellules souches dérivées du tissu adipeux16. Cependant, une évaluation exhaustive de la différence entre les VE adipocytaires dérivées in vitro et celles produites in vivo n’a pas été entreprise.
Les biopsies de tissus primaires contiennent du sang et, par conséquent, les cultures cellulaires dérivées peuvent contenir des érythrocytes et des VE dérivés d’érythrocytes, indépendamment des multiples lavages et changements de milieux mis en évidence dans notre protocole. Une étape supplémentaire de lyse des globules rouges après l’isolement de la fraction stromo-vasculaire peut être nécessaire pour éliminer les effets des érythrocytes sur les adipocytes. Ceci est important car les VE dérivées des érythrocytes peuvent avoir un impact sur la fonction cellulaire d’autres cellules17 et les VE dérivées des érythrocytes sont élevées en présence de stress oxydatif18 et chez les patients atteints du syndrome métabolique19,20. Par conséquent, le tissu adipeux dérivé de patients atteints de maladies métaboliques peut contenir des niveaux élevés de VE dérivés d’érythrocytes, ce qui peut influencer le phénotype in vitro des adipocytes.
Élimination du FBS
Le protocole décrit a utilisé le FBS dans le milieu de croissance pendant la différenciation adipogénique, mais par la suite, les adipocytes ont été soumis à de multiples changements de milieu avant la collecte finale du milieu pour l’isolement des VE dérivées des adipocytes. Par conséquent, nous avons supposé que le risque global de contamination des VE dérivés du FBS dans les préparations de VE était faible et avons par la suite confirmé que les VE résiduelles n’étaient pas présentes dans les milieux de culture cellulaire par western blot pour TSG101. L’isolement des VE cultivés sur cellules à partir de sources cellulaires nécessitant un FBS doit utiliser des VE appauvris en VE ou des VE bovins appauvris par ultra-centrifugation pour empêcher les VE bovines de confondre les concentrations de VE adipocytaires et l’analyse de la cargaison de VE adipocytaires. On sait que l’appauvrissement sérique des adipocytes modifie leurs réponses cellulaireset , par conséquent, l’étude doit garantir que l’appauvrissement sérique ou l’épuisement des EV du sérum rend leurs cultures adipocytaires vraiment représentatives de la biologie des adipocytes.
Limitation technique de l’isolation des VE par filtration et ultracentrifugation
Nous décrivons une méthode d’ultracentrifugation avec des tubes en plastique à usage unique qui nécessitent une étanchéité avant l’ultracentrifugation pour les isolations de VE. Nous reconnaissons que ces tubes scellés à usage unique peuvent ne pas être une option économique pour de nombreuses personnes et suggérons d’explorer des tubes similaires, qui ne nécessitent pas de scellement et sont réutilisables. Cependant, les chercheurs doivent s’assurer que le lavage des tubes réutilisables est adéquat et qu’il n’entraîne pas d’accumulation progressive de contaminants protéiques, lipidiques et ARN au fil du temps, ce qui pourrait avoir une incidence sur les enquêtes en aval sur la cargaison associée aux VE ou sur les études de la fonction cellulaire.
Le protocole de filtration et d’ultracentrifugation décrit ici est utilisé depuis de nombreuses années et de multiples études ont mis en évidence les lacunes de cette méthode, notamment l’isolement non spécifique de composants cellulaires contaminants tels que les mitochondries cellulaires, la présence de fragments nucléaires et de constituants de la membrane cellulaire. De plus, la méthode décrite ici permettra de co-isoler les lipoprotéines présentes dans les FBS appauvris en EV. La méthode peut être perfectionnée par l’utilisation de l’ultracentrifugation de densité et de la chromatographie d’exclusion stérique (SEC) pour éliminer les protéines solubles contaminantes et certaines lipoprotéines. Associé au lavage PBS des VE isolés et au SEC, les contaminants co-isolés peuvent être limités, mais pas complètement éliminés. Par conséquent, les utilisateurs doivent s’assurer d’inclure des témoins appropriés, y compris un milieu fictif qui n’a pas été en contact avec les cellules pour tenir compte des protéines solubles et des lipoprotéines dans le milieu de culture et un témoin surnageant appauvri en VE pour démontrer l’isolement réussi des VE dans des milieux conditionnés qui contiennent encore des protéines solubles et des lipoprotéines.
L’isolation des VE à l’aide de la filtration et de l’ultracentrifugation dépend de l’opérateur qui s’assure qu’aucune pression excessive n’est appliquée aux surnageants de culture cellulaire lorsqu’ils passent à travers l’alésage du filtre ou l’alésage de l’aiguille ou de la seringue. L’application d’une force excessive à cette étape du protocole décrit peut rompre les VE, influencer les concentrations finales de VE et générer de l’ARN libre, des protéines et des métabolites, qui étaient autrefois enfermés dans les VE. Nous avons décrit ici une méthode qui ne nécessite pas le corps de la seringue et donc l’application d’une force aux VE dans des médias conditionnés lorsqu’ils passent à travers le filtre ou l’aiguille dans leurs réservoirs de collecte et leurs tubes d’ultracentrifugation. Néanmoins, des précautions supplémentaires doivent être prises lors de la remise en suspension de la pastille EV dans le PBS. Seul un bref vortex doit être utilisé, car un vortex vigoureux peut perturber les membranes des VE.
Après l’ultracentrifugation, les opérateurs doivent faire attention aux tubes d’ultracentrifugation afin de ne pas perturber les granulés de VE. Cela peut être réalisé en manipulant les tubes avec soin et en les déplaçant lentement entre le rotor d’ultracentrifugation et le rack de tubes. Des précautions supplémentaires doivent être prises lors du perçage d’un trou dans le haut du tube d’ultracentrifugation pour aspirer les surnageants appauvris en VE. L’insertion de l’aiguille dans le haut du tube et l’aspiration rapide des surnageants créeront un vide dans le corps de la seringue, ce qui peut violemment forcer le surnageant à retourner dans le tube d’ultracentrifugation et perturber la pastille EV. Après avoir coupé le tube d’ultracentrifugation pour évacuer le surnageant restant, des précautions doivent être prises car la pastille EV peut se détacher et le versement jettera la pastille EV. Alternativement, une seringue et une aiguille peuvent être utilisées pour retirer lentement le surnageant restant sans verser ou retourner le tube.
La filtration et l’ultracentrifugation des surnageants pour l’isolement des VE sont une méthode utile et efficace. Mais il est susceptible de co-isoler les lipoprotéines et les protéines solubles. Ceux-ci peuvent être atténués en lavant les VE avec du PBS (comme décrit), mais cela n’éliminera pas tous les contaminants. Les protéines solubles peuvent être éluées de la fraction EV en utilisant la SEC, cependant, cette méthode ne fait pas la distinction entre les lipoprotéines et les VE. Les élutions SEC qui contiennent des VE peuvent être combinées à l’ultracentrifugation des VE à granulés. La filtration et l’ultracentrifugation différentielle sont une méthode privilégiée d’isolement des VE par rapport aux techniques de précipitation, qui utilisent du polyéthylène glycol, car ces méthodes de précipitation co-isolent de grandes quantités de protéines solubles et de lipoprotéines dans les surnageants de culture cellulaire et autres fluides biologiques. L’ultracentrifugation restera probablement la forme la plus accessible d’isolement des VE pour beaucoup, car la plupart des laboratoires sont équipés d’une ultracentrifugeuse, ce qui atténue les coûts de démarrage initiaux. Mais pour beaucoup, l’ultracentrifugation pour l’isolation des VE est entravée par le volume des tubes d’ultracentrifugation et le volume de départ du matériau. Plusieurs centaines de millilitres de surnageants de culture peuvent être nécessaires pour produire une quantité suffisante d’EV pour la protéomique en aval ou le séquençage de l’ARN. Cependant, il est probable que les techniques d’ultra-centrifugation pour l’isolement des VE seront accompagnées d’autres techniques telles que la capture SEC et la capture par immunoaffinité à l’aide des tétraspanines CD9, CD63 et CD81 pour améliorer la pureté des VE isolés. D’autres techniques, telles que les solutions de précipitation disponibles dans le commerce et la cytométrie en flux, peuvent être utiles dans des investigations spécifiques.
Pureté des préparations EV
Nous avons confirmé l’isolement des VE dérivées d’adipocytes par western blot pour TSG101, mais ce seul western blot est en deçà des directives publiées par l’International Society for Extracellular Vesicules (ISEV). Une caractérisation plus poussée de ces VE dérivées d’adipocytes serait idéale en utilisant les tétraspanines CD9, CD63 et CD81 pour identifier les exosomes et les marqueurs de contamination cellulaire tels que l’histone H3, l’albumine et l’apolipoprotéine A1.
Le protocole présenté ici permet d’isoler les VE à partir de surnageants de culture cellulaire à partir d’une gamme de sources cellulaires, y compris les adipocytes, pour la détermination de la taille, de la concentration, des marqueurs EV par transfert Western et de l’utilité dans les technologies basées sur les omiques telles que la protéomique et le séquençage de l’ARN.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
N.A. et R.C. reconnaissent le soutien par des subventions de recherche de la British Heart Foundation et du Centre of Research Excellence, Oxford (N.A. et R.C. ; RE/13/1/30181 et RE/18/3/34214), subvention de projet de la British Heart Foundation (N.A. et R.C. ; PG/18/53/33895), le Consortium tripartite sur l’immunométabolisme, la Fondation Novo Nordisk (NNF15CC0018486), l’Institut national de recherche en santé (NIHR), le Centre de recherche biomédicale d’Oxford (BRC), Nuffield Benefaction for Medicine et le Wellcome Institutional Strategic Support Fund (ISSF). Les opinions exprimées sont celles de l’auteur ou des auteurs et ne sont pas nécessairement celles du NHS, du NIHR ou du ministère de la Santé.
matériels
| Name | Company | Catalog Number | Comments |
| 100 µm mesh | Sefar | 03-250/50 | |
| 15 mL Conical Tube | Sarstedt | 62.554.002 | |
| 250 µm mesh | Sefar | 03-100/44 | |
| 50 mL Conical Tube | Sarstedt | 62.547.004 | |
| Beckman Coulter, Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Bicinchoninic acid assay (BCA) | Thermo Scientific | 23225 | |
| Biotin | Sigma | B4639 | |
| BSA (essentially fatty acid free) | Sigma | A7030 | |
| Collagenase H | Sigma | 11074032001 | |
| Dexamethasone | Sigma | D2915 | |
| Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 | Sigma | D6421 | |
| Fetal bovine serum | Labtech | FCS-SA | |
| Fibroblast growth factor | Bio-Techne | 233-FB-025 | |
| Glutamine | ThermoFisher | 25030024 | |
| Hanks balanced salt solution | Sigma | H9394 | |
| Human insulin | ThermoFisher | 12585-014 | |
| Hypodermic needles, Microlance 16G | VWR | 613-3897 | |
| IBMX | Sigma | I7018 | |
| Nanoparticle Tracking Analysis, Zetaview | Particle Metrix | BASIC PMX-120 | |
| NEFA kit | Randox | FA115 | |
| Pantothenate | Sigma | P5710 | |
| Penicillin and Streptomycin | ThermoFisher | 15140122 | |
| Phosphate buffered saline | ThermoFisher Scientific | 10010056 | |
| PluriStrainer 200 µm | Cambridge Bioscience | 43-50200-03 | |
| Polyallomer Quick-Seal ultra-clear 16 mm × 76 mm tubes | Beckman Coulter | 342413 | |
| Single use syringes, 2-piece, Injekt Solo | VWR | 20-2520 | |
| Sodium linoleate | Sigma | L8134 | |
| Sodium oleate | Sigma | O7501 | |
| Sodium palmitate | Sigma | P9767 | |
| Soldering Iron | Zacro | 7.14954E+11 | |
| Syringe Filter 0.2 µm | Sarstedt | 83.1826.001 | |
| Syringe Filter 0.45 µm | ThermoFisher | 195-2545 | |
| T175 cm2 tissue culture flasks | Sarstedt | 83.3912.002 | |
| T25 cm2 tissue culture flasks | Sarstedt | 83.3910.002 | |
| T75 cm2 tissue culture flasks | Sarstedt | 83.3911.002 | |
| Transferrin | Sigma | T8158 | |
| Triiodo-L-thyronine | Sigma | T5516 | |
| Troglitazone | Sigma | T2573 | |
| TrypLE Express Enzyme | Fisher Scientific | 12604021 |
Références
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Akbar, N., et al. Endothelium-derived extracellular vesicles promote splenic monocyte mobilization in myocardial infarction. JCI Insight. 2 (17), (2017).
- Xiao, Y., et al. Extracellular vesicles in type 2 diabetes mellitus: key roles in pathogenesis, complications, and therapy. Journal of Extracellular Vesicles. 8, 1625677(2019).
- Akbar, N., Azzimato, V., Choudhury, R. P., Aouadi, M. Extracellular vesicles in metabolic disease. Diabetologia. 62 (12), 2179-2187 (2019).
- Kobayashi, Y., et al. Circulating extracellular vesicles are associated with lipid and insulin metabolism. The American Journal of Physiology-Endocrinology and Metabolism. 315 (4), 574-582 (2018).
- Eguchi, A., et al. Circulating adipocyte-derived extracellular vesicles are novel markers of metabolic stress. Journal of Molecular Medicine. 94 (11), Berlin, Germany. 1241-1253 (2016).
- Crewe, C., et al. An Endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 175 (3), 695-708 (2018).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363 (6430), 989-993 (2019).
- Deng, Z. B., et al. Adipose tissue exosome-like vesicles mediate activation of macrophage-induced insulin resistance. Diabetes. 58 (11), 2498-2505 (2009).
- Kranendonk, M. E., et al. Human adipocyte extracellular vesicles in reciprocal signaling between adipocytes and macrophages. Obesity. 22 (5), Silver Spring. 1296-1308 (2014).
- Song, M., et al. Adipocyte-derived exosomes carrying sonic hedgehog mediate M1 macrophage polarization-induced insulin resistance via Ptch and PI3K pathways. Cellular Physiology and Biochemistry. 48 (4), 1416-1432 (2018).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10 (3), 881-906 (2018).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments: JoVE. (95), e50974(2015).
- Connolly, K. D., et al. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 159 (9), 3259-3267 (2018).
- Camino, T., et al. Vesicles shed by pathological murine adipocytes spread pathology: characterization and functional role of insulin resistant/hypertrophied adiposomes. International Journal of Molecular Sciences. 21 (6), 2252(2020).
- Zhu, Y., et al. Extracellular vesicles derived from human adipose-derived stem cells promote the exogenous angiogenesis of fat grafts via the let-7/AGO1/VEGF signalling pathway. Scientific Reports. 10 (1), 5313(2020).
- Sadallah, S., Eken, C., Schifferli, J. A. Erythrocyte-derived ectosomes have immunosuppressive properties. Journal of Leukocyte Biology. 84 (5), 1316-1325 (2008).
- Sudnitsyna, J., et al. Microvesicle formation induced by oxidative stress in human erythrocytes. Antioxidants. 9 (10), Basel. (2020).
- Helal, O., et al. Increased levels of microparticles originating from endothelial cells, platelets and erythrocytes in subjects with metabolic syndrome: relationship with oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases. 21 (9), 665-671 (2011).
- Agouni, A., et al. Endothelial dysfunction caused by circulating microparticles from patients with metabolic syndrome. The American Journal of Pathology. 173 (4), 1210-1219 (2008).
- Park, J., Park, J., Nahm, S. -S., Choi, I., Kim, J. Identification of anti-adipogenic proteins in adult bovine serum suppressing 3T3-L1 preadipocyte differentiation. BMB Reports. 46 (12), 582-587 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon