Method Article
ろ過および超遠心分離法を用いたヒト脂肪細胞由来細胞外小胞の単離とキャラクタリゼーション
要約
ヒト脂肪細胞由来の細胞外小胞(EV)を臀部および腹部脂肪組織から濾過および超遠心分離を使用して単離する方法について説明します。単離された脂肪細胞由来のEVは、ナノ粒子追跡分析と、EVタンパク質腫瘍感受性遺伝子101(TSG101)の存在に対するウェスタンブロッティングによってサイズと濃度を決定することにより、特徴付けます。
要約
細胞外小胞(EV)は、タンパク質、RNA、代謝物、脂質などの生物学的に活性な物質を運ぶ脂質封入エンベロープです。EVは、組織微小環境内で、または末梢血への遊離を通じて、他の細胞の細胞状態を局所的に調節することができます。脂肪細胞由来のEVは、末梢血中で上昇し、肥満や糖尿病などの代謝障害の際にカーゴ(RNAやタンパク質)に変化を示します。脂肪細胞由来のEVは、内皮細胞や脂肪組織常在マクロファージなど、隣接する血管細胞の細胞状態を調節して、脂肪組織の炎症を促進することができます。末梢血由来のEVは非常に不均一であり、血小板、内皮細胞、赤血球、筋肉などの他の供給源からのEVを含んでいるため、in vivoでの脂肪細胞由来EVの変化の調査は複雑です。したがって、ヒト脂肪細胞の培養は、脂肪細胞由来のEVを研究するためのモデルシステムを提供します。ここでは、ろ過および超遠心分離を使用して、ヒト臀部および腹部脂肪細胞の細胞培養培地から全小型EVを抽出するための詳細なプロトコルを提供します。さらに、EVのサイズと濃度を定量化するためのナノ粒子追跡分析(NTA)の使用を実証し、臀部および腹部脂肪細胞由来のEVにおけるEVタンパク質腫瘍感受性遺伝子101(TSG101)の存在を示します。このプロトコルから単離されたEVは、透過型電子顕微鏡、プロテオミクス、メタボロミクス、small RNAシーケンシング、マイクロアレイなどのダウンストリーム分析に使用でき、機能的なin vitro/in vivo研究に利用できます。
概要
細胞外小胞(EV)は、タンパク質、マイクロRNA、代謝物、脂質などの生物学的に活性な物質を運ぶ脂質封入エンベロープです。EVという用語は、エクソソーム、マイクロベシクル(微粒子/エクトソーム)、アポトーシス体1を含むさまざまな亜集団を意味します。EVは、病理学的シグナル伝達に関与し、血液や尿などの生体液に放出されるため、バイオマーカーとして役立つ可能性があります。EVは、組織微小環境において、または末梢血への遊離を通じて、他の細胞の細胞状態を局所的に調節することができる2。EVは親細胞の特徴を持っていますが、各亜集団の分化は、主にEVのサイズと、テトラスパニン(CD9、CD63、CD81)、腫瘍感受性遺伝子101(TSG101)、ALG-2相互作用タンパク質X(ALIX)の存在などのEVマーカーなどのタンパク質含有量に基づいています。これらのタンパク質マーカーは、エキソソームのエンドソーム起源(CD9、CD63、およびCD81)を代表しており、エキソソームは多小胞体内で生成されるか、または微小胞の原形質膜から直接出芽またはブレブングに関連するタンパク質を表します。しかし、これらの亜集団の間には大きな重複があり、血漿、血清、尿などの複雑な生体液中の個々の亜集団を区別することは困難です。
肥満、インスリン抵抗性、細胞外グルコース、酸素、炎症の摂動などの代謝障害は、EVとその貨物のサイズと濃度を変化させる可能性があります。脂肪細胞由来のEVは、ペリリピンA、アディポネクチンを運び、肥満や糖尿病の際にタンパク質とRNAの貨物に変化を示します3,4,5,6。脂肪細胞由来のEVは、隣接する血管内皮細胞7および脂肪組織常在マクロファージの細胞状態を調節して、脂肪組織の炎症およびインスリン抵抗性8,9,10,11を促進する。血漿、血清、尿などの複雑な生体液に由来するEV集団には、血小板、内皮細胞、赤血球、筋肉など複数の供給源からのEVが含まれており、代謝機能障害や疾患の病因に関与しているため、in vivoでの脂肪細胞由来EVの変化を調べることは複雑です。
したがって、ヒト前駆脂肪細胞の培養とin vitro分化は、脂肪細胞由来EVの研究のためのモデルシステムを提供します。ここでは、シリンジろ過と超遠心分離を使用して、ヒト脂肪細胞の細胞培養培地から全小型EVを抽出するための詳細なプロトコルを提供します。超遠心分離は、簡単に入手でき、予備の専門知識がほとんど必要ないため、EVの分離方法として依然として人気があります。しかし、沈殿法、サイズ排除クロマトグラフィー、テトラスパニンを用いた免疫親和性捕捉などの他の方法により、血漿、血清、尿、コンディショニング細胞培養培地など、さまざまな生体液からEVを分離することができます。ここで説明する超遠心分離プロトコルを含む各方法は、可溶性タンパク質とリポタンパク質を共単離できるため、さまざまな純度のEV調製物を生成します。これは、EVとしてマスクされる可能性があります。この超遠心分離プロトコルを、密度遠心分離、サイズ排除クロマトグラフィー、免疫親和性捕捉などの他の方法と組み合わせることで、単離されたEVの純度が劇的に向上します。しかし、超遠心分離と同様に、これらの他の方法では、血液、血漿、尿などの複雑なサンプルからEVの独立した亜集団を捕捉することはできません。したがって、選択した細胞集団の培養は、細胞特異的なEVを高収率で生成するための最も堅牢な方法の1つであり続けています。各EV法には多くの注意点があり、方法の選択は単離されたEVの種類とその濃度に影響を与える可能性があり、細胞および組織シグナル伝達の下流のメカニズム調査と診断研究のためのEVカーゴの決定に偏りを与える可能性があります。EV絶縁に関するこれらの方法論的問題については、他の場所や4、12の下の制限セクションで説明しています。ここでは、ろ過と超遠心分離を用いたヒト脂肪細胞由来EVの単離について述べます。さらに、EVのサイズと濃度を定量化するためのナノ粒子追跡分析(NTA)の使用を実証し、ヒト脂肪細胞由来のEVにおけるEVタンパク質腫瘍感受性遺伝子101(TSG101)の存在を示します。このプロトコルから単離されたEVは、透過型電子顕微鏡、プロテオミクス、メタボロミクス、small RNAシーケンシング、マイクロアレイなどのダウンストリーム分析に使用でき、機能的なin vitro/in vivo研究に利用できます。
プロトコル
すべての方法は、オックスフォード大学の機関倫理審査委員会によって承認されました。脂肪組織は、健康なボランティアからの局所麻酔下での針生検によって得られました。
1. 細胞培養培地およびバッファーの調製
- コラゲナーゼH(1 mg/mL)をHanks Balanced Salt Solution(HBSS)(塩化カルシウムおよび塩化マグネシウムを含まない)に溶解し、0.2 μmのポアシリンジフィルターを使用して滅菌フィルターを溶解することにより、コラゲナーゼ消化バッファーを調製します。
- コラゲナーゼ消化バッファーは、使用の10分以内に調製してください。
- 次のように増殖培地(GM)を調製します:10%ウシ胎児血清(FBS)、100単位/ mLペニシリン、100μg / mLストレプトマイシン、2 mM L-グルタミン、および0.5 ng / mL線維芽細胞成長因子(FGF)を添加したダルベッコの修正されたイーグルの培地/ハムの栄養混合物F12(DMEM / F12)。.
- DMEM/F12に100単位/mLのペニシリン、100 μg/mLのストレプトマイシン、2 mM L-グルタミン、17 μMのパントテン酸、100 nMのヒトインスリン、10 nMのトリヨード-L-チロニン、33 μMのビオチン、10 μg/mLのトランスフェリン、および1 μMのデキサメタゾンを添加したDMEM/F12を調製します。
- ステップ 1.3 の塩基性 DM に 0.25 mM 3-イソブチル-1-メチルキサンチンと 4 μM のトログリタゾンを添加して、完全分化培地(完全 DM)を調製します。
- 以下のように、10%の本質的に脂肪酸を含まないウシ血清アルブミン(BSA)に錯体化した10 mM脂肪酸ストック溶液を調製します。
- 16 gのBSAを160 mLのDMEM/F12培地に溶解し、37°Cに温めます。 3本の別々の50 mLコニカルチューブで、150 mgのオレイン酸ナトリウム、139 mgのパルミチン酸ナトリウム、および151 mgのリノール酸ナトリウムを計量します。温めたBSA溶液50 mLを各チューブに加え、ボルテックスを繰り返してよく混合します。
- オレイン酸チューブとリノール酸チューブを37°Cのウォーターバスに15分間戻します。完全に溶解するまでボルテックスで混合します。
- パルミチン酸溶液の場合は、チューブを65°Cのウォーターバスに2〜3分間入れます。ボルテックスで激しく混ぜます。
- 手順1.5.3を完全に溶解するまで、約30分間繰り返します。
注:一部の小さな粒子はまだ表示されている場合があります。 - 0.2 μmのポアシリンジフィルターを使用して脂肪酸溶液を滅菌ろ過します。
- 適切なアッセイを用いて、各ストック溶液の非エステル化脂肪酸濃度を確認してください。
注:脂肪酸とBSAの間のモル比を6:1にするためには、脂肪酸ストックを10 mM(±10%)にする必要があります。濃度がこの範囲外の場合は、原液を作り直す必要があります。ストック溶液は分注し、-30°Cで保存できます。
2. ヒト脂肪組織生検の消化
- 50 mLの円錐形チューブに取り付けられた200 μmの滅菌セルストレーナーを介して生検シリンジの内容物をゆっくりと濾し、脂肪組織がストレーナーに収集されるようにします。
- ストレーナーを新しい50 mLコニカルチューブに移し、10 mLのHBSSで脂肪組織を3回洗浄します。
注:外科用ハサミで血栓や線維組織を取り除くか、HBSS洗浄を繰り返して余分な赤血球を取り除く必要がある場合があります。 - 洗浄したティッシュの重さを量ります。
注:通常、針生検により400〜800mgの組織を採取します。 - コラゲナーゼ消化バッファーを滅菌済みの50 mLコニカルチューブに入れ、洗浄した組織を加えます。このステップでは、手術用ハサミを使用して、組織を同じサイズに細かく刻むことができます。
注:組織0.5 gあたり5 mLの緩衝液を使用してください。より大きな組織の場合、サンプルはペトリ皿で細かく刻むことができます。 - チューブを37°Cの振とう水浴に入れ、35〜40分間インキュベートします。
注:消化が成功すると、溶液は乳白色に見えるはずです。それでも組織の小片が見える場合は、手でさらに10〜20秒間振とうします。
3. 前駆脂肪細胞の単離
- プレアドポサイト画分をペレット化するには、1,000 x g で5分間遠心分離します。
- 浮遊脂肪細胞層と上清を吸引して廃棄し、細胞ペレットを覆うHBSSを約1mL残します。
- ペレットを5mLのHBSSに再懸濁し、細胞懸濁液を250μmの細孔サイズのメッシュに通し、続いて100μmのメッシュに通して、未消化の物質を取り除きます。細胞懸濁液を15mLのコニカルチューブに集めます。
- 1,000 x g で5分間遠心分離します。
注:このステップの後、赤血球の汚染が問題となる場合は、前駆細胞画分を赤血球溶解液で処理できます。 - 上清を吸引して捨てます。
- 細胞ペレットを5mLのGMに再懸濁し(ステップ1.2)、25cm2の接着性組織培養フラスコに播種します。フラスコを細胞培養インキュベーター(5% CO2、37°C)に入れます。
4. 前駆脂肪細胞培養の維持
- 細胞が増殖している間、2日ごとにGMを交換します
注:細胞増殖速度はドナーによって異なる場合があります。- 細胞が約80%のコンフルエントに達したら、75 cm2 の接着組織培養フラスコに移します。GMを取り外し、細胞をリン酸緩衝生理食塩水(PBS)で洗浄します。
- PBSを廃棄し、0.5 mLの高度に精製された細胞解離酵素を加えて、付着した細胞を解離します。37°Cで5分間インキュベートします。
- フラスコを強く叩いて細胞を放出し、5 mLのGMを加えます。細胞懸濁液を15 mLのコニカルチューブに集めます。
- 1,000 x g で5分間遠心分離します。
- 上清を吸引して捨てます。細胞ペレットを5mLのGMに再懸濁し、75 cm2 フラスコに移します。GMを最終容量12 mLまで補充し、細胞培養インキュベーター(5% CO2、37°C)のフラスコを交換します。
注:細胞を維持するために、GMを2〜3日ごとに交換し続けます。細胞が80%のコンフルエントに達したら、手順4.2〜4.3を繰り返し、細胞を1:3で新しい75 cm2 フラスコに分割します。これを、実験セットアップに十分な数の細胞が生成されるまで、数回の継代で繰り返すことができます。10継ぎ以上は、前駆細胞の増殖能力や分化能が低下するため、推奨しません。
5. 脂肪分化のための前駆脂肪細胞の播種
- 血球計算盤を使用して細胞をカウントし、200,000個の細胞を2 mLのGM中の6ウェルプレートの複数のウェルに播種します。あるいは、22 mLのGM培地に175 cm2 フラスコあたり350万個の細胞を播種します。
- 細胞が完全に合流するまでさらに2〜4日間増殖させ、培養の2日目にGMを変更します。
- 脂肪分化を開始するには、GMを取り外し、4日間完全なDMと交換します(6ウェルプレートのウェルあたり2 mL、175 cm2 フラスコのウェルあたり22 mL)。
注:2日目に新しい完全なDMと交換します。 - 4日目に、完全なDMを取り出し、22.5 μMオレイン酸、15 μMパルミチン酸、および12.5 μMリノール酸を添加した2 mL塩基性DMと交換して、6ウェルプレートのウェルあたり50 μM、または175 cm2 フラスコのウェルあたり22 mLの総脂肪酸濃度が得られます。さらに10日間、2日ごとにメディアと交換します。
注:7日目以降、分化している前駆脂肪細胞に脂肪滴が見えるはずです。 - 培養14日目に、脂肪細胞由来EVを単離するために細胞から培地を回収します。
6. 細胞外小胞の単離または保存および将来の細胞外小胞単離のための細胞培養上清の調製
- 各6ウェルプレートから細胞培養上清を取り除き、組み合わせます。15 mLのチューブに加えるか、175 cm2 のフラスコからすべての細胞培養上清を取り除き、50 mLのチューブに加えます。
- 1000 x g で4°Cで10分間遠心分離します。
- 上清を新しいきれいな15 mLまたは50 mLのチューブにそれぞれ注いでデカントします。
- 10 mLシリンジのバレルを取り外し、0.45 μmシリンジフィルターを取り付けます。
- 上清をシリンジリザーバーに注ぎ、親指または手のひらでシリンジバレルの開口部に穏やかな圧力を加え、細胞培養上清がフィルターを自由に通過するまで押します。
注:このろ過ステップの速度は、シリンジフィルターのタイプによって異なります。 - 濾液を清潔な50mLチューブに集めます。
注:必要に応じて、コンディショニングされたろ過媒体は、この時点で-80°Cで数週間保存できます。必要に応じて、細胞培養上清を4°Cで解凍し、1000 x g で4°Cで10分間遠心分離します。 上清を注いできれいなチューブにデカントしてから、EVアイソレーションを続行します。
7. 細胞外小胞の単離
- 13 mLの超遠心チューブにラベルを付け、予想されるEVペレットが形成されるチューブの底に円を描き、チューブの首の周りに超遠心チューブローターの向きを示す線をマークします。チューブにサンプル識別子をラベル付けします。
- チューブをチューブホルダーに入れます。
- 10mLシリンジに16Gの針を取り付け、シリンジバレルを取り外します。
- 針から保護カバーを取り外し、針を超遠心チューブの首に挿入します。
- 細胞培養上清をシリンジに直接注ぎ、超遠心チューブに充填します。
- 必要に応じてチューブにPBSをいっぱいになるまで補充します。
注意: 必要に応じてチューブがわずかにオーバーフローするようにし、超遠心チューブに空気空間や気泡がないことを確認します。 - はんだごてを使用して超遠心チューブを密封し、チューブを静かに絞ってチューブが気密であることを確認します。
- 超遠心チューブを超遠心分離ローターに入れます。チューブの上部にマークされた線とチューブの基部に描かれた円が、EVペレットが形成される外側を向いていることを確認してください。
- 120,000 x g で4°Cで2時間超遠心分離します。
- ローターを超遠心分離機から慎重に取り外します。
- ローターから超遠心チューブを取り外し、チューブホルダーに入れます。
- 10mLのシリンジに16Gの針を取り付けます。
- 超遠心チューブの上部に穴を開け、チューブの上部に針を2cm挿入し、上清をシリンジに吸引します。
- このEVが枯渇した上清を1.5 mLチューブにデカントし、-80°Cで凍結します。
- 針をチューブに再挿入し、残りの上清を慎重に吸引して廃棄します。
- はさみでチューブの上部を切ります。
- 残りの上澄み水を1回の素早い操作で注ぎます。
- チューブを逆さまに1分間吊るします。
- チューブ上に形成された液体をペーパータオルで軽くたたいて乾かします。
- チューブを反転させ、チューブホルダーに入れます。
- 100 μLのPBSをチューブに加えます。
- ピペットの先端を使用して、ステップ7.1でマークした領域で円を描くようにチューブの基部にあるEVペレットをゆっくりと取り除きます。
- 渦を短時間(1〜2秒)、2回渦巻きます。
- 新しい13 mL超遠心チューブにラベルを付けるには、チューブの底部に円を描き、予想されるEVペレットが形成され、チューブのネックの周りに超遠心チューブローターの向きを示す線をマークします。チューブにサンプル識別子をラベル付けします。
- チューブをチューブホルダーに入れます。
- 清潔なシリンジと針を使用して、新しい超遠心チューブに12 mLのPBSを加えます。
- シリンジと針を使用して、100 μL の EV サンプルを採取し、チューブに加えます。EVとPBSを慎重に混合し、PBSを穏やかに集めてチューブに吸引することにより、シリンジと針をすすぎます。
注:バブルの作成は避けてください。 - はんだごてを使用して超遠心チューブを密封し、チューブを静かに絞ってチューブが気密であることを確認します。
- 超遠心チューブを超遠心分離ローターに入れます。チューブの上部にマークされた線とチューブの基部に描かれた円が外側を向いていることを確認してください。
- 120,000 x g で4°Cで1時間超遠心分離します。
- ローターを超遠心分離機から慎重に取り外します。
- 12mLシリンジに16Gの針を取り付けます。
- 超遠心チューブの上部に穴を開け、チューブの上部に針を最大2cm挿入します。上清を注射器に吸引し、廃棄します。
- はさみでチューブの上部を切ります。
- 残りの上澄み水を1回の素早い操作で注ぎます。
- チューブを逆さまに1分間吊るします。
- チューブの端に形成された液体を軽くたたいて乾かします。
- チューブをチューブホルダーに入れます。
- 100 μLのPBSをチューブに加えます。
- ピペットの先端を使用して、ステップ7.24でマークされた領域で円を描くようにチューブの基部にあるEVペレットをゆっくりと取り除きます。
- 渦を短時間(1〜2秒)、2回渦巻きます。
- 100 μLのPBS/EV溶液を清潔な1.5 mLチューブにピペットで移し、濡れた氷の上に置いておきます。
注:EVは下流処理の準備ができており、-80°Cで冷凍して保存することができます。
8. ナノ粒子トラッキング解析(NTA)によるEVサイズ・濃度の決定
- システムの準備
注:EVのサイズと濃度を決定するためのナノ粒子追跡分析(NTA)の使用に関する詳細な方法は、Mehdianiらによって報告されました13。- サンプルを解凍し、4°Cに保ちます。
- ソフトウェアアイコンをクリックして、NTAソフトウェアを起動します。
- ソフトウェアが「セルチェック」で開き、フローセルに脱イオン水を充填するように促します。10 mLシリンジに脱イオン水を入れ、気泡がローディングチャンバーに入らないように機械に押し込みます。
- 画面の指示に従って、品質チェック(QC)を通じてシステムを準備します。ソフトウェアは細胞チェックを実行し、細胞の品質を測定します。これは非常に良いから優れたはずです。
- 100ナノメートルのポリスチレンビーズからなる品質管理を準備します。標準試料1μLを999μLの脱イオン水(希釈ストック)にピペットで移します。続いて、希釈したストック液10 μLを2.5 mLの脱イオン水(QCサンプル)に加えます。2〜3秒間穏やかにボルテックスし、ピペッティングして溶液を混合します。
注:品質管理サンプルは毎日新たに調製する必要がありますが、最初の希釈ストックサンプルは4°Cで1週間安定しています。 - 1 mLシリンジに1 mLのQCサンプルを充填し、シリンジからすべての気泡を取り除きます。
- 気泡を含まずに、シリンジの先端を注入チャンバーにゆっくりと傾け、同時にプランジャーを押してNTAサンプルローディングチャンバーに注入します。最大950μLのQCサンプルをチャンバーに注入します。
注:サンプルローディングチャンバーに気泡を入れないでください。 - ソフトウェアが自動アライメント(カメラの焦点を合わせるため)を実行し、Z電位の読み取り値の電圧をチェックするのを待ちます-電圧グラフは滑らかなU字型の曲線である必要があります。
注意: 「電圧が低すぎるエラー」というエラーメッセージが表示される場合は、セルがクリーニングで濡れているか、固定されていないか、気泡が発生している可能性があります。 - 自動アライメント/電圧チェックが完了したら、カメラ位置ドロップダウンを使用して、すべての位置(0.1-0.9)に異常なマークがないか確認します。これらのマークが存在する場合は、セルのフラッシングやクリーニングが必要であることを示しています。QC後、システムは「測定の準備ができました」と表示します。
- PBSでフローセルをプライムします。[Pump/Temp] タブを開き、[Pump] で [Run for pump 2 (PBS reservoir)] をクリックします。これにより、PBSがセルに1分間通され、その後自動的に停止します。
注:チャンバー内に粒子が混入している可能性がありますが、10mLのPBSをローディングポートに押し込むことで除去できます。 - 10mLシリンジにPBSを充填し、気泡が出ないようにチャンバーにロードします。
- レーザーの複数の位置を測定し、フレームあたりの粒子を平均化するデバイスの実行プロトコルを作成します。
- 先に進む前に、粒子数が5未満(できるだけ0に近い)であることを確認してください-必要に応じて、より多くのPBSでフラッシュします。
- 希釈する前に、EVサンプルをピペッティングで混合します。
- サンプルをPBSで1:1,000に希釈し、ピペッティングで混合します。1 mLシリンジにサンプルを充填し、気泡が入らないようにチャンバーにロードします。
- パーティクル数が許容範囲内にあることを確認します (カウント値の上のバーが緑色の領域内にあるか、それに近い必要があります)。そうでない場合は、それに応じてサンプルの希釈を調整します。サンプルとサンプル希釈の間に、10 mLのPBSをマシンの前面にロードしてチャンバーをクリアし、次に希釈したサンプル1 mLをロードします。
注:各サンプルは、サンプルの濃度に基づいて独立した希釈を行います。正確な測定のために、デバイスの粒子数はフレームあたり50〜200粒子である必要があります。 - ソフトウェアの [測定 ]タブに移動します。
- 「ビデオ撮影を実行」ボタンをクリックします。
- サンプル名を入力し、測定値を保存する保存先フォルダを選択します。
- EV 標準作業手順書 (SOP) を作成します。
- シャッタースピード100、カメラ感度80、11カメラ位置でパーティクルの数とサイズを2サイクルで測定するEV SOPを作成>保存>ロードします。
注:サンプルに特別な要件がない限り、これらの設定を変更する必要はありません。 - サンプルの希釈度を入力し、追加したい他のノートを追加します。
- [OK]をクリックすると、ソフトウェアが自動的に録音を開始します。完了すると、ソフトウェアは各カメラ位置の平均粒子数とサイズを示すポップアップテーブルを自動的に読み込みます。
注意: この間、振動が最終的な読み取りに影響を与えるため、機械や近くのカウンタートップに触れないでください。 - 統計的に異常な読み取り値を持つカメラ位置は自動的に除外されます-カメラ位置を手動で除外する(または何らかの理由で除外されたものを再含める)には、サンプル詳細の左側にあるチェックボックスをクリックします。
- [続行]をクリックすると、ソフトウェアがサイズと濃度の結果を含むサンプルのPDFを作成して開きます。
- シャッタースピード100、カメラ感度80、11カメラ位置でパーティクルの数とサイズを2サイクルで測定するEV SOPを作成>保存>ロードします。
- 統計分析
- NTAデータを一元配置または二元配置のANOVAと事後テューキー補正で分析します。データをグループ平均±標準偏差としてプロットします。<0.05のP値は有意であると考えられました。
結果
記載されているプロトコルに従って、ヒト臀部脂肪細胞から単離されたEVの量を決定しました。脂肪細胞由来EVのサイズと濃度をNTAを用いて計算しました(図1A,B)。我々は、細胞と接触していないが、培養され、上記の単離手順の対象となった同量の培地である偽培地コントロールを利用した。最初の単離後および単離された脂肪細胞EVをPBSで洗浄した後の脂肪細胞由来のEV濃度を測定し(図1A、B)、グループ平均±標準偏差(SD)をプロットしました。これは、事後テューキー補正を備えた二元配置ANOVAによって分析されました。
NTAによって測定された脂肪細胞由来EVの濃度は、1回目の単離から6.10 x 106から2.70 x 107の範囲であり、中央値は2.60 x 107 EV/mLでした(図1 A、B)。PBS洗浄後、サンプルあたりの脂肪細胞由来EVは有意に減少し(図1A、B)(P < 0.001)、これは5.00 x 105から4.30 x 106の範囲であり、中央値は2.70 x 106 EV/mLでした。国税庁が判断したように、シャムメディアコントロールにはEVは含まれていませんでした(図1A、B)。最初の分離からのEVのモードサイズは、PBS洗浄後125nmと105nmでした(図1A、B)。記載されたプロトコールをさらに、より大きなT175cm2フラスコからの腹部および臀部由来脂肪細胞に適用した。T175 cm2 フラスコから得られたこれらの臀部 EV サンプルの濃度は 3.60 x 107 から 7.50 x 107/mL で、中央値は 5.40 x 107 EVs/mL でした。T175 cm2フラスコからの腹部脂肪細胞由来EVの濃度は6.30 x 107から8.60 x 107/mLの範囲で、中央値は7.60 x 107 EV/mLでした(図1C、D)。T175cm2フラスコから派生したEVのモーダルサイズは、臀部EVが115nm、腹部EVが125nmでした。我々は、腫瘍感受性遺伝子101(TSG101)の免疫ブロッティングにより、臀部および腹部由来のEVにおけるEVタンパク質の存在を確認し、腹部および臀部脂肪細胞のペレットおよび腹部および臀部脂肪細胞由来のEVはTSG101に対して陽性であり、細胞と接触していない偽対照培地は陰性である(図1E)。
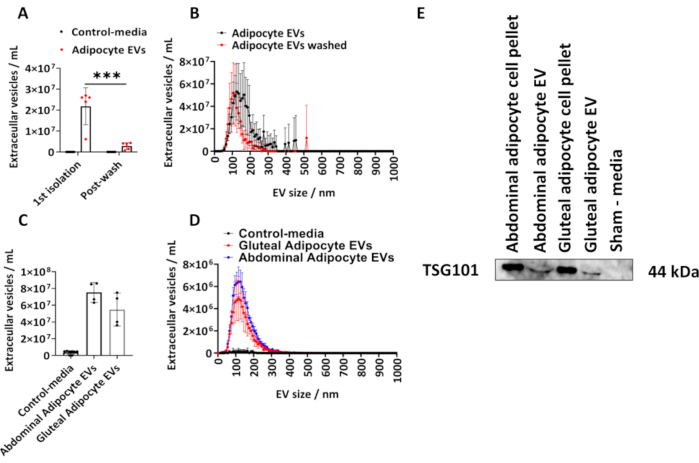
図1:細胞培養培地からの脂肪細胞由来EVのサイズと分布プロファイル、およびEVタンパク質TSG101の測定。 ナノ粒子トラッキング分析(NTA)によって決定された総EV濃度、サイズおよび濃度分布プロファイルは、1回目の 単離(N = 5)およびPBSによる洗浄後(N = 6)から得られます。(C)T175cm2 フラスコ(グループあたりN = 4)からの腹部および臀部由来のEVについてNTAによって決定された総濃度および(D)サイズと濃度分布プロファイル。(E)TSG101の臀部および腹部由来EVのウェスタンブロット。細胞ペレットおよび偽培地を、それぞれポジティブコントロールおよびネガティブコントロールとして使用した。データは、標準偏差(SD)±グループ平均です。一元配置または双方向の ANOVA と事後テューキー補正。P < 0.001 です。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
細胞培養上清から臀部および腹部脂肪細胞由来のEVを単離するためのプロトコルを実証し、NTA 7,14,15によってそれらのサイズと濃度を決定します。私たちは、培養されたヒト脂肪細胞がEVを産生して細胞培養培地に放出し、その後、ろ過と超遠心分離を使用して単離できることを示しました。単離された脂肪細胞由来のEVのサイズと濃度プロファイルを決定し、超遠心分離により細胞培養培地から共分離された汚染物質が分離された可能性が高く、単離されたEVペレットをPBSで洗浄すると、2回目のNTA測定でそれらの濃度が大幅に低下することを示しています。さらに、単離された臀部および腹部由来のEVの純度を、EVマーカーであるTSG101のウェスタンブロッティングにより決定しました。臀部および腹部由来のEV調製物はTSG101に対して陽性であったが、重要なことに、細胞に曝露されていない対照培地では陽性ではなかった。提示された実験では、EVを生成する親細胞としてヒト脂肪細胞を使用しましたが、記載された方法は、内皮細胞、血管平滑筋、骨格筋、免疫細胞などの他の細胞タイプ、および患者の血小板の乏しい血漿または血清からのEVの単離に適しています。
脂肪細胞由来のEVは代謝性疾患で上昇し、血液などの体液には、内皮細胞、骨格筋、赤血球、免疫細胞からのEVなど、代謝性疾患の病因にも関与する多くの細胞源からのEVが含まれているため、in vivoでの脂肪細胞EVのサイズと数の変化を決定することは複雑です。ここで説明する方法は、ヒト脂肪細胞のEVの決定を可能にし、これは、現在不明である脂肪細胞のEV生合成につながる要因を調査するメカニズム研究に有用なモデルを提供する可能性があります。重要なことは、脂肪細胞EVの生合成と、特定のRNA、タンパク質、代謝産物のロードが脂肪細胞EVにどのように調整されるかを決定することで、代謝機能障害における病原性脂肪細胞EVシグナル伝達を乱す新たな治療機会が明らかになる可能性があることです。詳細な研究により、酸素、グルコース、脂質、インスリンの摂動などの疾患や刺激に応答して、EVのサイズ、数、生合成経路、EVカーゴ(RNA、タンパク質、代謝物)がどのように変化するかについての理解を深めることができます。代謝性疾患における脂肪細胞EVシグナル伝達における環境因子の役割と、脂肪細胞由来EVが脂肪組織の炎症にどのように寄与するかに関する情報は、代謝性疾患における新たな治療標的を明らかにする可能性があります。
制限
脂肪細胞由来EVのin vitro作製
in vitroでヒト前駆脂肪細胞を使用することは、in vitro脂肪細胞の分化後の脂肪細胞由来EVの放出と生成を研究するためのモデルシステムを提供しますが、いくつかの制限があります。特に、in vitro由来の脂肪細胞EVは、血漿14 などの生体液から回収された脂肪由来のEVとは、サイズ、濃度、EVタンパク質、-RNA、代謝物、および機能が異なる可能性があります。これらのEVの違いは、脂肪組織由来幹細胞、内皮細胞、マクロファージなど、in vivoで脂肪組織に常在する他の非脂肪細胞細胞の影響を受ける可能性があります。これらは脂肪組織の生理機能と密接に関連しており、脂肪組織の炎症を含む脂肪組織の病理学で役割を果たしています。
ここで述べる2週間のin vitro分化プロトコルは、in vivoで見られるものと同等の完全に成熟した脂肪細胞を生成するのに十分ではないかもしれないことに留意すべきである;二次元(2D)形式で増殖したin vitro分化脂肪細胞は、in vivo細胞とは異なる形態を示し、単房性脂肪滴を生じません。さらに、このプロトコルに記載されている前駆脂肪細胞は、脂肪間質血管画分から得られ、細胞単離中に完全に排除されなかった他の細胞タイプからのEVプールへの寄与を評価していません。
脂肪組織における脂肪細胞と他の非脂肪細胞との重要な細胞間相互作用の喪失は、脂肪細胞のEV生成、放出、脂肪細胞からのEVタンパク質およびEV-RNAに影響を与え、脂肪組織由来幹細胞に影響を与える可能性がある16。しかし、in vitro由来の脂肪細胞EVがin vivoで産生されたものとどのように異なるかの評価は、完全には行われていません。
一次組織生検には血液が含まれているため、誘導された細胞培養物には、当社のプロトコルで強調されている複数の洗浄や培地の変更に関係なく、赤血球と赤血球由来の EV が含まれる場合があります。脂肪細胞に対する赤血球の影響を排除するために、間質血管画分の単離に続く追加の赤血球溶解ステップが必要になる場合があります。.赤血球由来のEVは他の細胞の細胞機能に影響を与える可能性があり17、酸化ストレスの存在下18およびメタボリックシンドロームの患者19,20では赤血球由来のEVが上昇するため、これは重要です。したがって、代謝性疾患患者に由来する脂肪組織には、赤血球由来のEVが高濃度で含まれている可能性があり、これが脂肪細胞のin vitro表現型に影響を与える可能性があります。
FBSの廃止
記載されたプロトコルは、脂肪形成分化中に増殖培地中のFBSを利用したが、その後、脂肪細胞は、脂肪細胞由来EVの単離のための最終培地収集の前に複数の培地交換を受けた。したがって、FBS由来EVのEV調製物中の汚染リスクは全体的に低いと仮定し、その後、TSG101のウェスタンブロッティングにより、細胞培養培地に残留EVが存在しないことを確認しました。FBSを必要とする細胞源から細胞培養されたEVを単離するには、EV枯渇FBSを使用するか、超遠心分離によってウシEVを枯渇させる必要があります。これは、ウシEVが脂肪細胞のEV濃度を交絡させないようにするためであり、脂肪細胞のEVカーゴの分析も必要である。脂肪細胞からの血清の枯渇は、脂肪細胞の応答を変化させることが知られている21 ため、調査では、血清の枯渇または血清からのEVの枯渇が、脂肪細胞の培養物を真に脂肪細胞の生物学を代表するものにすることを確認しなければならない。
ろ過と超遠心分離を用いたEV分離の技術的限界
EV単離のために超遠心分離の前にシーリングが必要な使い捨てプラスチックチューブを使用した超遠心分離の方法について説明します。これらの使い捨ての密閉チューブは、多くの個人にとって経済的な選択肢ではない可能性があることを認識しており、シーリングを必要とせず、再利用可能な同様のチューブの探索を提案します。ただし、研究者は、再利用可能なチューブの洗浄が適切であり、時間の経過とともにタンパク質、脂質、および RNA 汚染物質が徐々に蓄積し、EV 関連貨物の下流調査に影響を与えたり、細胞機能研究に影響を与えたりしないようにする必要があります。
ここで説明するろ過および超遠心分離プロトコルは、長年にわたって使用されており、複数の研究により、細胞ミトコンドリアなどの汚染細胞成分の非特異的な単離、核断片の存在、および細胞膜の成分を含む、この方法の短い欠点が強調されています。さらに、ここで説明する方法は、EV枯渇FBSに存在するリポタンパク質を共単離します。ここでの方法は、密度超遠心分離法およびサイズ排除クロマトグラフィー(SEC)を使用して、汚染された可溶性タンパク質および一部のリポタンパク質を除去することにより、さらに開発することができます。分離されたEVとSECのPBS洗浄と組み合わせることで、共分離された汚染物質は制限できますが、完全に排除することはできません。したがって、ユーザーは、培養培地中の可溶性タンパク質およびリポタンパク質を説明するために細胞と接触していない偽培地や、可溶性タンパク質およびリポタンパク質をまだ含む馴化培地からのEVの良好な単離を実証するためのEV枯渇上清コントロールを含む、適切なコントロールを確実に含める必要があります。
ろ過および超遠心分離を用いたEVの単離は、細胞培養上清がフィルターの穴または針/シリンジの穴を通過する間、細胞培養上清に過度の圧力が加えられないようにオペレーターが保証することに依存しています。記載されているプロトコルのこの段階で過度の力を加えると、EVが破裂し、最終的なEV濃度に影響を与え、かつてEVに包まれていた遊離RNA、タンパク質、代謝物が生成される可能性があります。ここでは、シリンジバレルを必要としない方法、したがって、EVがフィルターまたは針を通過して収集リザーバーと超遠心チューブに入るときに、調整された媒体に力を加える方法について説明しました。それにもかかわらず、EVペレットをPBSに再懸濁する際には、さらに注意が必要です。激しい渦巻きがEV膜を破壊する可能性があるため、短時間の渦のみを使用する必要があります。
超遠心分離後、オペレーターはEVペレットを乱さないように超遠心チューブに注意する必要があります。これは、チューブを慎重に取り扱い、超遠心ローターとチューブラックの間でチューブをゆっくりと移動させることで実現できます。超遠心チューブの上部に穴を開けて、EVが枯渇した上清を吸引する場合は、さらに注意が必要です。針をチューブの上部に挿入し、上清をすばやく吸引すると、シリンジバレルに真空が発生し、上清が激しく超遠心チューブに戻され、EVペレットが乱れる可能性があります。超遠心チューブを切って残った上澄み液を流し出した後、EVペレットがゆるくなり、注ぐとEVペレットが捨てられることがあるので注意が必要です。あるいは、シリンジと針を使用して、チューブを注いだり反転させたりすることなく、残りの上清をゆっくりと除去することもできます。
EVを分離するための上清のろ過と超遠心分離は、有用で効率的な方法です。しかし、それはリポタンパク質と可溶性タンパク質の共単離を受けやすいです。これらは、EVをPBSで洗うことで軽減できますが(説明されているように)、これによりすべての汚染物質が除去されるわけではありません。SECを利用することでEV画分から可溶性タンパク質を溶出させることができますが、この方法ではリポタンパク質とEVを区別しません。EVを含むSEC溶出液は、超遠心分離と組み合わせてEVをペレット化することができます。ろ過および示差超遠心分離法は、ポリエチレングリコールを使用する沈殿法よりもEV単離の好ましい方法であり、これらの沈殿法は細胞培養上清および他の生体液中の大量の可溶性タンパク質およびリポタンパク質を共分離する。超遠心分離は、ほとんどの研究所が超遠心分離機を装備しているため、多くの人にとって最もアクセスしやすいEV分離の形態であり続ける可能性があります。しかし、多くの人にとって、EVアイソレーションのための超遠心分離は、超遠心チューブの量と材料の開始量によって妨げられます。下流のプロテオミクスやRNAシーケンシングに十分なEV量を生成するには、数百ミリリットルの培養上清が必要になる場合があります。しかし、EV単離のための超遠心分離技術には、SECやテトラスパニンCD9、CD63、CD81を用いた免疫親和性捕捉などの他の技術が伴い、単離されたEVの純度を向上させる可能性があります。市販の沈殿液やフローサイトメトリーなどの他の手法は、特定の研究にいくらか役立つ可能性があります。
EV調製物の純度
TSG101については、ウェスタンブロッティングによる脂肪細胞由来EVの単離を確認しましたが、この1回のウェスタンブロットは、International Society for Extracellular Vesicles(ISEV)が発表したガイドラインには達していません。これらの脂肪細胞由来EVのさらなる特性評価は、テトラスパニンCD9、CD63、およびCD81を使用して、ヒストンH3、アルブミン、アポリポタンパク質A1などの細胞汚染のエキソソームとマーカーを同定するのに理想的です。
ここで紹介するプロトコールは、脂肪細胞を含むさまざまな細胞源からの細胞培養上清からEVを単離し、EVサイズ、濃度、ウェスタンブロットによるEVマーカー、およびプロテオミクスやRNAシーケンシングなどのオミクスベースの技術における有用性を決定することを可能にします。
開示事項
著者は何も開示していません。
謝辞
N.A.とR.C.は、オックスフォード大学ブリティッシュハート財団センターオブリサーチエクセレンス(N.A.とR.C.;RE/13/1/30181 および RE/18/3/34214)、British Heart Foundation Project Grant (N.A. and R.C.;PG/18/53/33895)、Tripartite Immunometabolism Consortium、Novo Nordisk Foundation(NNF15CC0018486)、National Institute for Health Research(NIHR)、Oxford Biomedical Research Centre(BRC)、Nuffield Benefaction for Medicine、およびWellcome Institutional Strategic Support Fund(ISSF)です。表明された見解は著者のものであり、必ずしもNHS、NIHR、または保健省の見解ではありません。
資料
| Name | Company | Catalog Number | Comments |
| 100 µm mesh | Sefar | 03-250/50 | |
| 15 mL Conical Tube | Sarstedt | 62.554.002 | |
| 250 µm mesh | Sefar | 03-100/44 | |
| 50 mL Conical Tube | Sarstedt | 62.547.004 | |
| Beckman Coulter, Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Bicinchoninic acid assay (BCA) | Thermo Scientific | 23225 | |
| Biotin | Sigma | B4639 | |
| BSA (essentially fatty acid free) | Sigma | A7030 | |
| Collagenase H | Sigma | 11074032001 | |
| Dexamethasone | Sigma | D2915 | |
| Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 | Sigma | D6421 | |
| Fetal bovine serum | Labtech | FCS-SA | |
| Fibroblast growth factor | Bio-Techne | 233-FB-025 | |
| Glutamine | ThermoFisher | 25030024 | |
| Hanks balanced salt solution | Sigma | H9394 | |
| Human insulin | ThermoFisher | 12585-014 | |
| Hypodermic needles, Microlance 16G | VWR | 613-3897 | |
| IBMX | Sigma | I7018 | |
| Nanoparticle Tracking Analysis, Zetaview | Particle Metrix | BASIC PMX-120 | |
| NEFA kit | Randox | FA115 | |
| Pantothenate | Sigma | P5710 | |
| Penicillin and Streptomycin | ThermoFisher | 15140122 | |
| Phosphate buffered saline | ThermoFisher Scientific | 10010056 | |
| PluriStrainer 200 µm | Cambridge Bioscience | 43-50200-03 | |
| Polyallomer Quick-Seal ultra-clear 16 mm × 76 mm tubes | Beckman Coulter | 342413 | |
| Single use syringes, 2-piece, Injekt Solo | VWR | 20-2520 | |
| Sodium linoleate | Sigma | L8134 | |
| Sodium oleate | Sigma | O7501 | |
| Sodium palmitate | Sigma | P9767 | |
| Soldering Iron | Zacro | 7.14954E+11 | |
| Syringe Filter 0.2 µm | Sarstedt | 83.1826.001 | |
| Syringe Filter 0.45 µm | ThermoFisher | 195-2545 | |
| T175 cm2 tissue culture flasks | Sarstedt | 83.3912.002 | |
| T25 cm2 tissue culture flasks | Sarstedt | 83.3910.002 | |
| T75 cm2 tissue culture flasks | Sarstedt | 83.3911.002 | |
| Transferrin | Sigma | T8158 | |
| Triiodo-L-thyronine | Sigma | T5516 | |
| Troglitazone | Sigma | T2573 | |
| TrypLE Express Enzyme | Fisher Scientific | 12604021 |
参考文献
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Akbar, N., et al. Endothelium-derived extracellular vesicles promote splenic monocyte mobilization in myocardial infarction. JCI Insight. 2 (17), (2017).
- Xiao, Y., et al. Extracellular vesicles in type 2 diabetes mellitus: key roles in pathogenesis, complications, and therapy. Journal of Extracellular Vesicles. 8, 1625677(2019).
- Akbar, N., Azzimato, V., Choudhury, R. P., Aouadi, M. Extracellular vesicles in metabolic disease. Diabetologia. 62 (12), 2179-2187 (2019).
- Kobayashi, Y., et al. Circulating extracellular vesicles are associated with lipid and insulin metabolism. The American Journal of Physiology-Endocrinology and Metabolism. 315 (4), 574-582 (2018).
- Eguchi, A., et al. Circulating adipocyte-derived extracellular vesicles are novel markers of metabolic stress. Journal of Molecular Medicine. 94 (11), Berlin, Germany. 1241-1253 (2016).
- Crewe, C., et al. An Endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 175 (3), 695-708 (2018).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363 (6430), 989-993 (2019).
- Deng, Z. B., et al. Adipose tissue exosome-like vesicles mediate activation of macrophage-induced insulin resistance. Diabetes. 58 (11), 2498-2505 (2009).
- Kranendonk, M. E., et al. Human adipocyte extracellular vesicles in reciprocal signaling between adipocytes and macrophages. Obesity. 22 (5), Silver Spring. 1296-1308 (2014).
- Song, M., et al. Adipocyte-derived exosomes carrying sonic hedgehog mediate M1 macrophage polarization-induced insulin resistance via Ptch and PI3K pathways. Cellular Physiology and Biochemistry. 48 (4), 1416-1432 (2018).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10 (3), 881-906 (2018).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments: JoVE. (95), e50974(2015).
- Connolly, K. D., et al. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 159 (9), 3259-3267 (2018).
- Camino, T., et al. Vesicles shed by pathological murine adipocytes spread pathology: characterization and functional role of insulin resistant/hypertrophied adiposomes. International Journal of Molecular Sciences. 21 (6), 2252(2020).
- Zhu, Y., et al. Extracellular vesicles derived from human adipose-derived stem cells promote the exogenous angiogenesis of fat grafts via the let-7/AGO1/VEGF signalling pathway. Scientific Reports. 10 (1), 5313(2020).
- Sadallah, S., Eken, C., Schifferli, J. A. Erythrocyte-derived ectosomes have immunosuppressive properties. Journal of Leukocyte Biology. 84 (5), 1316-1325 (2008).
- Sudnitsyna, J., et al. Microvesicle formation induced by oxidative stress in human erythrocytes. Antioxidants. 9 (10), Basel. (2020).
- Helal, O., et al. Increased levels of microparticles originating from endothelial cells, platelets and erythrocytes in subjects with metabolic syndrome: relationship with oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases. 21 (9), 665-671 (2011).
- Agouni, A., et al. Endothelial dysfunction caused by circulating microparticles from patients with metabolic syndrome. The American Journal of Pathology. 173 (4), 1210-1219 (2008).
- Park, J., Park, J., Nahm, S. -S., Choi, I., Kim, J. Identification of anti-adipogenic proteins in adult bovine serum suppressing 3T3-L1 preadipocyte differentiation. BMB Reports. 46 (12), 582-587 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved