Method Article
Filtration and Ultracentrifugation을 사용한 Human Adipocyte-derived Extracellular Vesicles의 분리 및 특성화
요약
우리는 여과 및 초원심분리를 사용하여 둔부 및 복부 지방 조직에서 인간 지방 세포 유래 세포외 소포(EV)를 분리하는 방법을 설명합니다. 우리는 나노입자 추적 분석(Nanoparticle Tracking Analysis)을 통해 크기와 농도를 측정하고 EV 단백질 종양 감수성 유전자 101(TSG101)의 존재에 대한 웨스턴 블로팅(western blotting)을 통해 분리된 지방세포 유래 EV를 특성화합니다.
초록
세포외 소포체(EV)는 단백질, RNA, 대사 산물 및 지질과 같은 생물학적 활성 물질을 운반하는 지질로 둘러싸인 외피입니다. EV는 조직 미세환경에서 국소적으로 또는 말초 혈액으로의 방출을 통해 다른 세포의 세포 상태를 조절할 수 있습니다. 지방세포 유래 EV는 말초 혈액에서 상승하며 비만 및 당뇨병을 포함한 대사 장애 중에 화물(RNA 및 단백질)에 변화를 보입니다. 지방세포 유래 EV는 내피 세포 및 지방 조직 상주 대식세포와 같은 주변 혈관 세포의 세포 상태를 조절하여 지방 조직 염증을 촉진할 수 있습니다. 말초 혈액에서 유래한 EV는 매우 이질적이며 다른 출처, 즉 혈소판, 내피 세포, 적혈구 및 근육의 EV를 포함하기 때문에 생체 내에서 지방 세포 유래 EV의 변화를 조사하는 것은 복잡합니다. 따라서 인간 지방세포 배양은 지방세포 유래 EV의 연구를 위한 모델 시스템을 제공합니다. 여기에서는 여과 및 초원심분리를 사용하여 인간 둔부 및 복부 지방 세포의 세포 배양 배지에서 총 소형 EV를 추출하기 위한 자세한 프로토콜을 제공합니다. 또한 EV 크기 및 농도의 정량화를 위한 나노입자 추적 분석(NTA)의 사용을 입증하고 둔부 및 복부 지방 세포 유래 EV에서 EV 단백질 종양 감수성 유전자 101(TSG101)의 존재를 보여줍니다. 이 프로토콜에서 분리된 EV는 투과 전자 현미경, 단백질체학, 대사체학, 소형 RNA 염기서열 분석, 마이크로어레이를 포함한 다운스트림 분석에 사용할 수 있으며 기능적 체외/생체 내 연구에 활용할 수 있습니다.
서문
세포외 소포체(EV)는 단백질, microRNA, 대사 산물 및 지질과 같은 생물학적 활성 물질을 운반하는 지질로 둘러싸인 외피입니다. EV라는 용어는 엑소좀(exosome), 미세소포(microvesicle, 미세입자/엑토솜) 및 자가사멸체(apoptotic body)를 포함하는 다양한 하위 집단을 나타냅니다1. EV는 병리학적 신호에 연루되어 혈액 및 소변을 포함한 생체 유체로 방출되기 때문에 바이오마커 역할을 할 수 있습니다. EV는 조직 미세환경에서 국소적으로 또는 말초 혈액으로의 방출을 통해 다른 세포의 세포 상태를 조절할 수 있습니다2. EV는 모 세포의 특징을 지니지만 각 하위 집단의 분화는 주로 테트라스파닌(CD9, CD63 및 CD81), 종양 감수성 유전자 101(TSG101) 및 ALG-2 상호 작용 단백질 X(ALIX)의 존재를 포함한 EV 마커와 같은 EV 크기와 단백질 함량을 기반으로 합니다. 이러한 단백질 마커는 엑소좀의 엔도솜 기원(CD9, CD63, CD81)을 대표하며, 엑소좀은 다소포체(multi-vesicular body) 내부에서 생성되거나 미세소포체의 원형질막(plasma membrane)에서 직접 발아 또는 기포(blebbing)와 관련된 단백질을 나타냅니다. 그러나 이러한 하위 집단 사이에는 상당한 중복이 있으며 혈장, 혈청 또는 소변과 같은 복잡한 생체 유체에서 개별 하위 집단을 구별하기 어렵습니다.
비만, 인슐린 저항성, 세포 외 포도당, 산소 및 염증의 섭동을 포함한 대사 장애는 EV와 화물의 크기와 농도를 변화시킬 수 있습니다. 지방세포 유래 EV는 페리리핀 A, 아디포넥틴을 운반하며 비만과 당뇨병 동안 단백질과 RNA 화물에 변화를 보입니다 3,4,5,6. 지방세포 유래 EV는 주변 혈관 내피 세포7 및 지방 조직 상주 대식세포의 세포 상태를 조절하여 지방 조직 염증 및 인슐린 저항성을 촉진합니다 8,9,10,11. 혈장, 혈청 또는 소변과 같은 복잡한 생체 유체에서 파생된 EV 집단에는 대사 기능 장애 및 질병의 발병기전과 관련된 혈소판, 내피 세포, 적혈구 및 근육과 같은 여러 출처의 EV가 포함되어 있기 때문에 생체 내에서 지방 세포 유래 EV의 변화를 조사하는 것은 복잡합니다.
따라서 인간 지방세포의 배양 및 체외 분화는 지방세포 유래 EV의 연구를 위한 모델 시스템을 제공합니다. 여기에서는 주사기 여과 및 초원심분리를 사용하여 인간 지방세포의 세포 배양 배지에서 소형 EV를 추출하기 위한 자세한 프로토콜을 제공합니다. 초원심분리는 쉽게 접근할 수 있고 사전 전문 지식이 거의 필요하지 않기 때문에 EV의 인기 있는 절연 방법으로 남아 있습니다. 그러나 테트라스파닌을 사용한 침전, 크기 배제 크로마토그래피 및 면역친화성 캡처와 같은 다른 방법을 사용하면 혈장, 혈청, 소변 및 컨디셔닝된 세포 배양 배지를 포함한 다양한 생체 유체에서 EV를 분리할 수 있습니다. 여기에 설명된 초원심분리 프로토콜을 포함한 각 방법은 EV로 가려질 수 있는 용해성 단백질과 지단백질을 공동 분리할 수 있기 때문에 다양한 순도의 EV 제제를 생산합니다. 이 초원심분리 프로토콜을 밀도 원심분리, 크기 배제 크로마토그래피 및 면역친화성 캡처와 같은 다른 방법과 결합하면 분리된 EV의 순도가 크게 증가합니다. 그러나 초원심분리와 유사하게 이러한 다른 방법은 혈액, 혈장 및 소변과 같은 복잡한 샘플에서 EV의 독립적인 하위 모집단을 캡처할 수 없습니다. 따라서 선택된 세포 집단의 배양은 세포 특이적 EV의 높은 수율을 생성하기 위한 가장 강력한 방법 중 하나로 남아 있습니다. 각 EV 방법에는 여러 가지 주의 사항이 있으며 방법 선택은 분리된 EV의 유형과 농도에 영향을 미칠 수 있으며, 이는 세포 및 조직 신호에 대한 다운스트림 기계론적 조사와 진단 연구를 위한 EV 화물 결정에 편향될 수 있습니다. EV 절연의 이러한 방법론적 문제는 다른 곳과아래 제한 사항 섹션 4,12에서 논의됩니다. 여기에서는 여과 및 초원심분리를 사용하여 인간 지방 세포 유래 EV를 분리하는 방법을 설명합니다. 또한 EV 크기 및 농도의 정량화를 위한 나노입자 추적 분석(NTA)의 사용을 입증하고 인간 지방 세포 유래 EV에서 EV 단백질 종양 감수성 유전자 101(TSG101)의 존재를 보여줍니다. 이 프로토콜에서 분리된 EV는 투과 전자 현미경, 단백질체학, 대사체학, 소형 RNA 염기서열 분석, 마이크로어레이를 포함한 다운스트림 분석에 사용할 수 있으며 기능적 체외/생체 내 연구에 활용할 수 있습니다.
프로토콜
모든 방법은 옥스퍼드 대학의 기관 윤리 검토 위원회의 승인을 받았습니다. 지방 조직은 건강한 지원자의 국소 마취제 하에 바늘 생검으로 얻었습니다.
1. 세포 배양 배지 및 완충액의 제조
- 0.2μm 공극 주사기 필터를 사용하여 Hanks Balanced Salt Solution(HBSS)(염화칼슘 미포함 및 염화마그네슘 없음)과 멸균 필터에 콜라겐분해효소 H(1mg/mL)를 용해하여 콜라겐분해효소 분해 완충액을 준비합니다.
- 콜라겐분해효소 분해 완충액은 사용하기 10분 전에 준비하십시오.
- 성장 배지(GM)를 다음과 같이 준비합니다: 10% 소 태아 혈청(FBS), 100 units/mL 페니실린, 100 μg/mL 스트렙토마이신, 2 mM L-글루타민 및 0.5 ng/mL 섬유아세포 성장 인자(FGF)가 보충된 Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12(DMEM/F12).
- 다음과 같이 염기성 분화 배지(염기성 DM)를 준비합니다: 100 units/mL 페니실린, 100 μg/mL 스트렙토마이신, 2 mM L-글루타민, 17 μM 판토텐산염, 100 nM 인간 인슐린, 10 nM 트리요오도-L-티로닌, 33 μM 비오틴, 10 μg/mL 트랜스페린 및 1 μM 덱사메타손.
- 1.3단계의 염기성 DM에 0.25mM 3-이소부틸-1-메틸크산틴 및 4μM 트로글리타존을 보충하여 완전 분화 배지(완전 DM)를 준비합니다.
- 다음과 같이 10% 본질적으로 지방산이 없는 소 혈청 알부민(BSA)과 복합화된 10mM 지방산 스톡 용액을 준비합니다.
- 160mL의 DMEM/F12 배지에 BSA 16g을 녹이고 37°C로 예열합니다. 3개의 별도 50mL 원뿔형 튜브에 올레산나트륨 150mg, 팔미틴산나트륨 139mg, 리놀리산나트륨 151mg의 무게를 잰다. 각 튜브에 데운 BSA 용액 50mL를 넣고 와류를 반복하여 잘 섞습니다.
- 올레산염 튜브와 리놀레이트 튜브를 37°C 수조에 15분 동안 다시 넣습니다. 완전히 용해될 때까지 와류로 섞습니다.
- 팔미테이트 용액의 경우 튜브를 65°C 수조에 2-3분 동안 놓습니다. 볼텍싱으로 격렬하게 혼합하십시오.
- 완전히 용해될 때까지 약 30분 동안 1.5.3단계를 반복합니다.
참고: 일부 작은 입자는 여전히 보일 수 있습니다. - 멸균 필터는 0.2μm 공극 주사기 필터를 사용하여 지방산 용액을 여과합니다.
- 적절한 분석을 사용하여 각 원액의 비에스테르화 지방산 농도를 확인합니다.
참고: 지방산은 지방산과 BSA 사이의 몰 비율이 10:1이 되려면 10mM(±10%)이어야 합니다. 농도가 이 범위를 벗어나면 원액을 다시 만들어야 합니다. 원액을 분주하여 -30°C에서 보관할 수 있습니다.
2. 인간 지방 조직 생검의 소화
- 50mL 원뿔형 튜브에 부착된 200μm 멸균 세포 여과기를 통해 생검 주사기의 내용물을 천천히 걸러내어 지방 조직이 여과기에 모이도록 합니다.
- 스트레이너를 새로운 50mL 원뿔형 튜브로 옮기고 10mL의 HBSS로 지방 조직을 3회 세척합니다.
참고: 수술용 가위로 혈전과 섬유 조직을 제거하거나 과도한 적혈구를 제거하기 위해 HBSS 세척을 반복해야 할 수도 있습니다. - 씻은 조직의 무게를 잰다.
참고: 일반적으로 바늘 생검으로 400-800mg의 조직을 얻습니다. - 콜라겐분해효소 분해 완충액을 멸균된 50mL 원뿔형 튜브에 넣고 세척된 조직을 추가합니다. 이 단계에서 수술용 가위를 사용하여 조직을 동일한 크기의 조각으로 다질 수 있습니다.
참고: 조직 0.5g당 5mL의 완충액을 사용하십시오. 더 큰 조직의 경우 페트리 접시에서 샘플을 다질 수 있습니다. - 튜브를 37°C의 흔들리는 수조에 넣고 35-40분 동안 배양합니다.
알림: 성공적으로 소화되면 용액이 유백색으로 보여야 합니다. 작은 조직 조각이 여전히 보이면 10-20초 동안 손으로 흔듭니다.
3. 지방세포의 분리
- 지방세포 분획 원심분리기를 1,000 x g 에서 5분 동안 펠릿화합니다.
- 흡인 후 부유 지방세포층과 상층액을 버리고 세포 펠릿을 덮고 있는 약 1mL의 HBSS를 남깁니다.
- 펠릿을 HBSS 5mL에 재현탁하고 250μm 공극 크기의 메쉬를 통해 세포 현탁액을 통과시킨 다음 100μm 메쉬를 통과시켜 소화되지 않은 물질을 제거합니다. 15mL 원뿔형 튜브에 세포 현탁액을 수집합니다.
- 1,000 x g 에서 5분 동안 원심분리기
참고: 이 단계 후에 적혈구 오염이 문제인 경우 적혈구 용해 용액으로 지방세포 분획을 치료할 수 있습니다. - 상층액을 흡인하고 버립니다.
- 세포 펠릿을 GM 5mL에 재현탁시키고(단계 1.2) 25cm2 부착 조직 배양 플라스크에 파종합니다. 플라스크를 세포 배양 인큐베이터(5% CO2, 37 °C)에 넣습니다.
4. 지방세포배양 유지
- 세포가 증식하는 동안 2일마다 GM을 교체하십시오.
참고: 세포 증식 속도는 기증자에 따라 다를 수 있습니다.- 세포가 약 80% 합류점에 도달하면 75cm2 부착 조직 배양 플라스크로 옮깁니다. GM을 제거하고 인산염 완충 식염수(PBS)로 세포를 세척합니다.
- PBS를 버리고 0.5mL의 고도로 정제된 세포 해리 효소를 첨가하여 부착된 세포를 분리합니다. 37 ° C에서 5 분 동안 배양하십시오.
- 플라스크를 세게 두드려 세포를 분리하고 GM 5mL를 추가합니다. 15mL 원뿔형 튜브에 세포 현탁액을 수집합니다.
- 1,000 x g 에서 5분 동안 원심분리기
- 상층액을 흡인하고 버립니다. 세포 펠릿을 5mL의 GM에 재현탁하고 75cm2 플라스크로 옮깁니다. GM을 최종 부피 12mL로 보충하고 세포 배양 인큐베이터(5% CO2, 37°C)에서 플라스크를 교체합니다.
알림: 세포를 유지하려면 2-3일마다 GM을 계속 교체하십시오. 세포가 80% 합류점에 도달하면 4.2-4.3단계를 반복하고 세포를 1:3으로 새로운 75cm2 플라스크로 나눕니다. 이는 실험 설정을 위해 충분한 수의 세포가 생성될 때까지 여러 계대에 대해 반복될 수 있습니다. 10개 이상의 계대는 지방세포의 증식 및 분화 능력이 감소하기 때문에 권장하지 않습니다.
5. 지방생성 분화를 위한 지방세포(preadipocyte) 파종
- 혈구계를 사용하여 세포를 계수하고 200,000개의 세포를 2mL의 GM에 있는 6웰 플레이트의 여러 웰에 시딩합니다. 또는 22mL의 GM 배지에 175cm2 플라스크당 350만 개의 세포를 시딩합니다.
- 세포가 완전한 합류점에 도달할 때까지 2-4일 동안 더 증식하도록 하여 배양 두 번째 날에 GM을 변경합니다.
- 지방생성 분화를 시작하려면 GM을 제거하고 4일 동안 완전한 DM으로 교체합니다(6웰 플레이트의 웰당 완전한 DM 2mL 또는 175cm2 플라스크의 경우 22mL).
참고: 2일차에 새로운 완전 DM으로 교체하십시오. - 4일차에 완전한 DM을 제거하고 22.5μM 올레산염, 15μM 팔미테이트 및 12.5μM 리놀레이트가 보충된 2mL 기본 DM으로 교체하여 6웰 플레이트의 웰당 50μM 또는 175cm2 플라스크의 경우 22mL의 총 지방산 농도를 제공합니다. 추가 10일 동안 2일마다 미디어로 교체하십시오.
참고: 7일째부터는 분화된 지방세포에서 지질 방울이 보여야 합니다. - 배양 14일차에 지방 세포 유래 EV의 분리를 위해 세포에서 배지를 수집합니다.
6. 세포외 소포 분리 또는 저장 및 미래의 세포외 소포 분리를 위한 세포 배양 상등액의 준비
- 각 6-well 플레이트에서 세포 배양 상등액을 제거하고 결합합니다. 15mL 튜브에 추가하거나 175cm2 플라스크에서 모든 세포 배양 상등액을 제거하고 50mL 튜브에 추가합니다.
- 1000 x g 에서 4°C에서 10분 동안 원심분리기.
- 깨끗한 새 15mL 또는 50mL 튜브에 각각 상등액을 붓습니다.
- 10mL 주사기의 배럴을 제거하고 0.45μm 주사기 필터를 부착합니다.
- 상층액을 주사기 저장소에 붓고 세포 배양 상등액이 필터를 자유롭게 통과할 때까지 엄지손가락이나 손바닥으로 주사기 배럴 입구를 부드럽게 누릅니다.
알림: 이 여과 단계의 속도는 주사기 필터의 유형에 따라 달라질 수 있습니다. - 깨끗한 50mL 튜브에 여과액을 수집합니다.
참고: 필요한 경우 컨디셔닝된 여과 매체는 이 시점에서 -80°C에서 몇 주 동안 보관할 수 있습니다. 필요한 경우 세포 배양 상층액을 4°C에서 해동하고 1000 x g 에서 4°C에서 10분 동안 원심분리합니다. EV 분리를 계속하기 전에 상층액을 부어 깨끗한 튜브에 디캔팅합니다.
7. 세포외 소포체의 분리
- 튜브 바닥에 원을 그려 13mL 초원심분리 튜브에 라벨을 붙이면 예상되는 EV 펠릿이 형성되고 초원심분리 튜브 로터의 방향을 위해 튜브 목 주위에 선이 표시됩니다. 튜브에 샘플 식별자를 표시합니다.
- 튜브 홀더에 튜브를 놓습니다.
- 10mL 주사기에 16G 바늘을 부착하고 주사기 배럴을 제거합니다.
- 바늘에서 보호 커버를 제거하고 바늘을 초원심분리 튜브의 목에 삽입합니다.
- 세포 배양 상등액을 주사기 배럴에 직접 부어 초원심분리 튜브를 채웁니다.
- 가득 찰 때까지 필요에 따라 PBS로 튜브를 보충합니다.
알림: 필요한 경우 튜브가 약간 넘치도록 하여 초원심분리 튜브에 공기 공간이 없고 기포가 없는지 확인합니다. - 납땜 인두를 사용하여 초원심분리 튜브를 밀봉하고 튜브를 부드럽게 눌러 튜브가 밀폐되도록 합니다.
- 초원심분리 튜브를 초원심분리 로터에 놓습니다. 튜브 상단에 표시된 선과 튜브 바닥에 그려진 원이 EV 펠릿이 형성될 바깥쪽을 향하고 있는지 확인합니다.
- 120,000 x g 에서 4°C에서 2시간 동안 초원심분리기.
- 초원심분리기에서 로터를 조심스럽게 제거합니다.
- 로터에서 초원심분리 튜브를 제거하고 튜브 홀더에 넣습니다.
- 10mL 주사기에 16G 바늘을 부착합니다.
- 초원심분리 튜브의 상단을 뚫고 바늘을 튜브 상단에 2cm 삽입하고 상층액을 주사기로 흡입합니다.
- 이 EV가 고갈된 상등액을 1.5mL 튜브에 디캔팅하고 -80°C에서 동결합니다.
- 바늘을 튜브에 다시 삽입하고 남은 상층액을 조심스럽게 흡인하여 버립니다.
- 가위로 튜브의 상단을 자릅니다.
- 한 번의 빠른 동작으로 남은 상층액을 붓습니다.
- 튜브를 1분 동안 거꾸로 매달아 둡니다.
- 튜브에 형성된 액체를 종이 타월로 두드려 말리십시오.
- 튜브를 뒤집어 튜브 홀더에 넣습니다.
- 튜브에 PBS 100μL를 추가합니다.
- 피펫 끝을 사용하여 7.1단계에 표시된 영역에서 원을 그리며 튜브 바닥에 있는 EV 펠릿을 부드럽게 제거합니다.
- 소용돌이를 짧게(1-2초), 두 번 누릅니다.
- 튜브 바닥에 원을 그려 새 13mL 초원심분리 튜브에 라벨을 붙이면 예상되는 EV 펠릿이 형성되고 초원심분리 튜브 로터의 방향을 위해 튜브 목 주위에 선을 표시합니다. 튜브에 샘플 식별자를 표시합니다.
- 튜브 홀더에 튜브를 놓습니다.
- 깨끗한 주사기와 바늘을 사용하여 새 초원심분리 튜브에 PBS 12mL를 추가합니다.
- 주사기와 바늘을 사용하여 100μL EV 샘플을 채취하여 튜브에 추가합니다. EV와 PBS를 조심스럽게 혼합하고 PBS를 부드럽게 모아 튜브로 흡인하여 주사기와 바늘을 헹굽니다.
참고: 거품을 만들지 마십시오. - 납땜 인두를 사용하여 초원심분리 튜브를 밀봉하고 튜브를 부드럽게 눌러 튜브가 밀폐되도록 합니다.
- 초원심분리 튜브를 초원심분리 로터에 놓습니다. 튜브 상단에 표시된 선과 튜브 바닥에 그려진 원이 바깥쪽을 향하고 있는지 확인합니다.
- 120,000 x g 에서 4°C에서 1시간 동안 초원심분리기.
- 초원심분리기에서 로터를 조심스럽게 제거합니다.
- 12mL 주사기에 16G 바늘을 부착합니다.
- 초원심분리 튜브의 상단을 뚫고 바늘을 튜브 상단에 최대 2cm까지 삽입합니다. 상층액을 주사기에 흡입하고 버립니다.
- 가위로 튜브의 상단을 자릅니다.
- 한 번의 빠른 동작으로 남은 상층액을 붓습니다.
- 튜브를 1분 동안 거꾸로 매달아 둡니다.
- 튜브 가장자리에 형성된 액체를 두드려 말리십시오.
- 튜브 홀더에 튜브를 놓습니다.
- 튜브에 PBS 100μL를 추가합니다.
- 피펫 끝을 사용하여 7.24단계에 표시된 영역에서 원을 그리며 튜브 바닥에 있는 EV 펠릿을 부드럽게 제거합니다.
- 소용돌이를 짧게(1-2초), 두 번 누릅니다.
- 깨끗한 1.5mL 튜브에 100μL의 PBS/EV 용액을 피펫팅하고 젖은 얼음에 보관합니다.
참고: EV는 다운스트림 처리 준비가 되어 있으며 -80°C에서 냉동 및 보관할 수 있습니다.
8. 나노입자 추적 분석(NTA)을 이용한 EV 크기 및 농도 측정
- 시스템 준비
참고: EV 크기 및 농도 측정을 위한 나노 입자 추적 분석(NTA)을 사용하는 자세한 방법은 Mehdiani et al.13에 의해 보고되었습니다.- 샘플을 해동하고 4 °C로 유지하십시오.
- 소프트웨어 아이콘을 클릭하여 NTA 소프트웨어를 시작합니다.
- 소프트웨어가 "cell check"에서 열리고 플로우 셀에 탈이온수를 채우라는 메시지가 표시됩니다. 10mL 주사기에 탈이온수를 채우고 기계에 밀어 넣어 기포가 로딩 챔버로 통과하지 않도록 합니다.
- 화면의 지시에 따라 품질 검사(QC)를 통해 시스템을 준비합니다. 이 소프트웨어는 세포 검사를 수행하고 세포 품질을 측정합니다. 이것은 매우 좋거나 훌륭해야 합니다.
- 100 나노 미터 폴리스티렌 비드로 구성된 품질 관리를 준비합니다. 표준물질의 1 μL를 999 μL의 탈이온수(희석된 스톡)에 피펫팅합니다. 그런 다음 10μL의 희석된 원을 2.5mL의 탈이온수(QC 샘플)에 첨가합니다. 2-3초 동안 부드럽게 와류를 일으키고 피펫팅하여 용액을 혼합합니다.
참고: 품질 관리 샘플은 매일 신선하게 준비해야 하지만 초기 희석된 원유 샘플은 4°C에서 1주일 동안 안정적입니다. - 1mL 주사기에 1mL의 QC 샘플을 채우고 주사기에서 모든 기포를 제거합니다.
- 기포가 발생하지 않도록 주사기 끝을 주입 챔버로 부드럽게 기울이는 동시에 플런저를 밀어 NTA 샘플 로딩 챔버에 주입합니다. 최대 950μL의 QC 샘플을 챔버에 주입합니다.
알림: 샘플 로딩 챔버에 기포를 유입하지 마십시오. - 소프트웨어가 자동 정렬(카메라 초점을 맞추기 위해)을 수행하고 Z-전위 판독값에 대한 전압을 확인하는 동안 기다립니다 - 전압 그래프는 부드러운 U자형 곡선이어야 합니다.
알림: "voltage too low error"라는 오류 메시지가 있는 경우 셀이 청소로 젖었거나 고정되지 않았거나 기포가 있을 수 있습니다. - 자동 정렬/전압 확인이 완료되면 카메라 위치 드롭다운을 사용하여 모든 위치(0.1-0.9)에 비정상적인 표시가 있는지 확인합니다. 이러한 표시가 있으면 셀을 세척 및/또는 청소해야 할 수 있음을 나타냅니다. QC 후 시스템은 "측정 준비 완료"를 표시합니다.
- 플로우 셀을 PBS로 프라임합니다. Pump/Temp(펌프/온도) 탭을 열고 Pump(펌프)에서 Run for pump 2 (PBS reservoir)를 클릭합니다. 이렇게 하면 PBS가 1분 동안 셀을 통해 실행된 다음 자동으로 중지됩니다.
참고: 챔버 내에 입자가 있을 수 있지만 10mL의 PBS를 로딩 포트를 통해 밀어 제거할 수 있습니다. - 10mL 주사기에 PBS를 채우고 기포 없이 챔버에 넣습니다.
- 레이저의 여러 위치를 측정하고 프레임당 입자의 평균을 구하는 장치를 실행할 프로토콜을 만듭니다.
- 계속하기 전에 입자 수가 5 미만(가능한 한 0에 가까움)인지 확인하고 필요한 경우 더 많은 PBS로 플러시합니다.
- 희석하기 전에 피펫팅으로 EV 샘플을 혼합합니다.
- PBS에서 샘플을 1:1,000으로 희석하고 피펫팅으로 혼합합니다. 1mL 주사기에 샘플을 채우고 기포 없이 챔버에 로드합니다.
- 파티클 수가 허용 가능한 범위 내에 있는지 확인합니다(카운트 값 위의 막대는 녹색 영역에 있거나 녹색 영역에 가까워야 함). 그렇지 않은 경우 샘플 희석을 적절하게 조정하십시오. 샘플과 샘플 희석 사이에 10mL의 PBS를 기계 전면에 로드하여 챔버를 비운 다음 희석된 샘플 1mL를 로드합니다.
알림: 각 샘플은 샘플의 농도에 따라 독립적으로 희석됩니다. 정확한 측정을 위해 장치의 입자 수는 프레임당 50-200개 입자 사이여야 합니다. - 소프트웨어의 측정 탭으로 이동합니다.
- Run video acquisition(비디오 획득 실행) 버튼을 클릭합니다.
- 샘플 이름을 입력하고 측정을 저장할 대상 폴더를 선택합니다.
- EV 표준 운영 절차(SOP)를 만듭니다.
- 셔터 속도 100> 카메라 감도 80에서 입자수와 크기를 측정하는 EV SOP를 생성하고 > 로드하고 2주기 동안 11개의 카메라 위치를 로드합니다.
참고: 샘플에 특별한 요구 사항이 없는 한 이러한 설정을 변경할 필요가 없습니다. - 샘플의 희석액을 입력하고 추가하려는 다른 메모를 추가합니다.
- 확인을 클릭하면 소프트웨어가 자동으로 녹음을 시작합니다. 완료되면 소프트웨어는 각 카메라 위치에 대한 평균 입자 수와 크기를 보여주는 팝업 테이블을 자동으로 로드합니다.
알림: 진동이 최종 판독값에 영향을 미치므로 이 시간 동안 기계나 근처의 조리대를 만지지 마십시오. - 통계적으로 비정상적인 판독값을 가진 카메라 위치는 자동으로 제외됩니다 - 카메라 위치를 수동으로 제외하려면(또는 어떤 이유로든 제외된 위치를 다시 포함하려면) 샘플 세부 정보 왼쪽의 확인란을 클릭하십시오.
- 계속을 클릭하면 소프트웨어가 크기 및 농도 결과가 포함된 샘플의 PDF를 생성하고 엽니다.
- 셔터 속도 100> 카메라 감도 80에서 입자수와 크기를 측정하는 EV SOP를 생성하고 > 로드하고 2주기 동안 11개의 카메라 위치를 로드합니다.
- 통계 분석
- 사후 Tukey 보정을 사용하여 단방향 또는 양방향 ANOVA로 NTA 데이터를 분석합니다. 데이터를 그룹으로 플롯하면 표준 편차± 의미합니다. <0.05의 P값은 유의한 것으로 간주되었습니다.
결과
우리는 설명된 프로토콜에 따라 인간 둔부 지방세포에서 분리된 EV의 양을 결정했습니다. NTA를 사용하여 지방 세포 유래 EV의 크기와 농도를 계산했습니다(그림 1A, B). 우리는 세포와 접촉하지 않았지만 배양되고 위에서 설명한 분리 절차의 적용을 받는 동일한 부피의 배지인 가짜 배지 대조군을 사용했습니다. 초기 분리 후 그리고 분리된 지방 세포 EV를 PBS에서 세척한 후(그림 1A,B) 지방 세포 유래 EV 농도를 측정하고 그룹 평균을 표준 편차(SD)± 표시했으며, 이는 사후 Tukey 보정을 통한 양방향 ANOVA로 분석되었습니다.
1차 분리에서 NTA에 의해 결정된 지방세포 유래 EV의 농도는 6.10 x 106에서 2.70 x 107 범위였으며 중앙값은 2.60 x 107 EVs/mL였습니다(그림 1 A,B). PBS 세척 후, 샘플당 지방 세포 유래 EV가 현저히 적었으며(그림 1A,B)(P < 0.001), 이는 5.00 x 105에서 4.30 x 106 범위였으며 중앙값은 2.70 x 106 EVs/mL였습니다. 가짜 미디어 컨트롤에는 NTA에서 결정한 EV가 포함되어 있지 않습니다(그림 1A, B). 첫 번째 분리에서 EV의 모달 크기는 PBS 세척 후 125nm 및 105nm였습니다(그림 1A, B). 기술된 프로토콜은 더 큰 T175 cm2 플라스크로부터 복부 및 둔근 유래 지방세포에 추가로 적용되었다. T175cm2 플라스크에서 추출한 이러한 둔부 EV 샘플의 농도는 3.60 x 107에서 7.50 x 107/mL 사이였으며 중앙값은 5.40 x 107 EVs/mL였습니다. T175 cm2 플라스크의 복부 지방 세포 유래 EV의 농도는 6.30 x 107에서 8.60 x 107/mL 사이였으며 중앙값은 7.60 x 107 EVs/mL였습니다(그림 1C,D). T175cm2 플라스크에서 파생된 EV의 모달 크기는 둔부 EV의 경우 115nm, 복부 EV의 경우 125nm였습니다. 종양 감수성 유전자 101(TSG101)에 대한 면역 블로팅을 통해 둔근 및 복부 유래 EV에서 EV 단백질의 존재를 확인했으며, 복부 및 둔부 지방 세포 펠릿과 복부 및 둔부 지방 세포 유래 EV는 TSG101에 대해 양성인 반면, 세포와 접촉하지 않은 가짜 대조 배지는 음성임을 발견했습니다(그림 1E).
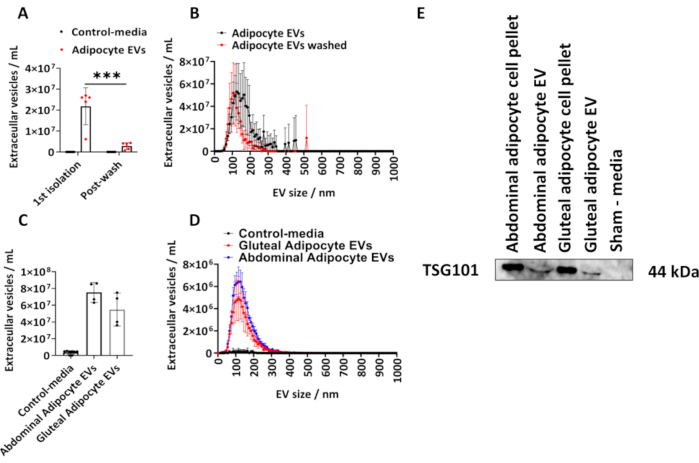
그림 1: 세포 배양 배지에서 지방 세포 유래 EV의 크기 및 분포 프로파일과 EV 단백질 TSG101의 측정. 1차 분리(N = 5)부터 PBS(N = 6)로 세척한 후 나노입자 추적 분석(NTA)에 의해 결정된 총 EV 농도와 크기 및 농도 분포 프로파일. (C) 총 농도 및 (D) T175cm2 플라스크(그룹당 N = 4)에서 복부 및 둔부 유래 EV에 대해 NTA에 의해 결정된 크기 및 농도 분포 프로파일. (E) TSG101에 대한 둔부 및 복부 유래 EV의 웨스턴 블롯. 세포 펠릿과 가짜 배지는 각각 양성 및 음성 대조군으로 사용되었습니다. 데이터는 그룹 평균± 표준 편차(SD)입니다. 사후 Tukey 보정을 사용하는 단방향 또는 양방향 ANOVA입니다. P < 0.001. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
우리는 세포 배양 상등액에서 둔부 및 복부 지방 세포 유래 EV를 분리하기 위한 프로토콜을 시연하고 NTA 7,14,15에 의해 크기와 농도를 결정합니다. 우리는 배양된 인간 지방 세포가 EV를 생산하여 세포 배양 배지로 방출하며, 이는 이후에 여과 및 초원심분리를 사용하여 분리될 수 있음을 보여줍니다. 우리는 분리된 지방 세포 유래 EV의 크기와 농도 프로파일을 측정하고 초원심분리가 세포 배양 배지에서 오염 물질을 공동 분리했을 가능성이 있으며 PBS에서 분리된 EV 펠릿을 세척하면 두 번째 NTA 측정에서 농도가 크게 낮아진다는 것을 보여주었습니다. 우리는 또한 EV 마커인 TSG101에 대한 웨스턴 블로팅을 통해 분리된 둔부 및 복부 유래 EV의 순도를 결정했습니다. 둔부 및 복부 유래 EV 제제는 TSG101에 대해 양성이었지만, 중요한 것은 세포에 노출되지 않은 대조 매체에는 이것이 없었다는 것입니다. 제시된 실험에서는 EV를 생성하는 모세포로 인간 지방세포를 사용했지만 설명된 방법은 내피 세포, 혈관 평활근, 골격근, 면역 세포를 포함한 다른 세포 유형과 환자의 혈소판 불량 혈장 또는 혈청에서 EV를 분리하는 데 적합합니다.
지방세포 유래 EV는 대사성 질환에서 증가하며, 혈액과 같은 생물학적 액체에는 내피 세포, 골격근, 적혈구 및 면역 세포의 EV를 포함하여 대사 질환의 발병기전과 관련된 여러 세포 공급원의 EV가 포함되어 있기 때문에 생체 내에서 지방 세포 EV의 크기와 수의 변화를 결정하는 것은 복잡합니다. 여기에 설명된 방법을 통해 인간 지방세포 EV를 측정할 수 있으며, 이는 현재 알려지지 않은 지방세포에서 EV 생물 발생으로 이어지는 요인을 조사하는 기계론적 연구에 유용한 모델을 제공할 수 있습니다. 중요한 것은 지방세포 EV 생물발생을 결정하고 지방세포 EV에서 특정 RNA, 단백질 및 대사 산물의 로딩이 어떻게 조정되는지를 결정하는 것은 대사 기능 장애에서 병원성 지방 세포 EV 신호를 교란할 수 있는 새로운 치료 기회를 밝힐 수 있다는 것입니다. 상세한 연구를 통해 EV 크기, 수, 생물 발생 경로 및 EV 화물(RNA, 단백질 및 대사 산물)이 산소, 포도당, 지질 및 인슐린의 섭동과 같은 질병 또는 자극에 반응하여 어떻게 변경되는지에 대한 더 나은 이해를 제공할 것입니다. 대사 질환에서 지방 세포 EV 신호전달에 대한 환경 요인의 역할과 지방 세포 유래 EV가 지방 조직 염증에 어떻게 기여하는지에 대한 정보는 대사 질환에서 새로운 치료 표적을 밝힐 수 있습니다.
제한
지방 세포 유래 EV의 체외 생성
인간 지방세포(in vitro)를 사용하면 체외 지방세포 분화에 따른 지방세포 유래 EV의 방출 및 생성을 연구할 수 있는 모델 시스템을 제공할 수 있지만, 여기에는 여러 가지 한계가 있습니다. 특히, 체외 유래 지방 세포 EV는 플라즈마14 와 같은 생체 유체에서 추출한 지방 유래 EV와 크기, 농도, EV 단백질, -RNA, -대사 산물 및 기능 면에서 다를 수 있습니다. 이러한 EV 차이는 지방 조직 생리학과 밀접하게 연결되어 있고 지방 조직 염증을 포함하여 지방 조직 병리학에서 역할을 보여준 지방 조직 유래 줄기 세포, 내피 세포 및 대식세포와 같이 생체 내 지방 조직에 상주하는 다른 비지방 세포 세포의 영향을 받을 수 있습니다.
여기에 설명된 2주간의 시험관 내 분화 프로토콜은 생체 내에서 볼 수 있는 것과 동등한 완전히 성숙한 지방 세포를 생성하기에 충분하지 않을 수 있다는 점에 유의해야 합니다. 2차원(2D) 형식으로 성장한 체외에서 분화된 지방세포는 in vivo 세포와 다른 형태를 나타내며 단위치 지질 방울을 생성하지 않습니다. 또한, 이 프로토콜에 설명된 지방세포는 지방 기질-혈관 분획에서 얻은 것이며, 세포 분리 중에 완전히 제거되지 않은 다른 세포 유형에서 EV 풀에 대한 기여도를 평가하지 않았습니다.
지방 조직에서 다른 비지방 세포와 지방 세포의 중요한 세포 간 상호 작용의 손실은 지방 세포 EV 생성, 방출, 지방 세포의 EV 단백질 및 EV-RNA 및 지방 조직 유래 줄기 세포에 영향을 미칠 수 있습니다16. 그러나 in vitro에서 파생된 지방 세포 EV가 in vivo에서 생산된 EV와 어떻게 다른지에 대한 평가는 철저하게 수행되지 않았습니다.
1차 조직 생검에는 혈액이 포함되어 있으므로 파생된 세포 배양에는 프로토콜에서 강조된 다중 세척 및 배지 변화에 관계없이 적혈구 및 적혈구 유래 EV가 포함될 수 있습니다. 지방세포에 대한 적혈구의 영향을 제거하기 위해 기질-혈관 분획을 분리한 후 추가적인 적혈구 용해 단계가 필요할 수 있습니다. 이는 적혈구 유래 EV가 다른 세포의 세포 기능에 영향을 미칠 수 있기 때문에중요하며17 적혈구 유래 EV는 산화 스트레스가 있을 때18 대사 증후군 환자에서 증가합니다19,20. 따라서 대사 질환 환자에서 유래한 지방 조직에는 적혈구 유래 EV의 수치가 높아질 수 있으며, 이는 지방 세포의 체외 표현형에 영향을 미칠 수 있습니다.
FBS 제거
설명된 프로토콜은 지방형성 분화 동안 성장 배지에서 FBS를 활용했지만, 이후 지방세포는 지방세포 유래 EV의 분리를 위한 최종 배지 수집 전에 여러 배지 변화를 겪었습니다. 따라서 EV 제제에서 FBS 유래 EV의 오염에 대한 전반적인 위험은 낮다고 가정하고 TSG101에 대한 웨스턴 블로팅을 통해 세포 배양 배지에 잔류 EV가 존재하지 않음을 확인했습니다. FBS가 필요한 세포 소스에서 세포 배양 EV를 분리하려면 EV가 고갈된 FBS를 사용하거나 초원심분리를 통해 소의 EV를 고갈시켜 소의 EV가 지방 세포 EV 농도를 혼동하는 것을 방지하고 지방 세포 EV 화물을 분석해야 합니다. 지방세포에서 혈청이 고갈되면 세포 반응이 변하는 것으로 알려져 있으므로, 혈청으로 인한 혈청 고갈 또는 EV가 고갈되면 지방 세포 배양이 지방 세포 생물학을 진정으로 대표하는지 조사가 이루어져야 합니다.
여과 및 초원심분리를 사용한 EV 절연의 기술적 한계
우리는 EV 분리를 위해 초원심분리 전에 밀봉해야 하는 일회용 플라스틱 튜브를 사용한 초원심분리 방법을 설명합니다. 당사는 이러한 일회용 밀봉 튜브가 많은 개인에게 경제적인 옵션이 아닐 수 있음을 인정하고 밀봉이 필요하지 않고 재사용이 가능한 유사한 튜브를 탐색할 것을 제안합니다. 그러나 조사관은 재사용 가능한 튜브의 세척이 적절하고 시간이 지남에 따라 단백질, 지질 및 RNA 오염 물질이 점진적으로 축적되지 않도록 해야 하며, 이는 EV 관련 화물의 다운스트림 조사에 영향을 미치거나 세포 기능 연구에 영향을 미칠 수 있습니다.
여기에 설명된 여과 및 초원심분리 프로토콜은 수년 동안 사용되어 왔으며 여러 연구에서 세포 미토콘드리아와 같은 오염된 세포 구성 요소의 비특이적 분리, 핵 조각의 존재 및 세포막의 구성 요소를 포함하여 이 방법의 단점을 강조했습니다. 또한, 여기에 설명된 방법은 EV가 고갈된 FBS에 존재하는 지단백질을 공동 분리합니다. 여기서의 방법은 밀도 초원심분리 및 크기 배제 크로마토그래피(SEC)를 사용하여 용해성 단백질과 일부 지단백질을 오염시키는 것을 제거함으로써 더욱 발전할 수 있습니다. 격리된 EV 및 SEC의 PBS 세척과 함께 동시 격리된 오염 물질은 제한될 수 있지만 완전히 제거되지는 않습니다. 따라서 사용자는 배양 배지의 용해성 단백질 및 지단백질을 설명하기 위해 세포와 접촉하지 않은 가짜 배지와 여전히 용해성 단백질과 지단백질을 포함하는 컨디셔닝 배지에서 EV를 성공적으로 분리하는 것을 입증하기 위해 EV가 고갈된 상층액 대조군을 포함한 적절한 대조군을 포함해야 합니다.
여과 및 초원심분리를 사용한 EV의 분리는 작업자가 세포 배양 상층액이 필터의 구멍 또는 바늘/주사기의 구멍을 통과하는 동안 세포 배양 상층액에 과도한 압력이 가해지지 않도록 하는 데 달려 있습니다. 설명된 프로토콜의 이 단계에서 과도한 힘을 가하면 EV가 파열되고 최종 EV 농도에 영향을 미치며 한때 EV에 갇혀 있던 유리 RNA, 단백질 및 대사 산물을 생성할 수 있습니다. 우리는 여기에서 주사기 배럴이 필요하지 않으므로 필터 또는 바늘을 통해 수집 저장소와 초원심분리 튜브로 들어갈 때 조절된 매체의 EV에 힘을 가할 필요가 없는 방법을 설명했습니다. 그럼에도 불구하고 PBS에서 EV 펠릿을 재현탁할 때 더 많은 주의를 기울여야 합니다. 격렬한 소용돌이는 EV 멤브레인을 방해할 수 있으므로 짧은 와류만 사용해야 합니다.
초원심분리 후 작업자는 초원심분리 튜브를 사용하여 EV 펠릿을 방해하지 않도록 주의해야 합니다. 이는 튜브를 조심스럽게 다루고 초원심분리 로터와 튜브 랙 사이에서 천천히 움직여 달성할 수 있습니다. EV가 고갈된 상층액을 흡인하기 위해 초원심분리 튜브 상단에 구멍을 뚫을 때 각별한 주의를 기울여야 합니다. 튜브 상단에 바늘을 삽입하고 상층액을 빠르게 흡인하면 주사기 배럴에 진공이 생성되어 상등액을 초원심분리 튜브로 격렬하게 다시 밀어 넣고 EV 펠릿을 파괴할 수 있습니다. 초원심분리 튜브를 절단하여 남은 상층액을 부은 후 EV 펠릿이 헐거워져 붓면 EV 펠릿이 버려질 수 있으므로 주의가 필요합니다. 또는 주사기와 바늘을 사용하여 튜브를 붓거나 뒤집지 않고 남아 있는 상층액을 천천히 제거할 수 있습니다.
EV의 분리를 위한 상등액의 여과 및 초원심분리는 유용하고 효율적인 방법입니다. 그러나 그것은 지단백질과 용해성 단백질의 공동 분리에 취약합니다. 이러한 문제는 PBS로 EV를 세척하여 완화할 수 있지만(설명된 대로) 모든 오염 물질을 제거하지는 않습니다. 용해성 단백질은 SEC를 활용하여 EV 분획에서 용출될 수 있지만 이 방법은 지단백질과 EV를 구별하지 않습니다. EV를 포함하는 SEC-용출액은 초원심분리와 결합하여 EV를 펠릿화할 수 있습니다. 여과 및 차등 초원심분리는 폴리에틸렌 글리콜을 사용하는 침전 기술보다 선호되는 EV 분리 방법이며, 이러한 침전 방법은 세포 배양 상등액 및 기타 생물학적 유체에서 다량의 용해성 단백질과 지단백질을 공동 분리하기 때문입니다. 초원심분리는 대부분의 실험실에 초원심분리기가 장착되어 있어 초기 시작 비용을 완화하기 때문에 많은 사람들에게 가장 접근하기 쉬운 형태의 EV 절연으로 남아 있을 가능성이 높습니다. 그러나 많은 경우 EV 절연을 위한 초원심분리는 초원심분리 튜브의 부피와 재료의 시작 부피로 인해 방해를 받습니다. 다운스트림 단백질체학 또는 RNA 염기서열분석을 위한 충분한 EV 수량을 생산하기 위해 수백 밀리리터의 배양 상등액이 필요할 수 있습니다. 그러나 EV 분리를 위한 초원심분리 기술에는 분리된 EV의 순도를 개선하기 위해 테트라스파닌 CD9, CD63 및 CD81을 사용하는 SEC 및 면역친화성 캡처와 같은 다른 기술이 수반될 가능성이 높습니다. 상업적으로 이용 가능한 침전 용액 및 유세포 분석과 같은 다른 기술은 특정 조사에 일부 사용될 수 있습니다.
EV 제제의 순도
TSG101에 대한 웨스턴 블로팅(western blotting)에 의한 지방 세포 유래 EV의 분리를 확인했지만, 이 단일 웨스턴 블롯은 국제세포외소포체학회(International Society for Extracellular vesicles, ISEV)에서 발표한 가이드라인에 미치지 못합니다. 이러한 지방 세포 유래 EV의 추가 특성 분석은 테트라스파닌 CD9, CD63 및 CD81을 사용하여 엑소좀과 히스톤 H3, 알부민 및 아포지단백 A1과 같은 세포 오염 마커를 식별하는 것이 이상적입니다.
여기에 제시된 프로토콜은 EV 크기, 농도, 웨스턴 블롯에 의한 EV 마커 및 단백질체학 및 RNA 염기서열 분석과 같은 오믹스 기반 기술에서의 유용성을 결정하기 위한 지방 세포를 포함한 다양한 세포 소스의 세포 배양 상등액에서 EV를 분리할 수 있도록 합니다.
공개
저자는 공개할 내용이 없습니다.
감사의 말
N.A. 및 R.C.는 영국 심장 재단(British Heart Foundation)의 연구 보조금 지원을 인정합니다. RE/13/1/30181 및 RE/18/3/34214), 영국 심장 재단 프로젝트 보조금(N.A. 및 R.C.; PG/18/53/33895), 삼자 면역대사 컨소시엄, 노보 노디스크 재단(NNF15CC0018486), 국립보건연구소(NIHR), 옥스퍼드 생물의학 연구 센터(BRC), 너필드 베네팩션 포 메디슨, 웰컴 기관 전략 지원 기금(ISSF). 표현된 견해는 저자의 견해이며 반드시 NHS, NIHR 또는 보건부의 견해는 아닙니다.
자료
| Name | Company | Catalog Number | Comments |
| 100 µm mesh | Sefar | 03-250/50 | |
| 15 mL Conical Tube | Sarstedt | 62.554.002 | |
| 250 µm mesh | Sefar | 03-100/44 | |
| 50 mL Conical Tube | Sarstedt | 62.547.004 | |
| Beckman Coulter, Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Bicinchoninic acid assay (BCA) | Thermo Scientific | 23225 | |
| Biotin | Sigma | B4639 | |
| BSA (essentially fatty acid free) | Sigma | A7030 | |
| Collagenase H | Sigma | 11074032001 | |
| Dexamethasone | Sigma | D2915 | |
| Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 | Sigma | D6421 | |
| Fetal bovine serum | Labtech | FCS-SA | |
| Fibroblast growth factor | Bio-Techne | 233-FB-025 | |
| Glutamine | ThermoFisher | 25030024 | |
| Hanks balanced salt solution | Sigma | H9394 | |
| Human insulin | ThermoFisher | 12585-014 | |
| Hypodermic needles, Microlance 16G | VWR | 613-3897 | |
| IBMX | Sigma | I7018 | |
| Nanoparticle Tracking Analysis, Zetaview | Particle Metrix | BASIC PMX-120 | |
| NEFA kit | Randox | FA115 | |
| Pantothenate | Sigma | P5710 | |
| Penicillin and Streptomycin | ThermoFisher | 15140122 | |
| Phosphate buffered saline | ThermoFisher Scientific | 10010056 | |
| PluriStrainer 200 µm | Cambridge Bioscience | 43-50200-03 | |
| Polyallomer Quick-Seal ultra-clear 16 mm × 76 mm tubes | Beckman Coulter | 342413 | |
| Single use syringes, 2-piece, Injekt Solo | VWR | 20-2520 | |
| Sodium linoleate | Sigma | L8134 | |
| Sodium oleate | Sigma | O7501 | |
| Sodium palmitate | Sigma | P9767 | |
| Soldering Iron | Zacro | 7.14954E+11 | |
| Syringe Filter 0.2 µm | Sarstedt | 83.1826.001 | |
| Syringe Filter 0.45 µm | ThermoFisher | 195-2545 | |
| T175 cm2 tissue culture flasks | Sarstedt | 83.3912.002 | |
| T25 cm2 tissue culture flasks | Sarstedt | 83.3910.002 | |
| T75 cm2 tissue culture flasks | Sarstedt | 83.3911.002 | |
| Transferrin | Sigma | T8158 | |
| Triiodo-L-thyronine | Sigma | T5516 | |
| Troglitazone | Sigma | T2573 | |
| TrypLE Express Enzyme | Fisher Scientific | 12604021 |
참고문헌
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Akbar, N., et al. Endothelium-derived extracellular vesicles promote splenic monocyte mobilization in myocardial infarction. JCI Insight. 2 (17), (2017).
- Xiao, Y., et al. Extracellular vesicles in type 2 diabetes mellitus: key roles in pathogenesis, complications, and therapy. Journal of Extracellular Vesicles. 8, 1625677(2019).
- Akbar, N., Azzimato, V., Choudhury, R. P., Aouadi, M. Extracellular vesicles in metabolic disease. Diabetologia. 62 (12), 2179-2187 (2019).
- Kobayashi, Y., et al. Circulating extracellular vesicles are associated with lipid and insulin metabolism. The American Journal of Physiology-Endocrinology and Metabolism. 315 (4), 574-582 (2018).
- Eguchi, A., et al. Circulating adipocyte-derived extracellular vesicles are novel markers of metabolic stress. Journal of Molecular Medicine. 94 (11), Berlin, Germany. 1241-1253 (2016).
- Crewe, C., et al. An Endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 175 (3), 695-708 (2018).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363 (6430), 989-993 (2019).
- Deng, Z. B., et al. Adipose tissue exosome-like vesicles mediate activation of macrophage-induced insulin resistance. Diabetes. 58 (11), 2498-2505 (2009).
- Kranendonk, M. E., et al. Human adipocyte extracellular vesicles in reciprocal signaling between adipocytes and macrophages. Obesity. 22 (5), Silver Spring. 1296-1308 (2014).
- Song, M., et al. Adipocyte-derived exosomes carrying sonic hedgehog mediate M1 macrophage polarization-induced insulin resistance via Ptch and PI3K pathways. Cellular Physiology and Biochemistry. 48 (4), 1416-1432 (2018).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10 (3), 881-906 (2018).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments: JoVE. (95), e50974(2015).
- Connolly, K. D., et al. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 159 (9), 3259-3267 (2018).
- Camino, T., et al. Vesicles shed by pathological murine adipocytes spread pathology: characterization and functional role of insulin resistant/hypertrophied adiposomes. International Journal of Molecular Sciences. 21 (6), 2252(2020).
- Zhu, Y., et al. Extracellular vesicles derived from human adipose-derived stem cells promote the exogenous angiogenesis of fat grafts via the let-7/AGO1/VEGF signalling pathway. Scientific Reports. 10 (1), 5313(2020).
- Sadallah, S., Eken, C., Schifferli, J. A. Erythrocyte-derived ectosomes have immunosuppressive properties. Journal of Leukocyte Biology. 84 (5), 1316-1325 (2008).
- Sudnitsyna, J., et al. Microvesicle formation induced by oxidative stress in human erythrocytes. Antioxidants. 9 (10), Basel. (2020).
- Helal, O., et al. Increased levels of microparticles originating from endothelial cells, platelets and erythrocytes in subjects with metabolic syndrome: relationship with oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases. 21 (9), 665-671 (2011).
- Agouni, A., et al. Endothelial dysfunction caused by circulating microparticles from patients with metabolic syndrome. The American Journal of Pathology. 173 (4), 1210-1219 (2008).
- Park, J., Park, J., Nahm, S. -S., Choi, I., Kim, J. Identification of anti-adipogenic proteins in adult bovine serum suppressing 3T3-L1 preadipocyte differentiation. BMB Reports. 46 (12), 582-587 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유