Method Article
Isolamento e caratterizzazione di vescicole extracellulari derivate da adipociti umani mediante filtrazione e ultracentrifugazione
In questo articolo
Riepilogo
Descriviamo l'isolamento di vescicole extracellulari (EV) derivate da adipociti umani dal tessuto adiposo gluteo e addominale mediante filtrazione e ultracentrifugazione. Caratterizziamo le EV isolate derivate da adipociti determinandone le dimensioni e la concentrazione mediante Nanoparticle Tracking Analysis e western blotting per la presenza del gene di suscettibilità tumorale 101 (TSG101) della proteina EV.
Abstract
Le vescicole extracellulari (EV) sono involucri lipidici racchiusi che trasportano materiale biologicamente attivo come proteine, RNA, metaboliti e lipidi. Le vescicole extracellulari possono modulare lo stato cellulare di altre cellule localmente nei microambienti tissutali o attraverso la liberazione nel sangue periferico. Le vescicole extracellulari derivate dagli adipociti sono elevate nel sangue periferico e mostrano alterazioni nel loro carico (RNA e proteine) durante i disturbi metabolici, tra cui obesità e diabete. Le vescicole extracellulari derivate dagli adipociti possono regolare lo stato cellulare delle cellule vascolari vicine, come le cellule endoteliali e i macrofagi residenti nel tessuto adiposo, per promuovere l'infiammazione del tessuto adiposo. Studiare le alterazioni nelle vescicole extracellulari derivate dagli adipociti in vivo è complesso perché le vescicole extracellulari derivate dal sangue periferico sono altamente eterogenee e contengono vescicole extracellulari provenienti da altre fonti, vale a dire piastrine, cellule endoteliali, eritrociti e muscoli. Pertanto, la coltura di adipociti umani fornisce un sistema modello per lo studio delle vescicole extracellulari derivate dagli adipociti. Qui, forniamo un protocollo dettagliato per l'estrazione di piccole vescicole extracellulari totali da terreni di coltura cellulare di adipociti glutei e addominali umani mediante filtrazione e ultracentrifugazione. Dimostriamo inoltre l'uso dell'analisi di tracciamento delle nanoparticelle (NTA) per la quantificazione delle dimensioni e della concentrazione delle EV e mostriamo la presenza del gene di suscettibilità tumorale 101 (TSG101) nelle EV derivate dagli adipociti glutei e addominali. Le vescicole extracellulari isolate di questo protocollo possono essere utilizzate per l'analisi a valle, tra cui la microscopia elettronica a trasmissione, la proteomica, la metabolomica, il sequenziamento di piccoli RNA, i microarray e possono essere utilizzate in studi funzionali in vitro/in vivo.
Introduzione
Le vescicole extracellulari (EV) sono involucri racchiusi in lipidi che trasportano materiale biologicamente attivo come proteine, microRNA, metaboliti e lipidi. Il termine EV denota varie sottopopolazioni, che includono esosomi, microvescicole (microparticelle/ectosomi) e corpi apoptotici1. Le vescicole extracellulari possono fungere da biomarcatori perché sono implicate nella segnalazione patologica e rilasciate nei biofluidi, tra cui sangue e urine. Le vescicole extracellulari possono modulare lo stato cellulare di altre cellule localmente in microambienti tissutali o attraverso la liberazione nel sangue periferico2. Le vescicole extracellulari presentano le caratteristiche della loro cellula madre, ma la differenziazione di ciascuna sottopopolazione si basa principalmente sulle dimensioni delle vescicole extracellulari e sul contenuto proteico, come i marcatori delle vescicole extracellulari, tra cui la presenza di tetraspanine (CD9, CD63 e CD81), il gene 101 della suscettibilità al tumore (TSG101) e la proteina X che interagisce con ALG-2 (ALIX). Questi marcatori proteici sono rappresentativi dell'origine endosomiale (CD9, CD63 e CD81) per gli esosomi, che sono generati all'interno di corpi multivescicolari o rappresentano proteine associate alla gemmazione o al blebbing direttamente dalla membrana plasmatica per le microvescicole. Tuttavia, esiste una significativa sovrapposizione tra queste sottopopolazioni ed è difficile distinguere le singole sottopopolazioni in biofluidi complessi come il plasma, il siero o l'urina.
I disturbi metabolici, tra cui l'obesità, l'insulino-resistenza e le perturbazioni del glucosio extracellulare, dell'ossigeno e dell'infiammazione possono alterare le dimensioni e la concentrazione delle vescicole extracellulari e del loro carico. Le vescicole extracellulari derivate da adipociti trasportano perilipina A, adiponectina e mostrano alterazioni nel loro carico proteico e RNA durante l'obesità e il diabete 3,4,5,6. Le vescicole extracellulari derivate dagli adipociti regolano lo stato cellulare delle cellule endoteliali vascolari vicine7 e dei macrofagi residenti nel tessuto adiposo per promuovere l'infiammazione del tessuto adiposo e la resistenza all'insulina 8,9,10,11. Studiare le alterazioni nelle vescicole extracellulari derivate dagli adipociti in vivo è complesso perché le popolazioni di vescicole extracellulari derivate da biofluidi complessi come plasma, siero o urina contengono vescicole extracellulari provenienti da più fonti, come piastrine, cellule endoteliali, eritrociti e muscoli, che sono implicati nella patogenesi della disfunzione metabolica e della malattia.
La coltura e il differenziamento in vitro di preadipociti umani, quindi, fornisce un sistema modello per lo studio delle vescicole extracellulari derivate dagli adipociti. Qui, forniamo un protocollo dettagliato per l'estrazione di piccole vescicole extracellulari totali da terreni di coltura cellulare di adipociti umani utilizzando la filtrazione a siringa e l'ultracentrifugazione. L'ultracentrifugazione rimane un metodo di isolamento popolare per le vescicole extracellulari perché è facilmente accessibile e richiede poche conoscenze specialistiche preliminari. Tuttavia, altri metodi come la precipitazione, la cromatografia ad esclusione dimensionale e l'acquisizione di immunoaffinità mediante tetraspanine consentono l'isolamento delle vescicole extracellulari da una serie di biofluidi, tra cui plasma, siero, urine e terreni di coltura cellulare condizionati. Ogni metodo, incluso il protocollo di ultracentrifugazione qui descritto, produce preparazioni di EV di purezza variabile perché i metodi possono co-isolare proteine solubili e lipoproteine, che possono mascherarsi come EV. La combinazione di questo protocollo di ultra-centrifugazione con altri metodi come la centrifugazione per densità, la cromatografia ad esclusione dimensionale e la cattura di immunoaffinità aumenta notevolmente la purezza delle vescicole extracellulari isolate. Ma in modo simile all'ultracentrifugazione, questi altri metodi non consentono la cattura di sottopopolazioni indipendenti di vescicole extracellulari da campioni complessi come sangue, plasma e urine. Pertanto, le colture di popolazioni cellulari selezionate rimangono uno dei metodi più robusti per generare rese elevate di vescicole extracellulari specifiche per le cellule. Ogni metodo EV ha una serie di avvertenze e la scelta del metodo può influire sui tipi di EV isolati e sulle loro concentrazioni, il che può influenzare le indagini meccanicistiche a valle sulla segnalazione cellulare e tissutale e la determinazione del carico EV per studi diagnostici; questi problemi metodologici dell'isolamento delle vescicole extracellulari sono discussi altrove e nelle sezioni limitazioni di seguito 4,12. Qui, descriviamo l'isolamento di vescicole extracellulari derivate da adipociti umani mediante filtrazione e ultracentrifugazione. Dimostriamo inoltre l'uso dell'analisi di tracciamento delle nanoparticelle (NTA) per la quantificazione delle dimensioni e della concentrazione delle vescicole extracellulari e mostriamo la presenza del gene 101 della suscettibilità tumorale della proteina EV (TSG101) nelle nostre vescicole extracellulari derivate da adipociti umani. Le vescicole extracellulari isolate di questo protocollo possono essere utilizzate per l'analisi a valle, tra cui la microscopia elettronica a trasmissione, la proteomica, la metabolomica, il sequenziamento di piccoli RNA, i microarray e possono essere utilizzate in studi funzionali in vitro/in vivo.
Protocollo
Tutti i metodi sono stati approvati dal comitato di revisione dell'etica istituzionale dell'Università di Oxford. Il tessuto adiposo è stato ottenuto mediante agobiopsia in anestesia locale da volontari sani.
1. Preparazione del terreno di coltura cellulare e dei tamponi
- Preparare un tampone per la digestione della collagenasi sciogliendo la collagenasi H (1 mg/mL) in Hanks Balanced Salt Solution (HBSS) (senza cloruro di calcio e senza cloruro di magnesio) e in un filtro sterile utilizzando un filtro per siringa con pori da 0,2 μm.
- Preparare il tampone per la digestione della collagenasi non più di 10 minuti prima dell'uso.
- Preparare il terreno di crescita (GM) come segue: Dulbecco's Modified Eagle's Medium/Ham miscela nutritiva F12 (DMEM/F12) integrata con il 10% di siero fetale bovino (FBS), 100 unità/mL di penicillina, 100 μg/mL di streptomicina, 2 mM di L-glutammina e 0,5 ng/mL di fattore di crescita dei fibroblasti (FGF).
- Preparare il terreno di differenziazione di base (DM di base) come segue: DMEM/F12 integrato con 100 unità/mL di penicillina, 100 μg/mL di streptomicina, 2 mM di L-glutammina, 17 μM di pantotenato, 100 nM di insulina umana, 10 nM di triiodo-L-tironina, 33 μM di biotina, 10 μg/mL di transferrina e 1 μM di desametasone.
- Preparare il terreno di differenziazione completo (DM completo) integrando il DM di base del passaggio 1.3 con 0,25 mM di 3-isobutilil-1-metilxantina e 4 μM di troglitazone.
- Preparare 10 mM di soluzioni madre di acidi grassi complessate al 10% di albumina sierica bovina (BSA) essenzialmente priva di acidi grassi come segue.
- Sciogliere 16 g di BSA in 160 mL di terreno DMEM/F12 e scaldare a 37 °C. In tre provette coniche separate da 50 mL, pesare 150 mg di oleato di sodio, 139 mg di palmitato di sodio e 151 mg di linoleato di sodio. Aggiungere 50 mL della soluzione BSA riscaldata a ciascuna provetta e mescolare bene agitando ripetutamente la provetta.
- Riportare i tubi di oleato e linoleato a bagnomaria a 37 °C per 15 minuti. Mescolare a vortice fino a completa dissoluzione.
- Per la soluzione di palmitato, mettere il tubo in un bagnomaria a 65 °C per 2-3 minuti. Mescolare energicamente a vortice.
- Ripetere il passaggio 1.5.3 fino a completa dissoluzione, circa 30 minuti.
NOTA: Alcune piccole particelle potrebbero essere ancora visibili. - Filtrare in modo sterile le soluzioni di acidi grassi utilizzando un filtro per siringa con pori da 0,2 μm.
- Confermare la concentrazione di acidi grassi non esterificati di ciascuna soluzione madre utilizzando un test appropriato.
NOTA: Le scorte di acidi grassi dovrebbero essere di 10 mM (±10%) per ottenere un rapporto molare di 6:1 tra acido grasso e BSA. Se la concentrazione è al di fuori di questo intervallo, la soluzione madre deve essere rifatta. Le soluzioni madre possono essere aliquotate e conservate a -30 °C.
2. Digestione di biopsie di tessuto adiposo umano
- Filtrare lentamente il contenuto della siringa per biopsia attraverso un filtro cellulare sterile da 200 μm collegato a una provetta conica da 50 mL in modo che il tessuto adiposo venga raccolto nel filtro.
- Trasferire il colino in una nuova provetta conica da 50 mL e lavare il tessuto adiposo tre volte con 10 mL di HBSS.
NOTA: Potrebbe essere necessario rimuovere i coaguli di sangue e il tessuto fibroso con le forbici chirurgiche o ripetere il lavaggio HBSS per rimuovere i globuli rossi in eccesso. - Pesare il fazzoletto lavato.
NOTA: In genere otteniamo 400-800 mg di tessuto mediante agobiopsia. - Mettere il tampone digestivo della collagenasi in una provetta conica sterile da 50 ml e aggiungere il fazzoletto lavato. In questa fase è possibile utilizzare le forbici chirurgiche per tritare il tessuto in pezzi di uguali dimensioni.
NOTA: Utilizzare 5 ml di tampone per 0,5 g di fazzoletto. Per tessuti più grandi, i campioni possono essere tritati in una piastra di Petri. - Mettere la provetta in un bagno d'acqua con agitazione a 37 °C e incubare per 35-40 minuti.
NOTA: Dopo una digestione riuscita, la soluzione dovrebbe apparire lattiginosa. Se sono ancora visibili piccoli pezzi di tessuto, agitare con le mani per altri 10-20 s.
3. Isolamento dei preadipociti
- Per pellettare la frazione preadipocitaria, centrifugare a 1.000 x g per 5 min.
- Aspirare ed eliminare lo strato di adipociti galleggianti e il surnatante lasciando circa 1 mL di HBSS che copre il pellet cellulare.
- Risospendere il pellet in 5 mL di HBSS e far passare la sospensione cellulare attraverso una rete di pori di 250 μm seguita da una rete di 100 μm per rimuovere qualsiasi materiale non digerito. Raccogliere la sospensione cellulare in una provetta conica da 15 mL.
- Centrifugare a 1.000 x g per 5 min.
NOTA: Dopo questa fase, la frazione preadipocitaria può essere trattata con una soluzione di lisi dei globuli rossi se la contaminazione dei globuli rossi è un problema. - Aspirare e scartare il surnatante.
- Risospendere il pellet cellulare in 5 mL di GM (fase 1.2) e seminarlo in un pallone di coltura tissutale aderente da 25cm2 . Porre il matraccio in un incubatore per colture cellulari (5% CO2, 37 °C).
4. Mantenimento delle colture preadipocitarie
- Sostituire il GM ogni 2 giorni mentre le cellule proliferano
NOTA: I tassi di proliferazione cellulare possono variare tra i donatori.- Quando le cellule raggiungono circa l'80% di confluenza, trasferirle in un pallone di coltura tissutale aderente da 75cm2 . Rimuovere il GM e lavare le cellule con soluzione salina tamponata con fosfato (PBS).
- Scartare il PBS e aggiungere 0,5 mL di enzimi di dissociazione cellulare altamente purificati per dissociare le cellule attaccate. Incubare a 37 °C per 5 min.
- Picchiettare bruscamente il pallone per rilasciare le cellule e aggiungere 5 mL di GM. Raccogliere la sospensione cellulare in una provetta conica da 15 mL.
- Centrifugare a 1.000 x g per 5 min.
- Aspirare e scartare il surnatante. Risospendere il pellet cellulare in 5 mL di GM e trasferirlo in un matraccio da 75 cm2 . Rabboccare il GM fino a un volume finale di 12 mL e riposizionare il pallone nell'incubatore per colture cellulari (5% CO2, 37 °C).
NOTA: Per mantenere le cellule, continuare a cambiare il GM ogni 2-3 giorni. Quando le celle raggiungono l'80% di confluenza, ripetere i passaggi 4.2-4.3 e dividere le celle 1:3 in nuovi flaconi da 75 cm2 . Questo può essere ripetuto per diversi passaggi fino a quando non è stato generato un numero sufficiente di cellule per la configurazione sperimentale. Non consigliamo più di 10 passaggi poiché la capacità di proliferazione e differenziazione dei preadipociti diminuisce.
5. Semina dei preadipociti per il differenziamento adipogenico
- Contare le cellule utilizzando un emocitometro e seminare 200.000 cellule in pozzetti multipli di una piastra a 6 pozzetti in 2 mL di GM. In alternativa, seminare 3,5 milioni di cellule per 175 cm2 palloni in 22 mL di terreno GM.
- Lasciare proliferare le cellule per altri 2-4 giorni fino a raggiungere la completa confluenza, cambiando il GM il secondo giorno di coltura.
- Per iniziare la differenziazione adipogenica, rimuovere il GM e sostituirlo con DM completo per 4 giorni (2 mL di DM completo per pozzetto di una piastra a 6 pozzetti o 22 mL per un pallone da 175 cm2 ).
NOTA: Sostituire con un nuovo DM completo il giorno 2. - Il giorno 4, rimuovere il DM completo e sostituirlo con 2 mL di DM basico integrato con 22,5 μM di oleato, 15 μM di palmitato e 12,5 μM di linoleato per ottenere una concentrazione totale di acidi grassi di 50 μM per pozzetto di una piastra a 6 pozzetti o 22 mL per un matraccio da 175 cm2 . Sostituire con il supporto ogni 2 giorni per altri 10 giorni.
NOTA: Dal giorno 7 in poi, le goccioline lipidiche dovrebbero essere visibili nei preadipociti differenzianti. - Il giorno 14 della coltura, raccogliere i terreni dalle cellule per l'isolamento delle vescicole extracellulari derivate dagli adipociti.
6. Preparazione del surnatante di coltura cellulare per l'isolamento o la conservazione delle vescicole extracellulari e il futuro isolamento delle vescicole extracellulari
- Rimuovere i surnatanti di coltura cellulare da ciascuna piastra a 6 pozzetti e combinare. Aggiungere in una provetta da 15 ml o rimuovere tutti i surnatanti di coltura cellulare da un pallone da 175 cm2 e aggiungere in una provetta da 50 ml.
- Centrifugare a 1000 x g per 10 min a 4 °C.
- Decantare il surnatante in una nuova provetta pulita da 15 mL o 50 mL versandolo, rispettivamente.
- Rimuovere il cilindro di una siringa da 10 ml e collegare un filtro per siringa da 0,45 μm.
- Versare il surnatante nel serbatoio della siringa e applicare una leggera pressione sull'apertura del cilindro della siringa con il pollice o il palmo della mano fino a quando il surnatante della coltura cellulare non passa liberamente attraverso il filtro.
NOTA: La velocità di questa fase di filtrazione può variare a seconda del tipo di filtro della siringa. - Raccogliere il filtrato in una provetta pulita da 50 mL.
NOTA: Se necessario, il mezzo filtrato condizionato può essere conservato a questo punto a -80 °C per diverse settimane. Se necessario, scongelare i surnatanti di coltura cellulare a 4 °C e centrifugare a 1000 x g per 10 minuti a 4 °C. Decantare il surnatante in un tubo pulito versandolo prima di continuare con gli isolamenti EV.
7. Isolamento delle vescicole extracellulari
- Etichettare una provetta per ultracentrifugazione da 13 mL disegnando un cerchio sul fondo della provetta, dove si formerà il pellet EV previsto e segnare una linea attorno al collo della provetta per l'orientamento nel rotore della provetta per ultracentrifugazione. Etichettare la provetta con un identificatore del campione.
- Posizionare il tubo nel supporto del tubo.
- Collegare un ago da 16 G a una siringa da 10 ml e rimuovere il cilindro della siringa.
- Rimuovere il coperchio protettivo dall'ago e inserire l'ago nel collo della provetta per ultracentrifugazione.
- Versare il surnatante della coltura cellulare direttamente nel cilindro della siringa per riempire la provetta di ultracentrifugazione.
- Rabboccare il tubo con PBS se necessario fino a riempirlo.
NOTA: Se necessario, lasciare traboccare leggermente la provetta, assicurandosi che non vi siano spazi d'aria nella provetta per ultracentrifugazione e che non vi siano bolle d'aria. - Sigillare la provetta per ultracentrifugazione utilizzando un saldatore, assicurandosi che la provetta sia ermetica premendo delicatamente la provetta .
- Posizionare le provette per ultracentrifugazione nel rotore di ultracentrifugazione; assicurarsi che la linea segnata nella parte superiore del tubo e il cerchio disegnato alla base del tubo siano rivolti verso l'esterno, dove si formerà il pellet EV.
- Ultracentrifugare a 120.000 x g per 2 h a 4 °C.
- Rimuovere con cautela il rotore dall'ultracentrifuga.
- Rimuovere le provette per ultracentrifugazione dal rotore e inserirle nel portaprovette.
- Collegare un ago da 16 G a una siringa da 10 mL.
- Forare la parte superiore della provetta per ultracentrifugazione e inserire l'ago per 2 cm nella parte superiore della provetta e aspirare il surnatante nella siringa.
- Decantare questo surnatante impoverito di EV in una provetta da 1,5 mL e congelare a -80 °C.
- Reinserire l'ago nel tubo e aspirare con cura il surnatante rimanente e gettarlo.
- Taglia la parte superiore del tubo con un paio di forbici.
- Versare il surnatante rimanente con una rapida azione.
- Lasciare che il tubo penda capovolto per 1 minuto.
- Asciugare il liquido che si forma sul tubo con carta assorbente.
- Capovolgere il tubo e posizionarlo nel supporto del tubo.
- Aggiungere 100 μl di PBS alla provetta.
- Utilizzando la punta di una pipetta, rimuovere delicatamente il pellet EV alla base del tubo con un movimento circolare nell'area contrassegnata al punto 7.1.
- Vortice brevemente (1-2 secondi), due volte.
- Etichettare una nuova provetta per ultracentrifugazione da 13 ml disegnando un cerchio sul fondo della provetta, dove si formerà il pellet EV previsto e segnare una linea attorno al collo della provetta per l'orientamento nel rotore della provetta per ultracentrifugazione. Etichettare la provetta con un identificatore del campione.
- Posizionare il tubo nel supporto del tubo.
- Aggiungere 12 mL di PBS a una nuova provetta per ultracentrifugazione utilizzando una siringa e un ago puliti.
- Utilizzando una siringa e un ago, raccogliere il campione EV da 100 μl e aggiungerlo alla provetta. Mescolare accuratamente le EV e il PBS e sciacquare la siringa e l'ago raccogliendo delicatamente il PBS e aspirandolo nel tubo.
NOTA: Evitare la formazione di bolle. - Sigillare la provetta per ultracentrifugazione utilizzando un saldatore, assicurandosi che la provetta sia ermetica premendo delicatamente la provetta .
- Posizionare le provette per ultracentrifugazione nel rotore di ultracentrifugazione; Assicurarsi che la linea segnata nella parte superiore del tubo e il cerchio disegnato alla base del tubo siano rivolti verso l'esterno.
- Ultracentrifugare a 120.000 x g per 1 h a 4 °C.
- Rimuovere con cautela il rotore dall'ultracentrifuga.
- Collegare un ago da 16 G a una siringa da 12 mL.
- Forare la parte superiore della provetta per ultracentrifugazione e inserire l'ago fino a 2 cm nella parte superiore della provetta; Aspirare il surnatante nella siringa e gettarlo.
- Taglia la parte superiore del tubo con un paio di forbici.
- Versare il surnatante rimanente con una rapida azione.
- Lasciare che il tubo penda capovolto per 1 minuto.
- Asciugare tamponando il liquido che si forma sul bordo del tubo.
- Posizionare il tubo nel supporto del tubo.
- Aggiungere 100 μl di PBS alla provetta.
- Utilizzando la punta di una pipetta, rimuovere delicatamente il pellet EV alla base della provetta con un movimento circolare nell'area contrassegnata al punto 7.24.
- Vortice brevemente (1-2 secondi), due volte.
- Pipettare 100 μl di soluzione PBS/EV in una provetta pulita da 1,5 mL e conservare con ghiaccio umido.
NOTA: I veicoli elettrici sono pronti per la lavorazione a valle e possono essere congelati e conservati a -80 °C.
8. Determinazione delle dimensioni e della concentrazione delle EV mediante Nanoparticle Tracking Analysis (NTA)
- Preparazione del sistema
NOTA: Un metodo dettagliato per l'uso dell'analisi di tracciamento delle nanoparticelle (NTA) per la determinazione delle dimensioni e della concentrazione delle EV è stato riportato da Mehdiani et al.13.- Scongelare i campioni e conservarli a 4 °C.
- Avvia il software NTA facendo clic sull'icona del software.
- Il software si aprirà in "controllo cella" e richiederà di riempire la cella di flusso con acqua deionizzata. Riempire una siringa da 10 ml con acqua deionizzata e spingerla nella macchina, assicurandosi che non passino bolle d'aria nella camera di caricamento.
- Seguire le istruzioni sullo schermo per preparare il sistema attraverso un controllo di qualità (QC). Il software eseguirà un controllo delle celle e fornirà una misura della qualità delle celle. Questo dovrebbe essere da molto buono a eccellente.
- Preparare il controllo di qualità costituito da perle di polistirene a 100 nanometri. Pipettare 1 μL dello standard in 999 μL di acqua deionizzata (stock diluito). Successivamente, aggiungere 10 μL del brodo diluito a 2,5 mL di acqua deionizzata (campione QC). Miscelare la soluzione agitando delicatamente per 2-3 s e pipettando.
NOTA: I campioni di controllo qualità devono essere preparati freschi ogni giorno, ma il campione madre diluito iniziale è stabile per 1 settimana a 4 °C. - Riempire una siringa da 1 mL con 1 mL del campione QC e rimuovere tutte le bolle d'aria dalla siringa.
- Iniettare, senza introdurre bolle d'aria, nella camera di caricamento del campione NTA inclinando delicatamente la punta della siringa nella camera di iniezione, spingendo contemporaneamente lo stantuffo. Iniettare fino a 950 μl del campione QC nella camera.
NOTA: Non introdurre bolle d'aria nella camera di caricamento del campione. - Attendi che il software esegua un allineamento automatico (per mettere a fuoco la telecamera) e controlli la tensione per le letture del potenziale Z: il grafico della tensione dovrebbe essere una curva liscia a forma di U.
NOTA: Se viene visualizzato un messaggio di errore "voltage errore troppo basso", la cella potrebbe essere bagnata dalla pulizia o non sicura o potrebbe esserci una bolla d'aria. - Una volta completato l'allineamento automatico/il controllo della tensione, utilizzare il menu a discesa della posizione della telecamera per controllare tutte le posizioni (0,1-0,9) per verificare la presenza di segni insoliti: la presenza di questi indica che potrebbe essere necessario lavare e/o pulire la cella. Dopo il controllo qualità, il sistema visualizzerà "pronto per le misurazioni".
- Adescare la cella a flusso con PBS. Apri la scheda Pompa/Temp e in Pompa, fai clic su Esegui per la pompa 2 (serbatoio PBS). Questo eseguirà PBS attraverso la cella per 1 minuto, quindi si fermerà automaticamente.
NOTA: Potrebbero esserci particelle nella camera, ma queste possono essere eliminate spingendo 10 ml di PBS attraverso la porta di caricamento. - Riempire una siringa da 10 ml con PBS e caricarla nella camera senza bolle d'aria.
- Crea un protocollo per l'esecuzione del dispositivo che misurerà più posizioni del laser e farà la media delle particelle per fotogramma.
- Verificare che il numero di particelle sia inferiore a 5 (il più vicino possibile a 0) prima di procedere - sciacquare con più PBS, se necessario.
- Prima della diluizione, miscelare il campione EV mediante pipettaggio.
- Diluire il campione 1:1.000 in PBS e miscelare mediante pipettaggio. Riempire una siringa da 1 ml con il campione e caricarla nella camera senza bolle d'aria.
- Verificare che il conteggio delle particelle rientri nell'intervallo accettabile (la barra sopra il valore di conteggio deve essere nella regione verde o vicino ad essa). In caso contrario, regolare di conseguenza la diluizione del campione. Tra i campioni e le diluizioni dei campioni, caricare 10 mL di PBS nella parte anteriore della macchina per liberare la camera, quindi caricare 1 mL del campione diluito.
NOTA: Ogni campione avrà una diluizione indipendente in base alla concentrazione del campione. Il conteggio delle particelle del dispositivo deve essere compreso tra 50 e 200 particelle per fotogramma per misurazioni accurate. - Vai alla scheda Misurazione nel software.
- Fare clic sul pulsante Esegui acquisizione video .
- Immettere un nome per il campione e selezionare una cartella di destinazione per salvare la misurazione.
- Creare una procedura operativa standard (SOP) EV.
- Crea > Salva > Carica una SOP EV che misurerà il numero e la dimensione delle particelle a una velocità dell'otturatore di 100 e una sensibilità della fotocamera di 80, 11 posizioni della fotocamera per 2 cicli.
NOTA: A meno che il campione non abbia requisiti speciali, non è necessario modificare queste impostazioni. - Inserisci la diluizione del campione e aggiungi tutte le altre note che desideri aggiungere.
- Fare clic su OK e il software avvierà automaticamente la registrazione. Una volta terminato, il software caricherà automaticamente una tabella pop-up che mostra il conteggio medio delle particelle e le dimensioni per ogni posizione della telecamera.
NOTA: Non toccare la macchina o i piani di lavoro vicini durante questo periodo poiché le vibrazioni influenzeranno le letture finali. - Le posizioni della telecamera con letture statisticamente insolite verranno automaticamente escluse: per escludere manualmente le posizioni della telecamera (o includere nuovamente quelle escluse per qualsiasi motivo), fare clic sulla casella di controllo a sinistra dei dettagli del campione.
- Fare clic su Continua e il software creerà e aprirà un PDF del campione con le dimensioni e i risultati della concentrazione.
- Crea > Salva > Carica una SOP EV che misurerà il numero e la dimensione delle particelle a una velocità dell'otturatore di 100 e una sensibilità della fotocamera di 80, 11 posizioni della fotocamera per 2 cicli.
- Analisi statistica
- Analizza i dati NTA tramite ANOVA unidirezionale o bidirezionale con correzione Tukey post-hoc. Tracciare i dati come gruppo significa ± deviazione standard. Un valore P di <0,05 è stato considerato significativo.
Risultati
Abbiamo determinato la quantità di vescicole extracellulari isolate da adipociti glutei umani seguendo il protocollo descritto. Abbiamo calcolato la dimensione e la concentrazione delle vescicole extracellulari derivate da adipociti utilizzando NTA (Figura 1A, B). Abbiamo utilizzato i controlli sham-media, che erano volumi uguali di terreni che non erano stati a contatto con le cellule, ma coltivati e soggetti alla procedura di isolamento sopra descritta. Abbiamo misurato la concentrazione di EV derivata dagli adipociti dopo l'isolamento iniziale e dopo aver lavato le EV isolate degli adipociti in PBS (Figura 1A, B) e tracciato le medie di gruppo ± deviazione standard (SD), che è stata analizzata da un'ANOVA a due vie con correzione di Tukey post-hoc.
La concentrazione di EV derivate da adipociti determinata mediante NTA dal 1° isolamento variava da 6,10 x 106 a 2,70 x 107 con una mediana di 2,60 x 107 EV/mL (Figura 1 A, B). A seguito di un lavaggio PBS, c'erano significativamente meno EV derivate da adipociti per campione (Figura 1A, B) (P < 0,001), che variavano da 5,00 x 105 a 4,30 x 106 con una mediana di 2,70 x 106 EV/mL. I controlli sham-media non contenevano EV come determinato da NTA (Figura 1A, B). La dimensione modale delle vescicole extracellulari dal primo isolamento era di 125 nm e 105 nm dopo un lavaggio PBS (Figura 1A, B). Il protocollo descritto è stato ulteriormente applicato agli adipociti di derivazione addominale e glutea da fiasche più grandi di T175 cm2. Questi campioni di EV glutei derivati da fiasche T175 cm2 variavano in concentrazione da 3,60 x 107 a 7,50 x 107/mL con una mediana di 5,40 x 107 EV/mL. Le vescicole extracellulari derivate da adipociti addominali da fiasche T175 cm2 variavano in concentrazione da 6,30 x 107 a 8,60 x 107/mL con una mediana di 7,60 x 107 EV/mL (Figura 1C,D). La dimensione modale delle vescicole extracellulari derivate dai fiaschi T175 cm2 era di 115 nm per le vescicole extracellulari glutee e di 125 nm per le vescicole extracellulari addominali. Abbiamo confermato la presenza della proteina EV nelle EV derivate da glutei e addominali mediante immunoblotting per il gene di suscettibilità al tumore 101 (TSG101) e abbiamo scoperto che i pellet di cellule adipocitarie addominali e glutee e le EV derivate da adipociti addominali e glutei erano positivi per TSG101, mentre come terreni di controllo sham, che non erano stati in contatto con le cellule erano negativi (Figura 1E).
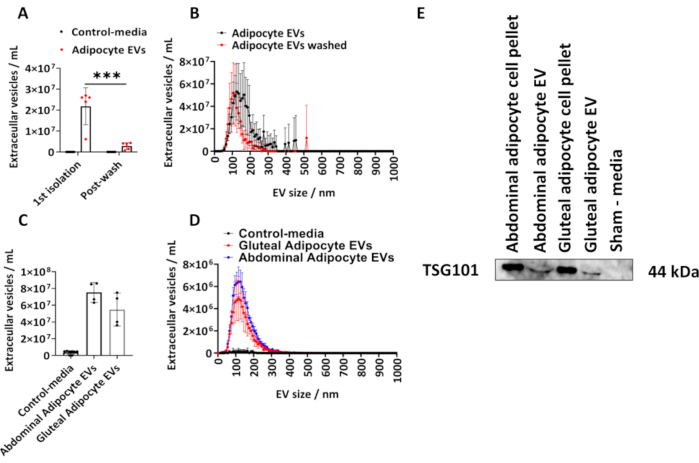
Figura 1: Dimensioni e profilo di distribuzione delle vescicole extracellulari derivate da adipociti da terreni di coltura cellulare e determinazione della proteina EV TSG101. Concentrazioni totali di EV e profili di distribuzione delle dimensioni e della concentrazione determinati mediante analisi di tracciamento delle nanoparticelle (NTA) dal 1° isolamento ( N = 5) e dopo il lavaggio con PBS (N = 6). (C) Concentrazioni totali e (D) profili di distribuzione delle dimensioni e della concentrazione determinati mediante NTA per EV derivate da addominali e glutei da fiasche T175 cm2 (N = 4 per gruppo). (E) Western blot di EV di derivazione glutea e addominale per TSG101. I pellet cellulari e i mezzi fittizi sono stati utilizzati rispettivamente come controlli positivi e negativi. I dati sono di gruppo ± deviazione standard (SD). ANOVA unidirezionale o bidirezionale con correzione Tukey post-hoc. P < 0,001. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Dimostriamo un protocollo per l'isolamento di vescicole extracellulari derivate da adipociti glutei e addominali da surnatanti di colture cellulari e ne determiniamo le dimensioni e la concentrazione mediante NTA 7,14,15. Abbiamo dimostrato che gli adipociti umani in coltura producono e rilasciano vescicole extracellulari nei terreni di coltura cellulare, che possono essere successivamente isolate mediante filtrazione e ultracentrifugazione. Abbiamo determinato le dimensioni e il profilo di concentrazione delle vescicole extracellulari isolate derivate da adipociti e abbiamo dimostrato che l'ultracentrifugazione probabilmente co-isolava contaminanti dai terreni di coltura cellulare e che il lavaggio dei pellet di vescicole extracellulari isolate in PBS riduce significativamente la loro concentrazione in una seconda misurazione NTA. Abbiamo inoltre determinato la purezza delle EV isolate derivate da glutei e addominali mediante western blotting per TSG101, un marcatore EV. Le preparazioni di EV di derivazione glutea e addominale erano positive per TSG101, ma, soprattutto, questo era assente nei terreni di controllo che non erano esposti alle cellule. Gli esperimenti presentati hanno utilizzato adipociti umani come cellula madre che genera EV, ma il metodo descritto è adatto per altri tipi di cellule, tra cui cellule endoteliali, muscolo liscio vascolare, muscolo scheletrico, cellule immunitarie e per l'isolamento di EV da plasma o siero povero di piastrine del paziente.
Le vescicole extracellulari derivate dagli adipociti sono elevate nelle malattie metaboliche e determinare alterazioni nelle dimensioni e nel numero di vescicole extracellulari degli adipociti in vivo è complesso perché i fluidi biologici come il sangue contengono vescicole extracellulari da una serie di fonti cellulari che sono anche implicate nella patogenesi della malattia metabolica, comprese le vescicole extracellulari da cellule endoteliali, muscolo scheletrico, eritrociti e cellule immunitarie. Il metodo qui descritto consente la determinazione delle vescicole extracellulari degli adipociti umani, che può fornire un modello utile per studi meccanicistici che indagano i fattori che portano alla biogenesi delle vescicole extracellulari negli adipociti, che è attualmente sconosciuta. È importante sottolineare che la determinazione della biogenesi delle EV degli adipociti e il modo in cui il caricamento di particolari RNA, proteine e metaboliti è orchestrato nelle EV degli adipociti può rivelare nuove opportunità terapeutiche per perturbare la segnalazione patogena delle EV degli adipociti nella disfunzione metabolica. Studi dettagliati forniranno una migliore comprensione di come le dimensioni, il numero, la via di biogenesi e il carico di EV (RNA, proteine e metaboliti) delle EV siano alterati in risposta a malattie o stimoli come perturbazioni di ossigeno, glucosio, lipidi e insulina. Le informazioni sul ruolo dei fattori ambientali sulla segnalazione delle vescicole extracellulari degli adipociti nella malattia metabolica e su come le vescicole extracellulari derivate dagli adipociti contribuiscono all'infiammazione del tessuto adiposo possono scoprire nuovi bersagli terapeutici nelle malattie metaboliche.
Limitazioni
Generazione in vitro di vescicole extracellulari derivate da adipociti
L'uso di preadipociti umani in vitro fornisce un sistema modello per studiare il rilascio e la generazione di vescicole extracellulari derivate da adipociti in seguito al differenziamento adipocitario in vitro, ma ci sono una serie di limitazioni. In particolare, è probabile che le vescicole extracellulari adipocitarie derivate in vitro differiscano dalle vescicole extracellulari derivate da derivati adiposi recuperate da fluidi biologici, come il plasma14 per dimensioni, concentrazione, proteina EV, RNA, metaboliti e funzione. Queste differenze di EV potrebbero essere influenzate da altre cellule non adipocitarie che sono residenti nel tessuto adiposo in vivo, come le cellule staminali derivate dal tessuto adiposo, le cellule endoteliali e i macrofagi, che sono intimamente legati alla fisiologia del tessuto adiposo e hanno mostrato ruoli nella patologia del tessuto adiposo, inclusa l'infiammazione del tessuto adiposo.
Va notato che il protocollo di differenziazione in vitro di 2 settimane qui descritto potrebbe non essere sufficiente per generare adipociti completamente maturi equivalenti a quelli osservati in vivo; gli adipociti differenziati in vitro cresciuti in un formato bidimensionale (2D) mostrano una morfologia diversa rispetto alle cellule in vivo e non sviluppano goccioline lipidiche uniloculare. Inoltre, i preadipociti descritti in questo protocollo sono ottenuti dalla frazione adiposa stromale-vascolare e non abbiamo valutato il contributo al pool EV da altri tipi di cellule che non sono state completamente eliminate durante l'isolamento cellulare.
La perdita di importanti interazioni cellula-cellula degli adipociti con altri non adipociti nel tessuto adiposo può influenzare la generazione di EV degli adipociti, il rilascio, la proteina EV e l'EV-RNA dagli adipociti e le cellule staminali derivate dal tessuto adiposo16. Tuttavia, non è stata intrapresa in modo esaustivo una valutazione delle differenze tra le vescicole extracellulari adipocitarie derivate in vitro e quelle prodotte in vivo.
Le biopsie tissutali primarie contengono sangue e pertanto le colture cellulari derivate possono contenere eritrociti e vescicole extracellulari derivate da eritrociti, indipendentemente dai lavaggi multipli e dai cambiamenti dei terreni evidenziati nel nostro protocollo. Un'ulteriore fase di lisi dei globuli rossi dopo l'isolamento della frazione stromale-vascolare può essere necessaria per eliminare gli effetti degli eritrociti sugli adipociti. Questo è importante perché le vescicole extracellulari derivate dagli eritrociti possono influenzare la funzione cellulare di altre cellule17 e le vescicole extracellulari derivate dagli eritrociti sono elevate in presenza di stress ossidativo18 e nei pazienti con sindrome metabolica19,20. Pertanto, il tessuto adiposo derivato da pazienti con malattia metabolica può contenere livelli elevati di EV derivate da eritrociti, che possono influenzare il fenotipo in vitro degli adipociti.
Eliminazione di FBS
Il protocollo descritto ha utilizzato FBS nei terreni di crescita durante la differenziazione adipogenica, ma successivamente gli adipociti sono stati soggetti a molteplici cambiamenti dei terreni prima della raccolta finale dei terreni per l'isolamento delle vescicole extracellulari derivate dagli adipociti. Pertanto, abbiamo ipotizzato che il rischio complessivo di contaminazione delle vescicole extracellulari derivate da FBS nelle preparazioni di vescicole extracellulari fosse basso e successivamente abbiamo confermato che le vescicole extracellulari residue non erano presenti nei terreni di coltura cellulare mediante western blotting per TSG101. L'isolamento di EV in coltura cellulare da fonti cellulari che richiedono FBS deve utilizzare FBS impoverito di EV o depletare EV bovine attraverso l'ultracentrifugazione per evitare che le EV bovine confondano le concentrazioni di EV degli adipociti e l'analisi del carico di EV degli adipociti. È noto che la deplezione del siero degli adipociti altera le loro risposte cellulari21 e quindi l'indagine deve garantire che la deplezione sierica o la deplezione EV dal siero renda le loro colture di adipociti veramente rappresentative della biologia degli adipociti.
Limitazione tecnica dell'isolamento delle vescicole extracellulari mediante filtrazione e ultracentrifugazione
Descriviamo un metodo di ultracentrifugazione con provette di plastica monouso che richiedono la sigillatura prima dell'ultracentrifugazione per l'isolamento delle vescicole extracellulari. Riconosciamo che questi tubi sigillati monouso potrebbero non essere un'opzione economica per molte persone e suggeriamo l'esplorazione di tubi simili, che non richiedono sigillatura e sono riutilizzabili. Tuttavia, i ricercatori devono garantire che il lavaggio dei tubi riutilizzabili sia adeguato e non porti all'accumulo progressivo di contaminanti proteici, lipidici e RNA nel tempo, che può influire sulle indagini a valle del carico associato alle vescicole extracellulari o sugli studi sulla funzione cellulare.
Il protocollo di filtrazione e ultracentrifugazione qui descritto è stato utilizzato per numerosi anni e diversi studi hanno evidenziato le carenze di questo metodo, tra cui gli isolamenti non specifici di componenti cellulari contaminanti come i mitocondri cellulari, la presenza di frammenti nucleari e costituenti della membrana cellulare. Inoltre, il metodo qui descritto co-isolerà le lipoproteine presenti nella FBS impoverita di EV. Il metodo può essere ulteriormente sviluppato mediante l'uso dell'ultracentrifugazione per densità e della cromatografia ad esclusione dimensionale (SEC) per eliminare le proteine solubili contaminanti e alcune lipoproteine. Insieme al lavaggio PBS delle EV isolate e dei SEC, i contaminanti co-isolati possono essere limitati ma non completamente eliminati. Pertanto, gli utilizzatori devono garantire l'inclusione di controlli appropriati, tra cui un terreno di coltura fittizio che non sia stato a contatto con le cellule per tenere conto delle proteine solubili e delle lipoproteine nei terreni di coltura e un controllo del surnatante impoverito di EV per dimostrare il successo dell'isolamento delle vescicole extracellulari da terreni condizionati che contengono ancora proteine e lipoproteine solubili.
L'isolamento delle vescicole extracellulari mediante filtrazione e ultracentrifugazione si basa sul fatto che l'operatore non applichi una pressione eccessiva ai surnatanti della coltura cellulare mentre viene fatta passare attraverso il foro del filtro o il foro dell'ago/siringa. L'applicazione di una forza eccessiva durante questa fase del protocollo descritto può rompere le vescicole extracellulari, influenzare le concentrazioni finali di vescicole extracellulari e generare RNA, proteine e metaboliti liberi, che una volta erano racchiusi nelle vescicole extracellulari. Abbiamo descritto qui un metodo che non richiede il cilindro della siringa e quindi l'applicazione di forza alle vescicole extracellulari in mezzi condizionati mentre passano attraverso il filtro o l'ago nei loro serbatoi di raccolta e provette per ultracentrifugazione. Tuttavia, è necessario prestare particolare attenzione quando si riattiva il pellet EV in PBS. È necessario utilizzare solo un vortice breve, poiché un vortice vigoroso può interrompere le membrane EV.
Dopo l'ultracentrifugazione, gli operatori devono fare attenzione alle provette per ultracentrifugazione per non disturbare il pellet EV. Ciò può essere ottenuto maneggiando le provette con cura e spostandole lentamente tra il rotore di ultracentrifugazione e il rack per provette. Prestare particolare attenzione quando si pratica un foro nella parte superiore della provetta di ultracentrifugazione per aspirare i surnatanti impoveriti di EV. L'inserimento dell'ago nella parte superiore della provetta e l'aspirazione rapida dei surnatanti creano un vuoto nel cilindro della siringa, che può forzare violentemente il surnatante a rientrare nella provetta per ultracentrifugazione e distruggere il pellet EV. Dopo aver tagliato la provetta di ultracentrifugazione per eliminare il surnatante rimanente, è necessario prestare attenzione perché il pellet EV potrebbe allentarsi e versando si scarterà il pellet EV. In alternativa, è possibile utilizzare una siringa e un ago per rimuovere lentamente il surnatante rimanente senza versare o capovolgere il tubo.
La filtrazione e l'ultracentrifugazione dei surnatanti per l'isolamento delle vescicole extracellulari è un metodo utile ed efficiente. Ma è soggetto al co-isolamento di lipoproteine e proteine solubili. Questi possono essere mitigati lavando le vescicole extracellulari con PBS (come descritto), ma questo non eliminerà tutti i contaminanti. Le proteine solubili possono essere eluite dalla frazione EV utilizzando SEC, tuttavia, questo metodo non distingue tra lipoproteine e EV. Le eluizioni SEC che contengono EV possono essere combinate con l'ultracentrifugazione per pellettare EV. La filtrazione e l'ultracentrifugazione differenziale sono un metodo preferito per l'isolamento delle vescicole extracellulari rispetto alle tecniche di precipitazione, che utilizzano il polietilenglicole perché questi metodi di precipitazione co-isolano grandi quantità di proteine solubili e lipoproteine nei surnatanti delle colture cellulari e in altri fluidi biologici. È probabile che l'ultracentrifugazione rimanga la forma più accessibile di isolamento delle vescicole extracellulari per molti, perché la maggior parte dei laboratori è dotata di un'ultracentrifuga, mitigando così i costi iniziali di avvio. Ma per molti, l'ultracentrifugazione per l'isolamento delle vescicole extracellulari è ostacolata dal volume delle provette per ultracentrifugazione e dal volume iniziale del materiale. Potrebbero essere necessarie diverse centinaia di millilitri di surnatanti di coltura per produrre una quantità sufficiente di EV per la proteomica a valle o il sequenziamento dell'RNA. Tuttavia, è probabile che le tecniche di ultracentrifugazione per l'isolamento delle vescicole extracellulari saranno accompagnate da altre tecniche come la SEC e la cattura di immunoaffinità utilizzando le tetraspanine CD9, CD63 e CD81 per migliorare la purezza delle vescicole extracellulari isolate. Altre tecniche, come le soluzioni di precipitazione disponibili in commercio e la citometria a flusso, possono essere di qualche utilità in indagini specifiche.
Purezza dei preparati EV
Abbiamo confermato l'isolamento di vescicole extracellulari derivate da adipociti mediante western blotting per TSG101, ma questo singolo western blot non è all'altezza delle linee guida pubblicate dalla società internazionale per le vescicole extracellulari (ISEV). Un'ulteriore caratterizzazione di queste vescicole extracellulari derivate dagli adipociti sarebbe ideale utilizzando le tetraspanine CD9, CD63 e CD81 per identificare esosomi e marcatori di contaminazione cellulare come l'istone H3, l'albumina e l'apolipoproteina A1.
Il protocollo qui presentato consente l'isolamento di vescicole extracellulari da surnatanti di colture cellulari da una serie di fonti cellulari, tra cui gli adipociti, per la determinazione delle dimensioni e della concentrazione di vescicole extracellulari mediante western blot e l'utilità in tecnologie omiche come la proteomica e il sequenziamento dell'RNA.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
N.A. e R.C. riconoscono il sostegno alle sovvenzioni per la ricerca della British Heart Foundation, del Centre of Research Excellence, Oxford (N.A. e R.C.; RE/13/1/30181 e RE/18/3/34214), British Heart Foundation Project Grant (N.A. e R.C.; PG/18/53/33895), il Consorzio Tripartito per l'Immunometabolismo, la Novo Nordisk Foundation (NNF15CC0018486), il National Institute for Health Research (NIHR), l'Oxford Biomedical Research Centre (BRC), il Nuffield Benefaction for Medicine e il Wellcome Institutional Strategic Support Fund (ISSF). Le opinioni espresse sono quelle dell'autore o degli autori e non necessariamente quelle del NHS, del NIHR o del Dipartimento della Salute.
Materiali
| Name | Company | Catalog Number | Comments |
| 100 µm mesh | Sefar | 03-250/50 | |
| 15 mL Conical Tube | Sarstedt | 62.554.002 | |
| 250 µm mesh | Sefar | 03-100/44 | |
| 50 mL Conical Tube | Sarstedt | 62.547.004 | |
| Beckman Coulter, Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Bicinchoninic acid assay (BCA) | Thermo Scientific | 23225 | |
| Biotin | Sigma | B4639 | |
| BSA (essentially fatty acid free) | Sigma | A7030 | |
| Collagenase H | Sigma | 11074032001 | |
| Dexamethasone | Sigma | D2915 | |
| Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 | Sigma | D6421 | |
| Fetal bovine serum | Labtech | FCS-SA | |
| Fibroblast growth factor | Bio-Techne | 233-FB-025 | |
| Glutamine | ThermoFisher | 25030024 | |
| Hanks balanced salt solution | Sigma | H9394 | |
| Human insulin | ThermoFisher | 12585-014 | |
| Hypodermic needles, Microlance 16G | VWR | 613-3897 | |
| IBMX | Sigma | I7018 | |
| Nanoparticle Tracking Analysis, Zetaview | Particle Metrix | BASIC PMX-120 | |
| NEFA kit | Randox | FA115 | |
| Pantothenate | Sigma | P5710 | |
| Penicillin and Streptomycin | ThermoFisher | 15140122 | |
| Phosphate buffered saline | ThermoFisher Scientific | 10010056 | |
| PluriStrainer 200 µm | Cambridge Bioscience | 43-50200-03 | |
| Polyallomer Quick-Seal ultra-clear 16 mm × 76 mm tubes | Beckman Coulter | 342413 | |
| Single use syringes, 2-piece, Injekt Solo | VWR | 20-2520 | |
| Sodium linoleate | Sigma | L8134 | |
| Sodium oleate | Sigma | O7501 | |
| Sodium palmitate | Sigma | P9767 | |
| Soldering Iron | Zacro | 7.14954E+11 | |
| Syringe Filter 0.2 µm | Sarstedt | 83.1826.001 | |
| Syringe Filter 0.45 µm | ThermoFisher | 195-2545 | |
| T175 cm2 tissue culture flasks | Sarstedt | 83.3912.002 | |
| T25 cm2 tissue culture flasks | Sarstedt | 83.3910.002 | |
| T75 cm2 tissue culture flasks | Sarstedt | 83.3911.002 | |
| Transferrin | Sigma | T8158 | |
| Triiodo-L-thyronine | Sigma | T5516 | |
| Troglitazone | Sigma | T2573 | |
| TrypLE Express Enzyme | Fisher Scientific | 12604021 |
Riferimenti
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Akbar, N., et al. Endothelium-derived extracellular vesicles promote splenic monocyte mobilization in myocardial infarction. JCI Insight. 2 (17), (2017).
- Xiao, Y., et al. Extracellular vesicles in type 2 diabetes mellitus: key roles in pathogenesis, complications, and therapy. Journal of Extracellular Vesicles. 8, 1625677(2019).
- Akbar, N., Azzimato, V., Choudhury, R. P., Aouadi, M. Extracellular vesicles in metabolic disease. Diabetologia. 62 (12), 2179-2187 (2019).
- Kobayashi, Y., et al. Circulating extracellular vesicles are associated with lipid and insulin metabolism. The American Journal of Physiology-Endocrinology and Metabolism. 315 (4), 574-582 (2018).
- Eguchi, A., et al. Circulating adipocyte-derived extracellular vesicles are novel markers of metabolic stress. Journal of Molecular Medicine. 94 (11), Berlin, Germany. 1241-1253 (2016).
- Crewe, C., et al. An Endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 175 (3), 695-708 (2018).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363 (6430), 989-993 (2019).
- Deng, Z. B., et al. Adipose tissue exosome-like vesicles mediate activation of macrophage-induced insulin resistance. Diabetes. 58 (11), 2498-2505 (2009).
- Kranendonk, M. E., et al. Human adipocyte extracellular vesicles in reciprocal signaling between adipocytes and macrophages. Obesity. 22 (5), Silver Spring. 1296-1308 (2014).
- Song, M., et al. Adipocyte-derived exosomes carrying sonic hedgehog mediate M1 macrophage polarization-induced insulin resistance via Ptch and PI3K pathways. Cellular Physiology and Biochemistry. 48 (4), 1416-1432 (2018).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10 (3), 881-906 (2018).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments: JoVE. (95), e50974(2015).
- Connolly, K. D., et al. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 159 (9), 3259-3267 (2018).
- Camino, T., et al. Vesicles shed by pathological murine adipocytes spread pathology: characterization and functional role of insulin resistant/hypertrophied adiposomes. International Journal of Molecular Sciences. 21 (6), 2252(2020).
- Zhu, Y., et al. Extracellular vesicles derived from human adipose-derived stem cells promote the exogenous angiogenesis of fat grafts via the let-7/AGO1/VEGF signalling pathway. Scientific Reports. 10 (1), 5313(2020).
- Sadallah, S., Eken, C., Schifferli, J. A. Erythrocyte-derived ectosomes have immunosuppressive properties. Journal of Leukocyte Biology. 84 (5), 1316-1325 (2008).
- Sudnitsyna, J., et al. Microvesicle formation induced by oxidative stress in human erythrocytes. Antioxidants. 9 (10), Basel. (2020).
- Helal, O., et al. Increased levels of microparticles originating from endothelial cells, platelets and erythrocytes in subjects with metabolic syndrome: relationship with oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases. 21 (9), 665-671 (2011).
- Agouni, A., et al. Endothelial dysfunction caused by circulating microparticles from patients with metabolic syndrome. The American Journal of Pathology. 173 (4), 1210-1219 (2008).
- Park, J., Park, J., Nahm, S. -S., Choi, I., Kim, J. Identification of anti-adipogenic proteins in adult bovine serum suppressing 3T3-L1 preadipocyte differentiation. BMB Reports. 46 (12), 582-587 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon