Method Article
בידוד ואפיון שלפוחיות חוץ-תאיות שמקורן באדיפוציטים אנושיים באמצעות סינון ואולטרה-צנטריפוגה
In This Article
Summary
אנו מתארים את הבידוד של שלפוחיות חוץ-תאיות (EVs) שמקורן באדיפוציטים אנושיים מרקמת השומן העכוזית והבטן באמצעות סינון ואולטרה-צנטריפוגה. אנו מאפיינים את ה-EVs המבודדים שמקורם באדיפוציטים על ידי קביעת גודלם וריכוזם על ידי ניתוח מעקב אחר ננו-חלקיקים ועל ידי כתמים מערביים לנוכחות גן רגישות לגידול חלבון EV 101 (TSG101).
Abstract
שלפוחיות חוץ-תאיות (EVs) הן מעטפות סגורות בשומנים הנושאות חומר פעיל ביולוגית כגון חלבונים, RNA, מטבוליטים ושומנים. EVs יכולים לווסת את המצב התאי של תאים אחרים באופן מקומי במיקרו-סביבות רקמה או באמצעות שחרור לדם היקפי. EVs שמקורם באדיפוציטים מוגברים בדם ההיקפי ומראים שינויים במטען שלהם (RNA וחלבון) במהלך הפרעות מטבוליות, כולל השמנת יתר וסוכרת. EVs שמקורם באדיפוציטים יכולים לווסת את המצב התאי של תאי כלי דם שכנים, כגון תאי אנדותל ומקרופאגים השוכנים ברקמת השומן כדי לקדם דלקת ברקמת השומן. חקירת שינויים ב-EVs שמקורם באדיפוציטים in vivo היא מורכבת מכיוון ש-EVs שמקורם בדם היקפי הם הטרוגניים מאוד ומכילים EVs ממקורות אחרים, כלומר טסיות דם, תאי אנדותל, אריתרוציטים ושרירים. לכן, התרבות של אדיפוציטים אנושיים מספקת מערכת מודל לחקר EVs שמקורם באדיפוציטים. כאן, אנו מספקים פרוטוקול מפורט למיצוי סך כל ה-EVs הקטנים ממצע תרבית תאים של אדיפוציטים אנושיים בגלוטאלי ובבטן באמצעות סינון ואולטרה-צנטריפוגה. אנו מדגימים עוד את השימוש בניתוח מעקב אחר ננו-חלקיקים (NTA) לכימות גודל וריכוז EV ומראים את נוכחותו של גן רגישות לגידול חלבון EV 101 (TSG101) ב-EVs הנגזרים מהעכוז והבטן. ניתן להשתמש ב-EVs מבודדים מפרוטוקול זה לניתוח במורד הזרם, כולל מיקרוסקופ אלקטרונים שידור, פרוטאומיקה, מטבולומיקה, ריצוף RNA קטן, מיקרו-מערכים וניתן להשתמש בהם במחקרים פונקציונליים in vitro/in vivo.
Introduction
שלפוחיות חוץ-תאיות (EVs) הן מעטפות סגורות בשומנים הנושאות חומר פעיל ביולוגית כגון חלבונים, מיקרו-רנ"א, מטבוליטים ושומנים. המונח EVs מציין תת-אוכלוסיות שונות, הכוללות אקסוזומים, מיקרו-שלפוחיות (מיקרו-חלקיקים/אקטוזומים) וגופים אפופטוטיים1. EVs עשויים לשמש כסמנים ביולוגיים מכיוון שהם מעורבים באיתות פתולוגי ומשתחררים לנוזלים ביולוגיים, כולל דם ושתן. EVs יכולים לווסת את המצב התאי של תאים אחרים באופן מקומי במיקרו-סביבות רקמה או באמצעות שחרור לדם היקפי2. EVs נושאים מאפיינים של תא האב שלהם, אך הבידול של כל תת-אוכלוסייה מבוסס בעיקר על גודל EV ותכולת חלבון כגון סמני EVs, כולל נוכחות של טטרספנינים (CD9, CD63 ו-CD81), גן רגישות לגידול 101 (TSG101) וחלבון X המקיים אינטראקציה עם ALG-2 (ALIX). סמני חלבון אלה מייצגים את המקור האנדוזומי (CD9, CD63 ו-CD81) עבור אקסוזומים, הנוצרים בתוך גופים רב-שלפוחיתיים או מייצגים חלבונים הקשורים לנביטה או לבלבל ישירות מקרום הפלזמה עבור מיקרו-שלפוחית. עם זאת, קיימת חפיפה משמעותית בין תת-אוכלוסיות אלה, וקשה להבחין בין תת-אוכלוסיות בודדות בנוזלים ביולוגיים מורכבים כגון פלזמה, סרום או שתן.
הפרעות מטבוליות, כולל השמנת יתר, עמידות לאינסולין והפרעות בגלוקוז חוץ-תאי, חמצן ודלקת יכולות לשנות את הגודל והריכוז של EVs והמטען שלהם. EVs שמקורם באדיפוציטים נושאים פריליפין A, אדיפונקטין ומראים שינויים במטען החלבון וה-RNA שלהם במהלך השמנת יתר וסוכרת 3,4,5,6. EVs שמקורם באדיפוציטים מווסתים את המצב התאי של תאי אנדותל כלי דם שכנים7 ומקרופאגים השוכנים ברקמת השומן כדי לקדם דלקת ברקמת השומן ותנגודת לאינסולין 8,9,10,11. חקירת שינויים ב-EVs שמקורם ב-adipocyte in vivo היא מורכבת מכיוון שאוכלוסיות EV שמקורן בנוזלים ביולוגיים מורכבים כגון פלזמה, סרום או שתן מכילות EVs ממקורות מרובים, כגון טסיות דם, תאי אנדותל, אריתרוציטים ושרירים, המעורבים בפתוגנזה של תפקוד מטבולי ומחלות.
התרבות והבידול במבחנה של קדם-אדיפוציטים אנושיים, אם כן, מספקים מערכת מודל לחקר EVs שמקורם באדיפוציטים. כאן, אנו מספקים פרוטוקול מפורט למיצוי סך כל ה-EVs הקטנים ממצע תרבית תאים של אדיפוציטים אנושיים באמצעות סינון מזרק ואולטרה-צנטריפוגה. אולטרה-צנטריפוגה נותרה שיטת בידוד פופולרית עבור רכבים חשמליים מכיוון שהיא נגישה בקלות ודורשת מעט ידע מומחה. עם זאת, שיטות אחרות כגון משקעים, כרומטוגרפיה של אי הכללת גודל ולכידת חיסון באמצעות טטרספנינים מאפשרות בידוד EV ממגוון נוזלים ביולוגיים, כולל פלזמה, סרום, שתן ומדיה של תרבית תאים מותנית. כל שיטה, כולל פרוטוקול האולטרה-צנטריפוגה המתואר כאן, מייצרת תכשירי EV בטוהר משתנה מכיוון שהשיטות יכולות לבודד חלבונים מסיסים וליפופרוטאינים, שעשויים להסוות EVs. שילוב פרוטוקול אולטרה-צנטריפוגה זה עם שיטות אחרות כגון צנטריפוגה בצפיפות, כרומטוגרפיה של אי הכללת גודל ולכידת חיסון מגדיל באופן דרמטי את הטוהר של EVs מבודדים. אך בדומה לאולטרה-צנטריפוגה, שיטות אחרות אלה אינן מאפשרות לכידת תת-אוכלוסיות עצמאיות של EVs מדגימות מורכבות כגון דם, פלזמה ושתן. לכן, תרביות של אוכלוסיות תאים נבחרות נותרו אחת השיטות החזקות ביותר ליצירת תשואות גבוהות של EVs ספציפיים לתאים. לכל שיטת EV יש מספר אזהרות ובחירת השיטה יכולה להשפיע על סוגי הרכבים החשמליים המבודדים והריכוזים שלהם, מה שעלול להטות חקירות מכניסטיות במורד הזרם של איתות תאים ורקמות וקביעת מטען EV למחקרי אבחון; סוגיות מתודולוגיות אלה של בידוד EV נדונות במקומות אחרים ובסעיפי המגבלות מתחתל-4,12. כאן, אנו מתארים את הבידוד של EVs אנושיים שמקורם באדיפוציטים באמצעות סינון ואולטרה-צנטריפוגה. אנו מדגימים עוד את השימוש בניתוח מעקב אחר ננו-חלקיקים (NTA) לכימות גודל וריכוז EV ומראים את נוכחותו של גן רגישות לגידול חלבון EV 101 (TSG101) ב-EVs שמקורם באדיפוציטים אנושיים. ניתן להשתמש ב-EVs מבודדים מפרוטוקול זה לניתוח במורד הזרם, כולל מיקרוסקופ אלקטרונים שידור, פרוטאומיקה, מטבולומיקה, ריצוף RNA קטן, מיקרו-מערך, וניתן להשתמש בהם במחקרים פונקציונליים in vitro/in vivo.
Protocol
כל השיטות אושרו על ידי מועצת הביקורת האתית המוסדית באוניברסיטת אוקספורד. רקמת השומן הושגה על ידי ביופסיית מחט בהרדמה מקומית ממתנדבים בריאים.
1. הכנת מדיום תרבית תאים ומאגרים
- הכן מאגר עיכול קולגנאז על ידי המסת קולגנאז H (1 מ"ג/מ"ל) בתמיסת מלח מאוזנת של הנקס (HBSS) (ללא סידן כלורי וללא מגנזיום כלוריד) ומסנן סטרילי באמצעות מסנן מזרק נקבוביות של 0.2 מיקרומטר.
- הכן את מאגר העיכול של הקולגנאז לא יותר מ -10 דקות לפני השימוש.
- הכינו את מצע הגידול (GM) באופן הבא: תערובת החומרים המזינים F12 (DMEM/F12) של Dulbecco בתוספת 10% סרום בקר עוברי (FBS), 100 יחידות/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין, 2 מ"מ L-גלוטמין ו-0.5 ננוגרם/מ"ל גורם גדילה פיברובלסטים (FGF).
- הכן את מדיום ההתמיינות הבסיסי (DM בסיסי) באופן הבא: DMEM/F12 בתוספת 100 יחידות/מ"ל פניצילין, 100 מיקרוגרם/מ"ל סטרפטומיצין, 2 מ"מ L-גלוטמין, 17 מיקרומטר פנטותנט, 100 ננומטר אינסולין אנושי, 10 ננומטר טריודו-L-תירונין, 33 מיקרומטר ביוטין, 10 מיקרוגרם/מ"ל טרנספרין ו-1 מיקרומטר דקסמתזון.
- הכן מדיום התמיינות מלא (DM מלא) על ידי השלמת ה-DM הבסיסי משלב 1.3 עם 0.25 מ"מ 3-איזובוטיל-1-מתילקסנטין ו-4 מיקרומטר טרוגליטזון.
- הכן תמיסות מלאי חומצות שומן של 10 מ"מ מורכבות ל-10% אלבומין בסרום בקר נטול חומצות שומן (BSA) כדלקמן.
- ממיסים 16 גרם BSA ב-160 מ"ל של DMEM/F12 בינוני ומחממים ל-37 מעלות צלזיוס. בשלושה צינורות חרוטיים נפרדים של 50 מ"ל, שקלו 150 מ"ג נתרן אולאט, 139 מ"ג נתרן פלמיטט ו-151 מ"ג נתרן לינולאט. הוסף 50 מ"ל מתמיסת ה-BSA המחוממת לכל צינור וערבב היטב על ידי מערבולת חוזרת.
- החזירו את צינורות האולאט והלינולאט לאמבט המים של 37 מעלות צלזיוס למשך 15 דקות. מערבבים על ידי מערבולת עד להמסה מלאה.
- לתמיסת הפלמיטט, הנח את הצינור באמבט מים של 65 מעלות צלזיוס למשך 2-3 דקות. מערבבים במרץ על ידי מערבולת.
- חזור על שלב 1.5.3 עד להמסה מלאה - כ-30 דקות.
הערה: ייתכן שחלק מהחלקיקים הקטנים עדיין נראים לעין. - מסנן סטרילי את תמיסות חומצות השומן באמצעות מסנן מזרק נקבוביות של 0.2 מיקרומטר.
- אשר את ריכוז חומצות השומן הלא אסטריות של כל תמיסת מלאי באמצעות בדיקה מתאימה.
הערה: מלאי חומצות השומן צריך להיות 10 מ"מ (±10%) כדי לתת יחס מולארי של 6:1 בין חומצת שומן ל-BSA. אם הריכוז נמצא מחוץ לטווח זה, יש ליצור מחדש את תמיסת המלאי. ניתן להציע פתרונות מלאי ולאחסן אותם בטמפרטורה של -30 מעלות צלזיוס.
2. עיכול ביופסיות של רקמת שומן אנושית
- מסננים לאט את תכולת מזרק הביופסיה דרך מסננת תאים סטרילית של 200 מיקרומטר המחוברת לצינור חרוטי של 50 מ"ל כך שרקמת השומן נאספת במסננת.
- העבירו את המסננת לצינור חרוטי חדש של 50 מ"ל ושטפו את רקמת השומן שלוש פעמים עם 10 מ"ל HBSS.
הערה: ייתכן שיהיה צורך להסיר קרישי דם ורקמות סיביות בעזרת מספריים כירורגיים או לחזור על שטיפת HBSS כדי להסיר עודפי כדוריות דם אדומות. - שקלו את הרקמה השטופה.
הערה: בדרך כלל אנו משיגים 400-800 מ"ג רקמה על ידי ביופסיית מחט. - הכניסו את מאגר העיכול של הקולגנאז לצינור חרוטי סטרילי של 50 מ"ל והוסיפו את הרקמה השטופה. ניתן להשתמש במספריים כירורגיים בשלב זה כדי לטחון את הרקמה לחתיכות בגודל שווה.
הערה: השתמש ב-5 מ"ל של חיץ לכל רקמה של 0.5 גרם. עבור רקמות גדולות יותר, ניתן לטחון דגימות בצלחת פטרי. - הכניסו את הצינור לאמבט מים מטלטלים של 37 מעלות צלזיוס ודגרו למשך 35-40 דקות.
הערה: לאחר עיכול מוצלח, התמיסה אמורה להיראות חלבית. אם עדיין ניתן לראות חתיכות רקמה קטנות, יש לנער ביד למשך 10-20 שניות נוספות.
3. בידוד של פרה-אדיפוציטים
- כדי לגלול את צנטריפוגת השבר הקדם-אדיפוציט ב -1,000 x גרם למשך 5 דקות.
- שאפו והשליכו את שכבת השומן הצפה והסופרנטנט והשאירו כ-1 מ"ל של HBSS המכסה את גלולת התא.
- השעו מחדש את הגלולה ב-5 מ"ל של HBSS והעבירו את תרחיף התא דרך רשת בגודל נקבוביות של 250 מיקרומטר ואחריה רשת של 100 מיקרומטר כדי להסיר כל חומר לא מעוכל. אוספים את תרחיף התאים בצינור חרוטי של 15 מ"ל.
- צנטריפוגה ב -1,000 x גרם למשך 5 דקות.
הערה: לאחר שלב זה, ניתן לטפל במקטע הפרה-אדיפוציט בתמיסת ליזה של תאי דם אדומים אם זיהום כדוריות דם אדומות מהווה בעיה. - שאפו והשליכו את הסופרנטנט.
- השעו מחדש את כדור התא ב-5 מ"ל GM (שלב 1.2) וזרעו לבקבוק תרביתרקמה דבק בגודל 25 ס"מ. מניחים את הבקבוק בחממת תרבית תאים (5% CO2, 37 מעלות צלזיוס).
4. תחזוקה של תרביות קדם-אדיפוציטים
- החלף את ה-GM כל יומיים בזמן שהתאים מתרבים
הערה: שיעורי התפשטות התאים עשויים להשתנות בין התורמים.- כאשר התאים מגיעים לכ-80% מפגש, העבירו אותם לבקבוק תרביתרקמה דבק בגודל 75 ס"מ. הסר את ה-GM ושטוף את התאים עם מי מלח עם פוספט (PBS).
- השליכו את ה-PBS והוסיפו 0.5 מ"ל של אנזימי דיסוציאציה של תאים מטוהרים מאוד כדי לנתק את התאים המחוברים. יש לדגור בטמפרטורה של 37 מעלות צלזיוס למשך 5 דקות.
- הקש על הבקבוק בחדות כדי לשחרר את התאים ולהוסיף 5 מ"ל GM. אסוף את תרחיף התאים בצינור חרוטי של 15 מ"ל.
- צנטריפוגה ב -1,000 x גרם למשך 5 דקות.
- שאפו והשליכו את הסופרנטנט. השעו מחדש את כדור התא ב-5 מ"ל GM והעבירו לבקבוק בגודל 75 ס"מ2 . מלאו את ה-GM לנפח סופי של 12 מ"ל והחליפו את הבקבוק בחממת תרבית התאים (5% CO2, 37 מעלות צלזיוס).
הערה: כדי לשמור על התאים, המשך להחליף את ה-GM כל 2-3 ימים. כאשר התאים מגיעים למפגש של 80%, חזור על שלבים 4.2-4.3 וחלק את התאים 1:3לצלוחיות חדשות בגודל 75 ס"מ. ניתן לחזור על זה במשך מספר קטעים עד שנוצר מספר מספיק של תאים עבור מערך הניסוי. לא היינו ממליצים על יותר מ-10 מעברים מכיוון שיכולת ההתפשטות וההתמיינות של הפרה-אדיפוציטים יורדת.
5. זריעת פרה-אדיפוציטים להתמיינות אדיפוגנית
- ספרו את התאים באמצעות המוציטומטר וזרעו 200,000 תאים לבארות מרובות של צלחת של 6 בארות ב-2 מ"ל של GM. לחלופין, זרעו 3.5 מיליון תאים לכל 175 ס"מ2 בקבוק ב-22 מ"ל של מדיה מהונדסת גנטית.
- אפשר לתאים להתרבות במשך 2-4 ימים נוספים עד שהם מגיעים למפגש מלא, ולשנות את ה-GM ביום השני של התרבית.
- כדי להתחיל בהתמיינות אדיפוגנית, הסר את ה-GM והחלף ב-DM מלא למשך 4 ימים (2 מ"ל DM מלא לבאר של צלחת של 6 בארות או 22 מ"ל עבור בקבוק175 ס"מ 2).
הערה: החלף ב-DM שלם טרי ביום השני. - ביום הרביעי, הסר את ה-DM השלם והחלף ב-2 מ"ל DM בסיסי בתוספת 22.5 מיקרומטר אולאט, 15 מיקרומטר פלמיטט ו-12.5 מיקרומטר לינולאט כדי לתת ריכוז כולל של חומצות שומן של 50 מיקרומטר לבאר של צלחת של 6 בארות או 22 מ"ל לבקבוק 175 ס"מ2 . יש להחליף במדיה כל יומיים למשך 10 ימים נוספים.
הערה: מהיום השביעי ואילך, טיפות שומן אמורות להופיע בפרה-אדיפוציטים המבדילים. - ביום התרבית ה-14, אספו את המדיה מהתאים לבידוד EVs שמקורם באדיפוציטים.
6. הכנת תרבית תאים לבידוד או אחסון שלפוחית חוץ-תאית ובידוד שלפוחית חוץ-תאית עתידית
- הסר את סופרנטנטים של תרבית תאים מכל צלחת של 6 בארות ושלב. הוסיפו לשפופרת של 15 מ"ל או הסירו את כל הסופרנטנטים של תרבית התאים מבקבוקבגודל 175 ס"מ והוסיפו לצינור של 50 מ"ל.
- צנטריפוגה ב-1000 x גרם למשך 10 דקות ב-4 מעלות צלזיוס.
- שפכו סופרנטנט לתוך צינור נקי חדש של 15 מ"ל או 50 מ"ל על ידי מזיגה, בהתאמה.
- הסר את הקנה של מזרק 10 מ"ל וחבר מסנן מזרק של 0.45 מיקרומטר.
- יוצקים פנימה את הסופרנטנט למאגר המזרק ומפעילים לחץ עדין על פתח קנה המזרק בעזרת אגודל או כף יד עד שתרבית התאים עוברת בחופשיות דרך המסנן.
הערה: המהירות של שלב סינון זה יכולה להשתנות בהתאם לסוג מסנן המזרק. - אוספים את המסנן בצינור נקי של 50 מ"ל.
הערה: במידת הצורך, ניתן לאחסן את המדיה המסוננת המותנית בשלב זה בטמפרטורה של -80 מעלות צלזיוס למשך מספר שבועות. במידת הצורך, הפשירו את חומרי העל של תרבית התאים ב-4 מעלות צלזיוס וצנטריפוגה ב-1000 x גרם למשך 10 דקות ב-4 מעלות צלזיוס. שפכו את הסופרנטנט לתוך צינור נקי על ידי מזיגה לפני שתמשיכו עם בידודי ה-EV.
7. בידוד שלפוחיות חוץ-תאיות
- סמן צינור אולטרה-צנטריפוגה של 13 מ"ל על ידי ציור עיגול בתחתית הצינור, שם תיווצר גלולת ה-EV הצפויה וסמן קו סביב צוואר הצינור להתמצאות ברוטור צינור האולטרה-צנטריפוגה. סמן את הצינור עם מזהה מדגם.
- הנח את הצינור במחזיק הצינור.
- חבר מחט של 16 גרם למזרק של 10 מ"ל והסר את קנה המזרק.
- הסר את כיסוי המגן מהמחט והכנס את המחט לצוואר צינור האולטרה-צנטריפוגה.
- יוצקים את תרבית התאים ישירות לתוך חבית המזרק כדי למלא את צינור האולטרה-צנטריפוגה.
- מלאו את הצינור ב-PBS לפי הצורך עד למלא.
הערה: אפשר לצינור לעלות מעט על גדותיו במידת הצורך, וודא שאין חללי אוויר בצינור האולטרה-צנטריפוגה ואין בועות אוויר. - אטום את צינור האולטרה-צנטריפוגה באמצעות מלחם, וודא שהצינור אטום על ידי סחיטה עדינה של הצינור.
- הנח את צינורות האולטרה-צנטריפוגה ברוטור האולטרה-צנטריפוגה; ודא שהקו המסומן בחלק העליון של הצינור והעיגול המצויר בבסיס הצינור פונים כלפי חוץ, שם תיווצר גלולת ה-EV.
- אולטרה-צנטריפוגה ב-120,000 x גרם למשך שעתיים ב-4 מעלות צלזיוס.
- הסר בזהירות את הרוטור מהאולטרה-צנטריפוגה.
- הסר צינורות אולטרה-צנטריפוגה מהרוטור והנח במחזיק הצינור.
- חבר מחט של 16 גרם למזרק של 10 מ"ל.
- חודרים את החלק העליון של צינור האולטרה-צנטריפוגה ומכניסים את המחט 2 ס"מ לחלק העליון של הצינור ושואבים את הסופרנטנט לתוך המזרק.
- שפכו את הסופרנטנט המדולדל הזה לתוך צינור של 1.5 מ"ל והקפיאו בטמפרטורה של -80 מעלות צלזיוס.
- הכנס מחדש את המחט לתוך הצינור ושאף בזהירות את הסופרנטנט שנותר והשליך.
- חותכים את החלק העליון של הצינור בעזרת מספריים.
- יוצקים את שאריות הסופרנטנט בפעולה מהירה אחת.
- הניחו לצינור לתלות הפוך למשך דקה אחת.
- יבש בטפיחות כל נוזל שנוצר על הצינור בעזרת מגבת נייר.
- הפוך את הצינור והנח במחזיק הצינור.
- הוסף 100 מיקרוליטר PBS לשפופרת.
- בעזרת קצה פיפטה, עקור בעדינות את כדור ה-EV בבסיס הצינור באמצעות תנועה סיבובית באזור המסומן בשלב 7.1.
- מערבולת קצרה (1-2 שניות), פעמיים.
- סמן צינור אולטרה-צנטריפוגה חדש של 13 מ"ל על ידי ציור עיגול בתחתית הצינור, שם תיווצר גלולת ה-EV הצפויה ומסמן קו סביב צוואר הצינור להתמצאות ברוטור צינור האולטרה-צנטריפוגה. סמן את הצינור עם מזהה מדגם.
- הנח את הצינור במחזיק הצינור.
- הוסף 12 מ"ל PBS לצינור אולטרה-צנטריפוגה חדש באמצעות מזרק ומחט נקיים.
- בעזרת מזרק ומחט אוספים את דגימת ה-EV של 100 מיקרוליטר ומוסיפים לצינור. ערבבו בזהירות את ה-EVs וה-PBS ושטפו את המזרק והמחט על ידי איסוף עדין של PBS ושאיבה לתוך הצינור.
הערה: הימנע מיצירת בועות. - אטום את צינור האולטרה-צנטריפוגה באמצעות מלחם, וודא שהצינור אטום על ידי סחיטה עדינה של הצינור.
- הנח את צינורות האולטרה-צנטריפוגה ברוטור האולטרה-צנטריפוגה; ודא שהקו המסומן בחלק העליון של הצינור והעיגול המצויר בבסיס הצינור פונים כלפי חוץ.
- אולטרה-צנטריפוגה ב-120,000 x גרם למשך שעה אחת ב-4 מעלות צלזיוס.
- הסר בזהירות את הרוטור מהאולטרה-צנטריפוגה.
- חבר מחט של 16 גרם למזרק של 12 מ"ל.
- חודרים את החלק העליון של צינור האולטרה-צנטריפוגה ומכניסים את המחט עד 2 ס"מ לחלק העליון של הצינור; שואבים את הסופרנטנט לתוך המזרק וזורקים.
- חותכים את החלק העליון של הצינור בעזרת מספריים.
- יוצקים את שאריות הסופרנטנט בפעולה מהירה אחת.
- הניחו לצינור לתלות הפוך למשך דקה אחת.
- יבש בטפיחות כל נוזל שנוצר בקצה הצינור.
- הנח את הצינור במחזיק הצינור.
- הוסף 100 מיקרוליטר PBS לשפופרת.
- בעזרת קצה פיפטה, עקור בעדינות את כדור ה-EV בבסיס הצינור באמצעות תנועה סיבובית באזור המסומן בשלב 7.24.
- מערבולת קצרה (1-2 שניות), פעמיים.
- יש להזרים 100 מיקרוליטר של תמיסת PBS/EV לתוך צינור נקי של 1.5 מ"ל ולשמור על קרח רטוב.
הערה: EV מוכנים לעיבוד במורד הזרם וניתן להקפיא ולאחסן בטמפרטורה של -80 מעלות צלזיוס.
8. קביעת גודל וריכוז EV באמצעות ניתוח מעקב אחר ננו-חלקיקים (NTA)
- הכנת המערכת
הערה: שיטה מפורטת לשימוש בניתוח מעקב אחר ננו-חלקיקים (NTA) לקביעת גודל וריכוז EV דווחה על ידי Mehdiani et al.13.- הפשירו דגימות ושמרו אותן בטמפרטורה של 4 מעלות צלזיוס.
- הפעל את תוכנת NTA על ידי לחיצה על סמל התוכנה.
- התוכנה תיפתח ב"בדיקת תאים" ותבקש למלא את תא הזרימה במים נטולי יונים. מלאו מזרק של 10 מ"ל במים נטולי יונים ודחפו לתוך המכונה, כדי להבטיח שלא יעברו בועות אוויר לתא הטעינה.
- עקוב אחר ההוראות שעל המסך כדי להכין את המערכת באמצעות בדיקת איכות (QC). התוכנה תבצע בדיקת תאים ותיתן מדד לאיכות התא. זה אמור להיות טוב מאוד עד מצוין.
- הכן את בקרת האיכות המורכבת מחרוזי פוליסטירן 100 ננומטר. פיפטה 1 מיקרוליטר של התקן ל-999 מיקרוליטר של מים נטולי יונים (מלאי מדולל). לאחר מכן, הוסף 10 מיקרוליטר מהמלאי המדולל ל-2.5 מ"ל מים נטולי יונים (דגימת QC). מערבבים את התמיסה על ידי מערבולת עדינה במשך 2-3 שניות ועל ידי פיפטינג.
הערה: יש להכין דגימות בקרת איכות טריות מדי יום, אך דגימת המלאי המדוללת הראשונית יציבה למשך שבוע ב-4 מעלות צלזיוס. - מלאו מזרק של 1 מ"ל ב-1 מ"ל של דגימת ה-QC והוציאו את כל בועות האוויר מהמזרק.
- הזרק, מבלי להכניס בועות אוויר, לתא טעינת הדגימה של NTA על ידי הטיה עדינה של קצה המזרק לתוך תא ההזרקה, תוך דחיפה בו-זמנית של הבוכנה. הזרקו עד 950 מיקרוליטר מדגימת ה-QC לתוך החדר.
הערה: אין להכניס בועות אוויר לתא טעינת הדגימה. - המתן בזמן שהתוכנה מבצעת יישור אוטומטי (כדי למקד את המצלמה) ובודקת את המתח עבור קריאות פוטנציאל Z - גרף המתח צריך להיות עקומה חלקה בצורת U.
הערה: אם יש הודעת שגיאה "כרךtage שגיאה נמוכה מדי", ייתכן שהתא רטוב מניקוי או לא מאובטח או שיש בועת אוויר. - לאחר השלמת היישור האוטומטי/כרךtagבדיקת המתח, השתמש בתפריט הנפתח של מיקום המצלמה כדי לבדוק את כל המיקומים (0.1-0.9) לאיתור סימנים חריגים - נוכחותם מצביעה על כך שייתכן שהתא זקוק לשטיפה ו/או ניקוי. לאחר QC, המערכת תציג "מוכן למדידות".
- ראש את תא הזרימה עם PBS. פתח את הכרטיסייה משאבה/טמפ' ותחת משאבה, לחץ על הפעל למשאבה 2 (מאגר PBS). פעולה זו תפעיל PBS דרך התא למשך דקה אחת, ולאחר מכן תיפסק אוטומטית.
הערה: יתכנו חלקיקים בתא, אך ניתן לנקות אותם על ידי דחיפה של 10 מ"ל PBS דרך יציאת הטעינה. - מלאו מזרק של 10 מ"ל ב-PBS והעמיסו לתא ללא בועות אוויר.
- צור פרוטוקול להפעלת המכשיר שימדוד מיקומים מרובים של הלייזר ויממוצע את החלקיקים למסגרת.
- בדוק שספירת החלקיקים נמוכה מ-5 (קרוב ככל האפשר ל-0) לפני שתמשיך - שטוף עם PBS נוסף, במידת הצורך.
- לפני הדילול, מערבבים את דגימת ה-EV על ידי פיפטינג.
- מדללים את הדגימה 1:1,000 ב-PBS ומערבבים על ידי פיפטינג. מלאו מזרק של 1 מ"ל בדגימה וטענו לתא ללא בועות אוויר.
- בדוק שספירת החלקיקים נמצאת בטווח המקובל (הסרגל מעל ערך הספירה צריך להיות באזור הירוק, או קרוב אליו). אם לא, התאם את דילול הדגימה בהתאם. בין דגימות לדילול דגימה, טען 10 מ"ל PBS בקדמת המכונה כדי לנקות את החדר, ולאחר מכן טען 1 מ"ל מהדגימה המדוללת.
הערה: לכל דגימה יהיה דילול עצמאי על סמך ריכוז הדגימה. ספירת החלקיקים של המכשיר צריכה להיות בין 50-200 חלקיקים למסגרת למדידות מדויקות. - עבור ללשונית מדידה בתוכנה.
- לחץ על כפתור הפעל רכישת וידאו .
- הזינו שם לדוגמה ובחרו תיקיית יעד לשמירת המדידה.
- צור נוהל הפעלה סטנדרטי של EV (SOP).
- צור > שמור > טען EV SOP שימדוד את מספר החלקיקים וגודלם במהירות תריס של 100 ורגישות מצלמה של 80, 11 מיקומי מצלמה למשך 2 מחזורים.
הערה: אלא אם כן לדוגמא יש דרישות מיוחדות, אין צורך לשנות הגדרות אלה. - הזן את הדילול של המדגם והוסף כל הערות אחרות שברצונך להוסיף.
- לחץ על אישור והתוכנה תתחיל להקליט אוטומטית. לאחר שתסיים, התוכנה תטען אוטומטית טבלה קופצת המציגה ספירת חלקיקים ממוצעת וגדלים עבור כל מיקום מצלמה.
הערה: אל תיגע במכונה או במשטחי השיש הסמוכים במהלך תקופה זו מכיוון שרעידות ישפיעו על הקריאות הסופיות. - מיקומי מצלמה עם קריאות חריגות מבחינה סטטיסטית לא ייכללו באופן אוטומטי - כדי לא לכלול באופן ידני את מיקומי המצלמה (או לכלול מחדש מיקומי מצלמה שאינם נכללים מכל סיבה שהיא), לחץ על תיבת הסימון משמאל לפרטי הדוגמה.
- לחץ על המשך והתוכנה תיצור ותפתח קובץ PDF של המדגם עם תוצאות הגודל והריכוז.
- צור > שמור > טען EV SOP שימדוד את מספר החלקיקים וגודלם במהירות תריס של 100 ורגישות מצלמה של 80, 11 מיקומי מצלמה למשך 2 מחזורים.
- ניתוח סטטיסטי
- נתח את נתוני NTA על ידי ANOVA חד כיווני או דו כיווני עם תיקון Tukey פוסט הוק. התוויית נתונים כקבוצה פירושה ± סטיית תקן. ערך P של <0.05 נחשב למשמעותי.
תוצאות
קבענו את כמות ה-EVs שבודדו מאדיפוציטים גלוטאליים אנושיים בהתאם לפרוטוקול המתואר. חישבנו את הגודל והריכוז של EVs שמקורם באדיפוציטים באמצעות NTA (איור 1A,B). השתמשנו בבקרות דמה-מדיה, שהיו נפחים שווים של מדיה שלא הייתה במגע עם תאים, אך תרבית וכפוף להליך הבידוד שתואר לעיל. מדדנו את ריכוז ה-EV שמקורו באדיפוציטים לאחר הבידוד הראשוני ולאחר שטיפת ה-EVs האדיפוציטים המבודדים ב-PBS (איור 1A,B) ושרטטנו את ממוצע הקבוצה ± סטיית תקן (SD), אשר נותח על ידי ANOVA דו-כיווני עם תיקון Tukey פוסט-הוק.
ריכוז ה-EVs שמקורם באדיפוציטים שנקבע על ידי NTAמהבידוד הראשון נע בין 6.10 x 106 ל-2.70 x 107 עם חציון של 2.60 x 107 EVs/mL (איור 1 A,B). לאחר שטיפת PBS, היו פחות EVs שמקורם באדיפוציטים לדגימה (איור 1A,B) (P < 0.001), שנעו בין 5.00 x 105 ל-4.30 x 106 עם חציון של 2.70 x 106 EVs/mL. בקרות המדיה המדומות לא הכילו רכבים חשמליים כפי שנקבע על ידי NTA (איור 1A,B). הגודל המודאלי של רכבים חשמליים מהבידוד הראשון היה 125 ננומטר ו-105 ננומטר לאחר שטיפת PBS (איור 1A,B). הפרוטוקול המתואר יושם עוד יותר על אדיפוציטים שמקורם בבטן ובגלוטאל, מצלוחיות T175 ס"מ2 גדולות יותר. דגימות EV גלוטאליות אלה שמקורן בצלוחיות T175 ס"מ2 נעו בריכוז בין 3.60 x 107 ל-7.50 x 107/mL עם חציון של 5.40 x 107 EVs/mL. EVs שמקורם באדיפוציטים בבטן מצלוחיות T175 ס"מ2 נעו בריכוז בין 6.30 x 107 ל-8.60 x 107/mL עם חציון של 7.60 x 107 EVs/mL (איור 1C,D). הגודל המודאלי של EVs שנגזר מבקבוקי T175 ס"מ2 היה 115 ננומטר עבור EVs גלוטאליים ו-125 ננומטר EVs בטניים. אישרנו את נוכחותו של חלבון EV ב-EVs שמקורם בגלוטאלי ובבטן על ידי אימונובלוטינג לגן רגישות לגידול 101 (TSG101) ומצאנו כי כדורי תאי אדיפוציטים בטניים וגלוטאליים ו-EVs שמקורם באדיפוציטים בטניים וגלוטאליים היו חיוביים ל-TSG101, בעוד שאמצעי בקרת דמה, שלא היה במגע עם תאים היה שלילי (איור 1E).
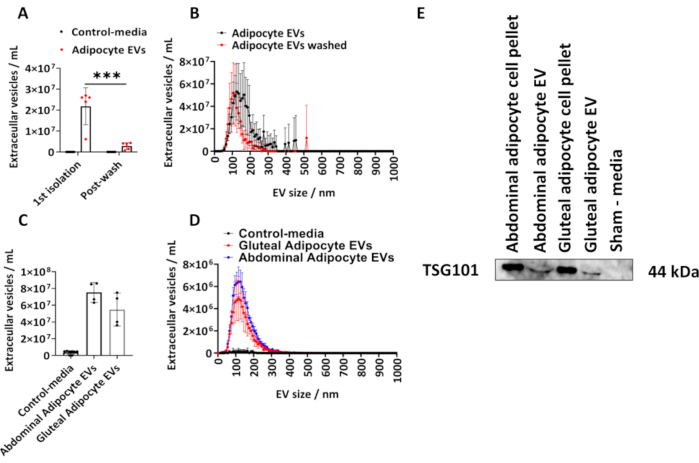
איור 1: גודל ופרופיל התפלגות של EVs שמקורם באדיפוציטים ממצע תרבית תאים וקביעת חלבון EV TSG101. סך ריכוזי EV ופרופילי התפלגות גודל וריכוז כפי שנקבעו על ידי ניתוח מעקב אחר ננו-חלקיקים (NTA)מהבידוד הראשון (N = 5) ולאחר שטיפה עם PBS (N = 6). (C) סך הריכוזים ו-(D) פרופילי התפלגות הגודל והריכוז שנקבעו על ידי NTA עבור EVs שמקורם בבטן ובגלוטאלי מבקבוקי T175 ס"מ2 (N = 4 לקבוצה). (E) כתם מערבי של EVs שמקורם בגלוטאלי ובבטן עבור TSG101. כדורי תאים ומדיה דמה שימשו כבקרות חיוביות ושליליות, בהתאמה. הנתונים הם אמצעים קבוצתיים ± סטיית תקן (SD). ANOVA חד כיווני או דו כיווני עם תיקון Tukey פוסט-הוק. P < 0.001. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
Discussion
אנו מדגימים פרוטוקול לבידוד EVs שמקורם בגלוטאלי ובבטן מסופרנטנטים של תרבית תאים וקובעים את גודלם וריכוזם על ידי NTA 7,14,15. אנו מראים כי אדיפוציטים אנושיים מתורבתים מייצרים ומשחררים EVs לתוך אמצעי תרבית התאים, אותם ניתן לבודד לאחר מכן באמצעות סינון ואולטרה-צנטריפוגה. קבענו את הגודל ופרופיל הריכוז של EVs מבודדים שמקורם באדיפוציטים והראינו כי אולטרה-צנטריפוגה ככל הנראה בודדה מזהמים ממצע תרבית התאים וכי שטיפת כדורי ה-EV המבודדים ב-PBS מורידה משמעותית את ריכוזם במדידת NTA שנייה. קבענו עוד את הטוהר של EVs מבודדים שמקורם בגלוטאלי ובבטן על ידי כתמים מערביים עבור TSG101, סמן EV. תכשירי EV שמקורם בגלוטאלי ובבטן היו חיוביים ל-TSG101, אך חשוב מכך, זה נעדר באמצעי ביקורת שלא נחשפו לתאים. הניסויים שהוצגו השתמשו בתאי אדיפוציטים אנושיים כתאי האב המייצרים EVs, אך השיטה המתוארת מתאימה לסוגי תאים אחרים, כולל תאי אנדותל, שריר חלק בכלי הדם, שרירי השלד, תאי חיסון, ולבידוד EVs מפלזמה או סרום גרועים של טסיות הדם של המטופל.
EVs שמקורם באדיפוציטים מוגברים במחלות מטבוליות וקביעת שינויים בגודל ובמספר EVs של אדיפוציטים in vivo היא מורכבת מכיוון שנוזלים ביולוגיים כמו דם מכילים EVs ממספר מקורות תאים המעורבים גם בפתוגנזה של מחלות מטבוליות, כולל EVs מתאי אנדותל, שרירי שלד, אריתרוציטים ותאי חיסון. השיטה המתוארת כאן מאפשרת קביעת EVs של אדיפוציטים אנושיים, מה שעשוי לספק מודל שימושי למחקרים מכניסטיים החוקרים את הגורמים המובילים לביוגנזה של EV באדיפוציטים, שאינו ידוע כיום. חשוב לציין, קביעת ביוגנזה של adipocyte EV וכיצד העמסה של RNAs, חלבונים ומטבוליטים מסוימים מתוזמרת ב-EVs של adipocyte עשויה לחשוף הזדמנויות טיפוליות חדשות להפריע לאיתות EV פתוגני של adipocyte בתפקוד מטבולי. מחקרים מפורטים יספקו הבנה טובה יותר של האופן שבו גודל EV, מספר, מסלול ביוגנזה ומטען EV (RNA, חלבונים ומטבוליטים) משתנים בתגובה למחלות או גירויים כגון הפרעות בחמצן, גלוקוז, שומנים ואינסולין. מידע על תפקידם של גורמים סביבתיים באיתות EV של שומן במחלות מטבוליות וכיצד EVs שמקורם באדיפוציטים תורמים לדלקת ברקמת השומן עשוי לחשוף מטרות טיפוליות חדשות במחלות מטבוליות.
מגבלות
ייצור במבחנה של רכבים חשמליים שמקורם באדיפוציטים
השימוש בפרה-אדיפוציטים אנושיים במבחנה מספק מערכת מודל לחקר השחרור והיצירה של EVs שמקורם באדיפוציטים בעקבות התמיינות אדיפוציטים במבחנה, אך ישנן מספר מגבלות. בפרט, EVs שמקורם במבחנה עשויים להיות שונים מ-EVs שמקורם בשומן שמקורם בנוזלים ביולוגיים, כגון פלזמה14 בגודלם, ריכוזם, חלבון EV, -RNA, -מטבוליטים ותפקודם. הבדלים אלה ב-EV יכולים להיות מושפעים מתאים אחרים שאינם אדיפוציטים השוכנים ברקמת השומן in vivo, כגון תאי גזע שמקורם ברקמת שומן, תאי אנדותל ומקרופאגים, הקשורים קשר הדוק לפיזיולוגיה של רקמת השומן והראו תפקידים בפתולוגיה של רקמת השומן, כולל דלקת ברקמת השומן.
יש לציין כי פרוטוקול ההתמיינות של שבועיים במבחנה המתואר כאן עשוי שלא להספיק כדי לייצר אדיפוציטים בוגרים לחלוטין השווים לאלה הנראים in vivo; אדיפוציטים מובחנים במבחנה הגדלים בפורמט דו-ממדי (2D) מציגים מורפולוגיה שונה לתאי in vivo ואינם מפתחים טיפות שומנים חד-עיניות. יתר על כן, הפרה-אדיפוציטים המתוארים בפרוטוקול זה מתקבלים מהמקטע הסטרומלי-וסקולרי של השומן ולא הערכנו את התרומה למאגר EV מסוגי תאים אחרים שלא חוסלו לחלוטין במהלך בידוד התאים.
אובדן אינטראקציות חשובות בין תאים של אדיפוציטים עם אחרים שאינם אדיפוציטים ברקמת השומן עשוי להשפיע על ייצור EV, שחרור, חלבון EV ו-EV-RNA של אדיפוציטים ותאי גזע שמקורם ברקמת שומן16. עם זאת, הערכה של ההבדל בין EVs אדיפוציטים שמקורם במבחנה מאלה המיוצרים in vivo לא נעשתה באופן ממצה.
ביופסיות רקמה ראשוניות מכילות דם ולכן תרביות התאים הנגזרות עשויות להכיל אריתרוציטים ו-EVs שמקורם באריתרוציטים ללא קשר לשטיפות המרובות ושינויי המדיה המודגשים בפרוטוקול שלנו. ייתכן שיהיה צורך בשלב נוסף של ליזיס תאי דם אדומים לאחר בידוד המקטע הסטרומלי-וסקולרי כדי לבטל את ההשפעות של אריתרוציטים על אדיפוציטים. זה חשוב מכיוון ש-EVs שמקורם באריתרוציטים יכולים להשפיע על התפקוד התאי של תאים אחרים17 ו-EVs שמקורם באריתרוציטים מוגברים בנוכחות מתח חמצוני18 ובחולים עם תסמונת מטבולית 19,20. לכן, רקמת שומן שמקורה בחולי מחלות מטבוליות עשויה להכיל רמות גבוהות של EVs שמקורם באריתרוציטים, מה שעשוי להשפיע על הפנוטיפ במבחנה של אדיפוציטים.
חיסול FBS
הפרוטוקול המתואר השתמש ב-FBS במצע הגידול במהלך התמיינות אדיפוגנית, אך לאחר מכן האדיפוציטים היו נתונים לשינויים מרובים במדיה לפני איסוף המדיה הסופי לבידוד EVs שמקורם באדיפוציטים. לכן, הנחנו שהסיכון הכולל לזיהום של רכבים חשמליים שמקורם ב-FBS בתכשירים לרכבים חשמליים הוא נמוך ולאחר מכן אישרנו כי שאריות EVs לא היו קיימות במצע תרבית התאים על ידי Western Blotting עבור TSG101. הבידוד של EVs בתרבית תאים ממקורות תאים הדורשים FBS חייב להשתמש ב-FBS מדולל EV או לדלל EVs בקר באמצעות אולטרה-צנטריפוגה כדי למנוע EVs מבקר לבלבל את ריכוזי ה-EV של אדיפוציטים וניתוח מטען EV של אדיפוציטים. ידוע כי דלדול הסרום מאדיפוציטים משנה את התגובות התאיות שלהם21 ולכן החקירה חייבת להבטיח שדלדול הסרום או דלדול EV מהסרום הופך את תרביות השומן שלהם למייצגות באמת את הביולוגיה של השומן.
מגבלה טכנית של בידוד EV באמצעות סינון ואולטרה-צנטריפוגה
אנו מתארים שיטה של אולטרה-צנטריפוגה עם צינורות פלסטיק חד פעמיים הדורשים איטום לפני אולטרה-צנטריפוגה לבידוד EV. אנו מכירים בכך שצינורות אטומים חד פעמיים אלה עשויים שלא להיות אופציה חסכונית עבור אנשים רבים ומציעים לחקור צינורות דומים, שאינם דורשים איטום וניתנים לשימוש חוזר. עם זאת, על החוקרים לוודא ששטיפת צינורות רב פעמיים היא מספקת ואינה מובילה להצטברות מתקדמת של מזהמי חלבון, שומנים ו-RNA לאורך זמן, מה שעלול להשפיע על חקירות במורד הזרם של מטען הקשור ל-EV או להשפיע על מחקרי תפקוד תאים.
פרוטוקול הסינון והאולטרה-צנטריפוגה המתואר כאן נמצא בשימוש במשך שנים רבות ומחקרים רבים הדגישו את הנפילות הקצרות של שיטה זו, כולל בידודים לא ספציפיים של רכיבים תאיים מזהמים כגון מיטוכונדריה תאית, נוכחות של שברי גרעין ומרכיבים של קרום התא. יתר על כן, השיטה המתוארת כאן תבודד במשותף ליפופרוטאינים הקיימים ב-FBS מדולל EV. השיטה כאן עשויה להיות מפותחת עוד יותר על ידי שימוש באולטרה-צנטריפוגה בצפיפות וכרומטוגרפיה של אי הכללת גודל (SEC) כדי לחסל חלבונים מסיסים מזהמים וכמה ליפופרוטאינים . יחד עם שטיפת PBS של הרכבים החשמליים המבודדים וה-SEC, ניתן להגביל את המזהמים המבודדים במשותף אך לא לבטל לחלוטין. לכן, על המשתמשים להבטיח הכללה של בקרות מתאימות, כולל מדיה דמה שלא הייתה במגע עם תאים כדי להסביר חלבונים וליפופרוטאינים מסיסים במצע התרבית ובקרת סופרנטנט מדולדל EV כדי להדגים את הבידוד המוצלח של EVs ממדיה מותנית שעדיין מכילה חלבונים מסיסים וליפופרוטאינים.
הבידוד של רכבים חשמליים באמצעות סינון ואולטרה-צנטריפוגה מסתמך על המפעיל המבטיח שלא יופעל לחץ מופרז על תרבית התאים בזמן שהוא מועבר דרך קדח המסנן או הקדח של המחט/מזרק. הפעלת כוח מופרז בשלב זה של הפרוטוקול המתואר עלולה לקרוע EVs, להשפיע על ריכוזי ה-EVs הסופיים וליצור RNA חופשי, חלבונים ומטבוליטים, שהיו עטופים בעבר ב-EVs. תיארנו כאן שיטה, שאינה דורשת את קנה המזרק ולכן הפעלת כוח על הרכבים החשמליים במדיה מותנית כשהם עוברים דרך המסנן או המחט לתוך מאגרי האיסוף וצינורות האולטרה-צנטריפוגה שלהם. עם זאת, יש לנקוט משנה זהירות בעת השעיית גלולת ה-EV ב-PBS. יש להשתמש רק במערבולת קצרה, מכיוון שמערבולת נמרצת עלולה לשבש את ממברנות ה-EV.
לאחר אולטרה-צנטריפוגה, על המפעילים להיזהר עם צינורות האולטרה-צנטריפוגה כדי לא להפריע לגלולת ה-EV. ניתן להשיג זאת על ידי טיפול בצינורות בזהירות והעברתם לאט בין הרוטור האולטרה-צנטריפוגה למתלה הצינור. יש לנקוט משנה זהירות בעת ניקוב חור בחלק העליון של צינור האולטרה-צנטריפוגה כדי לשאוב את הסופרנטנטים המדוללים ב-EV. החדרת המחט לחלק העליון של הצינור ושאיבת הסופרנטנטים במהירות תיצור ואקום בקנה המזרק, שיכול לאלץ באלימות את הסופרנטנט בחזרה לתוך צינור האולטרה-צנטריפוגה ולשבש את גלולת ה-EV. לאחר חיתוך צינור האולטרה-צנטריפוגה כדי לשפוך את הסופרנטנט שנותר, יש לנקוט בזהירות מכיוון שגלולת ה-EV עלולה להשתחרר ומזיגה תשליך את גלולת ה-EV. לחלופין, ניתן להשתמש במזרק ובמחט כדי להסיר לאט את הסופרנטנט שנותר מבלי לשפוך או להפוך את הצינור.
סינון ואולטרה-צנטריפוגה של סופרנטנטים לבידוד רכבים חשמליים היא שיטה שימושית ויעילה. אך הוא עלול לבידוד משותף של ליפופרוטאינים וחלבונים מסיסים. ניתן להפחית אותם על ידי שטיפת הרכבים החשמליים עם PBS (כמתואר), אך זה לא יחסל את כל המזהמים. ניתן להוציא חלבונים מסיסים מחלק ה-EV על ידי שימוש ב-SEC עם זאת, שיטה זו אינה מבחינה בין ליפופרוטאינים ל-EVs. ניתן לשלב את ה-SEC המכילים רכבים חשמליים עם אולטרה-צנטריפוגה לרכבים חשמליים גלולים. סינון ואולטרה-צנטריפוגה דיפרנציאלית היא שיטה מועדפת לבידוד EV על פני טכניקות משקעים, המשתמשות בפוליאתילן גליקול מכיוון ששיטות משקעים אלו מבודדות כמויות גדולות של חלבונים מסיסים וליפופרוטאינים בסופרנטנטים של תרבית תאים ונוזלים ביולוגיים אחרים. אולטרה-צנטריפוגה צפויה להישאר הצורה הנגישה ביותר של בידוד EV עבור רבים מכיוון שרוב המעבדות מצוידות באולטרה-צנטריפוגה, ולכן מפחיתים את עלויות ההפעלה הראשוניות. אבל עבור רבים, אולטרה-צנטריפוגה לבידוד EV מונעת על ידי נפח צינורות האולטרה-צנטריפוגה ונפח ההתחלה של החומר. ייתכן שיהיה צורך בכמה מאות מיליליטר של סופרנטנטים תרבית כדי לייצר כמות EV מספקת עבור פרוטאומיקה במורד הזרם או ריצוף RNA. עם זאת, סביר להניח שטכניקות אולטרה-צנטריפוגה לבידוד EV ילוו בטכניקות אחרות כגון SEC ולכידת חיסון באמצעות טטרה-ספנינים CD9, CD63 ו-CD81 כדי לשפר את הטוהר של EVs מבודדים. טכניקות אחרות כגון פתרונות משקעים זמינים מסחרית וזרימה ציטומטרית עשויות להועיל בחקירות ספציפיות.
טוהר תכשירי EV
אישרנו את הבידוד של EVs שמקורם באדיפוציטים על ידי כתמים מערביים עבור TSG101, אך כתם מערבי יחיד זה אינו עומד בהנחיות שפורסמו על ידי האגודה הבינלאומית לשלפוחיות חוץ-תאיות (ISEV). אפיון נוסף של EVs אלה שמקורם באדיפוציטים יהיה אידיאלי באמצעות טטרה-ספנינים CD9, CD63 ו-CD81 כדי לזהות אקסוזומים וסמנים של זיהום תאי כגון היסטון H3, אלבומין ואפוליפופרוטאין A1.
הפרוטוקול המוצג כאן מאפשר בידוד של EVs מסופרנטנטים של תרביות תאים ממגוון מקורות תאים כולל אדיפוציטים לקביעת גודל EV, ריכוז, סמני EV על ידי כתם מערבי ותועלת בטכנולוגיות מבוססות אומיקס כגון פרוטאומיקה וריצוף RNA.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
נ.א. ו-R.C. מודים על תמיכתם של מענקי מחקר מקרן הלב הבריטית, המרכז למצוינות במחקר, אוקספורד (N.A. ו-R.C.; RE/13/1/30181 ו-RE/18/3/34214), מענק פרויקט קרן הלב הבריטית (NA ו-R.C.; PG/18/53/33895), קונסורציום אימונומטבוליזם משולש, קרן נובו נורדיסק (NNF15CC0018486), המכון הלאומי לחקר הבריאות (NIHR), מרכז המחקר הביו-רפואי של אוקספורד (BRC), Nuffield Benefaction for Medicine, וקרן התמיכה האסטרטגית המוסדית של וולקאם (ISSF). הדעות המובעות הן של המחבר/ים ולאו דווקא של ה-NHS, ה-NIHR או משרד הבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| 100 µm mesh | Sefar | 03-250/50 | |
| 15 mL Conical Tube | Sarstedt | 62.554.002 | |
| 250 µm mesh | Sefar | 03-100/44 | |
| 50 mL Conical Tube | Sarstedt | 62.547.004 | |
| Beckman Coulter, Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Bicinchoninic acid assay (BCA) | Thermo Scientific | 23225 | |
| Biotin | Sigma | B4639 | |
| BSA (essentially fatty acid free) | Sigma | A7030 | |
| Collagenase H | Sigma | 11074032001 | |
| Dexamethasone | Sigma | D2915 | |
| Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 | Sigma | D6421 | |
| Fetal bovine serum | Labtech | FCS-SA | |
| Fibroblast growth factor | Bio-Techne | 233-FB-025 | |
| Glutamine | ThermoFisher | 25030024 | |
| Hanks balanced salt solution | Sigma | H9394 | |
| Human insulin | ThermoFisher | 12585-014 | |
| Hypodermic needles, Microlance 16G | VWR | 613-3897 | |
| IBMX | Sigma | I7018 | |
| Nanoparticle Tracking Analysis, Zetaview | Particle Metrix | BASIC PMX-120 | |
| NEFA kit | Randox | FA115 | |
| Pantothenate | Sigma | P5710 | |
| Penicillin and Streptomycin | ThermoFisher | 15140122 | |
| Phosphate buffered saline | ThermoFisher Scientific | 10010056 | |
| PluriStrainer 200 µm | Cambridge Bioscience | 43-50200-03 | |
| Polyallomer Quick-Seal ultra-clear 16 mm × 76 mm tubes | Beckman Coulter | 342413 | |
| Single use syringes, 2-piece, Injekt Solo | VWR | 20-2520 | |
| Sodium linoleate | Sigma | L8134 | |
| Sodium oleate | Sigma | O7501 | |
| Sodium palmitate | Sigma | P9767 | |
| Soldering Iron | Zacro | 7.14954E+11 | |
| Syringe Filter 0.2 µm | Sarstedt | 83.1826.001 | |
| Syringe Filter 0.45 µm | ThermoFisher | 195-2545 | |
| T175 cm2 tissue culture flasks | Sarstedt | 83.3912.002 | |
| T25 cm2 tissue culture flasks | Sarstedt | 83.3910.002 | |
| T75 cm2 tissue culture flasks | Sarstedt | 83.3911.002 | |
| Transferrin | Sigma | T8158 | |
| Triiodo-L-thyronine | Sigma | T5516 | |
| Troglitazone | Sigma | T2573 | |
| TrypLE Express Enzyme | Fisher Scientific | 12604021 |
References
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Akbar, N., et al. Endothelium-derived extracellular vesicles promote splenic monocyte mobilization in myocardial infarction. JCI Insight. 2 (17), (2017).
- Xiao, Y., et al. Extracellular vesicles in type 2 diabetes mellitus: key roles in pathogenesis, complications, and therapy. Journal of Extracellular Vesicles. 8, 1625677(2019).
- Akbar, N., Azzimato, V., Choudhury, R. P., Aouadi, M. Extracellular vesicles in metabolic disease. Diabetologia. 62 (12), 2179-2187 (2019).
- Kobayashi, Y., et al. Circulating extracellular vesicles are associated with lipid and insulin metabolism. The American Journal of Physiology-Endocrinology and Metabolism. 315 (4), 574-582 (2018).
- Eguchi, A., et al. Circulating adipocyte-derived extracellular vesicles are novel markers of metabolic stress. Journal of Molecular Medicine. 94 (11), Berlin, Germany. 1241-1253 (2016).
- Crewe, C., et al. An Endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 175 (3), 695-708 (2018).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363 (6430), 989-993 (2019).
- Deng, Z. B., et al. Adipose tissue exosome-like vesicles mediate activation of macrophage-induced insulin resistance. Diabetes. 58 (11), 2498-2505 (2009).
- Kranendonk, M. E., et al. Human adipocyte extracellular vesicles in reciprocal signaling between adipocytes and macrophages. Obesity. 22 (5), Silver Spring. 1296-1308 (2014).
- Song, M., et al. Adipocyte-derived exosomes carrying sonic hedgehog mediate M1 macrophage polarization-induced insulin resistance via Ptch and PI3K pathways. Cellular Physiology and Biochemistry. 48 (4), 1416-1432 (2018).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10 (3), 881-906 (2018).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments: JoVE. (95), e50974(2015).
- Connolly, K. D., et al. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 159 (9), 3259-3267 (2018).
- Camino, T., et al. Vesicles shed by pathological murine adipocytes spread pathology: characterization and functional role of insulin resistant/hypertrophied adiposomes. International Journal of Molecular Sciences. 21 (6), 2252(2020).
- Zhu, Y., et al. Extracellular vesicles derived from human adipose-derived stem cells promote the exogenous angiogenesis of fat grafts via the let-7/AGO1/VEGF signalling pathway. Scientific Reports. 10 (1), 5313(2020).
- Sadallah, S., Eken, C., Schifferli, J. A. Erythrocyte-derived ectosomes have immunosuppressive properties. Journal of Leukocyte Biology. 84 (5), 1316-1325 (2008).
- Sudnitsyna, J., et al. Microvesicle formation induced by oxidative stress in human erythrocytes. Antioxidants. 9 (10), Basel. (2020).
- Helal, O., et al. Increased levels of microparticles originating from endothelial cells, platelets and erythrocytes in subjects with metabolic syndrome: relationship with oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases. 21 (9), 665-671 (2011).
- Agouni, A., et al. Endothelial dysfunction caused by circulating microparticles from patients with metabolic syndrome. The American Journal of Pathology. 173 (4), 1210-1219 (2008).
- Park, J., Park, J., Nahm, S. -S., Choi, I., Kim, J. Identification of anti-adipogenic proteins in adult bovine serum suppressing 3T3-L1 preadipocyte differentiation. BMB Reports. 46 (12), 582-587 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved