Method Article
İnsan Adiposit Kaynaklı Hücre Dışı Veziküllerin Filtrasyon ve Ultrasantrifüj Kullanılarak İzolasyonu ve Karakterizasyonu
Bu Makalede
Özet
İnsan adiposit kaynaklı hücre dışı veziküllerin (EV'ler) gluteal ve abdominal yağ dokusundan filtrasyon ve ultrasantrifüj kullanılarak izolasyonunu tarif ediyoruz. İzole edilen adiposit türevli EV'leri, Nanopartikül İzleme Analizi ile boyutlarını ve konsantrasyonlarını belirleyerek ve EV-protein tümör duyarlılık geni 101 (TSG101) varlığı için western blotlama ile karakterize ediyoruz.
Özet
Hücre dışı veziküller (EV'ler), proteinler, RNA, metabolitler ve lipitler gibi biyolojik olarak aktif materyalleri taşıyan lipid kapalı zarflardır. EV'ler, diğer hücrelerin hücresel durumunu lokal olarak doku mikro ortamlarında veya periferik kana serbest bırakma yoluyla modüle edebilir. Adiposit kaynaklı EV'ler periferik kanda yükselir ve obezite ve diyabet dahil olmak üzere metabolik bozukluklar sırasında kargolarında (RNA ve protein) değişiklikler gösterir. Adiposit türevli EV'ler, yağ dokusu iltihabını teşvik etmek için endotel hücreleri ve yağ dokusunda yerleşik makrofajlar gibi komşu vasküler hücrelerin hücresel durumunu düzenleyebilir. Adiposit kaynaklı EV'lerdeki değişikliklerin in vivo olarak araştırılması karmaşıktır, çünkü periferik kandan türetilen EV'ler oldukça heterojendir ve trombositler, endotel hücreleri, eritrositler ve kas gibi diğer kaynaklardan EV'ler içerir. Bu nedenle, insan adipositlerinin kültürü, adiposit türevi EV'lerin incelenmesi için bir model sistem sağlar. Burada, filtrasyon ve ultrasantrifüjleme kullanılarak insan gluteal ve abdominal adipositlerinin hücre kültürü ortamından toplam küçük EV'lerin ekstraksiyonu için ayrıntılı bir protokol sunuyoruz. Ayrıca, EV boyutunun ve konsantrasyonunun nicelleştirilmesi için Nanopartikül İzleme Analizinin (NTA) kullanımını ve gluteal ve abdominal adiposit türevli EV'lerde EV-protein tümör duyarlılık geni 101'in (TSG101) varlığını gösteriyoruz. Bu protokolden izole edilmiş EV'ler, transmisyon elektron mikroskobu, proteomikler, metabolomikler, küçük RNA dizilimi, mikrodiziler dahil olmak üzere aşağı akış analizi için kullanılabilir ve fonksiyonel in vitro/in vivo çalışmalarda kullanılabilir.
Giriş
Hücre dışı veziküller (EV'ler), proteinler, mikroRNA'lar, metabolitler ve lipitler gibi biyolojik olarak aktif materyalleri taşıyan lipid kapalı zarflardır. EV'ler terimi, eksozomları, mikro-parçacıkları (mikropartiküller/ektozomlar) ve apoptotik cisimleri içeren çeşitli alt popülasyonları ifade eder1. EV'ler, patolojik sinyallemede rol oynadıkları ve kan ve idrar dahil olmak üzere biyosıvılara salındıkları için biyobelirteç görevi görebilirler. EV'ler, doku mikro ortamlarında lokal olarak veya periferik kana serbest bırakma yoluyla diğer hücrelerin hücresel durumunu modüle edebilir2. EV'ler ana hücrelerinin özelliklerini taşır, ancak her bir alt popülasyonun farklılaşması esas olarak EV boyutuna ve tetraspaninlerin varlığı (CD9, CD63 ve CD81), tümör duyarlılık geni 101 (TSG101) ve ALG-2 ile etkileşime giren protein X (ALIX) dahil olmak üzere EV belirteçleri gibi protein içeriğine dayanır. Bu protein belirteçleri, multi-veziküler cisimler içinde üretilen veya mikro-parçacıklar için doğrudan plazma zarından tomurcuklanma veya kanama ile ilişkili proteinleri temsil eden eksozomlar için endozomal kökeni (CD9, CD63 ve CD81) temsil eder. Bununla birlikte, bu alt popülasyonlar arasında önemli bir örtüşme vardır ve plazma, serum veya idrar gibi karmaşık biyosıvılardaki tek tek alt popülasyonları ayırt etmek zordur.
Obezite, insülin direnci ve hücre dışı glikoz, oksijen ve iltihaplanmadaki bozulmalar dahil olmak üzere metabolik bozukluklar, EV'lerin ve kargolarının boyutunu ve konsantrasyonunu değiştirebilir. Adiposit türevi EV'ler Perilipin A, adiponektin taşır ve obezite ve diyabet sırasında protein ve RNA yüklerinde değişiklikler gösterir 3,4,5,6. Adiposit türevli EV'ler, yağ dokusu iltihabını ve insülin direncini teşvik etmek için komşu vasküler endotel hücrelerinin7 ve yağ dokusunda yerleşik makrofajların hücresel durumunu düzenler 8,9,10,11. Adiposit kaynaklı EV'lerdeki değişikliklerin in vivo olarak araştırılması karmaşıktır çünkü plazma, serum veya idrar gibi karmaşık biyosıvılardan türetilen EV popülasyonları, metabolik disfonksiyon ve hastalığın patogenezinde rol oynayan trombositler, endotel hücreleri, eritrositler ve kas gibi birçok kaynaktan EV'ler içerir.
Bu nedenle, insan preadipositlerinin kültürü ve in vitro farklılaşması, adiposit türevi EV'lerin incelenmesi için bir model sistem sağlar. Burada, şırınga filtrasyonu ve ultrasantrifüjleme kullanılarak insan adipositlerinin hücre kültürü ortamından toplam küçük EV'lerin ekstraksiyonu için ayrıntılı bir protokol sunuyoruz. Ultrasantrifüjleme, EV'ler için popüler bir izolasyon yöntemi olmaya devam etmektedir, çünkü kolayca erişilebilir ve çok az önceden uzmanlık bilgisi gerektirir. Bununla birlikte, çökeltme, boyut dışlama kromatografisi ve tetraspaninler kullanılarak immünoaffinite yakalama gibi diğer yöntemler, plazma, serum, idrar ve şartlandırılmış hücre kültürü ortamı dahil olmak üzere bir dizi biyosıvıdan EV izolasyonunu mümkün kılar. Burada açıklanan ultrasantrifüj protokolü de dahil olmak üzere her yöntem, değişen saflıkta EV preparatları üretir, çünkü yöntemler, EV'ler olarak maskelenebilen çözünür proteinleri ve lipoproteinleri birlikte izole edebilir. Bu ultra santrifüjleme protokolünü yoğunluk santrifüjleme, boyut dışlama kromatografisi ve immünoaffinite yakalama gibi diğer yöntemlerle birleştirmek, izole edilmiş EV'lerin saflığını önemli ölçüde artırır. Ancak ultrasantrifüjlemeye benzer şekilde, bu diğer yöntemler kan, plazma ve idrar gibi karmaşık örneklerden EV'lerin bağımsız alt popülasyonlarının yakalanmasına izin vermez. Bu nedenle, seçilmiş hücre popülasyonlarının kültürleri, hücreye özgü EV'lerin yüksek verimlerini üretmek için en sağlam yöntemlerden biri olmaya devam etmektedir. Her EV yönteminin bir takım uyarıları vardır ve yöntem seçimi, izole edilen EV türlerini ve konsantrasyonlarını etkileyebilir, bu da hücresel ve doku sinyalizasyonuna ve teşhis çalışmaları için EV yükünün belirlenmesine ilişkin aşağı yönlü mekanik araştırmaları önyargılı hale getirebilir; EV izolasyonunun bu metodolojik konuları başka bir yerde veaşağıdaki sınırlamalar bölümlerinde tartışılmaktadır 4,12. Burada, filtrasyon ve ultrasantrifüjleme kullanılarak insan adiposit türevli EV'lerin izolasyonunu açıklıyoruz. Ayrıca, EV boyutunun ve konsantrasyonunun nicelleştirilmesi için Nanopartikül İzleme Analizinin (NTA) kullanımını ve insan adiposit türevli EV'lerimizde EV-protein tümör duyarlılık geni 101'in (TSG101) varlığını gösteriyoruz. Bu protokolden izole edilmiş EV'ler, transmisyon elektron mikroskobu, proteomikler, metabolomikler, küçük RNA dizilimi, mikrodizi dahil olmak üzere aşağı akış analizi için kullanılabilir ve fonksiyonel in vitro/in vivo çalışmalarda kullanılabilir.
Protokol
Tüm yöntemler Oxford Üniversitesi'ndeki kurumsal etik inceleme kurulu tarafından onaylanmıştır. Sağlıklı gönüllülerden lokal anestezi altında iğne biyopsisi ile yağ dokusu elde edildi.
1. Hücre kültürü ortamının ve tamponlarının hazırlanması
- Kollajenaz H'yi (1 mg / mL) Hanks Dengeli Tuz Çözeltisi (HBSS) (kalsiyum klorür ve magnezyum klorür olmadan) ve steril filtre içinde 0.2 μm gözenekli şırınga filtresi kullanarak çözerek bir kollajenaz sindirim tamponu hazırlayın.
- Kollajenaz sindirim tamponunu kullanmadan en fazla 10 dakika önce hazırlayın.
- Büyüme ortamını (GM) aşağıdaki gibi hazırlayın: %10 fetal sığır serumu (FBS), 100 ünite/mL penisilin, 100 μg/mL streptomisin, 2 mM L-glutamin ve 0.5 ng/mL fibroblast büyüme faktörü (FGF) ile desteklenmiş Dulbecco'nun Modifiye Eagle's Medium/Ham besin karışımı F12 (DMEM/F12).
- Temel farklılaşma ortamını (temel DM) aşağıdaki gibi hazırlayın: 100 ünite/mL penisilin, 100 μg/mL streptomisin, 2 mM L-glutamin, 17 μM pantotenat, 100 nM insan insülini, 10 nM triiyodo-L-tiron, 33 μM biotin, 10 μg/mL transferrin ve 1 μM deksametazon ile desteklenmiş DMEM/F12.
- Adım 1.3'teki temel DM'yi 0.25 mM 3-izobütil-1-metilksantin ve 4 μM troglitalaz ile takviye ederek tam farklılaşma ortamı (tam DM) hazırlayın.
- % 10 esas olarak yağ asidi içermeyen sığır serum albümini (BSA) ile kompleksleştirilmiş 10 mM yağ asidi stok çözeltilerini aşağıdaki gibi hazırlayın.
- 16 g BSA'yı 160 mL DMEM/F12 ortamında çözün ve 37 °C'ye ısıtın. Üç ayrı 50 mL konik tüpte 150 mg sodyum oleat, 139 mg sodyum palmitat ve 151 mg sodyum linoleat tartın. Her tüpe 50 mL ısıtılmış BSA çözeltisi ekleyin ve tekrarlanan girdaplama ile iyice karıştırın.
- Oleat ve linoleat tüplerini 15 dakika boyunca 37 ° C su banyosuna geri koyun. Tamamen eriyene kadar girdap yaparak karıştırın.
- Palmitat çözeltisi için tüpü 2-3 dakika boyunca 65 ° C'lik bir su banyosuna yerleştirin. Girdap yaparak kuvvetlice karıştırın.
- Tamamen eriyene kadar (yaklaşık 30 dakika) adım 1.5.3'ü tekrarlayın.
NOT: Bazı küçük parçacıklar hala görünür olabilir. - Steril filtre: 0.2 μm gözenekli şırınga filtresi kullanarak yağ asidi çözeltilerini filtreleyin.
- Uygun bir tahlil kullanarak her bir stok çözeltisinin esterleştirilmemiş yağ asitleri konsantrasyonunu onaylayın.
NOT: Yağ asidi stokları, yağ asidi ile BSA arasında 6:1'lik bir molar oran vermek için 10 mM (%±10) olmalıdır. Konsantrasyon bu aralığın dışındaysa, stok çözeltisi yeniden yapılmalıdır. Stok çözeltileri aliquote edilebilir ve -30 ° C'de saklanabilir.
2. İnsan yağ dokusu biyopsilerinin sindirimi
- Biyopsi şırıngasının içeriğini, yağ dokusunun süzgeçte toplanması için 50 mL'lik konik bir tüpe bağlı 200 μm'lik steril bir hücre süzgecinden yavaşça süzün.
- Süzgeci 50 mL'lik yeni bir konik tüpe aktarın ve yağ dokusunu 10 mL HBSS ile üç kez yıkayın.
NOT: Fazla kırmızı kan hücrelerini çıkarmak için kan pıhtılarını ve fibröz dokuyu cerrahi makasla çıkarmak veya HBSS yıkamasını tekrarlamak gerekebilir. - Yıkanmış dokuyu tartın.
NOT: Tipik olarak iğne biyopsisi ile 400-800 mg doku elde ediyoruz. - Kollajenaz sindirim tamponunu steril 50 mL'lik konik bir tüpe koyun ve yıkanmış dokuyu ekleyin. Dokuyu eşit büyüklükte parçalara ayırmak için bu aşamada cerrahi makas kullanılabilir.
NOT: 0,5 g doku başına 5 mL tampon kullanın. Daha büyük dokular için, örnekler bir Petri kabında kıyılabilir. - Tüpü 37 ° C'lik çalkalanan su banyosuna yerleştirin ve 35-40 dakika inkübe edin.
NOT: Başarılı bir sindirimden sonra, çözelti sütlü görünmelidir. Küçük doku parçaları hala görünüyorsa, 10-20 saniye daha elinizle sallayın.
3. Preadipositlerin izolasyonu
- Preadiposit fraksiyon santrifüjünü 5 dakika boyunca 1.000 x g'da peletlemek için.
- Yüzen adiposit tabakasını ve süpernatanı aspire edin ve atın, hücre peletini kaplayan yaklaşık 1 mL HBSS bırakın.
- Peleti 5 mL HBSS'de yeniden süspanse edin ve hücre süspansiyonunu 250 μm gözenek boyutunda bir ağdan ve ardından sindirilmemiş materyali çıkarmak için 100 μm'lik bir ağdan geçirin. Hücre süspansiyonunu 15 mL'lik konik bir tüpte toplayın.
- 5 dakika boyunca 1.000 x g'da santrifüjleyin.
NOT: Bu adımdan sonra, kırmızı kan hücresi kontaminasyonu bir sorunsa, preadiposit fraksiyonu bir kırmızı kan hücresi lizis çözeltisi ile tedavi edilebilir. - Süpernatanı aspire edin ve atın.
- Hücre peletini 5 mL GM (adım 1.2) içinde yeniden süspanse edin ve 25cm2'lik bir yapışkan doku kültürü şişesine tohumlayın. Şişeyi bir hücre kültürü inkübatörüne yerleştirin (% 5 CO2, 37 ° C).
4. Preadiposit kültürlerinin bakımı
- Hücreler çoğalırken GM'yi her 2 günde bir değiştirin
NOT: Hücre çoğalma oranları donörler arasında farklılık gösterebilir.- Hücreler yaklaşık% 80 birleşime ulaştığında, bunları 75cm2'lik bir yapışkan doku kültürü şişesine aktarın. GM'yi çıkarın ve hücreleri fosfat tamponlu salin (PBS) ile yıkayın.
- PBS'yi atın ve bağlı hücreleri ayırmak için 0.5 mL yüksek oranda saflaştırılmış hücre ayrışma enzimleri ekleyin. 37 °C'de 5 dakika inkübe edin.
- Hücreleri serbest bırakmak için şişeye keskin bir şekilde vurun ve 5 mL GM ekleyin. Hücre süspansiyonunu 15 mL'lik konik bir tüpte toplayın.
- 5 dakika boyunca 1.000 x g'da santrifüjleyin.
- Süpernatanı aspire edin ve atın. Hücre peletini 5 mL GM içinde yeniden süspanse edin ve 75cm2'lik bir şişeye aktarın. GM'yi 12 mL'lik bir son hacme kadar doldurun ve şişeyi hücre kültürü inkübatöründe (% 5 CO2, 37 ° C) değiştirin.
NOT: Hücreleri korumak için GM'yi her 2-3 günde bir değiştirmeye devam edin. Hücreler %80 birleşime ulaştığında, 4.2-4.3 adımlarını tekrarlayın ve hücreleri 1:3 oranında yeni 75cm2 şişelere bölün. Bu, deney kurulumu için yeterli sayıda hücre üretilene kadar birkaç pasaj için tekrarlanabilir. Preadipositlerin proliferasyon ve farklılaşma kapasitesi azaldığı için 10'dan fazla pasaj önermiyoruz.
5. Adipojenik farklılaşma için preadipositlerin tohumlanması
- Hücreleri bir hemositometre kullanarak sayın ve 200.000 hücreyi 2 mL GM içinde 6 oyuklu bir plakanın birden fazla kuyusuna tohumlayın. Alternatif olarak, 22 mL GM ortamında 175 cm2 şişesi başına 3,5 milyon hücre tohumlayın.
- Hücrelerin tam birleşmeye ulaşana kadar 2-4 gün daha çoğalmasına izin verin ve kültürün ikinci gününde GM'yi değiştirin.
- Adipojenik farklılaşmaya başlamak için, GM'yi çıkarın ve 4 gün boyunca tam DM ile değiştirin (6 oyuklu bir plakanın oyuğu başına 2 mL tam DM veya 175cm'lik 2 şişe için 22 mL).
NOT: 2. günde yeni tam DM ile değiştirin. - 4. günde, tam DM'yi çıkarın ve 22.5 μM oleat, 15 μM palmitat ve 12.5 μM linoleat ile takviye edilmiş 2 mL bazik DM ile değiştirin, böylece 6 oyuklu bir plakanın oyuğu başına 50 μM veya 175cm'lik bir 2 şişe için 22 mL'lik bir toplam yağ asidi konsantrasyonu verin. 10 gün daha boyunca her 2 günde bir medya ile değiştirin.
NOT: 7. günden itibaren, farklılaşan preadipositlerde lipid damlacıkları görünür olmalıdır. - Kültür 14. günde, adiposit türevli EV'lerin izolasyonu için ortamı hücrelerden toplayın.
6. Hücre dışı vezikül izolasyonu veya depolanması ve gelecekteki hücre dışı vezikül izolasyonu için hücre kültürü süpernatantının hazırlanması
- Her 6 oyuklu plakadan hücre kültürü süpernatantlarını çıkarın ve birleştirin. 15 mL'lik bir tüpe ekleyin veya tüm hücre kültürü süpernatantlarını 175cm2'lik bir şişeden çıkarın ve 50 mL'lik bir tüpe ekleyin.
- 1000 ° C'de 10 dakika boyunca 4 x g'da santrifüjleyin.
- Süpernatanı sırasıyla 15 mL veya 50 mL'lik yeni bir temiz tüpe dökerek boşaltın.
- 10 mL'lik bir şırınganın namlusunu çıkarın ve 0,45 μm'lik bir şırınga filtresi takın.
- Süpernatanı şırınga haznesine dökün ve hücre kültürü süpernatanı filtreden serbestçe geçene kadar şırınga namlusu açıklığına bir başparmak veya avuç içi ile hafif bir basınç uygulayın.
NOT: Bu filtreleme adımının hızı, şırınga filtresinin tipine bağlı olarak değişebilir. - Süzüntüyü 50 mL'lik temiz bir tüpte toplayın.
NOT: Gerekirse, şartlandırılmış filtrelenmiş ortam bu noktada -80 °C'de birkaç hafta saklanabilir. Gerektiğinde, hücre kültürü süpernatantlarını 4 °C'de çözün ve 1000 x g'da 4 °C'de 10 dakika santrifüjleyin. EV izolasyonlarına devam etmeden önce süpernatanı dökerek temiz bir tüpe boşaltın.
7. Hücre dışı veziküllerin izolasyonu
- 13 mL'lik bir ultrasantrifüj tüpünü, tüpün dibinde beklenen EV peletinin oluşacağı bir daire çizerek etiketleyin ve ultrasantrifüj tüpü rotorunda yönlendirme için tüpün boynunun etrafında bir çizgi işaretleyin. Tüpü bir numune tanımlayıcısı ile etiketleyin.
- Tüpü tüp tutucusuna yerleştirin.
- 10 mL'lik bir şırıngaya 16 G'lik bir iğne takın ve şırınga namlusunu çıkarın.
- Koruyucu kapağı iğneden çıkarın ve iğneyi ultrasantrifüj tüpünün boynuna yerleştirin.
- Ultrasantrifüj tüpünü doldurmak için hücre kültürü süpernatantını doğrudan şırınga namlusuna dökün.
- Tüpü dolana kadar gerektiği kadar PBS ile doldurun.
NOT: Gerekirse tüpün hafifçe taşmasına izin verin, ultrasantrifüj tüpünde hava boşluğu olmadığından ve hava kabarcığı olmadığından emin olun. - Ultrasantrifüj tüpünü bir havya kullanarak kapatın ve tüpü hafifçe sıkarak tüpün hava geçirmez olduğundan emin olun.
- Ultrasantrifüj tüplerini ultrasantrifüj rotoruna yerleştirin; Tüpün üst kısmında işaretlenen çizginin ve tüpün tabanında çizilen dairenin, EV peletinin oluşacağı yere doğru baktığından emin olun.
- 4 ° C'de 2 saat boyunca 120.000 x g'da ultrasantrifüj.
- Rotoru ultrasantrifüjden dikkatlice çıkarın.
- Ultrasantrifüj tüplerini rotordan çıkarın ve tüp tutucusuna yerleştirin.
- 10 mL'lik bir şırıngaya 16 G'lik bir iğne takın.
- Ultrasantrifüj tüpünün üst kısmını delin ve iğneyi tüpün üst kısmına 2 cm sokun ve süpernatanı şırıngaya aspire edin.
- EV ile tükenmiş bu süpernatanı 1,5 mL'lik bir tüpe boşaltın ve -80 °C'de dondurun.
- İğneyi tüpe tekrar yerleştirin ve kalan süpernatanı dikkatlice aspire edin ve atın.
- Tüpün üst kısmını bir makasla kesin.
- Kalan süpernatanı tek bir hızlı hareketle dökün.
- Tüpün 1 dakika boyunca baş aşağı asılmasına izin verin.
- Tüp üzerinde oluşan sıvıyı kağıt havluyla kurulayın.
- Tüpü ters çevirin ve tüp tutucuya yerleştirin.
- Tüpe 100 μL PBS ekleyin.
- Bir pipetin ucunu kullanarak, adım 7.1'de işaretlenen alanda dairesel bir hareket kullanarak EV peletini tüpün tabanından nazikçe çıkarın.
- Kısa bir süre (1-2 saniye), iki kez girdap.
- Yeni bir 13 mL ultrasantrifüj tüpünü, beklenen EV peletinin oluşacağı tüpün altına bir daire çizerek etiketleyin ve ultrasantrifüj tüpü rotorunda yönlendirme için tüpün boynunun etrafında bir çizgi işaretleyin. Tüpü bir numune tanımlayıcısı ile etiketleyin.
- Tüpü tüp tutucusuna yerleştirin.
- Temiz bir şırınga ve iğne kullanarak yeni bir ultrasantrifüj tüpüne 12 mL PBS ekleyin.
- Bir şırınga ve iğne kullanarak 100 μL EV örneğini toplayın ve tüpe ekleyin. EV'leri ve PBS'yi dikkatlice karıştırın ve PBS'yi nazikçe toplayarak ve tüpe aspire ederek şırıngayı ve iğneyi durulayın.
NOT: Baloncuk oluşturmaktan kaçının. - Ultrasantrifüj tüpünü bir havya kullanarak kapatın ve tüpü hafifçe sıkarak tüpün hava geçirmez olduğundan emin olun.
- Ultrasantrifüj tüplerini ultrasantrifüj rotoruna yerleştirin; Tüpün üst kısmında işaretlenen çizginin ve tüpün tabanında çizilen dairenin dışa baktığından emin olun.
- 4 ° C'de 1 saat boyunca 120.000 x g'da ultrasantrifüj.
- Rotoru ultrasantrifüjden dikkatlice çıkarın.
- 12 mL'lik bir şırıngaya 16 G'lik bir iğne takın.
- Ultrasantrifüj tüpünün üst kısmını delin ve iğneyi tüpün üst kısmına 2 cm'ye kadar sokun; Süpernatanı şırıngaya aspire edin ve atın.
- Tüpün üst kısmını bir makasla kesin.
- Kalan süpernatanı tek bir hızlı hareketle dökün.
- Tüpün 1 dakika boyunca baş aşağı asılmasına izin verin.
- Tüpün kenarında oluşan sıvıyı hafifçe kurulayın.
- Tüpü tüp tutucusuna yerleştirin.
- Tüpe 100 μL PBS ekleyin.
- Bir pipetin ucunu kullanarak, adım 7.24'te işaretlenen alanda dairesel bir hareket kullanarak EV peletini tüpün tabanından nazikçe çıkarın.
- Kısa bir süre (1-2 saniye), iki kez girdap.
- 100 μL PBS/EV solüsyonunu 1,5 mL'lik temiz bir tüpe pipetleyin ve ıslak buz üzerinde tutun.
NOT: EV'ler sonraki işlemler için hazırdır ve dondurulabilir ve -80 °C'de saklanabilir.
8. Nanopartikül İzleme Analizi (NTA) kullanılarak EV boyutunun ve konsantrasyonunun belirlenmesi
- Sistemin hazırlanması
NOT: EV boyutunun ve konsantrasyonunun belirlenmesi için Nanopartikül İzleme Analizinin (NTA) kullanımı için ayrıntılı bir yöntem Mehdiani ve ark.13 tarafından rapor edilmiştir.- Numunelerin buzunu çözün ve 4 °C'de tutun.
- Yazılım simgesine tıklayarak NTA yazılımını başlatın.
- Yazılım "hücre kontrolünde" açılacak ve akış hücresini deiyonize su ile doldurmanızı isteyecektir. 10 mL'lik bir şırıngayı deiyonize su ile doldurun ve yükleme haznesine hava kabarcığı girmediğinden emin olarak makineye itin.
- Sistemi bir kalite kontrolünden (QC) geçirmek için ekrandaki talimatları izleyin. Yazılım bir hücre kontrolü yapacak ve hücre kalitesinin bir ölçüsünü verecektir. Bu çok iyi ila mükemmel olmalı.
- 100 nanometre polistiren boncuklardan oluşan kalite kontrolünü hazırlayın. Standardın 1 μL'sini 999 μL deiyonize suya (seyreltilmiş stok) pipetleyin. Daha sonra, 10 μL seyreltilmiş stoğu 2,5 mL deiyonize suya (QC numunesi) ekleyin. Çözeltiyi 2-3 saniye hafifçe girdaplayarak ve pipetleyerek karıştırın.
NOT: Kalite kontrol numuneleri her gün taze olarak hazırlanmalıdır, ancak ilk seyreltilmiş stok numunesi 4 °C'de 1 hafta boyunca stabildir. - 1 mL'lik bir şırıngayı 1 mL QC numunesi ile doldurun ve şırıngadaki tüm hava kabarcıklarını çıkarın.
- Şırınganın ucunu enjeksiyon odasına hafifçe eğerek ve aynı anda pistonu iterek hava kabarcıkları oluşturmadan NTA numune yükleme odasına enjekte edin. Hazneye 950 μL'ye kadar QC numunesi enjekte edin.
NOT: Numune yükleme haznesine hava kabarcıkları sokmayın. - Yazılım otomatik hizalama gerçekleştirirken (kamerayı odaklamak için) ve Z-potansiyeli okumaları için voltajı kontrol ederken bekleyin - voltaj grafiği düzgün U şeklinde bir eğri olmalıdır.
NOT: "voltaj çok düşük hatası" hata mesajı varsa, hücre temizlikten dolayı ıslanmış veya güvenli olmayabilir veya hava kabarcığı olabilir. - Otomatik hizalama/voltaj kontrolü tamamlandıktan sonra, olağandışı işaretler için tüm konumları (0.1-0.9) kontrol etmek için kamera konumu açılır menüsünü kullanın - bunların varlığı, hücrenin yıkanması ve/veya temizlenmesi gerekebileceğini gösterir. QC'yi takiben, sistem "ölçümler için hazır" mesajını gösterecektir.
- Akış hücresini PBS ile hazırlayın. Pompa/Sıcaklık sekmesini açın ve Pompa altında, pompa 2 (PBS rezervuarı) için Çalıştır'a tıklayın. Bu, PBS'yi hücrede 1 dakika boyunca çalıştıracak ve ardından otomatik olarak duracaktır.
NOT: Haznede parçacıklar olabilir, ancak bunlar yükleme portundan 10 mL PBS itilerek temizlenebilir. - 10 mL'lik bir şırıngayı PBS ile doldurun ve hava kabarcığı olmadan hazneye yükleyin.
- Cihazın çalışması için lazerin birden fazla konumunu ölçecek ve kare başına parçacıkların ortalamasını alacak bir protokol oluşturun.
- Devam etmeden önce partikül sayısının 5'ten az olduğunu (mümkün olduğunca 0'a yakın) kontrol edin - gerekirse daha fazla PBS ile yıkayın.
- Seyreltmeden önce EV numunesini pipetleme ile karıştırın.
- Numuneyi PBS'de 1:1.000 oranında seyreltin ve pipetleme ile karıştırın. 1 mL'lik bir şırıngayı numune ile doldurun ve hava kabarcığı olmadan hazneye yükleyin.
- Partikül sayısının kabul edilebilir aralıkta olup olmadığını kontrol edin (sayım değerinin üzerindeki çubuk yeşil bölgede veya ona yakın olmalıdır). Değilse, numune seyreltmesini buna göre ayarlayın. Numuneler ve numune seyreltmeleri arasında, hazneyi temizlemek için makinenin önüne 10 mL PBS yükleyin, ardından seyreltilmiş numuneden 1 mL yükleyin.
NOT: Her numune, numunenin konsantrasyonuna bağlı olarak bağımsız seyreltmeye sahip olacaktır. Doğru ölçümler için cihazın partikül sayısı çerçeve başına 50-200 partikül arasında olmalıdır. - Yazılımdaki Ölçüm sekmesine gidin.
- Video alımını çalıştır düğmesine tıklayın.
- Bir örnek adı girin ve ölçümü kaydetmek için bir hedef klasör seçin.
- Bir EV standart işletim prosedürü (SOP) oluşturun.
- Partikül sayısını ve boyutunu 100 enstantane hızında ve 80 kamera hassasiyetinde ölçecek bir EV SOP'u oluşturun > Kaydedin > 2 döngü için 11 kamera konumu yükleyin.
NOT: Numunenin özel gereksinimleri olmadıkça, bu ayarların değiştirilmesine gerek yoktur. - Numunenin seyreltilmesini girin ve eklemek istediğiniz diğer notları ekleyin.
- Tamam'a tıklayın, yazılım otomatik olarak kayda başlayacaktır. Tamamlandığında, yazılım otomatik olarak her kamera konumu için ortalama parçacık sayımlarını ve boyutlarını gösteren bir açılır tablo yükleyecektir.
NOT: Titreşimler son okumaları etkileyeceğinden, bu süre zarfında makineye veya yakındaki tezgahlara dokunmayın. - İstatistiksel olarak olağandışı okumalara sahip kamera konumları otomatik olarak hariç tutulacaktır - herhangi bir kamera konumunu manuel olarak hariç tutmak (veya herhangi bir nedenle hariç tutulanları yeniden dahil etmek) için örnek ayrıntılarının solundaki onay kutusunu tıklayın.
- Devam'a tıkladığınızda yazılım, boyut ve konsantrasyon sonuçlarını içeren numunenin bir PDF'sini oluşturacak ve açacaktır.
- Partikül sayısını ve boyutunu 100 enstantane hızında ve 80 kamera hassasiyetinde ölçecek bir EV SOP'u oluşturun > Kaydedin > 2 döngü için 11 kamera konumu yükleyin.
- İstatistiksel analiz
- NTA verilerini, post-hoc Tukey düzeltmesi ile tek yönlü veya iki yönlü ANOVA ile analiz edin. Verileri grup olarak çizin, standart sapma ± anlamına gelir. P değerinin <0.05 olması anlamlı kabul edildi.
Sonuçlar
Tarif edilen protokolü takiben insan gluteal adipositlerinden izole edilen EV'lerin miktarını belirledik. Adiposit türevi EV'lerin boyutunu ve konsantrasyonunu NTA kullanarak hesapladık (Şekil 1A,B). Hücrelerle temas etmemiş, ancak kültürlenmiş ve yukarıda açıklanan izolasyon prosedürüne tabi tutulmuş eşit hacimlerde ortam olan sahte ortam kontrollerini kullandık. İlk izolasyonu takiben ve izole edilen adiposit EV'leri PBS'de yıkadıktan sonra adiposit kaynaklı EV konsantrasyonunu ölçtük (Şekil 1A,B) ve grup ortalamaları ± standart sapma (SD) olarak çizildi, bu da post-hoc Tukey düzeltmesi ile iki yönlü ANOVA ile analiz edildi.
1. izolasyondan NTA ile belirlenen adiposit türevli EV'lerin konsantrasyonu 6.10 x 106 ila 2.70 x 107 arasında değişmekte olup, medyan 2.60 x 107 EVs/mL'dir (Şekil 1 A,B). Bir PBS yıkamasını takiben, numune başına önemli ölçüde daha az adiposit türevi EV vardı (Şekil 1A, B) (P < 0.001), bunlar 5.00 x 105 ila 4.30 x 106 arasında değişen ve medyan 2.70 x 106 EV / mL. Sahte medya kontrolleri, NTA tarafından belirlendiği gibi hiçbir EV içermiyordu (Şekil 1A,B). İlk izolasyondan itibaren EV'lerin modal boyutu, bir PBS yıkamasını takiben 125 nm ve 105 nm idi (Şekil 1A,B). Tarif edilen protokol ayrıca daha büyük T175 cm2 şişelerinden abdominal ve gluteal türevli adipositlere uygulandı. T175 cm2 şişeden türetilen bu gluteal EV örneklerinin konsantrasyonu 3.60 x 107 ila 7.50 x 107 / mL arasında ve medyan 5.40 x 107 EV / mL arasında değişmektedir. T175 cm2 flasklardan abdominal adiposit türevi EV'lerin konsantrasyonu 6.30 x 107 ila 8.60 x 107 / mL arasında ve medyan 7.60 x 107 EV / mL arasında değişmektedir (Şekil 1C, D). T175 cm2 şişelerinden türetilen EV'lerin modal boyutu, gluteal EV'ler için 115 nm ve abdominal EV'ler için 125 nm idi. Tümör duyarlılık geni 101 (TSG101) için immünoblotlama ile gluteal ve abdominal kaynaklı EV'lerde EV proteininin varlığını doğruladık ve abdominal ve gluteal adiposit hücre peletlerinin ve abdominal ve gluteal adiposit türevli EV'lerin TSG101 için pozitif olduğunu, hücrelerle temas halinde olmayan sahte kontrol ortamı olarak negatif olduğunu bulduk (Şekil 1E).
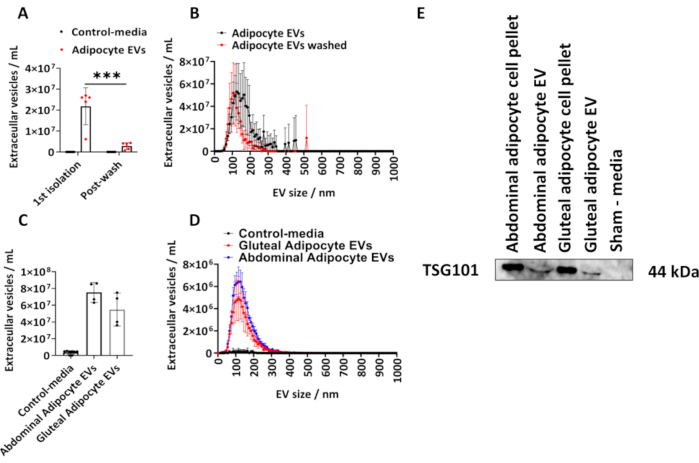
Şekil 1: Hücre kültürü ortamından adiposit türevi EV'lerin boyut ve dağılım profili ve EV-protein TSG101'in belirlenmesi. 1. izolasyondan (N = 5) ve PBS ile yıkamayı takiben (N = 6) Nanopartikül İzleme Analizi (NTA) ile belirlenen toplam EV konsantrasyonları ve boyut ve konsantrasyon dağılım profilleri. (C) T175cm2 şişelerinden (grup başına N = 4) abdominal ve gluteal türevli EV'ler için NTA tarafından belirlenen toplam konsantrasyonlar ve (D) boyut ve konsantrasyon dağılım profilleri. (E) TSG101 için gluteal ve abdominal türevli EV'lerin batı lekesi. Hücre peletleri ve sahte ortamlar sırasıyla pozitif ve negatif kontrol olarak kullanıldı. Veriler, standart sapma (SD) ± grup ortalamalarıdır. Post-hoc Tukey düzeltmesi ile tek yönlü veya iki yönlü ANOVA. P < 0.001. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Tartışmalar
Hücre kültürü süpernatantlarından gluteal ve abdominal adiposit türevi EV'lerin izolasyonu için bir protokol gösteriyoruz ve boyutlarını ve konsantrasyonlarını NTA 7,14,15 ile belirliyoruz. Kültürlenmiş insan adipositlerinin, daha sonra filtrasyon ve ultrasantrifüjleme kullanılarak izole edilebilen hücre kültürü ortamına EV'ler ürettiğini ve saldığını gösteriyoruz. İzole adiposit türevli EV'lerin boyutunu ve konsantrasyon profilini belirledik ve ultrasantrifüjlemenin muhtemelen hücre kültürü ortamından kirleticileri birlikte izole ettiğini ve izole edilmiş EV peletlerinin PBS'de yıkanmasının ikinci bir NTA ölçümünde konsantrasyonlarını önemli ölçüde azalttığını gösterdik. İzole edilmiş gluteal ve abdominal türevli EV'lerin saflığını, bir EV markörü olan TSG101 için western blotlama ile daha da belirledik. Gluteal ve abdominal kaynaklı EV preparatları TSG101 için pozitifti, ancak daha da önemlisi, hücrelere maruz kalmayan kontrol ortamlarında bu yoktu. Sunulan deneyler, EV'leri üreten ana hücre olarak insan adipositlerini kullandı, ancak açıklanan yöntem, endotel hücreleri, vasküler düz kas, iskelet kası, bağışıklık hücreleri dahil olmak üzere diğer hücre tipleri için ve EV'lerin hasta trombositinden fakir plazma veya serumdan izolasyonu için uygundur.
Adiposit kaynaklı EV'ler metabolik hastalıklarda yükselir ve adiposit EV'lerin boyut ve sayısındaki değişikliklerin in vivo olarak belirlenmesi karmaşıktır, çünkü kan gibi biyolojik sıvılar, endotel hücreleri, iskelet kası, eritrositler ve bağışıklık hücrelerinden gelen EV'ler de dahil olmak üzere metabolik hastalığın patogenezinde rol oynayan bir dizi hücre kaynağından EV'ler içerir. Burada açıklanan yöntem, şu anda bilinmeyen adipositlerde EV biyogenezine yol açan faktörleri araştıran mekanik çalışmalar için yararlı bir model sağlayabilecek insan adiposit EV'lerinin belirlenmesine izin verir. Daha da önemlisi, adiposit EV biyogenezinin ve adiposit EV'lerde belirli RNA'ların, proteinlerin ve metabolitlerin yüklenmesinin nasıl düzenlendiğinin belirlenmesi, metabolik disfonksiyonda patojenik adiposit EV sinyalini bozmak için yeni terapötik fırsatlar ortaya çıkarabilir. Ayrıntılı çalışmalar, EV boyutunun, sayısının, biyogenez yolunun ve EV yükünün (RNA, proteinler ve metabolitler) oksijen, glikoz, lipitler ve insülindeki bozulmalar gibi hastalık veya uyaranlara yanıt olarak nasıl değiştirildiğinin daha iyi anlaşılmasını sağlayacaktır. Metabolik hastalıkta çevresel faktörlerin adiposit EV sinyalizasyonu üzerindeki rolü ve adiposit kaynaklı EV'lerin adipoz doku inflamasyonuna nasıl katkıda bulunduğu hakkında bilgiler, metabolik hastalıkta yeni terapötik hedefleri ortaya çıkarabilir.
Sınırlama
Adiposit türevli EV'lerin in vitro üretimi
İnsan preadipositlerinin in vitro kullanımı, in vitro adiposit farklılaşmasını takiben adiposit türevi EV'lerin salınımını ve oluşumunu incelemek için bir model sistem sağlar, ancak bir takım sınırlamalar vardır. Özellikle, in vitro türetilmiş adiposit EV'lerin, boyutları, konsantrasyonları, EV-proteini, -RNA, -metabolitleri ve işlevleri bakımından plazma14 gibi biyo sıvılardan alınan adipoz kaynaklı EV'lerden farklı olması muhtemeldir. Bu EV farklılıkları, yağ dokusu fizyolojisi ile yakından bağlantılı olan ve yağ dokusu iltihabı da dahil olmak üzere yağ dokusu patolojisinde rol gösteren yağ dokusu kaynaklı kök hücreler, endotel hücreleri ve makrofajlar gibi in vivo yağ dokusunda yerleşik olan diğer adiposit olmayan hücrelerden etkilenebilir.
Burada tarif edilen 2 haftalık in vitro farklılaşma protokolünün, in vivo görülenlere eşdeğer tam olgun adipositler üretmek için yeterli olmayabileceğine dikkat edilmelidir; in vitro iki boyutlu (2D) formatta büyütülen diferansiye adipositler, in vivo hücrelerden farklı bir morfoloji gösterir ve uniloküler lipid damlacıkları geliştirmezler. Ayrıca, bu protokolde tarif edilen preadipositler adipoz stromal-vasküler fraksiyondan elde edilmiştir ve hücre izolasyonu sırasında tamamen elimine edilmeyen diğer hücre tiplerinin EV havuzuna katkısını değerlendirmedik.
Adipositlerin adipoz dokudaki diğer adiposit olmayanlarla önemli hücreden hücreye etkileşimlerinin kaybı, adiposit EV üretimini, salınımını, adipositlerden EV-proteini ve EV-RNA'yı ve yağ dokusu kaynaklı kök hücreleri etkileyebilir16. Bununla birlikte, in vitro türetilmiş adiposit EV'lerin in vivo üretilenlerden ne kadar farklı olduğuna dair bir değerlendirme kapsamlı bir şekilde yapılmamıştır.
Primer doku biyopsileri kan içerir ve bu nedenle türetilmiş hücre kültürleri, protokolümüzde vurgulanan çoklu yıkama ve ortam değişikliklerinden bağımsız olarak eritrositler ve eritrosit türevi EV'ler içerebilir. Eritrositlerin adipositler üzerindeki etkilerini ortadan kaldırmak için stromal-vasküler fraksiyonun izolasyonunu takiben ek bir kırmızı kan hücresi lizis aşaması gerekli olabilir. Bu önemlidir, çünkü eritrosit kaynaklı EV'ler diğer hücrelerin hücresel fonksiyonunu etkileyebilir17 ve eritrosit kaynaklı EV'ler oksidatif stresvarlığında 18 ve metabolik sendromlu hastalarda19,20 yükselir. Bu nedenle, metabolik hastalık hastalarından türetilen yağ dokusu, adipositlerin in vitro fenotipini etkileyebilecek yüksek seviyelerde eritrosit kaynaklı EV'ler içerebilir.
FBS'nin ortadan kaldırılması
Tarif edilen protokol, adipojenik farklılaşma sırasında büyüme ortamında FBS'yi kullandı, ancak daha sonra adipositler, adiposit türevi EV'lerin izolasyonu için son ortam toplamasından önce çoklu ortam değişikliklerine tabi tutuldu. Bu nedenle, EV preparatlarında FBS'den türetilen EV'lerin kontaminasyonu için genel riskin düşük olduğunu varsaydık ve daha sonra TSG101 için western blotlama ile hücre kültürü ortamında artık EV'lerin bulunmadığını doğruladık. Hücre kültürlenmiş EV'lerin FBS gerektiren hücre kaynaklarından izolasyonu, sığır-EV'lerin adiposit EV konsantrasyonlarını karıştırmasını ve adiposit EV yükünün analizini önlemek için ultra santrifüjleme yoluyla EV'yi tükenmiş FBS'yi kullanmalı veya tükenmiş sığır-EV'leri kullanmalıdır. Adipositlerden serumun tükenmesinin hücresel tepkilerini21 değiştirdiği bilinmektedir ve bu nedenle araştırma, serumdan serum tükenmesinin veya EV tükenmesinin adiposit kültürlerini adiposit biyolojisini gerçekten temsil etmesini sağlamalıdır.
Filtrasyon ve ultrasantrifüjleme kullanılarak EV izolasyonunun teknik olarak sınırlandırılması
EV izolasyonları için ultrasantrifüjlemeden önce sızdırmazlık gerektiren tek kullanımlık plastik tüplerle bir ultrasantrifüjleme yöntemini açıklıyoruz. Bu tek kullanımlık sızdırmaz tüplerin birçok kişi için ekonomik bir seçenek olmayabileceğini kabul ediyoruz ve sızdırmazlık gerektirmeyen ve tekrar kullanılabilir olan benzer tüplerin araştırılmasını öneriyoruz. Bununla birlikte, araştırmacılar, yeniden kullanılabilir tüplerin yıkanmasının yeterli olduğundan ve fazla mesai yapan protein, lipid ve RNA kirleticilerinin ilerleyici birikimine yol açmadığından emin olmalıdır, bu da EV ile ilişkili kargonun aşağı akış araştırmalarını veya hücresel fonksiyon çalışmaları üzerindeki etkiyi etkileyebilir.
Burada tarif edilen filtrasyon ve ultrasantrifüjleme protokolü çok sayıda yıldır kullanılmaktadır ve çok sayıda çalışma, hücresel mitokondri gibi kirletici hücresel bileşenlerin spesifik olmayan izolasyonları, nükleer fragmanların varlığı ve hücre zarının bileşenleri dahil olmak üzere bu yöntemin eksikliklerini vurgulamıştır. Ayrıca, burada açıklanan yöntem, EV tükenmiş FBS'de bulunan lipoproteinleri birlikte izole edecektir. Buradaki yöntem, kontamine çözünür proteinleri ve bazı lipoproteinleri ortadan kaldırmak için yoğunluk ultrasantrifüjleme ve boyut dışlama kromatografisi (SEC) kullanılarak daha da geliştirilebilir. İzole edilmiş EV'lerin ve SEC'nin PBS yıkaması ile birleştiğinde, birlikte izole edilmiş kirleticiler sınırlandırılabilir ancak tamamen ortadan kaldırılamaz. Bu nedenle, kullanıcılar, kültür ortamındaki çözünür proteinleri ve lipoproteinleri hesaba katmak için hücrelerle temas halinde olmayan bir sahte ortam ve EV'lerin hala çözünür proteinler ve lipoproteinler içeren koşullu ortamdan başarılı bir şekilde izole edildiğini göstermek için EV tükenmiş bir süpernatant kontrolü dahil olmak üzere uygun kontrollerin dahil edilmesini sağlamalıdır.
Filtrasyon ve ultrasantrifüjleme kullanılarak EV'lerin izolasyonu, operatöre, filtrenin deliğinden veya iğnenin/şırınganın deliğinden geçerken hücre kültürü süpernatantlarına aşırı basınç uygulanmamasını sağlamaya dayanır. Açıklanan protokolün bu aşamasında aşırı kuvvet uygulanması, EV'leri yırtabilir, nihai EV konsantrasyonlarını etkileyebilir ve bir zamanlar EV'lerde bulunan serbest RNA, proteinler ve metabolitler üretebilir. Burada, şırınga haznesini gerektirmeyen ve bu nedenle koşullandırılmış ortamlardaki EV'lere filtreden veya iğneden toplama rezervuarlarına ve ultrasantrifüj tüplerine geçerken kuvvet uygulanmasını gerektirmeyen bir yöntem tanımladık. Bununla birlikte, EV peletini PBS'de yeniden askıya alırken daha fazla özen gösterilmelidir. Sadece kısa bir girdap kullanılmalıdır, çünkü güçlü girdap EV membranlarını bozabilir.
Ultrasantrifüjlemeden sonra, operatörler EV peletini rahatsız etmemek için ultrasantrifüj tüplerine dikkat etmelidir. Bu, tüplerin dikkatli bir şekilde ele alınması ve ultrasantrifüj rotoru ile tüp rafı arasında yavaşça hareket ettirilmesiyle elde edilebilir. EV ile tükenmiş süpernatanları aspire etmek için ultrasantrifüj tüpünün tepesinde bir delik açarken daha fazla özen gösterilmelidir. İğneyi tüpün üst kısmına sokmak ve süpernatanları hızlı bir şekilde aspire etmek, şırınga namlusunda bir vakum yaratacaktır, bu da süpernatanı ultrasantrifüj tüpüne şiddetli bir şekilde geri zorlayabilir ve EV peletini bozabilir. Kalan süpernatanı dökmek için ultrasantrifüj tüpünü kestikten sonra, EV peleti gevşeyebileceğinden ve döküldüğünde EV peletini atacağından dikkatli olunmalıdır. Alternatif olarak, tüpü dökmeden veya ters çevirmeden kalan süpernatanı yavaşça çıkarmak için bir şırınga ve iğne kullanılabilir.
EV'lerin izolasyonu için süpernatanların filtrasyonu ve ultrasantrifüjlenmesi yararlı ve verimli bir yöntemdir. Ancak lipoproteinlerin ve çözünür proteinlerin birlikte izolasyonundan sorumludur. Bunlar, EV'leri PBS ile yıkayarak (açıklandığı gibi) hafifletilebilir, ancak bu, tüm kirleticileri ortadan kaldırmayacaktır. Çözünür proteinler, SEC kullanılarak EV fraksiyonundan ayrıştırılabilir, ancak bu yöntem lipoproteinler ve EV'ler arasında ayrım yapmaz. EV'leri içeren SEC-elutions, EV'leri peletlemek için ultrasantrifüjleme ile birleştirilebilir. Filtrasyon ve diferansiyel ultrasantrifüjleme, polietilen glikol kullanan çökeltme tekniklerine göre EV izolasyonu için tercih edilen bir yöntemdir, çünkü bu çökeltme yöntemleri, hücre kültürü süpernatantlarında ve diğer biyolojik sıvılarda büyük miktarlarda çözünür proteinleri ve lipoproteinleri birlikte izole eder. Ultrasantrifüjlemenin birçokları için en erişilebilir EV izolasyon şekli olmaya devam etmesi muhtemeldir, çünkü çoğu laboratuvar bir ultrasantrifüj ile donatılmıştır, bu nedenle ilk başlatma maliyetlerini azaltır. Ancak birçokları için, EV izolasyonu için ultrasantrifüjleme, ultrasantrifüj tüplerinin hacmi ve malzemenin başlangıç hacmi tarafından engellenir. Aşağı akış proteomiği veya RNA dizilimi için yeterli EV miktarı üretmek için birkaç yüz mililitre kültür süpernatanı gerekebilir. Bununla birlikte, EV izolasyonu için ultra santrifüjleme tekniklerine, izole edilmiş EV'lerin saflığını artırmak için tetraspaninler CD9, CD63 ve CD81 kullanılarak SEC ve immünoaffinite yakalama gibi diğer tekniklerin eşlik etmesi muhtemeldir. Ticari olarak temin edilebilen çökeltme çözeltileri ve akış sitometrisi gibi diğer teknikler, belirli araştırmalarda bazı kullanımlar olabilir.
EV preparatlarının saflığı
TSG101 için western blotlama ile adiposit türevi EV'lerin izolasyonunu doğruladık, ancak bu tek western lekesi, uluslararası hücre dışı veziküller derneği (ISEV) tarafından yayınlanan kılavuzların gerisinde kalıyor. Bu adiposit türevli EV'lerin daha fazla karakterizasyonu, eksozomları ve histon H3, albümin ve apolipoprotein A1 gibi hücresel kontaminasyon belirteçlerini tanımlamak için tetraspaninler CD9, CD63 ve CD81 kullanılarak ideal olacaktır.
Burada sunulan protokol, EV boyutunun, konsantrasyonunun, western blot ile EV belirteçlerinin belirlenmesi ve proteomik ve RNA dizilemesi gibi omik tabanlı teknolojilerde fayda için adipositler dahil olmak üzere bir dizi hücre kaynağından hücre kültürü süpernatantlarından EV'lerin izolasyonuna izin verir.
Açıklamalar
Yazarların ifşa edecek hiçbir şeyi yok.
Teşekkürler
N.A. ve R.C., İngiliz Kalp Vakfı, Oxford Araştırma Mükemmeliyet Merkezi'nden (N.A. ve R.C.; RE/13/1/30181 ve RE/18/3/34214), İngiliz Kalp Vakfı Proje Hibesi (N.A. ve R.C.; PG/18/53/33895), Üçlü İmmünometabolizma Konsorsiyumu, Novo Nordisk Vakfı (NNF15CC0018486), Ulusal Sağlık Araştırmaları Enstitüsü (NIHR), Oxford Biyomedikal Araştırma Merkezi (BRC), Nuffield Tıp için Fayda ve Wellcome Kurumsal Stratejik Destek Fonu (ISSF). İfade edilen görüşler yazar(lar)a aittir ve NHS, NIHR veya Sağlık Bakanlığı'na ait olmak zorunda değildir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 100 µm mesh | Sefar | 03-250/50 | |
| 15 mL Conical Tube | Sarstedt | 62.554.002 | |
| 250 µm mesh | Sefar | 03-100/44 | |
| 50 mL Conical Tube | Sarstedt | 62.547.004 | |
| Beckman Coulter, Optima MAX-XP Ultracentrifuge | Beckman Coulter | 393315 | |
| Bicinchoninic acid assay (BCA) | Thermo Scientific | 23225 | |
| Biotin | Sigma | B4639 | |
| BSA (essentially fatty acid free) | Sigma | A7030 | |
| Collagenase H | Sigma | 11074032001 | |
| Dexamethasone | Sigma | D2915 | |
| Dulbecco's Modified Eagle's Medium/Ham's nutrient mixture F12 | Sigma | D6421 | |
| Fetal bovine serum | Labtech | FCS-SA | |
| Fibroblast growth factor | Bio-Techne | 233-FB-025 | |
| Glutamine | ThermoFisher | 25030024 | |
| Hanks balanced salt solution | Sigma | H9394 | |
| Human insulin | ThermoFisher | 12585-014 | |
| Hypodermic needles, Microlance 16G | VWR | 613-3897 | |
| IBMX | Sigma | I7018 | |
| Nanoparticle Tracking Analysis, Zetaview | Particle Metrix | BASIC PMX-120 | |
| NEFA kit | Randox | FA115 | |
| Pantothenate | Sigma | P5710 | |
| Penicillin and Streptomycin | ThermoFisher | 15140122 | |
| Phosphate buffered saline | ThermoFisher Scientific | 10010056 | |
| PluriStrainer 200 µm | Cambridge Bioscience | 43-50200-03 | |
| Polyallomer Quick-Seal ultra-clear 16 mm × 76 mm tubes | Beckman Coulter | 342413 | |
| Single use syringes, 2-piece, Injekt Solo | VWR | 20-2520 | |
| Sodium linoleate | Sigma | L8134 | |
| Sodium oleate | Sigma | O7501 | |
| Sodium palmitate | Sigma | P9767 | |
| Soldering Iron | Zacro | 7.14954E+11 | |
| Syringe Filter 0.2 µm | Sarstedt | 83.1826.001 | |
| Syringe Filter 0.45 µm | ThermoFisher | 195-2545 | |
| T175 cm2 tissue culture flasks | Sarstedt | 83.3912.002 | |
| T25 cm2 tissue culture flasks | Sarstedt | 83.3910.002 | |
| T75 cm2 tissue culture flasks | Sarstedt | 83.3911.002 | |
| Transferrin | Sigma | T8158 | |
| Triiodo-L-thyronine | Sigma | T5516 | |
| Troglitazone | Sigma | T2573 | |
| TrypLE Express Enzyme | Fisher Scientific | 12604021 |
Referanslar
- Théry, C., et al. Minimal information for studies of extracellular vesicles 2018 (MISEV2018): a position statement of the International Society for Extracellular Vesicles and update of the MISEV2014 guidelines. Journal of Extracellular Vesicles. 7 (1), 1535750(2018).
- Akbar, N., et al. Endothelium-derived extracellular vesicles promote splenic monocyte mobilization in myocardial infarction. JCI Insight. 2 (17), (2017).
- Xiao, Y., et al. Extracellular vesicles in type 2 diabetes mellitus: key roles in pathogenesis, complications, and therapy. Journal of Extracellular Vesicles. 8, 1625677(2019).
- Akbar, N., Azzimato, V., Choudhury, R. P., Aouadi, M. Extracellular vesicles in metabolic disease. Diabetologia. 62 (12), 2179-2187 (2019).
- Kobayashi, Y., et al. Circulating extracellular vesicles are associated with lipid and insulin metabolism. The American Journal of Physiology-Endocrinology and Metabolism. 315 (4), 574-582 (2018).
- Eguchi, A., et al. Circulating adipocyte-derived extracellular vesicles are novel markers of metabolic stress. Journal of Molecular Medicine. 94 (11), Berlin, Germany. 1241-1253 (2016).
- Crewe, C., et al. An Endothelial-to-adipocyte extracellular vesicle axis governed by metabolic state. Cell. 175 (3), 695-708 (2018).
- Flaherty, S. E., et al. A lipase-independent pathway of lipid release and immune modulation by adipocytes. Science. 363 (6430), 989-993 (2019).
- Deng, Z. B., et al. Adipose tissue exosome-like vesicles mediate activation of macrophage-induced insulin resistance. Diabetes. 58 (11), 2498-2505 (2009).
- Kranendonk, M. E., et al. Human adipocyte extracellular vesicles in reciprocal signaling between adipocytes and macrophages. Obesity. 22 (5), Silver Spring. 1296-1308 (2014).
- Song, M., et al. Adipocyte-derived exosomes carrying sonic hedgehog mediate M1 macrophage polarization-induced insulin resistance via Ptch and PI3K pathways. Cellular Physiology and Biochemistry. 48 (4), 1416-1432 (2018).
- Ramirez, M. I., et al. Technical challenges of working with extracellular vesicles. Nanoscale. 10 (3), 881-906 (2018).
- Mehdiani, A., et al. An innovative method for exosome quantification and size measurement. Journal of Visualized Experiments: JoVE. (95), e50974(2015).
- Connolly, K. D., et al. Evidence for adipocyte-derived extracellular vesicles in the human circulation. Endocrinology. 159 (9), 3259-3267 (2018).
- Camino, T., et al. Vesicles shed by pathological murine adipocytes spread pathology: characterization and functional role of insulin resistant/hypertrophied adiposomes. International Journal of Molecular Sciences. 21 (6), 2252(2020).
- Zhu, Y., et al. Extracellular vesicles derived from human adipose-derived stem cells promote the exogenous angiogenesis of fat grafts via the let-7/AGO1/VEGF signalling pathway. Scientific Reports. 10 (1), 5313(2020).
- Sadallah, S., Eken, C., Schifferli, J. A. Erythrocyte-derived ectosomes have immunosuppressive properties. Journal of Leukocyte Biology. 84 (5), 1316-1325 (2008).
- Sudnitsyna, J., et al. Microvesicle formation induced by oxidative stress in human erythrocytes. Antioxidants. 9 (10), Basel. (2020).
- Helal, O., et al. Increased levels of microparticles originating from endothelial cells, platelets and erythrocytes in subjects with metabolic syndrome: relationship with oxidative stress. Nutrition, Metabolism and Cardiovascular Diseases. 21 (9), 665-671 (2011).
- Agouni, A., et al. Endothelial dysfunction caused by circulating microparticles from patients with metabolic syndrome. The American Journal of Pathology. 173 (4), 1210-1219 (2008).
- Park, J., Park, J., Nahm, S. -S., Choi, I., Kim, J. Identification of anti-adipogenic proteins in adult bovine serum suppressing 3T3-L1 preadipocyte differentiation. BMB Reports. 46 (12), 582-587 (2013).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır