需要订阅 JoVE 才能查看此. 登录或开始免费试用。
Method Article
快速网格准备时间解决低温电子显微镜
摘要
在这里,我们提供了一个详细的协议,用于快速网格制作和快速混合和冻结的快速网格制作设备,以进行时间解决的实验。
摘要
低温电子显微镜(cryo-EM)领域正在迅速发展,使用新的硬件和处理算法,产生更高的分辨率结构和更具挑战性的系统信息。低温-EM的样品制备正在经历一场类似的革命,正在开发新的方法来取代传统的印迹系统。其中包括使用压电分配器、针头打印和直接喷洒。由于这些发展,网格制备的速度从秒到毫秒,提供了新的机会,特别是在时间解决的低温EM领域,蛋白质和基板可以在暴跌冻结之前快速混合,捕获短寿命的中间状态。在这里,我们详细描述了一个标准协议,用于在内部时间解决的 EM 设备上制作网格,既用于标准快速网格准备,也用于时间解决实验。该协议要求至少 50 μL 样品的浓度为 ≥ 2 毫克/兆升,用于制备 4 个网格。样品应用和冻结之间的延迟可能低至 10 ms。与印迹方法相比,一个限制是以更快的速度增加冰厚。我们希望该协议将帮助其他人设计自己的网格制造设备和那些有兴趣设计时间已解决的实验。
引言
背景
低温电子显微镜(cryo-EM)的最新发展使对日益复杂的高分辨率系统进行了结构研究。除了少数例外,此类研究仅限于平衡1 或相对缓慢反应2的生物大分子。体内的许多过程 发生在 更快的时间尺度上(毫秒),并且对这些时间刻度3中时间解决的低温 EM (TrEM) 的兴趣与日增。然而,传统的低温EM样品制备的印迹方法太慢毫秒TrEM。
除时间分辨率差外,印迹方法还有其他限制。蛋白质和蛋白质复合物可能遭受变性或首选方向的网格4。在样品制备过程中减少暴露在空气-水界面上的时间,已证明可以减轻首选方向和蛋白质变性5,6。因此,快速网格制备不仅能实现毫秒 TrEM,还能提高电网质量。
目前,自动网格准备有三种不同的方法。第一种方法使用固定少量样品的针脚或毛细管。在建立液体和网格表面之间的接触后,样品被"写"到网格7,8。示例应用过程相对较慢,需要几秒钟。另一种方法使用由Piezo分配器和自吸电网9控制滴的生成。这允许更快的分配冻结时间,但仍然受到水滴和芯速的限制(目前达到54ms)。到目前为止,最快的方法是直接喷洒方法,其中样品在喷雾喷嘴和小(+10 - 20 μm)和快速(>5米/s)液滴中雾化,在与低温-EM网格接触后扩散。样品喷雾可以通过不同的方式产生,如空气母细胞雾化器,表面声波或超声波加湿器10,11,12,13。根据我们的经验,直接喷洒方法的冰厚更大,但直接喷洒可使喷涂时间冻结时间< 10 ms。
该协议描述了如何逐步解决的EM设备(TED)配备了微流体喷雾喷嘴可用于准备网格在快速时间尺度14,15。该设备用于制备网格,在样品应用和冷冻之间最短延迟时间为 6 ms,并快速混合和冻结两个样品。TED的设计是基于以前的版本16,类似于其他喷雾基于时间解决的低温EM设备17。
首先,描述了TED设置的四个主要部分。TED 的核心是液体处理单元,负责样品吸气和配药。气动柱塞通过喷雾将网格移动到液态乙烷中。喷雾的生成是通过微流体喷雾喷嘴实现的,冻结是在液体乙烷容器中完成的,该容器被简要描述。最后,突出了控制网格环境的其他功能,特别是湿度。随后是设备操作和进行 TrEM 实验的详细协议。为快速网格准备和简单的 TrEM 实验提供了具有代表性的结果。
实验设置
液体处理单元
TED 的液体处理系统由三个注射器驱动泵("泵 1 - 3")组成,每个泵都配有旋转阀(图 1)。电源提供泵 1 - 3 与 24 V 直流。与控制软件(以视觉基础和C++编写)的通信是通过 RS232 接口泵 1。命令通过序列 I/O 扩展端口从泵 1 分发到泵 2-3。泵 1-3 配备玻璃注射器(注射器 1-3',我们在这里使用 250 μL/零死容量注射器)。每个阀门有两个位置,"负载"和"分配"。"负载"位置用于将样品吸进注射器。1/16"O.D.,0.01°I.D. FEP 管的短片(+ 3 - 4 厘米)通过 ETFE/ETFE 无法兰配件连接到阀门 1-3 的"负载"位置。这小块管子伸进样品储层(通常是 1.5 mL 或 0.5 mL 塑料管)。"分配"位置通向喷嘴。"分配"插座和喷雾喷嘴之间的连接由 PE 管(+ 20-30 厘米长,0.043" O.D.,0.015" I.D.)制成,带有一小块袖管(+0.5 厘米)和 ETFE/ETFE 无法兰配件。
气动柱塞
TED 使用气动柱塞加速网格,并通过样品喷雾将其移动到液态乙烷容器中。负压钳子保持网格,拧成一个自制的支架,安装在双杆气动缸(图2A)。
压力来自一个大氮气瓶(W大小),配备多级调节器(0 - 10杆,"主压力")。柔性增强 PVC 管(12 mm O.D.)将调节器连接到 12 端口歧管,其中加压氮输送到喷嘴和气动柱塞。通过喷嘴的气体流是恒定的,直接在氮气瓶(主压力)调节。与喷嘴的连接由PU管(4 毫米 O.D.,2.5 毫米 I.D.)、一小块 PE 管(+ 8 厘米长,0.043 英寸 O.D.,0.015 英寸 I.D.)和适当的连接器制成。气动柱塞的压力通过电磁阀控制。PU 管(4 mm O.D.,2.5 mm I.D.)将电磁阀与调节器和气动柱塞连接起来,从而降低下陷压力(≤主压力)。电磁阀由计算机控制。 图 2B中给出了设置的示意图概述。
请注意,使用此设置,暴跌压力始终等于或小于喷雾气体压力(主压力)。但是,通过在喷嘴上游加入第二个调节器,可以轻松更改设置,从而在低喷气压力下允许更高的俯冲速度。高压(>>2杆)会损坏PDMS喷嘴。
警告:这是一个加压系统,"主要压力"应始终< 7 条。
0.5 和 2 条之间的压力通常用于气动柱塞,并显示压力和速度之间的大致线性关系(在喷雾的垂直位置)。俯冲速度使用示波器测量,与滑动电能计 (10 k?) 连接,并同时与 2 k Ω 电阻器 (图 2C) 连接。电源为电压计提供 9 V 直流。虽然通过设置暴跌压力在实验前设定了近似的暴跌速度,但强力计在实验后给出了速度的精确读数。
喷雾喷嘴和液体乙烷容器
气体动态虚拟喷嘴的制造和操作,用于喷雾样品的输送,已详细描述其他地方15。如上所述,阀门 1-3 的"分配"插座与喷嘴的液体入口相连(图 3A)。加压喷雾气体与喷嘴的气体入口相连。PDMS 喷嘴中的入口非常多,无需配件即可直接使用 0.043" O.D. PE 管。我们的喷嘴设计包含一个"喷射"几何形状,用于混合两个样品,类似于参考18中描述的设备。设计示意图显示在 图3B中,喷嘴的微观图像显示在 图3C中。微流体设备的布局需要使用三个注射器混合两个样品。喷嘴通常位于离网格 1-1.5 厘米的距离(在样品应用期间)。
我们使用液乙烷作为低温源,在用于标准印迹方法的液态乙烷/氮容器中。液态乙烷杯的垂直定位通过实验室提升平台实现。
控制喷雾和网格环境
柱塞和喷雾喷嘴包含在一个定制的PMMA(丙烯酸玻璃)盒与双门(图4A)。箱内的高相对湿度通过 TED 背面的空气加湿系统(图 4B)实现。空气由泵提供,并送入前 10 个罐(通常用于水槽净水下)。罐中装满了低(+5-10厘米)的水,还装有加湿器单元。加湿器的电源由位于丙烯酸玻璃盒内的数字湿度/温度控制器和湿度/温度传感器控制。当相对湿度达到 90% ≥ 时,控制器将关闭泵。第一罐的加湿空气通过扩散器泵送,浸入水中,浸入第二个 10" 罐中,然后进入丙烯酸玻璃盒。
注意事项:由于样品在喷雾喷嘴中具有气溶胶化,因此危险生物或化学标本不适合作为样品。
运行序列
控制软件中的 "运行脚本 "按钮启动"运行"序列。此命令序列可以在脚本文件中预先定义并通过软件更改。此处解释了最重要的变量:
喷雾速度:喷雾速度决定注射器泵使用的液体流速。流速可按以下方式计算:此处使用的注射器泵电机具有固定的步数大小。泵的全系列分为 48,000 步。第二个重要因素是注射器体积。我们通常使用 250 μL 注射器。控制软件中的喷射速度设置为步数/秒。喷雾速度为 1000 步/秒对应于:
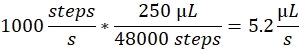
喷量:喷量决定要喷洒的总体积。因此,它也决定喷雾的持续时间。控制软件中的喷射音量设置为多个步骤。喷雾量为 2000 步,喷速为 1000 步/秒,喷喷持续时间为 2 秒,总喷量为 10.4 μL。
喷洒前时间:此变量定义了开始喷洒和暴跌之间的时间。重要的是要选择延迟时间,使喷雾有足够的时间稳定之前暴跌的网格。通常,喷雾剂在网格下降之前被给予 1.5 - 4s 以稳定。喷雾一直保持到网格通过。通常,液体流动(因此喷雾)在网格中断后停止 0.5 到 1 s。例如,使用 1000 步/s 的喷雾速度和 2000 步的喷雾量,典型的预喷时间为 1.5 s。
图 5A中显示了一个模范的命令序列,图5B中显示了随着时间的推移的网格位置。
Access restricted. Please log in or start a trial to view this content.
研究方案
1. 准备系统
注:以下协议描述了如何准备单个示例的网格。通常,为每个示例或条件准备了至少 2 个复制网格。对于更快的暴跌速度(小于 +20 ms 时间延迟),3 或 4 个复制网格通常准备考虑减少的薄冰区数量。
- 将蛋白质样本稀释至所需缓冲区的目标浓度。通常,最终浓度≥ 2 毫克/mL 与 TED 配合使用,可很好地进行网格准备。请注意,样品可以保存在冰上直到第 10 步,从第 10 步开始,样品将花费相当长的时间在室温下,因为准备 3-4 网格大约需要 20 分钟。
- 打开 TED。然后打开控制 PC 并启动控制软件。
- 通过按每个注射器泵上的 初始化 按钮(下黑色按钮),初始化所有注射器泵。
- 打开强力计电源,将其设置为 9 V 并启动示波器控制软件。
- 确保关闭 N2缸的调节阀。打开气缸阀。然后,慢慢打开调节阀,将出口压力设置为喷雾气体压力(通常为 1-2 杆)的预期值。对于此处使用的 PDMS 喷嘴,请不要使用高于 +2.5 条的压力以避免对喷嘴的损坏。持续流动的气体可防止液体在喷嘴尖端滴落和积聚,从而导致无法生产喷洒。
- 确保所有注射器泵阀处于"负载"位置。这可以通过将所有阀门切换到控制软件中的"分配"位置,然后返回到"负载"即可完成。让所有阀门都切换到"负载"。将所有注射器设置为零。
- 在此阶段,删除系统中存在的任何气泡。为此,注射器可能需要拧开,手动去除气泡,并且不再包含气泡时再次安装注射器。
- 液体处理组件通常存储在 H2O 中。在加载样品溶液之前,通过用过量的缓冲器清洗管子,使液体系统与缓冲器平滑。使用适当的最大液体流动速率,以避免喷雾喷嘴上的压力过大。液体流速> 10 μL/s 可能会对此处描述的 PDMS 喷嘴造成损坏。
- 将含有 200 μL 缓冲器 ≥的 1.5 mL 管放在注射器 1 上(顶部必须穿孔才能连接到管子上)。
- 确保阀门 1 处于"负载"位置。如有必要,切换控制软件。
- 通过控制软件,用注射器 1 吸气所需的缓冲量(通常为 50-100 μL)。
- 通过控制软件将阀门 1 切换到"分配"位置。
- 通过控制软件将注射器 1 中的所有液体分配。
- 将阀门返回到"负载",将程序中的注射器位置重置为"0",然后按下注射器 1 的初始化,为下一个周期的系统做好准备。
注:步骤 1.9.1 - 1.9.5 通常重复三次,以确保彻底清洗管子。
- 通过松开下垂的臂夹、将钳子放在夹子中并拧紧夹子,将带有 EM 网格的钳子(无需任何特定类型)加载钳子。
- 手动移动下垂的臂,使网格和喷嘴处于相同的高度("示例应用"位置)。如果喷嘴和网格对齐,液体在喷洒后会积聚在网格上很长一段时间。如有必要,调整喷嘴位置。
- 通过手动将带安装钳子的下垂臂移动到其末端位置(伸入乙烷杯),调整液态乙烷杯的位置。正确设置后,钳子保持的网格将到达液态乙烷杯的中心。
- 检查"运行脚本"是否将使用所需的流速、卷和时间。有关详细信息,请参阅上面的"运行序列"部分。
- 确保没有阻碍柱塞路径。吸气单次运行到注射器 1 所需的缓冲体积。这是在控制软件中完成的,请参阅"运行序列"部分,了解典型设置和体积。然后确保阀门 1 切换到"分配"位置。通过在控制软件中按 下运行脚本 执行测试运行。
注意:在运行序列完成之前,请远离 TED。移动部件可能会造成伤害! - 当"运行序列"完成后,将下垂臂上的压力设置为所需的值(通常为 1-2 条)。只有这样,在控制软件中按 OK 以释放从下垂的手臂上释放压力。如果需要调整"运行顺序"或对下垂臂的压力,则此设置可能会在此阶段更改,并重复步骤 1.13 - 1.15。
2. 快速网格准备
- 首先用液氮填充液态乙烷/氮容器。当足够冷且没有液氮时,将杯子中填充液态乙烷。避免凝固液体乙烷。此步骤与常规网格准备相同。
注意:为了最大限度地减少乙烷污染,请确保尽快执行步骤 2.2 - 2.13
警告:液态乙烷是一种低温和易燃物。处理时应小心谨慎。 - 准备低温-EM网格以进行发光放电。我们通常使用孔碳网格和发光放电 90s,在 0.1 mbar 气压和 10 mA。通常,一次发光的网格不超过 4 个。网格在发光放电后 30 分钟内使用。
- 用样品等价管(以下步骤 1.9.1 - 1.9.5,使用样品而不是缓冲)。如果可用的样本量较低,管子可能仅等于 1 个死体积。
- 在控制软件中,将单次运行到注射器 1 所需的样本量(有关详细信息,请参阅"运行序列"部分)。然后将阀门 1 切换到"分配"位置。
- 检查相对湿度是否达到预期值(我们通常以 60% 的相对湿度或更高)准备网格)。一旦达到≥ 60% 的湿度,仅打开湿度室的时间最少,以保持高湿度。
- 将钳子放在气动柱塞中,并固定它们。将柱塞移到起始位置(顶部)。
- 通过手动移动以接触柱塞,确保强力计的滑块处于起始位置,为测量做好准备。在示波器软件中的示波器上设置触发器。
- 放置液态乙烷/氮容器。
- 在控制软件中按 运行脚本 。提示时,单击控制软件中的 "确定 "以启动运行。
注意:在运行序列完成之前,请远离 TED。移动部件可能会造成伤害! - 完成"运行序列"后,通过单击控制软件中的 OK 来释放气动柱塞的压力。
- 打开湿度室,用一只手松开手臂和钳子之间的连接,同时用另一只手固定钳子。当钳子是免费的,移动暴跌的手臂,同时保持网格在液体乙烷。然后将网格转移到周围液体 N2的存储空间。冻结后,网格需要始终保持在液 N2 温度。
- 保存示波器测量。之后手动重置强力计滑块和柱塞的位置。
- 重复步骤 2.4-2.12 以准备复制网格
- 将网格传输到长期存储,直到网格剪报和数据收集。
- 根据步骤 1.9.1 - 1.9.5 用缓冲器清洗系统。然后按照步骤1.9.1- 1.9.5 用 H 2 O 清洗系统。
- 关闭主氮气调节器并关闭电源。
- 将乙烷/氮容器放入烟气罩中,让它加热,让液态乙烷和N2 蒸发。
3. 时间解决低温EM
注:在 TED 进行时间解决实验时,需要考虑其他方面,尽管基本设置和变量保持不变。这里假定两种溶液混合在 1:1 (v/v) 比率中,以产生沉积在网格上的最终混合物。遵循 '1 中描述的协议。与 TED 的快速网格准备,并具有以下更改:
- 与简单的喷雾实验相比,混合实验使用更高的库存浓度。以 1:1 (v/v) 比率混合将导致每个组件稀释 2 倍。
- 对于快速混合实验,请使用所有三个注射器,而不仅仅是一个注射器。
- 将管子连接到注射器泵 2-3。
- 将注射器泵的管子 2-3 连接到喷嘴。
- 将所有三个注射器均均衡在缓冲器中,并分别取样。通常,注射器 1 充满样品 A,注射器 2-3 充满样品 B(图3)。
- 更改运行顺序。 图6中给出了使用所有3个注射器进行快速混合实验的运行序列示例。另请参阅"运行序列"部分,了解详细信息。
- 不同的时间延迟可以通过两种方式实现:
- 更改柱塞速度。通过调整柱塞速度,可以在相对狭窄的范围内更改时间延迟。例如,喷雾/乙烷距离为 2 厘米,柱塞可以移动为 1 米/s 或 2 米/s,时间延迟分别为 20 ms 或 10 ms。这一点如第 1.15 步所述。
- 通过调整喷嘴的(垂直)位置来更改喷雾/乙烷位置。例如,如果喷嘴位于距离乙烷表面 5 厘米的距离内,则 1 m/s 的俯冲速度会延迟 50 ms。要实现显著更长的延迟时间,需要对设置进行进一步修改。
注:由于喷嘴的流量聚焦区域的层压流,我们预计喷嘴的这一部分不会进行显著的混合。相反,我们预计混合发生在喷雾发电期间、在通往电网的液滴中以及在网格上扩散的液滴中。喷雾液滴到达网格的飞行时间估计为 1 ms ≤(液滴速度为 ≥ 10 米/s,喷嘴网格距离为 1 厘米)。因此,只有滴落和美化之间的时间才被视为"时间延迟"。
Access restricted. Please log in or start a trial to view this content.
结果
与 TED 的快速网格准备
作为快速网格制备的测试标本,我们使用了马脾的阿波费里汀,在 30 mM HEPES 中为 20 μM,150 mM NaCl,pH 7.5。从参考 15 中描述的 690 个显微图(图 7A)中获得了3.5 + 分辨率的重建。选择脱焦范围,以便在原始图像中轻松识别粒子(图7B)。一个典型的网格,时间延迟为10-40ms显示足够的薄冰区域(
Access restricted. Please log in or start a trial to view this content.
讨论
这项工作中的方案可用于通过直接喷洒和TrEM实验进行快速网格准备。快速网格制备可用于减少颗粒与空气水接口的相互作用。主要限制是网格上可用的样品浓度和冰厚。在这些限制内,只要样品质量良好,协议将生成适合高分辨率低温-EM的网格。
故障 排除
液体流速和网格速度决定了沉积在网格上的液体量。以上述示例设置(液体流速 5 μL/s ...
Access restricted. Please log in or start a trial to view this content.
披露声明
没有。
致谢
我们要感谢莫莉S.C格雷维特的有益讨论和ABSL设施的工作人员帮助冷冻-EM数据收集。David P. Klebl 是利兹大学资助的阿斯特伯里中心韦康信托 4 年博士项目的博士生。FEI泰坦克里奥斯显微镜由利兹大学(UoL ABSL奖)和韦尔康信托(108466/Z/15/Z)资助。这项工作由BBSRC授予斯蒂芬·穆恩奇(BB/P026397/1)的赠款资助,并得到了美国心脏协会(AMR21-236078)和美国国家卫生研究院(171261)霍华德·怀特和维托尔德·加尔金的研究资助。
Access restricted. Please log in or start a trial to view this content.
材料
| Name | Company | Catalog Number | Comments |
| Time resolved device | |||
| acrylic glass box | USA scientific | ||
| digital humidity/temperature controller | THE20 digital humidity/temperature controller | ||
| dual rod pneumatic cylinder | dual rod pneumatic cylinder TN 10x70 | ||
| FEP tubing | Upchurch Scientific 1/16” O.D., 0.01'' I.D. FEP tubing | ||
| flangeless fittings | Upchurch Scientific ETFE/ETFE flangeless fittings | ||
| flexible reinforced PVC tubing | 12 mm OD. flexible reinforced PVC tubing | ||
| glass syringes | Kloehn 250 µL zero-dead volume | ||
| humidifier pump | Interpret Aqua Air AP3 | ||
| liquid ethane container | from Thermo/FEI VitrobotTM Mark IV | ||
| multistage regulator | GASARC class 3 multistage regulator | ||
| negative pressure tweezers | Dumont N5 Inox B negative pressure tweezers | ||
| oscilloscope | Hantek 6022BE oscilloscope | ||
| PE tubing | Scientific Commodities Inc. 0.043” O.D., 0.015” I.D. PE tubing | ||
| power supply | Mean Well GSM160A24-R7B | ||
| power supply | Wanptek KPS305D power supply | ||
| PU tubing | SMC TU0425 4 mm O.D., 2.5 mm I.D. PU tubing | ||
| regulator | Norgren R72G-2GK-RMN | ||
| slide potentiometer | PS100 slide potentiometer | ||
| solenoid valve | SMC NVJ314M solenoid valve | ||
| syringe drive pumps | Kloehn V6 48K model | ||
| Reagents & Materials | |||
| apoferritin from equine spleen | Sigma-Aldrich, A3660 | ||
| ATP | Sigma-Aldrich, A2383 | ||
| cryo-EM grids | Quantifoil 300 mesh Cu, R 1.2/1.3 | ||
| EGTA | Sigma Aldrich E3889 | ||
| F-actin | Provided by H.D. White (for preparation procedure, see ref. 1) | ||
| glow-discharger | Cressington 208 carbon coater with a glow-discharge unit | ||
| HEPES | Sigma-Aldrich, H7006 | ||
| KAc | Sigma-Aldrich, P1190 | ||
| MgCl2 | Sigma-Aldrich, M8266 | ||
| MOPS | Sigma-Aldrich, M1254 | ||
| NaCl | Sigma-Aldrich, S9888 | ||
| Skeletal muscle myosin S1 | Provided by H.D. White (for preparation procedure, see ref. 2) | ||
| Ref 1 | Spudich, J. A. & Watt, S. The regulation of rabbit skeletal muscle contraction I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of biological chemistry 246, 4866-4871 (1971). | ||
| Ref 2 | White, H. & Taylor, E. Energetics and mechanism of actomyosin adenosine triphosphatase. Biochemistry 15, 5818-5826 (1976). |
参考文献
- Murphy, B. J., et al. Rotary substates of mitochondrial ATP synthase reveal the basis of flexible F1-Fo coupling. Science. 364, (2019).
- Benton, D. J., Gamblin, S. J., Rosenthal, P. B., Skehel, J. J. Structural transitions in influenza haemagglutinin at membrane fusion pH. Nature. , 1-4 (2020).
- Dance, A. Molecular motion on ice. Nature Methods. , 1-5 (2020).
- D'Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747(2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15, 793-795 (2018).
- Klebl, D. P., et al. Need for speed: Examining protein behaviour during cryoEM grid preparation at different timescales. BioRxiv. , (2020).
- Ravelli, R. B., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11, 1-9 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. 197, 220-226 (2017).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195, 190-198 (2016).
- Feng, X., et al. A fast and effective microfluidic spraying-plunging method for high-resolution single-particle cryo-EM. Structure. 25, 663-670 (2017).
- Ashtiani, D., et al. Delivery of femtolitre droplets using surface acoustic wave based atomisation for cryo-EM grid preparation. Journal of Structural Biology. 203, 94-101 (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta Crystallographica Section D: Structural Biology. 75, (2019).
- Mäeots, M. -E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11, 1-14 (2020).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, (2019).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: from sprays to jets and back. Acta Crystallographica Section D: Structural Biology. 76, (2020).
- White, H., Thirumurugan, K., Walker, M., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144, 246-252 (2003).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. Protein Complex Assembly. , Springer. 59-71 (2018).
- Trebbin, M., et al. Microfluidic liquid jet system with compatibility for atmospheric and high-vacuum conditions. Lab on a Chip. 14, 1733-1745 (2014).
- Klebl, D. P., Sobott, F., White, H. D., Muench, S. P. On-grid and in-flow mixing for time-resolved Cryo-EM. Acta Crystallographica Section D: Structural Biology. , (2021).
- He, S., Scheres, S. H. Helical reconstruction in RELION. Journal of Structural Biology. 198, 163-176 (2017).
- Millar, N. C., Geeves, M. A. The limiting rate of the ATP-mediated dissociation of actin from rabbit skeletal muscle myosin subfragment 1. FEBS Letters. 160, 141-148 (1983).
- Kasas, S., Dumas, G., Dietler, G., Catsicas, S., Adrian, M. Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging. Journal of Microscopy. 211, 48-53 (2003).
- Glaeser, R. M., et al. Defocus-dependent Thon-ring fading. bioRxiv. , (2020).
- Bagshaw, C. A beginner's guide to flow kinetics. The Biochemist. 42, (2020).
Access restricted. Please log in or start a trial to view this content.
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。