Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Method Article
Zaman Çözümlü Cryo-Elektron Mikroskopisi için Hızlı Şebeke Hazırlığı
Bu Makalede
Özet
Burada, hem hızlı ızgara yapımı hem de zaman çözümlenmiş deneyler yapmak için hızlı karıştırma ve dondurma için hızlı ızgara yapma cihazının kullanımı için ayrıntılı bir protokol sunuyoruz.
Özet
Kriyo-elektron mikroskopisi (kriyo-EM) alanı, yeni donanım ve işleme algoritmaları ile hızla gelişmekte, daha yüksek çözünürlüklü yapılar ve daha zorlu sistemler hakkında bilgi üretmektedir. Kriyo-EM için örnek hazırlık, geleneksel şişirme sistemlerinin yerini almak için geliştirilen yeni yaklaşımlarla benzer bir devrime uğruyor. Bunlar arasında piezo-elektrikli dağıtıcıların kullanımı, pin baskısı ve doğrudan püskürtme yer almaktadır. Bu gelişmeler sonucunda, ızgara hazırlama hızı saniyelerden milisaniyelere kadar gidiyor ve özellikle proteinlerin ve substratların dalmadan önce hızla karıştırılabileceği zaman çözülen kriyo-EM alanında yeni fırsatlar sağlıyor, kısa ömürlü ara durumları hapsediyor. Burada, hem standart hızlı ızgara hazırlığı hem de zaman çözümlenmiş deneyler için şirket içi zaman çözümlü EM cihazımızda ızgara yapmak için standart bir protokol açıklıyoruz. Protokol, 4 ızgaranın hazırlanması için ≥ 2 mg / mL konsantrasyonlarında en az 50 μL numune gerektirir. Örnek uygulama ve donma arasındaki gecikme 10 ms kadar düşük olabilir. Bir sınırlama, daha yüksek hızlarda ve şişirme yöntemine kıyasla artan buz kalınlığıdır. Bu protokolün başkalarının kendi ızgara yapma cihazlarını tasarlamalarına ve zaman çözümlenmiş deneyler tasarlamak isteyenlere yardımcı olacağını umuyoruz.
Giriş
Arka plan
Kriyo-elektron mikroskopislerindeki (kriyo-EM) son gelişmeler, giderek karmaşıklaşan sistemlerin yüksek çözünürlükte yapısal çalışmalarını sağlamıştır. Birkaç istisna dışında, bu tür çalışmalar denge1 veya nispeten yavaş reaksiyonlarda biyolojik makromoleküllerle sınırlıdır2. Vivo'daki birçok işlem daha hızlı bir zaman ölçeğinde (milisaniye) gerçekleşir ve bu zaman ölçeklerinde zaman çözümlenen cryo-EM'ye (TrEM) olan ilgi artmaktadır3. Bununla birlikte, blotting yöntemi ile geleneksel kriyo-EM numune hazırlama milisaniye TrEM için çok yavaştır.
Blotting yönteminin kötü zaman çözümlemesi dışında başka sınırlamaları da vardır. Proteinler ve protein kompleksleri ızgaralarda denatürasyon veya tercih edilen yönelimden muzdarip olabilir4. Numune hazırlama sırasında hava-su arayüzüne maruz kalma süresinin azaltılmasının, tercih edilen oryantasyonu ve protein denatürasyonunu azalttığı gösterilmiştir5,6. Böylece, hızlı ızgara hazırlığı sadece milisaniye TrEM'i mümkün değil, aynı zamanda ızgara kalitesini de artırabilir.
Şu anda, otomatik ızgara hazırlama için üç farklı yaklaşım vardır. İlk yaklaşım, az miktarda örnek tutan bir pim veya kılcal damar kullanır. Sıvı ve ızgara yüzeyi arasında temas kurduktan sonra, örnek ızgara7,8üzerine 'yazılır'. Örnek uygulama işlemi nispeten yavaştır ve birkaç saniye sürer. Alternatif bir yaklaşım, bir piezo dağıtıcısı ve kendi kendine fitilleyen ızgaralar tarafından kontrollü damlacık üretimi kullanır9. Bu, daha hızlı dağıtmanın süreleri dondurmasına izin verir, ancak yine de damlacık ve fitilleme hızı ile sınırlıdır (şu anda 54 ms'ye ulaşıyor). Şimdiye kadarki en hızlı yaklaşım, numunenin bir püskürtme nozülinde atomize olduğu ve kriyo-EM ızgarası ile temas halinde yayılan küçük (~ 10 - 20 μm) ve hızlı (> 5 m / s) damlacıkların atomize olduğu doğrudan sprey yaklaşımıdır. Örnek sprey, airblast atomizörleri, yüzey akustik dalgaları veya ultrasonik nemlendiriciler10 , 11,12,13gibi farklı yollarla üretilebilir. Deneyimlerimize göre, doğrudan püskürtme yaklaşımına sahip buz kalınlığı daha fazladır, ancak doğrudan püskürtme, dağıtımın 10 ms'< süreleri dondurmasını sağlar.
Bu protokol, mikroakışkan sprey nozul ile donatılmış zaman çözümlenmiş bir EM cihazının (TED) hızlı bir zaman ölçeğinde ızgara hazırlamak için nasıl kullanılabileceğini adım adım açıklar14,15. Cihaz, numune uygulaması ile donma arasında minimum 6 ms gecikme süresine sahip ızgaralar hazırlamak ve iki numuneyi hızlı bir şekilde karıştırmak ve dondurmak için kullanılmıştır. TED'in tasarımı önceki bir sürüm16'ya dayanmaktadır ve diğer sprey tabanlı zaman çözümlü cryo-EM cihazlarına benzer17.
İlk olarak, TED kurulumunun dört ana kısmı açıklanmıştır. TED'in çekirdeği, numune aspirasyonu ve dağıtımından sorumlu olan sıvı taşıma ünitesidir. Pnömatik bir piston ızgarayı spreyden sıvı etan içine taşır. Spreyin üretimi mikroakışkan sprey nozülleri ile elde edilir ve dondurma kısaca açıklanan sıvı bir etan kabında yapılır. Son olarak, ızgara ortamını, özellikle nemi kontrol etmek için ek özellikler vurgulanır. Bunu cihazın çalışması ve TREM deneylerinin yapılması için ayrıntılı protokoller takip eder. Hızlı şebeke hazırlığı ve basit bir TrEM deneyi için temsili sonuçlar verilir.
Deneysel Kurulum
Sıvı taşıma ünitesi
TED'in sıvı taşıma sistemi, her biri bir döner vana ile donatılmış üç şırıng tahrik pompası ('pompalar 1 - 3') ile oluşturulur (Şekil 1). Güç kaynağı, 24 V DC'li 1 - 3 pompalar sağlar. Kontrol yazılımıyla iletişim (Visual Basic ve C++'ta yazılır) pompa 1 için bir RS232 arabirimi üzerinden yapılır. Komutlar, seri I/O genişletme bağlantı noktalarından pompa 1'den pompa 2-3'e dağıtılır. Pompa 1-3 cam şırınglarla donatılmıştır (şırıng 1-3', burada 250 μL / sıfır ölü hacimli şırıng kullanıyoruz). Her vananın 'yük' ve 'dağıtma' olmak üzere iki konumu vardır. 'Yük' konumu, numuneyi şırındak içine aspire etmek için kullanılır. 1/16" O.D., 0.01′′ I.D. FEP borularının kısa bir parçası (~ 3 - 4 cm) ETFE / ETFE flanşsız bağlantı parçaları aracılığıyla valflerin 'yük' konumuna bağlanır 1-3. Bu kısa boru parçası numune rezervuarına ulaşır (tipik olarak 1,5 mL veya 0,5 mL plastik tüp). 'Dağıtım' pozisyonu püskürtme nozülüne yol açar. 'Dağıtım' çıkışı ile püskürtme nozu arasındaki bağlantı PE boru (~ 20-30 cm uzunluk, 0,043" O.D., 0,015" I.D.), kısa bir kol boru parçası (~ 0,5 cm) ve ETFE / ETFE flanşsız bağlantı parçaları ile yapılır.
Pnömatik piston
TED, ızgarayı hızlandırmak ve numune spreyi aracılığıyla sıvı etan kabına taşımak için bir pnömatik piston kullanır. Negatif basınçlı cımbızlar ızgarayı tutar, çift çubuklu pnömatik silindire monte edilmiş ev yapımı bir tutucuya vidalanır (Şekil 2A).
Basınç, çok aşamalı bir regülatör (0 - 10 bar, 'ana basınç') ile donatılmış büyük bir azot gazı silindirinden (W boyutunda) sağlanır. Esnek güçlendirilmiş PVC boru (12 mm O.D.), regülatörü nozüle ve pnömatik pistona basınçlı azotun teslim edildiği 12 portlu bir manifolda bağlar. Nozuldan geçen gaz akışı sabittir, doğrudan azot silindiri (ana basınç) ile düzenlenir. Nozül bağlantısı PU boru (4 mm O.D., 2.5 mm I.D.), kısa bir PE boru parçası (~ 8 cm uzunluğunda, 0.043" O.D., 0.015" I.D.) ve uygun konektörlerle yapılır. Pnömatik piston üzerindeki basınç bir solenoid valf ile kontrol edilir. PU boru (4 mm O.D., 2,5 mm I.D.), daha düşük dalma basıncı (≤ ana basınç) sağlamak için solenoid valfi bir regülatör ve pnömatik pistona bağlar. Solenoid kapak bilgisayar kontrollüdür. Şekil 2B'de kuruluma şematik bir genel bakış verilmiştir.
Bu kurulumla dalma basıncının her zaman püskürtme gazı basıncından (ana basınç) eşit veya daha küçük olduğunu unutmayın. Bununla birlikte, kurulum, düşük püskürtme gazı basıncında daha yüksek dalma hızlarına izin vermek için püskürtme nozülüne ikinci bir regülatör dahil edilerek kolayca değiştirilebilir. Yüksek basınçlar (>> 2 bar) PDMS püskürtme nozülüne zarar verebilir.
DİkKAT: Bu basınçlı bir sistemdir ve 'ana basınç' her zaman 7 bar < olmalıdır.
0,5 ila 2 bar arasındaki basınçlar tipik olarak pnömatik piston için kullanılır ve basınç ve hız arasında (spreyin dikey konumunda) yaklaşık doğrusal bir ilişki gösterir. Dalma hızları, bir slayt potentiometresi (10 kΩ) ile aynı hizada ve 2 kΩ dirençle paralel olarak bağlanan bir osiloskopla ölçülür (Şekil 2C). Güç kaynağı, potentiometreye 9 V DC sağlar. Yaklaşık dalma hızı, dalma basıncı ayarlanarak deneyden önce ayarlanırken, potentiometre deneyden sonra hızın kesin bir şekilde okunmasını sağlar.
Püskürtme nozülleri ve sıvı etan kabı
Sprey bazlı numune teslimatı için gaz dinamik sanal nozüllerin imalatı ve çalışması başka bir yerde ayrıntılı olarak açıklanmıştır15. Yukarıda açıklandığı gibi, 1-3 vanaların 'dağıtım' çıkışları nozülün sıvı girişlerine bağlanır (Şekil 3A). Basınçlı sprey gazı nozülün gaz girişine bağlanır. PDMS püskürtme nozüllerindeki girişler, 0,043" O.D. PE borularının bağlantı parçalarına gerek kalmadan doğrudan kullanılabileceği şekildedir. Nozül tasarımımız,ref. 18'deaçıklanan cihaza benzer şekilde iki numunenin karıştırılması için bir 'jet-in-jet' geometrisi içerir. Tasarımın şeması Şekil 3B'de gösterilmiştir, bir nozülun mikroskobik bir görüntüsü Şekil 3C'de gösterilmiştir. Mikroakışkan cihazın düzeni, iki örneği karıştırmak için üç şırınga kullanılmasını gerektirir. Püskürtme nozülü tipik olarak ızgaradan 1-1,5 cm mesafede (numune uygulaması sırasında) konumlandırılmıştır.
Sıvı etanını kriyojen olarak, standart şişirme yönteminde kullanıldığı gibi sıvı etan/azot kabında kullanıyoruz. Sıvı etan kabının dikey konumlandırılması laboratuvar kaldırma platformu ile elde edilir.
Sprey ve ızgara ortamının kontrolü
Piston ve püskürtme nozülü, çift kapılı özel bir pmma (akrilik cam) kutusunda bulunur (Şekil 4A). Kutunun içindeki yüksek bağıl nem, TED'in arkasında bir hava nemlendirme sistemi ile elde edilir (Şekil 4B). Hava bir pompa tarafından sağlanır ve ilk 10" kutuya beslenir (tipik olarak lavabo suyu arıtması için kullanılır). Kutu düşük (~ 5-10 cm) su seviyesi ile doldurulur ve ayrıca bir nemlendirici ünitesine ev sahipliği yapmaktadır. Nemlendiricinin şebeke gücü, dijital nem/sıcaklık kontrolörü ve akrilik cam kutunun içinde bulunan bir nem/sıcaklık sensörü tarafından kontrol edilir. Kontrol ünitesi, bağıl nem %90'≥ ulaştığında pompayı kapatacak şekilde ayarlanır. İlk kutudan nemlendirilmiş hava bir difüzörden pompalanır, ikinci bir 10" kutuda suya batırılır ve ardından akrilik cam kutuya girer.
DİkKAT: Numune sprey nozülünde aerosolleştirildiğinden, tehlikeli biyolojik veya kimyasal numune numune olarak uygun değildir.
Çalışma sırası
Denetim yazılımındaki Komut Dosyasını Çalıştır düğmesi çalıştırma sırasını başlatır. Bu komut dizisi bir komut dosyasında önceden tanımlanabilir ve yazılım aracılığıyla değiştirilebilir. En önemli değişkenler burada açıklanmıştır:
Püskürtme hızı: Püskürtme hızı, şırınna pompası tarafından kullanılan sıvı akış hızını belirler. Akış hızı şu şekilde hesaplanabilir: Burada kullanılan şırıngır pompa motorları sabit bir adım boyutuna sahiptir. Pompanın tüm yelpazesi 48.000 adıma ayrılmıştır. İkinci önemli faktör şırıng hacmidir. Genellikle 250 μL şırınna kullanırız. Kontrol yazılımındaki püskürtme hızı adım/saniye sayısı olarak ayarlanır. 1000 adım/saniye püskürtme hızı şuna karşılık gelir:
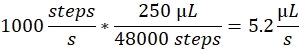
Püskürtme hacmi: Püskürtme hacmi, püskürtülecek toplam hacmi belirler. Böylece, spreyin süresini de belirler. Kontrol yazılımındaki püskürtme hacmi bir dizi adım olarak ayarlanır. 1000 adım/saniye püskürtme hızında 2000 adımlık bir püskürtme hacmi, 2 sn püskürtme süresine ve toplam 10,4 μL hacme yol açar.
Ön püskürtme süresi: Bu değişken, spreyin başlatılması ile dalma arasındaki süreyi tanımlar. Gecikme süresini, spreyin ızgarayı dalmadan önce stabilize etmek için yeterli zamana sahip olacak şekilde seçmek önemlidir. Genellikle, sprey ızgara dalmadan önce stabilize etmek için 1.5 - 4 s verilir. Sprey, ızgara hareket edene kadar korunur. Genellikle, sıvı akışı (ve dolayısıyla sprey), ızgara saplandıktan sonra 0,5 ila 1 sn durdurulur. Örneğin, 1000 adım/sn sprey hızı ve 2000 adımlık bir püskürtme hacmi kullanılarak, tipik bir ön püskürtme süresi 1,5 s'dir.
Şekil 5A'daörnek bir komut dizisi gösterilmiştir, zaman içinde ızgara konumu Şekil 5B'de gösterilmiştir.
Protokol
1. Sistemin hazırlanması
NOT: Aşağıdaki protokolde, tek bir örneğin ızgaralarının nasıl hazırlanacağı açıklanmaktadır. Genellikle, her örnek veya koşul için en az 2 çoğaltma ızgarası hazırlanır. Daha yüksek dalma hızları (~ 20 ms'den daha az zaman gecikmesi) için, 3 veya 4 çoğaltma ızgarası genellikle daha az sayıda ince buz alanını hesaba katmak için hazırlanır.
- Protein örneğini istenen tampondaki hedef konsantrasyona seyreltin. Tipik olarak, 2 mg/mL'≥ son konsantrasyonlar TED ile ızgara hazırlığı için iyi çalışır. Numunenin 10.
- TED'i açın. Ardından kontrol bilgisayarını açın ve kontrol yazılımını başlatın.
- Her şırınna pompasının Başlat düğmesine (alt siyah düğme) basarak tüm şırınna pompalarını başlatın.
- Potentiometre güç kaynağını açın, 9 V'a ayarlayın ve osiloskop kontrol yazılımını başlatın.
- N2silindirinin regülatör vanasının kapalı olduğundan emin olun. Silindir vanasını açın. Ardından, çıkış basıncını sprey gazı basıncı için istenen değere (tipik olarak 1-2 bar) ayarlayarak regülatör vanasını yavaşça açın. Burada kullanılan PDMS nozülleri için, nozüle zarar vermemek için ~ 2,5 bar'dan yüksek basınçlar kullanmayın. Sürekli akan gaz, sıvının nozul ucunda damlamasını ve birikmesini önler ve bu da iprodüklenebilir püskürtmeye yol açabilir.
- Tüm şırınd pompa vanalarının 'yük' konumunda olduğundan emin olun. Bu, tüm vanaları kontrol yazılımındaki 'dağıtım' konumuna geçirip ardından 'yük'e geri dönerek yapılabilir. Tüm vanaları 'yük' olarak değiştirin. Tüm şırındları sıfıra ayarlayın.
- Bu aşamada sistemde bulunan hava kabarcıklarını çıkarın. Bunu yapmak için şırınnaların sökülmeleri, kabarcıkların manuel olarak çıkarılması ve şırınnaların daha fazla kabarcık içermediğinde tekrar monte edilmesi gerekebilir.
- Sıvı taşıma bileşenleri genellikle H2O'da saklanır. Numune çözeltisini yüklemeden önce, boruyu fazla miktarda tamponla yıkayarak sıvı sistemini tamponla aşındırın. Püskürtme nozulunda aşırı basınçtan kaçınmak için uygun bir maksimum sıvı akış hızı kullanın. 10 μL/sn> sıvı akış hızları burada açıklanan PDMS nozullarında hasara neden olabilir.
- Şırınna 1'e ≥ 200 μL tampon içeren 1,5 mL'lik bir tüp yerleştirin (boruya tutturulması için üst kısım delinmelidir).
- Valf 1'in 'yük' konumunda olduğundan emin olun. Gerekirse kontrol yazılımını değiştirin.
- Kontrol yazılımı aracılığıyla şırınd 1 ile istenen miktarda (tipik olarak 50-100 μL) tamponu aspire edin.
- Kontrol yazılımı aracılığıyla valf 1'i 'dağıtma' konumuna getirin.
- Tüm sıvıyı kontrol yazılımı aracılığıyla şırınd 1'de dağıtın.
- Vanayı 'yüke' döndürün, şırınna konumunu programda '0' olarak sıfırlayın ve sistemi bir sonraki döngüye hazırlamak için şırınna 1'e basın.
NOT: 1.9.1 - 1.9.5 adımları, borunun iyice yıkanmasını sağlamak için genellikle üç kez tekrarlanır.
- Dalma kol kelepçesini gevşeterek, cımbızları kıskaç içine yerleştirerek ve kelepçeyi sıkarak EM ızgarası (belirli bir tip için gerekli değildir) ile cımbız yükleyin.
- Izgara ve nozül aynı yükseklikte olacak şekilde dalma kolunu manuel olarak hareket ettirin ('örnek uygulama' konumu). Nozül ve ızgara hizalanırsa, uzun bir süre püskürtülürkten sonra ızgarada sıvı birikir. Gerekirse, nozül pozisyonunu ayarlayın.
- Dalgıç kolunu monte edilmiş cımbızla manuel olarak uç konumuna (etan kabına uzanarak) hareket ettirerek sıvı etan kabının konumunu ayarlayın. Doğru şekilde kurulduğunda, cımbız tarafından tutulan bir ızgara yaklaşık olarak sıvı etan kabının ortasına ulaşacaktır.
- 'Run komut dosyasının' istenen akış hızlarını, birimleri ve zamanlamaları kullanıp kullanmayacağına bakın. Ayrıntılar için yukarıdaki 'Çalışma sırası' bölümüne bakın.
- Hiçbir şeyin pistonun yolunu engellemediğinden emin olun. Şırınd 1'e tek bir çalıştırma için gereken arabellek hacmini aspire edin. Bu kontrol yazılımında yapılır, tipik ayar ve birimler için 'Çalışma sırası' bölümüne bakın. Ardından valf 1'in 'dağıtma' konumuna geçtiğinden emin olun. Denetim yazılımında Komut Dosyası Çalıştır'a basarak bir test çalışması gerçekleştirin.
DİkKAT: Çalışma sırası tamamlanana kadar TED'den uzak durun. Hareketli parçalar yaralanmaya neden olabilir! - 'Çalıştırma sırası' tamamlandığında, dalma kolundaki basıncı istediğiniz değere (genellikle 1-2 çubuk) ayarlayın. Ancak daha sonra, dalma kolundan basınç serbest bırakmak için kontrol yazılımında Tamam'a basın. 'Çalışma sırası' veya dalma kolundaki basıncın ayarlanması gerekiyorsa, bu ayarlar bu aşamada değiştirilebilir ve 1.13 - 1.15 adımları tekrarlanabilir.
2. Hızlı Izgara Hazırlama
- Sıvı etan/azot kabını önce sıvı nitrojenle doldurun. Yeterince soğuk ve sıvı azot içermediğinde, bardağı sıvı etan ile doldurun. Sıvı etan katılaşmasından kaçının. Bu adım, geleneksel ızgara hazırlığı ile aynıdır.
NOT: Etan kontaminasyonlarını en aza indirmek için, 2.2 - 2.13 arası adımların mümkün olan en kısa sürede gerçekleştirilmesini sağlayın
DİkKAT: Sıvı etan bir kriyojendir ve yanıcıdır. Elleçleme yaparken dikkatli olunmalıdır. - Cryo-EM ızgaralarını kızdırma deşarjı için hazırlayın. Genellikle 0,1 mbar hava basıncında ve 10 mA'da 90 s boyunca delikli karbon ızgaraları ve kızdırma deşarjı kullanıyoruz. Genellikle, aynı anda en fazla 4 ızgara ışıma boşaltılır. Izgaralar, parlama deşarjının 30 dakika içinde kullanılır.
- Boruyu numune ile dengeler (tampon yerine numune kullanarak 1.9.1 - 1.9.5 adımlarını izleyerek). Mevcut numune hacmi düşükse, boru sadece 1 ölü hacimle dengelenebilir.
- Kontrol yazılımında şırınd 1'e tek bir çalıştırma için gereken örnek miktarını epire edin (ayrıntılar için 'Çalışma sırası' bölümüne bakın). Ardından valf 1'i 'dağıtma' konumuna getirin.
- Bağıl nemin istenen değere ulaşmış olup olmadığını kontrol edin (genellikle ızgaraları % 60 bağıl nemde veya daha yüksekte hazırlarız). % 60'≥ neme ulaşıldıktan sonra, yüksek nemi korumak için nem odasını sadece en az bir süre açın.
- Cımbızları, parıltılı bir ızgara tutarak pnömatik pistona yerleştirin ve sabitlayın. Pistonu başlangıç konumuna (üstte) taşıyın.
- Potentiometrenin kaydırıcısının, pistona temas etmek için manuel olarak hareket ettirerek ölçüme hazır, başlangıç konumunda olduğundan emin olun. Osiloskop yazılımındaki osiloskoptaki tetiği ayarlayın.
- Sıvı etan/azot kabını yerleştirin.
- Denetim yazılımında Komut Dosyası Çalıştır'a basın. İstendiğinde, çalıştırmayı başlatmak için denetim yazılımında Tamam'ı tıklatın.
DİkKAT: Çalışma sırası tamamlanana kadar TED'den uzak durun. Hareketli parçalar yaralanmaya neden olabilir! - 'Çalıştırma sırası' tamamlandıktan sonra, kontrol yazılımında Tamam'ı tıklatarak pnömatik piston üzerindeki basıncı bırakın.
- Açık nem odası, bir elinizle dalma kolu ve cımbız arasındaki bağlantıyı gevşetirken, diğer elinizle cımbızı sabitler. Cımbız serbest kaldığında, ızgarayı sıvı etan içinde tutarken dalma kolunu yukarı hareket ettinin. Daha sonra ızgarayı çevredeki sıvı N2'dekidepolama alanına aktarın. Donduktan sonra, ızgaranın her zaman sıvı N2 sıcaklığında tutulması gerekir.
- Osiloskop ölçümünü kaydedin. Daha sonra potentiometre kaydırıcısının ve pistonunun konumunu manuel olarak sıfırlayın.
- Çoğaltma ızgaralarını hazırlamak için 2.4-2.12 adımlarını yineleyin
- Izgara kırpma ve veri toplama süresine kadar ızgaraları uzun süreli depolama alanına aktarın.
- 1.9.1 - 1.9.5 adımlarına göre sistemi tamponla yıkayın. Ardından,1.9.1- 1.9.5 adımlarına göre sistemi H 2 O ile yıkayın.
- Ana azot gazı regülatörü ve gücü kapatın.
- Etan/azot kabını ısınması için bir duman kaputuna yerleştirin ve sıvı etan ve N2'nin buharlaşmasını bırakın.
3. Zaman çözülmüş cryo-EM
NOT: Zaman çözümlenmiş denemeler TED ile gerçekleştirildiğinde, temel kurulum ve değişkenler aynı kalsa da dikkate alınması gereken ek yönler vardır. Burada, ızgarada biriken nihai karışımı üretmek için iki çözeltinin 1:1 (v/v) oranında karıştırıldığı varsayılıyor. '1'de açıklanan protokolü izleyin. Aşağıdaki değişikliklerle TED' ile hızlı ızgara hazırlığı:
- Deneyleri karıştırmak için basit sprey deneylerinden daha yüksek stok konsantrasyonları kullanın. 1:1 (v/v) oranında karıştırma, her bileşenin 2 kat seyreltilmesine neden olur.
- Hızlı bir karıştırma deneyi için, tek bir şırınna değil, üç şırınnayı da kullanın.
- Şırınd pompalarına boru takın 2-3.
- Şırıngam pompalarından boruyu 2-3 püskürtme nozülüne takın.
- Tampondaki üç şırınnayı da aşındırın ve ayrı ayrı örneklenin. Tipik olarak, şırıng 1 örnek A ile doldurulur ve şırıng 2-3 şırıng B örneği ile doldurulur (Şekil 3).
- Çalışma sırasını değiştirin. Hızlı karıştırma deneyi için 3 şırınnanın tümünü kullanan bir çalışma dizisi örneği Şekil 6'da verilmiştir. Ayrıntılar için 'Çalıştırma sırası' bölümüne de bakın.
- Farklı zaman gecikmeleri iki şekilde elde edilebilir:
- Piston hızını değiştirin. Piston hızını ayarlayarak, zaman gecikmesi nispeten dar bir aralıkta değiştirilebilir. Örneğin, 2 cm'lik bir sprey/etan mesafesi ile piston sırasıyla 20 ms veya 10 ms zaman gecikmesi sağlamak için 1 m/s veya 2 m/s'de hareket ettirilebilir. Bu, adım 1.15'te açıklandığı gibi yapılır.
- Püskürtme nozülün (dikey) konumunu ayarlayarak sprey/etan pozisyonunu değiştirin. Nozül etan yüzeyinden 5 cm mesafede konumlandırılırsa, örneğin, 1 m/s'lik bir dalma hızı 50 ms zaman gecikmesi sağlar. Önemli ölçüde daha uzun süre gecikmeler elde etmek, kurulumda daha fazla değişiklik gerektirir.
NOT: Nozülun akış odaklama bölgesindeki laminer akış nedeniyle, nozülun bu kısmında önemli bir karıştırma beklemiyoruz. Bunun yerine, karıştırmanın sprey üretimi sırasında, ızgaraya giden damlacıklarda ve ızgaraya yayılan damlacıklar sırasında gerçekleşmesini bekliyoruz. Sprey damlacıklarının ızgaraya ulaşma süresi 1 ms ≤ tahmin edilmektedir (≥ 10 m/s damlacık hızı ve 1 cm nozül ızgarası mesafesi için). Bu nedenle, sadece damlacık iniş ve vitrifikasyon arasındaki süre 'zaman gecikmesi' olarak kabul edilir.
Sonuçlar
TED ile hızlı ızgara hazırlığı
Hızlı ızgara hazırlama için bir test numunesi olarak, 30 mM HEPES, 150 mM NaCl, pH 7.5'te 20 μM'de at dalağından apoferritin kullandık. 15. ref.(Şekil 7A)bölümünde açıklandığı gibi 690 mikrografiden3.5 Å çözünürlükte bir rekonstrüksiyon elde edildi. Defokus aralığı, parçacıkların ham görüntülerde kolayca tanımlanabilmesi için seçildi (Şekil 7B)...
Tartışmalar
Bu çalışmadaki protokoller doğrudan püskürtme ve TrEM deneyleri ile hızlı şebeke hazırlama için kullanılabilir. Hızlı şebeke hazırlama, hava suyu arayüzü ile parçacık etkileşimlerini azaltmak için kullanılabilir5. Ana sınırlamalar, ızgaradaki mevcut numune konsantrasyonu ve buz kalınlığıdır. Bu sınırlar dahilinde ve numune kalitesinin iyi olması koşuluyla, protokol yüksek çözünürlüklü kriyo-EM için uygun ızgaralar üretir.
Açıklamalar
Hiç kimse.
Teşekkürler
Yardımcı tartışmalar için Molly S.C. Gravett'e ve kriyo-EM veri toplama konusunda yardım için ABSL tesis personeline teşekkür ederiz. David P. Klebl, The Leeds Üniversitesi tarafından finanse edilen Astbury Centre'daki Wellcome Trust 4 yıllık doktora programında doktora öğrencisidir. FEI Titan Krios mikroskopları Leeds Üniversitesi (UoL ABSL ödülü) ve Wellcome Trust (108466/Z/15/Z) tarafından finanse edildi. Bu çalışma Stephen P. Muench'e (BB/P026397/1) bbsrc hibesi ile finanse edildi ve Amerikan Kalp Derneği'nden (AMR21-236078) Howard D. White ve ABD Ulusal Sağlık Enstitüleri'nden (171261) Howard D. White ve Vitold Galkin'e yapılan araştırma hibeleriyle desteklendi.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Time resolved device | |||
| acrylic glass box | USA scientific | ||
| digital humidity/temperature controller | THE20 digital humidity/temperature controller | ||
| dual rod pneumatic cylinder | dual rod pneumatic cylinder TN 10x70 | ||
| FEP tubing | Upchurch Scientific 1/16” O.D., 0.01'' I.D. FEP tubing | ||
| flangeless fittings | Upchurch Scientific ETFE/ETFE flangeless fittings | ||
| flexible reinforced PVC tubing | 12 mm OD. flexible reinforced PVC tubing | ||
| glass syringes | Kloehn 250 µL zero-dead volume | ||
| humidifier pump | Interpret Aqua Air AP3 | ||
| liquid ethane container | from Thermo/FEI VitrobotTM Mark IV | ||
| multistage regulator | GASARC class 3 multistage regulator | ||
| negative pressure tweezers | Dumont N5 Inox B negative pressure tweezers | ||
| oscilloscope | Hantek 6022BE oscilloscope | ||
| PE tubing | Scientific Commodities Inc. 0.043” O.D., 0.015” I.D. PE tubing | ||
| power supply | Mean Well GSM160A24-R7B | ||
| power supply | Wanptek KPS305D power supply | ||
| PU tubing | SMC TU0425 4 mm O.D., 2.5 mm I.D. PU tubing | ||
| regulator | Norgren R72G-2GK-RMN | ||
| slide potentiometer | PS100 slide potentiometer | ||
| solenoid valve | SMC NVJ314M solenoid valve | ||
| syringe drive pumps | Kloehn V6 48K model | ||
| Reagents & Materials | |||
| apoferritin from equine spleen | Sigma-Aldrich, A3660 | ||
| ATP | Sigma-Aldrich, A2383 | ||
| cryo-EM grids | Quantifoil 300 mesh Cu, R 1.2/1.3 | ||
| EGTA | Sigma Aldrich E3889 | ||
| F-actin | Provided by H.D. White (for preparation procedure, see ref. 1) | ||
| glow-discharger | Cressington 208 carbon coater with a glow-discharge unit | ||
| HEPES | Sigma-Aldrich, H7006 | ||
| KAc | Sigma-Aldrich, P1190 | ||
| MgCl2 | Sigma-Aldrich, M8266 | ||
| MOPS | Sigma-Aldrich, M1254 | ||
| NaCl | Sigma-Aldrich, S9888 | ||
| Skeletal muscle myosin S1 | Provided by H.D. White (for preparation procedure, see ref. 2) | ||
| Ref 1 | Spudich, J. A. & Watt, S. The regulation of rabbit skeletal muscle contraction I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of biological chemistry 246, 4866-4871 (1971). | ||
| Ref 2 | White, H. & Taylor, E. Energetics and mechanism of actomyosin adenosine triphosphatase. Biochemistry 15, 5818-5826 (1976). |
Referanslar
- Murphy, B. J., et al. Rotary substates of mitochondrial ATP synthase reveal the basis of flexible F1-Fo coupling. Science. 364, (2019).
- Benton, D. J., Gamblin, S. J., Rosenthal, P. B., Skehel, J. J. Structural transitions in influenza haemagglutinin at membrane fusion pH. Nature. , 1-4 (2020).
- Dance, A. Molecular motion on ice. Nature Methods. , 1-5 (2020).
- D'Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15, 793-795 (2018).
- Klebl, D. P., et al. Need for speed: Examining protein behaviour during cryoEM grid preparation at different timescales. BioRxiv. , (2020).
- Ravelli, R. B., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11, 1-9 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. 197, 220-226 (2017).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195, 190-198 (2016).
- Feng, X., et al. A fast and effective microfluidic spraying-plunging method for high-resolution single-particle cryo-EM. Structure. 25, 663-670 (2017).
- Ashtiani, D., et al. Delivery of femtolitre droplets using surface acoustic wave based atomisation for cryo-EM grid preparation. Journal of Structural Biology. 203, 94-101 (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta Crystallographica Section D: Structural Biology. 75, (2019).
- Mäeots, M. -. E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11, 1-14 (2020).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, (2019).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: from sprays to jets and back. Acta Crystallographica Section D: Structural Biology. 76, (2020).
- White, H., Thirumurugan, K., Walker, M., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144, 246-252 (2003).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. . Protein Complex Assembly. , 59-71 (2018).
- Trebbin, M., et al. Microfluidic liquid jet system with compatibility for atmospheric and high-vacuum conditions. Lab on a Chip. 14, 1733-1745 (2014).
- Klebl, D. P., Sobott, F., White, H. D., Muench, S. P. On-grid and in-flow mixing for time-resolved Cryo-EM. Acta Crystallographica Section D: Structural Biology. , (2021).
- He, S., Scheres, S. H. Helical reconstruction in RELION. Journal of Structural Biology. 198, 163-176 (2017).
- Millar, N. C., Geeves, M. A. The limiting rate of the ATP-mediated dissociation of actin from rabbit skeletal muscle myosin subfragment 1. FEBS Letters. 160, 141-148 (1983).
- Kasas, S., Dumas, G., Dietler, G., Catsicas, S., Adrian, M. Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging. Journal of Microscopy. 211, 48-53 (2003).
- Glaeser, R. M., et al. Defocus-dependent Thon-ring fading. bioRxiv. , (2020).
- Bagshaw, C. A beginner's guide to flow kinetics. The Biochemist. 42, (2020).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır