Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Быстрая подготовка сетки для криоэлектроно-микроскопии с временным разрешением
В этой статье
Резюме
Здесь мы предоставляем подробный протокол для использования устройства быстрого создания сетки как для быстрого изготовления сетки, так и для быстрого смешивания и замораживания для проведения экспериментов с временным разрешением.
Аннотация
Область криоэлектроновой микроскопии (крио-ЭМ) быстро развивается с новым оборудованием и алгоритмами обработки, создавая структуры с более высоким разрешением и информацию о более сложных системах. Подготовка образцов для крио-ЭМ претерпевает аналогичную революцию с новыми подходами, которые разрабатываются для замены традиционных систем блоттинга. К ним относятся использование пьезоэлектрических дозаторов, печати штифтами и прямого распыления. В результате этих разработок скорость подготовки сетки увеличивается от секунд до миллисекунд, предоставляя новые возможности, особенно в области крио-ЭМ с временным разрешением, где белки и субстраты могут быть быстро смешаны перед погружением замораживания, захватывая короткоживущие промежуточные состояния. Здесь мы подробно описываем стандартный протокол для создания сеток на нашем собственном электромагнитном устройстве с временным разрешением как для стандартной быстрой подготовки сети, так и для экспериментов с временным разрешением. Протокол требует минимум около 50 мкл образца в концентрациях ≥ 2 мг/мл для приготовления 4 решеток. Задержка между применением образца и замораживанием может составлять всего 10 мс. Одним из ограничений является увеличение толщины льда на более высоких скоростях и по сравнению с методом блоттинга. Мы надеемся, что этот протокол поможет другим в разработке их собственных устройств для создания сетей и тем, кто заинтересован в разработке экспериментов с временным разрешением.
Введение
Фон
Последние разработки в области криоэлектронотерапии (крио-ЭМ) позволили пролисть структурные исследования все более сложных систем с высоким разрешением. За редким исключением, такие исследования были ограничены биологическими макромолекулами при равновесии1 или относительно медленными реакциями2. Многие процессы in vivo происходят в более быстрой временной шкале (миллисекунды), и на этих временных масштабах3растет интерес к крио-ЭМ с временным разрешением (TrEM). Однако обычная крио-ЭМ подготовка образцов методом блоттинга слишком медленная для миллисекундного TrEM.
Метод блоттинга имеет и другие ограничения, помимо плохого разрешения по времени. Белки и белковые комплексы могут страдать от денатурации или предпочтительной ориентации на сетках4. Было показано, что сокращение времени воздействия на воздушно-водную границе раздела во время пробоподготовки смягчает предпочтительную ориентацию и денатурацию белка5,6. Таким образом, быстрая подготовка сетки не только обеспечивает миллисекундный TrEM, но и может улучшить качество сети.
В настоящее время существует три различных подхода к автоматизированной подготовке сети. Первый подход использует штырь или капилляр, который содержит небольшое количество образца. После установления контакта между жидкостью и поверхностью сетки образец «записывается» на сетку7,8. Процесс подачи примера заявки относительно медленный и занимает несколько секунд. Альтернативный подход использует контролируемую генерацию капель с помощью пьезодиспенсера и самовосхваляющихся сеток9. Это позволяет быстрее дозировать время замерзания, но по-прежнему ограничено скоростью капель и впитывания (в настоящее время достигающей 54 мс). Самым быстрым подходом до сих пор является подход прямого распыления, при котором образец распыляется в распылительном сопле и небольшие (~ 10 - 20 мкм) и быстрые (> 5 м / с) капли распространяются при контакте с крио-ЭМ сеткой. Образец распыления может быть получен различными способами, такими как аэростойные атомайзеры, поверхностные акустические волны или ультразвуковые увлажнители10,11,12,13. По нашему опыту, толщина льда при прямом распылении больше, но прямое распыление позволяет дозировать время замерзания < 10 мс.
Этот протокол описывает пошаговое описание того, как эм-устройство с временным разрешением (TED), оснащенное микрофлюидным распылительным соплом, может быть использовано для подготовки сеток в быстрой шкалевремени 14,15. Устройство использовалось для подготовки сеток с минимальным временем задержки 6 мс между нанесением образца и замораживанием, а также для быстрого смешивания и замораживания двух образцов. Конструкция TED основана на предыдущей версии16 и аналогична другим крио-ЭМ устройствам17на основе распыления с временным разрешением.
Во-первых, описываются четыре основные части установки TED. Ядром TED является блок обработки жидкости, который отвечает за аспирацию и дозирование образцов. Пневматический плунжер перемещает сетку через распыление в жидкий этан. Генерация спрея достигается с помощью микрофлюидных распылительных форсунок, а замораживание производится в жидком этановой емкости, которые кратко описаны. Наконец, выделены дополнительные функции для контроля среды сетки, особенно влажности. За этим следуют подробные протоколы работы устройства и проведения экспериментов TrEM. Репрезентативные результаты приведены для быстрой подготовки сетки и простого эксперимента TrEM.
Экспериментальная установка
Блок обработки жидкостей
Система обработки жидкости TED состоит из трех шприцевых приводных насосов («насосы 1 - 3»), каждый из которых оснащен поворотным клапаном(рисунок 1). Питание обеспечивают насосы 1 - 3 с напряжением 24 В постоянного тока. Связь с управляющим программным обеспечением (написанным на Visual Basic и C++) осуществляется через интерфейс RS232 для насоса 1. Команды распределяются через последовательные порты расширения ввода/вывода от насоса 1 до насосов 2-3. Насосы 1-3 оснащены стеклянными шприцами (шприцы 1-3', здесь мы используем шприцы 250 мкл/нулевой объем мертвого объема). Каждый клапан имеет два положения: «загрузка» и «дозирование». Положение «нагрузка» используется для аспирации образца в шприц. Короткая деталь (~ 3 - 4 см) 1/16" O.D., 0.01′′ I.D. FEP трубка соединена через фланцевые фитинги ETFE/ETFE с «нагрузочной» позицией клапанов 1-3. Этот короткий кусок трубки достигает резервуара для проб (обычно пластиковая трубка объемом 1,5 мл или 0,5 мл). Положение «дозировать» ведет к распылительной форсулке. Соединение между выходом «дозирования» и распылительным соплом производится полиэтиленовой трубкой (длина ~ 20-30 см, 0,043" O.D., 0,015" I.D.), с коротким куском втулки трубки (~ 0,5 см) и фланцевыми фитингами ETFE / ETFE.
Пневматический плунжер
TED использует пневматический плунжер для ускорения сетки и перемещения ее через распыление образцов в контейнер с жидким этаном. Пинцет с отрицательным давлением удерживает сетку, ввинченную в самодельный держатель, который крепится к двухвостковому пневматическому цилиндру(рисунок 2А).
Давление подается из большого баллона с азотным газом (размер W), оснащенного многоступенчатым регулятором (0 - 10 бар, «основное давление»). Гибкая армированная трубка из ПВХ (12 мм O.D.) соединяет регулятор с 12-портовым коллектором, куда азот под давлением подается в сопло и пневматический плунжер. Поток газа через сопло постоянен, регулируется непосредственно в азотном баллоне (основное давление). Соединение с соплом выполнено с помощью pu трубок (4 мм O.D., 2.5 мм I.D.), короткого куска полиэтиленовой трубки (~ 8 см длины, 0,043" O.D., 0.015" I.D.) и соответствующих разъемов. Давление на пневматический плунжер контролируется через электромагнитный клапан. Pu трубка (4 мм O.D., 2.5 мм I.D.) соединяет электромагнитный клапан с регулятором и пневматическим плунжером, чтобы обеспечить снижение давления погружения (≤ основного давления). Электромагнитный клапан управляется компьютером. Схематический обзор установки приведен на рисунке 2B.
Обратите внимание, что при такой установке давление погружения всегда равно или меньше давления распыляемого газа (основного давления). Тем не менее, настройку можно легко изменить, включив второй регулятор перед распылительным соплом, чтобы обеспечить более высокие скорости погружения при низком давлении распыляемого газа. Высокое давление (>> 2 бар) может повредить распылительное сопло PDMS.
ВНИМАНИЕ: Это система под давлением, и «основное давление» всегда должно быть < 7 бар.
Давления от 0,5 до 2 бар обычно используются для пневматического плунжера и показывают приблизительно линейную зависимость между давлением и скоростью (в вертикальном положении распыления). Скорости погружения измеряются с помощью осциллографа, соединенного в линию с потенциометром скольжения (10 кОм) и параллельно с резистором 2 кОм(рисунок 2C). Блок питания обеспечивает потенциометр с напряжением 9 В постоянного тока. В то время как приблизительная скорость погружения устанавливается до эксперимента путем установки давления погружения, потенциометр дает точное считывание скорости после эксперимента.
Распылительные форсунок и контейнер для жидкого этана
Изготовление и эксплуатация газодинамических виртуальных сопел для доставки образцов на основе распыления подробно описаны в другом месте15. Как описано выше, выпускные отверстия "дозирования" клапанов 1-3 соединены с жидкостными входами сопла(фиг.3А). Распыляемый газ под давлением подключается к входному отверстию сопла. Входы в распылительные сопла PDMS таковы, что трубки 0,043" O.D. PE можно использовать напрямую без необходимости в фитингах. Наша конструкция сопла содержит геометрию «струйной в струе» для смешивания двух образцов, аналогичную устройству, описанному в ref.18. Схема конструкции показана на рисунке 3В,микроскопическое изображение сопла показано на рисунке 3С. Компоновка микрофлюидного устройства требует использования трех шприцев для смешивания двух образцов. Распылительная форсунок обычно размещается на расстоянии 1-1,5 см от сетки (во время подачи образца).
Мы используем жидкий этан в качестве криогена, в контейнере с жидким этаном / азотом, как это используется для стандартного метода промокления. Вертикальное расположение чашки жидкого этана достигается с помощью лабораторной подъемной платформы.
Контроль распыления и среды сетки
Плунжер и распылительное сопло содержатся в изготовленной на заказ коробке из ПММА (акрилового стекла) с двойной дверцей(рисунок 4А). Высокая относительная влажность внутри коробки достигается системой увлажнения воздуха в задней части TED(рисунок 4B). Воздух подается насосом и подается в первую 10-дюймовую канистру (обычно используемую для очистки воды под раковиной). Канистра заполнена низким (~ 5-10 см) уровнем воды, а также вмещает увлажнитель воздуха. Сетевое питание увлажнителя контролируется цифровым регулятором влажности/температуры и датчиком влажности/температуры, расположенным внутри акрилового стеклянного ящика. Контроллер настроен на выключение насоса, когда относительная влажность достигает ≥ 90 %. Увлажненный воздух из первой канистры прокачивается через диффузор, погружается в воду во второй 10-дюймовой канистре, а затем поступает в коробку из акрилового стекла.
ПРЕДУПРЕЖДЕНИЕ: Поскольку образец аэрозолируется в распылительном сопле, опасные биологические или химические образцы не подходят в качестве образцов.
Последовательность выполнения
Кнопка Выполнить сценарий в управляют программном обеспечении инициирует последовательность выполнения. Эта последовательность команд может быть предварительно определена в файле скрипта и изменена с помощью программного обеспечения. Наиболее важные переменные объясняются здесь:
Скорость распыления: скорость распыления определяет расход жидкости, используемый шприцевым насосом. Расход можно рассчитать следующим образом: используемые здесь двигатели шприцевого насоса имеют фиксированный размер шага. Полный ассортимент насоса разделен на 48 000 ступеней. Вторым важным фактором является объем шприца. Обычно мы используем шприцы 250 мкл. Скорость распыления в управляемом программном обеспечении устанавливается как количество шагов в секунду. Скорость распыления 1000 шагов в секунду соответствует:
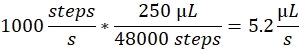
Объем распыления: Объем распыления определяет общий объем распыляемого. Таким образом, он также определяет продолжительность распыления. Объем распыления в управляемом программном обеспечении устанавливается в виде нескольких шагов. Объем распыления 2000 шагов при скорости распыления 1000 шагов в секунду приводит к продолжительности распыления 2 с и общему объему 10,4 мкл.
Время предварительного распыления: эта переменная определяет время между началом распыления и погружением. Важно выбрать время задержки таким образом, чтобы спрей успел стабилизироваться перед погружением сетки. Обычно спрей дают 1,5 - 4 с для стабилизации до погружения сетки. Распыление сохраняется до тех пор, пока сетка не пройдет. Обычно поток жидкости (и, следовательно, распыление) прекращается через 0,5-1 с после погружения сетки. Например, при использовании скорости распыления 1000 шагов / с и объема распыления 2000 шагов типичное время предварительного распыления составляет 1,5 с.
Примерная последовательность команд показана на рисунке 5А,положение сетки во времени показано на рисунке 5B.
протокол
1. Подготовка системы
ПРИМЕЧАНИЕ: Следующий протокол описывает, как подготовить сетки из одного образца. Обычно для каждого образца или условия подготавливается не менее 2 реплицированных сеток. Для более высоких скоростей погружения (задержка времени менее ~ 20 мс) 3 или 4 реплицируемые сетки обычно готовятся для учета уменьшенного количества тонких областей льда.
- Разбавить образец белка до целевой концентрации в нужном буфере. Как правило, конечные концентрации ≥ 2 мг/мл хорошо подоработают для приготовления сетки с TED. Обратите внимание, что образец можно держать на льду до этапа 10, начиная с этапа 10 и далее образец будет проводить значительное время при комнатной температуре, так как для приготовления 3-4 сеток требуется примерно 20 минут.
- Включите TED. Затем включите контрольный ПК и запустите управляя программное обеспечение.
- Инициализируйте все шприцевые насосы, нажав кнопку Initialize (нижняя черная кнопка) на каждом шприцевом насосе.
- Включите блок питания потенциометра, установите его на 9 В и запустите программное обеспечение управления осциллографом.
- Убедитесь, что регулирующий клапан цилиндра N2закрыт. Откройте клапан цилиндра. Затем медленно откройте клапан регулятора, установив давление на выходе на желаемое значение давления распыляемого газа (обычно 1-2 бар). Для сопел PDMS, используемых здесь, не используйте давление выше ~ 2,5 бар, чтобы избежать повреждения сопла. Непрерывно протекающий газ предотвращает капание и накопление жидкости на кончике сопла, что может привести к невоспроизводимому распылению.
- Убедитесь, что все клапаны шприцевого насоса находятся в положении «нагрузки». Это можно сделать, переключив все клапаны в положение «дозирования» в управляемом программном обеспечении, а затем обратно в «загрузку». Оставьте все клапаны включенными в «нагрузку». Установите все шприцы на ноль.
- Удалите все пузырьки воздуха, присутствующие в системе на этом этапе. Для этого шприцы, возможно, придется открутить, пузырьки удалить вручную и снова смонтировать шприцы, когда они больше не содержат пузырьков.
- Компоненты обработки жидкости обычно хранятся в H2O. Перед загрузкой раствора образца уравновешивайте жидкостную систему буфером, промыв трубку с избытком буфера. Используйте соответствующий максимальный расход жидкости, чтобы избежать избыточного давления на распылительной форсуне. Расход жидкости > 10 мкл/с может привести к повреждению сопел PDMS, описанных здесь.
- Поместите на шприц 1,5 мл трубку, содержащую буфер ≥ 200 мкл (верхняя часть должна быть проколота для крепления к трубке).
- Убедитесь, что клапан 1 находится в положении «нагрузки». При необходимости включите управляемый программное обеспечение.
- Аспирируйте желаемое количество (обычно 50-100 мкл) буфера со шприцем 1 через управляющее программное обеспечение.
- Переключите клапан 1 в положение «дозирования» с помощью программного обеспечения управления.
- Дозируйте всю жидкость в шприце 1 с помощью программного обеспечения управления.
- Обратный клапан для 'load', сбросьте положение шприца в '0' в программе и нажмите инициализировать на шприце 1, чтобы подготовить систему к следующему циклу.
ПРИМЕЧАНИЕ: Этапы 1.9.1 - 1.9.5 обычно повторяются три раза для обеспечения тщательной промывки трубки.
- Нагружайте пинцет с помощью электромагнитной сетки (не требуется для какого-либо конкретного типа) путем ослабления зажима погружающего рычага, помещения пинцета в зажим и затягивания зажима.
- Вручную переместите погружной рычаг так, чтобы сетка и сопло были на одной высоте (положение «применение образца»). Если насадка и сетка выровнены, жидкость будет накапливаться на сетке после распыления в течение длительного периода. При необходимости отрегулируйте положение сопла.
- Отрегулируйте положение чашки с жидким этаном, вручную переместив погружной рычаг с установленным пинцетом в его конечное положение (дойдя до этановой чашки). При правильной настройке сетка, удерживаемая пинцетом, достигнет примерно центра чашки жидкого этана.
- Убедитесь, что сценарий запуска будет использовать требуемую скорость потока, объемы и тайминги. Подробности см. в разделе «Последовательность выполнения» выше.
- Убедитесь, что ничто не препятствует пути плунжера. Аспирировать объем буфера, необходимый для одного запуска в шприц 1. Это делается в управляемом программном обеспечении, см. раздел «Последовательность выполнения» для типичных настроек и томов. Затем убедитесь, что клапан 1 переведен в положение «дозирования». Выполните тестовый запуск, нажав кнопку Выполнить сценарий в управляющей программе.
ВНИМАНИЕ: Держитесь подальше от TED до тех пор, пока последовательность выполнения не будет завершена. Движущиеся части могут привести к травмам! - Когда «последовательность запуска» будет завершена, установите давление на погружающую руку на желаемое значение (обычно 1-2 бара). Только после этого нажмите OK в управляющей программе, чтобы снять давление с погружающего рычага. Если необходимо отрегулировать "последовательность выполнения" или давление на погружающуюся руку, эти настройки могут быть изменены на этом этапе и повторены шаги 1.13 - 1.15.
2. Быстрая подготовка сетки
- Заполните контейнер с жидким этаном/азотом сначала жидким азотом. Когда достаточно холодно и без жидкого азота, наполните чашку жидким этаном. Избегайте затвердевания жидкого этана. Этот шаг такой же, как и для обычной подготовки сетки.
ПРИМЕЧАНИЕ: Чтобы свести к минимуму загрязнение этаном, убедитесь, что этапы 2.2 - 2.13 выполняются как можно быстрее.
ВНИМАНИЕ: Жидкий этан является криогеном и легковоспламеняющимся. Следует проявлять осторожность при обращении. - Подготовьте крио-ЭМ сетки для тлеющего разряда. Обычно мы используем дырявые углеродные решетки и тлеющий разряд в течение 90 с при давлении воздуха 0,1 мбар и 10 мА. Обычно одновременно разряжается не более 4 сеток. Сетки используются в течение 30 минут после разрядки свечения.
- Уравновешивайте трубку образцом (следуя этапам 1.9.1 - 1.9.5, используя образец вместо буфера). Если доступный объем пробы низкий, трубка может быть уравновешивается только 1 мертвым объемом.
- Аспирируйте количество образца, необходимое для одного прогона в шприц 1 в управляющей программе (см. раздел «Последовательность выполнения» для получения подробной информации). Затем переключите клапан 1 в положение «дозирования».
- Убедитесь, что относительная влажность достигла желаемого значения (обычно мы готовим сетки при относительной влажности 60 % или выше). Как только ≥ достигнута влажность 60%, открывайте влагоуховую камеру только на минимальное количество времени, чтобы поддерживать высокую влажность.
- Поместите пинцет, держа тлеющий разряд сетки, в пневматический плунжер и зафиксируйте их. Переместите плунжер в начальное положение (вверху).
- Убедитесь, что ползунок потенциометра находится в стартовом положении, готовый к измерению, переместив его вручную, чтобы связаться с плунжером. Установите триггер на осциллографе в программном обеспечении осциллографа.
- Поместите контейнер с жидким этаном/азотом.
- Нажмите Кнопка Выполнить сценарий в управляю. При появлении запроса нажмите кнопку ОК в управляюще, чтобы запустить запуск.
ВНИМАНИЕ: Держитесь подальше от TED до тех пор, пока последовательность выполнения не будет завершена. Движущиеся части могут привести к травмам! - Как только «последовательность запуска» будет завершена, спустите давление на пневматический плунжер, нажав OK в управляющей программе.
- Откройте камеру влажности, ослабьте связь между погружающим рычагом и пинцетей одной рукой, закрепив пинцет другой. Когда пинцет будет свободен, переместите погружающую руку вверх, сохраняя сетку в жидком этане. Затем перенесите сетку в ее место хранения в окружающей жидкостиN2. После замораживания сетка должна постоянно поддерживаться притемпературе жидкости N2.
- Сохраните измерение осциллографа. Вручную сбросьте положение ползунка потенциометра и плунжера после этого.
- Повторите шаги 2.4-2.12 для подготовки реплицированных сеток
- Перенесите сетки в долгосрочное хранилище до обрезки сетки и сбора данных.
- Промывайте систему буфером, согласно шагам 1.9.1 - 1.9.5. Затем промыть систему сH2O, согласно шагам 1.9.1 - 1.9.5.
- Выключите главный регулятор газообразного азота и выключите питание.
- Поместите контейнер с этаном/азотом в вытяжку, чтобы он нагреется и дал жидкости этан иN2 испариться.
3. Крио-ЭМ с временным разрешением
ПРИМЕЧАНИЕ: Когда эксперименты с временным разрешением проводятся с TED, есть дополнительные аспекты, которые необходимо учитывать, хотя базовая настройка и переменные остаются прежними. Здесь предполагается, что два раствора смешивают в соотношении 1:1 (v/v) для получения конечной смеси, которая наносится на сетку. Следуйте протоколу, описанного в '1. Быстрая подготовка сетки с помощью TED', со следующими изменениями:
- Используйте более высокие концентрации запасов для экспериментов по смешиванию, чем для простых экспериментов с распылением. Смешивание в соотношении 1:1 (v/v) приведет к 2-кратному разбавлению каждого компонента.
- Для эксперимента по быстрому смешиванию используйте все три шприца, а не только один.
- Прикрепите трубки к шприцевым насосам 2-3.
- Прикрепите трубку от шприцевых насосов 2-3 к распылительной форсурке.
- Уравновесьте все три шприца в буфере и образце отдельно. Как правило, шприц 1 заполняется образцом А, а шприцы 2-3 заполняются образцом В(фиг.3).
- Измените последовательность выполнения. Пример последовательности выполнения с использованием всех 3 шприцев для эксперимента быстрого смешивания приведен на рисунке 6. Смотрите также раздел «Последовательность выполнения» для получения подробной информации.
- Различные временные задержки могут быть достигнуты двумя способами:
- Измените скорость плунжера. Регулируя скорость плунжера, временная задержка может быть изменена в относительно узком диапазоне. Например, при расстоянии распыления/этана 2 см плунжер можно перемещать со скоростью 1 м/с или 2 м/с, чтобы дать временную задержку 20 мс или 10 мс соответственно. Это делается так, как описано в шаге 1.15.
- Измените положение распыления/этана, отрегулировав (вертикальное) положение распылительного сопла. Например, если сопло расположено на расстоянии 5 см от поверхности этана, скорость погружения 1 м/с дает временную задержку в 50 мс. Достижение значительно более длительных временных задержек требует дальнейших модификаций настройки.
ПРИМЕЧАНИЕ: Из-за ламинарного потока в области фокусировки потока сопла мы не ожидаем значительного перемешивания в этой части сопла. Вместо этого мы ожидаем, что смешивание происходит во время образования распыления, в каплях на пути к сетке и во время распространения капель на сетке. Время полета капель распыления до сетки оценивается ≤ 1 мс (для скорости капель ≥ 10 м/с и расстояния между соплами и сеткой 1 см). Таким образом, только время между посадкой капель и витрификацией считается «временной задержкой».
Результаты
Быстрая подготовка сетки с помощью TED
В качестве тестового образца для быстрой подготовки сетки мы использовали апоферритин из лошадиной селезенки при 20 мкМ в 30 мМ HEPES, 150 мМ NaCl, рН 7,5. Реконструкция с разрешением 3,5 Å была получена из 690 микроснимков, как описано в ссылке
Обсуждение
Протоколы в этой работе могут быть использованы для быстрой подготовки сетки путем прямого распыления и экспериментов TrEM. Быстрая подготовка сетки может быть использована для уменьшения взаимодействия частиц с воздушной водой, границейраздела 5. Основными ограничениями ...
Раскрытие информации
Никакой.
Благодарности
Мы хотели бы поблагодарить Молли С.C. Граветт за полезные обсуждения и персонал absl за помощь в сборе данных крио-ЭМ. Дэвид. Клебл является аспирантом по 4-летней программе PhD Wellcome Trust в Центре Астбери, финансируемом Университетом Лидса. Микроскопы FEI Titan Krios финансировались Университетом Лидса (награда UoL ABSL) и Wellcome Trust (108466/Z/15/Z). Эта работа финансировалась грантом BBSRC Стивену. Мюнху (BB/P026397/1) и поддерживалась исследовательскими грантами Говарду Д. Уайту из Американской кардиологической ассоциации (AMR21-236078) и Говарду Д. Уайту и Витольду Галкину из Национального института здравоохранения США (171261).
Материалы
| Name | Company | Catalog Number | Comments |
| Time resolved device | |||
| acrylic glass box | USA scientific | ||
| digital humidity/temperature controller | THE20 digital humidity/temperature controller | ||
| dual rod pneumatic cylinder | dual rod pneumatic cylinder TN 10x70 | ||
| FEP tubing | Upchurch Scientific 1/16” O.D., 0.01'' I.D. FEP tubing | ||
| flangeless fittings | Upchurch Scientific ETFE/ETFE flangeless fittings | ||
| flexible reinforced PVC tubing | 12 mm OD. flexible reinforced PVC tubing | ||
| glass syringes | Kloehn 250 µL zero-dead volume | ||
| humidifier pump | Interpret Aqua Air AP3 | ||
| liquid ethane container | from Thermo/FEI VitrobotTM Mark IV | ||
| multistage regulator | GASARC class 3 multistage regulator | ||
| negative pressure tweezers | Dumont N5 Inox B negative pressure tweezers | ||
| oscilloscope | Hantek 6022BE oscilloscope | ||
| PE tubing | Scientific Commodities Inc. 0.043” O.D., 0.015” I.D. PE tubing | ||
| power supply | Mean Well GSM160A24-R7B | ||
| power supply | Wanptek KPS305D power supply | ||
| PU tubing | SMC TU0425 4 mm O.D., 2.5 mm I.D. PU tubing | ||
| regulator | Norgren R72G-2GK-RMN | ||
| slide potentiometer | PS100 slide potentiometer | ||
| solenoid valve | SMC NVJ314M solenoid valve | ||
| syringe drive pumps | Kloehn V6 48K model | ||
| Reagents & Materials | |||
| apoferritin from equine spleen | Sigma-Aldrich, A3660 | ||
| ATP | Sigma-Aldrich, A2383 | ||
| cryo-EM grids | Quantifoil 300 mesh Cu, R 1.2/1.3 | ||
| EGTA | Sigma Aldrich E3889 | ||
| F-actin | Provided by H.D. White (for preparation procedure, see ref. 1) | ||
| glow-discharger | Cressington 208 carbon coater with a glow-discharge unit | ||
| HEPES | Sigma-Aldrich, H7006 | ||
| KAc | Sigma-Aldrich, P1190 | ||
| MgCl2 | Sigma-Aldrich, M8266 | ||
| MOPS | Sigma-Aldrich, M1254 | ||
| NaCl | Sigma-Aldrich, S9888 | ||
| Skeletal muscle myosin S1 | Provided by H.D. White (for preparation procedure, see ref. 2) | ||
| Ref 1 | Spudich, J. A. & Watt, S. The regulation of rabbit skeletal muscle contraction I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of biological chemistry 246, 4866-4871 (1971). | ||
| Ref 2 | White, H. & Taylor, E. Energetics and mechanism of actomyosin adenosine triphosphatase. Biochemistry 15, 5818-5826 (1976). |
Ссылки
- Murphy, B. J., et al. Rotary substates of mitochondrial ATP synthase reveal the basis of flexible F1-Fo coupling. Science. 364, (2019).
- Benton, D. J., Gamblin, S. J., Rosenthal, P. B., Skehel, J. J. Structural transitions in influenza haemagglutinin at membrane fusion pH. Nature. , 1-4 (2020).
- Dance, A. Molecular motion on ice. Nature Methods. , 1-5 (2020).
- D'Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15, 793-795 (2018).
- Klebl, D. P., et al. Need for speed: Examining protein behaviour during cryoEM grid preparation at different timescales. BioRxiv. , (2020).
- Ravelli, R. B., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11, 1-9 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. 197, 220-226 (2017).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195, 190-198 (2016).
- Feng, X., et al. A fast and effective microfluidic spraying-plunging method for high-resolution single-particle cryo-EM. Structure. 25, 663-670 (2017).
- Ashtiani, D., et al. Delivery of femtolitre droplets using surface acoustic wave based atomisation for cryo-EM grid preparation. Journal of Structural Biology. 203, 94-101 (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta Crystallographica Section D: Structural Biology. 75, (2019).
- Mäeots, M. -. E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11, 1-14 (2020).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, (2019).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: from sprays to jets and back. Acta Crystallographica Section D: Structural Biology. 76, (2020).
- White, H., Thirumurugan, K., Walker, M., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144, 246-252 (2003).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. . Protein Complex Assembly. , 59-71 (2018).
- Trebbin, M., et al. Microfluidic liquid jet system with compatibility for atmospheric and high-vacuum conditions. Lab on a Chip. 14, 1733-1745 (2014).
- Klebl, D. P., Sobott, F., White, H. D., Muench, S. P. On-grid and in-flow mixing for time-resolved Cryo-EM. Acta Crystallographica Section D: Structural Biology. , (2021).
- He, S., Scheres, S. H. Helical reconstruction in RELION. Journal of Structural Biology. 198, 163-176 (2017).
- Millar, N. C., Geeves, M. A. The limiting rate of the ATP-mediated dissociation of actin from rabbit skeletal muscle myosin subfragment 1. FEBS Letters. 160, 141-148 (1983).
- Kasas, S., Dumas, G., Dietler, G., Catsicas, S., Adrian, M. Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging. Journal of Microscopy. 211, 48-53 (2003).
- Glaeser, R. M., et al. Defocus-dependent Thon-ring fading. bioRxiv. , (2020).
- Bagshaw, C. A beginner's guide to flow kinetics. The Biochemist. 42, (2020).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены