É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação rápida da grade para microscopia crio-elétron resolvida pelo tempo
Neste Artigo
Resumo
Aqui, fornecemos um protocolo detalhado para o uso de um dispositivo de fabricação de grade rápida tanto para a fabricação rápida de grade quanto para a rápida mistura e congelamento para realizar experimentos resolvidos pelo tempo.
Resumo
O campo da microscopia crio-elétron (crio-EM) está se desenvolvendo rapidamente com novos algoritmos de hardware e processamento, produzindo estruturas de maior resolução e informações sobre sistemas mais desafiadores. A preparação da amostra para crio-EM está passando por uma revolução semelhante com novas abordagens sendo desenvolvidas para substituir os sistemas tradicionais de manchas. Estes incluem o uso de distribuidores piezo-elétricos, impressão de pinos e pulverização direta. Como resultado desses desenvolvimentos, a velocidade de preparação da rede está indo de segundos a milissegundos, proporcionando novas oportunidades, especialmente no campo do crio-EM resolvido no tempo, onde proteínas e substratos podem ser rapidamente misturados antes do congelamento do mergulho, prendendo estados intermediários de curta duração. Aqui descrevemos, em detalhes, um protocolo padrão para fazer grades em nosso dispositivo EM resolvido no tempo interno, tanto para preparação padrão de grade rápida quanto para experimentos resolvidos com o tempo. O protocolo requer um mínimo de cerca de 50 μL de amostra em concentrações de ≥ 2 mg/mL para a preparação de 4 grades. O atraso entre aplicação da amostra e congelamento pode ser tão baixo quanto 10 ms. Uma limitação é o aumento da espessura do gelo em velocidades mais rápidas e comparado com o método de mancha. Esperamos que este protocolo ajude outros a projetar seus próprios dispositivos de fabricação de grade e aqueles interessados em projetar experimentos resolvidos com o tempo.
Introdução
Fundo
Desenvolvimentos recentes na microscopia crio-elétron (crio-EM) permitiram estudos estruturais de sistemas cada vez mais complexos em alta resolução. Com poucas exceções, tais estudos têm sido limitados a macromoléculas biológicas em equilíbrio1 ou reações relativamente lentas2. Muitos processos in vivo ocorrem em uma escala de tempo mais rápida (milissegundos) e há um interesse crescente em crio-EM (TrEM) resolvidos no tempo nessas escalas de tempo3. No entanto, a preparação convencional da amostra crio-EM pelo método de manchas é muito lenta para o TrEM de milissegundo.
O método de mancha tem outras limitações além da baixa resolução de tempo. Proteínas e complexos proteicos podem sofrer de desnaturação ou orientação preferencial nas redes4. A redução do tempo de exposição à interface ar-água durante a preparação da amostra tem sido demonstrada para mitigar a orientação preferida e a desnaturação proteica5,6. Assim, a preparação rápida da grade não só permite o TrEM de milissegundos, mas também pode melhorar a qualidade da grade.
Atualmente, existem três abordagens diferentes para a preparação automatizada da rede. A primeira abordagem usa um pino ou capilar que contém uma pequena quantidade de amostra. Após estabelecer contato entre o líquido e a superfície da grade, a amostra é 'escrita' na grade7,8. O processo de aplicação da amostra é relativamente lento e leva alguns segundos. Uma abordagem alternativa usa a geração de gotículas controladas por um distribuidor piezo e grades auto-wicking9. Isso permite dispensar mais rapidamente os tempos de congelamento, mas ainda é limitado pela velocidade de gotícula e pavio (atualmente atingindo 54 ms). A abordagem mais rápida até agora é a abordagem direta de pulverização, na qual a amostra é atomizada em um bocal de spray e as gotículas pequenas (~ 10 - 20 μm) e rápidas (> 5 m/s) espalhadas após o contato com a grade crio-EM. O spray de amostra pode ser gerado de diferentes maneiras, como atomizadores do airblast, ondas acústicas de superfície ou umidificadores ultrassônicos10,11,12,13. Em nossa experiência, a espessura do gelo com a abordagem de pulverização direta é maior, mas a pulverização direta permite dispensar vezes < 10 ms.
Este protocolo descreve passo a passo como um dispositivo EM (TED) resolvido com o tempo equipado com um bocal de pulverização microfluido pode ser usado para preparar grades em uma escala de tempo rápida14,15. O dispositivo tem sido usado para preparar grades com um tempo mínimo de atraso de 6 ms entre aplicação da amostra e congelamento e para misturar e congelar rapidamente duas amostras. O design do TED é baseado em uma versão anterior16 e é semelhante a outros dispositivos crio-EM resolvidos com spray17.
Primeiro, as quatro partes principais da configuração TED são descritas. O núcleo do TED é a unidade de manuseio líquido, que é responsável pela aspiração e dispensação da amostra. Um êmbolo pneumático move a grade através do spray para o etano líquido. A geração do spray é alcançada com bicos de spray microfluidos e o congelamento é feito em um recipiente de etano líquido, que são descritos brevemente. Por fim, destacam-se as características adicionais para controlar o ambiente da rede, especialmente a umidade. Isso é seguido por protocolos detalhados para o funcionamento do dispositivo e para a realização de experimentos TrEM. Os resultados representativos são dados para a preparação rápida da grade e um simples experimento TrEM.
Configuração experimental
A unidade de manuseio líquido
O sistema de manuseio líquido do TED é formado por três bombas de acionamento de seringa ('bombas 1 - 3'), cada uma equipada com uma válvula rotativa(Figura 1). Uma fonte de alimentação fornece bombas 1 - 3 com DC 24 V. A comunicação com o software de controle (escrito em Visual Basic e C++) é através de uma interface RS232 para bombear 1. Os comandos são distribuídos através das portas de expansão de I/O serial da bomba 1 às bombas 2-3. As bombas 1-3 são equipadas com seringas de vidro (seringas de vidro 1-3', usamos 250 seringas de volume morto 250 μL/zero aqui). Cada válvula tem duas posições, 'carregar' e 'dispensar'. A posição 'carga' é usada para aspirar amostra na seringa. Uma peça curta (~ 3 - 4 cm) de 1/16" O.D., 0,01′′ A tubulação FEP é conectada através de encaixes ETFE/ETFE flangeless à posição de 'carga' das válvulas 1-3. Este pequeno pedaço de tubulação atinge o reservatório de amostras (tipicamente um tubo plástico de 1,5 mL ou 0,5 mL). A posição 'dispensar' leva ao bocal de pulverização. A conexão entre a tomada 'dispense' e o bocal de spray é feita por tubos pe (~ 20-30 cm de comprimento, 0,043" O.D., 0,015" I.D.), com um pequeno pedaço de tubo de manga (~ 0,5 cm) e encaixes etfe/ETFE flangeless.
O êmbolo pneumático
O TED usa um êmbolo pneumático para acelerar a rede e movê-la através do spray de amostra para o recipiente de etano líquido. Pinças de pressão negativa seguram a grade, aparafusadas em um suporte construído em casa que é montado em um cilindro pneumático de haste dupla(Figura 2A).
A pressão é fornecida a partir de um grande cilindro de gás nitrogênio (tamanho W), equipado com um regulador multiestáquia (0 -10 bar, 'pressão principal'). A tubulação de PVC reforçado flexível (12 mm O.D.) conecta o regulador a um coletor de 12 portas onde o nitrogênio pressurizado é entregue ao bocal e ao êmbolo pneumático. O fluxo de gás através do bocal é constante, regulado diretamente no cilindro de nitrogênio (pressão principal). A conexão com o bocal é feita com tubos PU (4 mm O.D., 2,5 mm I.D.), um pequeno pedaço de tubo de PE (~ 8 cm de comprimento, 0,043" O.D., 0,015" I.D.) e conectores apropriados. A pressão no êmbolo pneumático é controlada através de uma válvula solenoide. O tubo PU (4 mm O.D., 2,5 mm I.D.) conecta a válvula solenoide com um regulador e o êmbolo pneumático, para permitir uma pressão de mergulho reduzida (≤ pressão principal). A válvula solenoide é controlada por computador. Uma visão geral esquemática da configuração é dada na Figura 2B.
Observe que com esta configuração a pressão de mergulho é sempre igual ou menor do que a pressão do gás de pulverização (pressão principal). No entanto, a configuração pode ser facilmente alterada incorporando um segundo regulador a montante do bocal de pulverização para permitir velocidades de mergulho mais altas em baixa pressão de gás de pulverização. Altas pressões (>> 2 barras) podem danificar o bocal de spray PDMS.
ATENÇÃO: Trata-se de um sistema pressurizado e a "pressão principal" deve ser sempre < 7 bar.
Pressões entre 0,5 e 2 barras são tipicamente usadas para o êmbolo pneumático e mostram uma relação aproximadamente linear entre pressão e velocidade (na posição vertical do spray). As velocidades de mergulho são medidas com um osciloscópio, conectado em linha com um potencializador de slides (10 kΩ) e em paralelo com um resistor de 2 kΩ(Figura 2C). Uma fonte de alimentação fornece o potencialiômetro com 9 V DC. Enquanto a velocidade de mergulho aproximada é definida antes do experimento, definindo a pressão de mergulho, o potencialiômetro dá uma leitura precisa da velocidade após o experimento.
Bicos de spray e recipiente de etano líquido
A fabricação e operação de bicos virtuais dinâmicos a gás para entrega de amostras baseadas em spray foi descrita em outros lugares no detalhe15. Como descrito acima, as saídas 'dispensar' das válvulas 1-3 estão conectadas às entradas líquidas do bocal(Figura 3A). O gás pressurizado está conectado à entrada de gás do bocal. As entradas nos bicos de spray PDMS são tais que a tubulação de PE de 0,043" pode ser usada diretamente sem a necessidade de conexões. Nosso design de bocal contém uma geometria "jet-in-jet" para a mistura de duas amostras, semelhante ao dispositivo descrito no ref.18. Um esquema do design é mostrado na Figura 3B, uma imagem microscópica de um bocal é mostrada na Figura 3C. O layout do dispositivo microfluido requer o uso de três seringas para misturar duas amostras. O bocal de pulverização é normalmente posicionado a 1-1,5 cm de distância da grade (durante a aplicação da amostra).
Usamos etano líquido como criogen, em um recipiente líquido de etano/nitrogênio, como usado para o método padrão de manchas. O posicionamento vertical do copo de etano líquido é alcançado com uma plataforma de elevação de laboratório.
Controle do ambiente de pulverização e grade
O bocal de êmbolo e spray estão contidos dentro de uma caixa pmma personalizada (vidro acrílico) com uma porta dupla(Figura 4A). A alta umidade relativa dentro da caixa é alcançada por um sistema de umidificação do ar na parte de trás do TED (Figura 4B). O ar é fornecido por uma bomba e alimentado em um primeiro recipiente de 10" (normalmente usado para purificação de água do pia). O recipiente é preenchido com um nível baixo (~ 5-10 cm) de água e também abriga uma unidade umidificador. A potência da rede do umidificador é controlada por um controlador de umidade/temperatura digital e um sensor de umidade/temperatura localizado dentro da caixa de vidro acrílico. O controlador está pronto para desligar a bomba quando a umidade relativa atingir ≥ 90 %. O ar umidificado do primeiro recipiente é bombeado através de um difusor, imerso em água em um segundo recipiente de 10" e, em seguida, entra na caixa de vidro acrílico.
ATENÇÃO: Como a amostra é aerossolizada no bocal de spray, amostras biológicas ou químicas perigosas não são adequadas como amostras.
A sequência de execução
O botão Executar script no software de controle inicia a sequência de execução. Esta sequência de comandos pode ser pré-definida em um arquivo de script e alterada através do software. As variáveis mais importantes são explicadas aqui:
Velocidade do spray: A velocidade do pulverizador determina a taxa de fluxo de líquido usada pela bomba de seringa. A taxa de fluxo pode ser calculada da seguinte forma: Os motores da bomba de seringa utilizados aqui têm um tamanho de passo fixo. A gama completa da bomba é dividida em 48.000 passos. O segundo fator importante é o volume da seringa. Normalmente usamos seringas de 250 μL. A velocidade de pulverização no software de controle é definida como número de passos/segundo. Uma velocidade de pulverização de 1000 passos/segundo corresponde a:
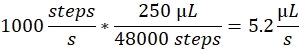
Volume de pulverização: O volume do spray determina o volume total a ser pulverizado. Assim, também determina a duração do spray. O volume de pulverização no software de controle é definido como uma série de etapas. Um volume de pulverização de 2000 passos, a uma velocidade de pulverização de 1000 passos/segundo, leva a uma duração de pulverização de 2 s e um volume total de 10,4 μL.
Tempo de pré-pulverização: Esta variável define o tempo entre o início do spray e o mergulho. É importante escolher o tempo de atraso para que o spray tenha tempo suficiente para estabilizar antes de mergulhar na grade. Normalmente, o spray é dado 1,5 - 4 s para estabilizar antes que a grade seja mergulhada. O spray é mantido até que a rede se move. Normalmente, o fluxo líquido (e, portanto, o spray) é interrompido de 0,5 a 1 s depois que a rede foi mergulhada. Usando uma velocidade de pulverização de 1000 passos/s e um volume de spray de 2000 passos, um tempo típico de pré-pulverização é de 1,5 s, por exemplo.
Uma sequência exemplar de comandos é mostrada na Figura 5A, a posição da grade ao longo do tempo é ilustrada na Figura 5B.
Protocolo
1. Preparando o sistema
NOTA: O protocolo a seguir descreve como preparar grades de uma única amostra. Normalmente, um mínimo de 2 grades de replicação são preparados para cada amostra ou condição. Para velocidades de mergulho mais rápidas (menos de ~ 20 ms de atraso de tempo), 3 ou 4 redes de réplica são tipicamente preparadas para explicar um número reduzido de áreas de gelo finas.
- Diluir a amostra de proteína para a concentração alvo no buffer desejado. Normalmente, as concentrações finais ≥ 2 mg/mL funcionam bem para a preparação da grade com o TED. Observe que a amostra pode ser mantida no gelo até o passo 10, a partir do passo 10 em diante a amostra passará um tempo considerável à temperatura ambiente, pois leva aproximadamente 20 minutos para preparar 3-4 grades.
- Ligue o TED. Em seguida, ligue o PC de controle e inicie o software de controle.
- Inicialize todas as bombas de seringa pressionando o botão Initialize (botão preto inferior) em cada bomba de seringa.
- Ligue a fonte de alimentação do potencialiômetro, coloque-a em 9 V e inicie o software de controle do osciloscópio.
- Certifique-se de que a válvula reguladora do cilindro N2esteja fechada. Abra a válvula do cilindro. Em seguida, abra lentamente a válvula reguladora definindo a pressão de saída para o valor desejado para a pressão do gás de pulverização (tipicamente 1-2 barra). Para os bocais PDMS usados aqui, não use pressões superiores a ~ 2,5 barras para evitar danos ao bocal. O gás que flui continuamente evita que o líquido escorra e se acumule na ponta do bocal que pode levar a pulverização irreprodutível.
- Certifique-se de que todas as válvulas da bomba de seringa estão na posição 'carga'. Isso pode ser feito mudando todas as válvulas para a posição de 'dispensar' no software de controle e, em seguida, voltar para 'carregar'. Deixe todas as válvulas comuts para 'carregar'. Coloque todas as seringas a zero.
- Remova quaisquer bolhas de ar presentes no sistema nesta fase. Para isso, as seringas podem ter que ser desparafusadas, bolhas removidas manualmente e as seringas montadas novamente quando não contêm mais bolhas.
- Os componentes de manuseio líquido são geralmente armazenados em H2O. Antes de carregar a solução amostral, equilibre o sistema líquido com tampão lavando a tubulação com um excesso de tampão. Use uma taxa de fluxo líquido máxima apropriada para evitar a sobrepressão no bocal do spray. Fluxos líquidos > 10 μL/s podem causar danos aos bicos PDMS descritos aqui.
- Coloque um tubo de 1,5 mL contendo ≥ tampão de 200 μL sobre a seringa 1 (a parte superior deve ser perfurada para fixar-se à tubulação).
- Certifique-se de que a válvula 1 está na posição 'carregar'. Troque o software de controle, se necessário.
- Aspire a quantidade desejada (tipicamente 50-100 μL) de tampão com seringa 1, através do software de controle.
- Mude a válvula 1 para a posição 'dispense', através do software de controle.
- Dispense todo o líquido na seringa 1, através do software de controle.
- Volte a válvula para 'carregar', reinicie a posição da seringa para '0' no programa e pressione inicializar sobre a seringa 1, para preparar o sistema para o próximo ciclo.
NOTA: As etapas 1.9.1 - 1.9.5 geralmente são repetidas três vezes para garantir a lavagem completa da tubulação.
- Carregue pinças com uma grade EM (sem necessidade de qualquer tipo específico) afrouxando o grampo do braço mergulhando, colocando a pinça no grampo e apertando o grampo.
- Mova manualmente o braço mergulhando para que a grade e o bocal estejam na mesma altura (a posição de "aplicação da amostra"). Se o bocal e a grade estiverem alinhados, o líquido se acumulará na rede após a pulverização por um longo período. Se necessário, ajuste a posição do bocal.
- Ajuste a posição do copo de etano líquido movendo manualmente o braço mergulhando com pinças montadas para sua posição final (alcançando o copo de etano). Quando configurada corretamente, uma grade mantida pelas pinças atingirá aproximadamente o centro do copo de etano líquido.
- Verifique se o 'script de execução' usará as taxas de fluxo, volumes e tempos desejados. Consulte a seção 'A sequência de execução' acima para obter detalhes.
- Certifique-se de que nada está obstruindo o caminho do êmbolo. Aspire o volume de buffer necessário para uma única corrida em seringa 1. Isso é feito no software de controle, consulte a seção 'A sequência de execução' para configuração e volumes típicos. Em seguida, certifique-se de que a válvula 1 seja comutada para a posição 'dispensar'. Execute um teste executado pressionando Executar script no software de controle.
ATENÇÃO: Fique afastado do TED até que a sequência de execução esteja concluída. Mover partes pode causar ferimentos! - Quando a 'sequência de execução' estiver concluída, coloque a pressão no braço mergulhando no valor desejado (tipicamente 1-2 barra). Só então pressione OK no software de controle para liberar a pressão do braço mergulhando. Se a 'sequência de execução' ou pressão no braço de mergulho precisar ser ajustada, essas configurações podem ser alteradas nesta fase e as etapas 1.13 - 1.15 repetidas.
2. Preparação rápida da grade
- Encha primeiro o recipiente de etano/nitrogênio líquido com nitrogênio líquido. Quando estiver suficientemente frio e livre de nitrogênio líquido, encha o copo com etano líquido. Evite a solidificação do etano líquido. Esta etapa é a mesma da preparação convencional da grade.
NOTA: Para minimizar a contaminação do etano, certifique-se de que as etapas 2.2 - 2.13 sejam realizadas o mais rápido possível
ATENÇÃO: O etano líquido é um criogen e inflamável. Deve-se tomar cuidado ao manusear. - Prepare grades crio-EM para descarga de brilho. Normalmente usamos redes de carbono furos e descarga de brilho para 90 s, a 0,1 mbar de pressão de ar e 10 mA. Normalmente, não mais do que 4 grades são descarregadas de brilho de cada vez. As grades são usadas dentro de 30 minutos de descarga de brilho.
- Equilibre a tubulação com amostra (seguindo as etapas 1.9.1 - 1.9.5, usando amostra em vez de tampão). Se o volume amostral disponível for baixo, o tubo pode ser equilibrado com apenas 1 volume morto.
- Aspire a quantidade de amostra necessária para uma única corrida em seringa 1 no software de controle (consulte a seção 'A sequência de execução' para obter detalhes). Em seguida, troque a válvula 1 para a posição 'dispensar'.
- Verifique se a umidade relativa atingiu o valor desejado (normalmente preparamos grades a 60 % de umidade relativa ou superior). Uma vez que ≥ 60 % de umidade é atingida, abra a câmara de umidade apenas por um período mínimo de tempo, para manter a alta umidade.
- Coloque a pinça, segurando uma grade com descarga de brilho, no êmbolo pneumático e fixe-as. Mova o êmbolo para sua posição inicial (na parte superior).
- Certifique-se de que o controle deslizante do potencialiômetro está na posição inicial, pronto para a medição, movendo-o manualmente para entrar em contato com o êmbolo. Defina o gatilho no osciloscópio no software osciloscópio.
- Coloque o recipiente de etano/nitrogênio líquido.
- Pressione o Script de execução no software de controle. Quando solicitado, clique em OK no software de controle para iniciar a execução.
ATENÇÃO: Fique afastado do TED até que a sequência de execução esteja concluída. Mover partes pode causar ferimentos! - Uma vez concluída a 'sequência de execução', solte a pressão no êmbolo pneumático clicando EM OK no software de controle.
- Abra a câmara de umidade, solte a conexão entre o braço mergulhando e a pinça com uma mão enquanto protege a pinça com a outra. Quando a pinça estiver livre, mova o braço para cima enquanto mantém a grade no etano líquido. Em seguida, transfira a rede para o seu espaço de armazenamento no líquido circundante N2. Depois de congelar, a rede precisa ser mantida à temperatura líquida N2 o tempo todo.
- Salve a medição do osciloscópio. Reinicie manualmente a posição do controle deslizante e do êmbolo do potencialiômetro posteriormente.
- Repetir passos 2.4-2.12 para preparar grades de replicação
- Transfira as grades para armazenamento a longo prazo até o recorte da rede e a coleta de dados.
- Lave o sistema com buffer, de acordo com as etapas 1.9.1 - 1.9.5. Em seguida, lave o sistema com H2O, de acordo com as etapas 1.9.1 - 1.9.5.
- Desligue o principal regulador de gás nitrogênio e desligue a energia.
- Coloque o recipiente de etano/nitrogênio em um capô de fumaça para deixá-lo aquecer e deixar o etano líquido e n2 evaporar.
3. Crio-EM resolvido pelo tempo
NOTA: Quando os experimentos resolvidos pelo tempo são realizados com o TED, há aspectos adicionais a serem considerados, embora a configuração básica e as variáveis permaneçam as mesmas. Supõe-se aqui que duas soluções são misturadas em uma proporção de 1:1 (v/v) para produzir a mistura final que é depositada na grade. Siga o protocolo descrito em 1º. Preparação rápida da grade com o TED', com as seguintes alterações:
- Use concentrações de estoque mais altas para misturar experimentos do que para experimentos simples de spray. A mistura em uma relação 1:1 (v/v) resultará em uma diluição de 2x de cada componente.
- Para um experimento de mistura rápida, use todas as três seringas em vez de apenas uma única.
- Anexar tubos às bombas de seringa 2-3.
- Anexar tubos das bombas de seringa 2-3 ao bocal de pulverização.
- Equilibre as três seringas em tampão e amostra separadamente. Normalmente, a seringa 1 é preenchida com amostra A e as seringas 2-3 são preenchidas com amostra B(Figura 3).
- Mude a sequência de execução. Um exemplo para uma sequência de execução usando todas as 3 seringas para um experimento de mixagem rápida é dado na Figura 6. Consulte também a seção 'A sequência de execução' para obter detalhes.
- Diferentes atrasos de tempo podem ser alcançados de duas maneiras:
- Mude a velocidade do êmbolo. Ajustando a velocidade do êmbolo, o atraso de tempo pode ser alterado em uma faixa relativamente estreita. Por exemplo, com uma distância de spray/etano de 2 cm, o êmbolo pode ser movido a 1 m/s ou 2 m/s para dar um atraso de tempo de 20 ms ou 10 ms, respectivamente. Isso é feito como descrito na etapa 1.15.
- Altere a posição de pulverização/etano ajustando a posição (vertical) do bocal de pulverização. Se o bocal estiver posicionado a uma distância de 5 cm da superfície do etano, por exemplo, uma velocidade de mergulho de 1 m/s dá um atraso de tempo de 50 ms. Alcançar atrasos de tempo significativamente maiores requer mais modificações na configuração.
NOTA: Devido ao fluxo laminar na região de foco de fluxo do bocal, não esperamos uma mistura significativa nesta parte do bocal. Em vez disso, esperamos que a mistura ocorra durante a geração de spray, em gotículas a caminho da grade e durante a propagação de gotículas na grade. O tempo de voo para gotículas de spray para chegar à rede é estimado ≤ 1 ms (para uma velocidade de gotícula de ≥ 10 m/s e uma distância de grade de bocal de 1 cm). Assim, apenas o tempo entre o pouso de gotícula e a vitrificação é considerado o "atraso de tempo".
Resultados
Preparação rápida da grade com o TED
Como uma amostra de teste para preparação rápida da grade, usamos apoferritina do baço de equino a 20 μM em 30 mM HEPES, 150 mM NaCl, pH 7.5. Uma reconstrução com resolução de 3,5 Å foi obtida a partir de 690 micrografos descritos no ref.15 (Figura 7A). A faixa de desfocus foi escolhida para que as partículas possam ser facilmente identificadas nas imagens brutas(Figura 7B
Discussão
Os protocolos neste trabalho podem ser usados para preparação rápida da grade por pulverização direta e experimentos TrEM. A preparação rápida da grade pode ser usada para reduzir as interações de partículas com a interface de água do ar5. As principais limitações são a concentração amostral disponível e a espessura do gelo na rede. Dentro desses limites e desde que a qualidade da amostra seja boa, o protocolo produz grades adequadas para crio-EM de alta resolução.
Divulgações
Nenhum.
Agradecimentos
Gostaríamos de agradecer a Molly S.C. Gravett por discussões úteis e a equipe de instalações da ABSL por ajuda com a coleta de dados crio-EM. David P. Klebl é um estudante de doutorado no programa de doutorado de 4 anos da Wellcome Trust no Centro Astbury financiado pela Universidade de Leeds. Os microscópios FEI Titan Krios foram financiados pela Universidade de Leeds (prêmio UoL ABSL) e Wellcome Trust (108466/Z/15/Z). Este trabalho foi financiado por uma subvenção do BBSRC para Stephen P. Muench (BB/P026397/1) e apoiado por bolsas de pesquisa para Howard D. White da American Heart Association (AMR21-236078) e Howard D. White e Vitold Galkin dos Institutos Nacionais de Saúde dos EUA (171261).
Materiais
| Name | Company | Catalog Number | Comments |
| Time resolved device | |||
| acrylic glass box | USA scientific | ||
| digital humidity/temperature controller | THE20 digital humidity/temperature controller | ||
| dual rod pneumatic cylinder | dual rod pneumatic cylinder TN 10x70 | ||
| FEP tubing | Upchurch Scientific 1/16” O.D., 0.01'' I.D. FEP tubing | ||
| flangeless fittings | Upchurch Scientific ETFE/ETFE flangeless fittings | ||
| flexible reinforced PVC tubing | 12 mm OD. flexible reinforced PVC tubing | ||
| glass syringes | Kloehn 250 µL zero-dead volume | ||
| humidifier pump | Interpret Aqua Air AP3 | ||
| liquid ethane container | from Thermo/FEI VitrobotTM Mark IV | ||
| multistage regulator | GASARC class 3 multistage regulator | ||
| negative pressure tweezers | Dumont N5 Inox B negative pressure tweezers | ||
| oscilloscope | Hantek 6022BE oscilloscope | ||
| PE tubing | Scientific Commodities Inc. 0.043” O.D., 0.015” I.D. PE tubing | ||
| power supply | Mean Well GSM160A24-R7B | ||
| power supply | Wanptek KPS305D power supply | ||
| PU tubing | SMC TU0425 4 mm O.D., 2.5 mm I.D. PU tubing | ||
| regulator | Norgren R72G-2GK-RMN | ||
| slide potentiometer | PS100 slide potentiometer | ||
| solenoid valve | SMC NVJ314M solenoid valve | ||
| syringe drive pumps | Kloehn V6 48K model | ||
| Reagents & Materials | |||
| apoferritin from equine spleen | Sigma-Aldrich, A3660 | ||
| ATP | Sigma-Aldrich, A2383 | ||
| cryo-EM grids | Quantifoil 300 mesh Cu, R 1.2/1.3 | ||
| EGTA | Sigma Aldrich E3889 | ||
| F-actin | Provided by H.D. White (for preparation procedure, see ref. 1) | ||
| glow-discharger | Cressington 208 carbon coater with a glow-discharge unit | ||
| HEPES | Sigma-Aldrich, H7006 | ||
| KAc | Sigma-Aldrich, P1190 | ||
| MgCl2 | Sigma-Aldrich, M8266 | ||
| MOPS | Sigma-Aldrich, M1254 | ||
| NaCl | Sigma-Aldrich, S9888 | ||
| Skeletal muscle myosin S1 | Provided by H.D. White (for preparation procedure, see ref. 2) | ||
| Ref 1 | Spudich, J. A. & Watt, S. The regulation of rabbit skeletal muscle contraction I. Biochemical studies of the interaction of the tropomyosin-troponin complex with actin and the proteolytic fragments of myosin. Journal of biological chemistry 246, 4866-4871 (1971). | ||
| Ref 2 | White, H. & Taylor, E. Energetics and mechanism of actomyosin adenosine triphosphatase. Biochemistry 15, 5818-5826 (1976). |
Referências
- Murphy, B. J., et al. Rotary substates of mitochondrial ATP synthase reveal the basis of flexible F1-Fo coupling. Science. 364, (2019).
- Benton, D. J., Gamblin, S. J., Rosenthal, P. B., Skehel, J. J. Structural transitions in influenza haemagglutinin at membrane fusion pH. Nature. , 1-4 (2020).
- Dance, A. Molecular motion on ice. Nature Methods. , 1-5 (2020).
- D'Imprima, E., et al. Protein denaturation at the air-water interface and how to prevent it. Elife. 8, 42747 (2019).
- Noble, A. J., et al. Reducing effects of particle adsorption to the air-water interface in cryo-EM. Nature Methods. 15, 793-795 (2018).
- Klebl, D. P., et al. Need for speed: Examining protein behaviour during cryoEM grid preparation at different timescales. BioRxiv. , (2020).
- Ravelli, R. B., et al. Cryo-EM structures from sub-nl volumes using pin-printing and jet vitrification. Nature Communications. 11, 1-9 (2020).
- Arnold, S. A., et al. Blotting-free and lossless cryo-electron microscopy grid preparation from nanoliter-sized protein samples and single-cell extracts. Journal of Structural Biology. 197, 220-226 (2017).
- Razinkov, I., et al. A new method for vitrifying samples for cryoEM. Journal of Structural Biology. 195, 190-198 (2016).
- Feng, X., et al. A fast and effective microfluidic spraying-plunging method for high-resolution single-particle cryo-EM. Structure. 25, 663-670 (2017).
- Ashtiani, D., et al. Delivery of femtolitre droplets using surface acoustic wave based atomisation for cryo-EM grid preparation. Journal of Structural Biology. 203, 94-101 (2018).
- Rubinstein, J. L., et al. Shake-it-off: a simple ultrasonic cryo-EM specimen-preparation device. Acta Crystallographica Section D: Structural Biology. 75, (2019).
- Mäeots, M. -. E., et al. Modular microfluidics enables kinetic insight from time-resolved cryo-EM. Nature Communications. 11, 1-14 (2020).
- Kontziampasis, D., et al. A cryo-EM grid preparation device for time-resolved structural studies. IUCrJ. 6, (2019).
- Klebl, D. P., et al. Sample deposition onto cryo-EM grids: from sprays to jets and back. Acta Crystallographica Section D: Structural Biology. 76, (2020).
- White, H., Thirumurugan, K., Walker, M., Trinick, J. A second generation apparatus for time-resolved electron cryo-microscopy using stepper motors and electrospray. Journal of Structural Biology. 144, 246-252 (2003).
- Kaledhonkar, S., Fu, Z., White, H., Frank, J. . Protein Complex Assembly. , 59-71 (2018).
- Trebbin, M., et al. Microfluidic liquid jet system with compatibility for atmospheric and high-vacuum conditions. Lab on a Chip. 14, 1733-1745 (2014).
- Klebl, D. P., Sobott, F., White, H. D., Muench, S. P. On-grid and in-flow mixing for time-resolved Cryo-EM. Acta Crystallographica Section D: Structural Biology. , (2021).
- He, S., Scheres, S. H. Helical reconstruction in RELION. Journal of Structural Biology. 198, 163-176 (2017).
- Millar, N. C., Geeves, M. A. The limiting rate of the ATP-mediated dissociation of actin from rabbit skeletal muscle myosin subfragment 1. FEBS Letters. 160, 141-148 (1983).
- Kasas, S., Dumas, G., Dietler, G., Catsicas, S., Adrian, M. Vitrification of cryoelectron microscopy specimens revealed by high-speed photographic imaging. Journal of Microscopy. 211, 48-53 (2003).
- Glaeser, R. M., et al. Defocus-dependent Thon-ring fading. bioRxiv. , (2020).
- Bagshaw, C. A beginner's guide to flow kinetics. The Biochemist. 42, (2020).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados