Method Article
在体内 小鼠劣质橄榄中的钙成像
摘要
我们提出一个协议,从心室侧暴露成年小鼠的脑系统。通过使用带微型显微镜的梯度折射指数透镜,钙成像可用于检查体内低劣橄榄神经索玛塔的活性。
摘要
劣质橄榄(IO)是心室中核中的一个核,是攀爬纤维的唯一来源,形成进入小脑的两条输入通道之一。长期以来,IO一直被认为是运动控制的关键,其活动目前被认为是小脑运动和认知功能的许多假设的中心。虽然其生理和功能 在体外单细胞水平上得到了较好的研究,但目前还没有关于活体动物IO网络活动的组织报告。这主要是因为 IO 的解剖位置极具挑战性,因此很难采用传统的荧光成像方法,即必须通过整个大脑在感兴趣的区域内创建一条光学路径。
在这里,我们描述了从 IO 网络获取最新水平的钙成像数据的替代方法。该方法利用 IO 的极端腹腔位置,并涉及通过颈部内脏插入梯度折射指数 (GRIN) 透镜的外科手术,以接触麻醉小鼠中钙传感器 GCaMP6s 表达 IO 的腹腔表面。显示具有代表性的钙成像记录,以证明在手术后记录 IO 神经元活动的可行性。虽然这是一个非生存手术,录音必须在麻醉下进行,它避免了对生命临界脑系统核的损害,并允许进行各种各样的实验,调查空间活动模式和输入集成在IO。此程序具有修改可用于在心室脑系统的其他相邻区域进行记录。
引言
系统神经科学的主要目标是了解神经元网络的空间活动模式如何促进动物行为的生成。因此,利用钙敏感探针的荧光成像方法在过去十年中已成为研究活体动物神经元网络活动的主要工具,因为它允许在从单个细胞到中尺度电路等空间尺度上可视化这些动态。近年来,通过透明颅窗3对表面大脑结构(如大脑或脑皮质)中的神经回路进行成像的常见方法,辅之以梯度折射索引(GRIN)镜头4,允许检查深层大脑结构中的网络动力学。目前可用的GLEN镜片允许进入几毫米深的结构,如小鼠杏仁核,海马和基底黑猩猩5。然而,许多感兴趣的区域,如心室中的各种核,都位于显著更深的位置,将它们置于GRN镜头到达的极致。
在这里,我们描述了如何克服这一困难,利用通过大脑的腹腔方面相对容易获得的美杜拉。我们使用成年小鼠,其中低劣的橄榄(IO),在心室中核,已被病毒性地通过钙传感器GCaMP6s传播,我们描述了手术步骤(修改从最初在Khosrovani等人描述的方法2007年6),把一个GIRN镜头放在麻醉小鼠的大脑的腹腔表面。我们使用微型显微镜演示了记录这种极端心室大脑区域神经元活动的可行性。虽然该程序必然是非生存手术,不能在清醒动物身上进行实验,但该方法允许在感官或其他无动于衷的通路刺激的背景下检查完整的网络动力学,比使用急性切片制剂等前活体方法具有明显的优势。
研究方案
遵循所有适用的国际、国家和机构关于照顾和使用动物的准则。无菌手术技术应用于立体毒性病毒载体注射。
1. 立体毒性病毒载体注射
注:携带遗传物质表达GCaMP6s(AAV9)的病毒。卡格GCaMP6s.WPRE.SV40)是立体喷射,如先前描述的7,8与以下修改。
- 使用石英玻璃(外部直径:1.14毫米,内部直径:0.53毫米),而不是薄膜玻璃,使用激光毛细管拉拔器制造具有长而刚性锥度用于 IO 注射的移液器,其参数按照产品手册进行调整。拉下后,用手术刀从移液器尖端切下1-2毫米,获得8-10毫米长的锥度,内尖直径为15-20微米(图1a)。通过将移液器的尖端斜靠在 30° 针形上,并配有旋转微皮斜面,从而更容易地进行大脑穿透和更少的移液器弯曲(图 1a),从而完成移液器。
注意:常用的薄氧酸玻璃移液器过于灵活,在拉到此长度时无法正确定位深部区域。在这项研究中,玻璃移液器使用了纳米喷油器来传递病毒。此外,还可使用精密玻璃注射器或压力喷射器。 - 确保鼠标胸部位于热垫上,使其颈部没有足够身体支撑,在将鼠标固定在立体氧化框架(图 1b)时,要非常小心地平展头骨。
注:布雷格马-兰布达的垂直尺寸差应小于0.05毫米。 - 使用 6.2 毫米 caudal、±0.5 毫米横向和 6.6 毫米腹腔相对于布雷格马作为瞄准主要 IO 核的坐标 (图 1c)。
注:大脑的完美水平将显著提高将病毒注射到IO中的成功率。实验者必须确认这些坐标,因为实验室、小鼠菌株和单个研究人员之间预计会有显著差异。为了准备本出版物的视频材料,我们使用了一个男性 C57Bl/6J 鼠标。 - 遵循相关机构指南,对病毒传播动物进行3-4周的术后护理和收容程序。
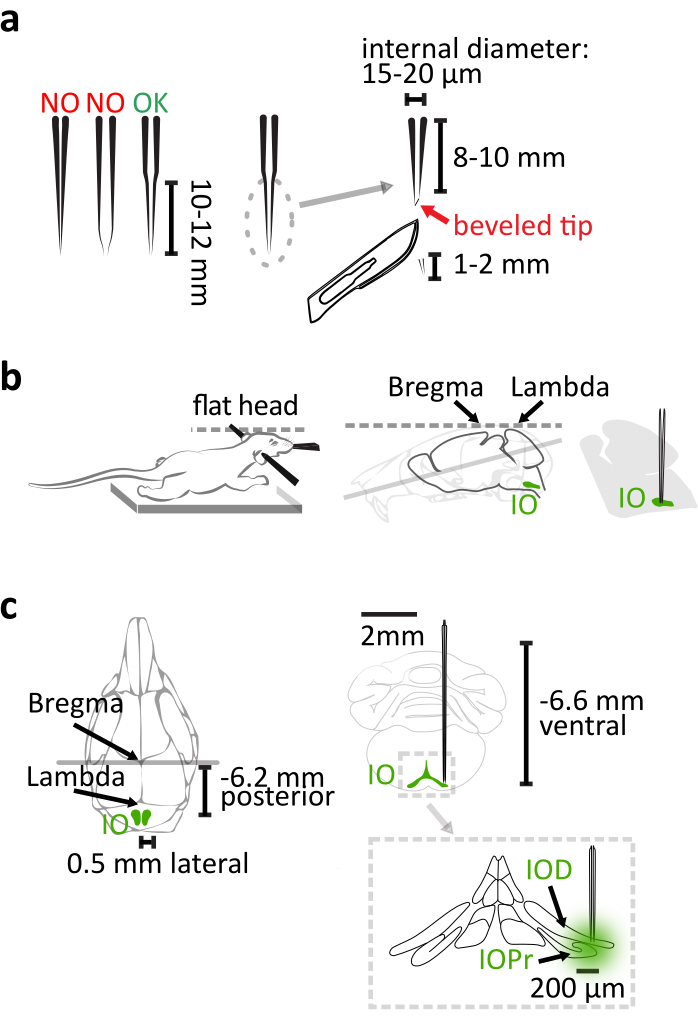
图1:立体毒病毒载体注射 。(a) 激光拉石英玻璃移液器有一个10-12毫米长的直锥。拉起后,切断1-2毫米的尖端。移液器通过将尖端斜靠在 30° 针形上来完成。(b) 正确的注射依赖于鼠标体在立体氧化框架中的正确位置。支撑鼠标胸部,防止伸长颈部。通过水平对齐布雷格玛和兰姆达来平定鼠标头。(c) 与布雷格玛相关的 IO 协调显示在小鼠头骨的后视图(左)和大脑的日冕视图(右上图)中。注射到达主核 (IOPr) 和 IO (右下)的多面 (IOD) 子核的横向部分。 请单击此处查看此图的较大版本。
2. 为心室手术准备工具和消耗品
- 通过从20口径导管尖切开一个5至6毫米长、0.8毫米宽的缝隙来准备一个管子,这样受管动物就可以呼气了(图2a)。
注意:如果使用具有恒定气流的常见异氟气化剂,动物需要缝隙才能呼出。如果除蒸发器外还使用呼吸机,导管可以完好无损。 - 在气管切口期间准备钝针以支撑气管。用钳子切断 25 口径针的尖端。用砂纸平滑断裂表面。用钳子将中间的钝针弯曲至约 15° 。
注意:弯曲的针头轻轻地抬起气管。这可以减少气管的变形。 - 用盐水稀释 50 毫克/mL 氯胺酮至 15%。最终浓度为7.5毫克/升。
- 组装清洁手术工具和消耗品,包括利多卡因凝胶、盐水、明胶海绵、吸水拭子、石油果冻和清洁组织。
- 打开异氟素蒸发器。将动物加热垫设置为 38 °C。
- 水平转动立体氧化框架 180° 的鼻锥,以便将鼠标固定到框架的腹侧向上。调整鼻锥高度,使其处于耳栏水平。
3. 麻醉和为手术准备小鼠
- 用称重秤称量动物,并计算稀释的氯胺酮注射量。
注:每公斤体重所需的氯胺酮总量为56.25毫克。因此,稀释氯胺酮的体积为每公斤体重7.5mL。单独使用氯胺酮的缺点包括肌肉放松不良、心动过速和增强的肌肉张力9。然而,在本协议中,氯胺酮仅用于涵盖10-20年代期间,在此期间,由于气管切除术而中断了异氟龙的管理。通过尽可能缩短这一步骤,异氟兰的麻醉作用不会显著降低,使用氯胺酮的缺点将降到最低。 - 将鼠标放入麻醉感应室中,预填充5%异氟素。当动物完全麻醉时,由于右反射和更深、更慢的呼吸模式,将异氟烷流转到立体毒性框架的鼻锥,并将异氟烷浓度降低到2.5%。
- 修复动物在立体声框架腹侧向上 (图 2b) 。调整鼻锥的海拔和间距,以确保动物能够轻松呼吸。用预热加热垫让动物保持温暖。
注:用纸巾或铝箔覆盖动物身体的下部有助于保持动物体温。 - 用剃须刀和脱毛霜(图2b)去除喉咙和大腿区域的皮肤毛发。在喉咙皮肤上涂抹利多卡因凝胶。
注:大腿夹外围氧饱和度(SPO2)传感器,将用于程序6,最适合无毛皮肤。 - 用直肠温度计(图2b)监测动物温度。
- 在手术中注射1mL的温暖(37°C)盐水,以补偿手术过程中的液体损失。
- 通过后肢脚趾的强捏来评估麻醉的深度。不应调用可检测响应。
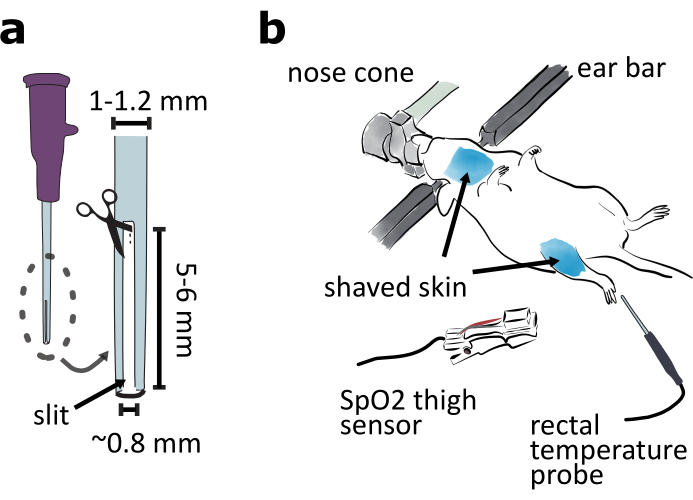
图2:准备心室接近手术。(a)在20口径导管尖切开一个长5-6毫米、宽0.8毫米的缝隙,准备一根管子。(b) 将动物腹腔侧安装在立体氧化框架中,并调整鼻锥角,以确保动物轻松呼吸。剃掉喉咙和大腿周围的皮肤。将 SPO2传感器连接到大腿上,以监测小鼠的生命体征。插入直肠温度探头,用于监测小鼠体温。请单击此处查看此图的较大版本。
4. 气管切除术和分管(20-25分钟)
- 暴露气管。
- 沿着中线在喉咙皮肤上做一个垂直切口。使用钝解剖方法将颈部皮肤与下部内脏分离,并切断皮肤以露出唾液腺(图3a-b,4a)。
- 从结缔组织中释放唾液腺,并横向翻转它们,用钳子(图3b-c)暴露胸甲状腺肌肉覆盖的气管。
注意:石油果冻可以涂在暴露的组织上,使其保持湿润。避免气管区域,以保持其清洁,为以下步骤。
- 气管切开术
- 在尿内注射第一剂稀释氯胺酮(7.5毫克/mL),每公斤体重5毫克(37.5毫克/千克)。
注:氯胺酮需要3-5分钟才能发挥作用,因此在将气管与周围肌肉和血管分离之前,应注射第一剂氯胺酮。氯胺酮在两次注射中施用,因为与异氟兰麻醉结合时过量影响的风险较高。 - 小心地沿着中线分裂胸甲状腺肌肉,用细钳尖露出气管(图3c)。使用钝解剖方法,用钳子将气管从血管和食道中分离。
- 在体内注射第二剂稀释氯胺酮(7.5毫克/mL),每公斤体重2.5毫升(18.75毫克/千克)。
- 在气管下交叉插入钝针以支撑它(图3d)。用手指握住这根针来支撑气管。用半圆针将第三个气管环的缝合线引导到甲状腺(图3d)。在这个气管环上做四个仪表带。
注意:绑在气管环上的螺纹用于将气管固定在动物胸部。在此步骤中,不要切断半圆针的线。气管环由软骨制成,软骨灵活,但不如骨骼强。不要将缝合线绑得太紧,否则环可能会断裂。 - 用一对钳子捏胸皮。用最后一步使用的相同半圆针刺穿胸皮,引导线穿过皮肤,为下一步将气管固定在胸部做准备(图3d)。
- 轻轻抬起气管,将螺纹拉到气管环上,将气管轮盘切到绑环上,然后切至甲状腺。将气管拉向胸部。通过在气管下面添加一小块手术海绵来提升气管的开口。
注意:在切开气管之前,请确保第二次注射氯胺酮后超过 5 分钟,以确保麻醉水平。 - 用细条清洁组织去除气管开口端内剩余的任何液体。将异丙酮流从立体氧化鼻锥切换到插管。将插管插入约2毫米深的气管中,并确保管内部分缝隙留在气管外,以便呼吸(图3e,4b)。
注意:小心调整插管的角度及其插入深度,使小鼠呼吸顺畅,避免损坏气管。石油果冻可以涂在气管外部,防止其干燥,因此气管不会轻易破裂。 - 通过制作 3-4 个工具领带修复气管到胸皮。将气管与缝合线连接起来,以确保插管(图3e,4b)。
- 在尿内注射第一剂稀释氯胺酮(7.5毫克/mL),每公斤体重5毫克(37.5毫克/千克)。
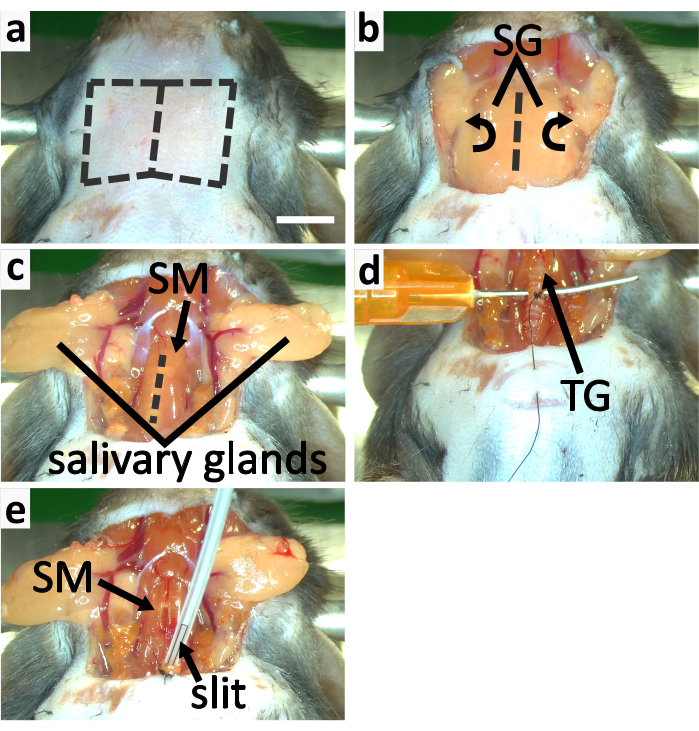
图3:小鼠的气管切除术和管状。(a-c) 面板显示暴露气管的过程。(a) 沿着虚线切割,去除喉咙皮肤。(b) 横向翻转唾液腺 (SG), 以暴露胸甲状腺肌肉 (SM) 覆盖的气管。(c) 沿着虚线切开 SM 以暴露气管。(d-e) 面板显示气管切除术。(d) 用钝和弯曲的针头支撑气管。将第三个气管环与甲状腺连接起来,以确保气管与胸部皮肤。(e) 使用带尖端有缝隙的管子。用缝合线将气管固定在胸皮上。将管子绑在一起,将管子固定在气管上。比例杆在+5毫米,适用于所有面板。请单击此处查看此图的较大版本。
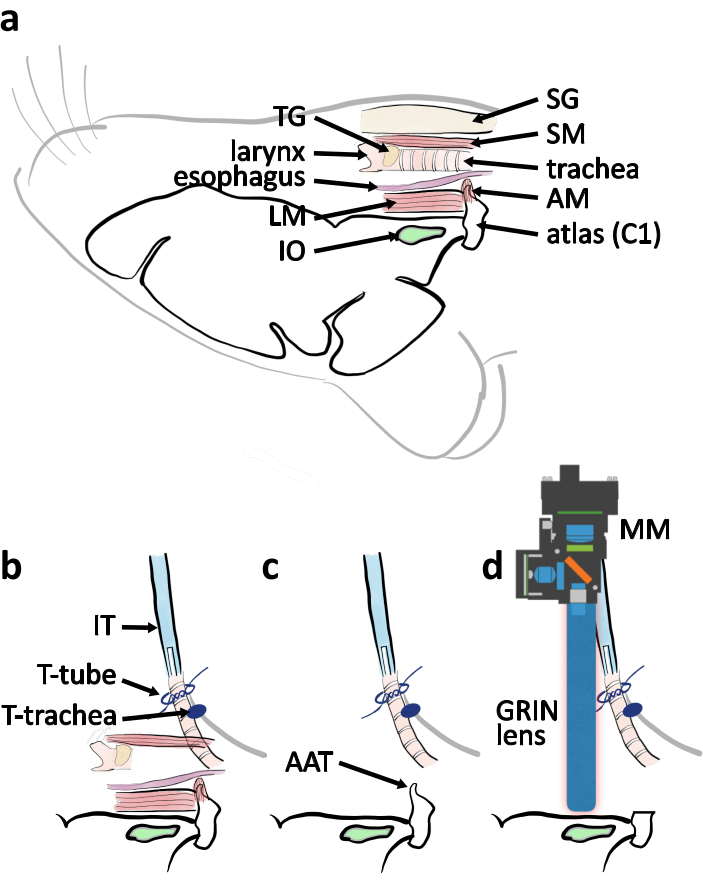
图4:从横向视图看,心室接近手术的示意图图 。 (a)当鼠标被放在心室侧向上时,在其相对位置指示相关解剖部分的示意图图。缩写:肌肉覆盖图集(AM)、纵向肌肉(LM)、唾液腺(SG)、甲状腺肌肉(SM)、甲状腺(TG)。(b) 气管切除术完成时,管子与气管有关的排列示意图。气管由胸皮上的领带(T-气管)固定。管内管 (IT) 由气管末端 (T 管) 周围的接头固定。(c) 取出地图集前块茎 (AAT),以清除 IO 的视野。(d) 描述微型显微镜 (MM) 和 IO 上方 GRIN 镜头的定位,用于成像实验。 请单击此处查看此图的较大版本。
5. 暴露脑筋急转弯(40-45分钟)
- 用细钳将胸甲状腺肌肉沿着肌肉纤维切开。用弹簧剪刀切断隔离部分(图3e)。
- 小心地将左侧气管和喉部从肌肉中释放,以尽量减少肌肉对血管的损伤。取出剩余的气管和喉部。用钳子将食道从附着的组织中释放出来,用弹簧剪刀将其切断。(图5a) 。
- 用细钳和弹簧剪刀取出覆盖腹腔拱门和前管图的肌肉(图5b)。
注意:取出肌肉时,用细钳尖分割部分。用一把弹簧剪刀切掉分开的部分。多次重复此,以暴露地图集腹腔拱门,以尽量减少撕裂血管的风险。 - 用一个荣格(图4c,5c)切割地图集的腹腔拱门。取出地图集前块茎。用手术海绵取出血液和液体,查看前额巨无霸和脑干(图4c,5d)。
- 通过用绞骨去除骨骼来扩大前体巨无霸。(图 5d- e) 。
- 用细钳和弹簧剪刀取出前门巨无霸上方的细软骨。小心地剥去杜拉母体的围层,用细钳子清晰地观察心室脑系统(图5f)。不要打破杜拉母校。
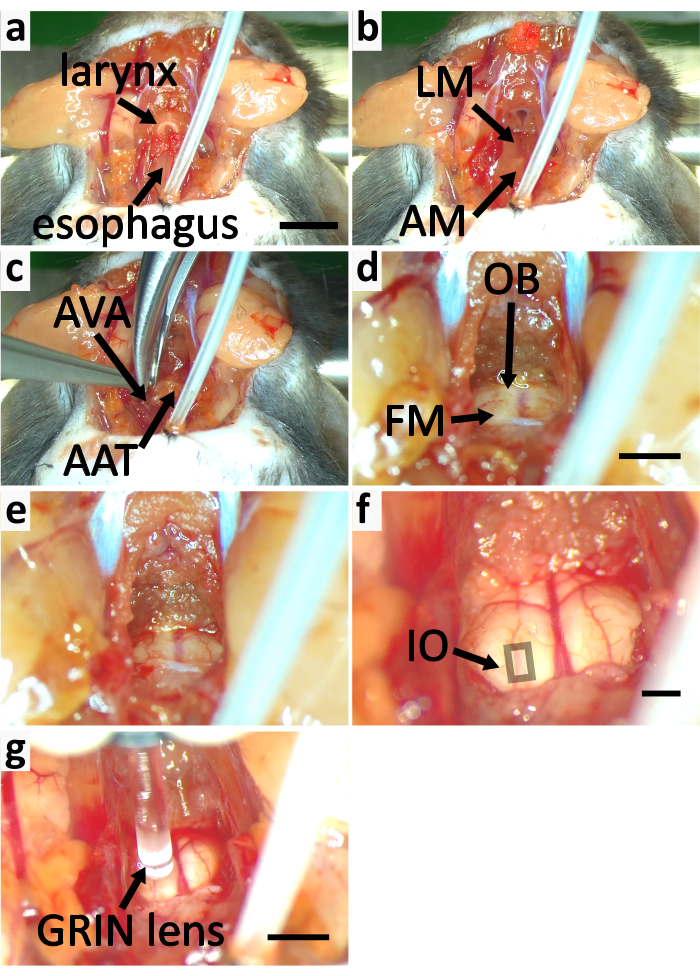
图5:暴露鼠标脑系统进行钙成像。(a-f)面板显示暴露脑筋的过程。(a) 去除图3e中标记的甲状腺肌肉(SM)。切断喉部和食道。(b) 去除纵向肌肉 (LM) 和覆盖地图集 (AM) 的肌肉。(c) 用荣格切割地图集腹腔拱门 (AVA),并取出地图集前块茎 (AAT)。(d) 切断腹骨 (OB) 以扩大前体放大镜 (FM)。(e) 扩大调频 (f) 前体放大镜上方的细软骨被移除。杜拉母体的围产层被剥落。正方形表示包含表面 IO 神经元的区域。(g) 用格林镜头对 IO 进行成像。比例杆在+5毫米,适用于a-c。比例杆为 d=2 mm,适用于 d-e。比例杆在 f=2 mm。g=2 mm 的缩放栏。请单击此处查看此图的更大版本。
6. 钙成像
- 将 SPO2 传感器夹在小鼠大腿上,以监测心率、氧饱和度和呼吸速率等生命体征 (图 2b)。
注:心率应在500bpm至600 bpm之间,氧饱和度应高于90%,呼吸速率为每分钟50-70呼吸10,11。 - 将G GRIN透镜探针(9毫米长,直径1毫米)安装在植入棒上。
注意:在成像前用70%的乙醇浸泡清洁组织清洁G GRIN透镜,以获得良好的成像质量。 - 将植入棒固定在立体氧化框架上,并将微型显微镜安装在植入棒上。
注:微型显微镜成像的准备工作应按照适当的产品用户指南完成。 - 在脑系统区域加入几滴热盐水,以浸入G GRIN 镜头。
- 使用 GRIN 镜头(图 4d, 5g) 接近脑系统。打开微型显微镜中的激发蓝色 LED(455 ± 8)。通过从微型显微镜监测荧光图像,定位 GCaMP6s 透镜 IO 神经元。在矩形区域寻找 IO 神经元~0.5-1.7 mm 轮盘到剩余的地图集,在心室脑系统表面区域的中线寻找 IO 神经元 (图 5f)。
注意:在为 IO 成像寻找合适的视场时,请查找 somata 的平均直径与 IO 神经元 somata(约 15 μm12)匹配的位置。在静膜状形成的邻近区域由显著较大的细胞13,14组成。垂直移动G GRIN镜头时要小心,因为用力按压在脑筋急转弯可能会杀死动物。
7. 按照程序对动物实施安乐死
- 实验结束时,用宫颈错位或其他经当地实验室动物护理法规批准的方法对动物实施安乐死。
- 为了进一步组织学调查,先用注射药物麻醉动物,如氯胺酮/西拉津组合(分别为100毫克/千克和10毫克/千克)15 之前,心脏灌注与林格的解决方案,然后固定溶液修复大脑。
8. 数据处理
- 在分析数据之前,对录制的钙成像视频进行预处理。
注:此步骤使用了带有微型显微镜的商业数据处理软件,下列协议步骤与此相关。或者,免费和开源软件,如CaImAn16,迷你PIPE 17和迷你镜18 可用于预处理和分析。- 将录制的钙成像视频加载到数据处理软件中。
- 单击 "预处理 "按钮。定义作物面积(不包括没有任何荧光神经元的区域),并裁剪视频以减少文件大小以加快处理速度。
- 单击 "空间过滤器" 按钮。将空间滤镜的低截止和高截止分别设置为 0.005 像素-1和 0.5 像素-1。 在视频的每个帧上应用空间滤镜,以增加对比度并使图像平滑。
注:空间过滤器是带状高斯过滤器。源自焦点外细胞的低空间频率组件可能会混淆下一步的运动校正。高空间频率组件可能导致视频显得不太流畅。 - 单击运动校正按钮。使用第一帧作为参考帧,将运动校正应用于视频,以减少脑部血流引起的运动相关人工制品。
注:运动校正采用特韦纳兹等人19日开发的图像登记方法。 - 导出运动校正视频为 TIFF 格式。
- 在 MATLAB 中的运动校正视频中应用 CNMF-E20 以识别单个神经元,按照在线存储库21中的 CNMF-E MATLAB 代码的说明操作。
注:CNMF-E 是一种受限的非负基质保理方法,专为单光子成像而定制。存储库中的演示脚本可以修改并用于处理数据。
结果
在这里,我们介绍一个代表记录获得的方法,如所述。 图6a 显示了在实验中可视化的标记明亮的IO细胞的位置。暗对角线条纹是血管。注意单个细胞的可变亮度,这些亮度由可变的变异效果产生。在面板 图 6b 中,我们显示从面板 a 中带有颜色和数字的 somata 中获取的平均规范化荧光强度 (deltaF/F) 痕迹。向上偏转表示细胞内钙的瞬时增加。请注意,不同级别的 GCaMP6s 表达(反映在面板 a 中的细胞亮度中)如何导致信号与噪声比率(SNR) 变量。
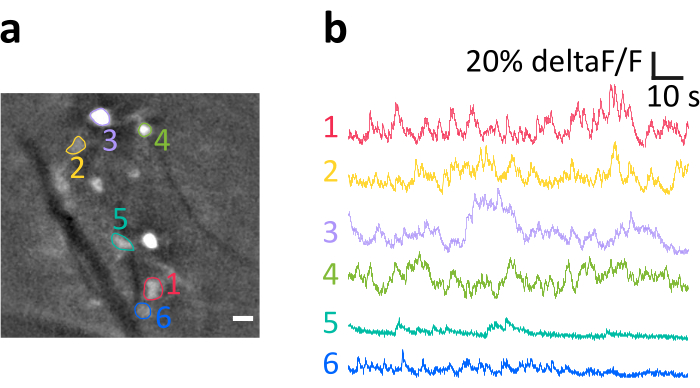
图6:麻醉小鼠体内IO神经元活动记录示例。亮点是 IO 神经元索马塔,其中几个已被指示为感兴趣的区域(10,彩色数字)。深色条纹是血管。(b) 从面板 a 中指出的从投资回报率获得的三角洲/F 痕迹示例。向上偏转反映钙信号的增加。缩放条形图为+10 μm。请单击此处查看此图的更大版本。
讨论
由于外科手术涉及在喉咙区域进行,具有许多至关重要的结构(动脉、神经),因此必须由具有高级外科技能的研究人员进行。在以下过程中,我们重点介绍和评论程序的几个要点:然而,必须提醒的是,任何书面建议都不能取代研究人员的经验、技能和直觉。
手术中最关键的一步是气管切除术。它包括切割气管,将异氟烃从鼻锥切换到插管,将气管固定在胸皮上,并将气管和插管绑在一起。所有这些操作必须平稳快速地完成,以避免意外事故,如麻醉不足、液体流入气管或管内脱落。在切割气管之前,必须牢记协议。
出血是这次手术中动物死亡的主要原因之一。由于颈部区域与血管密密麻麻,切口应仅在视线清晰时执行,以避免切割看不见的静脉和动脉。因此,必须切除遮挡视力的肌肉和结缔组织,并且必须在推进前清洗破裂毛细血管中的血液。
从手术开始,动物可以存活很长时间(超过8小时)。然而,快速完成外科手术很重要,所以当动物生理状况良好时,有更多的时间检查脑干神经元。熟练的研究人员可以在70分钟内完成整个过程。
虽然该方法提供了心室大脑表面的干净视图,但不幸的是,如果不进行气管切除术以及去除咽喉区域的大量组织,就不可能做到这一点。因此,不能允许动物从麻醉中醒来。此外,即使通过仔细调整麻醉剂的分娩、保持体温和水化,可以使动物存活数小时,但长期实验最终会导致动物状况的恶化,这是不可避免的。由研究人员的专业知识来考虑稳定录音的最大持续时间。
此处描述的方法的另一个潜在限制是,由于 GRIN 镜头未插入大脑帕奇马,因此只能检查相对肤浅的神经元(+150-200μm)。虽然在技术上可以植入G GRIN镜片,但急性手术方法不允许神经元有足够的时间从氧化应激中恢复,植入后血液的存在可能会降低图像质量,超出可接受性。
尽管有上述担忧,但我们相信这是首次提出 IO 神经元的 体内 成像方法。它允许在 体内 环境中检查IO神经元的空间显微活动,在感觉系统以及来自脑核和中脑结22的信号的情况下,这是迄今为止不可能实现的壮举。有了这种方法,现在可以通过感官和光遗传刺激的结合更深入地研究IO的功能。值得注意的是,随着电压成像(例如我们最近采用的 IO 23电压成像方法),我们希望采用的手术方法将激励众多研究人员接受挑战,研究 IO 如何有助于产生小脑复合尖峰。
披露声明
作者没有什么可透露的。
致谢
我们感谢来自OIST媒体中心的安德鲁·斯科特在视频录制和编辑方面所做的帮助。此外,我们感谢雨果·霍德梅克帮助开发手术,以暴露脑干和凯文·多根斯博士的帮助绘制图表的数字。此外,非常感谢萨尔瓦托雷·拉卡瓦的画外音旁白,以及所有NRIM成员和宠物在COVID-19的艰难时期继续支持福祉。
材料
| Name | Company | Catalog Number | Comments |
| AAV.CAG.GCaMP6s.WPRE.SV40 | Addgene, USA | 100844-AAV9 | |
| Absorbable suture with 6 mm half circle needle | Natume, Japan | L6-60N2 | hook needle with thread |
| Absorption triangles | FST, Germany | 18105-03 | Surgical sponges |
| Stereo microscopes | Leica, Germany | M50 | |
| Castroviejo curved tip needle holder with lock | FST, Germany | 12061-01 | Surgery tool |
| cotton swabs | Sanyo, Japan | HUBY-340 | |
| Delicate suture tying forceps | FST, Germany | 11063-07 | Surgery tool |
| Delicate Suture Tying Forceps | FST, Germany | 11063-07 | Surgery tool |
| Dumont #5/45 forceps | FST, Germany | 11251-35 | Surgery tool |
| Fine Iris scissors | FST, Germany | 14060-09 | Surgery tool |
| Friedman-Pearson rongeur curved tip | FST, Germany | 16221-14 | Surgery tool |
| Gelfoam absorbable gelatin sponge | Pfizer, USA | 0315-08 | Hemostatic gelatin sponge |
| Glass-Capillary Nanoinjection | Neurostar, Germany | n/a | For virus vector injection |
| Graefe Forceps with serrated tip | FST, Germany | 11052-10 | Surgery tool |
| Implantation rod | Inscopix, USA | n/a | It is part of the nVoke2 system. It's designed to nVoke2 miniature microscpe and GRIN lens can be mounted on it |
| IsoFlo | Zoetis, UK | n/a | Isoflurane |
| KETALAR FOR INTRAMUSCULAR INJECTION | Daiichi Sankyo, Japan | n/a | Ketamine |
| Kimwipes | Kimberly-Clark, USA | Cleaning tissue | |
| Laser-Based Micropipette Puller | Sutter Instrument, USA | P-2000 | |
| Micropipette Beveler | Sutter Instrument, USA | BV-10 | |
| Motorized Stereotaxic based on Kopf, Model 900 | Neurostar, Germany | n/a | Stereotaxic frame |
| mouseOxPlus with rectal temperature sensor and thigh clamp pulse oximeter | Starr Life Sciences, PA, USA | MouseOxPlus | Measures animal heart rate, arterial oxygen saturation (SpO2), breath rate, and temperature |
| nVoke2 integrarted Calcium imaging micro camera system | Inscopix, USA | 1000-003026 | Miniature microscope |
| Ohaus Compact Scales | Ohaus, USA | CS 200 | Scale used to weight animal |
| Otsuka Normal Saline | Otsuka Pharmaceutical Factory, Japan | n/a | |
| Physiological-biological temperature controller system | SuperTech Instruments, Hungary | TMP-5b | Thermal pad for mouse |
| ProView Lens Probe 1.0 mm diameter, 9.0 mm length | Inscopix, USA | 1050-002214 | Gradient-refractive index (GRIN) lens |
| Q114-53-10NP glass capillaries | Sutter Instrument, USA | 112017 | Customized quartz glass capillaries |
| Safety IV Catheter 20G | B. Braun, Germany | 4251652-03 | 20 gauage catheter used to prepare intubation tube |
| Sand paper | ESCO, Japan | EA366MC | Used to polish the tip of 25G needle to prepare curved and blunt needle |
| Scalpel blade | Muromachi Kikai, Japan | 10010-00 | Used to cut the tip of quartz glass pipette |
| SomnoSuite low flow inhalation anesthesia system | Kent Scientific, USA | SOMNO | Provides precise control of isoflurane flow |
| Surgic XT Plus drill | NSK | Y1002774 | For virus vector injection |
| Syringe 1 ml | Terumo, Japan | SS-01T | |
| Syringe needle 25G | Top, Japan | 00819 | Used to make blunt and bended needle |
| Syringe needle 26G | Terumo, Japan | NN-2613S | |
| Thrive 2100 Professional Trimmer | Thrive, Japan | n/a | Shaver |
| Vannas-Tübingen spring scissors | FST, Germany | 15004-08 | Surgery tool |
| Vaseline | Hayashi Pure Chemical, Japan | 22000255 | |
| Veet sensitive skin | Veet, Canada | n/a | Hair removal cream |
| Xylocaine Jelly 2 % 30ml | Aspen Japan, Japan | 871214 |
参考文献
- Russell, J. T. Imaging calcium signals in vivo: A powerful tool in physiology and pharmacology. British Journal of Pharmacology. , (2011).
- Zhang, T., et al. Kilohertz two-photon brain imaging in awake mice. Nature Methods. , (2019).
- Lin, X., Zhao, T., Xiong, W., Wen, S., Jin, X., Xu, X. M. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. Journal of Visualized Experiments. 2019 (143), 1-8 (2019).
- Lee, H. S., Han, J. H. Successful In vivo Calcium Imaging with a Head-Mount Miniaturized Microscope in the Amygdala of Freely Behaving Mouse. Journal of visualized experiments. (162), 1-19 (2020).
- Aharoni, D., Khakh, B. S., Silva, A. J., Golshani, P. All the light that we can see: a new era in miniaturized microscopy. Nature Methods. 16 (1), 11-13 (2019).
- Khosrovani, S., Van Der Giessen, R. S., De Zeeuw, C. I., De Jeu, M. T. G. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proceedings of the National Academy of Sciences. 104 (40), 15911-15916 (2007).
- Osten, P., Cetin, A., Komai, S., Eliava, M., Seeburg, P. H. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1 (6), 3166-3173 (2007).
- Berg, L., Gerdey, J., Masseck, O. A. Optogenetic Manipulation of Neuronal Activity to Modulate Behavior in Freely Moving Mice. Journal of visualized experiments : JoVE. , e61023 (2020).
- Green, C. J., Knight, J., Precious, S., Simpkin, S. Ketamine alone and combined with diazepam or xylazine in laboratory animals: A 10 year experience. Laboratory Animals. 15 (2), 163-170 (1981).
- Tsukamoto, A., Serizawa, K., Sato, R., Yamazaki, J., Inomata, T. Vital signs monitoring during injectable andn inhalant anesthesia in mice. Experimental Animals. 64 (1), 57-64 (2015).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harbor Protocols. 6 (2), 174-178 (2011).
- Vrieler, N., et al. Variability and directionality of inferior olive neuron dendrites revealed by detailed 3D characterization of an extensive morphological library. Brain Structure and Function. , 1677-1695 (2019).
- Esposito, M. S., Capelli, P., Arber, S. Brainstem nucleus MdV mediates skilled forelimb motor tasks. Nature. , (2014).
- Martin, E. M., Devidze, N., Shelley, D. N., Westberg, L., Fontaine, C., Pfaff, D. W. Molecular and neuroanatomical characterization of single neurons in the mouse medullary gigantocellular reticular nucleus. Journal of Comparative Neurology. , (2011).
- Cold Spring Harbor. Ketamine/Xylazine. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. eLife. 8, 1-45 (2019).
- Lu, J., et al. MIN1PIPE: A Miniscope 1-Photon-Based Calcium Imaging Signal Extraction Pipeline. Cell Reports. 23 (12), 3673-3684 (2018).
- . GitHub - PeyracheLab/miniscoPy: A package to analyse calcium imaging data recorded with the Miniscope Available from: https://github.com/PeyracheLab/miniscoPy (2020)
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. , (1998).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. eLife. 7, 1-37 (2018).
- . GitHub - zhoupc/CNMF_E: Constrained Nonnegative Matrix Factorization for microEndoscopic data Available from: https://github.com/zhoupc/CNMF_E (2020)
- De Gruijl, J. R., Bosman, L. W. J., De Zeeuw, C. I., De Jeu, M. T. G. Inferior olive: All ins and outs. Handbook of the Cerebellum and Cerebellar Disorders. , (2013).
- Dorgans, K., Kuhn, B., Uusisaari, M. Y. Imaging Subthreshold Voltage Oscillation With Cellular Resolution in the Inferior Olive in vitro. Frontiers in Cellular Neuroscience. , (2020).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。