Method Article
In vivo Imágenes de calcio en la aceituna inferior de ratón
En este artículo
Resumen
Presentamos un protocolo para exponer el médula oblonga del ratón adulto del lado ventral. Mediante el uso de una lente de índice de refracción de gradiente con un microscopio en miniatura, las imágenes de calcio se pueden utilizar para examinar la actividad de los somatas neuronales oliva inferiores in vivo.
Resumen
La aceituna inferior (IO), un núcleo en la médula ventral, es la única fuente de fibras trepadoras que forman una de las dos vías de entrada que entran en el cerebelo. Io se ha propuesto de largo para ser crucial para el control del motor y su actividad se considera actualmente estar en el centro de muchas hipótesis del motor y de las funciones cognoscitivas del cerebelo. Mientras que su fisiología y función han sido relativamente bien estudiadas a nivel unicelular in vitro, actualmenteno hay informes sobre la organización de la actividad de la red IO en animales vivos. Esto es en gran parte debido a la localización anatómica extremadamente desafiadora del IO, haciéndolo difícil sujetar a los métodos fluorescentes convencionales de la proyección de imagen, donde una trayectoria óptica se debe crear a través del cerebro entero situado dorsal a la región de interés.
Aquí describimos un método alternativo para obtener el estado de la técnica - datos de la proyección de imagen del calcio del nivel de la red io. El método se aprovecha de la ubicación ventral extrema de la IO e implica un procedimiento quirúrgico para insertar una lente de índice de refracción de gradiente (GRIN) a través de las vísceras del cuello para entrar en contacto con la superficie ventral del sensor de calcio GCaMP6s que expresa IO en ratones anestesiados. Una grabación representativa de la proyección de imagen del calcio se demuestra para demostrar la viabilidad de registrar actividad de la neurona io después de la cirugía. Si bien se trata de una cirugía de no supervivencia y las grabaciones deben llevarse a cabo bajo anestesia, evita el daño a los núcleos del tronco encefálico críticos para la vida y permite la realización de una gran variedad de experimentos que investigan los patrones de actividad espaciotemporal y la integración de entrada en el IO. Este procedimiento con modificaciones se podía utilizar para las grabaciones en otras, regiones adyacentes del médula oblonga ventral.
Introducción
El objetivo principal de la neurociencia de sistemas es comprender cómo los patrones de actividad espaciotemporal de las redes neuronales contribuyen a la generación de comportamiento animal. Por lo tanto, la metodología de imágenes fluorescentes que utiliza sondas sensibles al calcio se ha convertido en la última década en una herramienta principal para examinar la actividad de la red neuronal en animales vivos1,2,ya que permite la visualización de dicha dinámica a través de escalas espaciales que van desde células individuales hasta circuitos de mesoescala. En los últimos años, el enfoque común donde los circuitos neuronales en estructuras cerebrales superficiales (como las cortezas cerebrales o cerebelosas) se crean imágenes a través de una ventana craneal transparente3 se ha complementado con el uso de lentes de índice de refracción de gradiente (GRIN)4 que permiten el examen de la dinámica de la red en estructuras cerebrales profundas. Las lentes GRIN actualmente disponibles permiten llegar a estructuras de varios milímetros de profundidad, como la amígdala de ratón, el hipocampo y los gangliosbasales 5. Sin embargo, muchas regiones de interés, como varios núcleos en la médula ventral, se encuentran significativamente más profundos, colocándolos en el extremo del alcance de la lente GRIN.
Aquí, describimos cómo superar esta dificultad aprovechando la accesibilidad relativamente fácil de la médula a través del aspecto ventral del cerebro. Utilizando ratones adultos donde la aceituna inferior (IO), un núcleo en la médula ventral, ha sido transfectada viralmente con un sensor de calcio GCaMP6s, describimos los pasos quirúrgicos (modificados del método descrito originalmente en Khosrovani et al. 20076)para colocar una lente GRIN en la superficie ventral del cerebro de un ratón anestesiado. Usando un microscopio miniatura, demostramos la viabilidad de registrar actividad neuronal en tales regiones extremadamente ventrales del cerebro. Si bien el procedimiento es necesariamente una cirugía de no supervivencia y no se puede realizar experimentación en animales despiertos, el método permite el examen de la dinámica de red intacta en el contexto de la estimulación sensorial u otra vía aferente, proporcionando ventajas claras sobre los enfoques ex vivo, como el uso de preparaciones de rebanadas agudas.
Protocolo
Se siguieron todas las directrices internacionales, nacionales e institucionales aplicables para el cuidado y uso de animales. Las técnicas asépticas de la cirugía fueron aplicadas a la inyección stereotaxic del vector del virus.
1. Inyección de vectores de virus esteretáxicos
NOTA: Virus portador del material genético para la expresión de GCaMP6s (AAV9. Cag. GCaMP6s.WPRE.SV40) se inyecta estereotáxicamente como se describió anteriormente7,8 con las siguientes modificaciones.
- Utilice vidrio de cuarzo (diámetro externo: 1,14 mm, diámetro interno: 0,53 mm) en lugar de vidrio de borosilicato para fabricar una pipeta con cono largo y rígido para inyección io utilizando un tirador capilar láser con parámetros ajustados como en el manual del producto. Después de tirar, cortar 1-2 mm de la punta de la pipeta con un bisturí para adquirir un cono de 8-10 mm de largo con un diámetro de punta interna de 15-20 μm (Figura 1a). Finalice la pipeta biselando su punta a una forma de aguja de 30 ° con un biselador de micropipeta giratorio para una penetración cerebral más fácil y menos flexión de la pipeta (Figura 1a).
NOTA: La pipeta de vidrio de borosilicato comúnmente utilizada será demasiado flexible para apuntar correctamente a las áreas profundas cuando se tira a esta longitud. Un inyector del nanoliter fue utilizado con la pipeta de cristal para entregar el virus en este estudio. Alternativamente, también se puede usar una jeringa de vidrio de precisión o un inyector de presión. - Asegúrese de que el cofre del ratón se encuentra en la almohadilla térmica para que su cuello no se estire con suficiente apoyo corporal, y tenga mucho cuidado con la nivelación del cráneo al fijar el ratón en el marco estereotáxico (Figura 1b).
NOTA: La diferencia Bregma-lambda debe ser inferior a 0,05 mm en dimensión vertical. - Utilice 6,2 mm caudal, ±0,5 mm lateral y 6,6 mm ventral en relación con la bregma como las coordenadas para apuntar al núcleo principal de IO (Figura 1c).
NOTA: La nivelación perfecta del cerebro aumentará dramáticamente la tasa de éxito de la inyección de virus en IO. Las coordenadas deben ser confirmadas por el experimentador, ya que se esperan diferencias significativas entre laboratorios, cepas de ratón e investigadores individuales. Para preparar el material de vídeo para esta publicación, se utilizó un ratón macho C57Bl/6J. - Siga las pautas institucionales pertinentes para la atención postoperatoria y los procedimientos de alojamiento para animales transfectados viralmente durante 3-4 semanas.
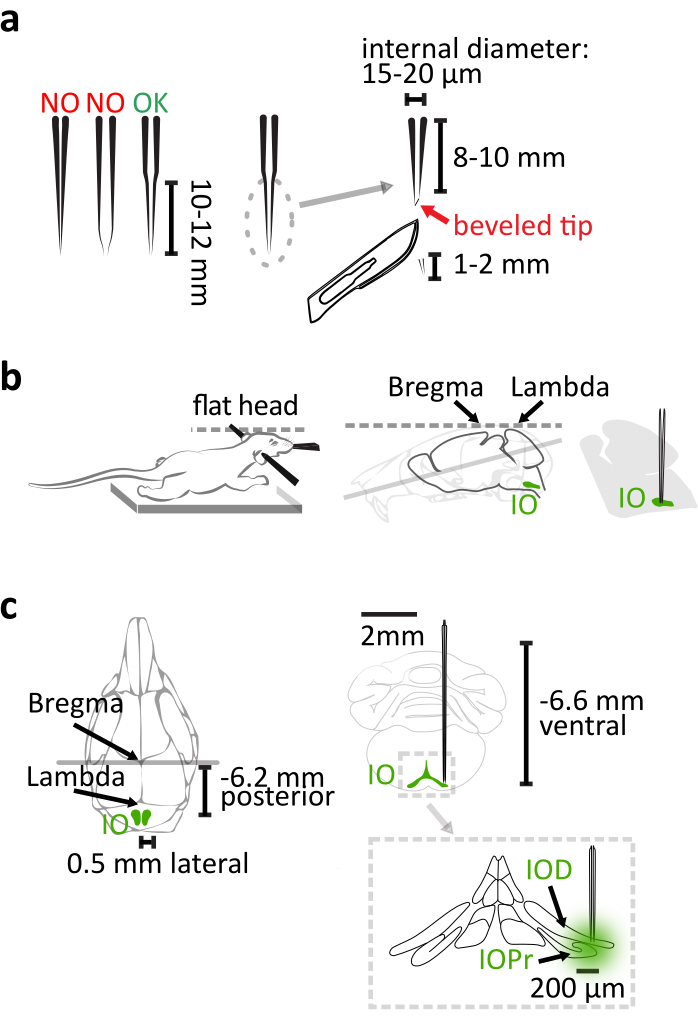
Figura 1:Inyección de vector de virus estereotáxico. (a) La pipeta de vidrio de cuarzo tirada por láser tiene un cono recto de 10-12 mm de largo. Después de tirar, cortar 1-2 mm de la punta. La pipeta se finaliza biselando la punta a una forma de aguja de 30°. (b)La inyección correcta se basa en la posición adecuada del cuerpo del ratón en el marco estereotáxico. Apoye el pecho del ratón para evitar estirar el cuello. Nivele la cabeza del ratón alineando el bregma y lambda horizontalmente. (c)La coordinación IO relativa a la bregma se muestra en la vista dorsal (izquierda) del cráneo del ratón y la vista coronal (parte superior derecha) del cerebro. La inyección alcanza la parte lateral del subnúcleo principal (IOPr) y dorsal (IOD) de IO (parte inferior derecha). Haga clic aquí para ver una versión más amplia de esta figura.
2. Preparación de herramientas y consumibles para cirugía de abordaje ventral
- Prepare un tubo de intubación cortando una hendidura de 5 a 6 mm de largo y 0,8 mm de ancho de la punta de un catéter de calibre 20 para que el animal intubado pueda exhalar (Figura 2a).
NOTA: La rendija es necesaria para que el animal exhale si se utiliza un vaporizador de isoflurano común con flujo de aire constante. Si se utiliza un ventilador además del vaporizador, el catéter se puede dejar intacto. - Prepare una aguja roma para apoyar la tráquea durante la traqueotomía. Corte la punta afilada de una aguja de calibre 25 con alicates. Alisar la superficie de fractura con papel de lija. Doble la aguja roma en el medio a unos 15° con alicates.
NOTA: Una aguja curva levanta la tráquea suavemente. Esto puede disminuir la deformación de la tráquea. - Diluir 50 mg/mL de ketamina con solución salina al 15%. La concentración final es de 7,5 mg/mL.
- Monte las herramientas de cirugía limpia y los consumibles, incluyendo gel de lidocaína, solución salina, esponjas de gelatina, hisopos absorbentes, vaselina y tejido de limpieza.
- Encienda el vaporizador de isoflurano. Fije la almohadilla de calentamiento animal a 38 °C.
- Gire el cono de la nariz del marco estereotáxico 180 ° horizontalmente, para que el ratón se pueda fijar en el lado ventral del marco hacia arriba. Ajuste la altura del cono de la nariz para que esté al nivel de las barras para los oídos.
3. Administración de anestesia y preparación del ratón para la cirugía
- Pesar al animal con una báscula de pesaje y calcular la cantidad de ketamina diluida para inyección.
NOTA: La cantidad total de ketamina necesaria es de 56,25 mg por kg de peso corporal. Por lo tanto, el volumen de ketamina diluida es de 7,5 mL por kg de peso corporal. Los inconvenientes de usar ketamina sola incluyen mala relajación muscular, taquicardia y tono muscular mejorado9. En este protocolo, sin embargo, la ketamina sólo se utiliza para cubrir el período de 10-20 s durante el cual la administración de isoflurano se interrumpe debido a la traqueotomía. Al mantener este paso lo más breve posible, el efecto anestésico del isoflurano no disminuye significativamente y se minimizan los inconvenientes del uso de ketamina. - Coloque el ratón en la cámara de inducción anestésica precargada con isoflurano al 5%. Cuando el animal está completamente anestesiado demostrado por la pérdida del reflejo corrector y el patrón de respiración más profundo y lento, cambie el flujo de isoflurano al cono de la nariz del marco estereotáxico y reduzca la concentración de isoflurano al 2,5%.
- Fijar el animal en el marco estereotáxico del lado ventral hacia arriba (Figura 2b). Ajuste la elevación y el tono del cono de la nariz para asegurarse de que el animal pueda respirar fácilmente. Mantenga al animal caliente con la almohadilla de calentamiento precalentada.
NOTA: Cubrir la parte inferior del cuerpo del animal con un pedazo de papel de seda o papel de aluminio puede ayudar a mantener la temperatura del animal. - Retire el vello de la piel en las zonas de garganta y muslos con una afeitadora y crema de depilación (Figura 2b). Aplique tópicamente el gel de lidocaína en la piel de la garganta.
NOTA: El sensor de saturación periférica de oxígeno (SpO2)de la abrazadera del muslo, que se utilizará en el procedimiento 6, funciona mejor en la piel sin pelo. - Controlar la temperatura del animal con un termómetro rectal(Figura 2b).
- Inyecte 1 mL de solución salina caliente (37 °C) por vía intraperitoneal para compensar la pérdida de líquido durante la cirugía.
- Evaluar la profundidad de la anestesia por un fuerte pellizco en los dedos de los miembros posteriores. No se debe evocar ninguna respuesta detectable.
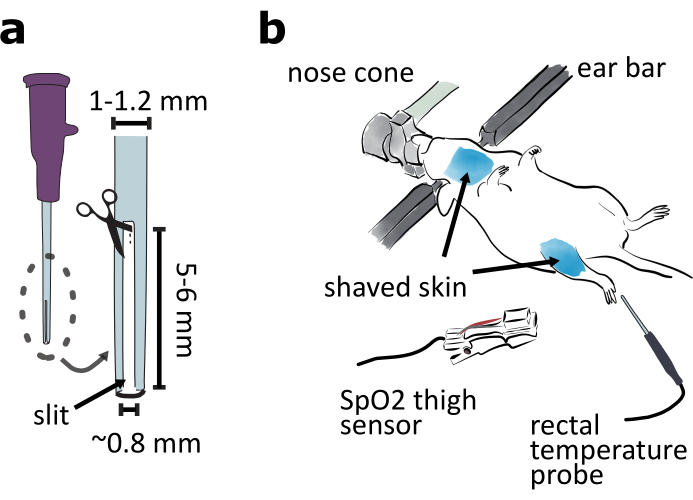
Figura 2:Preparación de la cirugía de aproximación ventral. (a)Preparar un tubo de intubación cortando una hendidura de 5-6 mm de largo y 0,8 mm de ancho en la punta del catéter de calibre 20. b) Monte el lado ventral del animal en un marco estereotáxico y ajuste el ángulo del cono de la nariz para asegurarse de que el animal respira fácilmente. Afeitarse la piel alrededor de las áreas de la garganta y los muslos. Conecte el sensor SpO2 al muslo para monitorear los signos vitales del ratón. Inserte la sonda de temperatura rectal para controlar la temperatura corporal del ratón. Haga clic aquí para ver una versión más amplia de esta figura.
4. Traqueotomía e intubación (20-25 min)
- Exponiendo la tráquea.
- Haga una incisión vertical en la piel de la garganta a lo largo de la línea media. Separe la piel del cuello de las vísceras debajo de ella mediante el método de disección contundente y corte la piel para revelar las glándulas salivales (Figura 3a-b, 4a).
- Libere las glándulas salivales del tejido conectivo y voltételas lateralmente para exponer la tráquea cubierta de músculo esternotiroideo con fórceps (Figura 3b-c).
NOTA: La vaselina se puede aplicar sobre el tejido expuesto para mantenerlos húmedos. Evite el área de la tráquea para mantenerla limpia durante los siguientes pasos.
- traqueotomía
- Inyecte la primera dosis de ketamina diluida (7,5 mg/mL) por vía intraperitoneal, 5 mL por kg de peso corporal (37,5 mg/kg).
NOTA: Se necesitan 3-5 minutos para que la ketamina funcione, por lo tanto, la primera dosis de ketamina debe inyectarse antes de separar la tráquea de los músculos y vasos sanguíneos circundantes. La ketamina se administra en dos inyecciones debido al riesgo elevado de efectos de sobredosis cuando se combina con anestesia con isoflurano. - Divida cuidadosamente el músculo esternotiroideo a lo largo de la línea media con la punta de un fino fórceps para exponer la tráquea(Figura 3c). Desprenda la tráquea de los vasos sanguíneos y el esófago con fórceps utilizando el método de disección contundente.
- Inyecte por vía intraperitoneal la segunda dosis de ketamina diluida (7,5 mg/mL), 2,5 mL por kg de peso corporal (18,75 mg/kg).
- Inserte una aguja roma debajo de la tráquea de forma transversal para apuntalarla (Figura 3d). Sostenga esta aguja con los dedos para apoyar la tráquea. Guía el hilo de sutura alrededor del tercer anillo de tráquea caudal hasta la glándula tiroides con una aguja de semicírculo (Figura 3d). Haga cuatro lazos de instrumentos en este anillo traqueal.
NOTA: El hilo atado al anillo traqueal se utiliza para asegurar la tráquea al pecho del animal. No corte el hilo de la aguja del semicírculo en este paso. Los anillos traqueales están hechos de cartílago que es flexible pero menos fuerte que los huesos. No ate el hilo de la sutura demasiado apretado o el anillo puede romperse. - Pellizque la piel del pecho con un par de pinzas. Perforar la piel del pecho con la misma aguja de semicírculo utilizada en el último paso y conducir el hilo a través de la piel, en preparación para asegurar la tráquea al pecho en el siguiente paso (Figura 3d).
- Levante suavemente la tráquea tirando del hilo atado al anillo traqueal y corte la tráquea rostral al anillo atado y caudal a las glándulas tiroides. Tire de la tráquea caudal hacia el pecho. Levante la abertura de la tráquea agregando un pequeño pedazo de esponja quirúrgica debajo de ella.
NOTA: Asegúrese de que hayan pasado más de 5 min después de la segunda inyección de ketamina antes de cortar la tráquea para asegurar el nivel de anestesia. - Retire cualquier líquido restante dentro de la punta de apertura de la tráquea con una tira delgada de tejido de limpieza. Cambie el flujo de isoflurano del cono de la nariz estereotáxica al tubo de intubación. Inserte el tubo de intubación en la tráquea a unos 2 mm de profundidad y asegúrese de que parte de la rendija en el tubo permanezca fuera de la tráquea para permitir la respiración(Figura 3e,4b).
NOTA: Ajuste cuidadosamente el ángulo del tubo de intubación y su profundidad de inserción para que el ratón respire suavemente y para evitar dañar la tráquea. La vaselina se puede aplicar en el exterior de la tráquea para evitar que se seque, por lo que la tráquea no se rompe fácilmente. - Fije la tráquea a la piel del pecho haciendo 3-4 lazos instrumentales. Ate la tráquea con el hilo de sutura para asegurar el tubo de intubación(Figura 3e,4b).
- Inyecte la primera dosis de ketamina diluida (7,5 mg/mL) por vía intraperitoneal, 5 mL por kg de peso corporal (37,5 mg/kg).
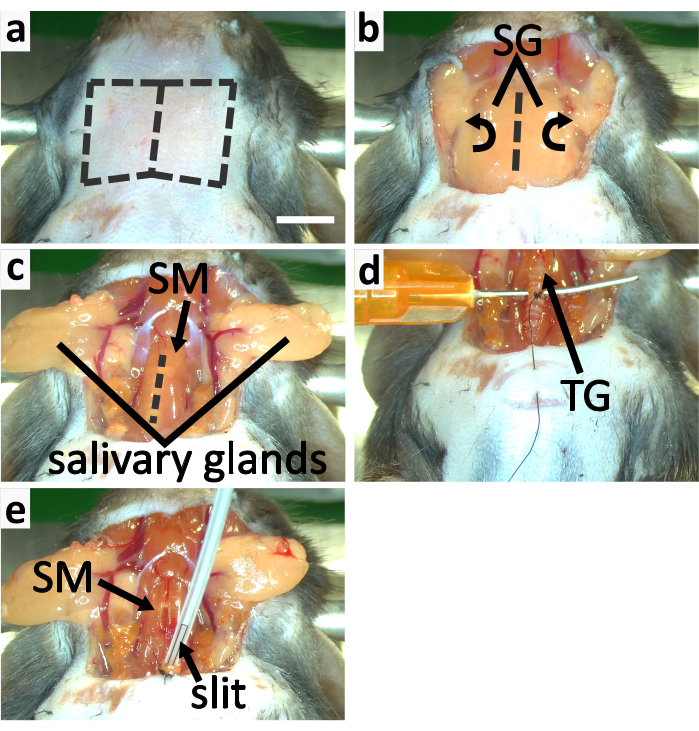
Figura 3:Traqueotomía e intubación de ratón. (a-c) los paneles muestran el proceso de exposición de la tráquea. (a ) Retire la piel de la garganta cortando a lo largo de las líneas discontinuas. (b)Voltear las glándulas salivales (SG) lateralmente para exponer la tráquea cubierta por el músculo esternotiroideo (SM). c) Hendidura abierta SM a lo largo de la línea discontinua para exponer la tráquea. (d-e) los paneles muestran la traqueotomía. (d) Apoyar la tráquea con una aguja roma y curvada. Ate el tercer anillo de tráquea caudal a la glándula tiroides para asegurar la tráquea a la piel del pecho. (e)Aplicar isoflurano con un tubo de intubación con una hendidura en la punta. Asegure la tráquea a la piel del pecho con el hilo de sutura. Asegure el tubo de intubación a la tráquea atándolos juntos. Barra de escala en a = 5 mm, se aplica a todos los paneles. Haga clic aquí para ver una versión más amplia de esta figura.
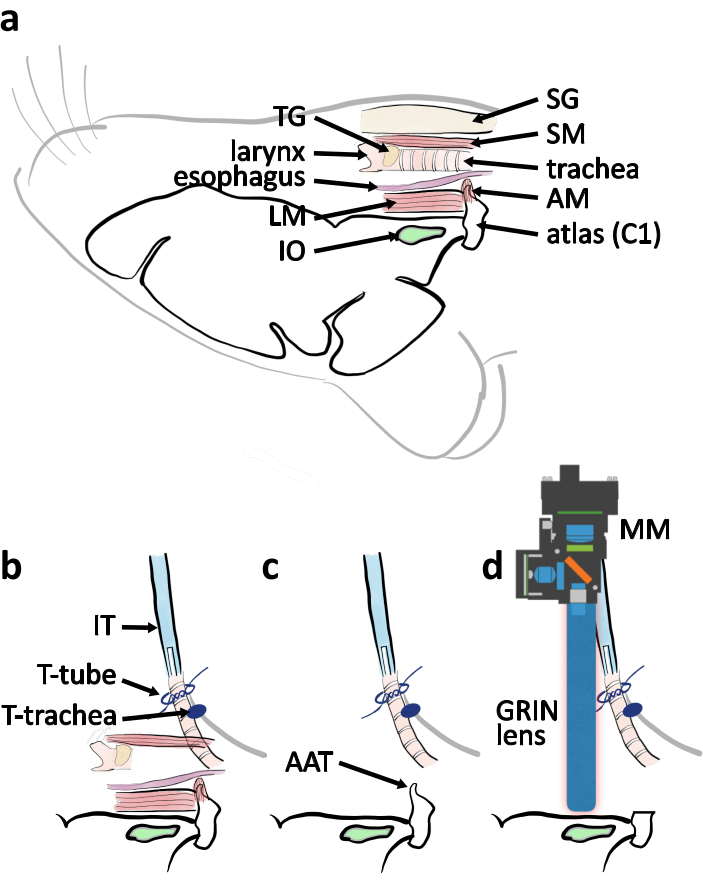
Figura 4:Diagrama esquemático de la cirugía de aproximación ventral desde la vista lateral. (a)Un dibujo esquemático con partes anatómicas relevantes indicadas en su ubicación relativa cuando el ratón se coloca de lado ventral hacia arriba. Abreviaturas: atlas de cobertura muscular (AM), músculo longitudinal (LM), glándulas salivales (SG), músculo esternotiroideo (SM), glándula tiroides (TG). b) Esquema de disposición del tubo de intubación en relación con la tráquea cuando se completa la traqueotomía. La tráquea está asegurada por los lazos en la piel del pecho (T-tráquea). El tubo de intubación (IT) está asegurado por los lazos alrededor del extremo de la tráquea (tubo en T). (c)Retire el tubérculo anterior del atlas (AAT) para despejar la línea de visión a la IO. (d) Esquemático que describe la posición del microscopio en miniatura (MM) y la lente GRIN por encima de la IO para el experimento de imagen. Haga clic aquí para ver una versión más amplia de esta figura.
5. Exponer el tronco encefálico (40-45 min)
- Hendidura el músculo esternotiroideo a lo largo de la fibra muscular con las medidas de control fino. Corte la parte aislada con las tijeras de resorte (Figura 3e).
- Libere cuidadosamente la tráquea sobrantes y la laringe de los músculos para minimizar el daño en los vasos sanguíneos en los músculos. Retire la tráquea sobrada y la laringe. Libere el esófago del tejido adjunto con fórceps y córtuelo con tijeras de resorte. (Figura 5a).
- Retirar el músculo que cubre el arco ventral y el tubérculo anterior del atlas con fórceps finos y tijeras de resorte (Figura 5b).
NOTA: Al retirar el músculo, divida parte del mismo con la punta de los fórceps finos. Corte la parte separada con un par de tijeras de resorte. Repita esto varias veces para exponer el arco ventral atlas para minimizar el riesgo de rasgar los vasos sanguíneos. - Cortar los arcos ventrales del atlas con un rongeur (Figura 4c, 5c). Retire el tubérculo anterior del atlas. Retire la sangre y el líquido con esponja quirúrgica para ver el agujero magno y el tronco encefálico (Figura 4c, 5d).
- Expanda el foramen magnum eliminando el hueso occipital con un rongeur. (Figura 5d-e).
- Retire el cartílago delgado por encima del foramen magno con brocas finas y tijeras de resorte. Pelar cuidadosamente la capa perióstico de la duramadre con fórceps finos para tener una visión clara del tronco encef ventral (Figura 5f). No rompa la duramadre.
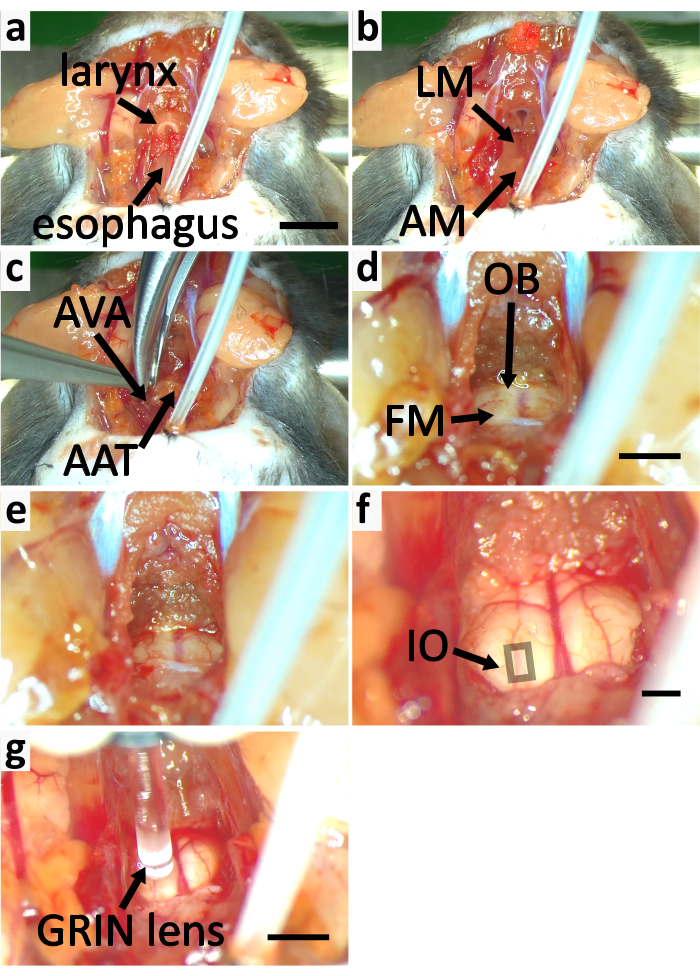
Figura 5:Exponer el tronco encefálico del ratón para obtener imágenes de calcio. (a-f) los paneles muestran el proceso de exposición del tronco encefálico. (a) Retirar el músculo esternotiroideo (SM) marcado en la Figura 3e. Cortar la laringe y el esófago. (b)Retire el músculo longitudinal (LM) y el atlas de cobertura muscular (AM). (c) Cortar los arcos ventrales del atlas (AVA) con un rongeur y retirar el tubérculo anterior del atlas (AAT). d) Cortar el hueso occipital (OB) para expandir el foramen magno (FM). e) FM expandida. (f) Se elimina el cartílago delgado por encima del agujero magno. La capa perióstico de duramadre se desprende. El cuadrado indica el área que contiene neuronas IO superficiales. (g)Imagen de la IO con lente GRIN. Barra de escala en a=5 mm, se aplica a a-c. Barra de escala en d=2 mm, se aplica a d-e. Barra de escala en f=2 mm. Barra de escala en g=2 mm. Haga clic aquí para ver una versión más grande de esta figura.
6. Imágenes de calcio
- Sujete el sensor SpO2 en el muslo del ratón para monitorizar signos vitales como la frecuencia cardíaca, la saturación de oxígeno y la frecuencia respiratoria(Figura 2b).
NOTA: La frecuencia cardíaca debe estar entre 500 lpm y 600 lpm, la saturación de oxígeno debe ser superior al 90%, y la frecuencia respiratoria debe ser de 50-70 respiraciones por minuto10,11. - Monte la sonda de lente GRIN (9 mm de longitud. 1 mm de diámetro) en la varilla de implantación.
NOTA: Limpie la lente GRIN con un 70% de tejido de limpieza empapado en etanol antes de obtener imágenes para obtener una buena calidad de imagen. - Fije la varilla de implantación en el marco estereotáxico y monte el microscopio en miniatura en la varilla de implantación.
NOTA: La preparación del microscopio en miniatura para la obtención de imágenes debe completarse de acuerdo con las directrices apropiadas para el usuario del producto. - Agregue varias gotas de solución salina caliente en el área del tronco encefálico para la inmersión de la lente GRIN.
- Acércate al tronco encefálico con la lente GRIN(Figura 4d,5g). Encienda el LED azul de excitación (455 ± 8) en el microscopio en miniatura. Localice las neuronas IO transfectadas por GCaMP6s mediante el monitoreo de la imagen de fluorescencia desde el microscopio en miniatura. Busque neuronas IO en una región en forma de rectángulo ~ 0.5-1.7 mm rostral al atlas restante y ~ 0.6-1.1 mm lateral a la línea media en el área superficial del tronco encefálico ventral (Figura 5f).
NOTA: Al buscar un campo de visión apropiado para las imágenes de IO, busque la ubicación donde el diámetro promedio de somata coincide con el de la somata de la neurona IO (aproximadamente 15 μm12). Las regiones adyacentes en la formación reticular medular consisten en células significativamente más grandes13,14. Tenga cuidado al mover la lente GRIN verticalmente, ya que presionarla en el tronco cerebral con demasiada fuerza puede matar a los animales.
7. Eutanasia animal siguiendo el procedimiento
- Al final del experimento, eutanasiar al animal con dislocación cervical u otro método aprobado por la regulación local de cuidado de animales de laboratorio.
- Para una mayor investigación histológico, primero anestesiar al animal con fármaco inyectable, como la combinación de ketamina/xilazina (100 mg/kg y 10 mg/kg, respectivamente)15 antes de la perfusión cardíaca con la solución de Ringer seguida de una solución fijadora para fijar el cerebro.
8. Tratamiento de datos
- Preprocese el video de imágenes de calcio grabado antes de analizar los datos.
NOTA: El software de procesamiento de datos comercial acompañado con el microscopio en miniatura se utilizó para este paso y los siguientes pasos de protocolo se relacionan con eso. Alternativamente, el software libre y de código abierto como CaImAn16,MINIPIPE17y MiniscoPy18 se puede utilizar tanto para el preprocesamiento como para el análisis.- Cargue el vídeo de imágenes de calcio grabado en el software de procesamiento de datos.
- Haga clic en el botón Preprocesar. Defina un área de cultivo excluyendo regiones sin neuronas fluorescentes y recorte el video para disminuir el tamaño del archivo para un procesamiento más rápido.
- Haga clic en el botón Filtro espacial. Establezca el límite bajo y el límite alto para el filtro espacial en 0,005 píxeles-1y 0,5 píxeles-1, respectivamente. Aplique el filtro espacial en cada fotograma del vídeo para aumentar el contraste y suavizar la imagen.
Nota: El filtro espacial es un filtro gaussiano de paso de banda. Los componentes de baja frecuencia espacial que se originan en celdas fuera de foco pueden confundir la corrección de movimiento en el siguiente paso. El componente de alta frecuencia espacial puede hacer que el vídeo parezca menos suave. - Haga clic en el botón Corrección de movimiento. Aplique la corrección de movimiento al vídeo utilizando el primer fotograma como sistema de referencia para reducir los artefactos relacionados con el movimiento causados por el flujo sanguíneo en el tronco encefálico.
NOTA: La corrección de movimiento utiliza un método de registro de imágenes desarrollado por Thevenaz et al19. - Exporte el vídeo corregido en movimiento como formato TIFF.
- Aplique CNMF-E20 en el vídeo corregido por movimiento en MATLAB para identificar neuronas individuales, siguiendo las instrucciones para el código MATLAB cnmf-e en el repositorio en línea21.
NOTA: CNMF-E es un enfoque de factorización de matriz no negativa restringido personalizado para imágenes de un fotón. Los scripts de demostración del repositorio se pueden modificar y utilizar para procesar datos.
Resultados
Aquí presentamos una grabación representativa obtenida con el método según lo descrito. La Figura 6a muestra la ubicación de las celdas de E/S brillantemente etiquetadas visualizadas durante el experimento. Las rayas diagonales oscuras son vasos sanguíneos. Tenga en cuenta el brillo variable de las células individuales, resultante de la eficacia de transfección variable. En el panel figura 6b mostramos las trazas de intensidad de fluorescencia normalizada media (deltaF/F) obtenidas de la somata indicada con colores y números en el panel a. Las deflexiones ascendentes representan aumentos transitorios en calcio intracelular. Observe cómo el diferente nivel de expresión de GCaMP6s (reflejado en el brillo de la celda en el panel a) conduce a relaciones de señal a ruido (SNR) variables.
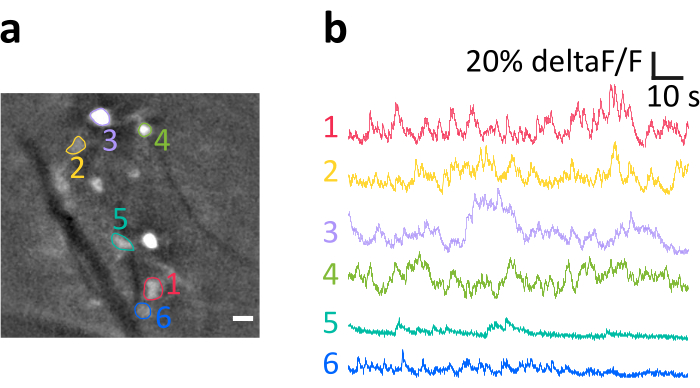
Figura 6:Ejemplo de registro de la actividad de las neuronas IO en ratón anestesiado. ( a ) Ejemplo representativo de una grabación después del filtrado espacial. Los puntos brillantes son los somata neuronales IO, varios de los cuales se han indicado como regiones de interés (ROIs, números coloreados). Las rayas oscuras son vasos sanguíneos. b) Ejemplo de trazas deltaF/F obtenidas de las IDI indicadas en el panel a. Las deflexiones hacia arriba reflejan aumentos en la señal de calcio. Barra de escala en a=10 μm. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Como el procedimiento quirúrgico implica operaciones realizadas en la región de la garganta con numerosas estructuras vitalmente críticas (arterias, nervios), es esencial que sea realizado por un investigador con habilidades quirúrgicas de alto nivel. A continuación, destacamos y comentamos varios puntos clave del procedimiento; sin embargo, debe recordarse que ninguna cantidad de consejos escritos puede suplantar la experiencia, la habilidad y la intuición del investigador.
El paso más crítico en la cirugía es la traqueotomía. Consiste en cortar la tráquea, cambiar el isoflurano del cono de la nariz al tubo de intubación, asegurar la tráquea a la piel del pecho y unir la tráquea y el tubo de intubación. Todas estas operaciones deben completarse de manera suave y rápida para evitar accidentes, como anestesia inadecuada, entrada de líquido en la tráquea o deslizamiento del tubo de intubación. Uno debe tener el protocolo claro en mente antes de cortar la tráquea.
La hemorragia es una de las principales causas de muerte animal en esta cirugía. Dado que el área del cuello es densa con vasos sanguíneos, el corte solo debe ejecutarse cuando la línea de visión está clara para evitar cortar venas y arterias invisibles. Por lo tanto, los músculos y los tejidos conectivos que oscurecen la visión deben ser removidos, y la sangre de los capilares rotos debe limpiarse antes de avanzar.
El animal se puede mantener con vida durante mucho tiempo (más de 8 horas) desde el inicio de la cirugía. Sin embargo, es importante terminar el procedimiento quirúrgico rápidamente para que haya más tiempo para examinar las neuronas del tronco encefálico cuando la condición fisiológica animal es buena. Un investigador experto puede terminar todo el procedimiento en 70 min.
Si bien el método proporciona una vista limpia de las superficies ventrales del cerebro, desafortunadamente es imposible hacerlo sin realizar una traqueotomía, así como eliminar una cantidad significativa de tejido en la región de la garganta. Por lo tanto, no se puede permitir que el animal se despierte de la anestesia. Además, a pesar de que es posible mantener al animal con vida durante muchas horas con un ajuste cuidadoso de la administración de anestésicos, el mantenimiento de la temperatura corporal y la hidratación, es inevitable que la experimentación prolongada eventualmente conduzca al debilitamiento de la condición animal. Se deja a la experiencia del investigador considerar la duración máxima de las grabaciones estables.
Otra limitación potencial del método como se describe aquí es que como la lente GRIN no se inserta en el parénquima cerebral, sólo las neuronas relativamente superficiales (~ 150-200 μm) pueden ser examinadas. Mientras que la implantación quirúrgica de la lente GRIN es técnicamente posible, el método de cirugía aguda no permite suficiente tiempo para que las neuronas se recuperen del estrés oxidativo y la presencia de sangre después de la implantación probablemente degradará la calidad de la imagen más allá de lo aceptable.
A pesar de las preocupaciones antedichos, creemos que ésta es la primera vez que un método para la proyección de imagen in vivo de las neuronas del IO se presenta. Permite el examen de la actividad espaciotemporal en las neuronas IO en el contexto in vivo en presencia de entradas aferentes intactas de los sistemas sensoriales, así como las señales de los núcleos cerebelosos y la unión mesodiencefálica22,una hazaña que no ha sido posible hasta ahora. Con este método, la función de la IO ahora se puede investigar en mayor profundidad con la combinación de estimulación sensorial y optogenética. En particular, con la evolución de las imágenes de voltaje (como nuestro método reciente para la obtención de imágenes de voltaje en el IO 23),esperamos que el método quirúrgico presentado inspire a numerosos investigadores a asumir el desafío de investigar cómo el IO contribuye a la generación de picos complejos cerebelosos.
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Agradecemos a Andrew Scott del centro de medios de OIST por su ayuda con la grabación y edición de video. Además, agradecemos a Hugo Hoedemaker por su ayuda con el desarrollo de la cirugía para exponer el tronco encefálico y al Dr. Kevin Dorgans por su ayuda con el dibujo de diagramas para figuras. Además, un gran agradecimiento a Salvatore Lacava por su narración de voz en general, así como a todos los miembros y mascotas de nRIM por su continuo apoyo al bienestar en los tiempos difíciles de COVID-19.
Materiales
| Name | Company | Catalog Number | Comments |
| AAV.CAG.GCaMP6s.WPRE.SV40 | Addgene, USA | 100844-AAV9 | |
| Absorbable suture with 6 mm half circle needle | Natume, Japan | L6-60N2 | hook needle with thread |
| Absorption triangles | FST, Germany | 18105-03 | Surgical sponges |
| Stereo microscopes | Leica, Germany | M50 | |
| Castroviejo curved tip needle holder with lock | FST, Germany | 12061-01 | Surgery tool |
| cotton swabs | Sanyo, Japan | HUBY-340 | |
| Delicate suture tying forceps | FST, Germany | 11063-07 | Surgery tool |
| Delicate Suture Tying Forceps | FST, Germany | 11063-07 | Surgery tool |
| Dumont #5/45 forceps | FST, Germany | 11251-35 | Surgery tool |
| Fine Iris scissors | FST, Germany | 14060-09 | Surgery tool |
| Friedman-Pearson rongeur curved tip | FST, Germany | 16221-14 | Surgery tool |
| Gelfoam absorbable gelatin sponge | Pfizer, USA | 0315-08 | Hemostatic gelatin sponge |
| Glass-Capillary Nanoinjection | Neurostar, Germany | n/a | For virus vector injection |
| Graefe Forceps with serrated tip | FST, Germany | 11052-10 | Surgery tool |
| Implantation rod | Inscopix, USA | n/a | It is part of the nVoke2 system. It's designed to nVoke2 miniature microscpe and GRIN lens can be mounted on it |
| IsoFlo | Zoetis, UK | n/a | Isoflurane |
| KETALAR FOR INTRAMUSCULAR INJECTION | Daiichi Sankyo, Japan | n/a | Ketamine |
| Kimwipes | Kimberly-Clark, USA | Cleaning tissue | |
| Laser-Based Micropipette Puller | Sutter Instrument, USA | P-2000 | |
| Micropipette Beveler | Sutter Instrument, USA | BV-10 | |
| Motorized Stereotaxic based on Kopf, Model 900 | Neurostar, Germany | n/a | Stereotaxic frame |
| mouseOxPlus with rectal temperature sensor and thigh clamp pulse oximeter | Starr Life Sciences, PA, USA | MouseOxPlus | Measures animal heart rate, arterial oxygen saturation (SpO2), breath rate, and temperature |
| nVoke2 integrarted Calcium imaging micro camera system | Inscopix, USA | 1000-003026 | Miniature microscope |
| Ohaus Compact Scales | Ohaus, USA | CS 200 | Scale used to weight animal |
| Otsuka Normal Saline | Otsuka Pharmaceutical Factory, Japan | n/a | |
| Physiological-biological temperature controller system | SuperTech Instruments, Hungary | TMP-5b | Thermal pad for mouse |
| ProView Lens Probe 1.0 mm diameter, 9.0 mm length | Inscopix, USA | 1050-002214 | Gradient-refractive index (GRIN) lens |
| Q114-53-10NP glass capillaries | Sutter Instrument, USA | 112017 | Customized quartz glass capillaries |
| Safety IV Catheter 20G | B. Braun, Germany | 4251652-03 | 20 gauage catheter used to prepare intubation tube |
| Sand paper | ESCO, Japan | EA366MC | Used to polish the tip of 25G needle to prepare curved and blunt needle |
| Scalpel blade | Muromachi Kikai, Japan | 10010-00 | Used to cut the tip of quartz glass pipette |
| SomnoSuite low flow inhalation anesthesia system | Kent Scientific, USA | SOMNO | Provides precise control of isoflurane flow |
| Surgic XT Plus drill | NSK | Y1002774 | For virus vector injection |
| Syringe 1 ml | Terumo, Japan | SS-01T | |
| Syringe needle 25G | Top, Japan | 00819 | Used to make blunt and bended needle |
| Syringe needle 26G | Terumo, Japan | NN-2613S | |
| Thrive 2100 Professional Trimmer | Thrive, Japan | n/a | Shaver |
| Vannas-Tübingen spring scissors | FST, Germany | 15004-08 | Surgery tool |
| Vaseline | Hayashi Pure Chemical, Japan | 22000255 | |
| Veet sensitive skin | Veet, Canada | n/a | Hair removal cream |
| Xylocaine Jelly 2 % 30ml | Aspen Japan, Japan | 871214 |
Referencias
- Russell, J. T. Imaging calcium signals in vivo: A powerful tool in physiology and pharmacology. British Journal of Pharmacology. , (2011).
- Zhang, T., et al. Kilohertz two-photon brain imaging in awake mice. Nature Methods. , (2019).
- Lin, X., Zhao, T., Xiong, W., Wen, S., Jin, X., Xu, X. M. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. Journal of Visualized Experiments. 2019 (143), 1-8 (2019).
- Lee, H. S., Han, J. H. Successful In vivo Calcium Imaging with a Head-Mount Miniaturized Microscope in the Amygdala of Freely Behaving Mouse. Journal of visualized experiments. (162), 1-19 (2020).
- Aharoni, D., Khakh, B. S., Silva, A. J., Golshani, P. All the light that we can see: a new era in miniaturized microscopy. Nature Methods. 16 (1), 11-13 (2019).
- Khosrovani, S., Van Der Giessen, R. S., De Zeeuw, C. I., De Jeu, M. T. G. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proceedings of the National Academy of Sciences. 104 (40), 15911-15916 (2007).
- Osten, P., Cetin, A., Komai, S., Eliava, M., Seeburg, P. H. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1 (6), 3166-3173 (2007).
- Berg, L., Gerdey, J., Masseck, O. A. Optogenetic Manipulation of Neuronal Activity to Modulate Behavior in Freely Moving Mice. Journal of visualized experiments : JoVE. , e61023 (2020).
- Green, C. J., Knight, J., Precious, S., Simpkin, S. Ketamine alone and combined with diazepam or xylazine in laboratory animals: A 10 year experience. Laboratory Animals. 15 (2), 163-170 (1981).
- Tsukamoto, A., Serizawa, K., Sato, R., Yamazaki, J., Inomata, T. Vital signs monitoring during injectable andn inhalant anesthesia in mice. Experimental Animals. 64 (1), 57-64 (2015).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harbor Protocols. 6 (2), 174-178 (2011).
- Vrieler, N., et al. Variability and directionality of inferior olive neuron dendrites revealed by detailed 3D characterization of an extensive morphological library. Brain Structure and Function. , 1677-1695 (2019).
- Esposito, M. S., Capelli, P., Arber, S. Brainstem nucleus MdV mediates skilled forelimb motor tasks. Nature. , (2014).
- Martin, E. M., Devidze, N., Shelley, D. N., Westberg, L., Fontaine, C., Pfaff, D. W. Molecular and neuroanatomical characterization of single neurons in the mouse medullary gigantocellular reticular nucleus. Journal of Comparative Neurology. , (2011).
- Cold Spring Harbor. Ketamine/Xylazine. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. eLife. 8, 1-45 (2019).
- Lu, J., et al. MIN1PIPE: A Miniscope 1-Photon-Based Calcium Imaging Signal Extraction Pipeline. Cell Reports. 23 (12), 3673-3684 (2018).
- . GitHub - PeyracheLab/miniscoPy: A package to analyse calcium imaging data recorded with the Miniscope Available from: https://github.com/PeyracheLab/miniscoPy (2020)
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. , (1998).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. eLife. 7, 1-37 (2018).
- . GitHub - zhoupc/CNMF_E: Constrained Nonnegative Matrix Factorization for microEndoscopic data Available from: https://github.com/zhoupc/CNMF_E (2020)
- De Gruijl, J. R., Bosman, L. W. J., De Zeeuw, C. I., De Jeu, M. T. G. Inferior olive: All ins and outs. Handbook of the Cerebellum and Cerebellar Disorders. , (2013).
- Dorgans, K., Kuhn, B., Uusisaari, M. Y. Imaging Subthreshold Voltage Oscillation With Cellular Resolution in the Inferior Olive in vitro. Frontiers in Cellular Neuroscience. , (2020).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados