Method Article
In vivo Imagerie du calcium chez la souris Olive inférieure
Dans cet article
Résumé
Nous présentons un protocole pour exposer le tronc cérébral de la souris adulte du côté ventral. En utilisant une lentille à indice de réfraction gradient avec un microscope miniature, l’imagerie au calcium peut être utilisée pour examiner l’activité de la somata neuronale olive inférieure in vivo.
Résumé
L’olive inférieure (IO), un noyau dans la médulle ventrale, est la seule source de fibres grimpantes qui forment l’une des deux voies d’entrée entrant dans le cervelet. IO a longtemps été proposé pour être crucial pour le contrôle de moteur et son activité est actuellement considérée au centre de nombreuses hypothèses de moteur et de fonctions cognitives du cervelet. Bien que sa physiologie et sa fonction aient été relativement bien étudiées in vitro auniveau unicellulaire, il n’y a actuellement aucun rapport sur l’organisation de l’activité du réseau IO chez les animaux vivants. Ceci est en grande partie dû à l’emplacement anatomique extrêmement difficile de l’IO, le rendant difficile à soumettre aux méthodes fluorescentes conventionnelles d’imagerie, où un chemin optique doit être créé à travers tout le cerveau situé dorsalement à la région d’intérêt.
Nous décrivons ici une méthode alternative pour obtenir des données d’imagerie calcique de pointe à partir du réseau IO. La méthode tire parti de l’emplacement ventral extrême de l’IO et implique une procédure chirurgicale pour insérer une lentille gradient-réfractive index (GRIN) à travers les viscères de cou pour entrer en contact avec la surface ventrale du capteur de calcium GCaMP6s-exprimant IO chez les souris anesthésiées. Un enregistrement représentatif de formation image de calcium est montré pour démontrer la faisabilité d’enregistrer l’activité de neurone IO après la chirurgie. Bien qu’il s’agisse d’une chirurgie de non-survie et que les enregistrements doivent être effectués sous anesthésie, elle évite les dommages aux noyaux critiques pour la vie du tronc cérébral et permet de mener une grande variété d’expériences étudiant les modèles d’activité spatio-temporelle et l’intégration d’entrée dans l’OI. Ce procédé avec des modifications a pu être employé pour des enregistrements dans d’autres, régions adjacentes du tronc cérébral ventral.
Introduction
L’objectif principal des neurosciences des systèmes est de comprendre comment les modèles d’activité spatio-temporelle des réseaux neuronaux contribuent à la génération du comportement animal. Ainsi, la méthodologie d’imagerie fluorescente utilisant des sondes sensibles au calcium est devenue au cours de la dernière décennie un outil principal pour examiner l’activité du réseau neuronal chez les animaux vivants1,2, car elle permet la visualisation de cette dynamique à travers des échelles spatiales allant des cellules uniques aux circuits à méso-échelle. Ces dernières années, l’approche courante où les circuits neuronaux dans les structures cérébrales superficielles (telles que les cortex cérébraux ou cérébelleux) sont entqués à travers une fenêtre crânienne transparente3 a été complétée par l’utilisation de lentilles à indice de réfraction gradient (GRIN)4 permettant l’examen de la dynamique des réseaux dans les structures cérébrales profondes. Les lentilles GRIN actuellement disponibles permettent d’atteindre des structures de plusieurs millimètres de profondeur, telles que l’amygdale de souris, l’hippocampe et les ganglions de la base5. Cependant, de nombreuses régions d’intérêt telles que divers noyaux dans la médulle ventrale se trouvent significativement plus profondément, les plaçant à l’extrême de la portée du cristallin GRIN.
Ici, nous décrivons comment surmonter cette difficulté en profitant de l’accessibilité relativement facile de la médulle par l’aspect ventral du cerveau. En utilisant des souris adultes où l’olive inférieure (IO), un noyau dans la médulle ventrale, a été transfectée viralement avec un capteur de calcium GCaMP6s, nous décrivons les étapes chirurgicales (modifiées à partir de la méthode décrite à l’origine dans Khosrovani et al. 20076) pour placer une lentille GRIN sur la surface ventrale du cerveau d’une souris anesthésiée. À l’aide d’un microscope miniature, nous démontrons la faisabilité d’enregistrer l’activité neuronale dans de telles régions cérébrales extrêmement ventrales. Bien que la procédure soit nécessairement une chirurgie de non-survie et qu’aucune expérimentation ne puisse être effectuée chez des animaux éveillés, la méthode permet d’examiner la dynamique de réseau intacte dans le contexte de la stimulation sensorielle ou d’une autre voie afférente, offrant des avantages clairs par rapport aux approches ex vivo telles que l’utilisation de préparations de tranches aiguës.
Protocole
Toutes les lignes directrices internationales, nationales et institutionnelles applicables pour le soin et l’utilisation des animaux ont été suivies. Des techniques aseptiques de chirurgie ont été appliquées à l’injection stéréotaxique de vecteur de virus.
1. Injection stéréotaxique de vecteurs de virus
REMARQUE: Virus porteur du matériel génétique pour exprimer les GCaMP6 (AAV9. Cag. GCaMP6s.WPRE.SV40) est injecté stéréotaxiquement comme décrit précédemment7,8 avec les modifications suivantes.
- Utilisez du verre de quartz (diamètre externe: 1,14 mm, diamètre intérieur: 0,53 mm) au lieu de verre borosilicate pour fabriquer une pipette avec cône long et rigide pour injection IO à l’aide d’un pull capillaire laser avec des paramètres ajustés comme dans le manuel du produit. Après le tirage, couper 1-2 mm de l’extrémité de la pipette avec un scalpel pour acquérir une conicité de 8-10 mm de long avec un diamètre de pointe interne de 15-20 μm (Figure 1a). Finalisez la pipette en biseautant sa pointe en forme d’aiguille à 30° avec un biseauteur de micropipette rotatif pour faciliter la pénétration du cerveau et moins de flexion de la pipette(Figure 1a).
REMARQUE: La pipette en verre borosilicate couramment utilisée sera trop flexible pour cibler correctement les zones profondes lorsqu’elle est tirée à cette longueur. Un injecteur de nanolitres a été utilisé avec la pipette en verre pour administrer le virus dans cette étude. Alternativement, une seringue en verre de précision ou un injecteur de pression peut également être utilisé. - Assurez-vous que le coffre de la souris se trouve sur le coussin thermique afin que son cou ne soit pas étiré avec suffisamment de soutien corporel, et soyez extrêmement prudent avec le nivellement du crâne lors de la fixation de la souris sur le cadre stéréotaxique (Figure 1b).
REMARQUE : la différence Bregma-lambda doit être inférieure à 0,05 mm en dimension verticale. - Utilisez 6,2 mm caudales, ±0,5 mm latérales et 6,6 mm ventrales par rapport à bregma comme coordonnées pour cibler le noyau d’E/S principal(figure 1c).
REMARQUE: Le nivellement parfait du cerveau augmentera considérablement le taux de réussite de l’injection de virus dans IO. Les coordonnées doivent être confirmées par l’expérimentateur, car des différences significatives sont attendues entre les laboratoires, les souches de souris et les chercheurs individuels. Pour préparer le matériel vidéo de cette publication, nous avons utilisé une souris C57Bl/6J mâle. - Suivez les lignes directrices institutionnelles pertinentes pour les soins postopératoires et les procédures de logement pour les animaux transfectés viraux pendant 3-4 semaines.
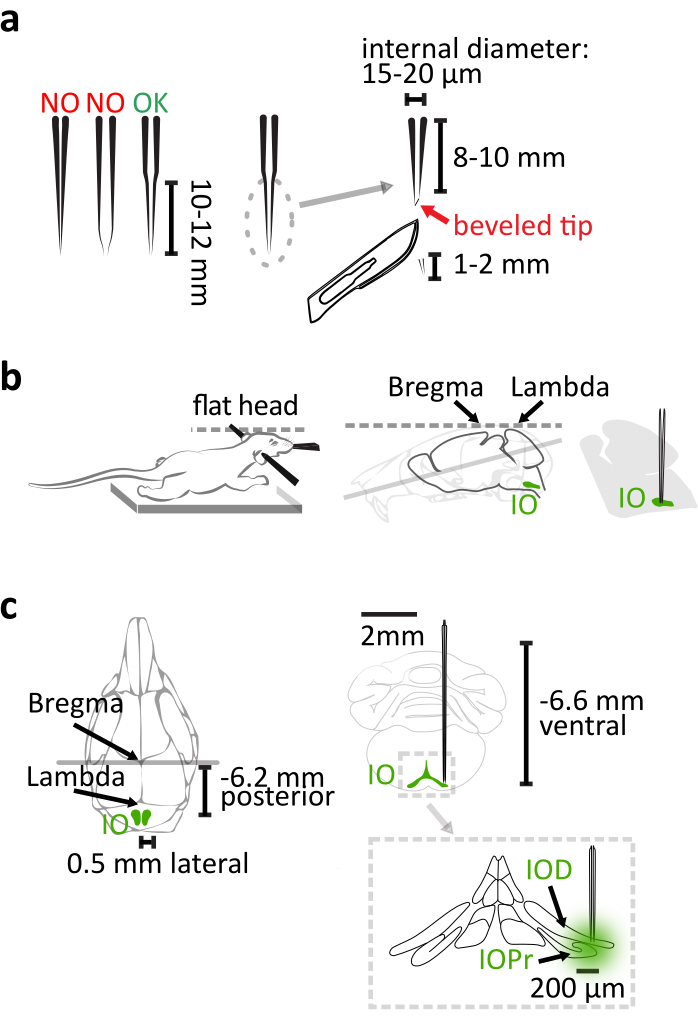
Figure 1: Injection stéréotaxique de vecteur de virus. (a)La pipette en verre de quartz tirée au laser a une conicité droite de 10 à 12 mm de long. Après avoir tiré, couper 1-2 mm de la pointe. La pipette est finalisée en biseautant la pointe en forme d’aiguille à 30°. (b)L’injection correcte repose sur la position correcte du corps de la souris dans le cadre stéréotaxique. Soutenez la poitrine de la souris pour éviter d’étirer le cou. Niveler la tête de la souris en alignant le bregma et lambda horizontalement. (c) La coordination io relative à bregma est montrée dans la vue dorsale (à gauche) du crâne de souris et la vue coronale (en haut à droite) du cerveau. L’injection atteint la partie latérale du principal (IOPr) et les sous-onclei dorsaux (IOD) de IO (en bas à droite). Veuillez cliquer ici pour voir une version plus grande de cette figure.
2. Préparation d’outils et de consommables pour la chirurgie d’approche ventrale
- Préparez un tube d’intubation en coupant une fente de 5 à 6 mm de long et de 0,8 mm de large à partir de l’extrémité d’un cathéter de calibre 20 afin que l’animal intubé puisse expirer (Figure 2a).
REMARQUE: La fente est nécessaire pour que l’animal respire si un vaporisateur isoflurane commun avec un flux d’air constant est utilisé. Si un ventilateur est utilisé en plus du vaporisateur, le cathéter peut être laissé intact. - Préparez une aiguille émoussée pour soutenir la trachée pendant la trachéotomie. Coupez la pointe pointue d’une aiguille de calibre 25 avec une pince. Lisser la surface de fracture avec du papier de verre. Pliez l’aiguille émoussé au milieu à environ 15 ° avec une pince.
REMARQUE: Une aiguille incurvée soulève doucement la trachée. Cela peut diminuer la déformation de la trachée. - Diluer 50 mg/mL de kétamine avec une solution saline à 15 %. La concentration finale est de 7,5 mg/mL.
- Assemblez les outils de chirurgie propre et les consommables, y compris le gel de lidocaïne, la solution saline, les éponges de gélatine, les écouvillons absorbants, la vaseline et les tissus de nettoyage.
- Allumez le vaporisateur d’isoflurane. Réglez le coussin chauffant de l’animal à 38 °C.
- Tournez le cône de nez du cadre stéréotaxique à 180 ° horizontalement, de sorte que la souris puisse être fixée dans le cadre ventral vers le haut. Ajustez la hauteur du cône de nez de sorte qu’il soit au niveau des barres d’oreille.
3. Administration de l’anesthésie et préparation de la souris pour la chirurgie
- Peser l’animal avec une balance et calculer la quantité de kétamine diluée pour injection.
REMARQUE: La quantité totale de kétamine nécessaire est de 56,25 mg par kg de poids corporel. Par conséquent, le volume de kétamine diluée est de 7,5 mL par kg de poids corporel. Les inconvénients de l’utilisation de la kétamine seule comprennent une mauvaise relaxation musculaire, une tachycardie et un tonus musculaire amélioré9. Dans ce protocole, cependant, la kétamine est seulement employée pour couvrir la période 10-20 s pendant laquelle l’administration d’isoflurane est interrompue en raison de la trachéotomie. En gardant cette étape aussi brève que possible, l’effet anesthésique de l’isoflurane n’est pas diminué de manière significative et les inconvénients de l’utilisation de la kétamine sont minimisés. - Placez la souris dans la chambre d’induction anesthésique préremplie d’isoflurane à 5%. Lorsque l’animal est complètement anesthésié, ce qui se manifeste par une perte de réflexe de redressement et un schéma respiratoire plus profond et plus lent, passez le flux d’isoflurane au cône nasal du cadre stéréotaxique et réduisez la concentration d’isoflurane à 2,5%.
- Fixez l’animal dans le cadre stéréotaxique côté ventral vers le haut(Figure 2b). Ajustez l’élévation et le pas du cône de nez pour vous assurer que l’animal peut respirer facilement. Gardez l’animal au chaud avec le coussin chauffant préchauffé.
REMARQUE: Couvrir la partie inférieure du corps de l’animal avec un morceau de papier de soie ou de papier d’aluminium peut aider à maintenir la température de l’animal. - Enlevez les poils de la peau dans les zones de la gorge et de la cuisse à l’l’œuvre à l’l’avec un rasoir et une crème d’épilation(figure 2b). Appliquer par voie topique le gel de lidocaïne sur la peau de la gorge.
REMARQUE: Le capteur de saturation en oxygène périphérique de la pince à cuisse (SpO2),qui sera utilisé dans la procédure 6, fonctionne mieux sur les peaux sans poils. - Surveiller la température de l’animal à l’avec un thermomètre rectal (Figure 2b).
- Injecter 1 mL de solution saline chaude (37 °C) par voie intrapéritonéale pour compenser la perte de liquide pendant la chirurgie.
- Évaluer la profondeur de l’anesthésie par une forte pincement sur les orteils des membres postérieurs. Aucune réponse détectable ne doit être évoquée.
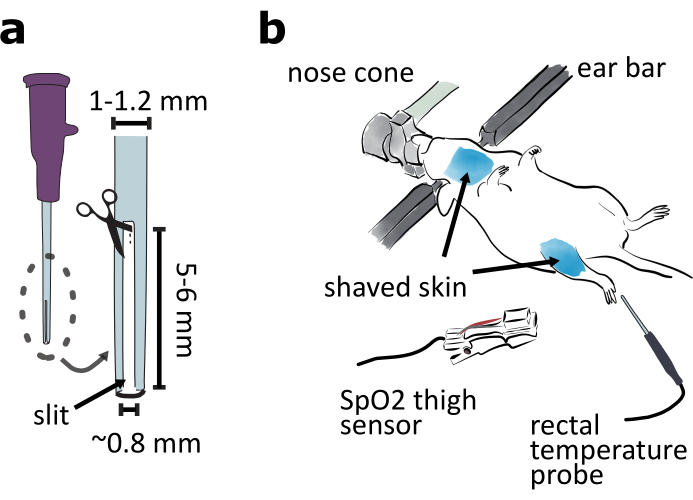
Figure 2: Préparation de la chirurgie d’approche ventrale. (a) Préparer un tube d’intubation en coupant une fente de 5 à 6 mm de long et de 0,8 mm de large dans l’extrémité du cathéter de calibre 20. (b)Monter la face ventrale de l’animal dans un cadre stéréotaxique et ajuster l’angle du cône de nez pour vous assurer que l’animal respire facilement. Rasez la peau autour de la gorge et des cuisses. Fixez le capteur SpO2 à la cuisse pour surveiller les signes vitaux de la souris. Insérez la sonde de température rectale pour surveiller la température corporelle de la souris. Veuillez cliquer ici pour voir une version plus grande de cette figure.
4. Trachéotomie et intubation (20-25 min)
- Exposition de la trachée.
- Faire une incision verticale dans la peau de la gorge le long de la ligne médiane. Séparez la peau du cou des viscères sous elle en utilisant la méthode de dissection émoussée et coupez la peau pour révéler les glandes salivaires(Figure 3a-b, 4a).
- Libérez les glandes salivaires du tissu conjonctif et retournez-les latéralement pour exposer la trachée recouverte de muscle sternothyroïde avec une pince(figure 3b-c).
REMARQUE: La vaseline peut être appliquée sur les tissus exposés pour les garder humides. Évitez la trachée pour la garder propre pendant les étapes suivantes.
- trachéotomie
- Injecter la première dose de kétamine diluée (7,5 mg/mL) par voie intrapéritonéale, 5 mL par kg de poids corporel (37,5 mg/kg).
REMARQUE: Il faut 3-5 min pour que la kétamine fonctionne, donc la première dose de kétamine doit être injectée avant de séparer la trachée des muscles et des vaisseaux sanguins environnants. La kétamine est administrée en deux injections en raison du risque élevé d’effets de surdosage lorsqu’elle est combinée à une anesthésie isoflurane. - Divisez soigneusement le muscle sternothyroïdienne le long de la ligne médiane avec l’extrémité d’une pince fine pour exposer la trachée (Figure 3c). Détachez la trachée des vaisseaux sanguins et l’œsophage avec des pinces à l’aide de la méthode de dissection émoussée.
- Injecter par voie intrapéritonéale la deuxième dose de kétamine diluée (7,5 mg/mL), soit 2,5 mL par kg de poids corporel (18,75 mg/kg).
- Insérez une aiguille émoussée sous la trachée dans le sens transversal pour la soutenir (Figure 3d). Tenez cette aiguille avec les doigts pour soutenir la trachée. Guider le fil de suture autour du troisième anneau de trachée caudale vers la glande thyroïde à l’aiguille d’un demi-cercle (Figure 3d). Faites quatre liens d’instruments sur cet anneau trachéal.
REMARQUE: Le fil attaché à l’anneau trachéal est utilisé pour fixer la trachée à la poitrine de l’animal. Ne coupez pas le fil de l’aiguille du demi-cercle à cette étape. Les anneaux trachéaux sont faits de cartilage qui est flexible mais moins fort que les os. N’attachez pas le fil de suture trop serré ou l’anneau peut se briser. - Pincez la peau de la poitrine avec une paire de pinces. Percer la peau de la poitrine avec la même aiguille demi-cercle utilisée dans la dernière étape et conduire le fil à travers la peau, en préparation pour fixer la trachée à la poitrine à l’étape suivante (Figure 3d).
- Soulevez doucement la trachée en tirant le fil attaché à l’anneau trachéal et coupez la trachée rostrale à l’anneau attaché et caudale aux glandes thyroïdes. Tirez la trachée caudale vers la poitrine. Soulevez l’ouverture de la trachée en ajoutant un petit morceau d’éponge chirurgicale en dessous.
REMARQUE: Assurez-vous que plus de 5 minutes se sont écoulées après la deuxième injection de kétamine avant de couper la trachée pour assurer le niveau d’anesthésie. - Enlevez tout liquide restant à l’intérieur de l’extrémité d’ouverture de la trachée à l’avec une fine bande de tissu nettoyant. Basculer le flux d’isoflurane du cône de nez stéréotaxique au tube d’intubation. Insérez le tube d’intubation dans la trachée d’environ 2 mm de profondeur et assurez-vous qu’une partie de la fente dans le tube reste à l’extérieur de la trachée pour permettre la respiration(figure 3e,4b).
REMARQUE: Ajustez soigneusement l’angle du tube d’intubation et sa profondeur d’insertion pour que la souris respire en douceur et pour éviter d’endommager la trachée. La vaseline peut être appliquée à l’extérieur de la trachée pour l’empêcher de se dessécher, de sorte que la trachée ne se rompt pas facilement. - Fixez la trachée à la peau de la poitrine en faisant 3-4 liens instrumentaux. Attachez la trachée avec le fil de suture pour fixer le tube d’intubation(figure 3e,4b).
- Injecter la première dose de kétamine diluée (7,5 mg/mL) par voie intrapéritonéale, 5 mL par kg de poids corporel (37,5 mg/kg).
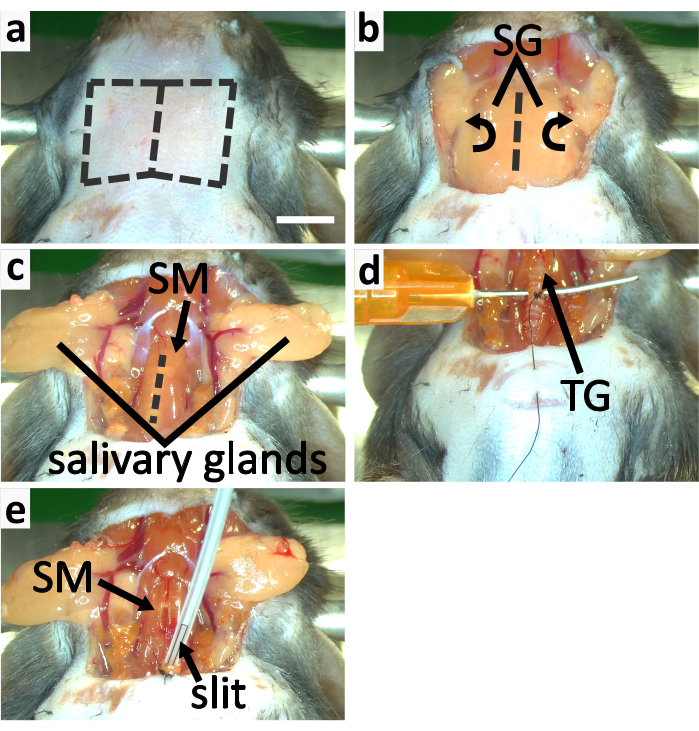
Figure 3: Trachéotomie et intubation de souris. (a-c) panneaux montrent le processus d’exposition de la trachée. (a)Enlever la peau de la gorge en coupant le long des lignes pointillées. b)Retournez latéralement les glandes salivaires (SG) pour exposer la trachée recouverte par le muscle sternothyroïde (SM). c)Fente ouverte SM le long de la ligne pointillée pour exposer la trachée. (d-e) les panneaux montrent la trachéotomie. ( d) Soutenir la trachée avec une aiguille émoussée et incurvée. Attachez le troisième anneau de trachée caudale à la glande thyroïde pour fixer la trachée à la peau de coffre. e)Appliquer l’isoflurane à l’écrébinage. Fixez la trachée à la peau de poitrine avec le fil de suture. Fixez le tube d’intubation à la trachée en les attachant ensemble. La barre d’échelle en a=5 mm s’applique à tous les panneaux. Veuillez cliquer ici pour voir une version plus grande de cette figure.
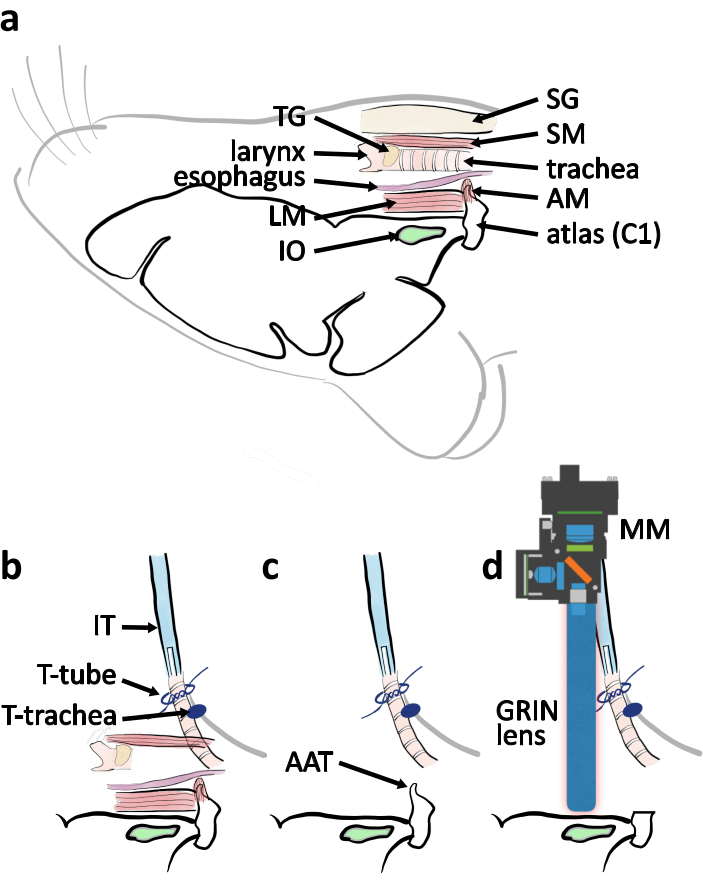
Figure 4: Schéma de principe de la chirurgie d’approche ventrale à partir d’une vue latérale. (a) Undessin schématique avec les parties anatomiques pertinentes indiquées dans leur emplacement relatif lorsque la souris est placée côté ventral vers le haut. Abréviations : muscle couvrant atlas (AM), muscle longitudinal (LM), glandes salivaires (SG), muscle sternothyroïdien (SM), glande thyroïde (TG). b)Schéma de disposition du tube d’intubation par rapport à la trachée lorsque la trachéotomie est terminée. La trachée est fixée par les attaches sur la peau de la poitrine (trachée en T). Le tube d’intubation (IT) est fixé par les attaches autour de l’extrémité de la trachée (tube en T). c)Enlever le tubercule antérieur de l’atlas (AAT) pour dégager la ligne de vision de l’OI. (d)Schéma décrivant le positionnement du microscope miniature (MM) et de la lentille GRIN au-dessus de l’E/S pour l’expérience d’imagerie. Veuillez cliquer ici pour voir une version plus grande de cette figure.
5. Exposition du tronc cérébral (40-45 min)
- Trancher le muscle sternothyroïdienne le long de la fibre musculaire avec la pince fine. Couper la partie isolée avec les ciseaux à ressort(Figure 3e).
- Libérez soigneusement la trachée restante et le larynx des muscles pour minimiser les dommages sur les vaisseaux sanguins dans les muscles. Enlever la trachée restante et le larynx. Libérez l’œsophage du tissu attaché avec une pince et coupez-le avec des ciseaux à ressort. (Figure 5a).
- Enlevez le muscle recouvrant l’arc ventral et le tubercule antérieur de l’atlas à l’aide d’une pince fine et de ciseaux à ressort (figure 5b).
REMARQUE: Lors du retrait du muscle, divisez-en une partie avec la pointe de la pince fine. Coupez la partie séparée avec une paire de ciseaux à ressort. Répétez ceci plusieurs fois pour exposer l’arc ventral d’atlas pour réduire au minimum le risque d’arracher des vaisseaux sanguins. - Couper les arcs ventraux de l’atlas avec un rongeur(figure 4c,5c). Enlever le tubercule antérieur de l’atlas. Retirez le sang et le liquide à l’avec une éponge chirurgicale pour voir le foramen magnum et le tronc cérébral (Figure 4c, 5d).
- Dilatez le foramen magnum en enlevant l’os occipital avec un rongeur. (Figure 5d-e).
- Retirez le cartilage mince au-dessus du foramen magnum avec une pince fine et des ciseaux à ressort. Pelez soigneusement la couche périostéale du dura mater avec une pince fine pour avoir une vue claire du tronc cérébral ventral (Figure 5f). Ne cassez pas la dura mater.
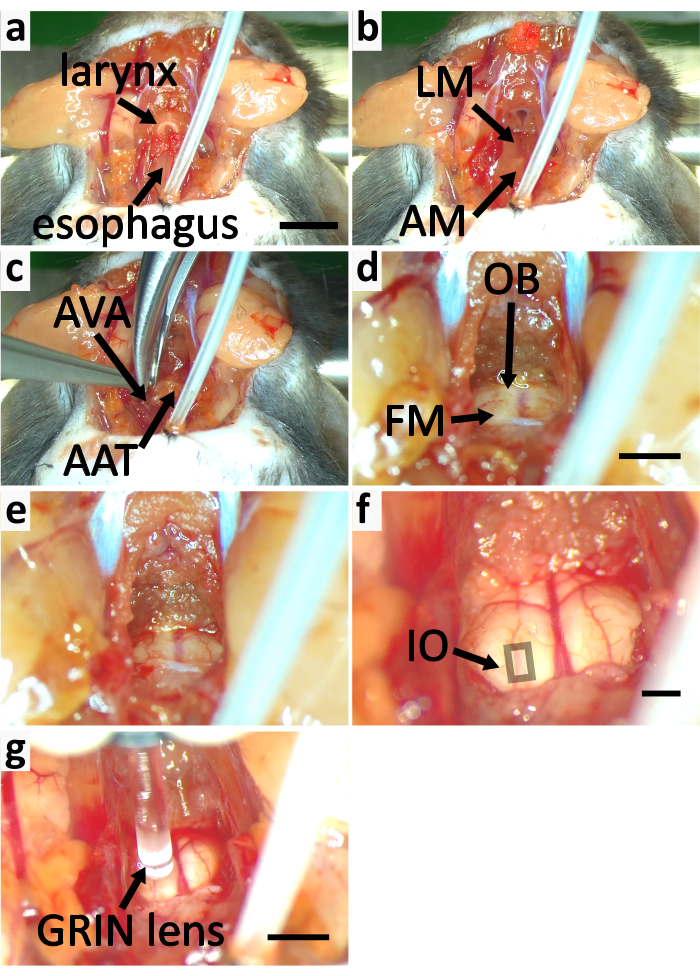
Figure 5: Exposer le tronc cérébral de la souris pour l’imagerie du calcium. (a-f) panneaux montrent le processus d’exposition du tronc cérébral. (a)Enlever le muscle sternothyroïdique (SM) marqué à la figure 3e. Coupez le larynx et l’œsophage. b)Enlever le muscle longitudinal (LM) et l’atlas de couverture musculaire (AM). c)Couper les arcs ventraux de l’atlas (AVA) à l’aide d’un rongeur et enlever le tubercule antérieur de l’atlas (AAT). (d) Couper l’os occipital (OB) pour dilater le foramen magnum (FM). ( e) Fm expansé. (f) Le cartilage mince au-dessus du foramen magnum est enlevé. La couche périostéale de dura mater est décollée. Le carré indique la zone contenant des neurones IO superficiels. (g)Imagez l’IO avec l’objectif GRIN. La barre d’échelle dans a=5 mm, s’applique à a-c. La barre d’échelle en d=2 mm s’applique à d-e. Barre d’échelle en f=2 mm. Barre d’échelle en g=2 mm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
6. Imagerie calcique
- Serrez le capteur SpO2 sur la cuisse de la souris pour surveiller les signes vitaux tels que la fréquence cardiaque, la saturation en oxygène et la fréquence respiratoire(Figure 2b).
REMARQUE: La fréquence cardiaque doit être comprise entre 500 bpm et 600 bpm, la saturation en oxygène doit être supérieure à 90% et la fréquence respiratoire doit être de 50 à 70 respirations par minute10,11. - Montez la sonde de lentille GRIN (longueur de 9 mm, diamètre 1 mm) sur la tige d’implantation.
REMARQUE: Nettoyez la lentille GRIN avec 70% de tissu nettoyant imbibé d’éthanol avant l’imagerie pour une bonne qualité d’imagerie. - Fixez la tige d’implantation sur le cadre stéréotaxique et montez le microscope miniature sur la tige d’implantation.
NOTA : La préparation du microscope miniature pour l’imagerie doit être effectuée conformément aux lignes directrices appropriées de l’utilisateur du produit. - Ajouter plusieurs gouttes de solution saline chaude dans la région du tronc cérébral pour l’immersion de la lentille GRIN.
- Approchez le tronc cérébral avec la lentille GRIN (Figure 4d, 5g). Allumez la LED bleue d’excitation (455 ± 8) dans le microscope miniature. Localisez les neurones d’E/S transfectés par GCaMP6s en surveillant l’image de fluorescence à partir du microscope miniature. Recherchez les neurones IO dans une région en forme de rectangle ~ 0,5-1,7 mm rostral à l’atlas restant et ~ 0,6-1,1 mm latéral à la ligne médiane dans la zone superficielle du tronc cérébral ventral (Figure 5f).
REMARQUE: Lorsque vous recherchez un champ de vision approprié pour l’imagerie IO, recherchez l’emplacement où le diamètre moyen de somata correspond à celui de io neuron somata (environ 15 μm12). Les régions adjacentes dans la formation réticulaire médullaire sont constituées de cellules significativement plus grandes13,14. Soyez prudent lorsque vous déplacez la lentille GRIN verticalement, car appuyer dessus sur le tronc cérébral trop fort peut tuer l’animal.
7. Euthanasier l’animal après la procédure
- À la fin de l’expérience, euthanasier l’animal avec une luxation cervicale ou une autre méthode approuvée par la réglementation locale sur les soins aux animaux de laboratoire.
- Pour une enquête histologique plus approfondie, anesthésiez d’abord l’animal avec un médicament injectable, tel que la combinaison kétamine / xylazine (100 mg / kg et 10 mg / kg, respectivement)15 avant la perfusion cardiaque avec la solution de Ringer suivie d’une solution fixatrice pour fixer le cerveau.
8. Traitement des données
- Prétr traiter la vidéo d’imagerie du calcium enregistrée avant d’analyser les données.
REMARQUE: Le logiciel de traitement de données commercial accompagné du microscope miniature a été utilisé pour cette étape et les étapes de protocole suivantes s’y rapportent. Alternativement, des logiciels libres et open source tels que CaImAn16,MINIPIPE17et MiniscoPy18 peuvent être utilisés à la fois pour le prétraitement et l’analyse.- Chargez la vidéo d’imagerie du calcium enregistrée dans le logiciel de traitement des données.
- Cliquez sur le bouton Prétraitement. Définissez une zone de recadrage excluant les régions sans neurones fluorescents et recadrez la vidéo pour réduire la taille du fichier afin d’accélérer le traitement.
- Cliquez sur le bouton Filtre spatial. Définissez le seuil bas et le seuil élevé pour le filtre spatial sur 0,005 pixel-1et 0,5 pixel-1 respectivement. Appliquez le filtre spatial sur chaque image de la vidéo pour augmenter le contraste et lisser l’image.
Remarque : le filtre spatial est un filtre gaussien passe-bande. Les composants à basse fréquence spatiale provenant de cellules floues peuvent confondre la correction de mouvement à l’étape suivante. Composant de fréquence spatiale élevée peut entraîner la vidéo à apparaître moins lisse. - Cliquez sur le bouton Correction de mouvement. Appliquez la correction de mouvement à la vidéo en utilisant la première image comme cadre de référence pour réduire les artefacts liés au mouvement causés par le flux sanguin dans le tronc cérébral.
REMARQUE: La correction de mouvement utilise une méthode d’enregistrement d’image développée par Thevenaz et al19. - Exportez la vidéo corrigée des mouvements au format TIFF.
- Appliquez CNMF-E20 sur la vidéo corrigée de mouvement dans MATLAB pour identifier les neurones uniques, en suivant les instructions pour le code MATLAB CNMF-E dans le référentiel en ligne21.
REMARQUE: CNMF-E est une approche de factorisation matricielle non négative contrainte personnalisée pour l’imagerie à un photon. Les scripts de démonstration dans le référentiel peuvent être modifiés et utilisés pour traiter les données.
Résultats
Nous présentons ici un enregistrement représentatif obtenu avec le procédé décrit. La figure 6a montre l’emplacement des cellules d’E/S clairement étiquetées visualisées au cours de l’expérience. Les bandes diagonales sombres sont des vaisseaux sanguins. Notez la luminosité variable des cellules individuelles, résultant de l’efficacité variable de la transfection. Dans le panneau figure 6b, nous montrons les traces d’intensité de fluorescence normalisées moyennes (deltaF/F) obtenues à partir de la somata indiquée par des couleurs et des nombres dans le panneau a. Les déviations vers le haut représentent des augmentations transitoires du calcium intracellulaire. Notez comment différents niveaux d’expression GCaMP6s (reflétés dans la luminosité de la cellule dans le panneau a) conduisent à des rapports signal/bruit (SNR) variables.
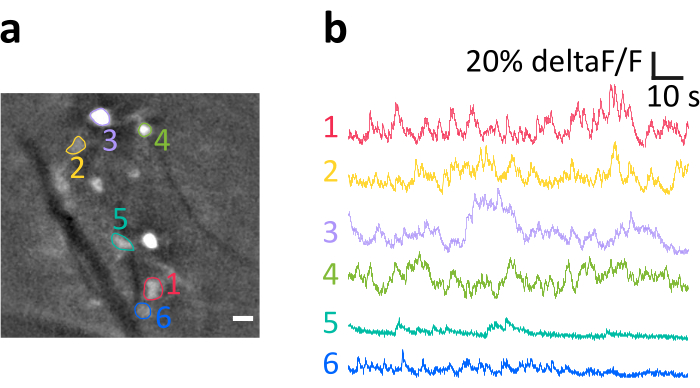
Figure 6: Exemple d’enregistrement de l’activité des neurones IO chez une souris anesthésiée. (a) Exemple représentatif de trame à partir d’un enregistrement après filtrage spatial. Les points lumineux sont la somata neuronale IO, dont plusieurs ont été indiquées comme des régions d’intérêt (ROIs, nombres colorés). Les rayures sombres sont des vaisseaux sanguins. b)Exemple de traces deltaF/F obtenues à partir des ROIs indiqués dans le panneau a. Les déviations vers le haut reflètent l’augmentation du signal de calcium. Barre d’échelle dans a=10 μm. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Comme l’intervention chirurgicale implique des opérations effectuées dans la région de la gorge avec de nombreuses structures vitales (artères, nerfs), il est essentiel qu’elle soit menée par un chercheur ayant des compétences chirurgicales de haut niveau. En suivant, nous soulignons et commentons plusieurs points clés de la procédure; cependant, il faut se rappeler qu’aucune quantité de conseils écrits ne peut supplanter l’expérience, les compétences et l’intuition du chercheur.
L’étape la plus critique de la chirurgie est la trachéotomie. Il s’agit de couper la trachée, de passer l’isoflurane du cône nasal au tube d’intubation, de fixer la trachée à la peau de la poitrine et d’attacher la trachée et le tube d’intubation ensemble. Toutes ces opérations doivent être effectuées de manière fluide et rapide pour éviter les accidents, tels qu’une anesthésie inadéquate, un afflux de liquide dans la trachée ou un glissement du tube d’intubation. Il faut garder le protocole clair à l’esprit avant de couper la trachée.
L’hémorragie est l’une des principales causes de mort animale dans cette chirurgie. Étant donné que la région du cou est dense en vaisseaux sanguins, la coupe ne doit être exécutée que lorsque la ligne de visée est claire pour éviter de couper des veines et des artères invisibles. Par conséquent, les muscles et les tissus conjonctifs obscurcissant la vision doivent être enlevés, et le sang des capillaires cassés doit être nettoyé avant d’avancer.
L’animal peut être maintenu en vie pendant une longue période (plus de 8 heures) à partir du début de la chirurgie. Cependant, il est important de terminer l’intervention chirurgicale rapidement afin qu’il y ait plus de temps pour examiner les neurones du tronc cérébral lorsque l’état physiologique de l’animal est bon. Un chercheur qualifié peut terminer toute la procédure en 70 min.
Bien que la méthode offre une vue propre des surfaces ventrales du cerveau, il est malheureusement impossible de le faire sans effectuer une trachéotomie ainsi que l’élimination d’une quantité importante de tissu dans la région de la gorge. Par conséquent, l’animal ne peut pas être autorisé à se réveiller de l’anesthésie. De plus, même s’il est possible de maintenir l’animal en vie pendant de nombreuses heures avec un ajustement minutieux de l’administration anesthésique, le maintien de la température corporelle et de l’hydratation, il est inévitable que l’expérimentation prolongée finisse par affaiblir la condition animale. Il est laissé à l’expertise du chercheur de considérer la durée maximale des enregistrements stables.
Une autre limitation potentielle de la méthode décrite ici est que comme la lentille GRIN n’est pas insérée dans le parenchyme cérébral, seuls les neurones relativement superficiels (~ 150-200 μm) peuvent être examinés. Bien que l’implantation chirurgicale du cristallin GRIN soit techniquement possible, la méthode de chirurgie aiguë ne laisse pas suffisamment de temps aux neurones pour récupérer du stress oxydatif et la présence de sang après l’implantation dégradera probablement la qualité de l’image au-delà de l’acceptable.
Malgré les préoccupations ci-dessus, nous croyons que c’est la première fois qu’une méthode pour l’imagerie in vivo des neurones d’IO est présentée. Il permet d’examiner l’activité spatio-temporelle dans les neurones IO dans le contexte in vivo en présence d’entrées afférentes intactes provenant des systèmes sensoriels ainsi que les signaux des noyaux cérébelleux et de la jonction mésoodencéphalique22,un exploit qui n’a pas été possible jusqu’à présent. Avec cette méthode, la fonction de l’IO peut maintenant être étudiée plus en profondeur avec une combinaison de stimulation sensorielle et optogénétique. Notamment, avec l’évolution de l’imagerie de tension (telle que notre récente méthode d’imagerie de tension dans l’IO 23),nous espérons que la méthode chirurgicale présentée inspirera de nombreux chercheurs à relever le défi d’étudier comment l’IO contribue à la génération de pointes complexes cérébelleux.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous remercions Andrew Scott du centre des médias de l’OIST pour son aide à l’enregistrement et au montage vidéo. Nous remercions également Hugo Hoedemaker pour son aide dans le développement de la chirurgie pour exposer le tronc cérébral et le Dr Kevin Dorgans pour son aide dans la rédaction de diagrammes pour les figures. De plus, un grand merci à Salvatore Lacava pour sa narration en voix off, ainsi qu’à tous les membres du nRIM et aux animaux de compagnie pour leur soutien continu au bien-être dans les moments difficiles de COVID-19.
matériels
| Name | Company | Catalog Number | Comments |
| AAV.CAG.GCaMP6s.WPRE.SV40 | Addgene, USA | 100844-AAV9 | |
| Absorbable suture with 6 mm half circle needle | Natume, Japan | L6-60N2 | hook needle with thread |
| Absorption triangles | FST, Germany | 18105-03 | Surgical sponges |
| Stereo microscopes | Leica, Germany | M50 | |
| Castroviejo curved tip needle holder with lock | FST, Germany | 12061-01 | Surgery tool |
| cotton swabs | Sanyo, Japan | HUBY-340 | |
| Delicate suture tying forceps | FST, Germany | 11063-07 | Surgery tool |
| Delicate Suture Tying Forceps | FST, Germany | 11063-07 | Surgery tool |
| Dumont #5/45 forceps | FST, Germany | 11251-35 | Surgery tool |
| Fine Iris scissors | FST, Germany | 14060-09 | Surgery tool |
| Friedman-Pearson rongeur curved tip | FST, Germany | 16221-14 | Surgery tool |
| Gelfoam absorbable gelatin sponge | Pfizer, USA | 0315-08 | Hemostatic gelatin sponge |
| Glass-Capillary Nanoinjection | Neurostar, Germany | n/a | For virus vector injection |
| Graefe Forceps with serrated tip | FST, Germany | 11052-10 | Surgery tool |
| Implantation rod | Inscopix, USA | n/a | It is part of the nVoke2 system. It's designed to nVoke2 miniature microscpe and GRIN lens can be mounted on it |
| IsoFlo | Zoetis, UK | n/a | Isoflurane |
| KETALAR FOR INTRAMUSCULAR INJECTION | Daiichi Sankyo, Japan | n/a | Ketamine |
| Kimwipes | Kimberly-Clark, USA | Cleaning tissue | |
| Laser-Based Micropipette Puller | Sutter Instrument, USA | P-2000 | |
| Micropipette Beveler | Sutter Instrument, USA | BV-10 | |
| Motorized Stereotaxic based on Kopf, Model 900 | Neurostar, Germany | n/a | Stereotaxic frame |
| mouseOxPlus with rectal temperature sensor and thigh clamp pulse oximeter | Starr Life Sciences, PA, USA | MouseOxPlus | Measures animal heart rate, arterial oxygen saturation (SpO2), breath rate, and temperature |
| nVoke2 integrarted Calcium imaging micro camera system | Inscopix, USA | 1000-003026 | Miniature microscope |
| Ohaus Compact Scales | Ohaus, USA | CS 200 | Scale used to weight animal |
| Otsuka Normal Saline | Otsuka Pharmaceutical Factory, Japan | n/a | |
| Physiological-biological temperature controller system | SuperTech Instruments, Hungary | TMP-5b | Thermal pad for mouse |
| ProView Lens Probe 1.0 mm diameter, 9.0 mm length | Inscopix, USA | 1050-002214 | Gradient-refractive index (GRIN) lens |
| Q114-53-10NP glass capillaries | Sutter Instrument, USA | 112017 | Customized quartz glass capillaries |
| Safety IV Catheter 20G | B. Braun, Germany | 4251652-03 | 20 gauage catheter used to prepare intubation tube |
| Sand paper | ESCO, Japan | EA366MC | Used to polish the tip of 25G needle to prepare curved and blunt needle |
| Scalpel blade | Muromachi Kikai, Japan | 10010-00 | Used to cut the tip of quartz glass pipette |
| SomnoSuite low flow inhalation anesthesia system | Kent Scientific, USA | SOMNO | Provides precise control of isoflurane flow |
| Surgic XT Plus drill | NSK | Y1002774 | For virus vector injection |
| Syringe 1 ml | Terumo, Japan | SS-01T | |
| Syringe needle 25G | Top, Japan | 00819 | Used to make blunt and bended needle |
| Syringe needle 26G | Terumo, Japan | NN-2613S | |
| Thrive 2100 Professional Trimmer | Thrive, Japan | n/a | Shaver |
| Vannas-Tübingen spring scissors | FST, Germany | 15004-08 | Surgery tool |
| Vaseline | Hayashi Pure Chemical, Japan | 22000255 | |
| Veet sensitive skin | Veet, Canada | n/a | Hair removal cream |
| Xylocaine Jelly 2 % 30ml | Aspen Japan, Japan | 871214 |
Références
- Russell, J. T. Imaging calcium signals in vivo: A powerful tool in physiology and pharmacology. British Journal of Pharmacology. , (2011).
- Zhang, T., et al. Kilohertz two-photon brain imaging in awake mice. Nature Methods. , (2019).
- Lin, X., Zhao, T., Xiong, W., Wen, S., Jin, X., Xu, X. M. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. Journal of Visualized Experiments. 2019 (143), 1-8 (2019).
- Lee, H. S., Han, J. H. Successful In vivo Calcium Imaging with a Head-Mount Miniaturized Microscope in the Amygdala of Freely Behaving Mouse. Journal of visualized experiments. (162), 1-19 (2020).
- Aharoni, D., Khakh, B. S., Silva, A. J., Golshani, P. All the light that we can see: a new era in miniaturized microscopy. Nature Methods. 16 (1), 11-13 (2019).
- Khosrovani, S., Van Der Giessen, R. S., De Zeeuw, C. I., De Jeu, M. T. G. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proceedings of the National Academy of Sciences. 104 (40), 15911-15916 (2007).
- Osten, P., Cetin, A., Komai, S., Eliava, M., Seeburg, P. H. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1 (6), 3166-3173 (2007).
- Berg, L., Gerdey, J., Masseck, O. A. Optogenetic Manipulation of Neuronal Activity to Modulate Behavior in Freely Moving Mice. Journal of visualized experiments : JoVE. , e61023 (2020).
- Green, C. J., Knight, J., Precious, S., Simpkin, S. Ketamine alone and combined with diazepam or xylazine in laboratory animals: A 10 year experience. Laboratory Animals. 15 (2), 163-170 (1981).
- Tsukamoto, A., Serizawa, K., Sato, R., Yamazaki, J., Inomata, T. Vital signs monitoring during injectable andn inhalant anesthesia in mice. Experimental Animals. 64 (1), 57-64 (2015).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harbor Protocols. 6 (2), 174-178 (2011).
- Vrieler, N., et al. Variability and directionality of inferior olive neuron dendrites revealed by detailed 3D characterization of an extensive morphological library. Brain Structure and Function. , 1677-1695 (2019).
- Esposito, M. S., Capelli, P., Arber, S. Brainstem nucleus MdV mediates skilled forelimb motor tasks. Nature. , (2014).
- Martin, E. M., Devidze, N., Shelley, D. N., Westberg, L., Fontaine, C., Pfaff, D. W. Molecular and neuroanatomical characterization of single neurons in the mouse medullary gigantocellular reticular nucleus. Journal of Comparative Neurology. , (2011).
- Cold Spring Harbor. Ketamine/Xylazine. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. eLife. 8, 1-45 (2019).
- Lu, J., et al. MIN1PIPE: A Miniscope 1-Photon-Based Calcium Imaging Signal Extraction Pipeline. Cell Reports. 23 (12), 3673-3684 (2018).
- . GitHub - PeyracheLab/miniscoPy: A package to analyse calcium imaging data recorded with the Miniscope Available from: https://github.com/PeyracheLab/miniscoPy (2020)
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. , (1998).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. eLife. 7, 1-37 (2018).
- . GitHub - zhoupc/CNMF_E: Constrained Nonnegative Matrix Factorization for microEndoscopic data Available from: https://github.com/zhoupc/CNMF_E (2020)
- De Gruijl, J. R., Bosman, L. W. J., De Zeeuw, C. I., De Jeu, M. T. G. Inferior olive: All ins and outs. Handbook of the Cerebellum and Cerebellar Disorders. , (2013).
- Dorgans, K., Kuhn, B., Uusisaari, M. Y. Imaging Subthreshold Voltage Oscillation With Cellular Resolution in the Inferior Olive in vitro. Frontiers in Cellular Neuroscience. , (2020).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon