Method Article
In vivo Imaging del calcio nell'oliva inferiore del topo
In questo articolo
Riepilogo
Presentiamo un protocollo per esporre il tronco encefalico del topo adulto dal lato ventrale. Utilizzando una lente indice gradient-rifrazione con un microscopio in miniatura, l'imaging di calcio può essere utilizzato per esaminare l'attività dei somata neurali olivari inferiori in vivo.
Abstract
L'oliva inferiore (IO), un nucleo nel midollo ventrale, è l'unica fonte di fibre rampicanti che formano uno dei due percorsi di ingresso che entrano nel cervelletto. L'IO è stato a lungo proposto per essere cruciale per il controllo motorio e la sua attività è attualmente considerata al centro di molte ipotesi di funzioni motorie e cognitive del cervelletto. Mentre la sua fisiologia e funzione sono state relativamente ben studiate a livello di singola cellula in vitro, attualmente non ci sono rapporti sull'organizzazione dell'attività della rete IO negli animali viventi. Ciò è in gran parte dovuto alla posizione anatomica estremamente impegnativa dell'IO, rendendo difficile l'argomento dei metodi convenzionali di imaging fluorescente, dove un percorso ottico deve essere creato attraverso l'intero cervello situato dorsalmente nella regione di interesse.
Qui descriviamo un metodo alternativo per ottenere dati di imaging di calcio all'avanguardia dalla rete IO. Il metodo sfrutta l'estrema posizione ventrale dell'IO e prevede una procedura chirurgica per l'inserimento di una lente indice gradiente-rifrazione (GRIN) attraverso i visceri del collo per entrare in contatto con la superficie ventrale del sensore di calcio GCaMP6s-espresso IO in topi anestetizzati. Una registrazione rappresentativa dell'imaging del calcio dimostra la fattibilità di registrare l'attività dei neuroni IO dopo l'intervento chirurgico. Sebbene si tratta di un intervento chirurgico di non sopravvivenza e le registrazioni devono essere condotte in anestesia, evita danni ai nuclei del tronco encefalico critici per la vita e consente di condurre una grande varietà di esperimenti che studiano i modelli di attività spaziotemporale e l'integrazione dell'input nell'IO. Questa procedura con modifiche potrebbe essere utilizzata per registrazioni in altre regioni adiacenti del tronco encefalico ventrale.
Introduzione
L'obiettivo principale delle neuroscienze dei sistemi è capire come i modelli di attività spaziotemporale delle reti neuronali contribuiscano alla generazione di comportamenti animali. Pertanto, la metodologia di imaging fluorescente che utilizza sonde sensibili al calcio è diventata nell'ultimo decennio uno strumento principale per esaminare l'attività della rete neuronale negli animaliviventi 1,2, in quanto consente la visualizzazione di tali dinamiche su scale spaziali che vanno dalle singole cellule ai circuiti mesoscala. Negli ultimi anni, l'approccio comune in cui i circuiti neurali nelle strutture cerebrali superficiali (come cortici cerebrali o cerebellari) sono immagini attraverso una finestra cranaletrasparente 3 è stato completato con l'uso di lenti dell'indice gradiente-rifrazione (GRIN)4 che consentono l'esame della dinamica di rete nelle strutture cerebrali profonde. Le lenti GRIN attualmente disponibili consentono di raggiungere strutture profonde diversi millimetri, come l'amigdala del topo, l'ippocampo e i gangli basali5. Tuttavia, molte regioni di interesse come vari nuclei nel midollo ventrale si trovano significativamente più in profondità, posizionandoli all'estremo della portata della lente GRIN.
Qui, descriviamo come superare questa difficoltà sfruttando l'accessibilità relativamente facile del midollo attraverso l'aspetto ventrale del cervello. Usando topi adulti in cui l'oliva inferiore (IO), un nucleo nel midollo ventrale, è stata trasfettata viralmente con un sensore di calcio GCaMP6s, descriviamo i passaggi chirurgici (modificati dal metodo descritto originariamente in Khosrovani et al. 20076) per posizionare una lente GRIN sulla superficie ventrale del cervello di un topo anestetizzato. Usando un microscopio in miniatura, dimostriamo la fattibilità di registrare l'attività neuronale in regioni cerebrali così estremamente ventrali. Mentre la procedura è necessariamente un intervento chirurgico di non sopravvivenza e nessuna sperimentazione può essere eseguita su animali svegli, il metodo consente l'esame della dinamica di rete intatta nel contesto della stimolazione sensoriale o di altre vie afferenti, fornendo chiari vantaggi rispetto agli approcci ex vivo come l'uso di preparati a fette acute.
Protocollo
Sono state seguite tutte le linee guida internazionali, nazionali e istituzionali applicabili per la cura e l'uso degli animali. Le tecniche di chirurgia asetica sono state applicate all'iniezione vettoriale stereotassica del virus.
1. Iniezione vettoriale di virus stereotassici
NOTA: Virus che trasporta il materiale genetico per esprimere GCaMP6s (AAV9. Cag. GCaMP6s.WPRE.SV40) viene iniettato stereotassicamente come descritto inprecedenza 7,8 con le seguenti modifiche.
- Utilizzare vetro al quarzo (diametro esterno: 1,14 mm, diametro interno: 0,53 mm) invece del vetro borosilicato per fabbricare una pipetta con cono lungo e rigido per iniezione IO utilizzando un estrattore capillare laser con parametri regolati come nel manuale del prodotto. Dopo aver tirato, tagliare 1-2 mm dalla punta della pipetta con un bisturi per acquisire una conio lunga 8-10 mm con un diametro della punta interna di 15-20 μm(Figura 1a). Finalizzare la pipetta smussando la punta a forma di ago a 30° con una smussatura a micropipetta rotante per una maggiore penetrazione cerebrale e una minore flessione delle pipette(Figura 1a).
NOTA: La pipetta di vetro borosilicata comunemente usata sarà troppo flessibile per indirizzare correttamente le aree profonde quando viene tirata a questa lunghezza. Un iniettore di nanoliter è stato utilizzato con la pipetta di vetro per fornire il virus in questo studio. In alternativa, è possibile utilizzare anche una siringa di vetro di precisione o un iniettore di pressione. - Assicurarsi che il torace del mouse si trovi sul cuscinetto termico in modo che il collo non sia allungato con abbastanza supporto per il corpo e fare molta attenzione a livellare il cranio quando si fissa il mouse sul telaio stereotassico (Figura 1b).
NOTA: La differenza Bregma-lambda deve essere inferiore a 0,05 mm in dimensione verticale. - Utilizzare caudale da 6,2 mm, ±0,5 mm laterale e ventrale di 6,6 mm rispetto al bregma come coordinate per il bersaglio del nucleo IO principale (Figura 1c).
NOTA: Il perfetto livellamento del cervello aumenterà drasticamente il tasso di successo dell'iniezione di virus in IO. Le coordinate devono essere confermate dallo sperimentatore in quanto ci si aspetta differenze significative tra laboratori, ceppi di topi e singoli ricercatori. Per preparare materiale video per questa pubblicazione, abbiamo usato un mouse C57Bl/6J maschio. - Seguire le pertinenti linee guida istituzionali per le procedure di assistenza post-operatoria e di alloggio per gli animali virali-trasfetati per 3-4 settimane.
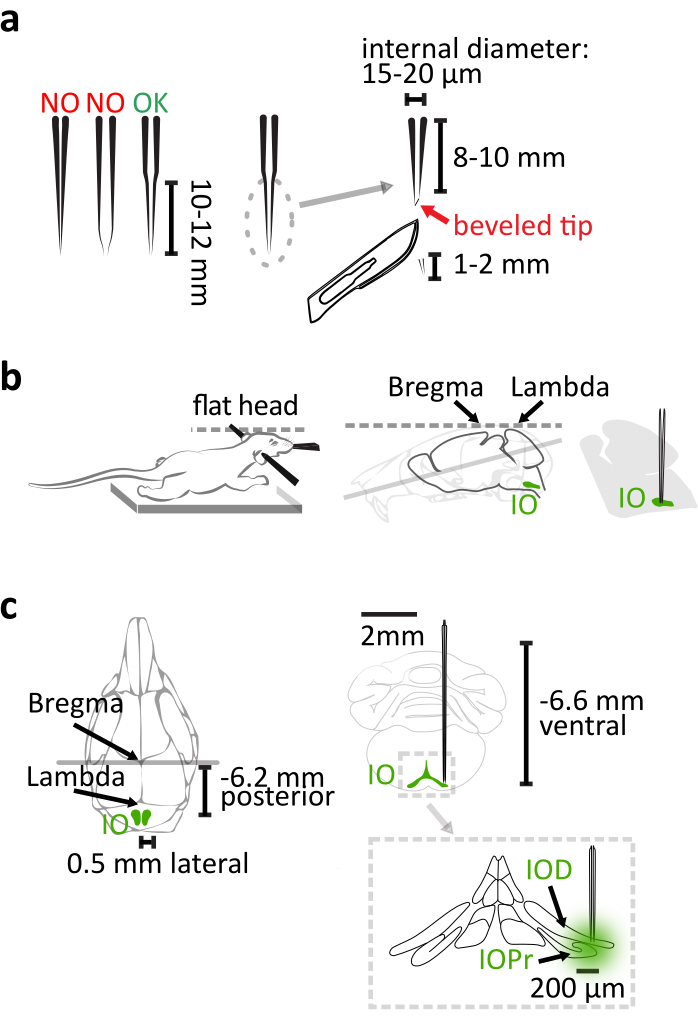
Figura 1: Iniezione vettoriale di virus stereotassica. (a) La pipetta in vetro al quarzo tirata al laser ha una cono dritto lunga 10-12 mm. Dopo aver tirato, tagliare 1-2 mm dalla punta. La pipetta viene finalizzata smussando la punta a forma di ago a 30°. (b) La corretta iniezione si basa sulla corretta posizione del corpo del mouse nel telaio stereotassico. Sostenere il petto del mouse per evitare di allungare il collo. Livellare la testa del mouse allineando orizzontalmente il bregma e il lambda. (c) La coordinazione dell'IO rispetto al bregma è mostrata nella vista dorsale (a sinistra) del cranio del topo e nella vista coronale (in alto a destra) del cervello. L'iniezione raggiunge la parte laterale del principale (IOPr) e i sottonuclei dorsali (IOD) dell'IO (in basso a destra). Clicca qui per visualizzare una versione più grande di questa figura.
2. Preparazione di strumenti e materiali di consumo per la chirurgia dell'approccio ventrale
- Preparare un tubo di intubazione tagliando una fessura lunga da 5 a 6 mm e larga 0,8 mm dalla punta di un catetere calibro 20 in modo che l'animale intubato possa espirarsi(Figura 2a).
NOTA: La fessura è necessaria affinché l'animale respiri se viene utilizzato un comune vaporizzatore di isoflurane con flusso d'aria costante. Se viene utilizzato un ventilatore oltre al vaporizzatore, il catetere può essere lasciato intatto. - Preparare un ago smussato per sostenere la trachea durante la tracheotomia. Tagliare la punta affilata di un ago calibro 25 con pinze. Levigare la superficie di frattura con carta vetrata. Piegare l'ago smussato al centro a circa 15° con pinze.
NOTA: Un ago curvo solleva delicatamente la trachea. Ciò può ridurre la deformazione della trachea. - Diluire 50 mg/mL di ketamina con salina al 15%. La concentrazione finale è di 7,5 mg/mL.
- Assemblare gli strumenti di chirurgia pulita e i materiali di consumo tra cui gel lidocaina, salina, spugne di gelatina, tamponi assorbenti, vaselina e tessuto detergente.
- Accendere il vaporizzatore di isoflurane. Impostare il riscaldante per animali a 38 °C.
- Ruotare il cono del naso del telaio stereotassico di 180° orizzontalmente, in modo che il mouse possa essere fissato nel lato ventrale del telaio verso l'alto. Regolare l'altezza del cono del naso in modo che sia a livello delle barre dell'orecchio.
3. Somministrazione di anestesia e preparazione del topo per l'intervento chirurgico
- Pesare l'animale con una bilancia e calcolare la quantità di ketamina diluita per iniezione.
NOTA: La quantità totale di ketamina necessaria è di 56,25 mg per kg di peso corporeo. Pertanto, il volume di ketamina diluita è di 7,5 mL per kg di peso corporeo. Gli svantaggi dell'uso della ketamina da soli includono scarso rilassamento muscolare, tachicardia e tono muscolaremigliorato 9. In questo protocollo, tuttavia, la ketamina viene utilizzata solo per coprire il periodo di 10-20 s durante il quale la somministrazione di isoflurane viene interrotta a causa della tracheotomia. Mantenendo questo passaggio il più breve possibile, l'effetto anestetico dell'isoflurane non è significativamente diminuito e gli svantaggi che usano la ketamina sono ridotti al minimo. - Posizionare il mouse nella camera di induzione anestetica precompilato con isoflurane al 5%. Quando l'animale è completamente anestetizzato mostrato dalla perdita del riflesso di destro e del modello respiratorio più profondo e lento, passare il flusso di isoflurane al cono del naso del telaio stereotassico e ridurre la concentrazione di isoflurane al 2,5%.
- Fissare l'animale nel lato ventrale del telaio stereotassico verso l'alto (Figura 2b). Regolare l'elevazione e il passo del cono del naso per assicurarsi che l'animale possa respirare facilmente. Mantenere l'animale caldo con la pastiglia riscaldante preriscaldata.
NOTA: Coprire la parte inferiore del corpo animale con un pezzo di carta velina o un foglio di alluminio può aiutare a mantenere la temperatura dell'animale. - Rimuovere i peli della pelle nelle aree della gola e della coscia con un rasoio e una crema per la depilazione(Figura 2b). Applicare localmente il gel di lidocaina sulla pelle della gola.
NOTA: Il sensore di saturazione dell'ossigeno periferico del morsetto della coscia (SpO2),che verrà utilizzato nella procedura 6, funziona meglio sulla pelle senza peli. - Monitorare la temperatura animale con un termometro rettale(figura 2b).
- Iniettare 1 mL di soluzione salina calda (37 °C) intraperitoneale per compensare la perdita di liquidi durante l'intervento chirurgico.
- Valutare la profondità dell'anestesia con un forte pizzico sulle dita degli arti posteriori. Non deve essere evocata alcuna risposta rilevabile.
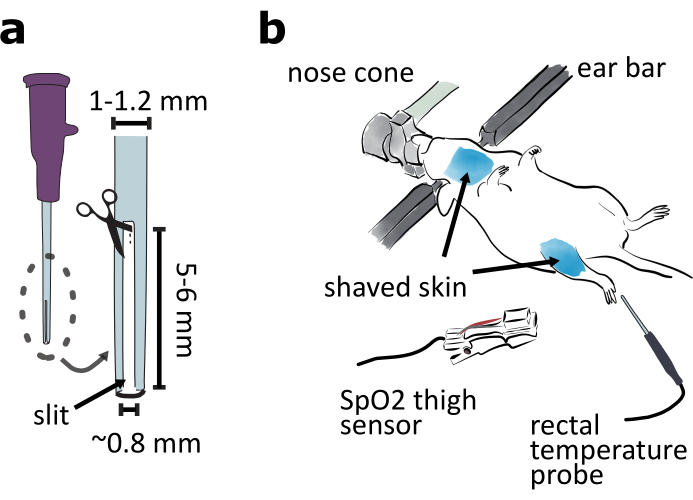
Figura 2: Preparazione della chirurgia dell'approccio ventrale. a ) Preparare un tubo di intubazione tagliando una fessura lunga 5-6 mm e larga 0,8 mm nella punta del catetere a 20 scartamenti. bMontail lato ventrale animale in un telaio stereotassico e regola l'angolo del cono del naso per garantire che l'animale respiri facilmente. Radere la pelle intorno alla gola e alle aree della coscia. Collegare il sensore SpO2 alla coscia per monitorare i segni vitali del mouse. Inserire la sonda di temperatura rettale per monitorare la temperatura corporea del mouse. Clicca qui per visualizzare una versione più grande di questa figura.
4. Tracheotomia e intubazione (20-25 min)
- Esponendo la trachea.
- Fai un'incisione verticale nella pelle della gola lungo la linea mediana. Separare la pelle del collo dai visceri sotto di essa utilizzando il metodo della dissezione smussata e tagliare la pelle per rivelare le ghiandole salivari(Figura 3a-b, 4a).
- Ghiandole salivari libere dal tessuto connettivo e capovolgerle lateralmente per esporre la trachea coperta di muscolo sternotiroideo con forcep (Figura 3b-c).
NOTA: La vaselina può essere applicata sul tessuto esposto per mantenerli umidi. Evitare l'area della trachea per mantenerla pulita per i seguenti passaggi.
- tracheotomia
- Iniettare la prima dose di chetamina diluita (7,5 mg/mL) per via intraperitoneale, 5 mL per kg di peso corporeo (37,5 mg/kg).
NOTA: Ci vogliono 3-5 minuti perché la ketamina funzioni, quindi la prima dose di ketamina deve essere iniettata prima di separare la trachea dai muscoli circostanti e dai vasi sanguigni. La ketamina viene somministrata in due iniezioni a causa dell'elevato rischio di effetti di sovradosaggio se combinata con anestesia isoflurana. - Dividere con cura il muscolo sternotiroide lungo la linea mediana con la punta di una flessoria fine per esporre la trachea (Figura 3c). Staccare la trachea dai vasi sanguigni e dall'esofago con le forcelle usando il metodo della dissezione smussata.
- Iniettare per via intraperitoneale la seconda dose di chetamina diluita (7,5 mg/mL), 2,5 mL per kg di peso corporeo (18,75 mg/kg).
- Inserire un ago smussato sotto la trachea trasversalmente per puntellarlo (Figura 3d). Tenere questo ago con le dita per sostenere la trachea. Guidare il filo di sutura attorno al terzo anello di trachea caudale alla ghiandola tiroidea con un ago a mezzo cerchio (Figura 3d). Crea quattro cravatte per strumenti su questo anello tracheale.
NOTA: Il filo legato all'anello tracheale viene utilizzato per fissare la trachea al petto dell'animale. Non tagliare il filo dall'ago a mezzo cerchio in questo passaggio. Gli anelli tracheali sono fatti di cartilagine che è flessibile ma meno forte delle ossa. Non legare troppo stretto il filo di sutura o l'anello potrebbe rompersi. - Pizzicare la pelle del petto con un paio di forcep. Perforare la pelle del torace con lo stesso ago semicerchiato utilizzato nell'ultimo passaggio e condurre il filo attraverso la pelle, in preparazione per fissare la trachea al petto nella fase successiva(Figura 3d).
- Sollevare delicatamente la trachea tirando il filo legato all'anello tracheale e tagliare la trachea rostrale all'anello legato e caudale alle ghiandole tiroidee. Tirare la trachea caudale verso il petto. Sollevare l'apertura della trachea aggiungendo un piccolo pezzo di spugna chirurgica sotto di essa.
NOTA: Assicurarsi che siano passati più di 5 minuti dopo la seconda iniezione di ketamina prima di tagliare la trachea per garantire il livello di anestesia. - Rimuovere il liquido rimanente all'interno della punta di apertura della trachea con una sottile striscia di tessuto detergente. Passare il flusso di isoflurane dal cono del naso stereotassico al tubo di intubazione. Inserire il tubo di intubazione nella trachea profondo circa 2 mm e assicurarsi che parte della fessura nel tubo rimanga al di fuori della trachea per consentire larespirazione (Figura 3e, 4b).
NOTA: Regolare con cura l'angolo del tubo di intubazione e la sua profondità di inserimento per far respirare il mouse senza intoppi ed evitare di danneggiare la trachea. La vaselina può essere applicata all'esterno della trachea per evitare che si asciughi, quindi la trachea non si rompe facilmente. - Fissare la trachea alla pelle del torace facendo 3-4 cravatte strumentali. Legare la trachea con il filo di sutura per fissare il tubo di intubazione (Figura 3e, 4b).
- Iniettare la prima dose di chetamina diluita (7,5 mg/mL) per via intraperitoneale, 5 mL per kg di peso corporeo (37,5 mg/kg).
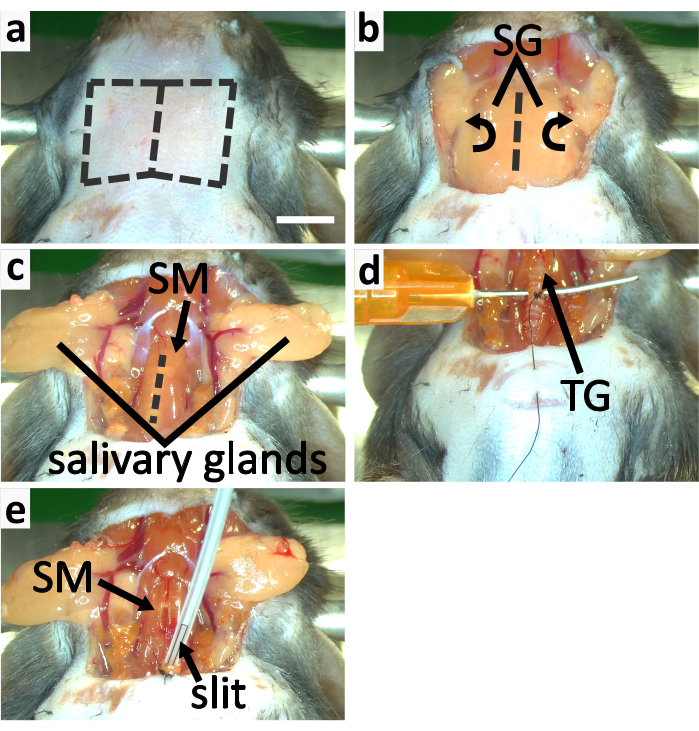
Figura 3: Tracheotomia e intubazione del topo. (a-c) i pannelli mostrano il processo di esposizione della trachea. (a) Rimuovere la pelle della gola tagliando lungo le linee tratteggiate. (b) Capovolgere lateralmente le ghiandole salivari (SG) per esporre la trachea coperta dal muscolo sternotiroideo (SM). (e) Spacco aperto SM lungo la linea tratteggiata per esporre la trachea. (d-e) mostrano la tracheotomia. d Sostenerela trachea con un ago smussato e curvo. Legare il terzo anello di trachea caudale alla ghiandola tiroidea per fissare la trachea alla pelle toracica. (e) Applicare l'isoflurane con un tubo di intubazione con una fessura nella punta. Fissare la trachea sulla pelle del torace con il filo di sutura. Fissare il tubo di intubazione alla trachea legandoli insieme. La barra di scala in a=5 mm si applica a tutti i pannelli. Clicca qui per visualizzare una versione più grande di questa figura.
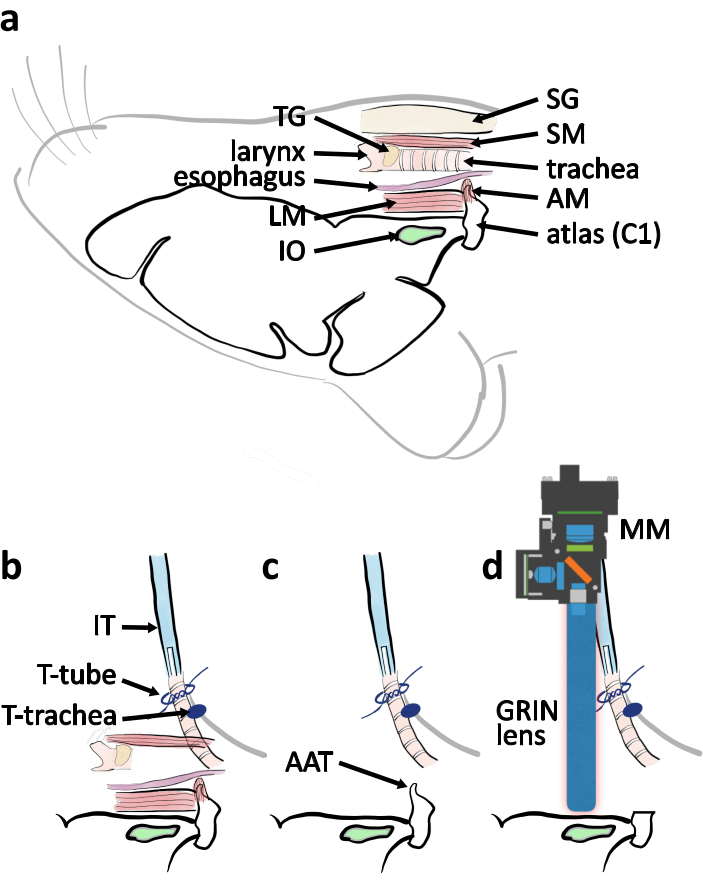
Figura 4: Diagramma schematico della chirurgia dell'approccio ventrale dalla vista laterale. (a) Un disegno schematico con parti anatomiche rilevanti indicate nella loro posizione relativa quando il mouse è posizionato sul lato ventrale verso l'alto. Abbreviazioni: atlante di copertura muscolare (AM), muscolo longitudinale (LM), ghiandole salivari (SG), muscolo sternotiroideo (SM), ghiandola tiroidea (TG). bSchema di disposizione del tubo di intubazione in relazione alla trachea al termine della tracheotomia. La trachea è fissata dalle cravatte sulla pelle del torace (T-trachea). Il tubo di intubazione (IT) è fissato dalle fasce attorno all'estremità della trachea (tubo a T). cRimuovereil tubercolo anteriore dell'atlante (AAT) per cancellare la linea di visione verso l'IO. (d) Schema che descrive il posizionamento del microscopio miniaturico (MM) e dell'obiettivo GRIN sopra l'IO per l'esperimento di imaging. Clicca qui per visualizzare una versione più grande di questa figura.
5. Esposizione del tronco encefalico (40-45 min)
- Tagliare il muscolo sternotiroide lungo la fibra muscolare con le forcep sottili. Tagliare la parte isolata con le forbici a molla(Figura 3e).
- Liberare con cura la trachea sinistra e la laringe dai muscoli per ridurre al minimo il danno sui vasi sanguigni nei muscoli. Rimuovere la trachea sinistra e la laringe. Liberare l'esofago dal tessuto attaccato con le forcelle e tagliarlo con forbici a molla. (Figura 5a).
- Rimuovere il muscolo che copre l'arco ventrale e il tubercolo anteriore dell'atlante con forcep sottili e forbici a molla (Figura 5b).
NOTA: Quando si rimuove il muscolo, dividerne una parte con la punta delle forcep sottili. Tagliare la parte separata con un paio di forbici a molla. Ripetilo più volte per esporre l'arco ventrale dell'atlante per ridurre al minimo il rischio di strappare i vasi sanguigni. - Tagliare gli archi ventrali dell'atlante con un rongeur(Figura 4c, 5c). Rimuovere il tubercolo anteriore dell'atlante. Rimuovere il sangue e il fluido con spugna chirurgica per visualizzare il forame magnum e il tronco encefalico(Figura 4c, 5d).
- Espandere il forame magnum rimuovendo l'osso occipitale con un rongeur. (Figura 5d-e).
- Rimuovere la cartilagine sottile sopra il magnum del forame con forcep sottili e forbici a molla. Sbucciare con cura lo strato periosteale della dura madre con forcette fini per avere una visione chiara del tronco encefalico ventrale (Figura 5f). Non rompere la dura mater.
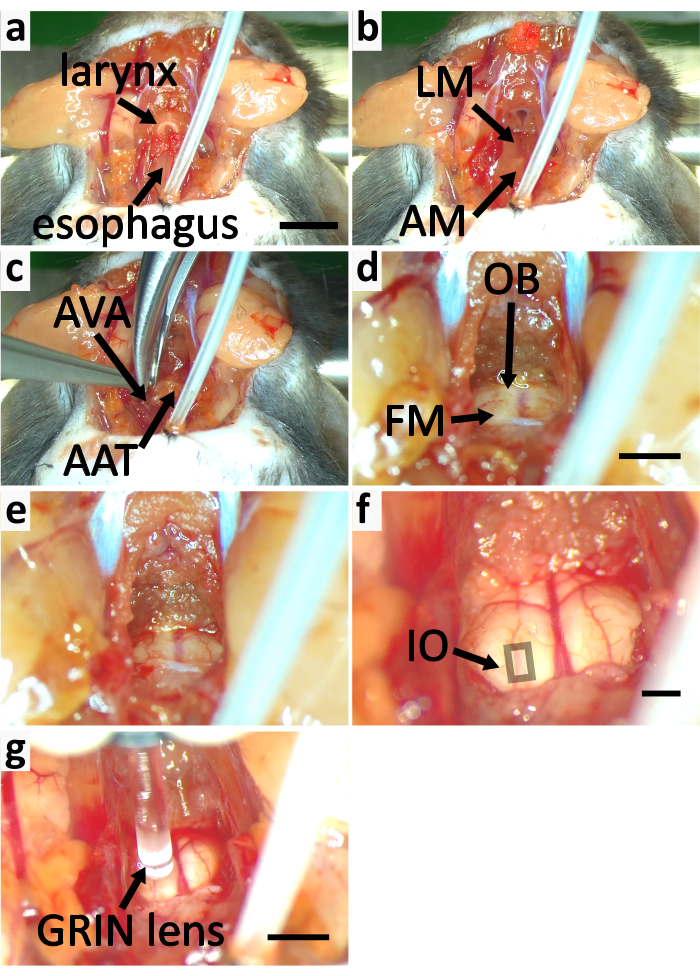
Figura 5: Esporre il tronco encefalico del topo per l'imaging del calcio. (a-f) i pannelli mostrano il processo di esposizione del tronco encefalico. (a) Rimuovere il muscolo sternotiroideo (SM) etichettato nella figura 3e. Taglia la laringe e l'esofago. (b) Rimuovere il muscolo longitudinale (LM) e l'atlante di copertura muscolare (AM). (c) Tagliare gli archi ventrali dell'atlante (AVA) con un rongeur e rimuovere il tubercolo anteriore dell'atlante (AAT). d)Tagliare l'osso occipitale (OB) per espandere il forame magnum (FM). (e) FM espanso. (f) La cartilagine sottile sopra il foramen magnum viene rimossa. Lo strato periosteale di dura madre è staccato. Il quadrato indica l'area contenente neuroni IO superficiali. (g) Immagine dell'IO con obiettivo GRIN. La barra di scala in a=5 mm si applica all'a-c. La barra di scala in d=2 mm si applica a d-e. Barra di scala in f=2 mm. Barra di scala in g=2 mm. Fare clic qui per visualizzare una versione più grande di questa figura.
6. Imaging del calcio
- Bloccare il sensore SpO2 sulla coscia del mouse per monitorare segni vitali come frequenza cardiaca, saturazione di ossigeno e frequenza dell'alito (Figura 2b).
NOTA: La frequenza cardiaca dovrebbe essere compresa tra 500 bpm e 600 bpm, la saturazione di ossigeno dovrebbe essere superiore al 90% e la frequenza del respiro dovrebbe essere di 50-70 respiri al minuto10,11. - Montare la sonda dell'obiettivo GRIN (lunghezza 9 mm, 1 mm di diametro) sull'asta di impianto.
NOTA: Pulire l'obiettivo GRIN con tessuto detergente imbevuto di etanolo al 70% prima di immagini per una buona qualità di imaging. - Fissare l'asta di impianto sul telaio stereotassico e montare il microscopio in miniatura sull'asta di impianto.
NOTA: La preparazione del microscopio in miniatura per l'imaging deve essere completata secondo le linee guida appropriate per l'utente del prodotto. - Aggiungere diverse gocce di salina calda nell'area del tronco encefalico per l'immersione della lente GRIN.
- Avvicinati al tronco encefalico con l'obiettivoGRIN (Figura 4d, 5g). Accendere il LED blu eccitazione (455 ± 8) nel microscopio in miniatura. Individuare i neuroni IO trasfetati da GCaMP6s monitorando l'immagine di fluorescenza dal microscopio in miniatura. Cercare neuroni IO in una regione a forma di rettangolo ~0,5-1,7 mm rostrali al rimanente atlante e ~0,6-1,1 mm lateralmente alla linea mediana nell'area superficiale del tronco encefalico ventrale (Figura 5f).
NOTA: Quando si cerca un campo visivo appropriato per l'imaging IO, cercare il luogo in cui il diametro medio dei somata corrisponde a quello dei somata neuronali IO (circa 15 μm12). Le regioni adiacenti nella formazione reticolare midollare sono costituite da cellule significativamentepiù grandi 13,14. Fai attenzione quando muovi l'obiettivo GRIN verticalmente, poiché premendolo sul tronco troppo duro può uccidere l'animale.
7. Eutanasia degli animali secondo la procedura
- Al termine dell'esperimento, eutanasiare l'animale con lussazione cervicale o altro metodo approvato dalla regolazione locale della cura degli animali di laboratorio.
- Per ulteriori indagini istografie, anestetizzare prima l'animale con farmaco iniettabile, come la combinazione chetamina/xiazina (rispettivamente 100 mg/kg e 10 mg/kg)15 prima della perfusione cardiaca con la soluzione di Ringer seguita da una soluzione fissante per fissare il cervello.
8. Trattamento dei dati
- Pre-elaborare il video di imaging di calcio registrato prima di analizzare i dati.
NOTA: Il software di elaborazione dati commerciale accompagnato dal microscopio in miniatura è stato utilizzato per questo passaggio e le seguenti fasi del protocollo si riferiscono a questo. In alternativa, è possibile utilizzare software libero e open source come CaImAn16,MINIPIPE17e MiniscoPy18 sia per la pre-elaborazione che per l'analisi.- Caricare il video di imaging calcico registrato nel software di elaborazione dei dati.
- Fare clic sul pulsante Pre-elaborazione. Definire un'area di ritaglio escludendo le regioni senza neuroni fluorescenti e ritagliare il video per ridurre le dimensioni del file per un'elaborazione più rapida.
- Fare clic sul pulsante Filtro spaziale. Impostare il cut-off basso e il taglio alto per il filtro spaziale rispettivamente su 0,005 pixel-1e 0,5 pixel-1. Applicare il filtro spaziale su ogni fotogramma del video per aumentare il contrasto e smussare l'immagine.
NOTA: Il filtro spaziale è un filtro gaussiano passa banda. I componenti a bassa frequenza spaziale originati da celle fuori fuoco potrebbero confondere la correzione del movimento nel passaggio successivo. La componente ad alta frequenza spaziale può far apparire il video meno fluido. - Fate clic sul pulsante Correzione movimento (Motion Correction). Applicare la correzione del movimento al video utilizzando il primo fotogramma come fotogramma di riferimento per ridurre i manufatti legati al movimento causati dal flusso sanguigno nel tronco encefalico.
NOTA: La correzione del movimento utilizza un metodo di registrazione delle immagini sviluppato da Thevenaz et al19. - Esportate il video corretto per il movimento in formato TIFF.
- Applicare CNMF-E20 sul video corretto dal movimento in MATLAB per identificare singoli neuroni, seguendo le istruzioni per il codice CNMF-E MATLAB nel repository online21.
NOTA: CNMF-E è un approccio di fattorizzazione della matrice non negativa vincolato personalizzato per l'imaging di un fotone. Gli script demo nel repository possono essere modificati e utilizzati per elaborare i dati.
Risultati
Qui presentiamo una registrazione rappresentativa ottenuta con il metodo descritto. La figura 6a mostra la posizione delle celle IO con etichetta brillante visualizzata durante l'esperimento. Le strisce diagonali scure sono vasi sanguigni. Si noti la luminosità variabile delle singole cellule, risultante dall'efficacia della trasfezione variabile. Nella figura del pannello 6b mostriamo le tracce di intensità di fluorescenza normalizzata media (deltaF/F) ottenute dai somata indicati con colori e numeri nel pannello a. Le deformazioni verso l'alto rappresentano aumenti transitori del calcio intracellulare. Si noti come il diverso livello di espressione di GCaMP6s (riflesso nella luminosità cellulare nel pannello a) porti a rapporti tra segnale e rumore variabili (SNR).
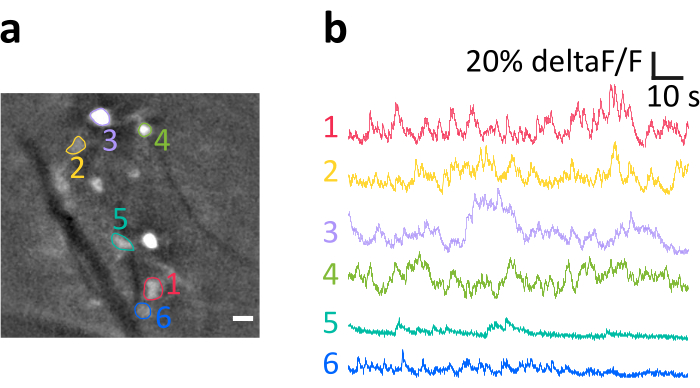
Figura 6: Esempio di registrazione dell'attività dei neuroni IO nel mouse anestetizzato. (a) Fotogramma di esempio rappresentativo da una registrazione dopo il filtraggio spaziale. I punti luminosi sono somi neuronali IO, molti dei quali sono stati indicati come regioni di interesse (ROM, numeri colorati). Le strisce scure sono vasi sanguigni. (b) Esempio di tracce deltaF/F ottenute dalle ROM indicate nel pannello a. Le deviazioni verso l'alto riflettono l'aumento del segnale calcio. Barra di scala in a=10 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Poiché la procedura chirurgica prevede operazioni eseguite nella regione della gola con numerose strutture vitali critiche (arterie, nervi), è essenziale che sia condotta da un ricercatore con abilità chirurgiche di alto livello. Di seguito, evidenziamo e commentiamo diversi punti chiave della procedura; tuttavia, va ricordato che nessuna quantità di consigli scritti può soppiantare l'esperienza, l'abilità e l'intuizione del ricercatore.
Il passo più critico nell'intervento chirurgico è la tracheotomia. Si tratta di tagliare la trachea, cambiare l'isoflurane dal cono del naso al tubo di intubazione, fissare la trachea alla pelle toracica e legare la trachea e il tubo di intubazione insieme. Tutte queste operazioni devono essere completate in modo fluido e rapido per evitare incidenti, come anestesia inadeguata, afflusso di fluido in trachea o slittamento del tubo di intubazione. Prima di tagliare la trachea, è necessario tenere a mente il protocollo.
L'emorragia è una delle principali cause di morte animale in questo intervento chirurgico. Poiché l'area del collo è densa di vasi sanguigni, il taglio deve essere eseguito solo quando la linea di vista è chiara per evitare di tagliare vene e arterie non vedere. Pertanto, i muscoli e i tessuti connettivi che oscurano la vista devono essere rimossi e il sangue dai capillari rotti deve essere pulito prima di avanzare.
L'animale può essere tenuto in vita per molto tempo (più di 8 ore) dall'inizio dell'intervento chirurgico. Tuttavia, è importante terminare rapidamente la procedura chirurgica in modo che ci sia più tempo per esaminare i neuroni del tronco encefalico quando le condizioni fisiologiche degli animali sono buone. Un ricercatore qualificato può terminare l'intera procedura in 70 minuti.
Mentre il metodo fornisce una visione pulita delle superfici cerebrali ventrali, è purtroppo impossibile farlo senza eseguire una tracheotomia e rimuovere una quantità significativa di tessuto nella regione della gola. Pertanto, non si può permettere all'animale di svegliarsi dall'anestesia. Inoltre, anche se è possibile mantenere in vita l'animale per molte ore con un'attenta regolazione del parto anestetico, mantenendo la temperatura corporea e l'idratazione, è inevitabile che la sperimentazione prolungata porti infine all'indebolimento delle condizioni animali. È lasciato all'esperienza del ricercatore considerare la durata massima delle registrazioni stabili.
Un'altra potenziale limitazione del metodo qui descritta è che poiché la lente GRIN non è inserita nel parenchima cerebrale, possono essere esaminati solo neuroni relativamente superficiali (~150-200 μm). Mentre l'impianto chirurgico della lente GRIN è tecnicamente possibile, il metodo di chirurgia acuta non consente ai neuroni di recuperare tempo sufficiente dallo stress ossidativo e dalla presenza di sangue dopo l'impianto che probabilmente degrada la qualità dell'immagine oltre l'accettabile.
Nonostante le preoccupazioni di cui sopra, crediamo che questa sia la prima volta che viene presentato un metodo per l'imaging in vivo dei neuroni IO. Permette l'esame dell'attività spatiotemporale nei neuroni IO nel contesto in vivo in presenza di ingressi afferenti intatti da sistemi sensoriali così come i segnali dei nuclei cerebellari e della giunzione mesodiencefalica22, un'impresa che finora non è stata possibile. Con questo metodo, la funzione dell'IO può ora essere studiata in modo più approfondito con la combinazione di stimolazione sensoriale e optogenetica. In particolare, con l'evoluzione dell'imaging di tensione (come il nostro recente metodo per l'imaging della tensione nell'IO 23), speriamo che il metodo chirurgico presentato ispiri numerosi ricercatori a affrontare la sfida di indagare come l'IO contribuisce alla generazione di picchi complessi cerebellari.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Ringraziamo Andrew Scott del Media Center di OIST per il suo aiuto nella registrazione e nell'editing video. Inoltre, ringraziamo Hugo Hoedemaker per il suo aiuto nello sviluppo dell'intervento chirurgico per esporre il tronco encefalico e il Dr. Kevin Dorgans per il suo aiuto nel disegnare diagrammi per le figure. Inoltre, un grande ringraziamento a Salvatore Lacava per la sua narrazione voice-over, così come a tutti i membri nRIM e agli animali domestici per il continuo supporto al benessere nei momenti difficili del COVID-19.
Materiali
| Name | Company | Catalog Number | Comments |
| AAV.CAG.GCaMP6s.WPRE.SV40 | Addgene, USA | 100844-AAV9 | |
| Absorbable suture with 6 mm half circle needle | Natume, Japan | L6-60N2 | hook needle with thread |
| Absorption triangles | FST, Germany | 18105-03 | Surgical sponges |
| Stereo microscopes | Leica, Germany | M50 | |
| Castroviejo curved tip needle holder with lock | FST, Germany | 12061-01 | Surgery tool |
| cotton swabs | Sanyo, Japan | HUBY-340 | |
| Delicate suture tying forceps | FST, Germany | 11063-07 | Surgery tool |
| Delicate Suture Tying Forceps | FST, Germany | 11063-07 | Surgery tool |
| Dumont #5/45 forceps | FST, Germany | 11251-35 | Surgery tool |
| Fine Iris scissors | FST, Germany | 14060-09 | Surgery tool |
| Friedman-Pearson rongeur curved tip | FST, Germany | 16221-14 | Surgery tool |
| Gelfoam absorbable gelatin sponge | Pfizer, USA | 0315-08 | Hemostatic gelatin sponge |
| Glass-Capillary Nanoinjection | Neurostar, Germany | n/a | For virus vector injection |
| Graefe Forceps with serrated tip | FST, Germany | 11052-10 | Surgery tool |
| Implantation rod | Inscopix, USA | n/a | It is part of the nVoke2 system. It's designed to nVoke2 miniature microscpe and GRIN lens can be mounted on it |
| IsoFlo | Zoetis, UK | n/a | Isoflurane |
| KETALAR FOR INTRAMUSCULAR INJECTION | Daiichi Sankyo, Japan | n/a | Ketamine |
| Kimwipes | Kimberly-Clark, USA | Cleaning tissue | |
| Laser-Based Micropipette Puller | Sutter Instrument, USA | P-2000 | |
| Micropipette Beveler | Sutter Instrument, USA | BV-10 | |
| Motorized Stereotaxic based on Kopf, Model 900 | Neurostar, Germany | n/a | Stereotaxic frame |
| mouseOxPlus with rectal temperature sensor and thigh clamp pulse oximeter | Starr Life Sciences, PA, USA | MouseOxPlus | Measures animal heart rate, arterial oxygen saturation (SpO2), breath rate, and temperature |
| nVoke2 integrarted Calcium imaging micro camera system | Inscopix, USA | 1000-003026 | Miniature microscope |
| Ohaus Compact Scales | Ohaus, USA | CS 200 | Scale used to weight animal |
| Otsuka Normal Saline | Otsuka Pharmaceutical Factory, Japan | n/a | |
| Physiological-biological temperature controller system | SuperTech Instruments, Hungary | TMP-5b | Thermal pad for mouse |
| ProView Lens Probe 1.0 mm diameter, 9.0 mm length | Inscopix, USA | 1050-002214 | Gradient-refractive index (GRIN) lens |
| Q114-53-10NP glass capillaries | Sutter Instrument, USA | 112017 | Customized quartz glass capillaries |
| Safety IV Catheter 20G | B. Braun, Germany | 4251652-03 | 20 gauage catheter used to prepare intubation tube |
| Sand paper | ESCO, Japan | EA366MC | Used to polish the tip of 25G needle to prepare curved and blunt needle |
| Scalpel blade | Muromachi Kikai, Japan | 10010-00 | Used to cut the tip of quartz glass pipette |
| SomnoSuite low flow inhalation anesthesia system | Kent Scientific, USA | SOMNO | Provides precise control of isoflurane flow |
| Surgic XT Plus drill | NSK | Y1002774 | For virus vector injection |
| Syringe 1 ml | Terumo, Japan | SS-01T | |
| Syringe needle 25G | Top, Japan | 00819 | Used to make blunt and bended needle |
| Syringe needle 26G | Terumo, Japan | NN-2613S | |
| Thrive 2100 Professional Trimmer | Thrive, Japan | n/a | Shaver |
| Vannas-Tübingen spring scissors | FST, Germany | 15004-08 | Surgery tool |
| Vaseline | Hayashi Pure Chemical, Japan | 22000255 | |
| Veet sensitive skin | Veet, Canada | n/a | Hair removal cream |
| Xylocaine Jelly 2 % 30ml | Aspen Japan, Japan | 871214 |
Riferimenti
- Russell, J. T. Imaging calcium signals in vivo: A powerful tool in physiology and pharmacology. British Journal of Pharmacology. , (2011).
- Zhang, T., et al. Kilohertz two-photon brain imaging in awake mice. Nature Methods. , (2019).
- Lin, X., Zhao, T., Xiong, W., Wen, S., Jin, X., Xu, X. M. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. Journal of Visualized Experiments. 2019 (143), 1-8 (2019).
- Lee, H. S., Han, J. H. Successful In vivo Calcium Imaging with a Head-Mount Miniaturized Microscope in the Amygdala of Freely Behaving Mouse. Journal of visualized experiments. (162), 1-19 (2020).
- Aharoni, D., Khakh, B. S., Silva, A. J., Golshani, P. All the light that we can see: a new era in miniaturized microscopy. Nature Methods. 16 (1), 11-13 (2019).
- Khosrovani, S., Van Der Giessen, R. S., De Zeeuw, C. I., De Jeu, M. T. G. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proceedings of the National Academy of Sciences. 104 (40), 15911-15916 (2007).
- Osten, P., Cetin, A., Komai, S., Eliava, M., Seeburg, P. H. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1 (6), 3166-3173 (2007).
- Berg, L., Gerdey, J., Masseck, O. A. Optogenetic Manipulation of Neuronal Activity to Modulate Behavior in Freely Moving Mice. Journal of visualized experiments : JoVE. , e61023 (2020).
- Green, C. J., Knight, J., Precious, S., Simpkin, S. Ketamine alone and combined with diazepam or xylazine in laboratory animals: A 10 year experience. Laboratory Animals. 15 (2), 163-170 (1981).
- Tsukamoto, A., Serizawa, K., Sato, R., Yamazaki, J., Inomata, T. Vital signs monitoring during injectable andn inhalant anesthesia in mice. Experimental Animals. 64 (1), 57-64 (2015).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harbor Protocols. 6 (2), 174-178 (2011).
- Vrieler, N., et al. Variability and directionality of inferior olive neuron dendrites revealed by detailed 3D characterization of an extensive morphological library. Brain Structure and Function. , 1677-1695 (2019).
- Esposito, M. S., Capelli, P., Arber, S. Brainstem nucleus MdV mediates skilled forelimb motor tasks. Nature. , (2014).
- Martin, E. M., Devidze, N., Shelley, D. N., Westberg, L., Fontaine, C., Pfaff, D. W. Molecular and neuroanatomical characterization of single neurons in the mouse medullary gigantocellular reticular nucleus. Journal of Comparative Neurology. , (2011).
- Cold Spring Harbor. Ketamine/Xylazine. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. eLife. 8, 1-45 (2019).
- Lu, J., et al. MIN1PIPE: A Miniscope 1-Photon-Based Calcium Imaging Signal Extraction Pipeline. Cell Reports. 23 (12), 3673-3684 (2018).
- . GitHub - PeyracheLab/miniscoPy: A package to analyse calcium imaging data recorded with the Miniscope Available from: https://github.com/PeyracheLab/miniscoPy (2020)
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. , (1998).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. eLife. 7, 1-37 (2018).
- . GitHub - zhoupc/CNMF_E: Constrained Nonnegative Matrix Factorization for microEndoscopic data Available from: https://github.com/zhoupc/CNMF_E (2020)
- De Gruijl, J. R., Bosman, L. W. J., De Zeeuw, C. I., De Jeu, M. T. G. Inferior olive: All ins and outs. Handbook of the Cerebellum and Cerebellar Disorders. , (2013).
- Dorgans, K., Kuhn, B., Uusisaari, M. Y. Imaging Subthreshold Voltage Oscillation With Cellular Resolution in the Inferior Olive in vitro. Frontiers in Cellular Neuroscience. , (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon