Method Article
インビボ マウス劣オリーブにおけるカルシウムイメージング
要約
我々は、腹側から成虫マウスの脳幹を暴露するプロトコルを提示する。ミニチュア顕微鏡で傾斜屈折率レンズを用いることで、インビボでのオリーブ神経ソマタの活性を調べるためにカルシウムイメージングを用いることができる。
要約
腹側髄質の核であるオリーブ(IO)は、小脳に入る2つの入力経路のうちの1つを形成するクライミング繊維の唯一の供給源である。IOは、運動制御にとって重要であると長い間提案されており、その活動は現在、小脳の運動と認知機能の両方の多くの仮説の中心であると考えられている。その生理学と機能は インビトロの単細胞レベルで比較的よく研究されているが、現在のところ、生きている動物におけるIOネットワーク活動の組織に関する報告はない。これは主にIOの極めて困難な解剖学的位置に起因し、従来の蛍光イメージング法の対象となるため、対象領域に向かう脳全体を通して光学路を作り出さなければならない。
ここでは、IOネットワークから最新レベルのカルシウムイメージングデータを取得する代替方法について説明する。この方法は、IOの極端な腹側位置を利用し、麻酔マウスにおけるカルシウムセンサGCaMP6s発現IOの腹側表面に接触するために頸部内臓を介して勾配屈折率(GRIN)レンズを挿入するための外科的処置を伴う。代表的なカルシウムイメージング記録は、手術後にIOニューロン活性を記録するフィージビリティを示す。これは非生存手術であり、録音は麻酔下で行われなければならないが、生命界の脳幹核への損傷を避け、時空間的活動パターンおよびIOにおける入力統合を調査する多種多様な実験を行うことを可能にする。この手順は、腹側脳幹の他の隣接領域での記録に使用できます。
概要
システム神経科学の主な目標は、神経回路の時空間的な活動パターンが動物の行動の生成にどのように寄与するかを理解することです。このように、カルシウム感受性プローブを利用した蛍光イメージング方法論は、1細胞からメソスケール回路に至るまでの空間的なダイナミクスを可視化できるため、過去10年間に生きている動物1,2における神経細胞ネットワーク活性を調べる主要なツールとなっています。近年、脳の表面構造(脳や小脳のコルチなど)の神経回路が透明な頭蓋窓3を介して画像化される一般的なアプローチは、深部脳構造におけるネットワークダイナミクスの検討を可能にする勾配屈折率(GRIN)レンズ4の使用によって補完されている。現在利用可能なGRINレンズは、マウス扁桃体、海馬、大脳基底核5などの数ミリメートルの深い構造に到達することができます。しかし、腹側髄質中の様々な核のような関心のある多くの領域は、かなり深く、GRINレンズの到達の極端な部分に置きます。
ここでは、脳の腹側を通して髄質の比較的容易なアクセスを利用して、この困難を克服する方法を説明する。側腹腔髄質の核であるオリーブ(IO)がカルシウムセンサGCaMP6sでウイルスにトランスフェクションされた成体マウスを用いて、麻酔薬の脳の腹側にGRINレンズを配置するための外科的ステップ(もともとKhosrovaniら 20076.に記載された方法から改変)を記述する。ミニチュア顕微鏡を用いて、このような極度の腹側脳領域における神経活動の記録の実現可能性を実証する。この処置は必ずしも非生存手術であり、覚醒動物では実験を行うことはできないが、この方法は感覚的または他の異性経路刺激の文脈における無傷のネットワークダイナミクスの検査を可能にし、急性スライス製剤を使用するなどのex vivoアプローチよりも明確な利点を提供する。
プロトコル
動物のケアと使用に関するすべての適用可能な国際、国内、制度的ガイドラインに従った。無菌手術技術を立体性ウイルスベクター注射に適用した。
1. 立体ウイルスベクターインジェクション
注:GCaMP6sを発現するための遺伝物質を運ぶウイルス(AAV9.CAG.GCaMP6s.WPRE.SV40)は、前に述べたように立体的に注入される7,8以下の修飾を伴う。
- 石英ガラス(外径:1.14mm、内径:0.53mm)を使用して、製品マニュアルのように調整されたパラメータを持つレーザーキャピラリープーラーを使用して、IO注入用の長くて硬いテーパーでピペットを製造します。引っ張った後、ピペットの先端から1〜2mmをメスで切り取り、15〜20μmの内先端径を持つ8〜10mmの長テーパーを取得します(図1a)。回転マイクロピペットベベラーで30°針の形に先端をベベルしてピペットを完成させ、脳の浸透を容易にし、ピペットの屈曲を減らします(図1a)。
注:一般的に使用されるホウケイ酸塩ガラスピペットは、この長さに引っ張られたときに正しく深い領域をターゲットにするには、あまりにも柔軟になります。ナノリットルインジェクターは、この研究でウイルスを提供するためにガラスピペットと一緒に使用されました.あるいは、精密ガラス注射器または圧力インジェクターも使用することができる。 - マウスの胸部がサーマルパッドの上にあることを確認して、首が十分なボディサポートで引き伸ばされないようにし、ステレオタックスフレーム(図1b)でマウスを固定する際に頭蓋骨を平準化することに非常に注意してください。
注: ブレグマ-ラムダの差は、垂直寸法で 0.05 mm 未満にする必要があります。 - 主なIO核を標的とする座標として、6.2mmカウダル、±0.5mm横長、および6.6mmの側腹を主なIO核を標的とする座標として使用する(図1c)。
注:脳の完璧なレベリングは劇的にIOにウイルスを注入する成功率を増加させます.実験室、マウス株および個々の研究者間の有意な相違が予想されるように、座標は実験者によって確認されなければならない。この出版物のためのビデオ材料を準備するために、我々は1つの雄のC57Bl / 6Jマウスを使用しました。 - ウイルス感染動物の術後ケアおよび住宅手順に関する関連する制度ガイドラインに3〜4週間従ってください。
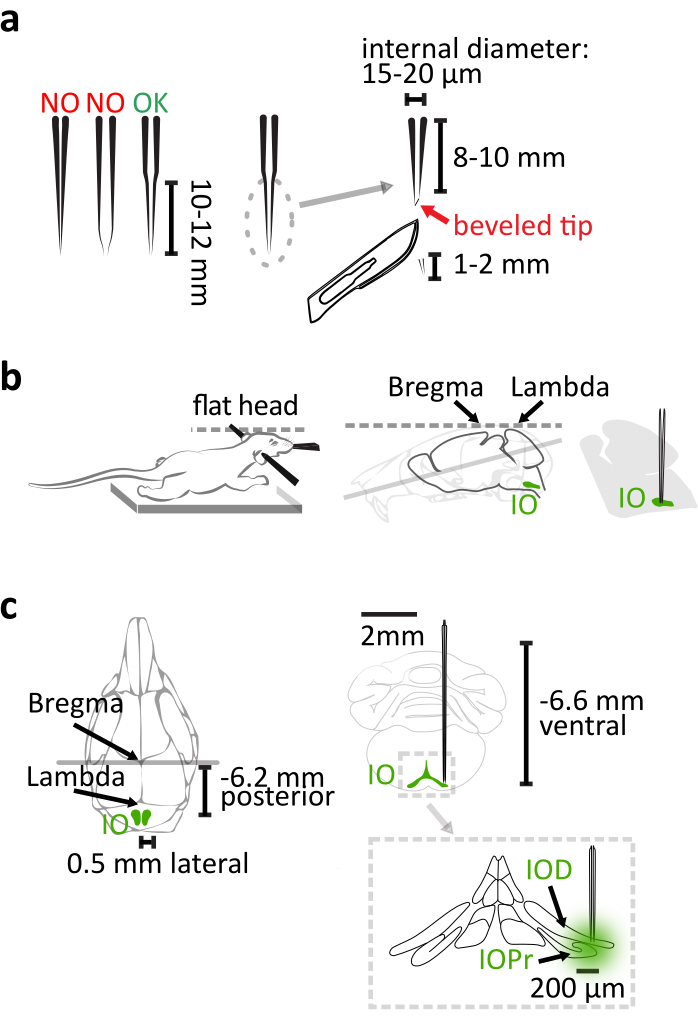
図1:ステレオタキシックウイルスベクターインジェクション(a)レーザープルドクォーツガラスピペットは、長さ10〜12mmのストレートテーパーを有する。引っ張った後、先端から1〜2mmを切り落とします。ピペットは、先端を30°針状にベベルすることで完成します。(b)正しい射出は、ステレオタキシックフレーム内のマウス本体の適切な位置に依存する。マウスの胸を支えるので、首を伸ばさないようにします。ブレグマとラムダを水平に整列させることで、マウスヘッドを水平にします。(c)bregmaに対するIO協調は、脳のマウス頭蓋骨とコロナのビュー(右上)の後側のビュー(左)で示される。注射は、主体の側側部分(IOPr)およびIO(右下)の側側(IOD)下核に到達する。この図の大きなバージョンを表示するには、ここをクリックしてください。
2. 腹側アプローチ手術用ツールと消耗品の調製
- 20ゲージのカテーテルの先端から長さ5~6mm、幅0.8mmのスリットを切って挿管チューブを用意し、挿管動物が息を吐き出せるようにします(図2a)。
注:一定の気流を持つ一般的なイソフルラン気化器を使用する場合、スリットは動物が息を吐くために必要です。気化器に加えて人工呼吸器を使用する場合、カテーテルはそのまま残すことができます。 - 気管切開中に気管を支えるために鈍い針を準備します。25ゲージの針の先端をペンチで切り落とします。紙で破断面を滑らかにします。ペンチで約15°の真ん中に鈍い針を曲げ.
注:湾曲した針は気管を穏やかに持ち上げます。これにより、気管の変形が減少します。 - 50 mg/mL ケタミンを生理食塩水で 15% に希釈します。最終濃度は7.5mg/mLです。
- 清潔な手術ツールとリドカインゲル、生理食糸、ゼラチンスポンジ、吸収綿棒、石油ゼリー、洗浄ティッシュなどの消耗品を組み立てます。
- イオフルーラン気化器のスイッチを入れ。動物の加熱パッドを38°Cに設定します。
- ステレオタックスフレームの鼻コーンを水平に180°回転させ、マウスをフレーム腹側に固定できるようにします。鼻のコーンの高さを、イヤーバーのレベルになるように調整します。
3. 麻酔の投与と手術のためのマウスの準備
- 体重計で動物の重量を量り、注射のための希釈ケタミンの量を計算します。
注: 必要なケタミンの合計量は 56.25 体重当たり mg.そのため、希釈ケタミンの体積は、体重1kg当たり7.5mLです。ケタミンを単独で使用することの欠点は、貧しい筋肉弛緩、頻脈および強化された筋肉の緊張9を含む。しかし、このプロトコルでは、ケタミンは、気管切開のためにイソフルラン投与が中断される10〜20の期間をカバーするためにのみ使用される。このステップをできるだけ簡潔にしておくことで、イオブルランの麻酔効果は著しく低下せず、ケタミンを用いた欠点は最小限に抑えられる。 - 5%のイオブルランをあらかじめ充填した麻酔誘導室にマウスを入れます。動物が完全に麻酔が行われると、右反射の喪失と深く、より遅い呼吸パターンが、イソフルランの流れを立体フレームの鼻コーンに切り替え、イソフルラン濃度を2.5%に減らす。
- 立体フレーム腹側の動物を上に固定します(図2b)。動物が簡単に呼吸できることを確認するために、鼻コーンの標高とピッチを調整します。事前に温めた暖房パッドで動物を暖かく保ちます。
注:動物の体の下部をティッシュペーパーまたはアルミホイルで覆うことは、動物の温度を維持するのに役立ちます。 - ●こどや太ももの部分の皮膚毛を剃り、脱毛クリームで取り除く(図2b)。喉の皮膚にリドカインゲルを局所的に塗布する。
メモ:手順6で使用される大腿クランプの末梢酸素飽和度(SpO2)センサーは、無毛の皮膚に最適です。 - 直腸温度計で動物の温度を監視します(図2b)。
- 手術中の体液損失を補うために、腹腔内に1mLの温かい(37°C)腹腔内注射を行います。
- 後肢の足指に強いピンチで麻酔の深さを評価します。検出可能な応答を呼び出すべきではありません。
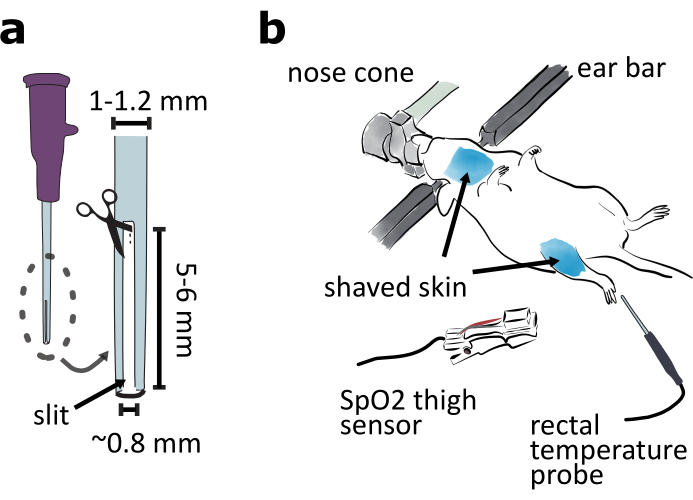
図2:腹側アプローチ手術の準備(a)20ゲージカテーテル先端部に長さ5~6mm、幅0.8mmのスリットを切断して挿管チューブを用意する。(b)動物側を立体的なフレームに取り付け、鼻の円錐角を調整して動物が呼吸しやすいようにします。喉と太ももの領域の周りの皮膚を剃ります。マウスのバイタルサインを監視するために、大腿にSpO2センサーを取り付けます。マウスの体温を監視するために直腸温度プローブを挿入します。この図の大きなバージョンを表示するには、ここをクリックしてください。
4. 気管切開術と挿管 (20-25 分)
- 気管を露出する。
- 正中線に沿って喉の皮膚に垂直切開を行います。鈍い解剖法を用いて頸部皮膚を下の内臓から分離し、唾液腺を明らかにするために皮膚を切り落とす(図3a-b、4a)。
- 結合組織から唾液腺を解放し、それらを横方向に反転させ、気管を覆ったステ無甲状腺の筋肉を鉗子で露出させる(図3b-c)。
注:石油ゼリーは、それらを湿らせた保つために露出した組織に適用することができます。気管領域を避けて、次の手順で清潔に保ちます。
- 気管 切開 術
- 最初の用量の希釈ケタミン(7.5 mg/mL)の腹腔内、体重1kg当たり5mL(37.5mg/kg)を注入する。
注:ケタミンが機能するには3〜5分かかりますので、周囲の筋肉や血管から気管を分離する前にケタミンの最初の用量を注入する必要があります。ケタミンは、イオブルラン麻酔と組み合わせると過剰摂取効果のリスクが高いため、2回の注射で投与される。 - 細かい鉗子の先端で中線に沿ってステ無甲状腺の筋肉を慎重に分割して気管を露出させる(図3c)。鈍い解剖法を使用して、血管と食道から気管を鉗子で取り外します。
- 腹腔内注射した2回目の希釈ケタミン(7.5mg/mL)、体重1kg当たり2.5mL(18.75mg/kg)を注入する。
- 気管の下に鈍い針を横方向に挿入して支える(図3d)。気管を支えるために指でこの針を持ちます。第3気管リングの周りの縫合糸を半円の針で甲状腺に導く(図3d)。この気管リングに4つの楽器のネクタイを作ります。
注意:気管リングに結ばれた糸は、動物の胸部に気管を固定するために使用されます。このステップでは、半円針から糸を切り落とさないで下さい。気管リングは軟骨でできており、軟骨は骨よりも柔軟性はありますが、強度は低いです。縫合糸をきつく締めすぎないように、またはリングが壊れることがあります。 - 鉗子のペアで胸の皮膚をつまみます。最後のステップで使用したのと同じ半円の針で胸部の皮膚を突き刺し、次のステップで胸部に気管を固定する準備として、糸を皮膚に通す(図3d)。
- 気管リングに結ばれた糸を引っ張って気管をそっと持ち上げ、気管のrostralを結ばれたリングに切り、甲状腺に尾を引きます。尾大気管を胸に向かって引っ張ります。その下に手術用スポンジの小片を追加することによって気管の開口部を上げます。
注:麻酔レベルを確保するために気管を切断する前にケタミンの2回目の注射後に5分以上経過していることを確認してください。 - 洗浄ティッシュの薄いストリップと気管の開口部の先端の中に残っている液体を取除きます。ステレオタックスノーズコーンから挿管チューブにイオブルランの流れを切り替えます。チューブチューブを深さ約2mmの気管に挿入し、チューブ内のスリットの一部が気管の外側に残っていることを確認して呼吸を可能にする(図3e、4b)。
注:慎重に挿管チューブとその挿入深さの角度を調整して、マウスの息をスムーズにし、気管を損傷しないようにします。油性ゼリーは気管の外側に塗布して乾燥を防ぐことができるので、気管が容易に破裂することはありません。 - 3-4インストゥルメンタルタイズを作ることによって胸の皮膚に気管を固定します。管管を縫合糸で結び、挿管管を固定します(図3e、4b)。
- 最初の用量の希釈ケタミン(7.5 mg/mL)の腹腔内、体重1kg当たり5mL(37.5mg/kg)を注入する。
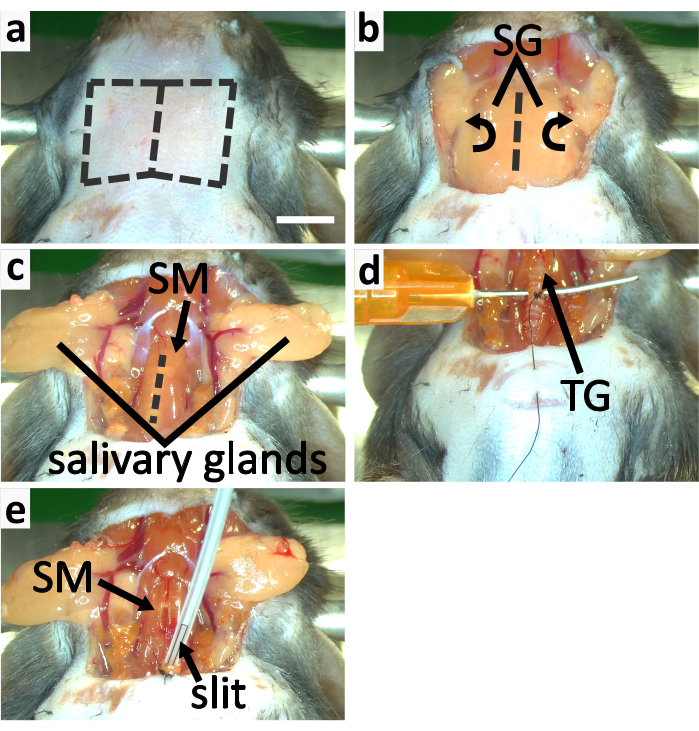
図3: 気管切開とマウスの挿管(a-c)パネルは気管を露出するプロセスを示す。() 破線に沿って切って喉の皮膚を取り除く。(b) 唾液腺(SG)を横方向に反転させ、ステノ甲状腺筋(SM)で覆われた気管を露出させる。(c) スリットは、破線に沿って SM を開き、気管を露出する。(d-e) パネルは気管切開を示す。(d) 鈍い湾曲した針で気管を支える。胸部の皮膚に気管を固定するために甲状腺に3番目の気管リング尾部を結びます。(e)先端にスリットが付いている挿管管でイソフルランを適用する。縫合糸で胸部の皮膚に気管を固定します。挿管チューブを一緒に結ぶことによって気管に固定します。スケールバーはa =5 mmで、すべてのパネルに適用されます。この図の大きなバージョンを表示するには、ここをクリックしてください。
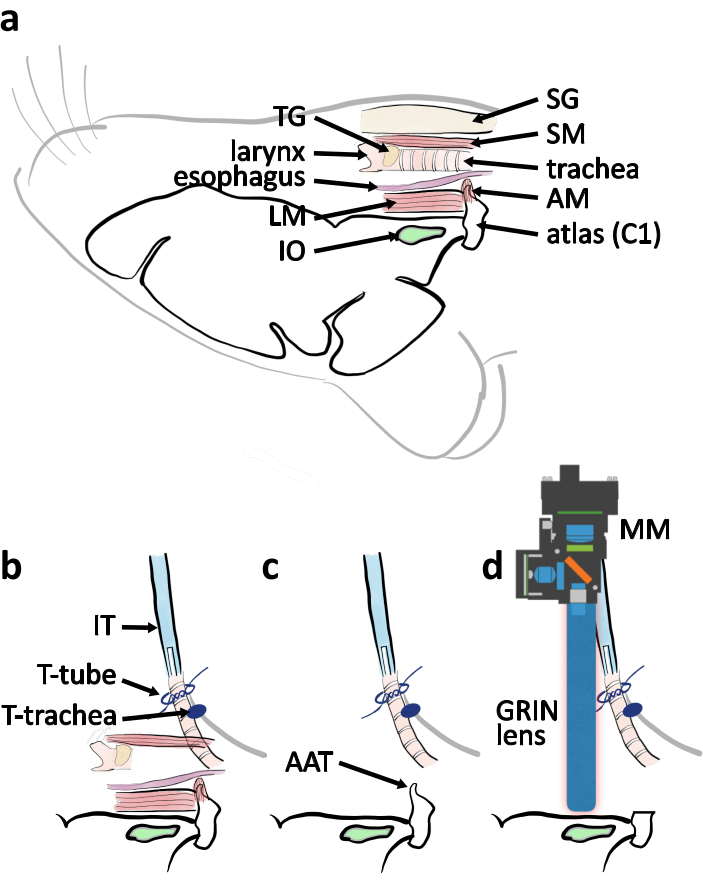
図4:横方向から腹側アプローチ手術の模式図を 示す図(a)マウスが腹側を上に置いたときに、関連する解剖学的部分が相対的な位置に示された模式図。略語: 筋肉被覆アトラス (AM), 縦筋 (LM), 唾液腺 (SG), ステノ甲状腺筋肉 (SM), 甲状腺 (TG).(b)気管切開が完了したときの気管に関する挿管管の配置の概略。胸部の皮膚の結びつき(T気管)によって気管が固定される。挿管管チューブ(IT)は、気管端(Tチューブ)の周囲のネクタイによって固定されています。(c) アトラス前ツベル(AAT)を取り外して、IOに対する視線をクリアします。(d)撮像実験用IO上のミニチュア顕微鏡(MM)とGRINレンズの位置を説明する回路図。 この図の大きなバージョンを表示するには、ここをクリックしてください。
5. 脳幹の露出 (40-45 分)
- 細かい鉗子で筋線維に沿って、ステノ甲状腺の筋肉をスリットします。スプリングハサミで孤立した部分を切り落とします(図3e)。
- 筋肉の血管の損傷を最小限に抑えるために、残った気管と喉頭を筋肉から慎重に解放します。残った気管と喉頭を取り除く。鉗子で付着した組織から食道を解放し、春のはさみでそれを切り落とす。(図5a)
- 腹側のアーチを覆う筋肉とアトラスの前塊茎を細かい鉗子とスプリングハサミで取り除く(図5b)。
注:筋肉を取り除くときは、細かい鉗子の先端で筋肉の一部を分割します。分離した部分をスプリングハサミで切り落とします。これを何度も繰り返して、アトラス腹側のアーチを露出して血管を裂くリスクを最小限に抑えます。 - アトラスの腹側のアーチをロンギュールで切る(図4c、5c)。アトラスの前塊茎を取り除く。手術用スポンジで血液と体液を取り除き、頭脳のマグナムと脳幹を見る(図4c、5d)。
- 後頭部の骨をロンギュールで取り除くことによって、前頭部のマグナムを拡大する。(図 5d-e)
- 細かい鉗子とスプリングハサミで、前衛マグナムの上の薄い軟骨を取り除きます。硬膜の骨膜層を細かい鉗子で慎重に剥がし、腹側脳幹をはっきりと見えるようにする(図5f)。デュラマーターを壊さないで下ろしてください。
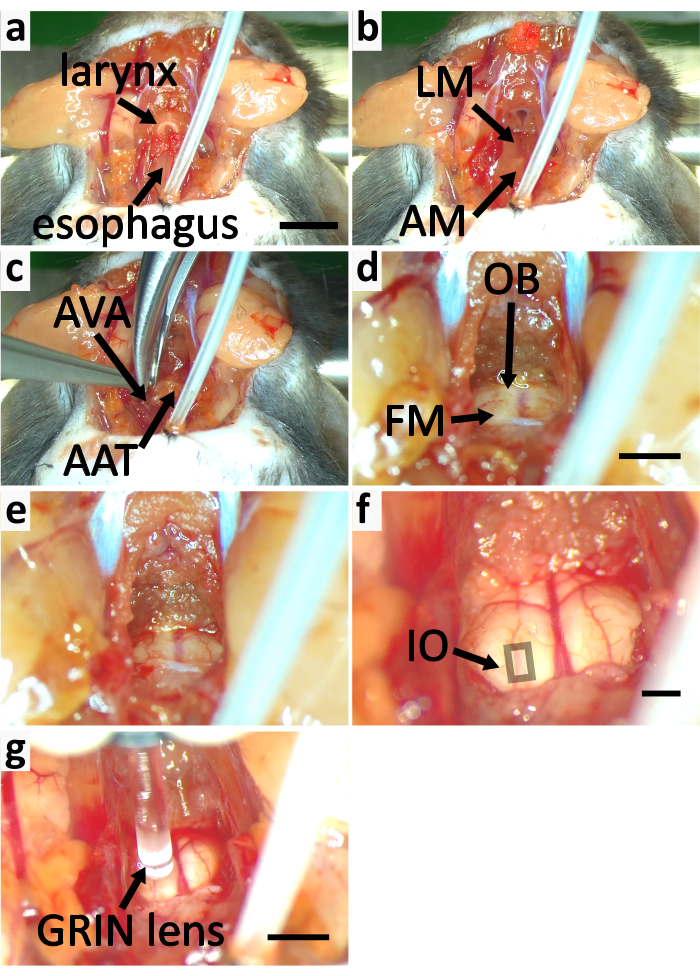
図5: カルシウムイメージング用マウスの脳幹を露呈する。(a-f)パネルは脳幹を露出するプロセスを示す。()図3eに標識されたステム甲状腺筋(SM)を取り外します。喉頭と食道を切り落とします。(b) 縦筋(LM)と筋肉被覆アトラス(AM)を取り除く。(c) アトラス腹側アーチ(AVA)をロンギュールで切断し、アトラス前塊茎(AAT)を取り除く。(d)後頭部骨(OB)を切り落とし、前頭部(FM)を拡大する。(e)拡張FM. (f) 前門のマグナムの上の薄い軟骨が除去される。デュラマーターのペリオスチール層は剥がれます。正方形は表面的なIOニューロンを含む領域を示す。(g)Gは、GRINレンズを使用してIOを画像化します。スケールバーはa=5 mmで、a-cに適用されます。d=2 mm のスケールバーは d-e に適用されます。f = 2 mm のスケール バー。g=2 mm のスケール バーをクリックして、この図の大きなバージョンを表示するには、ここをクリックしてください。
6. カルシウムイメージング
- マウスの太ももにSpO2センサーをクランプして、心拍数、酸素飽和度、呼吸速度などのバイタルサインを監視します(図2b)。
注:心拍数は500 bpmと600 bpmの間で、酸素飽和度は90%より高く、呼吸率は毎分10、11回50〜70呼吸でなければなりません。 - GRINレンズプローブ(長さ9mm、直径1mm)を注入ロッドに取り付けます。
注:イメージング品質を高める前に、70%エタノール浸し洗浄組織でGRINレンズを洗浄してください。 - ステレオタックスフレームに埋め込みロッドを固定し、移植ロッドにミニチュア顕微鏡を取り付けます。
注: イメージング用の小型顕微鏡の準備は、適切な製品ユーザーガイドラインに従って完了する必要があります。 - GRINレンズを浸漬するために、脳幹領域に温かい生理食糸を数滴加えます。
- GRINレンズ(図4d、5g)で脳幹に近づく。ミニチュア顕微鏡の励起ブルーLED(455±8)をオンにします。ミニチュア顕微鏡から蛍光画像を監視することにより、GCaMP6sトランスフェクションIOニューロンを見つけます。残りのアトラスに対して~0.5~1.7mmの四角形の領域でIOニューロンを探し、腹側脳幹の表面領域の中線に対して〜0.6-1.1mmの横方向を探す(図5f)。
注:IOイメージングの適切な視野を探す場合は、ソマタの平均直径がIOニューロンソマタの平均直径と一致する場所を探します(約15 μm12)。髄質網状形成における隣接領域は、有意に大きい細胞13、14から成る。GRINレンズを垂直に動かす際には、脳幹に強く押し込みすぎると動物が死ぬ可能性があるため、注意してください。
7. 安楽死させる動物の手順
- 実験の終わりに、子宮頸部脱臼または地元の実験動物の治療規則によって承認された他の方法で動物を安楽死させる。
- さらなる組織学の調査のために、最初にケタミン/キシラジンの組み合わせ(それぞれ100mg/kgと10 mg/kg)15リンガーの溶液で心臓灌流の前に、脳を固定するための固定液を続ける注射薬で動物を麻酔する。
8. データ処理
- 記録されたカルシウムイメージングビデオを事前に処理してから、データを分析します。
注: ミニチュア顕微鏡に付属する商用データ処理ソフトウェアは、このステップに使用され、次のプロトコル手順はそれに関連しています。また、CaImAn 16、MINIPIPE 17、MiniscoPy18などのフリーでオープンソースのソフトウェアを、前処理と分析の両方に利用することもできます。- 記録されたカルシウムイメージングビデオをデータ処理ソフトウェアにロードします。
- [ 前処理 ] ボタンをクリックします。蛍光ニューロンのない領域を除くトリミング領域を定義し、より高速な処理のためにファイルサイズを小さくするためにビデオをトリミングします。
- [ 空間フィルター ] ボタンをクリックします。空間フィルタのカットオフとハイカットオフをそれぞれ 0.005 ピクセル-1、0.5 ピクセル-1 に設定します。ビデオの各フレームに空間フィルターを適用して、コントラストを高め、画像を滑らかにします。
注: 空間フィルタはバンドパス ガウス フィルタです。焦点が合っていないセルから発生する低空間周波数成分は、次のステップでモーション補正を混乱させる可能性があります。高空間周波数成分は、ビデオの滑らかさを低下させる原因となる場合があります。 - [モーション補正]ボタンをクリックします。最初のフレームを基準フレームとして使用して、脳幹の血流によって引き起こされる動き関連のアーティファクトを減らすことによって、動画にモーション補正を適用します。
注意:モーション補正は、Thevenazら19によって開発された画像登録方法を使用しています。 - モーション補正ビデオを TIFF 形式で書き出します。
- オンラインリポジトリ21 のCNMF-E MATLABコードの指示に従って、単一のニューロンを識別するためにMATLABの動き補正ビデオにCNMF-E20を適用する。
注: CNMF-E は、1 光子イメージング用にカスタマイズされた、制約付き非負行列ファクタリゼーションアプローチです。リポジトリ内のデモ スクリプトは、データの処理に変更および使用できます。
結果
ここでは、記載した方法で得られた代表的な記録を提示する。 図6a は、実験中に可視化された明るいラベルのIOセルの位置を示す。暗い斜めの縞は血管です。なお、個々の細胞の明るさの変化は、トランスフェクション効能の変化から生じる。パネル 図6b では、パネルaに色と数字で示されたソマトンから得られた平均正規化蛍光強度(deltaF/F)トレースを示す。上向きの偏向は、細胞内カルシウムの一過性増加を表す。GCaMP6sの発現のレベルが異なる(パネルaの細胞の明るさに反映される)が、可変的な信号対雑音比(SNR)を導く方法に注意してください。
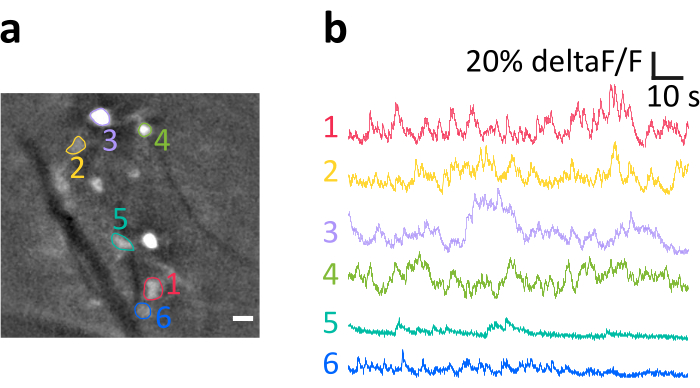
図6:麻酔マウスにおけるIOニューロンの活動記録例(a)空間フィルタリング後の記録からの代表的なフレーム。明るいスポットはIOニューロンソマトンであり、そのうちのいくつかは関心領域(ROI、色付きの数字)として示されています。暗い縞は血管です。(b) パネル a に示された ROI から取得されたデルタF/F トレースの例。上向きのたわみはカルシウムシグナルの増加を反映する。a=10 μm のスケールバー。
ディスカッション
外科的処置は、多数の極めて重要な構造(動脈、神経)を有する咽喉領域で行われる手術を伴うため、高レベルの外科的スキルを有する研究者によって行われることが不可欠である。以下では、この手順のいくつかの重要なポイントを強調し、コメントします。しかし、書かれたアドバイスの量は、研究者の経験、スキル、および直感に取って代わることはできないということを思い出させる必要があります。
手術の最も重要なステップは気管切開です。気管を切断し、鼻コーンから挿管チューブにイオブルランを切り替え、気管を胸部の皮膚に固定し、気管と挿管チューブを結び付けます。これらの操作はすべて、不十分な麻酔、気管への流体の流入、挿管チューブのスリップオフなどの事故を避けるために、スムーズかつ迅速な方法で完了する必要があります。気管を切る前にプロトコルを明確にしておかなければなりません。
出血は、この手術における動物死亡の主な原因の1つである。首の領域は血管で密集しているので、目に見えない静脈や動脈を切断することを避けるために、視線が明確な場合にのみ切断を実行する必要があります。したがって、視力を隠す筋肉や結合組織を取り除く必要があり、壊れた毛細血管からの血液は前進する前に洗浄する必要があります。
動物は手術の開始から長い間(8時間以上)生き続けることができます。しかし、動物の生理学的状態が良好なときに脳幹ニューロンを調べる時間が増えるため、外科的処置を迅速に終了することが重要です。熟練した研究者は、70分で全体の手順を完了することができます。
この方法は腹側脳表面のきれいなビューを提供するが、残念ながら気管切開を行わず、喉の領域内のかなりの量の組織を除去することは不可能である。したがって、動物は麻酔から目覚めることはできません。さらに、麻酔薬の送達を注意深く調整し、体温や水分補給を維持することで、動物を何時間も生き続けることが可能であるにもかかわらず、長期実験が最終的に動物の状態の弱体化につながることは避けられない。安定した録音の最大期間を考慮することは、研究者の専門知識に委ねられます。
ここで説明する方法のもう一つの潜在的な制限は、GRINレンズが脳の華やまに挿入されないので、比較的表面的なニューロン(〜150〜200μm)しか検査できないということである。GRINレンズの外科的移植は技術的に可能であるが、急性の外科手術方法は、ニューロンが酸化ストレスから回復するのに十分な時間を許さないし、移植後の血液の存在は許容範囲を超えて画質を低下させる可能性が高い。
上記の懸念事項にもかかわらず、IOニューロンの インビボ イメージング法が発表されるのはこれが初めてであると考えています。これは、感覚系からの無傷の発泡性入力の存在下 での生体内 の文脈におけるIOニューロンにおける時空間的活性の検査を可能にするとともに、小脳核およびメソジエンスファリック接合部22からの信号は、これまで不可能であった偉業である。この方法により、IOの機能は、感覚的および光遺伝学的刺激の組み合わせにより、より深く調査できるようになりました。特に、電圧イメージング(IO 23における最近の電圧イメージング法など)の進化により、提示された外科的手法が、IOが小脳複雑なスパイクの生成にどのように寄与するかを調査することに挑戦する多くの研究者を鼓舞することを期待しています。
開示事項
著者らは開示するものは何もない。
謝辞
OISTのメディアセンターのアンドリュー・スコットがビデオ録画と編集に協力してくれたことに感謝します。また、ヒューゴ・ホーデメイカーが脳幹を暴露する手術の開発に協力してくれたことに感謝し、ケビン・ドオルガン博士は数字の図を描くのに役立ちます。さらに、サルヴァトーレ・ラカヴァのナレーション、そしてCOVID-19の厳しい時代の幸福のための継続的なサポートのためのすべてのnRIMメンバーとペットに感謝します。
資料
| Name | Company | Catalog Number | Comments |
| AAV.CAG.GCaMP6s.WPRE.SV40 | Addgene, USA | 100844-AAV9 | |
| Absorbable suture with 6 mm half circle needle | Natume, Japan | L6-60N2 | hook needle with thread |
| Absorption triangles | FST, Germany | 18105-03 | Surgical sponges |
| Stereo microscopes | Leica, Germany | M50 | |
| Castroviejo curved tip needle holder with lock | FST, Germany | 12061-01 | Surgery tool |
| cotton swabs | Sanyo, Japan | HUBY-340 | |
| Delicate suture tying forceps | FST, Germany | 11063-07 | Surgery tool |
| Delicate Suture Tying Forceps | FST, Germany | 11063-07 | Surgery tool |
| Dumont #5/45 forceps | FST, Germany | 11251-35 | Surgery tool |
| Fine Iris scissors | FST, Germany | 14060-09 | Surgery tool |
| Friedman-Pearson rongeur curved tip | FST, Germany | 16221-14 | Surgery tool |
| Gelfoam absorbable gelatin sponge | Pfizer, USA | 0315-08 | Hemostatic gelatin sponge |
| Glass-Capillary Nanoinjection | Neurostar, Germany | n/a | For virus vector injection |
| Graefe Forceps with serrated tip | FST, Germany | 11052-10 | Surgery tool |
| Implantation rod | Inscopix, USA | n/a | It is part of the nVoke2 system. It's designed to nVoke2 miniature microscpe and GRIN lens can be mounted on it |
| IsoFlo | Zoetis, UK | n/a | Isoflurane |
| KETALAR FOR INTRAMUSCULAR INJECTION | Daiichi Sankyo, Japan | n/a | Ketamine |
| Kimwipes | Kimberly-Clark, USA | Cleaning tissue | |
| Laser-Based Micropipette Puller | Sutter Instrument, USA | P-2000 | |
| Micropipette Beveler | Sutter Instrument, USA | BV-10 | |
| Motorized Stereotaxic based on Kopf, Model 900 | Neurostar, Germany | n/a | Stereotaxic frame |
| mouseOxPlus with rectal temperature sensor and thigh clamp pulse oximeter | Starr Life Sciences, PA, USA | MouseOxPlus | Measures animal heart rate, arterial oxygen saturation (SpO2), breath rate, and temperature |
| nVoke2 integrarted Calcium imaging micro camera system | Inscopix, USA | 1000-003026 | Miniature microscope |
| Ohaus Compact Scales | Ohaus, USA | CS 200 | Scale used to weight animal |
| Otsuka Normal Saline | Otsuka Pharmaceutical Factory, Japan | n/a | |
| Physiological-biological temperature controller system | SuperTech Instruments, Hungary | TMP-5b | Thermal pad for mouse |
| ProView Lens Probe 1.0 mm diameter, 9.0 mm length | Inscopix, USA | 1050-002214 | Gradient-refractive index (GRIN) lens |
| Q114-53-10NP glass capillaries | Sutter Instrument, USA | 112017 | Customized quartz glass capillaries |
| Safety IV Catheter 20G | B. Braun, Germany | 4251652-03 | 20 gauage catheter used to prepare intubation tube |
| Sand paper | ESCO, Japan | EA366MC | Used to polish the tip of 25G needle to prepare curved and blunt needle |
| Scalpel blade | Muromachi Kikai, Japan | 10010-00 | Used to cut the tip of quartz glass pipette |
| SomnoSuite low flow inhalation anesthesia system | Kent Scientific, USA | SOMNO | Provides precise control of isoflurane flow |
| Surgic XT Plus drill | NSK | Y1002774 | For virus vector injection |
| Syringe 1 ml | Terumo, Japan | SS-01T | |
| Syringe needle 25G | Top, Japan | 00819 | Used to make blunt and bended needle |
| Syringe needle 26G | Terumo, Japan | NN-2613S | |
| Thrive 2100 Professional Trimmer | Thrive, Japan | n/a | Shaver |
| Vannas-Tübingen spring scissors | FST, Germany | 15004-08 | Surgery tool |
| Vaseline | Hayashi Pure Chemical, Japan | 22000255 | |
| Veet sensitive skin | Veet, Canada | n/a | Hair removal cream |
| Xylocaine Jelly 2 % 30ml | Aspen Japan, Japan | 871214 |
参考文献
- Russell, J. T. Imaging calcium signals in vivo: A powerful tool in physiology and pharmacology. British Journal of Pharmacology. , (2011).
- Zhang, T., et al. Kilohertz two-photon brain imaging in awake mice. Nature Methods. , (2019).
- Lin, X., Zhao, T., Xiong, W., Wen, S., Jin, X., Xu, X. M. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. Journal of Visualized Experiments. 2019 (143), 1-8 (2019).
- Lee, H. S., Han, J. H. Successful In vivo Calcium Imaging with a Head-Mount Miniaturized Microscope in the Amygdala of Freely Behaving Mouse. Journal of visualized experiments. (162), 1-19 (2020).
- Aharoni, D., Khakh, B. S., Silva, A. J., Golshani, P. All the light that we can see: a new era in miniaturized microscopy. Nature Methods. 16 (1), 11-13 (2019).
- Khosrovani, S., Van Der Giessen, R. S., De Zeeuw, C. I., De Jeu, M. T. G. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proceedings of the National Academy of Sciences. 104 (40), 15911-15916 (2007).
- Osten, P., Cetin, A., Komai, S., Eliava, M., Seeburg, P. H. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1 (6), 3166-3173 (2007).
- Berg, L., Gerdey, J., Masseck, O. A. Optogenetic Manipulation of Neuronal Activity to Modulate Behavior in Freely Moving Mice. Journal of visualized experiments : JoVE. , e61023 (2020).
- Green, C. J., Knight, J., Precious, S., Simpkin, S. Ketamine alone and combined with diazepam or xylazine in laboratory animals: A 10 year experience. Laboratory Animals. 15 (2), 163-170 (1981).
- Tsukamoto, A., Serizawa, K., Sato, R., Yamazaki, J., Inomata, T. Vital signs monitoring during injectable andn inhalant anesthesia in mice. Experimental Animals. 64 (1), 57-64 (2015).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harbor Protocols. 6 (2), 174-178 (2011).
- Vrieler, N., et al. Variability and directionality of inferior olive neuron dendrites revealed by detailed 3D characterization of an extensive morphological library. Brain Structure and Function. , 1677-1695 (2019).
- Esposito, M. S., Capelli, P., Arber, S. Brainstem nucleus MdV mediates skilled forelimb motor tasks. Nature. , (2014).
- Martin, E. M., Devidze, N., Shelley, D. N., Westberg, L., Fontaine, C., Pfaff, D. W. Molecular and neuroanatomical characterization of single neurons in the mouse medullary gigantocellular reticular nucleus. Journal of Comparative Neurology. , (2011).
- Cold Spring Harbor. Ketamine/Xylazine. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. eLife. 8, 1-45 (2019).
- Lu, J., et al. MIN1PIPE: A Miniscope 1-Photon-Based Calcium Imaging Signal Extraction Pipeline. Cell Reports. 23 (12), 3673-3684 (2018).
- . GitHub - PeyracheLab/miniscoPy: A package to analyse calcium imaging data recorded with the Miniscope Available from: https://github.com/PeyracheLab/miniscoPy (2020)
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. , (1998).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. eLife. 7, 1-37 (2018).
- . GitHub - zhoupc/CNMF_E: Constrained Nonnegative Matrix Factorization for microEndoscopic data Available from: https://github.com/zhoupc/CNMF_E (2020)
- De Gruijl, J. R., Bosman, L. W. J., De Zeeuw, C. I., De Jeu, M. T. G. Inferior olive: All ins and outs. Handbook of the Cerebellum and Cerebellar Disorders. , (2013).
- Dorgans, K., Kuhn, B., Uusisaari, M. Y. Imaging Subthreshold Voltage Oscillation With Cellular Resolution in the Inferior Olive in vitro. Frontiers in Cellular Neuroscience. , (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved