Method Article
אין ויוו הדמיית סידן בעכבר זית נחות
In This Article
Summary
אנו מציגים פרוטוקול לחשוף את גזע המוח של עכבר בוגר מהצד הגחוני. באמצעות עדשת מדד שבירה הדרגתית עם מיקרוסקופ מיניאטורי, ניתן להשתמש בהדמיית סידן כדי לבחון את הפעילות של סומטה עצבית זית נחותה ב- vivo.
Abstract
זית נחות (IO), גרעין במדולה הגחונית, הוא המקור היחיד לסיבים מטפסים היוצרים את אחד משני מסלולי הקלט הנכנסים למוטל המוח הקטן. IO הוצע זמן רב להיות חיוני עבור שליטה מוטורית ופעילותה נחשבת כיום במרכז השערות רבות של תפקודים מוטוריים וקוגניטיביים של המוח הקטן. בעוד הפיזיולוגיה והתפקוד שלה נחקרו היטב יחסית ברמה חד-תאית במבחנה, כיום אין דיווחים על ארגון פעילות רשת IO בבעלי חיים חיים. זאת בעיקר בשל המיקום האנטומי המאתגר ביותר של ה- IO, מה שמקשה על הכפוף לשיטות הדמיה פלואורסצנטיות קונבנציונליות, שבהן יש ליצור נתיב אופטי דרך המוח כולו הממוקם באופן דורסי לאזור העניין.
כאן אנו מתארים שיטה חלופית להשגת נתוני דימות סידן ברמה העדכנית ביותר מרשת ה- IO. השיטה מנצלת את המיקום הגחוני הקיצוני של ה- IO וכוללת הליך כירורגי להחדרת עדשת אינדקס שבירה הדרגתית (GRIN) דרך הקרביים בצוואר כדי לבוא במגע עם פני השטח הגחוניים של חיישן הסידן GCaMP6s-מבטא IO בעכברים מורדמים. הקלטת דימות סידן מייצגת מוצגת כדי להדגים את ההיתכנות להקליט פעילות נוירון IO לאחר הניתוח. אמנם מדובר בניתוח שאינו הישרדותי ויש לבצע את ההקלטות בהרדמה, אך הוא מונע פגיעה בגרעיני גזע המוח הקריטיים לחיים ומאפשר לבצע מגוון רחב של ניסויים החוקרים דפוסי פעילות מרחבית ושילוב קלט בקלט. הליך זה עם שינויים יכול לשמש להקלטות באזורים אחרים, סמוכים של גזע המוח הגחוני.
Introduction
המטרה העיקרית של מדעי המוח במערכות היא להבין כיצד דפוסי פעילות מרחבית של רשתות עצביות תורמים ליצירת התנהגות בעלי חיים. לפיכך, מתודולוגיית הדמיה פלואורסצנטית העושה שימוש בבדיקות רגישות לסידן הפכה בעשור האחרון לכלי מרכזי לבחינת פעילות רשת עצבית בבעליחיים 1,2 , שכן היא מאפשרת הדמיה שלדינמיקהכזו על פני קשקשים מרחביים החל מתאים בודדים ועד מעגלים מזוקלים. בשנים האחרונות, הגישה הנפוצה שבה מעגלים עצביים במבני מוח שטחיים (כגון קליפות מוח או מוחיות) מצוידים דרךחלון גולגולתי שקוף 3 הושלם עם השימוש של אינדקס שביר שבירה (GRIN) עדשות4 המאפשר בדיקה של דינמיקת הרשת במבני מוח עמוקים. עדשות GRIN הזמינות כיום מאפשרות להגיע למבנים בעומק של כמה מילימטרים, כגון האמיגדלה של העכבר, ההיפוקמפוס והגרעינים הבסיסיים5. עם זאת, אזורים רבים של עניין כגון גרעינים שונים במדולה הגחוני לשכב עמוק יותר באופן משמעותי, הצבת אותם בקצה של עדשת GRIN להגיע.
כאן, אנו מתארים כיצד להתגבר על קושי זה על ידי ניצול הנגישות הקלה יחסית של medulla דרך ההיבט הגחוני של המוח. באמצעות עכברים בוגרים שבהם הזית הנחות (IO), גרעין במדולה הגחונית, נחתך ויראלית עם חיישן סידן GCaMP6s, אנו מתארים את הצעדים הכירורגיים (שונה מהשיטה המתוארת במקור Khosrovani et al. 20076) כדי למקם עדשת GRIN על פני השטח הגחוני של המוח של עכבר מורדם. באמצעות מיקרוסקופ מיניאטורי, אנו מדגימים את ההיתכנות של רישום פעילות עצבית באזורי מוח גחוני כל כך. בעוד ההליך הוא בהכרח ניתוח שאינו הישרדות ולא ניתן לבצע ניסויים בבעלי חיים ערים, השיטה מאפשרת בדיקה של דינמיקת רשת שלמה בהקשר של גירוי מסלול חושי או אפרנטי אחר, ומספקת יתרונות ברורים על פני גישות אקס ויוו כגון שימוש בתכשירי פרוסה חריפים.
Protocol
כל ההנחיות הבינלאומיות, הלאומיות והמוסדיות הרלוונטיות לטיפול ולשימוש בבעלי חיים בוצעו. טכניקות ניתוח אספטי יושמו על הזרקת וקטור וירוס סטראוטקסי.
1. הזרקת וקטור וירוס סטראוטקסי
הערה: וירוס הנושא את החומר הגנטי להבעת GCaMP6s (AAV9. ק.ג. GCaMP6s.WPRE.SV40) מוזרק באופן סטראוטקסי כפי שתואר קודםלכן 7,8 עם השינויים הבאים.
- השתמש זכוכית קוורץ (קוטר חיצוני: 1.14 מ"מ, קוטר פנימי: 0.53 מ"מ) במקום זכוכית borosilicate כדי ליצור פיפטה עם התחדדות ארוכה ונוקשה להזרקת IO באמצעות משיכה נימי לייזר עם פרמטרים מותאמים כמו במדריך המוצר. לאחר המשיכה, חותכים 1.2 מ"מ מקצה הפיפט עם אזמל כדי לרכוש התחדדות באורך 8-10 מ"מ בקוטר 15-20 מיקרומטר פנימי(איור 1a). סיימו את הפיפט על ידי כיפוף הקצה שלו לצורת מחט של 30° עם שיפוע מיקרופיפט מסתובב לחדירה קלה יותר למוח ופחות כיפוף פיפטה(איור 1a).
הערה: פיפטה זכוכית borosilicate נפוץ יהיה גמיש מדי כדי למקד כראוי אזורים עמוקים כאשר משך באורך זה. מזרק ננו-ליטר שימש עם פיפטה זכוכית כדי לספק את הנגיף במחקר זה. לחלופין, מזרק זכוכית מדויק או מזרק לחץ יכול לשמש גם. - ודאו שחזה העכבר מונח על המשטח התרמי כדי שצווארו לא יהיה מתוח עם מספיק תמיכה בגוף, והיזהרו מאוד עם איזון הגולגולת בעת תיקון העכבר במסגרת הסטראוטקסית(איור 1b).
הערה: הפרש Bregma-lambda צריך להיות פחות מ 0.05 מ"מ בממד אנכי. - השתמש בקודל 6.2 מ"מ, ±0.5 מ"מ לרוחב ו-6.6 מ"מ גחוני יחסית ל bregma כקואורדינטות למיקוד גרעין ה-IO העיקרי (איור 1c).
הערה: איזון מושלם של המוח יגדיל באופן דרמטי את שיעור ההצלחה של הזרקת וירוס לתוך IO. הקואורדינטות חייבות להיות מאושרות על ידי הנסיין כמו הבדלים משמעותיים צפויים בין מעבדות, זני עכבר וחוקרים בודדים. להכנת חומר וידאו עבור פרסום זה, השתמשנו בעכבר C57Bl/6J זכר אחד. - עקוב אחר ההנחיות המוסדיות הרלוונטיות לטיפול לאחר הניתוח ונהלי דיור לבעלי חיים בעלי חיים שנדבקו בנגיף במשך 3-4 שבועות.
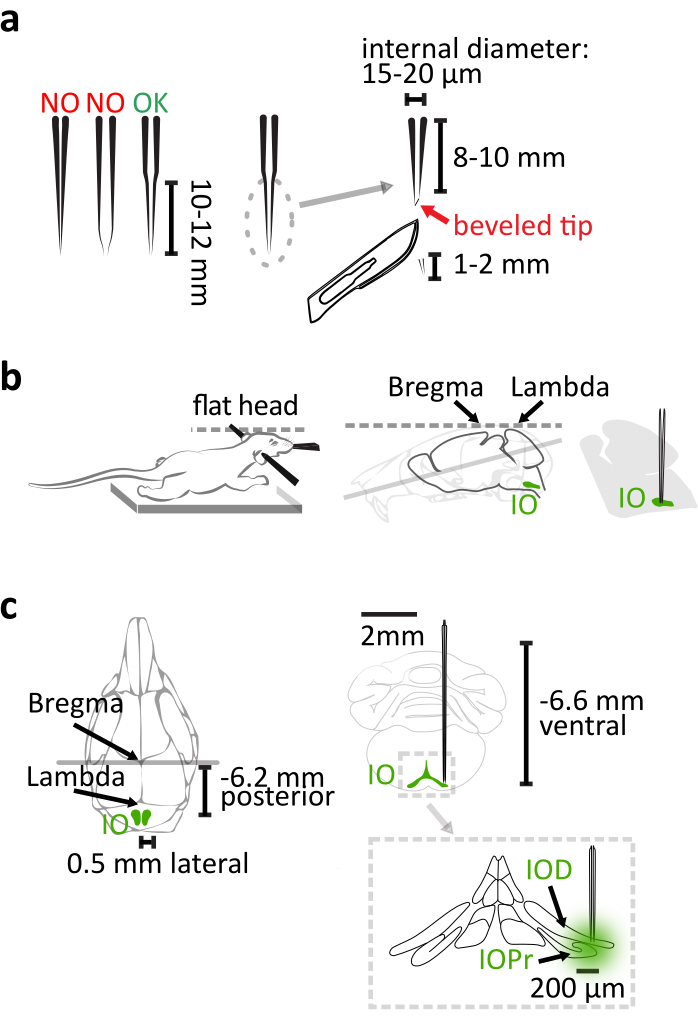
איור 1: הזרקת וקטור וירוס סטראוטקסי. (א)פיפט זכוכית קוורץ משך לייזר יש להתחדד ישר 10-12 מ"מ ארוך. לאחר משיכה, לחתוך 1-2 מ"מ מהקצה. פיפטה היא סופית על ידי שיפוע הקצה לצורת מחט 30 °. (ב)ההזרקה הנכונה מסתמכת על המיקום הנכון של גוף העכבר במסגרת הסטראוטקסית. תמיכה בחזה העכבר כדי למנוע מתיחת הצוואר. יישר את ראש העכבר על-ידי יישור ה-bregma וה-lambda אופקית. (ג)תיאום ה-IO ביחס לרגמה מוצג בתצוגה הגבית (משמאל) של גולגולת העכבר והנוף הקורונלי (החלק הימני העליון) של המוח. ההזרקה מגיעה לחלק לרוחב של הקרן (IOPr) ותת-נוקלי הגב (IOD) של IO (תחתית ימין). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
2. הכנת כלים ומתכלים לניתוחי גישה גחונית
- הכינו צינור אינטובציה על ידי חיתוך חריץ באורך 5 עד 6 מ"מ וברוחב 0.8 מ"מ מקצה קטטר 20 מד כדי שהחיה הצנרורת תוכל לנשום לרווחה (איור 2a).
הערה: החריץ נחוץ כדי שבעל חיים יתנשף אם נעשה שימוש במאדה isoflurane משותף עם זרימת אוויר מתמדת. אם משתמשים במכונות הנשמה בנוסף לאייד, ניתן להשאיר את הקטטר ללא פגע. - הכינו מחט קהה לתמיכה בקנה הנשימה במהלך קנה הנשימה. חותכים את הקצה החד של מחט 25-מד עם צבת. להחליק את משטח השבר עם נייר זכוכית. לכופף את המחט קהה באמצע על 15 ° עם צבת.
הערה: מחט מעוגלת מרימה את קנה הנשימה בעדינות. זה יכול להקטין את העיוות של קנה הנשימה. - לדלל 50 מ"ג / מ"ל קטמין עם מלוחים ל 15%. הריכוז הסופי הוא 7.5 מ"ג / מ"ל.
- להרכיב את כלי הניתוח הנקי ואת המתכלים כולל ג'ל לידוקאין, מלוחים, ספוגים ג'לטין, ספוגים סופגים, ג'לי נפט ורקמת ניקוי.
- תדליק את מאדה האיסופלורן. הגדר את כרית חימום בעלי החיים ל 38 מעלות צלזיוס.
- סובב את חרוט האף של מסגרת סטריאטקסית ב- 180° אופקית, כך שניתן יהיה לתקן את העכבר לצד הגחוני של המסגרת כלפי מעלה. להתאים את גובה חרוט האף, כך שהוא ברמה של מוטות אוזניים.
3. ניהול הרדמה והכנת העכבר לניתוח
- לשקול את החיה עם סולם שקילה ולחשב את כמות קטמין מדולל להזרקה.
הערה: הכמות הכוללת של קטמין הדרוש הוא 56.25 מ"ג לכל משקל גוף ק"ג. לכן, נפח קטמין מדולל הוא 7.5 מ"ל לכל משקל גוף ק"ג. החסרונות של שימוש קטמין לבד כוללים הרפיה שרירים ירודה, טכיקרדיה טונוס שרירים משופרת9. בפרוטוקול זה, אם כי, קטמין משמש רק כדי לכסות את התקופה 10-20 שבמהלכו הממשל isoflurane מופרע בשל קנה הנשימה. על ידי שמירה על צעד זה קצר ככל האפשר, ההשפעה ההרדמה של isoflurane אינו פחתה באופן משמעותי ואת החסרונות באמצעות קטמין ממוזערים. - מניחים את העכבר לתוך תא אינדוקציה הרדמה ממולא מראש עם 5% isoflurane. כאשר החיה מורדמת לחלוטין על ידי אובדן רפלקס תיקון ודפוס נשימה עמוק ואיטי יותר, לעבור את זרימת isoflurane אל חרוט האף של מסגרת סטראוטקסית ולהפחית את ריכוז isoflurane ל 2.5%.
- תקן את החיה בצד הגחוני של המסגרת הסטראוטקסית כלפי מעלה (איור 2b). כוונן את הגובה ואת גובה חרוט האף כדי לוודא שהחיה יכולה לנשום בקלות. שמרו על החיה חמה עם כרית החימום המחוממת מראש.
הערה: כיסוי החלק התחתון של גוף החיה בפיסת נייר טישו או רדיד אלומיניום יכול לסייע בשמירה על טמפרטורת בעלי החיים. - הסר את שיער העור באזורי הגרון והירך עם מכונת גילוח וקרם להסרת שיער(איור 2b). יש למרוח את ג'ל הלידוקאין על עור הגרון.
הערה: חיישן רוויית החמצן ההיקפית של מלחצי הירך (SpO2),אשר ישמש בהליך 6, פועל בצורה הטובה ביותר על עור חסר שיער. - ניטור טמפרטורת בעלי החיים באמצעות מדחום רקטלי(איור 2b).
- הזרק 1 מ"ל של מלוחים חמים (37 מעלות צלזיוס) תוך-אופן כדי לפצות על אובדן הנוזלים במהלך הניתוח.
- להעריך את עומק ההרדמה על ידי צביטה חזקה על בהונות הגפיים האחוריות. אין לעורר תגובה הניתנת לגילוי.
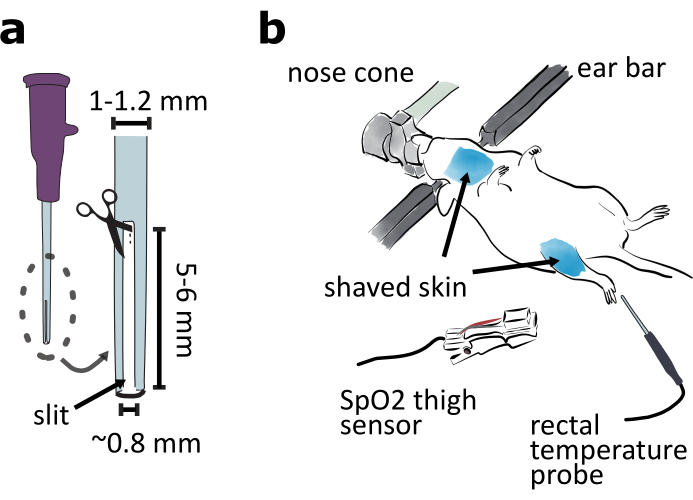
איור 2: הכנת ניתוח גישה גחונית. (א) הכן צינור אינטובציה על ידי חיתוך חתך באורך 5-6 מ"מ וחריץ ברוחב 0.8 מ"מ בקצה קטטר 20 מד. (ב)הר את הצד הגחוני של החיה כלפי מעלה במסגרת סטראוטקסית והתאם את זווית חרוט האף כדי להבטיח שהחיה נושמת בקלות. לגלח את העור סביב אזורי הגרון והירך. חבר את חיישן SpO2 לירך לניטור סימנים חיוניים לעכבר. הכנס את בדיקת הטמפרטורה רקטלית לניטור טמפרטורת הגוף של העכבר. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
4. קנה הנשימה והיצירה (20-25 דקות)
- חושף את קנה הנשימה.
- בצע חתך אנכי בעור הגרון לאורך קו האמצע. הפרד את עור הצוואר מהמצחית שמתחתיו באמצעות שיטת הניתוח הקהה וחתך את העור כדי לחשוף את בלוטות הרוק(איור 3a-b,4a).
- חינם בלוטות הרוק מרקמת החיבור ולהפוך אותם לרוחב כדי לחשוף את קנה הנשימה מכוסה שריר החזה עם מלקחיים (איור 3b-c).
הערה: ניתן למרוח את ג'לי הנפט על הרקמה החשופה כדי לשמור אותם לחים. הימנע מאזור קנה הנשימה כדי לשמור אותו נקי לשלבים הבאים.
- כריתת קנה הנשימה
- להזריק את המנה הראשונה של קטמין מדולל (7.5 מ"ג / מ"ל) תוך-פרטית, 5 מ"ל לק"ג משקל גוף (37.5 מ"ג/ק"ג).
הערה: זה לוקח 3-5 דקות קטמין לתפקד, ולכן המנה הראשונה של קטמין צריך להיות מוזרק לפני הפרדת קנה הנשימה מן השרירים וכלי הדם שמסביב. קטמין מנוהל בשתי זריקות בגלל הסיכון הגבוה של השפעות מנת יתר בשילוב עם הרדמה isoflurane. - לפצל בזהירות את שריר העצם לאורך קו האמצע עם קצה של מלקחיים עדינים כדי לחשוף את קנה הנשימה (איור 3c). נתק את קנה הנשימה מכלי הדם ואת הוושט עם מלקחיים בשיטת הניתוח הקהה.
- תוך-אופן להזריק את המנה השנייה של קטמין מדולל (7.5 מ"ג/מ"ל), 2.5 מ"ל לק"ג משקל גוף (18.75 מ"ג/ק"ג).
- הכנס מחט קהה מתחת לקנה הנשימה לרוחב כדי לתמוך בה (איור 3D). תחזיק את המחט עם האצבעות כדי לתמוך בקנה הנשימה. מדריך חוט התפר סביב caudal טבעת קנה הנשימה השלישית בלוטת התריס עם מחט חציעיגול (איור 3D). תעשה ארבעה קשרים על טבעת קנה הנשימה הזאת.
הערה: החוט הקשור לטבעת קנה הנשימה משמש לאבטחת קנה הנשימה לחזה החיה. אין לחתוך את החוט ממחט חצי העיגול בשלב זה. טבעות קנה הנשימה עשויות סחוס שהוא גמיש אך פחות חזק מעצמות. אין לקשור את חוט התפר חזק מדי או שהטבעת עלולה להישבר. - צבוט את עור החזה עם זוג מלקחיים. חודרים את עור החזה עם אותה מחט בחצי עיגול המשמשת בשלב האחרון ומובילים את החוט דרך העור, כהכנה לאבטחת קנה הנשימה לחזה בשלב הבא(איור 3D).
- בעדינות להרים את קנה הנשימה על ידי משיכת החוט קשור לטבעת קנה הנשימה לחתוך את rostral קנה הנשימה לטבעת קשורה caudal בלוטות התריס. משוך את קנה הנשימה caudal לכיוון החזה. הרם את פתיחת קנה הנשימה על ידי הוספת חתיכה קטנה של ספוג כירורגי מתחתיה.
הערה: ודא יותר מ 5 דקות עברו לאחר הזריקה השנייה של קטמין לפני חיתוך קנה הנשימה כדי להבטיח את רמת ההרדמה. - הסר כל נוזל שנותר בתוך קצה הפתיחה של קנה הנשימה עם רצועה דקה של רקמת ניקוי. העבר את זרימת הטופוריה מ חרוט אף סטראוטקסי לצינור הצנרור. הכנס את צינור הצנרור לקנה הנשימה בעומק של כ-2 מ"מ וודא שחלק מהחתך בצינור נשאר מחוץ לקנה הנשימה כדי לאפשרנשימה (איור 3e, 4b).
הערה: כוונן בזהירות את זווית צינור הצנרור ואת עומק הכניסה שלו כדי לגרום לעכבר לנשום בצורה חלקה ולהימנע מפגיעה בקנה הנשימה. ג'לי נפט יכול להיות מיושם בצד החיצוני של קנה הנשימה כדי למנוע ממנו להתייבש, כך קנה הנשימה לא נקרע בקלות. - לתקן את קנה הנשימה לעור החזה על ידי ביצוע 3-4 קשרים אינסטרומנטליים. קשרו את קנה הנשימה עם חוט התפר כדי לאבטח את צינור הצנרור(איור 3e, 4b).
- להזריק את המנה הראשונה של קטמין מדולל (7.5 מ"ג / מ"ל) תוך-פרטית, 5 מ"ל לק"ג משקל גוף (37.5 מ"ג/ק"ג).
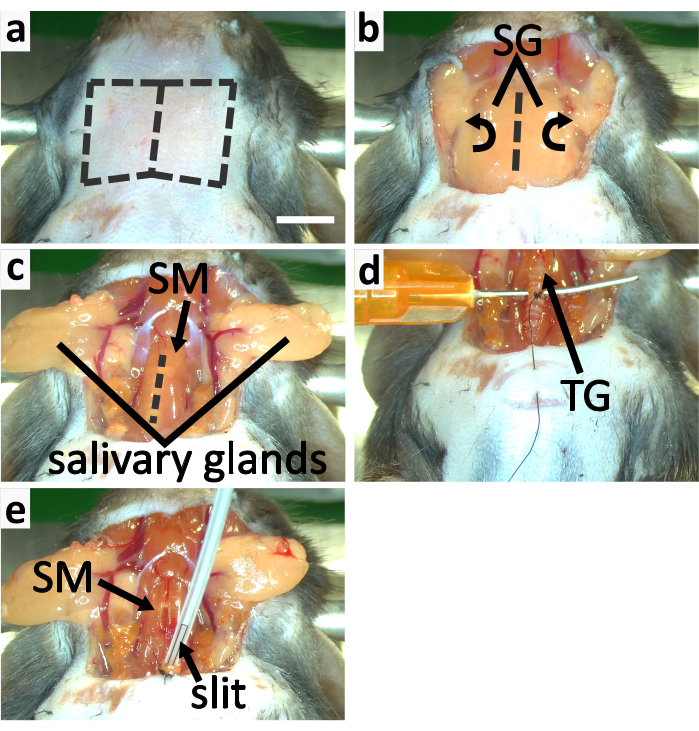
איור 3: כריתת קנה הנשימה וצנרור העכבר. לוחותa-cמציגים את תהליך חשיפת קנה הנשימה. (א)הסר את עור הגרון על ידי חיתוך לאורך הקווים המקווקוים. (ב)הפוך את בלוטות הרוק (SG) לרוחב כדי לחשוף את קנה הנשימה מכוסה על ידי שריר העצם (SM). (ג)חתך SM פתוח לאורך הקו המקווקו כדי לחשוף את קנה הנשימה. (d-e)לוחות להראות את קנה הנשימה. (ד)לתמוך בקנה הנשימה עם מחט קהה ומעוקל. לקשור את טבעת קנה הנשימה השלישית caudal לבלוטת התריס לאבטחת קנה הנשימה לעור החזה. (ה)החל isoflurane עם צינור אינטובציה עם חריץ בקצה. אבטחו את קנה הנשימה לעור החזה בעזרת חוט התפר. לאבטח את צינור הצנרור לקנה הנשימה על ידי תיקון אותם יחד. סרגל שינוי קנה המידה ב- a = 5 מ"מ, חל על כל הלוחות. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
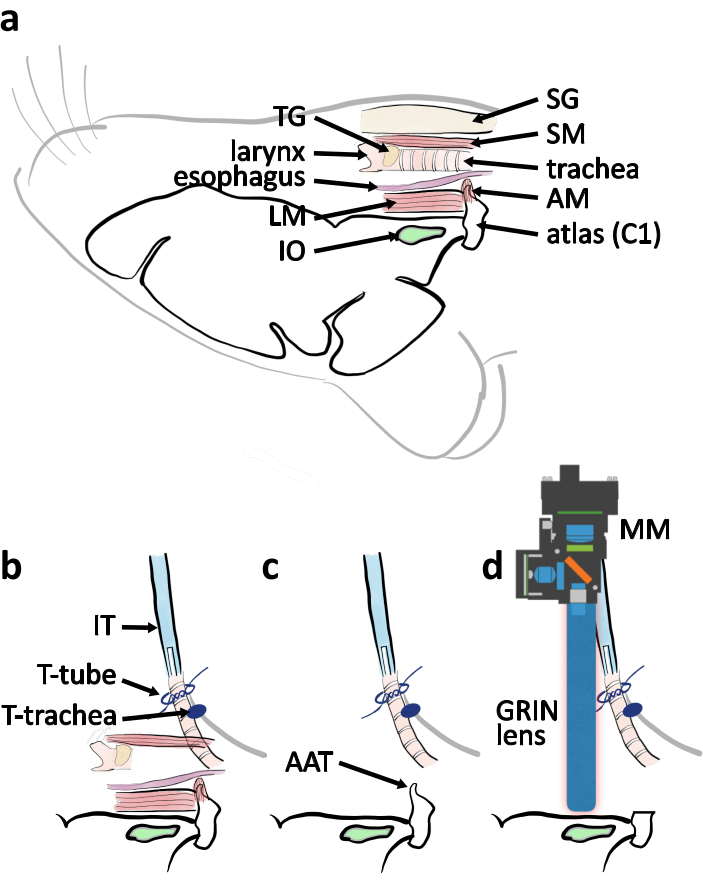
איור 4: דיאגרמה סכמטית של ניתוח גישה גחונית ממבט רוחבי. (א) ציור סכמטי עם חלקים אנטומיים רלוונטיים המצוין במיקום היחסי שלהם כאשר העכבר ממוקם בצד הגחוני כלפי מעלה. קיצורים: אטלס כיסוי שרירים (AM), שריר האורך (LM), בלוטות הרוק (SG), שריר העצם החזה (SM), בלוטת התריס (TG). (ב)סכמטי של סידור צינור הצנרור ביחס לקנה הנשימה כאשר קנה הנשימה הושלם. קנה הנשימה מאובטח על ידי העניבות על עור החזה (T-trachea). צינור הצנרור (IT) מאובטח על ידי הקשרים סביב קצה קנה הנשימה (T-tube). (ג)הסר את פקעת האטלס (AAT) כדי לנקות את קו הראייה ל- IO. (ד)סכמטי המתאר את מיקום המיקרוסקופ הזעיר (MM) ואת עדשת GRIN מעל ה- IO לניסוי הדמיה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
5. חשיפת גזע המוח (40-45 דקות)
- חתך את שריר העצם לאורך סיבי השריר עם מלקחיים עדינים. חותכים את החלק המבודד עם מספריים האביב(איור 3e).
- שחררו בזהירות את קנה הנשימה השמאלי ואת הגרון מהשרירים כדי למזער את הנזק לכלי הדם בשרירים. הסר את קנה הנשימה השמאלי ואת הגרון. שחררו את הוושט מהרקמה המצורפת עם מלקחיים וחתכו אותו במספריים אביביים. (איור5א).
- הסירו את השריר המכסה את קשת הגחון ואת פקעת האטלסים הדקה עם מלקחיים דקים ומספריים אביביים(איור 5b).
הערה: בעת הסרת השריר, לפצל חלק ממנו עם קצה המלקחיים בסדר. חותכים את החלק המופרד עם זוג מספריים אביביים. חזור על זה מספר פעמים כדי לחשוף את קשת הגחון אטלס כדי למזער את הסיכון של קריעת כלי הדם. - חותכים את קשתות הגחון של האטלס עם rongeur(איור 4c, 5c). הסר את פקעת האטלס החיצונית. הסר את הדם והנוזל עם ספוג כירורגי כדי להציג את מגנום התוספת ואת גזע המוח (איור 4c, 5d).
- הרחב את מגנום המזחלות על ידי הסרת עצם העורף עם רונגור. (איור 5d-e).
- הסר את הסחוס הדק מעל מגנום המזחלות עם מלקחיים דקים ומספריים אביביים. יש לקלף בזהירות את השכבה periosteal של דורה מאטר עם מלקחיים עדינים כדי לקבל תצוגה ברורה של גזע המוח הגחוני (איור 5f). אל תשבור את הדורה מאטר.
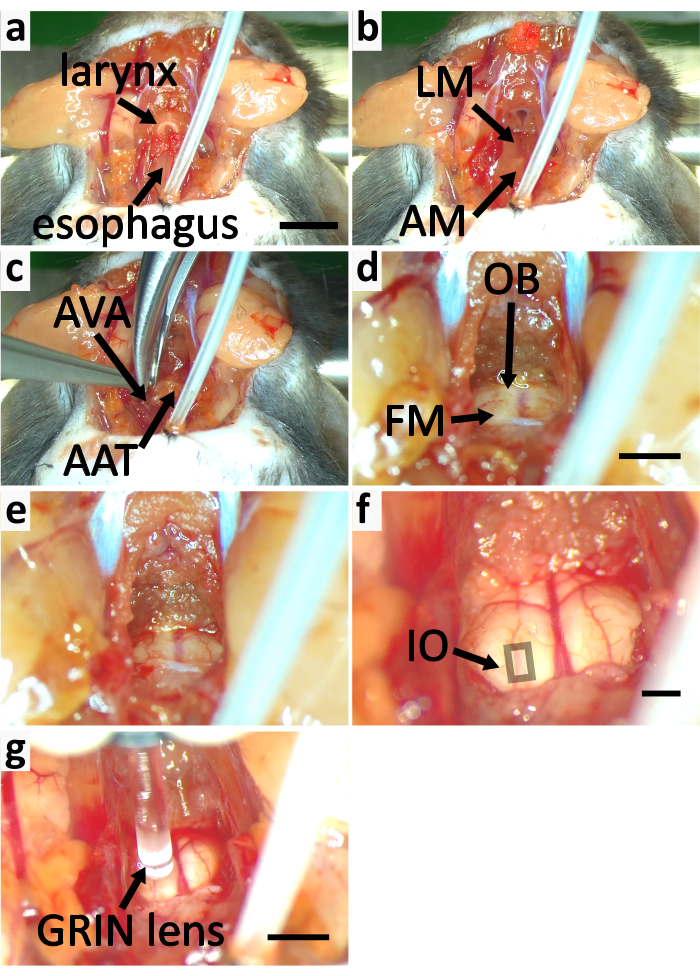
איור 5: חשוף את גזע המוח של העכבר להדמיית סידן. לוחותa-fמציגים את תהליך חשיפת גזע המוח. (a)הסירו את שריר העצם (SM) המסומן באיור 3e. חותכים את הגרון והוושט. (ב)הסר את שריר האורך (LM) ואת השריר המכסה אטלס (AM). (ג)חותכים את קשתות הגחון האטלס (AVA) עם rongeur ולהסיר את פקעת האטלס לפניישי (AAT). (ד)לחתוך את עצם העורף (OB) כדי להרחיב את מגנום פורמן (FM). (ה)FM מורחב (ו) הסחוס הדק מעל מגנום המזחלת מוסר. השכבה periosteal של דורה מאטר הוא קלוף. הריבוע מציין את האזור המכיל נוירוני IO שטחיים. (ז)תמונה IO עם עדשת GRIN. סרגל קנה המידה ב- a = 5 מ"מ, חל על a-c. סרגל קנה המידה ב- d = 2 מ"מ, חל על d-e. סרגל קנה מידה ב- f = 2 מ"מ. סרגל קנה מידה ב- g = 2 מ"מ. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
6. דימות סידן
- מהדקים את חיישן SpO2 על הירך של העכבר כדי לנטר סימנים חיוניים כגון קצב לב, רוויית חמצן וקצב נשימה (איור 2b).
הערה: קצב הלב צריך להיות בין 500 לדקה עד 600 לדקה, רוויית החמצן צריכה להיות גבוהה מ -90%, וקצב הנשימה צריך להיות 50-70 נשימות לדקה10,11. - הר את הגשושית עדשת GRIN (קוטר 9 מ"מ. 1 מ"מ) על מוט ההשתלה.
הערה: יש לנקות את עדשת GRIN בעזרת רקמת ניקוי ספוגה באתנול 70% לפני ההדמיה לקבלת איכות הדמיה טובה. - תקן את מוט ההשתלה על המסגרת הסטראוטקסית והרכיב את המיקרוסקופ הזעיר על מוט ההשתלה.
הערה: הכנת המיקרוסקופ הזעיר להדמיה צריכה להסתיים בהתאם להנחיות המשתמש המתאימות למוצר. - הוסף כמה טיפות של מלוחים חמים באזור גזע המוח לטבילה של עדשת GRIN.
- התקרבו לגזע המוח בעזרת עדשת GRIN(איור 4d, 5g). הפעל את נורית ה-LED הכחולה (455 ± 8) במיקרוסקופ הזעיר. אתר את נוירוני ה- IO של GCaMP6s-transfected על-ידי ניטור תמונת הפלואורסצנטיות מהמיקרוסקופ הזעיר. חפש נוירוני קלט/פלט באזור בצורת מלבן ~ 0.5-1.7 מ"מ rostral האטלס הנותר ו ~ 0.6-1.1 מ"מ לרוחב לקו האמצע באזור השטחי של גזע המוח הגחוני (איור 5f).
הערה: כאשר מחפשים שדה תצוגה מתאים להדמיית קלט/יח, חפשו את המיקום שבו הקוטר הממוצע של סומטה תואם לזה של סומטה נוירון קלט/אי (כ-15 מיקרומטר12). האזורים הסמוכים להיווצרות רשתית מדולרית מורכבים מתאים גדולים משמעותית13,14. היזהר בעת הזזת עדשת GRIN אנכית, כמו לחיצה עליו על גזע המוח קשה מדי עלול להרוג את החיה.
7. המתת חסד של בעלי חיים בעקבות הליך
- בסוף הניסוי, המתת חסד לבעל החיים עם נקע בצוואר הרחם או שיטה אחרת שאושרה על ידי תקנת טיפול בבעלי חיים במעבדה מקומית.
- לצורך חקירה היסטולוגית נוספת, תחילה הרדמה את החיה עם תרופה להזרקה, כגון שילוב קטמין/קסילאזין (100 מ"ג/ק"ג ו-10 מ"ג/ק"ג, בהתאמה)15 לפני זלוף הלב עם הפתרון של רינגר ואחריו פתרון קיבעוני לתיקון המוח.
8. עיבוד נתונים
- עבד מראש את סרטון הדמיית הסידן המוקלט לפני ניתוח הנתונים.
הערה: תוכנת עיבוד הנתונים המסחרית המלווה במיקרוסקופ הזעיר שימשה לשלב זה ושלבי הפרוטוקול הבאים מתייחסים לכך. לחלופין, ניתן להשתמש בתוכנות קוד פתוח וחינמיות כגון CaImAn16, MINIPIPE17ו- MiniscoPy18 הן לעיבוד מראש והן לניתוח.- טען את וידאו דימות הסידן המוקלט בתוכנת עיבוד הנתונים.
- לחץ על לחצן קדם-עיבוד. הגדר אזור חיתוך שאינו כולל אזורים ללא נוירונים פלואורסצנטיים וחתוך את הווידאו כדי להקטין את גודל הקובץ לעיבוד מהיר יותר.
- לחץ על לחצן מסנן מרחבי. הגדר את החיתוך הנמוך ואת החיתוך הגבוה עבור מסנן מרחבי ל- 0.005פיקסלים -1ו- 0.5פיקסלים -1 בהתאמה. החל את המסנן המרחבי על כל מסגרת של הווידאו כדי להגדיל את הניגודיות ולהחליק את התמונה.
הערה: המסנן המרחבי הוא מסנן גאוסיאני. רכיבי תדר מרחבי נמוך שמקורם בתאים מחוץ למיקוד עלולים לבלבל את תיקון התנועה בשלב הבא. רכיב תדר מרחבי גבוה עלול לגרום לסרטון להיראות פחות חלק. - לחץ על לחצן תיקון תנועה. החל את תיקון התנועה על הווידאו באמצעות המסגרת הראשונה כמסגרת התייחסות כדי להפחית את החפצים הקשורים לתנועה הנגרמת על ידי זרימת הדם בגזע המוח.
הערה: תיקון התנועה משתמש בשיטת רישום תמונה שפותחה על ידי Thevenaz et al19. - יצא את הווידאו המתוקן בתנועה כתבנית TIFF.
- החל CNMF-E20 על וידאו מתוקן תנועה ב MATLAB כדי לזהות נוירונים בודדים, בעקבות ההוראות עבור קוד CNMF-E MATLAB במאגר המקוון21.
הערה: CNMF-E היא גישה מוגבלת של יצירת פקטוריזציה של מטריצה לא שלילית המותאמת אישית להדמיית פוטון אחד. ניתן לשנות קבצי Script של הדגמה במאגר ולהשתמש בהם לעיבוד נתונים.
תוצאות
כאן אנו מציגים הקלטה מייצגת שהושגה עם השיטה כמתואר. איור 6a מציג את המיקום של תאי IO בעלי תווית בהירה שהמחישו במהלך הניסוי. הפסים האלכסוניים הכהים הם כלי דם. שים לב לבהירות המשתנה של תאים בודדים, הנובעת מיעילות transfection משתנה. בחלונית איור 6b אנו מציגים את עקבות עוצמת הפלואורסצנטיות המנורמלת הממוצעת (deltaF/F) המתקבלות מהסומאטה המצוינת בצבעים ובמספרים בחלונית a. הסטות כלפי מעלה מייצגות עליות חולפות בסידן תאי. שים לב כיצד רמה שונה של ביטוי GCaMP6s (המשתקף בבהירות התא בחלונית a) מובילה ליחסי אות לרעש (SNR) משתנים.
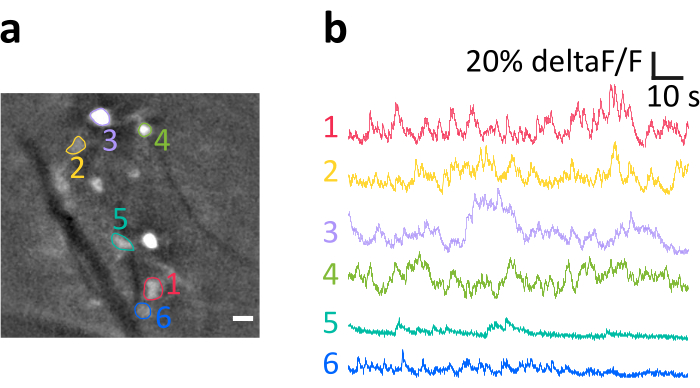
איור 6: הקלטה לדוגמה של פעילות של תאי עצב מסוג IO בעכבר מורדם. (א) מסגרת דוגמה מייצגת מהקלטה לאחר סינון מרחבי. נקודות אור הן סומאטה עצבית IO, כמה מהם צוינו כאזורי אינטרסים (ROIs, מספרים צבעוניים). פסים כהים הם כלי דם. (ב)עקבות דלתאF/F לדוגמה שהתקבלו מה- ROIs שצוינו בחלונית a. הסטות כלפי מעלה משקפות עליות באות הסידן. סרגל קנה מידה ב- a = 10 מיקרומטר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
כמו ההליך הכירורגי כרוך פעולות שבוצעו באזור הגרון עם מבנים קריטיים חיוניים רבים (עורקים, עצבים), זה חיוני כי הוא מנוהל על ידי חוקר עם מיומנויות כירורגיות ברמה גבוהה. באופן הבא, אנו מדגישים ומעירים על מספר נקודות מפתח של ההליך; עם זאת, יש להזכיר כי שום כמות של עצה בכתב לא יכולה להחליף את החוויה, המיומנות והאינטואיציה של החוקר.
הצעד הקריטי ביותר בניתוח הוא קנה הנשימה. זה כרוך בחיתוך קנה הנשימה, החלפת isoflurane מן חרוט האף לצינור אינטובציה, הבטחת קנה הנשימה לעור החזה ותיקון קנה הנשימה ואת צינור אינטובציה יחד. כל הפעולות הללו חייבות להסתיים בצורה חלקה ומהירה כדי למנוע תאונות, כגון הרדמה לקויה, זרימת נוזלים לקנה הנשימה או החלקה של צינור אינטובציה. יש לזכור את הפרוטוקול לפני חיתוך קנה הנשימה.
דימום הוא אחד הגורמים העיקריים למוות של בעלי חיים בניתוח זה. מאז אזור הצוואר הוא צפוף עם כלי הדם, לחתוך צריך להתבצע רק כאשר קו הראייה ברור, כדי למנוע חיתוך ורידים ועורקים בלתי נראים. לכן, יש להסיר שרירים ורקמות חיבור המטשטשים את הראייה, ויש לנקות דם מנחמים שבורים לפני שמתקדמים.
בעלי חיים יכולים להישמר בחיים במשך זמן רב (יותר מ 8 שעות) מתחילת הניתוח. עם זאת, חשוב לסיים את ההליך הכירורגי במהירות ולכן יש יותר זמן לבחון נוירונים גזע המוח כאשר מצבם הפיזיולוגי של בעלי החיים הוא טוב. חוקר מיומן יכול לסיים את כל ההליך ב 70 דקות.
בעוד השיטה מספקת תצוגה נקייה של משטחי המוח הגחוני, למרבה הצער זה בלתי אפשרי לעשות זאת מבלי לבצע tracheotomy, כמו גם הסרת כמות משמעותית של רקמה באזור הגרון. לכן, לא ניתן לאפשר לחיה להתעורר מהרדמה. יתר על כן, למרות שניתן לשמור על החיה בחיים במשך שעות רבות עם התאמה זהירה של אספקת הרדמה, שמירה על טמפרטורת הגוף לחות, זה בלתי נמנע כי ניסויים ממושכים יוביל בסופו של דבר להיחלשות מצב החיה. נותר למומחיותו של החוקר לשקול את משך הזמן המקסימלי של הקלטות יציבות.
מגבלה אפשרית נוספת של השיטה כמתואר כאן היא כי כמו עדשת GRIN אינו מוכנס לתוך parenchyma המוח, רק נוירונים שטחיים יחסית (~ 150-200 מיקרומטר) ניתן לבדוק. בעוד השתלה כירורגית של עדשת GRIN אפשרית מבחינה טכנית, שיטת ניתוח חריפה אינה מאפשרת מספיק זמן לנוירונים להתאושש מלחץ חמצוני ונוכחות של דם לאחר ההשתלה סביר להניח לפגוע באיכות התמונה מעבר מקובל.
למרות החששות לעיל, אנו מאמינים שזו הפעם הראשונה שיטה להדמיה in vivo של נוירונים IO מוצג. זה מאפשר בדיקה של פעילות spatiotemporal בתאי העצב IO בהקשר vivo בנוכחות כניסות afferent שלם ממערכות חושיות, כמו גם את האותות מן הגרעינים המוח הקטן ואת צומת mesodiencephalic22, הישג שלא היה אפשרי עד כה. בשיטה זו, הפונקציה של IO עכשיו ניתן לחקור לעומק יותר עם שילוב של גירוי חושי ואופטוגנטי. יש לציין כי עם האבולוציה של הדמיית מתח (כגון השיטה האחרונה שלנו להדמיית מתח ב- IO 23), אנו מקווים שהשיטה הכירורגית המוצגת תעורר חוקרים רבים לקחת על האתגר של חקירת האופן שבו ה- IO תורם ליצירת קוצים מורכבים במוח הקטן.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים לאנדרו סקוט ממרכז המדיה של OIST על עזרתו בהקלטת וידאו ועריכה. כמו כן, אנו מודים להוגו הודמייקר על עזרתו בפיתוח הניתוח לחשיפת גזע המוח וד"ר קווין דורגנס על עזרתו בשרטוט דיאגרמות לדמויות. בנוסף, תודה רבה לסלבטורה לאקאבה על קריינות הקריינות שלו, כמו גם לכל חברי nRIM וחיות המחמד על התמיכה המתמשכת ברווחה בזמנים הקשים של COVID-19.
Materials
| Name | Company | Catalog Number | Comments |
| AAV.CAG.GCaMP6s.WPRE.SV40 | Addgene, USA | 100844-AAV9 | |
| Absorbable suture with 6 mm half circle needle | Natume, Japan | L6-60N2 | hook needle with thread |
| Absorption triangles | FST, Germany | 18105-03 | Surgical sponges |
| Stereo microscopes | Leica, Germany | M50 | |
| Castroviejo curved tip needle holder with lock | FST, Germany | 12061-01 | Surgery tool |
| cotton swabs | Sanyo, Japan | HUBY-340 | |
| Delicate suture tying forceps | FST, Germany | 11063-07 | Surgery tool |
| Delicate Suture Tying Forceps | FST, Germany | 11063-07 | Surgery tool |
| Dumont #5/45 forceps | FST, Germany | 11251-35 | Surgery tool |
| Fine Iris scissors | FST, Germany | 14060-09 | Surgery tool |
| Friedman-Pearson rongeur curved tip | FST, Germany | 16221-14 | Surgery tool |
| Gelfoam absorbable gelatin sponge | Pfizer, USA | 0315-08 | Hemostatic gelatin sponge |
| Glass-Capillary Nanoinjection | Neurostar, Germany | n/a | For virus vector injection |
| Graefe Forceps with serrated tip | FST, Germany | 11052-10 | Surgery tool |
| Implantation rod | Inscopix, USA | n/a | It is part of the nVoke2 system. It's designed to nVoke2 miniature microscpe and GRIN lens can be mounted on it |
| IsoFlo | Zoetis, UK | n/a | Isoflurane |
| KETALAR FOR INTRAMUSCULAR INJECTION | Daiichi Sankyo, Japan | n/a | Ketamine |
| Kimwipes | Kimberly-Clark, USA | Cleaning tissue | |
| Laser-Based Micropipette Puller | Sutter Instrument, USA | P-2000 | |
| Micropipette Beveler | Sutter Instrument, USA | BV-10 | |
| Motorized Stereotaxic based on Kopf, Model 900 | Neurostar, Germany | n/a | Stereotaxic frame |
| mouseOxPlus with rectal temperature sensor and thigh clamp pulse oximeter | Starr Life Sciences, PA, USA | MouseOxPlus | Measures animal heart rate, arterial oxygen saturation (SpO2), breath rate, and temperature |
| nVoke2 integrarted Calcium imaging micro camera system | Inscopix, USA | 1000-003026 | Miniature microscope |
| Ohaus Compact Scales | Ohaus, USA | CS 200 | Scale used to weight animal |
| Otsuka Normal Saline | Otsuka Pharmaceutical Factory, Japan | n/a | |
| Physiological-biological temperature controller system | SuperTech Instruments, Hungary | TMP-5b | Thermal pad for mouse |
| ProView Lens Probe 1.0 mm diameter, 9.0 mm length | Inscopix, USA | 1050-002214 | Gradient-refractive index (GRIN) lens |
| Q114-53-10NP glass capillaries | Sutter Instrument, USA | 112017 | Customized quartz glass capillaries |
| Safety IV Catheter 20G | B. Braun, Germany | 4251652-03 | 20 gauage catheter used to prepare intubation tube |
| Sand paper | ESCO, Japan | EA366MC | Used to polish the tip of 25G needle to prepare curved and blunt needle |
| Scalpel blade | Muromachi Kikai, Japan | 10010-00 | Used to cut the tip of quartz glass pipette |
| SomnoSuite low flow inhalation anesthesia system | Kent Scientific, USA | SOMNO | Provides precise control of isoflurane flow |
| Surgic XT Plus drill | NSK | Y1002774 | For virus vector injection |
| Syringe 1 ml | Terumo, Japan | SS-01T | |
| Syringe needle 25G | Top, Japan | 00819 | Used to make blunt and bended needle |
| Syringe needle 26G | Terumo, Japan | NN-2613S | |
| Thrive 2100 Professional Trimmer | Thrive, Japan | n/a | Shaver |
| Vannas-Tübingen spring scissors | FST, Germany | 15004-08 | Surgery tool |
| Vaseline | Hayashi Pure Chemical, Japan | 22000255 | |
| Veet sensitive skin | Veet, Canada | n/a | Hair removal cream |
| Xylocaine Jelly 2 % 30ml | Aspen Japan, Japan | 871214 |
References
- Russell, J. T. Imaging calcium signals in vivo: A powerful tool in physiology and pharmacology. British Journal of Pharmacology. , (2011).
- Zhang, T., et al. Kilohertz two-photon brain imaging in awake mice. Nature Methods. , (2019).
- Lin, X., Zhao, T., Xiong, W., Wen, S., Jin, X., Xu, X. M. Imaging neural activity in the primary somatosensory cortex using Thy1-GCaMP6s transgenic mice. Journal of Visualized Experiments. 2019 (143), 1-8 (2019).
- Lee, H. S., Han, J. H. Successful In vivo Calcium Imaging with a Head-Mount Miniaturized Microscope in the Amygdala of Freely Behaving Mouse. Journal of visualized experiments. (162), 1-19 (2020).
- Aharoni, D., Khakh, B. S., Silva, A. J., Golshani, P. All the light that we can see: a new era in miniaturized microscopy. Nature Methods. 16 (1), 11-13 (2019).
- Khosrovani, S., Van Der Giessen, R. S., De Zeeuw, C. I., De Jeu, M. T. G. In vivo mouse inferior olive neurons exhibit heterogeneous subthreshold oscillations and spiking patterns. Proceedings of the National Academy of Sciences. 104 (40), 15911-15916 (2007).
- Osten, P., Cetin, A., Komai, S., Eliava, M., Seeburg, P. H. Stereotaxic gene delivery in the rodent brain. Nature Protocols. 1 (6), 3166-3173 (2007).
- Berg, L., Gerdey, J., Masseck, O. A. Optogenetic Manipulation of Neuronal Activity to Modulate Behavior in Freely Moving Mice. Journal of visualized experiments : JoVE. , e61023 (2020).
- Green, C. J., Knight, J., Precious, S., Simpkin, S. Ketamine alone and combined with diazepam or xylazine in laboratory animals: A 10 year experience. Laboratory Animals. 15 (2), 163-170 (1981).
- Tsukamoto, A., Serizawa, K., Sato, R., Yamazaki, J., Inomata, T. Vital signs monitoring during injectable andn inhalant anesthesia in mice. Experimental Animals. 64 (1), 57-64 (2015).
- Ewald, A. J., Werb, Z., Egeblad, M. Monitoring of vital signs for long-term survival of mice under anesthesia. Cold Spring Harbor Protocols. 6 (2), 174-178 (2011).
- Vrieler, N., et al. Variability and directionality of inferior olive neuron dendrites revealed by detailed 3D characterization of an extensive morphological library. Brain Structure and Function. , 1677-1695 (2019).
- Esposito, M. S., Capelli, P., Arber, S. Brainstem nucleus MdV mediates skilled forelimb motor tasks. Nature. , (2014).
- Martin, E. M., Devidze, N., Shelley, D. N., Westberg, L., Fontaine, C., Pfaff, D. W. Molecular and neuroanatomical characterization of single neurons in the mouse medullary gigantocellular reticular nucleus. Journal of Comparative Neurology. , (2011).
- Cold Spring Harbor. Ketamine/Xylazine. Cold Spring Harbor Protocols. 2006 (1), (2006).
- Giovannucci, A., et al. CaImAn an open source tool for scalable calcium imaging data analysis. eLife. 8, 1-45 (2019).
- Lu, J., et al. MIN1PIPE: A Miniscope 1-Photon-Based Calcium Imaging Signal Extraction Pipeline. Cell Reports. 23 (12), 3673-3684 (2018).
- . GitHub - PeyracheLab/miniscoPy: A package to analyse calcium imaging data recorded with the Miniscope Available from: https://github.com/PeyracheLab/miniscoPy (2020)
- Thévenaz, P., Ruttimann, U. E., Unser, M. A pyramid approach to subpixel registration based on intensity. IEEE Transactions on Image Processing. , (1998).
- Zhou, P., et al. Efficient and accurate extraction of in vivo calcium signals from microendoscopic video data. eLife. 7, 1-37 (2018).
- . GitHub - zhoupc/CNMF_E: Constrained Nonnegative Matrix Factorization for microEndoscopic data Available from: https://github.com/zhoupc/CNMF_E (2020)
- De Gruijl, J. R., Bosman, L. W. J., De Zeeuw, C. I., De Jeu, M. T. G. Inferior olive: All ins and outs. Handbook of the Cerebellum and Cerebellar Disorders. , (2013).
- Dorgans, K., Kuhn, B., Uusisaari, M. Y. Imaging Subthreshold Voltage Oscillation With Cellular Resolution in the Inferior Olive in vitro. Frontiers in Cellular Neuroscience. , (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved