Method Article
斑马鱼非酒精性脂肪肝相关肝细胞癌早期进展期间的肝脏微环境分析
摘要
在这里,我们介绍了如何生成非酒精性脂肪性肝病(NAFLD)相关的肝细胞癌(HCC)斑马鱼模型,以研究胆固醇过剩对肝脏微环境和免疫细胞景观的影响。
摘要
肝癌目前是全球癌症相关死亡的第三大原因,肝细胞癌(HCC)占所有肝癌病例的75-90%。随着预防和治疗乙型肝炎的有效治疗方法的引入,非酒精性脂肪性肝病(NAFLD)以及被称为非酒精性脂肪性肝炎(NASH)的更具侵略性的形式正迅速成为现代社会中发生HCC的头号危险因素。为了更好地了解NASH在HCC发展中的作用,我们设计了一种NASH相关的HCC斑马鱼。斑马鱼幼虫的光学清晰度和遗传可追踪性使其成为使用非侵入性荧光活成像研究肝脏微环境和免疫细胞组成的有吸引力且强大的模型。该协议描述了如何使用NASH相关的HCC斑马鱼模型来研究肝脏微环境中胆固醇过剩的影响及其对疾病早期免疫细胞组成的影响。首先,我们用10%的高胆固醇饮食喂养表达肝细胞特异性活化β-连环蛋白的HCC幼虫(s704Tg)8天,以开发NASH相关的HCC模型。在这里,我们描述了如何利用不同的转基因系通过非侵入性共聚焦显微镜评估肝脏中的几种早期恶性肿瘤特征,例如肝脏区域,细胞和核形态(肝细胞区域,核区域,核:细胞质比(N:C比率),核循环性,微核/核突出评分)和血管生成。然后,使用带有标记免疫细胞(中性粒细胞,巨噬细胞和T细胞)的转基因系,我们展示了如何分析NASH相关HCC幼虫中的肝脏免疫细胞组成。所描述的技术可用于评估早期肝癌发生阶段的肝脏微环境和免疫细胞组成,但也可以对其进行修改以研究其他肝病模型中的这些特征。
引言
肝细胞癌(HCC)是一种侵袭性癌症,治疗选择有限。已经发现,超过30%的HCC患者肥胖并患有NASH,NASH是NAFLD的一种侵袭性形式1,2,3,4。摄入富含卡路里的饮食会大大增加脂肪酸的可用性,从而导致局部和全身代谢变化并引发脂肪变性、肝细胞损伤、炎症和纤维化——这些都是 NASH 的关键特征。NASH进展为HCC涉及肝脏中脂质的积累,从而引发炎症并改变免疫细胞组成5,6,7。了解肝脏微环境和免疫细胞景观在肝病进展过程中如何改变,以及它如何由于某些病因因素而变化,具有特别的兴趣和重要性。为了更好地确定胆固醇过剩对肝脏微环境和免疫细胞景观的影响,我们开发了一种独特的NASH相关HCC斑马鱼模型。该模型的使用使我们更好地了解饮食和营养过剩对肝脏微环境和肝病进展的影响。
哺乳动物模型,如小鼠和人体组织样本,对于理解脂肪性肝炎和脂肪变性的发病机制至关重要8。小鼠是肝病和癌症的首选模型,但它们在细胞水平上缺乏光学清晰度,而人体组织样本通常缺乏动物模型能够模仿的3D环境。这些障碍使斑马鱼成为研究界的强大模型。斑马鱼与人类有着显着的相似之处,至少有70%的基因保护。它们维持肝脏微环境、肝细胞组成、功能、信号传导和对损伤的反应9,10。使用高胆固醇饮食(HCD)结合已建立的HCC转基因斑马鱼模型,我们开发了NASH相关HCC的斑马鱼模型。
在这里,我们提出了一个协议,解释了如何生成与NASH相关的HCC斑马鱼模型,以及如何研究肝脏微环境并解决体内早期恶性肿瘤特征。使用非侵入性共聚焦显微镜与具有荧光标记肝细胞膜和细胞核的斑马鱼转基因系相结合,我们可以通过分析肝脏形态(面积、体积和表面积)、细胞和核形态(肝细胞面积、核面积、N:C 比、核循环度、微核/核疝评分)和血管生成(血管密度)来解决早期恶性肿瘤特征。免疫细胞微环境也是肝癌发生的重要特征11,12,13,14,因此,我们还展示了如何使用具有标记免疫细胞(中性粒细胞,巨噬细胞和T细胞)的转基因斑马鱼系分析NASH相关HCC幼虫中的肝脏免疫细胞组成。所描述的技术是该模型独有的,对于评估肝病进展中的肝脏微环境和免疫细胞组成非常有用。
研究方案
动物研究按照阿尔伯特·爱因斯坦医学院机构动物护理和使用委员会(IACUC)批准的程序进行。有关方案中使用的缓冲液和溶液的配方,请参阅 补充表1。
1.准备10%富含胆固醇的饮食,以应对急性胆固醇过剩。
- 在两个 25 mL 玻璃烧杯中称取 2 x 4 g 金珍珠饮食 5-50 nm 活性球体 (GPAS),一个用于正常饮食 (ND),另一个用于 10% 高胆固醇饮食 (HCD)。
注意:可以使用斑马鱼幼虫的任何商业干粮饮食。 - 在 10 mL 玻璃烧杯中称取 0.4 g 胆固醇。用一些箔纸盖住烧杯。
- 使用带有 20 G 针头的 10 mL 注射器测量 5 mL 乙醚。接下来,将乙醚加入ND烧杯中,并立即用刮刀将其与干粮混合。
注意:乙醚会引起眼睛、皮肤和呼吸道刺激。仅在化学通风橱中使用。 - 使用带有20 G针头的10 mL注射器再次测量5 mL乙醚,并将其加入装有胆固醇的10 mL烧杯中,立即用注射器上下吸出混合。
- 快速将胆固醇溶液添加到HCD烧杯中,并立即用刮刀混合,直到溶液均匀。
- 将烧杯留在引擎盖中长达24小时以完全蒸发乙醚。第二天,用研杵和研钵将GPAS饮食磨成细颗粒。
注意:研磨日粮是至关重要的一步,幼虫将无法吃大于 50 nm 的颗粒。 - 将每种日粮转移到一个小的标记塑料袋或50mL离心管中,并储存在-20°C。
2. NASH诱导,短期幼虫喂养富含胆固醇的饮食 - 静态条件。
- 在第-1天建立转基因鱼系(表1)。第二天早上(第0天),鱼产卵后,将卵收集在网状过滤器中。
- 使用装有胚胎水(E3)的洗涤瓶彻底冲洗鸡蛋,并小心地将鸡蛋转移到带有E3培养基的10厘米培养皿中。
- 清洁盘子中可能积聚在繁殖箱中的所有碎屑,包括任何死亡或未受精的卵。
注意:冲洗卵和清洁盘子对于避免微生物不受控制的生长和随之而来的幼虫发育缺陷至关重要。 - 每 10 厘米培养皿(在 25 mL 的 E3 中)以 70/80 的密度将鸡蛋分开。在第1天,在配备透照基座的解剖镜下,检查并清洁死胚胎或有发育缺陷的胚胎。
注意:使用透照基底暗场模式来识别具有发育效果的胚胎,并检查平板中微生物的生长。不同的设施在其系统中具有不同的微生物产量。如有必要,更换E3培养基和/或培养皿,以避免负面影响。 - 在第5天,将所有培养皿中的幼虫混合在15厘米的培养皿中,加入不含亚甲蓝的E3。接下来,按如下方式在喂食箱中划分幼虫(表2)。
注意:在对照条件下,为了在不引发全身性慢性炎症的情况下产生健康的幼虫,幼虫每天应喂食约0.1毫克的食物。请注意,食物总量(表2)平均分为每天两次喂食。 - 将幼虫保持在28°C的培养箱中,在暗光循环(例如,14小时光照/ 10小时黑暗循环)中,并从第5天到第12天每天两次喂食幼虫。
- 每天吸出任何食物残渣,以及使用连接到 1 mL 移液器吸头的真空系统培养基的 90-95%。接下来小心地将不含亚甲蓝的新E3倒入喂食箱的一角,以免损坏幼虫。
注意:每天清洁喂食箱对于避免微生物不受控制的生长至关重要。
3.从饲养箱中收集受精后13天的幼虫。
- 在第13天,根据设置的实验条件数量准备收集盘。用永久性记号笔在培养皿的侧面(盖子和底部)做一个标记,以避免更换样品,例如一条黑色条纹用于正常饮食 (ND),两条黑色条纹用于 HCD。
- 倒入足够的不含亚甲蓝的E3,以覆盖每个盘子的底部。小心地使用真空系统从喂食箱中吸出水,尝试从底部吸出任何碎屑或死幼虫,以避免将这些材料转移到收集盘中。
- 当水位开始变低时,慢慢抬起喂食箱,使幼虫游到其中一个角落,然后向相反的方向吸气。
注意:使用带切割尖端的 1 mL 移液器,在不同的高度,以便在吸水时允许不同的直径。在不同的尺寸之间交替,从较大的直径开始,随着水量的减少和幼虫密度的增加而变为较小的直径。 - 一旦只有大约 20-30 mL 的液体,小心地将幼虫倒入步骤 1 中制备的收集培养皿中。将喂食盒中的贴有标签的胶带放在培养皿的盖子上。
- 对所有进纸箱重复步骤3.2-3.4。
4. 饮食诱发肝脂肪变性的对照测定 - 油红 O (ORO) 染色、成像和评分。
- 使用玻璃巴斯德移液管,将15-20幼虫转移到2mL圆底管中,并置于冰上约15-30分钟。从管中取出大部分介质。
- 加入2mL的4%多聚甲醛(PFA)固定幼虫并在4°C孵育过夜。
- 第二天早上,取出 4% PFA 溶液,用 2 mL 的 1x PBS 洗涤幼虫 3 次。
- 每个条件准备一个12孔板(图2A),带有一个网格孔插入物。
- 使用玻璃移液管,将幼虫从 2 mL 管转移到先前放置在孔中的插入物中,加入 5 mL 的 1x PBS。染色后保存 2 mL 管以储存样品。
注意:幼虫在这个阶段非常粘,不要使用塑料移液器。 - 将带有幼虫的插入物转移到另一个装有 5 mL 60% 异丙醇溶液的孔中。孵育幼虫30分钟室温(RT)。
- 同时,在60%异丙醇溶液中制备0.3%油红O。使用0.45μm注射器过滤器过滤0.3%油红溶液两次。
注意:通过将 3 mL 0.5% 油红 O 在异丙醇中与 2 mL 蒸馏水混合,每孔制备 5 mL 溶液。60%异丙醇溶液中的0.3%油红O需要新鲜制备。 - 接下来,将带有幼虫的网状插入物转移到另一个孔中,其中 5 mL 在 60% 异丙醇溶液中加入 5 mL 新鲜制作的 0.3% 油红 O。将幼虫在室温下孵育3小时,轻轻摇动。
- ORO染色后,通过将插入物转移到另一个含有60%异丙醇的孔中来冲洗幼虫。在60%异丙醇中洗涤幼虫两次,每次30分钟,将插入物依次转移到含有60%异丙醇的孔中。
- 通过依次将插入物转移到具有1x PBS-0.1%吐温的孔中,在1x PBS-0.1%吐温中洗涤幼虫3次5分钟。
- 将幼虫转移到 2 mL 管中。取出PBST,加入1mL的80%甘油,并储存在4°C直至成像。
- 为了获得更好的成像,将幼虫转移到 1x PBS-0.1% 吐温,并在解剖镜下使用两个 #55 镊子小心地拉动组织来解剖肝脏。
注意:如果使用Casper背景成像,可以使用整个幼虫进行。 - 使用玻璃移液管,小心地将肝脏转移到含有50%甘油的瓷点板的孔中。使用小工具放置肝脏以操纵幼虫(例如,睫毛工具 - 图2B)。在配备彩色相机的体视显微镜中对肝脏进行成像。
- 评分肝脂肪变性(无 ORO 染色 = 无;浅红色 ORO 染色 = 轻度;红-深红色 ORO 染色 = 中度/重度)。
5. 使用斑马鱼损伤和卡住装置进行生长和成像(zWEDGI)的非侵入性共聚焦成像。
- 准备一个 10 厘米的培养皿,加入 15-20 mL 的 1x Tricaine-E3,刚好足以覆盖底部。
注意:通过将 2 mL 的 25x 三卡因储备溶液 (4 mg/mL) 稀释在 48 mL 的 E3 中,可以获得 1x 三卡因-E3 工作溶液 (0.16 mg/mL)。三卡因浓度不得超过0.16 mg/mL,因为幼虫在此发育阶段对麻醉极为敏感。 - 用塑料巴斯德移液管将15-20幼虫转移到含有1x Tricaine-E3的培养皿中,并麻醉幼虫5分钟。
- 准备一个 6 孔板,每孔含有 2-3 mL 不含亚甲蓝的 E3。
- 在荧光体视显微镜上,筛选麻醉幼虫以获得所需的荧光标记物(表1)。在E3中以最少量的Tricaine转移筛选的幼虫,并让它们在6孔板中恢复,直到需要成像为止。
注意:筛选双、三和四重转基因幼虫需要时间,将幼虫置于 E3 中并经常更换 6 孔板的培养基,以减少不必要的三卡因暴露。此外,幼虫在这个发育阶段会漂浮,因此使用睫毛工具定位幼虫进行筛查,而不会引起组织损伤。 - 筛选后,用 25 mL 的 1x Tricaine-E3 准备一个 10 cm 培养皿。用塑料巴斯德移液管将15-20只幼虫转移到含有1x Tricaine-E3的培养皿中,并麻醉幼虫5分钟。
- 同时,在体视显微镜下将1x Tricaine-E3加入到伤和卡压装置(例如zWEDGI)的腔室中15,16。使用 P200 微量移液器从腔室和约束通道中去除气泡。去除所有多余的 1x 三卡因-E3,只留下足够的体积来填充腔室。
- 将麻醉的幼虫转移到zWEDGI的加载室中,并在体视显微镜下使用睫毛工具将其定位。轻轻地,轻拍幼虫的头部并推动它,使尾巴进入约束隧道。此外,使用微量移液器从伤室中取出1x Tricaine-E3以帮助幼虫进入隧道。确保幼虫的位置正确以进行左叶成像 - 倒置显微镜:左侧朝下;正置显微镜:左侧朝上。
注意:如果没有zWEDGI,可以将鱼安装在1x Tricaine-E3中的1%低熔点琼脂糖中,但是,琼脂糖浸泡可用于快速成像(最多15分钟)。 - 对于肝细胞和核形态分析,使用40倍空气物镜和2μm光学切片的z堆栈使用共聚焦显微镜对肝脏进行成像。对于肝脏形态学、血管生成和免疫细胞募集测定,使用 20 倍空气物镜和 5 μm 光学切片的 z 堆栈对肝脏进行成像。对于肝脏较大的幼虫,应拍摄2 x 2的切片图像,以确保所有肝脏和周围区域的成像为75μm。
- 成像后,使用带有1x Tricaine-E3的塑料巴斯德移液管将幼虫从约束隧道中拉出,并转移到不含亚甲蓝的E3培养皿中。
6.肝脏形态变异分析。
注意:下面列出的步骤用于肝脏表面积和体积定量:
- 打开成像软件。将包含要分析的图像文件的文件夹添加到 竞技场 ,选择 观察文件夹 图标。接下来,通过右键单击缩略图选择 转换为本机 Imaris 文件格式 以将文件转换为格式 (.ims)。
- 在"超越"子菜单上,调整每个通道的亮度和对比度。接下来,从肝脏创建一个表面,单击蓝色的 添加新表面 按钮。
- 接下来,在表面创建面板上选择 仅分割感兴趣区域 以手动创建肝脏表面。
- 单击 跳过自动创建|手动编辑 选项。选择 轮廓 并在场景面板上取消选择"音量"选项。
注意:体积视图选项需要取消选择,否则将无法选择不同 z 堆栈中的感兴趣区域。 - 在 z 堆栈中导航并通过选择模式在每个平面中绘制感兴趣区域,选择您喜欢的绘制 模式。要开始绘制,请将指针更改为 选择 模式而不是 导航模式,然后单击"绘制"并开始将指针拖过肝脏以 绘制 ROI。
- 在不同的焦平面中选择ROI后,选择"创建表面"以合并所有选定的ROI并 创建肝脏表面 。
- 接下来,使用新创建的表面创建肝细胞信号的掩码。单击表面,然后在 "编辑 "选项卡(铅笔)下选择" 全部遮罩"。在出现的窗口中,选择要遮罩的通道,该通道将用于量化肝脏体积和表面积。然后,选择将表面外的体素设置为 0 并勾选 复制通道 在应用蒙版之前的选项。
- 使用统计分析菜单中的肝脏表面积和肝脏体积值进行分析。
注意:执行以下步骤进行肝脏面积定量。
- 打开斐济软件。在插件菜单上,选择生物格式,然后选择生物格式导入器,勾选拆分通道选项以打开图像文件。
- 在"图像"菜单上,选择" 属性 "以检查图像是否具有正确的像素大小和体素深度(如果值不正确)。接下来,转到图像 菜单,单击调整,然后单击亮度和 对比度,调整 图像亮度 和对比度。
- 接下来,使用肝细胞通道创建肝脏的最大强度投影。转到图像 菜单,单击 堆栈 ,然后单击Z 项目。选择 最大强度投影。
- 使用手绘选择工具,手动创建幼虫肝脏周围的感兴趣区域(ROI)。接下来,在"分析"菜单上单击"测量"以获取肝脏区域。将结果另存为电子表格以供进一步分析。
7.肝细胞和核形态分析。
- 打开斐济软件。在插件菜单上,选择生物格式,然后选择生物格式导入器勾选拆分通道选项以打开图像文件。
- 在"图像"菜单上,选择" 属性 "以检查图像是否具有正确的像素大小和体素深度(如果值不正确)。接下来,转到图像菜单,单击调整,然后单击亮度和 对比度,调整 图像亮度 和对比度。
- 在"分析"菜单中,选择要分析的所有参数(例如,面积、周长和形状描述符)上的"设置度量"勾号。选择肝细胞膜荧光通道。浏览 Z,使用徒手选择工具围绕一个肝细胞绘制完美的投资回报率。接下来,在"分析"菜单上单击"测量"以计算肝细胞面积。
- 对15-30个肝细胞重复步骤7.3。将结果另存为电子表格以供进一步分析。
- 接下来,选择细胞核荧光通道。浏览 Z,使用徒手选择工具在肝细胞核周围绘制完美的投资回报率。接下来,在 分析 菜单上单击 测量以计算 核面积和圆度。
- 对15-30个肝细胞重复步骤7.5。将结果保存为电子表格以供进一步分析,包括核:细胞质比的定量。
- 对样本是否存在微核和脑疝进行评分如下(表3)。
8.血管生成分析。
- 按照本协议第6节所述手动创建肝脏表面。将此表面命名为"肝表面"。
- 为肝脏内的内皮细胞信号创建一个掩模。单击表面,然后在编辑选项卡(铅笔)下选择 "全部遮罩"。在出现的窗口中,选择内皮细胞通道以仅从肝脏中分离血管信号。选择将表面外的体素设置为 0 并在应用蒙版之前勾选复制 通道 选项。
- 将新的内皮细胞掩蔽通道重命名为 肝脉管系统。
- 要测量容器体积和表面积,请创建第二个表面。单击蓝色的 添加新曲面 按钮。在曲面创建的第一步中,确保取消选择所有选项以自动创建曲面。
- 在第二步中,选择肝脉管系统通道以创建表面。取消选择平滑选项以检测尽可能多的船只细节,并在阈值选项中启用背景减法。
- 调整阈值,确保检测到的表面与肝血管信号共定位。使用统计分析菜单中的表面积和体积值。使用以下公式计算容器密度指数:
血管密度指数(按肝脏μm 2)=(血管表面积(μm 2))/(肝脏表面积(μm2))
血管密度指数(肝脏μm 3)=(血管体积(μm 3))/(肝脏体积(μm3))
9.免疫细胞募集分析。
- 打开斐济软件。在插件菜单上,选择生物格式,然后选择生物格式导入器勾选拆分通道选项以打开图像文件。
- 在"图像"菜单上,选择"属性"以检查图像是否具有正确的像素大小和体素深度(如果值不正确)。接下来,转到图像菜单,单击调整,然后单击亮度和对比度,调整图像亮度和对比度(例如,巨噬细胞 - mCherry 或 dTomato; 中性粒细胞 - BFP;T细胞 - EGFP;肝细胞 - EGFP或mCherry)。
- 接下来,为每个通道创建最大强度投影。
- 如第6节(步骤6.9-6.12)所述,在幼虫肝脏周围创建ROI并测量肝脏面积。创建第二个ROI,包括肝脏区域和75μm周围区域("招募区域")。
- 接下来,在 编辑 菜单上选择 选择 选项,然后选择 添加到管理器。选择先天免疫细胞通道最大强度投影,从ROI管理器窗口中单击肝脏ROI以设置 募集区域。
- 在插件菜单上,选择分析选项,然后选择细胞计数器并计数募集区域内的免疫细胞。在电子表格上记录招募到肝脏区域的免疫细胞数量。
- 通过标准化每个肝脏区域的免疫细胞数量来计算中性粒细胞、巨噬细胞和 T 细胞密度。
结果
通过将短期高胆固醇饮食引入肝细胞癌(HCC)斑马鱼模型中,该模型过度表达肝细胞特异性组成活性形式的β-连环蛋白(s704Tg;Tg(fabp10a:pt-B-cat, cryaa:Venus)17,我们能够创建NASH相关HCC的非哺乳动物脊椎动物模型。通过测量肝脂肪变性、肝脏大小、肝细胞、核形态、血管生成和免疫细胞浸润,可早期监测肝病进展(图 1)。
以正常饮食喂养的HCC幼虫显示无至轻度肝脂肪变性,通过油红O染色测量。然而,以高胆固醇饮食喂养的HCC幼虫显示出肝脂肪变性的显着增加(图2)。
肝病的一个众所周知的标志物是肝肿大17。为了评估肝脏大小,HCC幼虫可以与在肝细胞上特异性表达荧光标记物的转基因系杂交,例如Tg(fabp10a:H2BmCherry)。为了评估肝肿大,需要评估肝脏面积(2D),肝表面积和肝体积(3D)。暴露于胆固醇过剩8天后,在HCC幼虫中观察到肝脏肿大(图3)。
使用非侵入性实时成像,在肝细胞膜(如Tg(fabp10a:Life-actin-EGFPP)和肝细胞核(如Tg(Fabp10a:H2B-mCherry)中表达荧光蛋白的转基因鱼系可用于评估与肝细胞恶性肿瘤相关的细胞和核形态改变。NASH相关HCC(图4A,B,D)以及核面积(图4C,E)和核:细胞质比(图4F)的肝细胞面积增加。在HCD + HCC组中也观察到核循环性显着降低(图4G)。脂毒性触发DNA损伤,这是微核存在时致癌的一个特征。使用H2B-mCerry标记,我们观察到以高胆固醇饮食喂养的HCC幼虫中微核的发生率更高(图4H)。
肝脉管系统可以很容易地在斑马鱼模型中使用转基因标记系进行评估,例如Tg(kdrl:mCherry或Tg(fli:EGFP),它们标记脉管系统。在HCC + HCD幼虫中观察到血管密度显着增加(图5)。
为了观察NASH相关HCC早期触发的炎症反应,在巨噬细胞和中性粒细胞中表达荧光蛋白的转基因鱼系,如Tg(mfap4:tdTomato-CAAX; lyz:BFP),与HCC转基因系杂交。中性粒细胞和巨噬细胞的浸润发生在用HCD喂养的HCC和HCC中,通过量化肝脏和附近(周围区域高达75μm)中性粒细胞/巨噬细胞的数量和密度来评估(图6A-H)。然而,HCC + HCD显示出中性粒细胞数量和密度的显着增加(图6F-H)。在受精后13天,适应性免疫系统已经发挥作用。使用在T细胞中表达荧光蛋白的转基因鱼系,例如Tg(lck:EGFP),并与HCC转基因系组合;我们评估了胆固醇过剩对T细胞募集到肝脏的影响。在喂食HCD的HCC幼虫中观察到T细胞密度和总数显着降低(图6I-K)。
| 转基因斑马鱼系 | ZFIN参考 | 测定 |
| 卡斯帕 | 罗伊A9;米特法W2 | 肝性脂肪中毒 |
| Tg(fabp10a:pt-β-catenin_cryaa:Venus / fabp10a:H2B-mCherry ) | s704Tg / uwm41Tg | 肝脏形态 |
| Tg(fabp10a:pt-β-catenin_cryaa:Venus; fabp10a:H2B-mCherry; fabp10a:LIFEACT-EGFP) | s704Tg / uwm41Tg / uwm42Tg | 肝细胞和核形态 |
| Tg(fabp10a:pt-β-catenin_ cryaa:Venus; fli:EGFP) | s704Tg / y1Tg | 血管 生成 |
| Tg(fabp10a:pt-β-catenin_cryaa:金星; mfap4:番茄-CAAX;lyzC:BFP) | s704Tg / xt6Tg / zf2171Tg | 巨噬细胞和中性粒细胞募集 |
| Tg(fabp10a:pt-β-catenin_cryaa:Venus; lck:EGFP) | s704Tg / cz1Tg | T细胞募集 |
表1:用于不同测定的转基因斑马鱼品系。
| 幼虫数量 | 喂料箱尺寸 | 每天的食物量(毫克) | E3 体积(毫升) |
| 30-40 | 小型养殖箱 | 3-4 | 200 |
| 60-80 | 小/大养殖箱 | 6-8 | 400 |
| 100-150 | 大养殖箱 | 10-15 | 500 |
表 2:设置进料箱的条件。
| 表现型 | 评分方法 |
| 没有 | 正常细胞核,无微核或脑疝 |
| 轻微 | 微细胞核数量少(每个视野少于 5 个)和/或脑疝 |
| 中度/重度 | 中度至大量微核(每个视野超过 5 个)和/或脑疝 |
表3:微核和核疝评分。
图1:协议图总结了主要实验步骤和分析方法。 请点击此处查看此图的大图。
图2:肝脂肪变性的对照测定 - ORO染色。 HCC幼虫喂食正常或高胆固醇饮食,并进行油红O(ORO)染色以评估肝脂肪变性。(A) 使用网孔插入物进行顺序 ORO 染色的 12 孔板图。(B)用于操纵幼虫的睫毛工具的图像。(C)涂有油红的肝脏的代表性图像;肝细胞癌和肝细胞癌+肝细胞癌幼虫。(D)卡方图显示具有不同肝脂肪变性评分的幼虫的百分比。比例尺= 50 μm。 请点击此处查看此图的大图。
图3:肝脏大小的代表性图像。 使用zWEDGI在倒转转盘共聚焦显微镜上对表达肝脏标志物(Tg(fabp10a:H2B-mCherry))的转基因HCC幼虫进行实时和非侵入性成像。(A)HCC和HCC + HCD幼虫肝脏的代表性3D重建。(乙-四)显示肝脏形态改变的图表,包括HCC和HCC + HCD幼虫的肝脏面积(B)肝表面积(C)和肝脏体积(D)。比例尺 = 50 μm。 请点击此处查看此图的大图。
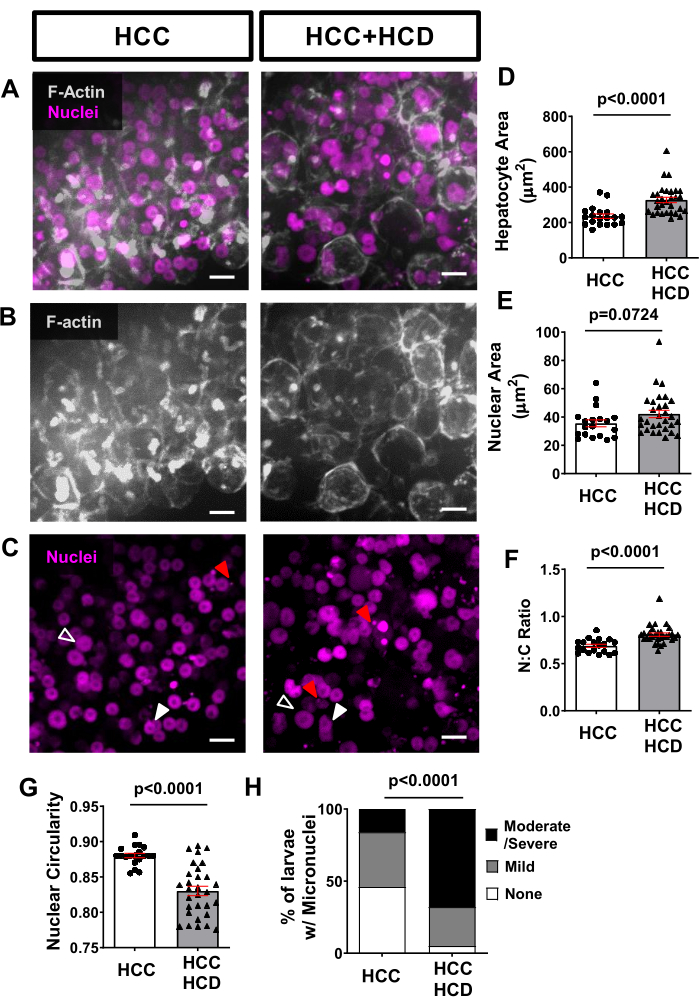
图4:来自肝细胞和细胞核形态的代表性图像。 对在肝细胞膜(Tg(fabp10a:Life-actin-EGFP)和肝细胞核(Tg(fabp10a:H2B-mCherry)中表达荧光蛋白的转基因HCC系进行成像。(A-C)HCC和HCC + HCD幼虫的F-肌动蛋白和肝细胞核的代表性3D重建。张开的箭头显示增大的细胞核;白色箭头显示形状改变的细胞核;红色箭头表示微核和核疝。(D-G)图表显示了HCC和HCC + HCD 13天龄幼虫中细胞和核参数的平均值。(D)肝细胞区。(e) 核区。(六)核:细胞质比。(g) 核循环性。每个点代表每个幼虫的平均值。点图显示均值 ±SEM (H) 卡方图,显示具有不同微核和核突出评分的幼虫百分比。比例尺 = 10 μm。 请点击此处查看此图的大图。
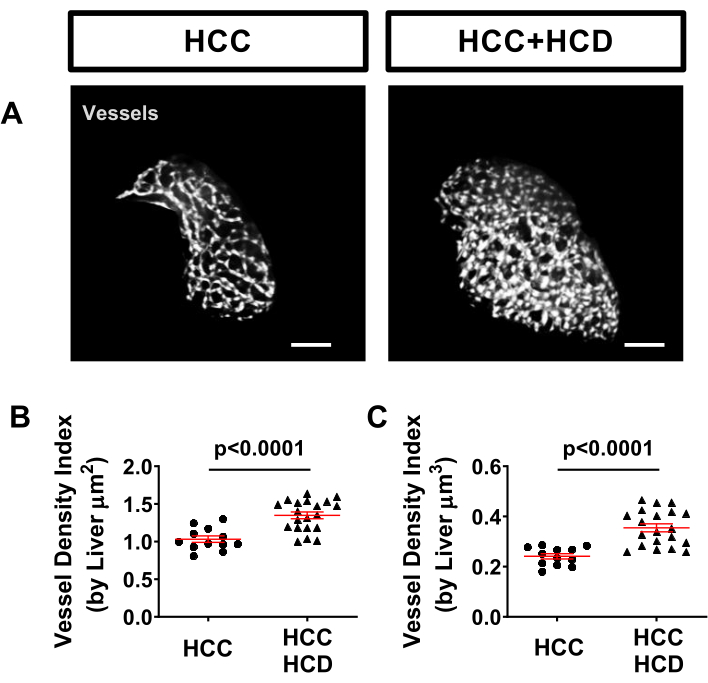
图 5:肝脏脉管系统的代表性图像。 在肝细胞核(Tg(Fabp10a:H2B-mCherry)和内皮细胞(Tg)fli:EGFP)中表达荧光蛋白的转基因HCC系。(A)HCC和HCC + HCD幼虫中肝脉管系统的代表性三维重建。(乙-丙)图表显示了HCC和HCC + HFCD幼虫中肝脏表面积(B)体积(C)的血管密度指数。点图显示均值 ±SEM。 比例尺 = 50 μm。 请点击此处查看此图的大图。
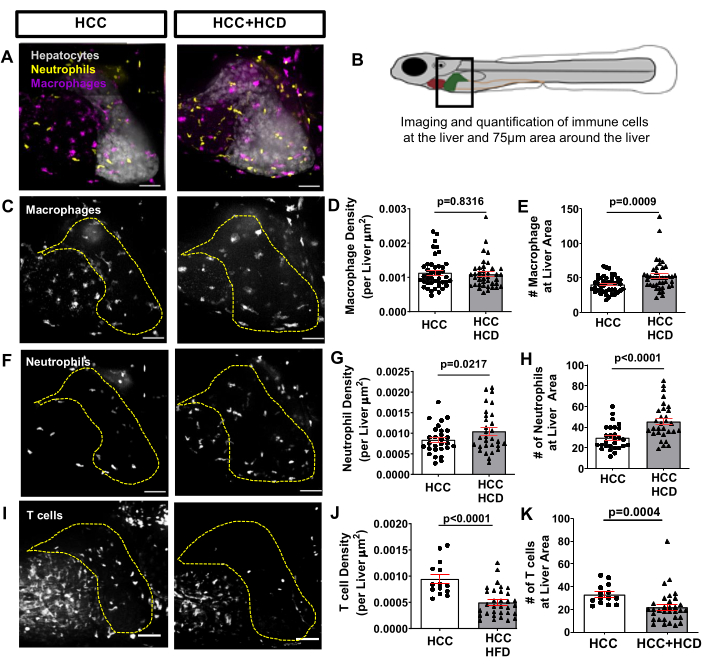
图6:来自肝脏免疫细胞景观的代表性图像。 在巨噬细胞和中性粒细胞(Tg(mfap4:tdTomato-CAAX; lyz:BFP)或T细胞(Tg(lck-EGFP))中表达荧光蛋白的转基因HCC系。(中、女)13日龄HCC和HCC + HCD幼虫肝脏和白细胞募集到肝脏区域的代表性3D重建。(B)成像肝脏区域图。(D-E)图表显示HCC和HCC + HCD幼虫肝脏区域的巨噬细胞密度(D)和数量(E)。(G-H)图表显示HCC和HCC + HCD幼虫肝脏区域中性粒细胞密度(G)和数量(H)。(G)HCC和HCC + HCD幼虫中T细胞募集到肝脏区域的代表性3D重建。(H-I)图表显示HCC和HCC + HCD幼虫肝脏区域中的T细胞密度(H)和数量(I)。点图显示均值 ±SEM。 比例尺 = 50 μm。 请点击此处查看此图的大图。
补充表1:缓冲液和溶液表 请点击此处下载此表。
讨论
随着HCC发病率的增加,特别是NASH诱导的HCC,拥有更有效的模型来研究NASH相关HCC所涉及的细胞和分子机制非常重要。肝脏细胞-细胞相互作用的反卷积对于更好地了解肝病进展和肝癌发生至关重要。本协议中描述的方法提供了一种独特的方法来分析 体内 和非侵入性肝病进展。
饮食的准备对于成功建立NASH相关的HCC模型至关重要。重要的是让乙醚在通风橱内完全蒸发以避免有害影响,同时为斑马鱼准备饮食。为了将这些饮食与幼虫一起使用(受精后5-12天),将饮食磨成细颗粒以确保幼虫摄入食物非常重要。使用荧光标记的脂肪酸类似物可用于评估幼虫的食物摄入量。
在将幼虫放入繁殖箱并开始喂食程序之前,通过混合来自不同平板的幼虫来确保实验取样均匀至关重要。这一步很重要,因为从第0天开始,每个平板中都会促进不同的微环境,并可能影响炎症反应。
另一个重要步骤是计算幼虫数量,以了解每个喂食箱需要多少食物。如果食物量不足以满足每个箱子中存在的幼虫数量,将发生以下两种情况之一:1)幼虫将喂养不足;2)幼虫会过度喂食。不准确的喂养会导致与营养不良或营养过剩相关的不健康状况,例如炎症,这将极大地影响肝脏微环境。如果发生不准确的喂养,幼虫会出现运动问题。在这个发育阶段,幼虫应该密集游泳,因此,如果注意到运动问题,幼虫是在不健康的条件下饲养的(营养不良或由于过度喂养而暴露于有毒剂量的胆固醇)。出于这个原因,需要严格控制正常饮食和富含胆固醇的饮食的喂养程序。可以进行一些测定以快速解决幼虫喂养和健康的准确性,包括肝肿大(肝脏大小)和组织和器官炎症,特别是肝脏和肠道(中性粒细胞和巨噬细胞浸润明显增加)。
每天清洁和更换95%的E3对于减少饲养箱中微生物的生长以及改善幼虫的健康和存活至关重要。或者,可以将幼虫放置在独立的机架系统中。为获得最佳效果,将 60-80 只幼虫放入 3 升水箱中。通过将流量调整为快速滴水模式并每天两次(上午和下午)喂食幼虫3-4毫克,将水流量保持在最低水平。应定期检查水流量,以确保每个水箱中的水流正确。在我们的实验室中,这种方法为我们提供了95-100%的存活率,短期喂养10%的HCD。此外,该方法大大减少了静态进料方案中描述的日常清洁和水交换所必需的固有工作量。
虽然我们利用富含10%胆固醇的饮食在短期暴露中诱导NASH(5天足以诱发脂肪性肝炎),但可以进行饮食改变并扩大到使用果糖 18,脂肪酸(如棕榈酸)19,或可以使用4%富含胆固醇的饮食扩展的喂养方案20。目前,HCC的成功治疗靶点很少,NASH也没有。斑马鱼模型的使用提供了一个独特的机会来扩展我们对肝癌发生的知识,同时也提供了一个无与伦比的脊椎动物系统来执行大通量药物筛选。本协议中描述的技术将有助于肝脏疾病和肝癌发生的未来发现和治疗靶点。
披露声明
作者没有什么可透露的。
致谢
作者要感谢阿尔伯特·爱因斯坦医学院斑马鱼核心设施技术人员克林顿·德保罗和斯巴达克·加里宁为我们的斑马鱼系提供帮助和维护。FJMN得到了癌症研究所和纤维层状癌症基金会的支持。
材料
| Name | Company | Catalog Number | Comments |
| Cholesterol | Sigma | C8667-25G | Easily degraded. Store -20°C. |
| Corning Netwells carrier kit 15 mm | Fisher | 07-200-223 | |
| Corning Netwells inserts | Fisher | 07-200-212 | |
| Diethyl ether | Fisher | 60-046-380 | Highly Volatile. |
| Dumont forceps #55 dumostar | Fisher | NC9504088 | |
| Fisherbrand Pasteur Pipets 5.75in | Fisher | 22-183624 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Science | 15710 | |
| Golden Pearl Diet 5–50 nm Active Spheres | Brine Shrimp Direct | - | Any commercial dry powder food for larvae can be used. |
| Graduated Transfer Pipets | Fisher | 22-170-404 | |
| Isopropanol | Fisher | BP26181 | |
| PBS, pH7.4, 10X, 10 Pack | Crystalgen | 221-1422-10 | |
| Petri Dishes 100X20MM | Fisher | 08-747D | |
| Tricaine | Sigma | A-5040 | |
| Tween 20 | Fisher | BP337-500 | |
| Oil Red O solution 0.5% isopropanol | Sigma | O1391-500ML | |
| Tricaine | Sigma | A-5040 | |
| Tween 20 | Fisher | BP337-500 | |
| Vactrap | VWR | 76207-630 | Vacuum system for larvae collection |
| Microscopes | |||
| Fluorescent Stereomicroscope | Leica | M205 FCA THUNDER Imager Model Organism Large | |
| Spinning Disk Confocal Microscope | Nikon | Nikon CSU-W1 | |
| Stereomicroscope | Leica | S9i with transilluminated base | |
| Software | |||
| Fiji | Open-source Java image processing program. | ||
| Imaris 9.6 | Bitplane; Oxford Instruments. |
参考文献
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic Fatty Liver Disease-Related Hepatocellular Carcinoma: A Problem of Growing Magnitude. Seminals in Liver Disease. 35 (3), 304-317 (2015).
- El-Serag, H. B., Kanwal, F. Epidemiology of hepatocellular carcinoma in the United States: where are we? Where do we go. Hepatology. 60 (5), 1767-1775 (2014).
- Estes, C., et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom, and United States for the period 2016-2030. Journal of Hepatology. 69 (4), 896-904 (2018).
- Estes, C., Razavi, H., Loomba, R., Younossi, Z., Sanyal, A. J. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease. Hepatology. 67 (1), 123-133 (2018).
- Meli, R., Mattace Raso, G., Calignano, A. Role of innate immune response in non-alcoholic Fatty liver disease: metabolic complications and therapeutic tools. Frontiers in Immunology. 5, 177 (2014).
- Ganz, M., et al. Progression of non-alcoholic steatosis to steatohepatitis and fibrosis parallels cumulative accumulation of danger signals that promote inflammation and liver tumors in a high fat-cholesterol-sugar diet model in mice. Journal of Translational Medicine. 13, 193 (2015).
- Ma, C., et al. NAFLD causes selective CD4(+) T lymphocyte loss and promotes hepatocarcinogenesis. Nature. 531 (7593), 253-257 (2016).
- Reimer, K. C., Wree, A., Roderburg, C., Tacke, F. New drugs for NAFLD: lessons from basic models to the clinic. Hepatology International. 14 (1), 8-23 (2020).
- Wrighton, P. J., Oderberg, I. M., Goessling, W. There is something fishy about liver cancer: Zebrafish models of hepatocellular carcinoma. Cellular and Molecular Gastroenterology and Hepatology. 8 (3), 347-363 (2019).
- Goessling, W., Sadler, K. C. Zebrafish: An important tool for liver disease research. Gastroenterology. 149 (6), 1361-1377 (2015).
- Huo, X., et al. Transcriptomic profiles of tumor-associated neutrophils reveal prominent roles in enhancing angiogenesis in liver tumorigenesis in zebrafish. Science Reports. 9 (1), 1509 (2019).
- Yan, C., Yang, Q., Gong, Z. Tumor-associated neutrophils and macrophages promote gender disparity in hepatocellular carcinoma in zebrafish. Cancer Research. 77 (6), 1395-1407 (2017).
- Capece, D., et al. The inflammatory microenvironment in hepatocellular carcinoma: A pivotal role for tumor-associated macrophages. Biomed Research International. 2013, 187204 (2013).
- de Oliveira, S., et al. Metformin modulates innate immune-mediated inflammation and early progression of NAFLD-associated hepatocellular carcinoma in zebrafish. Journal of Hepatology. 70 (4), 710-721 (2019).
- Huemer, K., et al. Long-term live imaging device for improved experimental manipulation of zebrafish larvae. Journal of Visualized Experiments. (128), e56340 (2017).
- Huemer, K., et al. zWEDGI: Wounding and entrapment device for imaging live zebrafish larvae. Zebrafish. 14 (1), 42-50 (2017).
- Evason, K. J., et al. Identification of chemical inhibitors of beta-catenin-driven liver tumorigenesis in zebrafish. PLoS Genetics. 11 (7), 1005305 (2015).
- Sapp, V., Gaffney, L., EauClaire, S. F., Matthews, R. P. Fructose leads to hepatic steatosis in zebrafish that is reversed by mechanistic target of rapamycin (mTOR) inhibition. Hepatology. 60 (5), 1581-1592 (2014).
- Park, K. H., Ye, Z. W., Zhang, J., Kim, S. H. Palmitic acid-enriched diet induces hepatic steatosis and injury in adult zebrafish. Zebrafish. 16 (6), 497-504 (2019).
- Progatzky, F., et al. Dietary cholesterol directly induces acute inflammasome-dependent intestinal inflammation. Nature Communication. 5, 5864 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。