Method Article
ゼブラフィッシュにおける非アルコール性脂肪性肝疾患関連肝細胞癌の早期進行過程における肝微小環境の解析
要約
ここでは、非アルコール性脂肪性肝疾患(NAFLD)関連の肝細胞癌(HCC)ゼブラフィッシュモデルを生成して、肝臓の微小環境と免疫細胞の景観に対するコレステロール余剰の影響を研究する方法を紹介します。
要約
肝臓がんは現在、世界のがん関連死因の3番目に多い原因であり、肝細胞がん(HCC)はすべての肝臓がん症例の75〜90%を占めています。B / C型肝炎を予防および治療するための効果的な治療法の導入により、非アルコール性脂肪性肝疾患(NAFLD)、および非アルコール性脂肪性肝炎(NASH)として知られるより攻撃的な形態は、現代社会でHCCを発症する最大の危険因子に急速になりつつあります。NASHがHCCの開発に果たす役割をよりよく理解するために、NASH関連のHCCゼブラフィッシュを設計しました。ゼブラフィッシュの幼虫の光学的透明度と遺伝的扱いやすさは、非侵襲的な蛍光ライブイメージングを使用して肝臓の微小環境と免疫細胞組成を研究するための魅力的で強力なモデルになります。このプロトコルでは、NASH関連HCCゼブラフィッシュモデルを使用して、肝臓微小環境における余剰コレステロールの影響と、疾患の初期段階での免疫細胞組成への影響を調査する方法について説明します。まず、肝細胞特異的活性化β-カテニンを発現するHCC幼虫(s704Tg)に10%高コレステロール食を8日間給餌し、NASH関連HCCモデルを開発しました。ここでは、肝臓領域、細胞、核形態(肝細胞領域、核領域、核:細胞質比(N:C比)、核円形度、小核/核ヘルニアスコアリング)や血管新生など、非侵襲的共焦点顕微鏡によって肝臓のいくつかの初期悪性腫瘍の特徴を評価するために、さまざまなトランスジェニックラインを利用する方法について説明します。次に、タグ付き免疫細胞(好中球、マクロファージ、およびT細胞)を有するトランスジェニック株を用いて、NASH関連HCC幼虫における肝免疫細胞組成を分析する方法を示します。記載された技術は、初期の肝発癌段階で肝臓微小環境および免疫細胞組成を評価するのに有用であるが、他の肝疾患モデルにおいてそのような特徴を研究するために改変することもできる。
概要
肝細胞がん(HCC)は、治療選択肢が限られている侵攻性のがんです。HCC患者の30%以上が肥満であり、NAFLD1,2,3,4の攻撃的な形態であるNASHを患っていることがわかっています。カロリーが豊富な食事を摂取すると、脂肪酸の利用可能性が劇的に増加し、局所的および全身的な代謝シフトを引き起こし、脂肪症、肝細胞損傷、炎症、および線維症を引き起こします-NASHのすべての重要な特徴。HCCへのNASHの進行は、肝臓での脂質の蓄積を伴い、それが炎症を引き起こし、免疫細胞組成を変化させます5,6,7。肝疾患の進行中に肝微小環境と免疫細胞の景観がどのように変化するか、および特定の病因によってどのように変化するかを理解することは、特に興味深く重要です。余剰コレステロールが肝臓の微小環境と免疫細胞の景観に与える影響をよりよく特定するために、NASH関連HCCの独自のゼブラフィッシュモデルを開発しました。このモデルを使用することで、食事と栄養過多が肝臓の微小環境と肝疾患の進行に与える影響をよりよく理解できるようになりました。
マウスやヒト組織サンプルなどの哺乳類モデルは、脂肪性肝炎および脂肪症の病因を理解する上で不可欠でした8。マウスは肝疾患や癌の好ましいモデルですが、細胞レベルでの光学的透明度に欠けていますが、人間の組織サンプルには、動物モデルが模倣できる3D環境がないことがよくあります。これらの障害により、ゼブラフィッシュは研究コミュニティの強力なモデルになりました。ゼブラフィッシュは人間と著しく類似しており、少なくとも70%の遺伝子保存があります。それらは、肝臓の微小環境、肝細胞組成、機能、シグナル伝達、および傷害への反応を維持します9,10。高コレステロール食(HCD)とHCCの確立されたトランスジェニックゼブラフィッシュモデルを組み合わせて、NASH関連HCCのゼブラフィッシュモデルを開発しました。
ここでは、NASH関連HCCゼブラフィッシュモデルを生成する方法と、肝臓の微小環境を研究し、in vivoで初期の悪性腫瘍の特徴に対処する方法を説明するプロトコルを提示します。非侵襲的共焦点顕微鏡と、蛍光タグが付けられた肝細胞膜および核を有するゼブラフィッシュトランスジェニック株を組み合わせることで、肝臓の形態(面積、体積、表面積)、細胞および核の形態(肝細胞面積、核面積、N:C比、核循環度、小核/核ヘルニアスコアリング)、血管新生(血管密度)を分析することにより、初期の悪性腫瘍の特徴に対処することができます。免疫細胞の微小環境も肝発がんの重要な特徴であるため11,12,13,14、したがって、タグ付き免疫細胞(好中球、マクロファージ、およびT細胞)を持つトランスジェニックゼブラフィッシュ系統を使用して、NASH関連HCC幼虫の肝臓免疫細胞組成を分析する方法も示します。記載された技術は、モデルに固有であり、肝疾患進行における肝微小環境および免疫細胞組成を評価するのに非常に有用である。
プロトコル
動物実験は、アルバートアインシュタイン医科大学の施設動物管理および使用委員会(IACUC)によって承認された手順に従って実施されます。プロトコルで使用されるバッファーと溶液のレシピについては、 補足表1を参照してください。
1.急性コレステロール余剰のための10%コレステロール強化食の準備。
- 2つの25 mLガラスビーカーに2 x 4 gのゴールデンパールダイエット5-50 nmアクティブスフィア(GPAS)を計量します-1つは通常の食事(ND)用、もう1つは10%高コレステロール食(HCD)用です。
注:ゼブラフィッシュの幼虫のための市販のドライフードダイエットを使用することができます。 - 10mLのガラスビーカーに0.4gのコレステロールを量ります。ビーカーをホイルで覆います。
- 20 Gの針が付いた10 mLシリンジを使用して、5 mLのジエチルエーテルを測定します。次に、ジエチルエーテルをNDビーカーに加え、すぐにスパチュラを使用してドライフードと混ぜます。
注意: ジエチルエーテルは、目、皮膚、気道の炎症を引き起こします。.化学ヒュームフードでのみ使用してください。 - 20 G針付きの10 mLシリンジを使用して5 mLのジエチルエーテルを再度測定し、コレステロールを含む10 mLビーカーに追加し、シリンジですぐに上下に吸引して混合します。
- コレステロール溶液をHCDビーカーにすばやく加え、溶液が均一になるまですぐにスパチュラで混ぜます。
- ビーカーをフードに最大24時間置いて、ジエチルエーテルを完全に蒸発させます。翌日、乳棒と乳鉢を使用してGPASダイエットを微粒子に粉砕します。
注:食事を粉砕することは重要なステップであり、幼虫は50nmを超える粒子を食べることができません。 - 各食事を小さなラベル付きのビニール袋または50 mLの遠沈管に移し、-20°Cで保存します。
2.コレステロール強化食による短期間の幼虫摂食によるNASH誘導 - 静的条件。
- -1日目にトランスジェニックフィッシュラインを設定します(表1)。翌朝(0日目)、魚が産卵した後、メッシュストレーナーで卵を集めます。
- 胚水(E3)を入れた洗浄ボトルを使用して、卵をよくすすぎ、卵をE3培地で10cmのペトリ皿に慎重に移します。
- 死んだ卵や未受精の卵を含め、繁殖箱に蓄積した可能性のあるすべての破片のプレートをきれいにします。
注:卵をすすぎ、プレートを洗浄することは、微生物の制御されない成長とその結果としての幼虫の発育上の欠陥を回避するために重要です。 - 卵を10 cmのペトリ皿あたり70/80の密度で分けます(25 mLのE3中)。1日目に、透過照明ベースを備えた解剖スコープの下で、死んだ胚または発生障害のある胚をチェックしてきれいにします。
注意: 透過照明ベース暗視野モードを使用して、発生効果のある胚を識別し、プレート内の微生物の成長を確認します。施設が異なれば、システム内の微生物収量も異なります。悪影響を避けるために、必要に応じてE3培地および/または皿を交換してください。 - 5日目に、すべての皿の幼虫を15 cmのペトリ皿に入れ、メチレンブルーなしでE3を加えます。次に、以下のように給餌箱内の幼虫を分ける(表2)。
注:対照条件では、全身性の慢性炎症を引き起こすことなく健康な幼虫を生成するには、幼虫に1日あたり幼虫あたり約0.1mgの食物を与える必要があります。食物の総量(表2)が1日2回の給餌に均等に分割されていることに注意してください。 - 幼虫を28°Cのインキュベーターに暗光サイクル(例:14時間明/10時間暗サイクル)で保管し、5日目から12日目まで1日2回幼虫に餌を与えます。
- 1 mLピペットチップに取り付けられた真空システムを使用して、食品の破片、および培地の90〜95%を毎日吸引します。次に、幼虫を傷つけないように、メチレンブルーを含まない新しいE3を給餌ボックスの片隅に慎重に注ぎます。
注意: 給餌ボックスの毎日の清掃は、微生物の制御されない成長を避けるために重要です。
3.給餌箱からの受精後13日の幼虫の収集。
- 13日目に、設定された実験条件の数に応じて収集皿を準備します。パーマネントマーカーペンを使用して、サンプルの切り替えを避けるために皿の側面(蓋と底)にマークを付けます(例:通常の食事(ND)用の1本の黒い縞模様とHCD用の2本の黒い縞模様)。
- 各皿の底を覆うのに十分なE3をメチレンブルーなしで注ぎます。慎重に真空システムを使用して給餌ボックスから水を吸引し、これらの材料を収集皿に移さないように、底から破片や死んだ幼虫を吸引するようにしてください。
- 水位が低くなり始めたら、給餌ボックスをゆっくりと持ち上げて幼虫を角の1つまで泳がせ、反対方向に吸引します。
注:水を吸引するときに異なる直径を可能にするために、さまざまな高さでカットチップを備えた1mLピペットを使用してください。異なるサイズを交互に使用し、より大きな直径から始めて、水量が減少し幼虫の密度が増加するにつれて、より小さな直径に変更します。 - 約20〜30 mLの液体しかなくなったら、ステップ1で準備した収集シャーレに幼虫を注意深くデカントします。給餌ボックスからラベルの付いたテープを皿の蓋に置きます。
- すべての給餌ボックスに対して手順3.2〜3.4を繰り返します。
4.食事誘発性肝脂肪症の対照アッセイ-オイルレッドO(ORO)染色、イメージング、およびスコアリング。
- ガラスパスツールピペットを使用して、15〜20匹の幼虫を2mLの丸底チューブに移し、約15〜30分間氷上に置きます。チューブからほとんどのメディアを取り外します。
- 幼虫を固定するために4%パラホルムアルデヒド(PFA)を2mL加え、4°Cで一晩インキュベートします。
- 翌朝、4%PFA溶液を取り除き、幼虫を2 mLの1x PBSで3回洗浄します。
- 1つのメッシュウェルインサートを備えた条件ごとに12ウェルプレート(図2A)を準備します。
- ガラスピペットを使用して、幼虫を2 mLチューブからウェルに予め置いたインサートに移し、5 mLの1x PBSを加える。染色後のサンプル保存用に2 mLチューブを保存してください。
注意:幼虫はこの段階で非常に粘着性があり、プラスチック製のピペットを使用しないでください。 - 幼虫を含むインサートを5mLの60%イソプロパノール溶液を含む別のウェルに移します。幼虫を室温(RT)で30分間インキュベートします。
- その間、60%イソプロパノール溶液中の0.3%オイルレッドOを調製する。0.45 μmシリンジフィルターを使用して、0.3%オイルレッド溶液を2回ろ過します。
注:イソプロパノール中の3 mLの0.5%オイルレッドOを2 mLの蒸留水と混合することにより、ウェルあたり5 mLの溶液を調製します。60%イソプロパノール溶液中の0.3%オイルレッドOは、新たに調製する必要があります。 - 次に、幼虫の入ったメッシュインサートを、60%イソプロパノール溶液中の5mLの新しく作られた0.3%オイルレッドOを含む別のウェルに移します。穏やかな揺動でRTで3時間インキュベートされた幼虫。
- ORO染色後、60%イソプロパノールを含む別のウェルにインサートを移して幼虫をすすぐ。幼虫を60%イソプロパノールで30分間2回洗浄し、60%イソプロパノールを含むウェルにインサートを順次移します。
- 1x PBS-0.1%トゥイーンでインサートを順番にウェルに移し、1x PBS-0.1%トゥイーンで幼虫を5分間3回洗浄します。
- 幼虫を2mLチューブに移します。PBSTを除去し、1 mLの80%グリセロールを加え、イメージングするまで4°Cで保存します。
- より良いイメージングのために、幼虫を1x PBS-0.1%トゥイーンに移し、解剖スコープ下で2つの#55鉗子を使用して組織を注意深く引っ張って肝臓を解剖します。
注:キャスパーバックグラウンドイメージングを使用する場合は、幼虫全体を使用して実行できます。 - ガラスピペットを使用して、肝臓を50%グリセロールを含む磁器スポットプレートのウェルに注意深く移します。幼虫を操作するための小さなツールを使用して肝臓を配置します(たとえば、まつげツール- 図2B)。カラーカメラを備えた実体顕微鏡で肝臓を画像化します。
- 肝脂肪症のスコア(ORO染色なし=なし、薄赤色ORO染色=軽度、赤-暗赤色ORO染色=中等度/重度)。
5.ゼブラフィッシュ成長イメージングのための創傷および閉じ込めデバイス(zWEDGI)を使用した非侵襲的共焦点イメージング。
- 底を覆うのに十分な15〜20 mLの1xトリカイン-E3を入れた10 cmのペトリ皿を準備します。
注:1xトリカイン-E3作業溶液(0.16 mg / mL)は、2 mLの25xトリカインストック溶液(4 mg / mL)を48 mLのE3で希釈することによって得ることができます。トリカイン濃度は、幼虫がこの発達段階で麻酔に非常に敏感であるため、0.16 mg / mLを超えてはなりません。. - プラスチック製のパスツールピペットで15〜20匹の幼虫を1xトリカイン-E3を含むペトリ皿に移し、幼虫を5分間麻酔します。
- ウェルあたりメチレンブルーを含まない2〜3 mLのE3を含む6ウェルプレートを準備します。
- 蛍光実体顕微鏡上で、麻酔をかけた幼虫をスクリーニングして、目的の蛍光マーカーを探します(表1)。スクリーニングされた幼虫をE3の最小量のトリカインに移し、画像化する時間になるまで6ウェルプレートで回復させます。
注:二重、三重、および四重のトランスジェニック幼虫のスクリーニングには時間がかかり、幼虫をE3に入れ、6ウェルプレートから培地を頻繁に交換して、トリカインへの不必要な曝露を減らします。また、この発達段階の幼虫は浮遊するので、まつげツールを使用して、組織損傷を誘発することなくスクリーニングのために幼虫を配置します。 - スクリーニング後、25 mLの1xトリカイン-E3を含む10 cmのペトリ皿を準備します。プラスチック製のパスツールピペットで15〜20匹の幼虫を1xトリカイン-E3を含むペトリ皿に移し、幼虫を5分間麻酔します。
- 一方、実体顕微鏡下で、1xトリカイン-E3を創傷および閉じ込め装置のチャンバーに追加します(例:zWEDGI)15,16。P200マイクロピペットを使用して、チャンバーと拘束トンネルから気泡を取り除きます。余分な1xトリカイン-E3をすべて取り除き、チャンバーを満たすのに十分な量だけを残します。
- 麻酔をかけた幼虫をzWEDGIのローディングチャンバーに移し、まつげツールを使用して実体顕微鏡の下に配置します。幼虫の頭を軽くたたき、尾が拘束トンネルに入るように押します。さらに、マイクロピペットを使用して、幼虫がトンネルに入るのを助けるために、創傷室から1x Tricaine-E3を取り除きます。幼虫が左葉のイメージングに適切に配置されていることを確認してください-倒立顕微鏡:左側を下向きにします。正立顕微鏡:左側を上向き。
注:zWEDGIが利用できない場合は、魚を1xトリカイン-E3の1%低融点アガロースに取り付けて配置できますが、アガロース浸漬は迅速なイメージング(最大15分)にのみ使用できます。 - 肝細胞および核形態解析では、40倍の空気対物レンズと2 μmの光学切片のzスタックを使用して共焦点顕微鏡で肝臓を画像化します。肝臓の形態、血管新生、および免疫細胞動員アッセイでは、20倍の空気対物レンズと5 μmの光学切片のzスタックを使用して肝臓を画像化します。大きな肝臓を持つ幼虫の場合、75μmのすべての肝臓とその周辺領域のイメージングを確実にするために、2 x 2タイル画像を撮影する必要があります。
- イメージング後、1x Tricaine-E3を含むプラスチック製パスツールピペットを使用して、拘束トンネルから幼虫を引き出し、メチレンブルーを含まないE3のシャーレに移します。
6.肝臓の形態学的変異の分析。
注:以下の手順は、肝臓の表面積と体積の定量化のために実行されます。
- イメージングソフトウェアを開きます。分析する画像ファイルを含むフォルダーを アリーナ に追加し、[ フォルダーの観察 ]アイコンを選択します。次に、サムネイルを右クリックして、[ ネイティブImarisファイル形式に変換 ]を選択して、ファイルを形式(.ims)に変換します。
- Surpassサブメニューで、各チャンネルの明るさとコントラストを調整します。次に、青い[ 新しいサーフェスの追加 ]ボタンをクリックして、肝臓からサーフェスを作成します。
- 次に、表面作成パネルで [関心領域のみをセグメント化 ]を選択して、肝臓の表面を手動で作成します。
- [ 自動作成|をスキップ] をクリックします。手動編集 オプション。 輪郭 を選択し、シーンパネルで「ボリューム」オプションの選択を解除します。
注:ボリュームビューオプションは選択解除する必要があり、そうしないと、異なるzスタックで関心領域を選択できなくなります。 - zスタックをナビゲートし、[モード]を選択して各平面に関心領域を描画し、好みの描画モードを選択します。描画を開始するには、ポインタをナビゲートではなく選択モードに変更し、次に[描画]をクリックし、ポインタを肝臓にドラッグしてROIを描画し始めます。
- さまざまな焦点面でROIを選択した後、[サーフェスの作成]を選択して、選択したすべてのROIをマージし、肝臓 サーフェス を作成します。
- 次に、新しく作成した表面を使用して、肝細胞シグナルのマスクを作成します。サーフェスをクリックし、[ 編集 ]タブ(鉛筆)で [すべてマスク]を選択します。表示されるウィンドウで、肝臓の体積と表面積を定量化するために使用されるマスクするチャネルを選択します。次に、[サーフェスの外側のボクセルを0に設定する]を選択し、マスクを適用する前に[ チャネルを複製 ]オプションにチェックマークを付けます。
- 分析には、統計分析メニューの肝臓表面積と肝臓体積の値を使用します。
注意: 肝臓面積の定量化には、次の手順を実行します。
- フィジーソフトウェアを開きます。[プラグイン]メニューで、[バイオフォーマット]、[バイオフォーマットインポーター]の順に選択し、[チャンネルの分割]オプションにチェックマークを付けて画像ファイルを開きます。
- [イメージ] メニューの [ プロパティ ] を選択して、イメージのピクセル サイズとボクセル深度が正しいことを確認します (値が正しくない場合)。次に、[画像] メニューに移動し、[ 調整 ]、[明るさとコントラスト]の順にクリックし、画像の 明るさとコントラストを調整します。
- 次に、肝細胞チャネルを用いて、肝臓の最大強度投影を作成する。[画像]メニューに移動し、[スタック]、[Zプロジェクト]の順にクリックします。[最大強度投影]を選択します。
- フリーハンド選択ツールを使用して、幼虫の肝臓を囲む関心領域(ROI)を手動で作成します。次に、[ 分析 ]メニューで [測定] をクリックして肝臓面積を取得します。結果をスプレッドシートとして保存して、さらに分析します。
7.肝細胞および核形態学的分析。
- フィジーソフトウェアを開きます。[プラグイン]メニューで、[バイオフォーマット]を選択し、[バイオフォーマットインポーターの分割チャンネル]オプションにチェックマークを付けて、画像ファイルを開きます。
- [イメージ] メニューの [ プロパティ ] を選択して、イメージのピクセル サイズとボクセル深度が正しいことを確認します (値が正しくない場合)。次に、[画像]メニューに移動し、[ 調整 ]、[明るさとコントラスト]の順にクリックし、画像の 明るさとコントラストを調整します。
- [分析]メニューで、 分析 するすべてのパラメータ(面積、周長、形状記述子など)の[ 測定値の設定 ]チェックマークを選択します。肝細胞膜蛍光チャネルを選択します。Zをナビゲートし、フリーハンド選択ツールを使用して、1つの肝細胞の周りに完璧なROIを描画します。次に、[ 分析 ]メニューで [測定 ]をクリックして肝細胞面積を計算します。
- 15〜30個の肝細胞に対してステップ7.3を繰り返します。結果をスプレッドシートとして保存して、さらに分析します。
- 次に、核蛍光チャネルを選択します。Zをナビゲートし、フリーハンド選択ツールを使用して、肝細胞の核の周りに完璧なROIを描画します。次に、[ 分析 ]メニューで [測定 ]をクリックして、核面積と円形度を計算します。
- 15〜30個の肝細胞に対してステップ7.5を繰り返します。核:細胞質比の定量化を含むさらなる分析のために、結果をスプレッドシートとして保存します。
- 小核の存在およびヘルニアについてのサンプルのスコアは以下のようにした(表3)。
8.血管新生分析。
- このプロトコルのセクション6で説明されているように、肝臓の表面を手動で作成します。この表面を「肝臓表面」と名付けます。
- 肝臓内の内皮細胞シグナルのマスクを作成します。サーフェスをクリックし、編集タブ(鉛筆)の下で [すべてマスク]を選択します。表示されるウィンドウで、内皮細胞チャネルを選択して、肝臓から血管信号を分離します。[サーフェスの外側のボクセルを0に設定]を選択し、[マスク]を適用する前に[ チャネルを複製 ]オプションにチェックマークを付けます。
- 新しい内皮細胞マスクチャネルの名前を 肝血管系に変更します。
- 容器の体積と表面積を測定するには、2番目のサーフェスを作成します。青い[ 新しいサーフェスの追加 ]ボタンをクリックします。サーフェス作成の最初のステップで、サーフェスを自動的に作成するためにすべてのオプションが選択されていないことを確認します。
- 2番目のステップでは、肝血管系チャネルを選択して、表面を作成します。スムージングオプションの選択を解除して、船舶からできるだけ多くの詳細を検出し、しきい値オプションでバックグラウンド減算を有効にします。
- 検出された表面が肝血管系シグナルと共局在していることを確認するために、閾値を調整します。統計分析メニューから表面積と体積の値を使用します。次の式を使用して血管密度指数を計算します。
血管密度指数(肝臓によるμm2)=(血管表面積(μm2))/(肝臓表面積(μm2))
血管密度指数(肝臓μm3による)=(血管容積(μm3))/(肝臓容積(μm3))
9.免疫細胞動員分析。
- フィジーソフトウェアを開きます。[プラグイン]メニューで、[バイオフォーマット]を選択し、[バイオフォーマットインポーターの分割チャンネル]オプションにチェックマークを付けて、画像ファイルを開きます。
- [イメージ] メニューの [プロパティ] を選択して、イメージのピクセル サイズとボクセル深度が正しいことを確認します (値が正しくない場合)。次に、[画像]メニューに移動し、[調整]、[明るさとコントラスト]の順にクリックし、画像の明るさとコントラストを調整します(例:マクロファージ-mCherryまたはdTomato;好中球-BFP;T細胞 - EGFP;肝細胞 - EGFPまたはmチェリー)。
- 次に、各チャンネルへの最大強度投影を作成します。
- セクション6(ステップ6.9-6.12)で説明されているように、幼虫の肝臓を囲むROIを作成し、肝臓面積を測定します。肝臓領域と75μmの周辺領域(「募集領域」)を含む2番目のROIを作成します。
- 次に、[ 編集 ]メニューで[ 選択] オプションを選択し、[ マネージャーに追加]を選択します。自然免疫細胞チャネルの最大強度投影を選択し、ROIマネージャーウィンドウから肝臓ROIをクリックして、 募集領域を設定します。
- [プラグイン]メニューで、[ 分析 ]オプションを選択し、[ セルカウンター ]を選択して、 募集エリア内の免疫細胞をカウントします。肝臓領域に動員された免疫細胞の数をスプレッドシートに記録します。
- 肝臓面積あたりの免疫細胞の数を正規化することにより、好中球、マクロファージ、およびT細胞密度を計算します。
結果
肝細胞癌(HCC)ゼブラフィッシュモデルに短期間の高コレステロール食を導入することにより、肝細胞特異的構成活性型のベータカテニン(s704Tg;Tg(fabp10a:pt-B-cat, cryaa:Venus)17では、NASH関連HCCの非哺乳類脊椎動物モデルを作成することができます。肝疾患の進行は、肝脂肪症、肝サイズ、肝細胞、核形態、血管新生、免疫細胞浸潤を測定することで早期にモニターできます(図1)。
通常の食事を与えられたHCC幼虫は、オイルレッドO染色によって測定された、軽度の肝脂肪症を示さない。しかし、高コレステロール食を与えられたHCC幼虫は、肝脂肪症の有意な増加を示しています(図2)。
肝疾患のよく知られたマーカーは肝腫大17です。肝臓のサイズを評価するために、HCC幼虫は、Tg(fabp10a:H2BmCherry)などの肝細胞に蛍光マーカーを特異的に発現するトランスジェニック系統と交配することができます。肝腫大を評価するために、肝臓面積(2D)、肝臓表面積、および肝臓容積(3D)の評価が行われます。余剰のコレステロールへの曝露の8日後、肝肥大はHCC幼虫において観察された(図3)。
非侵襲的なライブイメージングを使用して、肝細胞膜(Tg(fabp10a:Life-actin-EGFPP)など)および肝細胞核(Tg(Fabp10a:H2B-mCherryなど)で蛍光タンパク質を発現するトランスジェニックフィッシュラインを使用して、肝細胞の悪性腫瘍に関連する細胞および核の形態変化を評価できます。肝細胞面積は、NASH関連HCC(図4A、B、D)、ならびに核領域(図4C、E)および核:細胞質比(図4F)で増加しました。核の円形度の有意な減少は、HCD+HCCグループでも観察されました(図4G)。脂肪毒性は、小核の存在下での発がんの特徴であるDNA損傷を引き起こします。H2B-mCherryマーカーを使用して、高コレステロール食を与えられたHCC幼虫で小核の発生率が高いことを観察しました(図4H)。
肝血管系は、血管系を標識するTg(kdrl:mCherryまたはTg(fli:EGFP)などのトランスジェニックタグラインを使用して、ゼブラフィッシュモデルで簡単に評価できます。HCC + HCD幼虫では血管密度の有意な増加が観察されました(図5)。
NASH関連HCCの初期に誘発される炎症反応を観察するために、Tg(mfap4:tdTomato-CAAX;lyz:BFP)などのマクロファージおよび好中球に蛍光タンパク質を発現するトランスジェニックフィッシュラインをHCCトランスジェニックラインとアウトクロスしました。好中球とマクロファージの浸潤は、HCCとHCDを与えられたHCCの両方で発生し、肝臓とその周辺(最大75μmの周囲)の好中球/マクロファージの数と密度を定量することによって評価しました(図6A-H)。それにもかかわらず、HCC + HCDは好中球の数と密度の有意な増加を示しました(図6F-H)。受精後13日目に、適応免疫システムはすでに機能しています。Tg(lck:EGFP)などのT細胞で蛍光タンパク質を発現するトランスジェニックフィッシュラインを使用し、HCCトランスジェニックラインと組み合わせて使用 する。T細胞の肝臓への動員に対するコレステロール過剰の影響を評価しました。HCDを与えられたHCC幼虫では、T細胞密度と全体の数の有意な減少が観察されました(図6I-K)。
| トランスジェニックゼブラフィッシュ系統 | ZFINリファレンス | 試験 |
| キャスパー | ロイA9;ミトファW2 | 肝脂肪症 |
| Tg(fabp10a:pt-β-catenin_cryaa:Venus / fabp10a:H2B-mCherry ) | s704Tg / uwm41Tg | 肝臓の形態学 |
| Tg(fabp10a:pt-β-catenin_cryaa:Venus; fabp10a:H2B-mCherry; fabp10a:LIFEACT-EGFP) | s704Tg / uwm41Tg / uwm42Tg | 肝細胞と核形態 |
| Tg(fabp10a:pt-β-catenin_ cryaa:Venus; fli:EGFP) | s704Tg / y1Tg | 血管 新生 |
| Tg(fabp10a:pt-β-catenin_cryaa:金星; mfap4:トマト-CAAX;lyzC:BFP) | s704Tg / xt6Tg / zf2171Tg | マクロファージと好中球の動員 |
| Tg(fabp10a:pt-β-catenin_cryaa:Venus; lck:EGFP) | s704Tg / cz1Tg | T細胞リクルートメント |
表1:異なるアッセイで使用するトランスジェニックゼブラフィッシュ系統。
| 幼虫の数 | 給餌ボックスサイズ | 一日あたりの食物量(mg) | E3 容量 (ml) |
| 30-40 | 小型飼育ボックス | 3-4 | 200 |
| 60-80 | 小型/大型飼育ボックス | 6-8 | 400 |
| 100-150 | 大きな飼育ボックス | 10-15 | 500 |
表2:給餌ボックスの条件を設定します。
| 表現型 | 採点方法 |
| 何一つ | 正常核、小核またはヘルニアなし |
| 軽度 | 小核の数が少ない(視野あたり5未満)および/またはヘルニア |
| 中等度/重度 | 中等度から多数の小核(視野あたり5個以上)および/またはヘルニア |
表3:小核と核ヘルニアのスコアリング。
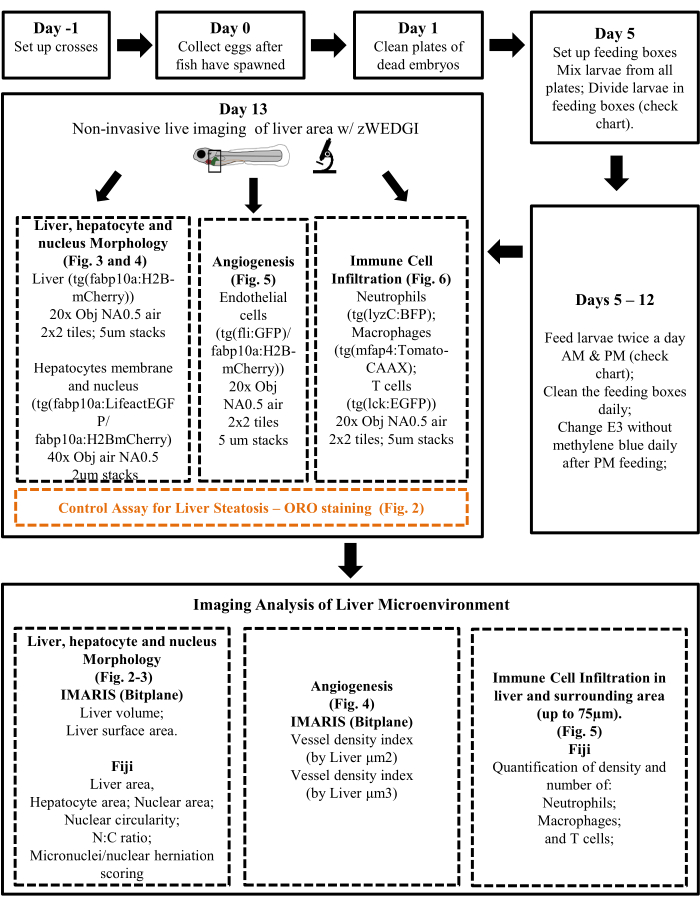
図1:主な実験ステップと分析アプローチをまとめたプロトコル図。 この図の拡大版を表示するには、ここをクリックしてください。
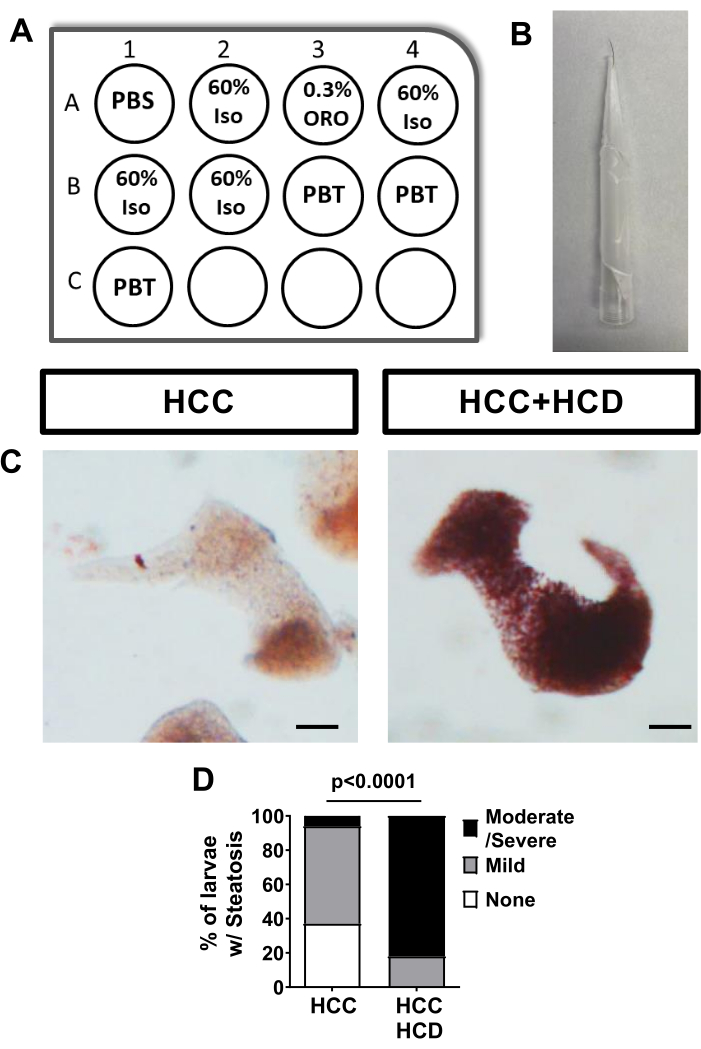
図2:肝脂肪症の対照アッセイ-ORO染色。 HCC幼虫に正常または高コレステロール食を与え、肝脂肪症を評価するためにオイルレッドO(ORO)染色を実施した。(a)メッシュウェルインサートを用いて逐次ORO染色を行う12穴プレートの図。(B)幼虫を操作するために使用されるまつげ道具の画像。(C)オイルレッドで染色された肝臓の代表的な画像。HCCおよびHCC + HCD幼虫。(D)肝脂肪症のスコアが異なる幼虫の割合を示すカイ二乗グラフ。スケールバー= 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。
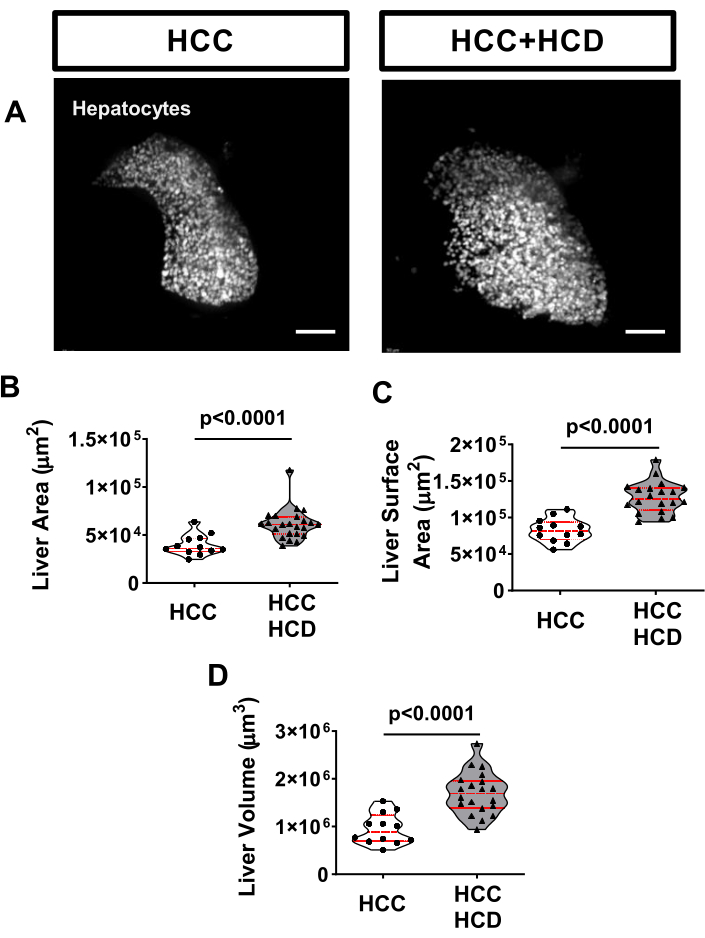
図3:肝臓サイズからの代表的な画像。 肝臓マーカー(Tg(fabp10a:H2B-mCherry))を発現するトランスジェニックHCC幼虫を、zWEDGIを用いて倒立スピニングディスク共焦点顕微鏡上で生きて非侵襲的にイメージングした。(A)HCCおよびHCC + HCD幼虫における肝臓の代表的な3D再構成。(B-D)HCCおよびHCC+HCD幼虫における肝面積(B)肝表面積(C)および肝臓容積(D)を含む肝臓形態変化を示すグラフ。スケールバー = 50 μm。 この図の拡大版を表示するには、ここをクリックしてください。
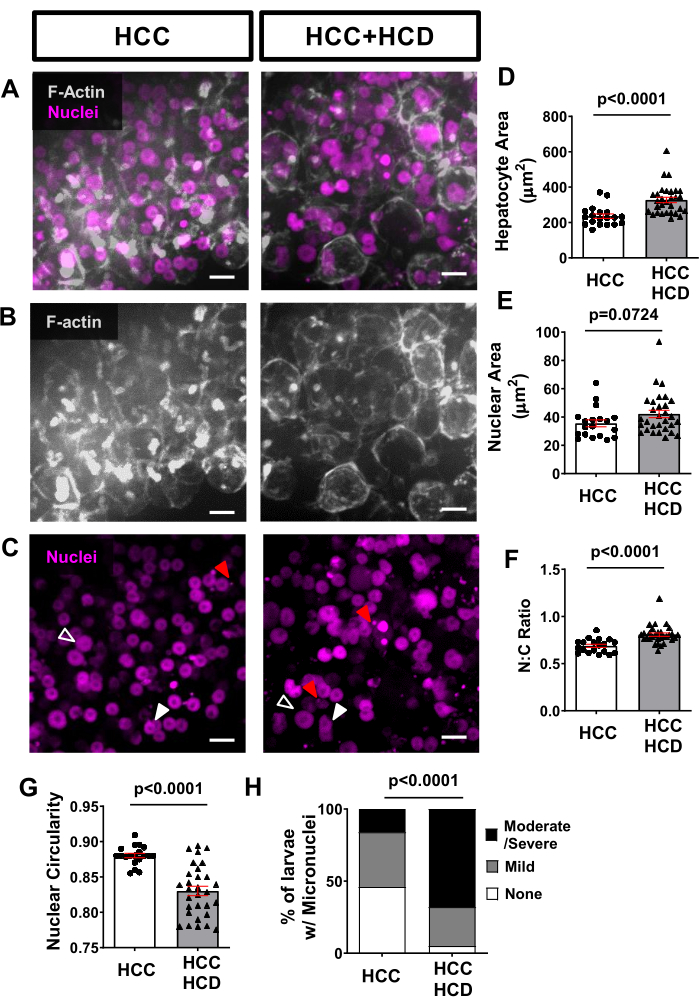
図4:肝細胞と核形態からの代表的な画像。 肝細胞膜(Tg(fabp10a:Life-actin-EGFP)および肝細胞核(Tg(fabp10a:H2B-mCherry))で蛍光タンパク質を発現するトランスジェニックHCC株をイメージングしました。(A-C)HCCおよびHCC + HCD幼虫のFアクチンおよび肝細胞核の代表的な3D再構成。開いた矢印は拡大した核を示しています。白い矢印は、形を変えた核を示しています。赤い矢印は小核と核ヘルニアを示しています。(D-G)HCCおよびHCC+HCDの13日齢幼虫における細胞および核パラメータの平均を示すグラフ。(D)肝細胞領域。(e)原子力地域。(F)核:細胞質比。(G)核の循環性。各ドットは幼虫あたりの平均を表します。ドットプロットは、小核と核ヘルニアのスコアが異なる幼虫の割合を示す平均±SEM(H)カイ二乗グラフを示しています。スケールバー = 10 μm。 この図の拡大版を表示するには、ここをクリックしてください。
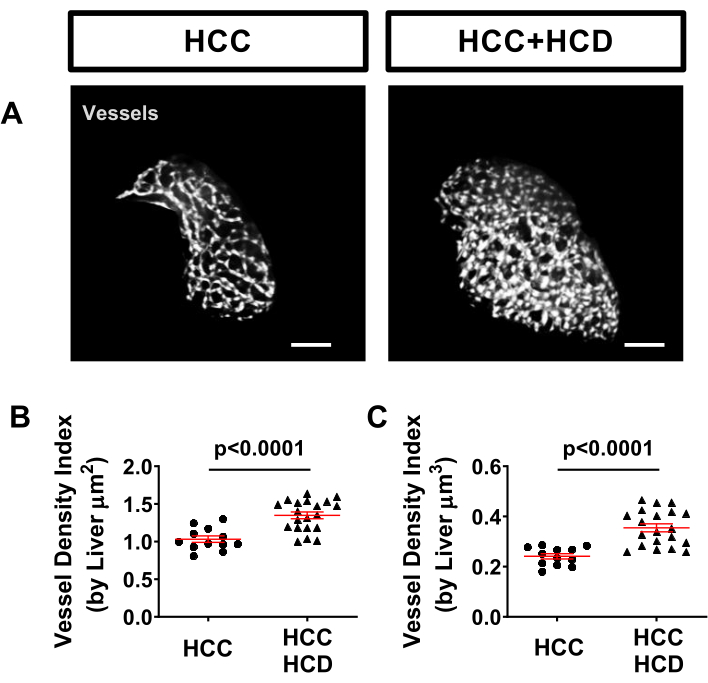
図5:肝血管系からの代表的な画像。 肝細胞核(Tg(Fabp10a:H2B-mCherry)および内皮細胞(Tg)fli:EGFP)で蛍光タンパク質を発現するトランスジェニックHCC株。(A)HCCおよびHCC + HCD幼虫における肝血管系の代表的な3D再構成。(B-C)HCCおよびHCC+HFCD幼虫における肝表面積(B)体積(C)による血管密度指数を示すグラフ。ドットプロットは平均±SEMを示します。 スケールバー= 50μm。 この図の拡大版を表示するには、ここをクリックしてください。
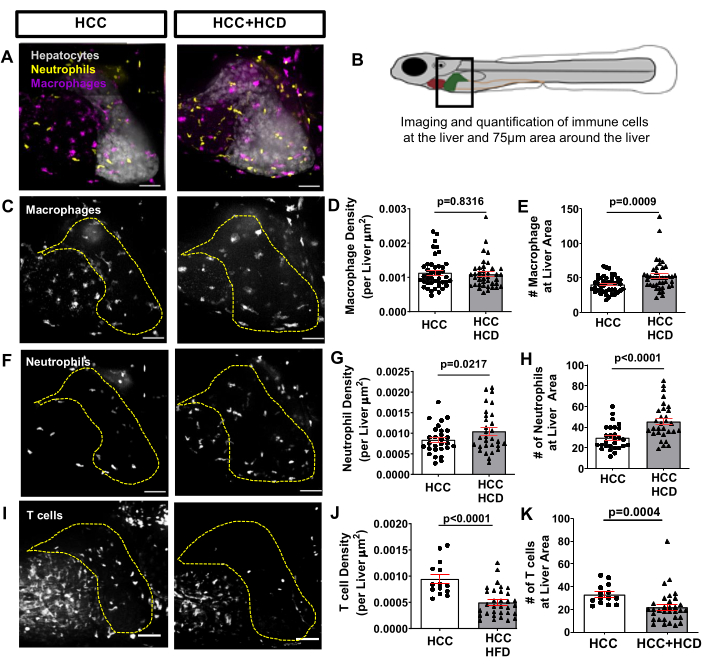
図6:肝免疫細胞ランドスケープからの代表的な画像。 マクロファージおよび好中球(Tg(mfap4:tdトマト-CAAX;lyz:BFP)またはT細胞(Tg(lck-EGFP))で蛍光タンパク質を発現するトランスジェニックHCC株。(A,C,F)13日齢のHCCおよびHCC + HCD幼虫の肝臓領域への肝臓および白血球動員の代表的な3D再構成。(B)画像化された肝臓領域の図。(D-E)HCCおよびHCC+HCD幼虫における肝臓面積におけるマクロファージ密度(D)および数(E)を示すグラフ。(G-H)HCCおよびHCC+HCD幼虫における肝臓面積における好中球密度(G)および数(H)を示すグラフ。(G)HCCおよびHCC + HCD幼虫の肝臓領域へのT細胞動員の代表的な3D再構成。(H-I)HCCおよびHCC+HCD幼虫における肝臓領域におけるT細胞密度(H)および数(I)を示すグラフ。ドットプロットは平均±SEMを示しています。 スケールバー= 50μm。 この図の拡大版を表示するには、ここをクリックしてください。
補足表1:バッファーとソリューションの表 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
HCC、特にNASH誘発HCCの発生率の増加に伴い、NASH関連HCCに関与する細胞および分子メカニズムを研究するためのより効率的なモデルを持つことが非常に重要です。肝臓での細胞間相互作用のデコンボリューションは、肝疾患の進行と肝発癌をよりよく理解するために重要です。このプロトコルに記載されているアプローチは、 in vivo および非侵襲的に肝疾患の進行を分析する独自の方法を提供します。
食事の準備は、NASH関連HCCモデルの確立の成功に不可欠です。ゼブラフィッシュの食事を準備しながら、有害な影響を避けるためにジエチルエーテルをヒュームフード内で完全に蒸発させることが重要です。幼虫(受精後5〜12日)でこれらの食事を使用するには、幼虫による食物摂取を確実にするために、食事を微粒子に粉砕することが非常に重要です。蛍光タグ付き脂肪酸類似体の使用は、幼虫における食物摂取量を評価するために使用することができる。
幼虫を飼育ボックスに入れて給餌手順を開始する前に、異なるプレートからの幼虫を混合することによって実験サンプリングが均一化されていることを確認することが重要です。0日目から始まるさまざまな微小環境が各プレートで促進され、炎症反応に影響を与える可能性があるため、このステップは重要です。
もう一つの重要なステップは、幼虫を数えて、各給餌箱に必要な食物の量を知ることです。食物の量が各箱に存在する幼虫の数に対して十分でない場合、2つのシナリオのうちの1つが発生します:1)幼虫は不足しています。2)幼虫は食べ過ぎになります。不正確な摂食は、炎症などの栄養失調や栄養過剰に関連する不健康な状態につながり、肝臓の微小環境に大きな影響を与えます。不正確な摂食が発生した場合、幼虫は動きの問題を示します。この発達段階では、幼虫は集中的に泳いでいるはずなので、動きの問題に気付いた場合、幼虫は不健康な条件(栄養失調または過剰摂取による有毒な量のコレステロールへの曝露)で飼育されました。このため、給餌手順は、通常の食事とコレステロールが豊富な食事の両方について厳密に管理する必要があります。肝腫大(肝臓サイズ)の存在や組織や臓器、特に肝臓や腸の炎症(好中球やマクロファージの浸潤の目に見える増加)など、幼虫の摂食と健康状態の正確さに迅速に対処するために、いくつかのアッセイを実行できます。
E3の95%の毎日の洗浄と交換は、給餌ボックス内の微生物の増殖を減らし、幼虫の健康と生存を改善するために極めて重要です。あるいは、幼虫をスタンドアロンラックシステムに配置することもできます。最良の結果を得るには、60〜80匹の幼虫を3リットルのタンクに入れます。流れを高速滴下モードに調整し、幼虫に1日2回(AMとPM)3〜4 mgを与えることにより、水の流れを最小レベルに保ちます。各タンクの正しい流れを確保するために、水の流れを定期的にチェックする必要があります。私たちの研究室では、この方法は、10%HCDの短期給餌で95〜100%の生存率をもたらします。さらに、この方法は、記載された静的給餌プロトコルに必要な日常の洗浄および水交換に固有の作業負荷を大幅に軽減した。
短期間の曝露でNASHを誘発するために10%コレステロール強化食を利用しましたが(脂肪性肝炎を誘発するには5日で十分です)、食事の変更を実行して拡張することができますフルクトース 18、脂肪酸(パルミチン酸など)19、または4%コレステロール強化食を使用して延長できる給餌プロトコル20。現在、HCCの治療標的はほとんどなく、NASHの治療標的も成功していません。ゼブラフィッシュモデルの使用は、肝発がんに関する知識を拡大するユニークな機会を提供するだけでなく、大規模なスループットの薬物スクリーニングを実行するための比類のない脊椎動物システムも提供します。このプロトコルに記載されている技術は、肝疾患および肝発癌の将来の発見および治療標的を促進するであろう。
開示事項
著者は開示するものは何もありません。
謝辞
著者は、ゼブラフィッシュ系統の支援と保守のために、アルバートアインシュタイン医科大学ゼブラフィッシュコア施設の技術者であるクリントンデパオロとスパルタクカリニンに感謝したいと思います。FJMNは、Cancer Research InstituteとFibrolamellar Cancer Foundationの支援を受けています。
資料
| Name | Company | Catalog Number | Comments |
| Cholesterol | Sigma | C8667-25G | Easily degraded. Store -20°C. |
| Corning Netwells carrier kit 15 mm | Fisher | 07-200-223 | |
| Corning Netwells inserts | Fisher | 07-200-212 | |
| Diethyl ether | Fisher | 60-046-380 | Highly Volatile. |
| Dumont forceps #55 dumostar | Fisher | NC9504088 | |
| Fisherbrand Pasteur Pipets 5.75in | Fisher | 22-183624 | |
| 4% paraformaldehyde (PFA) | Electron Microscopy Science | 15710 | |
| Golden Pearl Diet 5–50 nm Active Spheres | Brine Shrimp Direct | - | Any commercial dry powder food for larvae can be used. |
| Graduated Transfer Pipets | Fisher | 22-170-404 | |
| Isopropanol | Fisher | BP26181 | |
| PBS, pH7.4, 10X, 10 Pack | Crystalgen | 221-1422-10 | |
| Petri Dishes 100X20MM | Fisher | 08-747D | |
| Tricaine | Sigma | A-5040 | |
| Tween 20 | Fisher | BP337-500 | |
| Oil Red O solution 0.5% isopropanol | Sigma | O1391-500ML | |
| Tricaine | Sigma | A-5040 | |
| Tween 20 | Fisher | BP337-500 | |
| Vactrap | VWR | 76207-630 | Vacuum system for larvae collection |
| Microscopes | |||
| Fluorescent Stereomicroscope | Leica | M205 FCA THUNDER Imager Model Organism Large | |
| Spinning Disk Confocal Microscope | Nikon | Nikon CSU-W1 | |
| Stereomicroscope | Leica | S9i with transilluminated base | |
| Software | |||
| Fiji | Open-source Java image processing program. | ||
| Imaris 9.6 | Bitplane; Oxford Instruments. |
参考文献
- Pocha, C., Kolly, P., Dufour, J. F. Nonalcoholic Fatty Liver Disease-Related Hepatocellular Carcinoma: A Problem of Growing Magnitude. Seminals in Liver Disease. 35 (3), 304-317 (2015).
- El-Serag, H. B., Kanwal, F. Epidemiology of hepatocellular carcinoma in the United States: where are we? Where do we go. Hepatology. 60 (5), 1767-1775 (2014).
- Estes, C., et al. Modeling NAFLD disease burden in China, France, Germany, Italy, Japan, Spain, United Kingdom, and United States for the period 2016-2030. Journal of Hepatology. 69 (4), 896-904 (2018).
- Estes, C., Razavi, H., Loomba, R., Younossi, Z., Sanyal, A. J. Modeling the epidemic of nonalcoholic fatty liver disease demonstrates an exponential increase in burden of disease. Hepatology. 67 (1), 123-133 (2018).
- Meli, R., Mattace Raso, G., Calignano, A. Role of innate immune response in non-alcoholic Fatty liver disease: metabolic complications and therapeutic tools. Frontiers in Immunology. 5, 177 (2014).
- Ganz, M., et al. Progression of non-alcoholic steatosis to steatohepatitis and fibrosis parallels cumulative accumulation of danger signals that promote inflammation and liver tumors in a high fat-cholesterol-sugar diet model in mice. Journal of Translational Medicine. 13, 193 (2015).
- Ma, C., et al. NAFLD causes selective CD4(+) T lymphocyte loss and promotes hepatocarcinogenesis. Nature. 531 (7593), 253-257 (2016).
- Reimer, K. C., Wree, A., Roderburg, C., Tacke, F. New drugs for NAFLD: lessons from basic models to the clinic. Hepatology International. 14 (1), 8-23 (2020).
- Wrighton, P. J., Oderberg, I. M., Goessling, W. There is something fishy about liver cancer: Zebrafish models of hepatocellular carcinoma. Cellular and Molecular Gastroenterology and Hepatology. 8 (3), 347-363 (2019).
- Goessling, W., Sadler, K. C. Zebrafish: An important tool for liver disease research. Gastroenterology. 149 (6), 1361-1377 (2015).
- Huo, X., et al. Transcriptomic profiles of tumor-associated neutrophils reveal prominent roles in enhancing angiogenesis in liver tumorigenesis in zebrafish. Science Reports. 9 (1), 1509 (2019).
- Yan, C., Yang, Q., Gong, Z. Tumor-associated neutrophils and macrophages promote gender disparity in hepatocellular carcinoma in zebrafish. Cancer Research. 77 (6), 1395-1407 (2017).
- Capece, D., et al. The inflammatory microenvironment in hepatocellular carcinoma: A pivotal role for tumor-associated macrophages. Biomed Research International. 2013, 187204 (2013).
- de Oliveira, S., et al. Metformin modulates innate immune-mediated inflammation and early progression of NAFLD-associated hepatocellular carcinoma in zebrafish. Journal of Hepatology. 70 (4), 710-721 (2019).
- Huemer, K., et al. Long-term live imaging device for improved experimental manipulation of zebrafish larvae. Journal of Visualized Experiments. (128), e56340 (2017).
- Huemer, K., et al. zWEDGI: Wounding and entrapment device for imaging live zebrafish larvae. Zebrafish. 14 (1), 42-50 (2017).
- Evason, K. J., et al. Identification of chemical inhibitors of beta-catenin-driven liver tumorigenesis in zebrafish. PLoS Genetics. 11 (7), 1005305 (2015).
- Sapp, V., Gaffney, L., EauClaire, S. F., Matthews, R. P. Fructose leads to hepatic steatosis in zebrafish that is reversed by mechanistic target of rapamycin (mTOR) inhibition. Hepatology. 60 (5), 1581-1592 (2014).
- Park, K. H., Ye, Z. W., Zhang, J., Kim, S. H. Palmitic acid-enriched diet induces hepatic steatosis and injury in adult zebrafish. Zebrafish. 16 (6), 497-504 (2019).
- Progatzky, F., et al. Dietary cholesterol directly induces acute inflammasome-dependent intestinal inflammation. Nature Communication. 5, 5864 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved